15.4 : مقياس درجة الحموضة
توجد أيونات الهيدرونيوم والهيدروكسيد في كل من الماء النقي وفي جميع المحاليل المائية ، وتتناسب تركيزاتهما عكسيًا على النحو الذي يحدده المنتج الأيوني للماء (Kw). غالبًا ما تكون تركيزات هذه الأيونات في محلول محددات حاسمة لخصائص المحلول والسلوك الكيميائي للمذابات الأخرى. يمكن أن يختلف محلولان مختلفان في تركيزات أيونات الهيدرونيوم أو الهيدروكسيد بمليون ، مليار ، أو حتى تريليون مرة. من الوسائل الشائعة للتعبير عن الكميات التي قد تمتد عبر العديد من مراتب الحجم استخدام مقياس لوغاريتمي. لذلك يتم تحديد الرقم الهيدروجيني للحل كما هو موضح هنا ، حيث [H 3 O < sup>H3O+] هو التركيز المولي لأيون الهيدرونيوم في المحلول:
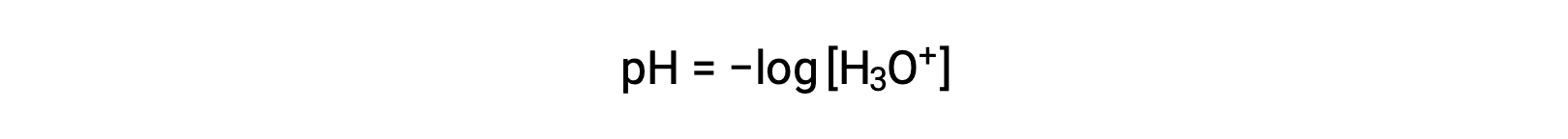
تؤدي إعادة ترتيب هذه المعادلة لعزل مولارية أيون الهيدرونيوم إلى الحصول على التعبير المكافئ:
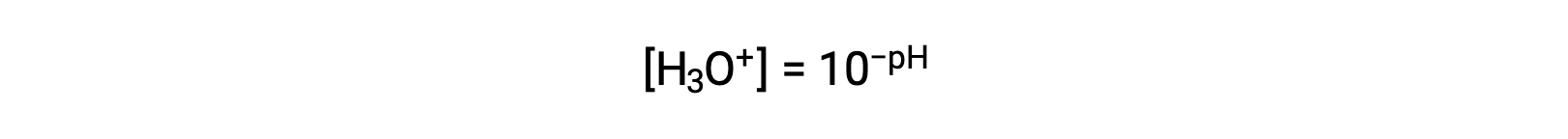
وبالمثل ، يمكن التعبير عن مولارية أيون الهيدروكسيد كدالة p أو pOH :
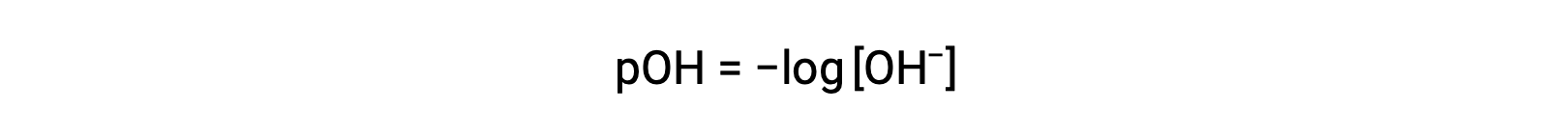
أو
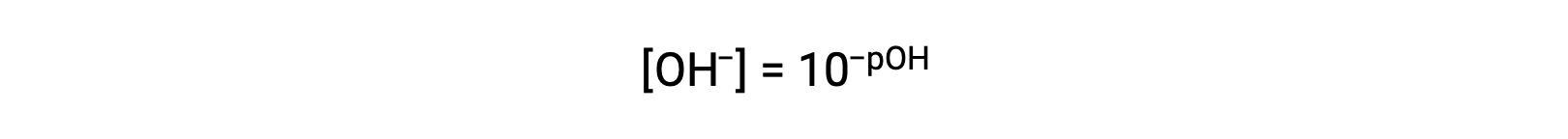
أخيرًا، يمكن اشتقاق العلاقة بين هذين التركيزين الأيونيين المعبر عنه كوظائف p بسهولة من تعبير KW:
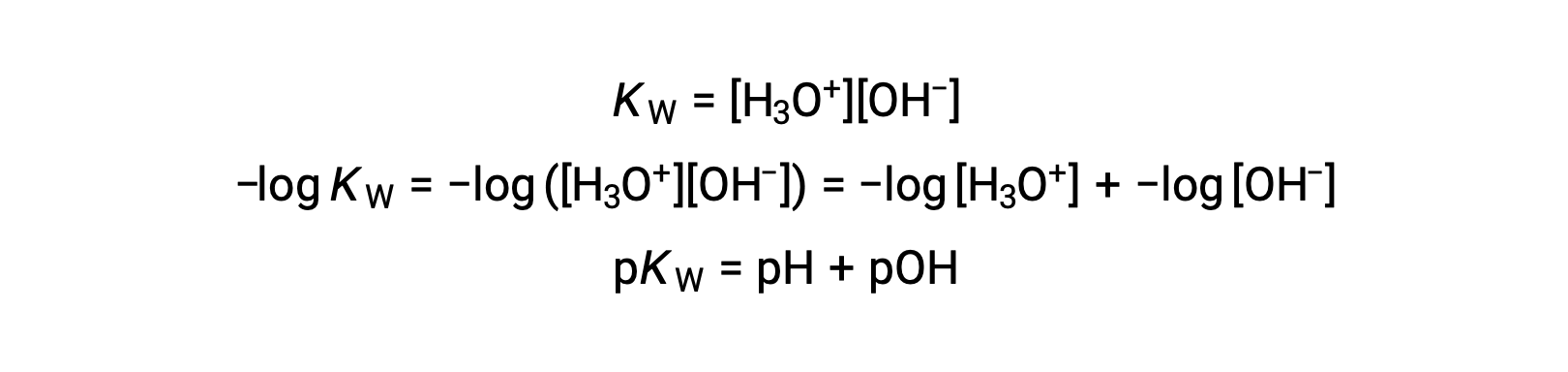
عند 25 °C، قيمة KW هي 1.0 × 10−14 وهكذا:
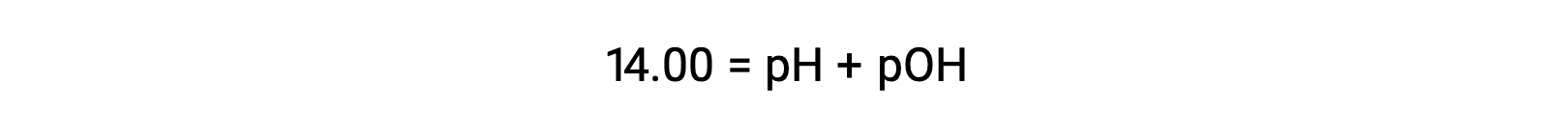
مولارية أيون الهيدرونيوم في الماء النقي (أو أي محلول محايد) هي 1.0 × 10−7 M عند 25 °C. لذلك فإن الأس الهيدروجيني و الأس الهيدروجيني لمحلول محايد عند درجة الحرارة هذه هما:
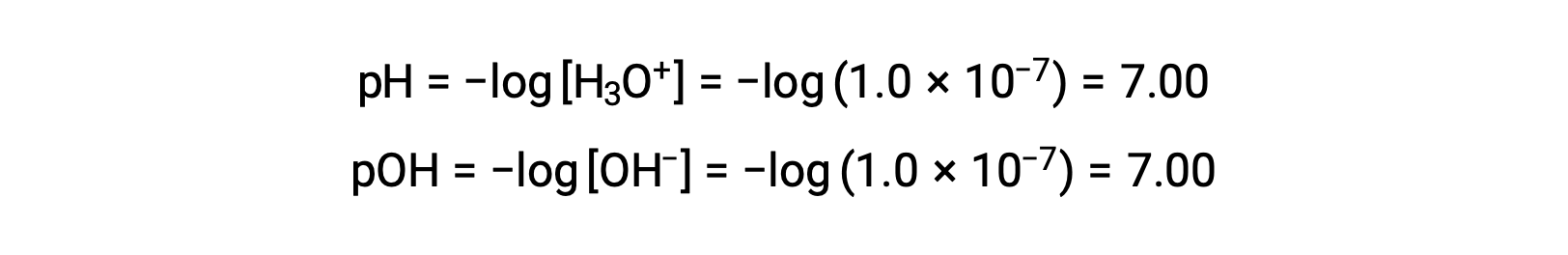
وهكذا، عند درجة الحرارة هذه، المحاليل الحمضية هي تلك التي تحتوي على مولارية أيونات الهيدرونيوم أكبر من 1.0 × 10−7 M ومولارية أيونات الهيدروكسيد أقل من 1.0 × 10−7 M (المقابلة لقيم الأس الهيدروجيني الأقل من 7.00 وقيم الأس الهيدروجيني أكبر من 7.00). الحلول الأساسية هي تلك التي تحتوي على مولات أيونات الهيدرونيوم أقل من 1.0 × 10−7 M ومولاريات أيونات الهيدروكسيد أكبر من1.0 × 10−7 M (المقابلة لقيم الأس الهيدروجيني الأكبر من 7.00 وقيم الأس الهيدروجيني الأقل من 7.00).
نظرًا لأن ثابت التأين التلقائي KW يعتمد على درجة الحرارة، فإن هذه الارتباطات بين قيم الأس الهيدروجيني والصفات الحمضية / المحايدة / الأساسية ستكون مختلفة عند درجات حرارة بخلاف 25 °C على سبيل المثال، مولارية الهيدرونيوم للماء النقي عند 80°C هي 4.9 × 10−7 M، والتي تتوافق مع قيم الأس الهيدروجيني والأس الهيدروجيني لـ:
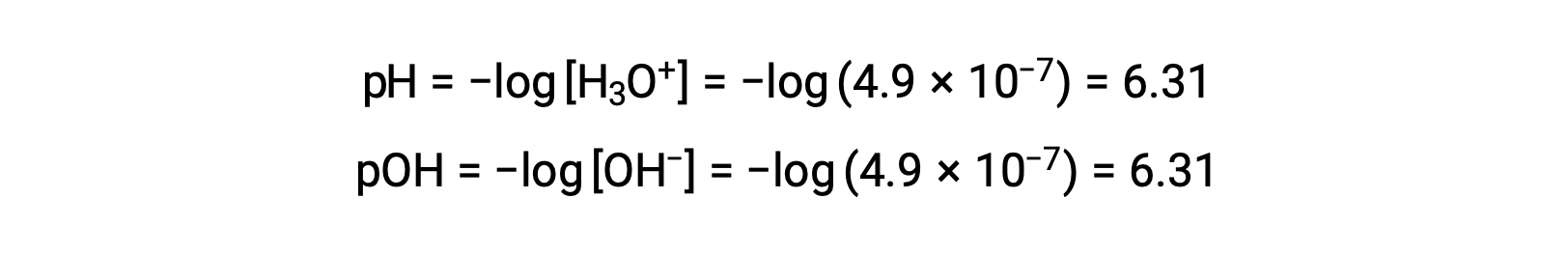
عند درجة الحرارة هذه، تُظهر المحاليل المحايدة pH = pOH = 6.31، وتظهر المحاليل الحمضية pH أقل من 6.31 و pOH أكبر من 6.31، بينما تُظهر المحاليل الأساسية pH أكبر من 6.31 و pOH أقل من 6.31. يمكن أن يكون هذا التمييز مهمًا عند دراسة بعض العمليات التي تحدث في درجات حرارة أخرى ، مثل تفاعلات الإنزيم في الكائنات الحية ذوات الدم الحار عند درجة حرارة حوالي 36 – 40 °C. ما لم يُذكر خلاف ذلك، يُفترض أن الإشارات إلى قيم الأس الهيدروجيني هي تلك الموجودة في 25 °C.
تم اقتباس هذا النص منOpenstax, Chemistry 2e, Section 14.2: pH and pOH.
From Chapter 15:

Now Playing
15.4 : مقياس درجة الحموضة
Acids and Bases
68.2K Views

15.1 : أحماض وقواعد برونستيد-لوري
Acids and Bases
90.6K Views

15.2 : قوى الحمض/القاعدة وثوابت التفكّك
Acids and Bases
60.0K Views

15.3 : الماء: حمض وقاعدة برونستيد-لوري
Acids and Bases
49.8K Views

15.5 : القوى النسبية لأزواج حمض-قاعدة المترافقة
Acids and Bases
45.2K Views

15.6 : حمض قوي ومحاليل أساسية
Acids and Bases
31.3K Views

15.7 : المحاليل الحامضية الضعيفة
Acids and Bases
37.5K Views

15.8 : المحاليل القاعدية الضعيفة
Acids and Bases
22.4K Views

15.9 : مخاليط الأحماض
Acids and Bases
19.5K Views

15.10 : الأيونات كأحماض وقواعد
Acids and Bases
23.3K Views

15.11 : تحديد الرقم الهيدروجيني (pH) لمحاليل الملح
Acids and Bases
43.2K Views

15.12 : أحماض بوليبروتيك
Acids and Bases
28.9K Views

15.13 : قوة الحمض والبنية الجزيئية
Acids and Bases
30.7K Views

15.14 : أحماض وقواعد لويس
Acids and Bases
43.3K Views
Copyright © 2025 MyJoVE Corporation. All rights reserved