15.5 : القوى النسبية لأزواج حمض-قاعدة المترافقة
إن كيمياء قانون برونستدø-لوري تستند على فكرة نقل البروتونات. وبالتالي، فإن المنطق يشير إلى وجود علاقة بين القوى النسبية لأزواج حمض القاعدة المترافق. يتم قياس قوة الحمض أو القاعدة في ثابت التأين الخاص به ، K a أو K b ، والذي يمثل مدى تفاعل التأين الحمضي أو القاعدي. بالنسبة إلى زوج حمض القاعدة المترافقHA / A−، تكون معادلات توازن التأين وتعبيرات التأين ثابتة
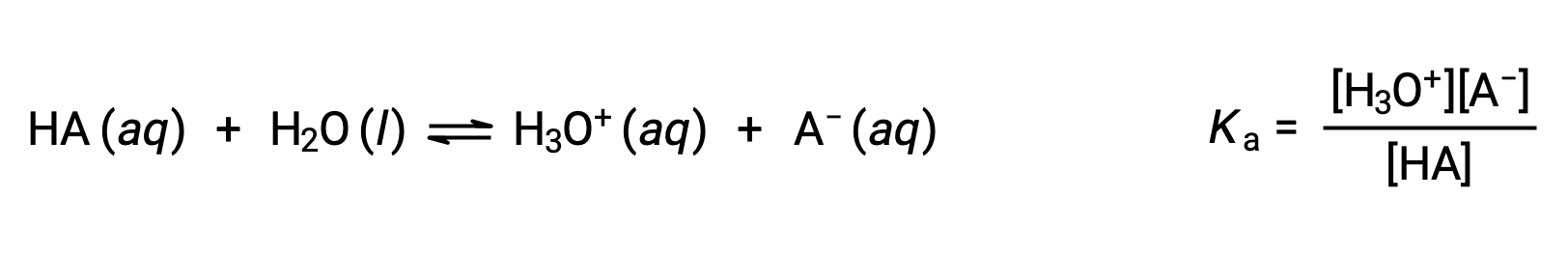
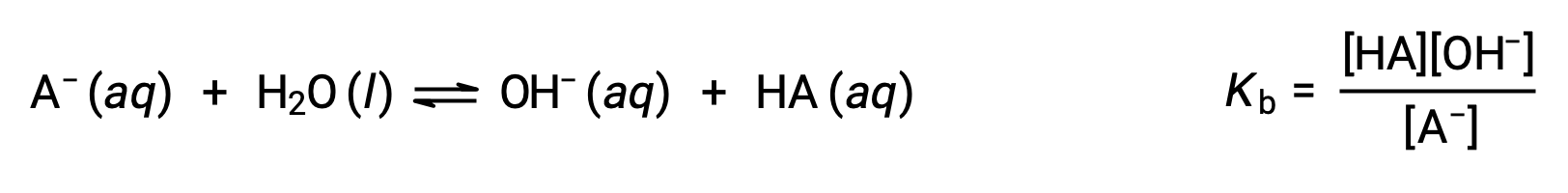
تؤدي إضافة هاتين المعادلتين الكيميائيتين إلى الحصول على معادلة التأين التلقائي للماء:
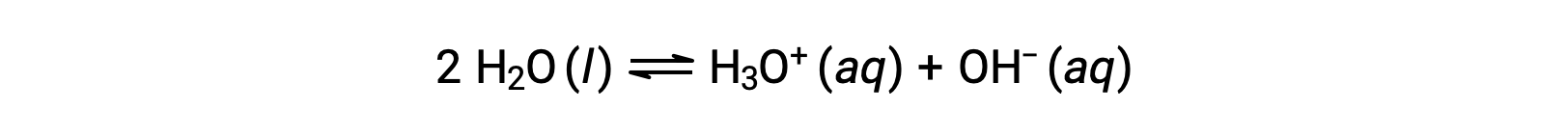
كما تمت مناقشته سابقًا ، فإن ثابت التوازن لتفاعل مُجمع يساوي الناتج الرياضي لثوابت التوازن للتفاعلات المضافة ، وهكذا
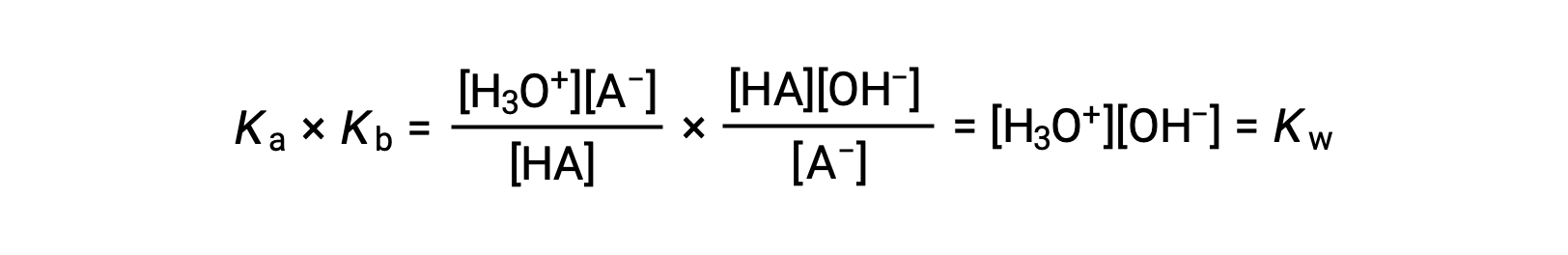
توضح هذه المعادلة العلاقة بين ثوابت التأين لأي زوج مترافق من حامض-قاعدي ، أي أن حاصل ضربهما الرياضي يساوي حاصل ضرب الماء ، K W . من خلال إعادة ترتيب هذه المعادلة ، تصبح العلاقة المتبادلة بين نقاط القوة لزوج حمض-قاعدي مترافق واضحة:
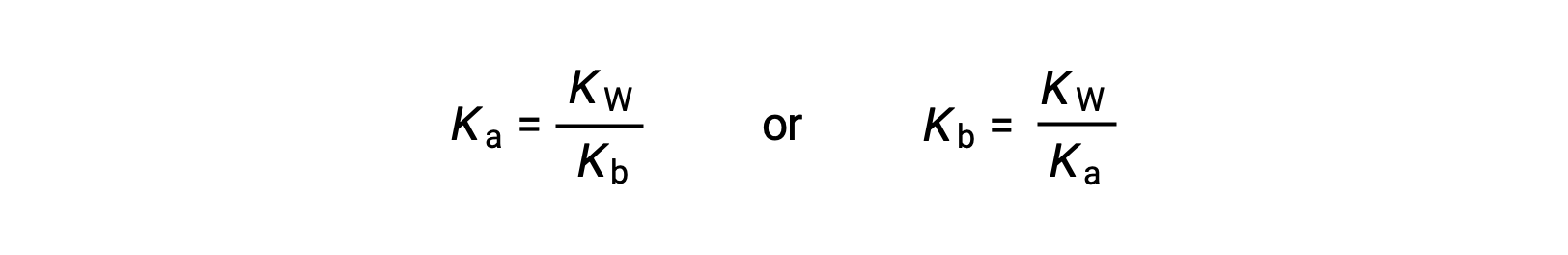
العلاقة التناسبية العكسية بين K a و K b تعني أنه كلما كان الحمض أو القاعدة أقوى ، فإن أضعف شريكها المقترن.
أخذ السجل السالب لكلا طرفي المعادلة، Ka × Kb = KW يعطي
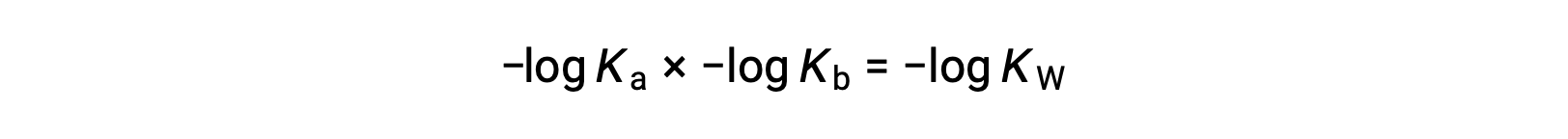
ثم
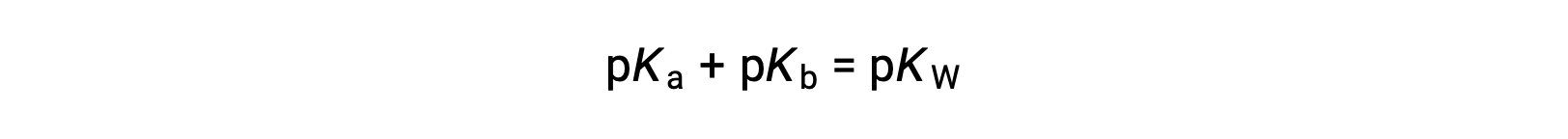
حيث أن pKW هو 14 عند 25 °C، يمكن أيضًا كتابة هذه المعادلة كـ
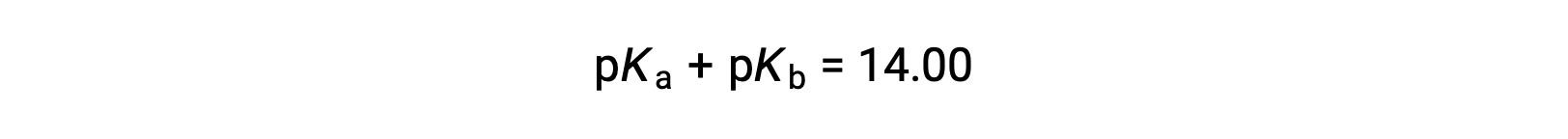
يمثل كل من pKa و pKb أيضًا قوة الأحماض والقواعد، على التوالي. مثل pH و pOH، كلما زادت قيمة pKa أو pKb، كلما كان الحمض أضعف أو القاعدة ، على التوالي.
| حمض | قاعدة |
| حمض البيركلوريك (HClO4)* | أيون البيركلورات (ClO4−)** |
| حمض الكبريت (H2SO4)* | أيون كبريتات الهيدروجين (HSO4−)** |
| يوديد الهيدروجين (HI)* | أيون يوديد (I−)** |
| بروميد الهيدروجين (HBr)* | أيون البروميد (Br−)** |
| كلوريد الهيدروجين (HCl)* | أيون كلوريد (Cl−)** |
| حمض النيتريك (HNO3)* | أيون النترات (NO3−)** |
| أيون الهيدرونيوم (H3O+) | الماء (H2O) |
| كبريتات الهيدروجين (HSO4−) | أيون الكبريت (SO42−) |
| حمض الفوسفوريك (H3PO4) | أيون فوسفات الهيدروجين (H2PO4−) |
| فلوريد الهيدروجين (HF) | أيون فلوريد (F−) |
| حمض النيتروز (HNO2) | أيون النتريت (NO2-) |
| حمض الخل (CH3CO2H) | أيون الأسيتات (CH3CO2−) |
| حمض الكربونيك (H2CO3) | كربونات الهيدروجين (HCO3−) |
| كبريتيد الهيدروجين (H2S) | أيون كبريتيد الهيدروجين (HS) |
| أيون الأمونيوم (NH4+) | الأمونيا (NH3) |
| سيانيد الهيدروجين (HCN) | أيون سيانيد(CN−) |
| كربونات الهيدروجين (HCO3−) | أيون الكربونات (CO32-) |
| الماء (H2O) | أيون هيدروكسيد (OH−) |
| أيون كبريتيد الهيدروجين (HS−)† | أيون كبريتيد (S2−)‡ |
| الإيثانول (C2H5OH)† | إيثاكسيد أيون (C2H5O−)‡ |
| الأمونيا (NH3)† | آيون الأميد (NH2−)‡ |
| الهيدروجين (H2)† | هيدريد أيون (H−)‡ |
| الميثان (CH4)† | أيون الميثيل (CH3−)‡ |
| *يخضع لتأيين الحمض بشكل كامل في الماء | |
| † لا يخضع لتأيين الحمض في الماء | |
| **لا يخضع لتأيين القاعدة في الماء | |
| يتحمّل ‡التأين بشكل كامل للقاعدة في الماء | |
تم ترتيب قائمة الأزواج المتقارنة من حمض–قاعدة لإظهار القوة النسبية لكل نوع بالمقارنة مع الماء. في العمود الحمضي، تلك الأنواع المدرجة تحت الماء هي أحماض أضعف من الماء. لا تخضع هذه الأنواع للتأين الحمضي في الماء؛ هم ليسوا أحماض برونستدø-لوري. جميع الأنواع المذكورة أعلاه هي أحماض أقوى، تنقل البروتونات إلى الماء إلى حد ما عند إذابتها في محلول مائي لتوليد أيونات الهيدرونيوم. الأنواع الموجودة فوق الماء ولكن تحتها أيون الهيدرونيوم عبارة عن أحماض ضعيفة ، تخضع للتأين الحمضي الجزئي ، في حين أن الأنواع الموجودة فوق أيون الهيدرونيوم هي أحماض قوية تتأين تمامًا في محلول مائي.
هذا النص مقتبس من Openstax, Chemistry 2e, Section 14.3: Relative Strengths of Acids and Bases.
Tags
From Chapter 15:

Now Playing
15.5 : القوى النسبية لأزواج حمض-قاعدة المترافقة
Acids and Bases
45.0K Views

15.1 : أحماض وقواعد برونستيد-لوري
Acids and Bases
90.3K Views

15.2 : قوى الحمض/القاعدة وثوابت التفكّك
Acids and Bases
59.8K Views

15.3 : الماء: حمض وقاعدة برونستيد-لوري
Acids and Bases
49.5K Views

15.4 : مقياس درجة الحموضة
Acids and Bases
67.9K Views

15.6 : حمض قوي ومحاليل أساسية
Acids and Bases
31.1K Views

15.7 : المحاليل الحامضية الضعيفة
Acids and Bases
37.3K Views

15.8 : المحاليل القاعدية الضعيفة
Acids and Bases
22.2K Views

15.9 : مخاليط الأحماض
Acids and Bases
19.5K Views

15.10 : الأيونات كأحماض وقواعد
Acids and Bases
23.1K Views

15.11 : تحديد الرقم الهيدروجيني (pH) لمحاليل الملح
Acids and Bases
43.2K Views

15.12 : أحماض بوليبروتيك
Acids and Bases
28.7K Views

15.13 : قوة الحمض والبنية الجزيئية
Acids and Bases
30.5K Views

15.14 : أحماض وقواعد لويس
Acids and Bases
43.1K Views
Copyright © 2025 MyJoVE Corporation. All rights reserved