A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
الكالسيوم في الجسم الحي 2 + -- التصوير من الخلايا العصبية بالجسم فطر خلال التعلم الشم في عسل النحل
In This Article
Summary
يمكن أن يكون مشروطا النحل في نموذج التعلم الشمية مشهي (PER تكييف). استخدام الروائح والمحفزات ، أنشأنا طريقة السلوك التي يتم تسجيلها في حين يستخدم التصوير في وقت واحد لقياس النشاط الكالسيوم أثارت رائحة الجسم في الخلايا العصبية الفطر في الجسم الحي.
Abstract
والمجراة ونصف وقد وضعت في التحضير لتصوير الكالسيوم المجراة في المختبر لدينا من قبل Joerges ، كوتنر وGalizia أكثر من عشر سنوات مضت ، لقياس النشاط رائحة أثار في الفص antennal 1. منذ ذلك الحين ، فقد كان المكرر باستمرار وتطبيقه على neuropiles مختلفة في الدماغ النحل. هنا ، نحن تصف إعداد المستخدمة حاليا في المختبرات لقياس نشاط الخلايا العصبية في الجسم باستخدام فطر يقترن ديكستران الكالسيوم الحساسة للصبغة (Fura - 2). وصمة عار علينا retrogradely الخلايا العصبية عن طريق حقن الجسم الفطر صبغة في المحاور أو المنطقة سوما. ونحن نركز على الحد من الغزو ، من أجل تحقيق التحضير الذي لا يزال من الممكن تدريب النحل باستخدام PER تكييف. ونحن قادرون على رصد وقياس ردة الفعل السلوكية من خلال تسجيل الكهربائية myograms من العضلات التي تسيطر على الواحدة (M17) 2.
بعد التجربة الفسيولوجية والتحقيق في هياكل تصوير بمزيد من التفصيل باستخدام مبائر المجهري المسح الضوئي لمعالجة هوية الخلايا العصبية.
Protocol
النحل التحضير والعودة ملء
- الصيد العلافون عسل النحل في الخلية والبرد على الجليد لتجميد.
- جبل زجاجي في تسجيل 3 غرف. إصلاح العين والصدر على جدران الغرفة مع تسجيل انخفاض ذوبان الشمع نقطة الثابت.
- سحب الزجاج الشعيرات الدموية كما يستخدم عادة لالكهربية وكسر في طرف من الحصول على القطر غيض من كاليفورنيا. 10μm. تغطية غيض من شعري مع عجينة صبغ. صبغ معجون يتكون من خليط من 10:01 Fura - 2 ديكستران يسين ويمكن حلها ديكستران tetramethylrhodamine.
- لتلوين الداخلي شل هوائيات مع تفصيلات أو eicosane ن. إزالة قطعة من إهاب فوق الدماغ والغدد وتدفع القصبة الهوائية إلى الجانب للسماح بالوصول إلى الجسم الفطر.
- حقن الشعيرات الدموية في سوما إما أو منطقة محواري الجسم من الخلايا العصبية الفطر. يمكن القيام بذلك يدويا أو باستخدام مجانا تتلاعب الجزئي. ثم استعادة قطعة إهاب على كبسولة الرأس وتخفيف هوائيات.
- تغذية النحل بمحلول سكروز 30 ٪ قبل تخزينها في قضية ترطيب لما لا يقل عن أربع ساعات أو أكثر من ليلة عند 20 درجة مئوية.
التصوير في فيفو
- منع تحركات مثل النحلة مع قطعة صغيرة من الإسفنج التي تضغط على البطن وثابت مع مقطع أو الشريط إلى غرفة تسجيل.
- لمنع الحركة من الدماغ الناتجة عن الضخ من المريء ، وقطع شق صغير في إهاب فوق شفا والانسحاب بعناية المريء وهياكلها الصلبة المحيطة بها لوضعها تحت التوتر دون الإضرار المريء 4. مع تغطية عنصر السيليكون اثنين.
- جعل الثقوب بإبرة وأسلاك كهربائية إدراج لتسجيل M17.
- إزالة قطعة إهاب والقصبة الهوائية والغدد فوق الدماغ. heamolymph تمتص داخل الكبسولة الرأس مع قطعة من الورق.
- ملء الكبسولة مع رئيس عنصر السيليكون اثنين. من المهم أن يتم تغطيتها بالكامل في الدماغ.
- النحلة على خشبة المسرح مكان المجهر ووضع قطرة من الماء على سطح سيليكون أن تزج الهدف تراجع من المجهر في الحبرية. التركيز على الخلايا العصبية الملون.
التحفيز الرائحة وتسجيل إشارات
Olfactometer : نحن نستخدم جهاز كمبيوتر مخصص للرقابة جهاز تحفيز بناء أو "olfactometer" كما هو موضح سابقا Galizia وفيتر 3. مخففة الروائح الى تيار الهواء المستمر موجهة نحو الهوائيات. أي حافز يتكون من نبض 3S رائحة من الهواء رائحة 0.2ml المشبعة. ويمكن ضبط بروتوكول التحفيز في تسجيل TILLVision البرمجيات.
المجهر والتصوير انشاء : نحن نستخدم المجهر زايس مضان. وتسجل الصور على 25 درجة مئوية مع معدل أخذ العينات من 5 هرتز باستخدام جهاز التصوير الحراثة الضوئيات التي شنت على المجهر. يتم تسجيل إشارات الكالسيوم خلال X60 ، أوليمبوس W تراجع 0.9 الهدف مع كاميرا CCD يافعة (640X480 بكسل ، 4X اهمال على رقاقة ل160X120 بكسل). هو متحمس Fura - 2 مع ضوء أحادي اللون من 340 والطول الموجي 380nm لقياسات ratiometric. تم الكشف عن مضان من خلال مرآة مزدوج اللون 410nm 440nm وتصفية تمريرة طويلة. يتم تعيين المعلمات للتسجيل في برنامج التسجيل. يستمر كل قياس يمكن تعديلها 10S وزمن التعرض للموجات اثنين إلى تلطيخ كثافة في كل إعداد.
M17 التسجيل : يتم تسجيل العضلات المنقلة من الشفة (M17) خارج الخلية لرصد ردود الفعل السلوكية المتصلة التعلم ، أي 5 في (6). حقن الأسلاك النحاسية في العضلات القريبة من أجزاء الفم. حقن الكهربائي الأرضي في العين. وتتضخم إمكانات العضلات مع مكبر للصوت ما قبل بناء العرف ، رقمية وتخزينها على جهاز الكمبيوتر. يتم تشغيل بداية التحفيز التي olfactometer.
تحليل البيانات
- خلال التجربة : يتم تغذية تسجيلات للإشارة إلى الكالسيوم كمبيوتر وتخزينها. ويسمح برنامج تسجيل TILLVision تفتيشا أوليا للإشارات ، مثل حساب النسبة بين الطول الموجي (340nm/380nm) وحساب deltaF (الطرح من الأساس).
- تتم معالجة الصور مع العرف البرامج المكتوبة في IDL. حساب نسبة الكالسيوم 2 + إشارات من 340nm 380nm وقياسات لكل بكسل. تحديد مضان الخلفية (F) من المتوسط خلال أطر قبل التحفيز وطرح من إشارة ratiometric (deltaF).
- لتحديد منطقة سياحية (ROI) : يعني حساب من الإطارات خلال التحفيز وتطبيق مرشح تمرير منخفض (3X3px). تحويل مقياس رمادية اللون على نطاق وكاذبة. تحديد نشاط الخلايا العصبية في الهياكل كبقع النشاط في الصور الملونة وكاذبة وتحديد العائد على الاستثمار.
- حساب ديناميكية الزمني للمناطق نشطة عن طريق حساب متوسط العائد على الاستثمار في بكسل على جميع الإطارات دون أي تصفية أو التصحيح.
> التحليل الصرفي والإعمار
جنبا إلى جنب مع ديكستران Fura - 2 ملأنا الخلايا العصبية مع ديكستران يمكن حلها رودامين صبغ ("مصغرة روبي"). كلا الأصباغ لها نفس الوزن الجزيئي ، وينبغي أن تشارك في الموجود في الخلايا العصبية. مجال التصوير واسع يسمح القرار الوحيد المكانية محدودة للغاية ، ولذلك فمن المستحسن للتحقيق في الهياكل الملون بعد التجربة باستخدام المجهر متحد البؤر المسح الضوئي.
- بعد القياسات الفسيولوجية ، وتشريح أدمغة يحملق.
- شطف في برنامج تلفزيوني ويذوى متدرج في الإيثانول واضحة في salycilate الميثيل.
- لتضمين المجهري مبائر الدماغ في salycilate الميثيل.
- نستخدم المجهر لايكا SP2 TCS. الطول الموجي 543nm هو الإثارة.
- نحن مسح الدماغ مع الهواء أو الزيت الهدف الغمر وقارن بين الهياكل ملطخة البيانات التصوير.
ممثل النتائج :
إذا كان التلوين وإعداد ناجحة ، في إشارة نطاق اللون كاذبة ، على سبيل المثال في الخلايا العصبية هيئة فطر الفص ألفا خارجي ، يمكن أن تبدو في الشكل 1.
ويمكن حساب الاستجابة السلوكية (PER) كما تردد خلال تصاعد وتيرة ارتفاع ناقص التحفيز قبل التحفيز (figure2).
قد يكون التحقيق في هياكل ملطخة بمزيد من التفصيل باستخدام المجهر مبائر (figure3).

الشكل 1 : الممثل اشارات التصوير الكالسيوم (التحفيز مع هيبتانال). ج : المصور المنطقة من الدماغ النحل. باء : صورة الفلورية الخام كما رأينا من خلال تراجع X20 الهدف في الطول الموجي 380nm الإثارة ، هي الخطوط العريضة لشحمة ألفا من الجسم الفطر في الأرجواني. تم حقن صبغة في حافة البطن - الجانبي للفصوص ألفا لصبغ الخلايا العصبية خارجي. أوجز ROI مختارة ألفا الفص المبينة في الأرجواني ، باللون الأسود ؛ الكاذبة صورة ملونة مستمدة من إشارة المتوسط ، deltaF (340/380) ، وخلال التحفيز الثلاثة الثانية : C. وأشار ديناميات الزمانية من الكالسيوم في إشارة استجابة لتحفيز السكروز من ipsi وهوائي مضاد الوحشي على التوالي على عائد الاستثمار : D : ديناميات الزمانية إشارة الكالسيوم في تحفيز استجابة لرائحة ، إشارة المتوسط من منطقة الفائدة كما هو مبين في E C. في C.

الشكل 2 : الممثل M17 الاستجابة. بعد تكييف الشمية النحلة يمتد خرطوم عندما تقدم رائحة دون مكافأة. الخط الأحمر يشير إلى التحفيز الرائحة. أقحم : لكل من نحل العسل.
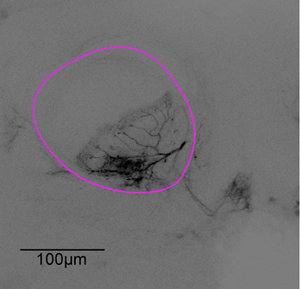
الشكل 3 : الممثل المكدس الصورة. بعد تجربة التصوير كان تشريح الدماغ. يتم فحص الخلايا العصبية من الرقم 1 باستخدام المجهر مبائر مع الغمر X20 الهدف النفط ، ألفا ، المبينة في الفص الأرجواني.
Access restricted. Please log in or start a trial to view this content.
Discussion
في هذا العرض مررنا جميع الخطوات للتحقيق في إشارات الكالسيوم في الجسم الحي النحل. طبقنا هذه التقنية لهيئة فطر الخلايا العصبية ، ولكن يمكن أن يتم التصوير في جميع الخلايا العصبية التي يمكن أن تنشأ تقنية تلوين. وقد ركزنا على الخلايا العصبية في مسار الشمية من عس?...
Access restricted. Please log in or start a trial to view this content.
Acknowledgements
ويتم تمويل هذا العمل من قبل DFG.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| low melting point hard wax Deiberit 502 | Dr. Böhme Schöps Dental GmbH | ||
| FURA-2 dextran potassium salt, 10 000 MW | Invitrogen | F-3029 | Protect from light. |
| tetramethylrhodamine dextran 10 000 MW | Invitrogen | D-3312 | Protect from light. |
| n-eicosane | Sigma-Aldrich | 21, 927-4 | |
| Kwik Sil Adhesive | World Precision Instruments, Inc. | KWIK SIL | |
| Imaging Set-up | TILL Photonics | ||
| CCD camera | Imago | ||
| CED | Texas Instruments |
References
- Joerges, J., Küttner, A., Galizia, C. G., Menzel, R. Representations of odors and odor mixtures visualized in the honeybee brain. Nature. 387 (6630), 285-288 (1997).
- Rehder, V. Quantification of the honeybee's proboscis reflex by electromyiographic recordings. J. Insect Physiol. 33, 501-507 (1987).
- Galizia, C. G., Vetter, R. S. Optical Methods for Analyzing Odor-Evoked Activity in the Insect Brain. Methods in Insect Sensory Neuroscience. Christensen, T. A. , CRC Press. Boca Raton. 345-388 (2004).
- Mauelshagen, J. Neural correlates of olfactory learning paradigms in an identified neuron in the honeybee brain. J Neurophysiol. 69 (2), 609-625 (1993).
- Kuwabara, M. Bildung des bedingten Reflexes von Pavlovs Typus bei der Honigbiene Apis mellifica, Hokaido Univ. Zool. J. Sci. 13, 458-464 (1957).
- Bitterman, M. E., Menzel, R., Fietz, A., Schafer, S. Classical conditioning of proboscis extension in honeybees (Apis mellifera. Journal of Comparative Psychology. 97 (2), 107-119 (1983).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved