A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
عزل خلايا الرئة ماوس شجيرى
In This Article
Summary
يوصف مستحضر عالي النقاء من الخلايا الجذعية الماوس الرئة. ويولى اهتمام محدد لعزل الخلايا الجذعية التقليدية فرعية.
Abstract
الخلايا الجذعية الرئة (DC) تلعب دورا أساسيا في مجال الاستشعار عن غزو الجراثيم ، فضلا عن 1،2 في السيطرة على ردود مولد للتحمل 3 في الجهاز التنفسي. وقد وصفت ما لا يقل عن ثلاث مجموعات فرعية من الخلايا الجذعية الرئيسية الرئة في الفئران : DC التقليدية (CDC) 4 ، بلازماوية DC (PDC) (5) وإنتاج الإنترفيرون العاصمة القاتل (IKDC) 6،7. مجموعة فرعية منها هي فرعية العاصمة الأبرز في الرئة 8.
العلامة المشتركة المعروفة لتحديد مجموعات فرعية هي العاصمة CD11c ، وهو النوع الأول إنتغرين عبر الغشاء (β2) الذي أعرب أيضا عن حيدات ، الضامة ، العدلات وبعض الخلايا باء 9. في بعض الأنسجة ، وذلك باستخدام CD11c كعلامة لتحديد الماوس العاصمة غير صالحة ، كما هو الحال في الطحال ، حيث ان معظم الخلايا + CD11c تمثل مجموعة فرعية منها التي تعبر عن مستويات عالية من التوافق النسيجي الرئيسي الثاني فئة المعقدة (MHC - II). ومع ذلك ، فإن سرطان الرئة هو أكثر الأنسجة المتجانسة حيث تكونالجانب فرعية العاصمة ، وهناك نسبة عالية من السكان الخلايا المتميزة التي تعبر عن مستويات عالية من CD11c نوبة انخفاض مستويات MHC - II. استنادا إلى توصيف ومعظمها على التعبير عن F4/80 ، علامة بلعم الطحال ، وقد تم تحديد مرحبا CD11c الرئة لو MHC - II سكان الخلية كما الضامة الرئوي (10) وأكثر في الآونة الأخيرة ، تمهيدا العاصمة المحتملة 11.
على النقيض من PDC الماوس ، اقتصر على دراسة الدور المحدد للمركز السيطرة على الأمراض في استجابة مناعية الرئوي نظرا لعدم وجود علامة معينة يمكن أن تساعد في عزل هذه الخلايا. لذا ، في هذا العمل ، ونحن تصف الإجراء لعزل عالي النقاء الماوس الرئة CDC. عزل مجموعات فرعية العاصمة الرئوي يمثل أداة مفيدة جدا للحصول على نظرة ثاقبة وظيفة هذه الخلايا في الاستجابة لمسببات الأمراض التنفسية فضلا عن العوامل البيئية التي يمكن أن تؤدي إلى استجابة المضيف المناعية في الرئة.
Protocol
1. نضح الرئة وحيدة الخلية تعليق
- الموت ببطء والفأر مع حقنة مخدر داخل الصفاق من خليط الكيتامين / زيلازين (في ملغم / الماوس الكيتامين 1.8 ، زيلازين 0.19) ، واستنزاف عن طريق الوريد الفخذي
- كشف التجويف الصدري عن طريق قطع وسحب بلطف يعود الجلد الخارجي للالبريتوني. المضي قدما لفتح الحجاب الحاجز عن طريق قطع القفص الصدري لفضح كل من القلب والرئتين.
- يروي بلطف الرئتين باستخدام حقنة 5 مل مملوءة EDTA - HBSS (1MM EDTA في HBSS - المغنيسيوم الكالسيوم الحرة /). الاتصال إبرة G 25 و ادخال ابرة في البطين الأيمن. لمنع التسرب أثناء الحقن ، وتأمين الأنسجة myocardiac حول إبرة باستخدام ملقط. حقن بلطف حل مع الحفاظ على الضغط المستمر. ونضح دقيقة نتيجة التضخم في الرئة وتغيير اللون إلى أبيض / الوردي.
- إزالة تصريف الغدد الليمفاوية لتجاهل أي تلوث محتمل من هذا النسيج.
- جمعأنسجة الرئة ، ونقل إلى طبق بتري على الجليد ، وختم لقطع صغيرة باستخدام شفرة حلاقة.
- نقل الأنسجة ترتكز في أنبوب C gentleMACS تحتوي على 5 مل / الرئة في حل الهضم كولاجيناز (كولاجيناز نوع 1A 0.5 ملغ / مل بالإضافة إلى نوع البنكرياس البقري الدناز الرابع 20 ميكروغرام / مل في HBSS تحتوي على 5 ٪ FBS ، 100 U / مل البنسلين و100 ميكروغرام / الستربتوميسين مل).
- استخدام dissociator gentleMACS للحصول على تعليق خلية واحدة. اختيار البرنامج : m_lung_01. احتضان عينة على 37 درجة مئوية لمدة 30 دقيقة. هز أنبوب كل 5 دقائق لresuspend شظايا الأنسجة. المضي قدما في m_lung_02 البرنامج.
- نقل العينة إلى أنبوب 15 مل المخروطية والطرد المركزي لمدة 10 دقيقة في 335 ز س في 4 درجات مئوية. بعد هذه الخطوة ، وإبقاء كل الكواشف centrifugations في 4 درجات مئوية لمنع انخفاض في قابلية الخلية.
- تجاهل طاف وليز المتبقية خلايا الدم الحمراء بإضافة 2 مل من ACK lysing العازلة لمدة 1 دقيقة في درجة حرارة الغرفة. غسل الخلايا مع 13مل من البرد BSA PBS/0.5 ٪ ، وأجهزة الطرد المركزي لمدة 10 دقيقة في 335 ز س في 4 درجات مئوية.
- تجاهل ، resuspend طاف خلايا الكلي في 5 مل من البرد BSA PBS/0.5 ٪ وتمرير دقيق النايلون 100 ميكرون شبكة.
- تحديد عدد الخلايا الكلي باستخدام التريبان استبعاد الصباغ الأزرق.
2. العزلة والمغناطيسية CD11c تخصيب خلايا +
- تعليق واحد خلية الطرد المركزي لمدة 10 دقائق في ز × 200 درجة مئوية في 4 و تجاهل طاف.
- Resuspend الخلية بيليه في 400 ميكرولتر من الفصل العازلة (PBS ، BSA 0.5 ٪ ، و 2 ملي EDTA) في خلايا 8 10 المجموع. كتلة FC - بوساطة الأضداد غير محددة ملزمة باستخدام anti-CD16/CD32 الأضداد (0.5μg / 10 6 خلايا) لمدة 30 دقيقة في 4 درجات مئوية.
- غسل الخلايا مع 10 مل من العازلة فصل البرد والطرد المركزي لمدة 10 دقيقة في ز × 200 في 4 درجات مئوية. Resuspend الخلايا في 400 ميكرولتر من العازلة الفاصلة.
- إضافة 100 ميكرولتر من MicroBeads CD11c في 10 8 خلايا الكلية. المزيج جيدا واحتضان لمدة 15 دقيقة في الثلاجة (2-8 درجة مئوية).
- غسل الخلايا مع 10 مل من العازلة فصل البرد والطرد المركزي لمدة 10 دقيقة في ز × 200 درجة مئوية في 4 و تجاهل طاف.
- Resuspend الكرية خلية في 3 مل من العازلة الفصل البارد.
- تنفيذ الفصل المغناطيسي باستخدام فاصل autoMACS TM برو بتحديد posseld البرنامج. جمع الكسر الإيجابي (0.5 مل).
3. الخلايا الجذعية التقليدية (CDC) العزلة
- احتضان المخصب CD11c تعليق خلية ايجابية مع مكافحة CD11c PE - Cy7 وanti-IA/IE (MHC - II) - FITC الأجسام المضادة لمدة 30 دقيقة في 4 درجات مئوية. تركيز الأجسام المضادة الأمثل هو 0.5 ميكروغرام / 10 6 من الخلايا.
- غسل الخلايا من البرد BSA PBS/0.5 ٪ والطرد المركزي لمدة 10 دقيقة في 335 ز س في 4 درجات مئوية. Resuspend الخلايا في 0.5 مل من جيش صرب البوسنة PBS/0.5 ٪ وتمريرها من خلال شبكة من النايلون 40 ميكرون.
- شروعفرز الخلايا باستخدام الخلية الأغنية FACS فارز في وضع النقاء. إضافة 100 ميكرولتر من جيش صرب البوسنة PBS/0.5 ٪ للأنابيب جمع من أجل منع تلف الخلايا النقية. إبقاء خلايا الجسم عند درجة حرارة المبرد في جميع أنحاء الخلية عملية الفرز.
4. بروتوكول بديلة للحصول على تعليق خلية واحدة وCD11c تخصيب خلايا +
- في استبدال dissociator gentleMACS ، يمكن نقل أنسجة الرئة أساس من 1.5 إلى الخطوة أنبوب مخروطية 15 مل تحتوي على 5 مل من محلول كولاجيناز في الرئة واحتضان لمدة 1 ساعة على 37 درجة مئوية. دوامة الخلايا كل 15 دقيقة من أجل resuspend شظايا الأنسجة. تعطيل الأنسجة عن طريق تمرير العينة 6-8 مرات الدخول والخروج من خلال حقنة 3 مل متصلة إبرة مجموعة ال 20. تجنب جعل فقاعات أثناء العملية ، وإلا سوف يعرض للخطر بقاء الخلية. مرة واحدة يتم الحصول على تعليق خلية ، انتقل إلى الخطوة 1.8.
- ليحل محل منفصل ، TM AutoMACSProويمكن أيضا تور ، والعزلة المغناطيسي لإثراء الخلايا CD11c ، أن يؤديها تمرير تعليق خلية يدويا من خلال أعمدة MACS اثنين. سيتم اختيار الأعمدة المناسبة تختلف تبعا لحجم العينة.
5. ممثل النتائج :
ويتم تحديد المراكز على النحو الرئة مرحبا CD11c / MHC - II سكان الخلية مرحبا. كما هو مبين في الشكل. 1 ، منها تمثل نسبة أقل من 1.4 ٪ بالمقارنة مع بعض الأنسجة الأخرى مثل الطحال (4.8 ٪). لكن ، على النقيض من الطحال والرئة الخلايا CD11c ايجابية عن كميات مختلفة من MHC - II ، بما في ذلك السكان خلية مختلفة من أن من CDC. بعد إعداد وحيدة الخلية ، وكان العائد خلية من خلايا الرئة مجموعه حوالي 3،0-3،8 7 × 10 خلية / الرئة مع بقاء 60-70 ٪ من خلالها ما يزيد قليلا عن 1 ٪ منها تمثل مجموعة فرعية. وزادت هذه النسبة بعد عزلة المغناطيسي CD11c حيث تم زيادة مجموع الرئة منها حوالي 10 رIMES (> 16 ٪) من إعداد الأصلي (الشكل 2A). ومع ذلك ، تمثل الخلايا CD11c التعبير عن كميات قليلة من MHC - II (CD11c مرحبا / لو MHC - II ، الضامة) وارتفاع عدد السكان الخلية تلويث (> 70 ٪) والتي كانت مختلطة مع مجموعة فرعية منها الرئة. كما هو مبين في الشكل. 2B ، تم القضاء على تلك الخلايا بعد فرز الخلايا الخطوة عندما وصلت منها النقاء> 96 ٪. وكان العائد المعتاد منها بعد العملية برمتها 5 × 10 4 خلية / الرئة. Microphotographs تظهر الخصائص المورفولوجية من مركز السيطرة على الأمراض والخلايا تقريب مع التشعبات نموذجي (اللوحة العليا). من ناحية أخرى ، مثلت CD11c مرحبا / لو MHC - II مجموعة فرعية مختلفة شكليا يعرض نتوءات الخلوية التي هي نموذجية في الضامة (MΦ ، اللوحة السفلى) 12.
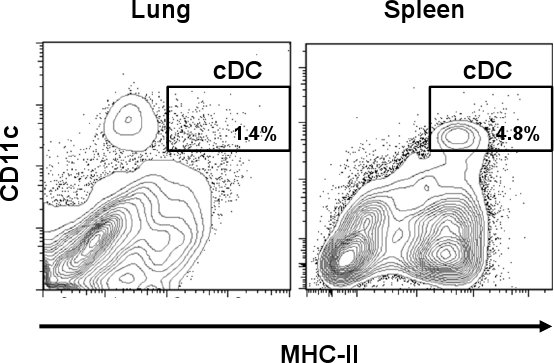
الشكل 1. التردد في العاصمة التفاضلية الماوس الرئة والطحال. a الرئةوجمعت الثانية من نسيج الطحال C57BL / 6 و الفئران تعامل مع كولاجيناز. بعد الهضم كولاجيناز ، تم صبغ الخلايا المضادة للماوس CD11c - PE - IA Cy7 ومكافحة فأر / IE FITC. قطع ممثل التدفق الخلوي تظهر النسب المئوية للCDC (CD11c مرحبا / مرحبا MHC - II) في الرئة والطحال.
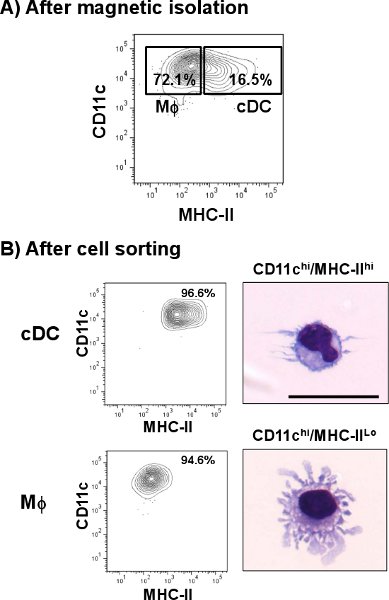
الشكل 2. عزل CDC من الرئة الماوس. تم تعليق الرئة المسمى الفأر مع خلية واحدة لمكافحة CD11c microbeads ومرت من خلال فاصل الخلايا التلقائي. أ) مؤامرة ممثل يبين النسب المئوية للCDC (CD11c مرحبا / مرحبا MHC - II) و الضامة (MΦ ، CD11c مرحبا / لو MHC - II) السكان بعد تخصيب CD11c. يتبع مزيد من تلطيخ الكسر المخصب استخدام الألغام المضادة للماوس CD11c - PE - IA Cy7 ومكافحة فأر / IE FITC. تم فرز الخلايا ايجابية مزدوجة وتحليلها من قبل التدفق الخلوي. إلىتم التعرف على التشكل ، cytospun الخلايا والملون مع تلوين رايت بالغيمزا المعدلة. B) المؤامرات الممثل تظهر النسب المئوية من مركز السيطرة على الأمراض وMΦ بعد فرز الخلايا. Microphotographs تظهر صورة ممثل CDC MΦ الرئة وسرطان الرئة. شريط النطاق = 20 ميكرون.
Access restricted. Please log in or start a trial to view this content.
Discussion
عزل العاصمة الماوس الرئوية هي تقنية هامة لدراسة طائفة واسعة من المحفزات في الجهاز التنفسي. عملية الحصول على هذه الخلايا وتشمل الخطوات الحاسمة التي تمنع فقدان الخلايا وكذلك بقاء الخلية والنقاء. سوف Perfusing الرئة قبل جمع مساعدة للقضاء على أي خلايا المحيطية وكذلك الحد من...
Access restricted. Please log in or start a trial to view this content.
Disclosures
الكتاب ليس لديهم ما يكشف.
Acknowledgements
فإن الكتاب أود أن أشكر لمارلين ديتريش في مرفق التدفق الخلوي LSU الأساسية لمساعدتها على فرز الخلايا وموترام بيتر لمساعدته مع microphotographs. وقد تم تمويل هذا العمل من قبل معهد الطيران المصاحبة للبحوث الطبية ، وبرنامج بحوث LSU جائزة للمنافسة ، ومنح المعاهد الوطنية للصحة / NIAID P20 RR020159 وR03AI081171.
Access restricted. Please log in or start a trial to view this content.
Materials
| اسم الكاشف | شركة | فهرس العدد | تعليق (اختياري) |
| ACK lysing العازلة | Invitrogen | D6 - 0005DG | |
| مكافحة فأر CD11c (HL3) | Pharmingen دينار بحريني | 5580979 | PE - Cy7 مترافق |
| مكافحة فأر IA / IE (269) | BD - Pharmingen | 553623 | مترافق FITC |
| Collangenase نوع 1A | سيغما | 9891 - 500MG | |
| خلية مصافى | فالكون دينار بحريني | 352340 ، 352360 | |
| CD11c (N418) Microbeads | Miltenyi | 130-052-001 | |
| أنا الدناز | سيغما | D5025 - 150KU | |
| هانك محلول الملح المتوازن | Invitrogen | 14170 | |
| Hepes العازلة الحل | Invitrogen | 15630 | |
| أطباق بتري 60 مم | فالكون دينار بحريني | 351016 | |
| GentleMACS ™ C أنابيب | Miltenyi | 130-093-237 | |
| طيف MACS dissociator | Miltentyi | 130-093-235 | |
| AutoMACS برو ™ | Miltenyi | 130-092-545 | |
| FASCS الأغنية | دينار بحريني |
References
- Pulendran, B., Palucka, K., Banchereau, J. Sensing pathogens and tuning immune responses. Science. 293, 253-256 (2001).
- Banchereau, J. Immunobiology of dendritic cells. Annual Review of Immunology. 18, 767-811 (2000).
- Manicassamy, S., Pulendran, B. Dendritic cell control of tolerogenic responses. Immunol. Rev. 241, 206-227 (2011).
- Steinman, R. M., Cohn, Z. A. Identification of a novel cell type in peripheral lymphoid organs of mice. I. Morphology, quantitation, tissue distribution. J. Exp. Med. 137, 1142-1162 (1973).
- Asselin-Paturel, C. Mouse type I IFN-producing cells are immature APCs with plasmacytoid morphology. Nat. Immunol. 2, 1144-1150 (2001).
- Chan, C. W. Interferon-producing killer dendritic cells provide a link between innate and adaptive immunity. Nat. Med. 12, 207-213 (2006).
- Taieb, J. A novel dendritic cell subset involved in tumor immunosurveillance. Nat. Med. 12, 214-219 (2006).
- Guerrero-Plata, A., Kolli, D., Hong, C., Casola, A., Garofalo, R. P. Subversion of pulmonary dendritic cell function by paramyxovirus infections. Journal of Immunology. 182, 3072-3083 (2009).
- Larson, R. S., Springer, T. A. Structure and function of leukocyte integrins. Immunol. Rev. 114, 181-217 (1990).
- Sung, S. S. A major lung CD103 (alphaE)-beta7 integrin-positive epithelial dendritic cell population expressing Langerin and tight junction proteins. J. Immunol. 176, 2161-2172 (2006).
- Wang, H. Local CD11c+ MHC class II- precursors generate lung dendritic cells during respiratory viral infection, but are depleted in the process. J. Immunol. 177, 2536-2542 (2006).
- Bhatia, S. Rapid host defense against Aspergillus fumigatus involves alveolar macrophages with a predominance of alternatively activated phenotype. PLoS One. 6, e15943-e15943 (2011).
- Shao, Z., Makinde, T. O., McGee, H. S., Wang, X., Agrawal, D. K. Fms-like tyrosine kinase 3 ligand regulates migratory pattern and antigen uptake of lung dendritic cell subsets in a murine model of allergic airway inflammation. J. Immunol. 183, 7531-75381 (2009).
- Hao, X., Kim, T. S., Braciale, T. J. Differential response of respiratory dendritic cell subsets to influenza virus infection. J. Virol. 82, 4908-4919 (2008).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved