Method Article
Microchambers الاغاروز لفترة طويلة التصوير الكالسيوم من
In This Article
Summary
Imaging behavior and neural activity over long time scales without immobilization of the animal is a prerequisite to understand behavior. Agarose microfluidic chambers imaging (AMI) can be used to image neural activity and behavior for all life stages of Caenorhabditis elegans.
Abstract
يتم التحكم السلوك من قبل الجهاز العصبي. التصوير الكالسيوم هو وسيلة واضحة في الديدان الخيطية شفافة انواع معينة ايليجانس لقياس نشاط الخلايا العصبية خلال السلوكيات المختلفة. لربط النشاط العصبي مع السلوك، لا ينبغي أن يجمد الحيوان ولكن ينبغي أن تكون قادرة على التحرك. تحدث العديد من التغيرات السلوكية خلال فترات زمنية طويلة وتتطلب تسجيل أكثر من عدة ساعات من السلوك. هذا أيضا يجعل من الضروري الثقافة الديدان في وجود الغذاء. كيف يمكن أن تكون الديدان مثقف ونشاطهم العصبي تصوير على فترات زمنية طويلة؟ الاغاروز Microchamber تصوير (AMI) وقد وضعت سابقا للثقافة ومراقبة اليرقات الصغيرة والآن تم تكييفها لدراسة جميع مراحل الحياة من أوائل L1 حتى مرحلة البلوغ من C. ايليجانس. AMI يمكن القيام بها في مختلف مراحل حياة C. ايليجانس. ويتحقق التصوير الكالسيوم على المدى الطويل دون شل حركة الحيوانات باستخدام التعرض أثار باختصار خارجيا كومbined ومع الإلكترون ضرب إلى جانب المسؤول عن تسجيل الجهاز (EMCCD) الكاميرا. التصغير أو المسح الضوئي يمكن توسيع نطاق هذا الأسلوب لصورة ما يصل الى 40 الديدان في وقت واحد. وهكذا، وصفت طريقة لسلوك صورة والنشاط العصبي على فترات زمنية طويلة في جميع مراحل حياة C. ايليجانس.
Introduction
Caenorhabditis elegans has been established as a model system to study behavior1. Due to its amenability to genetics, the molecular and cellular mechanisms underlying behavior can be studied. Many behaviors occur on long time scales. Two principal approaches can be used to observe motile animals over long time scales. The first approach is following the animal during movement using an automated stage or camera2-8 and the second is to restrict the movement to a range that is at least as small as the field of view of the camera9-14. Both methods have their advantages. Tracking allows following an animal over long spatial ranges but limits the number of animals that can be discerned in one experiment. Restricting the movement of the animals allows scaling up the observation to many individuals at the same time by using arrays of restricted compartments.
Because the nematode is transparent, live fluorescent imaging can be performed non-invasively15. Calcium imaging provides a functional readout for the activity of excitable cells and is established for C. elegans16-20. Calcium enters the cell via channels in the plasma membrane that open upon depolarization. Thus, calcium acts as a proxy for neural activity. Calcium sensors can be grouped in two major classes, ratiometric and non-ratiometric sensors. Both classes employ conformational changes of calcium-binding proteins induced upon binding of calcium. Ratiometric sensors contain two fluorescent proteins. When the lower-wavelength fluorescent protein is excited, a part of the light energy is transmitted to the higher wavelength fluorescent protein as a function of their distance in a process called Fluorescence Resonance Energy Transfer or Förster Resonance Energy Transfer (FRET)21. Non-ratiometric sensors are based on circularly permuted GFP and employ de-quenching of the fluorophore caused by calcium binding22. Each class has its advantages. While ratiometric sensors are less sensitive to movement or expression artifacts, non-ratiometric sensors typically have a higher dynamic range. Both ratiometric and non-ratiometric sensors have been useful to study the activity of excitable cells in C. elegans16-20,23,24.
When doing long-term fluorescence imaging, the experimenter will have to deal with several potential challenges: 1. Disturbance of behavior through excitation light: Worms are sensitive to short-wavelength fluorescence excitation light and avoid light from the violet to blue range that is used for calcium imaging25,26. Worms respond with either a backward or a forward escape response25,26. Thus, the amount of light needs to be controlled. 2. Bleaching of the fluorescent sensor protein: Often, bleaching of the fluorescent protein hampers long-term imaging. Typically, however, light intensities that are needed to observe bleaching are higher than the light intensities that cause disturbing effects on the behavior of the animals. Thus, bleaching is only a theoretical problem in this type of calcium imaging. 3. Worms inside the microchambers are not fixed and move constantly during wake behavior and images may appear blurred if the worm is not immobilized. All these challenges can be solved using extremely short exposure times with low light intensity. This can be realized by using a highly sensitive EMCCD camera with short exposure times and external triggering of a light emitting diode (LED). To expose the worms to the illumination light as briefly as possible (only during the exposure time of the camera) the LED is externally triggered using a transistor-transistor logic (TTL) signal that the camera emits during exposure resulting in an illumination of the worm for precisely the time the camera chip is exposed. This also means that the EMCCD chip will be dark during data readout, which is optimal for readout performance of this chip.
Previously, agarose microchambers have been developed for long-term fluorescence imaging of C. elegans larvae9. Here, it is described how agarose micro-chambers can be used for long-term calcium imaging for any life stage of C. elegans, how calcium imaging can be performed, and how this method can be upscaled to assay many individual worms in parallel.
Protocol
1. أدوات والثقافة وسائل الإعلام، وأطباق
- استخدام المجهر قادرة على حفظ العينة في التركيز ومجهز مرحلة التلقائية. بناء سخان غطاء حسب الطلب أو شراء حلا التجاري. انشاء-EMCCD LED نظام الكاميرا التي تعرض الكاميرا مشغلات LED الإضاءة من خلال إشارة TTL باستخدام تعليمات الشركة الصانعة.
ملاحظة: انظر مناقشة للحصول على التفاصيل. - Polydimethylsiloxan (PDMS) الطوابع:
- افتعال PDMS الطوابع في منشأة على microfluidics أو لديك الطوابع PDMS التي تنتجها مسبك التجاري. لاستخدام مسبك التجاري، وإرسال ملف أوتوكاد للشركة وتحديد العمق (15 ميكرون، على سبيل المثال) من الجهاز. بعد التسليم من مسبك، وقطع شريحة PDMS إلى 16 طوابع باستخدام مشرط.
- السندات كل طابع فردي لشريحة زجاجية باستخدام البلازما الجوية. للارتباط، فضح كل من الطوابع PDMS وشريحة زجاجية لالبلازما الجوية لنوبة 1 دقيقة (باستخدام أعلى إعدادات البلازما عند 0.5 ملي بار). تأكد من أن الأسطح للارتباط تواجه صعودا خلال العلاج البلازما. ثم، وضع ختم PDMS على الشريحة الزجاجية.
- اتخاذ 3،5 سم الطبق السفلي وقطع منطقة مربع من 18 × 18 مم من وسط قاع الطبق باستخدام آلة طحن العمودي وقطع دوارة حادة. استخدام منخفضة سرعة دوران القاطع وتغذية بطيئة لمنع البلاستيك من ذوبان بسبب الحرارة الناتجة عن الاحتكاك. إعداد عدة أطباق في آن واحد.
ملاحظة: الطبق السفلي يمكن إعادة استخدامها عدة مرات بعد التجربة إذا تم تنظيفها بعد تمرغ في الايثانول النقي O / N. - الاغاروز:
- حل 3 ز عالية ذوبان نقطة الاغاروز في 100 مل S-بصل (5.85 جم كلوريد الصوديوم، 1 ز K 2 هبو 4 و 6 ز KH 2 PO 4، 1 مل الكولسترول (5 ملغ / مل في الإيثانول)، H 2 O ل1 L، تعقيم بواسطة التعقيم) من قبل الغليان. جعل aliquots من المنحل الاغاروز في 2 مل أنابيب إيبندورف وستوره. أيضا، إعداد دفعة من الاسعار المنخفضة للذوبان نقطة الاغاروز بالضبط بنفس الطريقة كنقطة الاغاروز ذوبان عالي.
- قبل الاستخدام، ضع 3 aliquots من نقطة ذوبان عالي الاغاروز على كتلة التدفئة في 95-98 درجة مئوية. قبل الاستخدام، ضع قسامة واحدة من نقطة منخفضة ذوبان الاغاروز على كتلة التدفئة في 95-98 درجة مئوية حتى قد ذاب، وبعد ذلك على كتلة التدفئة في 30 - 35 ° C.
2. اختيار الحيوانات
- تنمو الديدان في مناطق ذات كثافة منخفضة على لوحات NGM المصنفة للحصول على الحيوانات نظيفة. تأكد من أن هناك الكثير من المواد الغذائية والحيوانات القليلة الوحيدة على لوحة.
- للتصوير L1 اليرقات، ونقل نحو 30 البيض التي تحتوي على أجنة في مرحلة المملح على الطازجة لوحة NGM المصنفة. لنقل مراحل اليرقات في وقت لاحق أو C. الكبار ايليجانس، نقل نحو 30 الديدان على الطازجة لوحة NGM المصنفة.
3. إعداد الاغاروز Microchambers
- إعداد الطبق:
- خذ طبق من البلاستيك مع افتتاح مربع من 18 × 18 مم في الجزء السفلي ووضعه رأسا على عقب مع افتتاح تواجه صعودا. إغلاق الفتحة عن طريق وضع قطعة من شريط لاصق على الوجهين 20 × 20 مم على الافتتاح. تحويل صحن حول بحيث شريط لاصق على الجزء السفلي، ووضع الطبق على سطح صلب. قطع افتتاح مجانا باستخدام مشرط.
- باستخدام ماصة P1000، وملء 2 مل من 3٪ ارتفاع ذوبان نقطة الاغاروز في S-بصل في طبق. وضع الاغاروز على المنطقة التي تحيط فتح والسماح يصلب. انتظر حتى الاغاروز صلبة.
- بدوره حولها الطبق وانزع فيلم واقية التي تغطي شريط لاصق على الوجهين بحيث الجانب زجة ستبقى على طبق وسيتم عرضة للخطر.
ملاحظة: ونتيجة لذلك، فإن حلقة رائعة من شريط لاصق تحيط خارج الافتتاح. يخدم الاغاروز كمستودع الرطوبة التي ستحيط في وقت لاحق العينة.
- الصب من microchambers:
- فضح عشرالبريد سطح PDMS صب مع البلازما الجوية ل20-60 ثانية.
ملاحظة: هذا العلاج البلازما يجعل PDMS سطح ماء، والذي يحول دون احتباس فقاعات الهواء وتنتج يطبع أكثر وضوحا. - بناء اثنين من الفواصل المتساوية في الارتفاع من التراص 5-9 الشرائح الزجاجية. المكان، بالتوازي مع الجانبين الطويلة، وأول كومة الفاصل، ثم شريحة زجاجية واحدة، ثم مرة أخرى كومة الفاصل. ضع الشريحة الزجاجية التي تحتوي على ختم PDMS متعامد عبر الفواصل. ضبط ارتفاع الفواصل حتى لا يكون هناك مساحة من حوالي 1.5 ملم بين السطح الصب من الطوابع PDMS وشريحة زجاجية واحدة.
- وضع قطرة من الملفات الساخنة السائل عالية ذوبان نقطة الاغاروز على شريحة زجاجية واحدة بالقرب من الطوابع PDMS وسرعان ما حرك PDMS ختم عموديا في الاغاروز السائل. السماح للالاغاروز يصلب. تأكد من أنه يحصل على مظهر مبهمة، والتي عادة ما يستغرق حوالي 2 دقيقة. سحب قبالة الطابع عموديا مع حركة واحدة.
ملاحظة: أنه لأمر مريح للGLرق هل الشرائح جنبا إلى جنب مع شريط لاصق على الوجهين. الحركة الرأسية للطابع يمنع فقاعات الهواء من الوقوع في فخ الاغاروز.
- فضح عشرالبريد سطح PDMS صب مع البلازما الجوية ل20-60 ثانية.
- نقل البيض أو الديدان جنبا إلى جنب مع البكتيريا OP50 على الاغاروز باستخدام غرامة اختيار سلك البلاتين. توزيع بيضة واحدة أو دودة واحدة لكل غرفة جنبا إلى جنب مع المواد الغذائية التي تستخدم لها جفن. ملء حوالي 30 بيضة على لوحة الاغاروز واحد.
- قطع لوح الاغاروز تحتوي على microchambers شغل في ساحة حوالي 15 × 15 مم بحيث يناسب بشكل رائع في افتتاح الطبق. التقاط لوح الاغاروز مربع مع ملقط ووضعه رأسا على عقب على الزجاج ساترة من 20 × 20 مم. مرة واحدة انخفض، لا رفعه من جديد أو الانزلاق حولها لأن هذا قد يسبب البكتيريا والديدان إلى أن طردوا من الغرف الخاصة بهم.
- جمعية الطبق:
- وضع ساترة الزجاج على افتتاح طبق من البلاستيك. اضغط بلطف إلى أسفل ساترة الزجاج على خاتم مصنوع من شريط لاصق على الوجهين.الحرص على عدم كسر الزجاج.
- تحويل الطبق رأسا على عقب واستخدام ماصة P1000 لسد الفجوة بين لوح أجار التي تحتوي على microchambers وخزان الاغاروز مع السائل منخفضة ذوبان نقطة الاغاروز يبرد إلى حوالي 30 درجة مئوية. الانتظار حتى agarose وطدت.
- ختم الطبق مع غطاء. لالمجاهر المقلوب استخدام غطاء ساخنة. لالمجاهر تستقيم استخدام غطاء طبيعي وختم الطبق مع parafilm.
- بعد الانتهاء من إعداد microchambers، والتحقق منها تحت stereomicroscope. ملء الصحيح أمر بالغ الأهمية. انظر مناقشة للحصول على التفاصيل.
4. التصوير الكالسيوم
- استخدام السلالات المعدلة وراثيا معربا عن أجهزة استشعار الكالسيوم المشفرة وراثيا مثل HBR16 (goeIs5 [pnmr-1 :: SL1-GCaMP3.35-SL2 :: UNC-54-3'UTR، UNC-119 (+)]) (27).
- استخدام المجهر المركب مجهز لepifluorescence واسعة المجال. وصل الناتج TTL من الكاميرا EMCCD لالمدخلات TTL للLED، بحيث في كل مرة تسجل الكاميرا إطار سيتم إضاءة العينة. استخدام الوقت تعرض حوالي 5 ميللي ثانية. استخدام EM ربح في حدود 50-300.
- تحديد فيلم انفجار على التوالي لمدة 24 ساعة مع كل دودة التي يجري تصويرها كل 15-30 دقيقة لأول مرة لمدة 20 ثانية مع مدينة دبي للإنترنت، ثم لمدة 20 ثانية مع مضان GFP لتسجيل GCaMP، ومن ثم اتخاذ الصورة النهائية للإشارة mKate2 يتم اتخاذها لل السيطرة على مستويات التعبير. استخدام معدل الإطار 2 / ثانية خلال كل انفجار.
- للتفتيش البيانات البصرية، واستخدام خريطة مموهة الألوان لتعزيز وضوح التغيرات الصغيرة في كثافة مضان. مؤامرة البيانات الفلورسنت كما ΔF / F، F مع كونها قيمة خط الأساس متوسط مضان. وصف تفصيلي للتحليل البيانات الكالسيوم يمكن العثور عليها في الأدبيات 20.
5. AMI الموازي من الديدان متعددة
- ضع صحن يحتوي على microchambers على المجهر، والتركيز على عينة وإشراك autofoسلطات الجمارك. إعداد بروتوكول البرامج بحيث الكاميرا تكتسب دفعة من 40 إطارات الصورة في 20 ثانية كل نصف ساعة لمدة 24 ساعة، الأمر الذي سيؤدي في 1920 لقطة في دودة، وهو مبلغ معقول من البيانات. إعداد المسح بحيث يزور كل دودة باستخدام المرحلة. تهدف لتصوير نحو 30 الديدان في تشغيل واحد.
- صورة الديدان متعددة التصغير، أي باستخدام التكبير أقل. استخدام التكبير أقل لتغطية العديد من microchambers مع رقاقة الكاميرا وتصوير العديد من microchambers المجاور في وقت واحد. بعد انتهاء الحصول على الصور، فصل البيانات لكل غرفة على حدة من قبل الاقتصاص المنطقة ذات الاهتمام تغطي حيوان واحد.
- لتقييم البيانات بسرعة التنقل، استخدام إطار الطرح 28-32.
6. التصوير مراحل الحياة المختلفة من C. ايليجانس
- استخدام microchambers الاغاروز لجميع مراحل حياة C. ايليجانس من L1 إلى الكبار وبما dauers. استخدام أبعاد الغرفة المناسبة للتنمية المتكاملة للأسرةferent مراحل الحياة التي تظهر في الجدول 1.
| فئة عمرية | حجم الغرفة | عمق الغرفة | نموذجي وقت التسجيل | تكبير |
| L1 | 190 × 190 ميكرون | 10-15 ميكرومتر | البيض - منتصف L2 | 400X |
| L2 | 370 X 370 ميكرون | 15 ميكرون | البيض - L3 | 200X |
| داور يرقة | 370 X 370 ميكرون | 25 ميكرون | 4 أيام | 200X |
| L3 | 700 X 700 ميكرون | 45 ميكرون | L2 - L4 | 200X |
| L4 | 700 X 700 ميكرون | 45 ميكرون | L4 الشباب - الشباب البالغين | 100X |
| الشباب البالغين | 700 X 700 ميكرون | 45 ميكرون | 12 - 24 ساعة | 100X |
الجدول 1. أحجام غرفة لمراحل الحياة المختلفة. المبينة ل أبعاد الغرفة وتكبير التي هي مفيدة لمختلف مراحل الأمثل ل8 × 8 ملم كاميرا رقاقة.
النتائج
microchambers الاغاروز يمكن تطبيقها على أي مرحلة من الحياة C. ايليجانس. كما يمكن أن يرى في الشكل 1A، ويمكن ملاحظة نمو اليرقات وسلوك النوم خلال L1 نوام المثقبيات. أظهرت أحجام الغرفة التي هي 190 × 190 ميكرون، 10 ميكرون العميق. إذا كانت هناك حاجة جداول زمنية أطول، ويمكن استخدام الدوائر الكبيرة. كما يمكن أن يرى في الشكل 1B، وذلك باستخدام غرفة ذات أبعاد أكبر (370 X 370 ميكرون، 25 ميكرون العميق) يسمح تطوير C. ايليجانس من البيض حتى الكبار. ويبين الشكل 1C تحليل التغيرات طويلة الأجل في السلوك باستخدام إطار الطرح من دودة نمت في غرفة من البيض حتى الكبار. المعروضة هي شدة يعني بعد إطار الطرح لرشقات نارية المحددة أثناء أعقاب ونوام المثقبيات. وانخفاض كثافة يعني بعد القيم إطار الطرح هو، وانخفاض حركة الدودة. أظهرت يتم اختيار آثار انفجار واحد من حالة أعقاب واحدة حالة نوام المثقبيات في مرحلة اليرقات. الومن المقرر في الغالب إلى زيادة التباين وحجم الحيوان الزيادة الملحوظة في متوسط كثافة خلال التنمية. ويبين الشكل 1D يرقة داور، مرحلة الحياة البديلة التي تعمل في ظروف بيئية معاكسة 33. حجم الغرفة 370 X 370 ميكرون، 15 ميكرون عميقة. لاحظ أن وضعت اليرقة داور الى غرفة من دون الغذائي البكتيري، والتي من شأنها أن تسبب خروج من مرحلة اليرقات داور. ويبين الشكل 1E دودة الكبار، وقد وضعت بالفعل الكثير من البيض في الغرفة. وكانت أبعاد الغرفة المستخدمة في البالغين 700 X 700 ميكرون، 45 ميكرون العميق. أخيرا، يبين الشكل 1F على خنثى الكبار والتزاوج من الذكور داخل غرفة الكبار.
التصوير الكالسيوم في الديدان متحركة ممكن مع أجهزة استشعار الكالسيوم GCaMP. أرقام 2A، B عرض التصوير الكالسيوم من عصبون قيادة AVA لليرقة L1 27. أرقام 2C، D إظهار النشاط الكالسيوم لسالي نوع من الخلايا العصبية في حيوان بالغ.
رفع مستوى التصوير على المدى الطويل من الممكن عن طريق المسح الضوئي والتصغير الشكل 3A يدل على جودة الصورة من التصوير في وقت واحد من 30 الديدان على رقاقة واحدة كاميرا مع كاميرا 5 ميجا بكسل. الشكل 3B يدل على جودة الصورة من 4 الديدان الكالسيوم تصويرها في وقت واحد.

الشكل 1. التكيف من AMI لجميع مراحل حياة C. ايليجانس. (A) اليرقة تصويرها من أوائل L1 حتى أوائل المرحلة L2 في 190 × 190 ميكرون غرف. (B) للتنمية من البيض حتى الكبار في الغرفة 370 X 370 ميكرون. (C) التنقل من دودة تقييمها باستخدام إطار الطرح. أظهرت هو كثافة يعني كل الصور من الصورة بعد إطار الطرح لأحد اختيار الفيلم انفجار لكل ستا اليرقاتشركة جنرال الكتريك للأعقاب والسلوك نوام المثقبيات. (D) وداور يرقة في غياب المواد الغذائية في غرفة ميكرون 370 X 370. خنثى (E) الكبار مع العديد من البيض الذي تضعه في غرفة 700 X 700 ميكرون. (F) التزاوج من ذكر وخنثى داخل غرفة 700 X 700 ميكرون. YA يعني الشباب البالغين. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
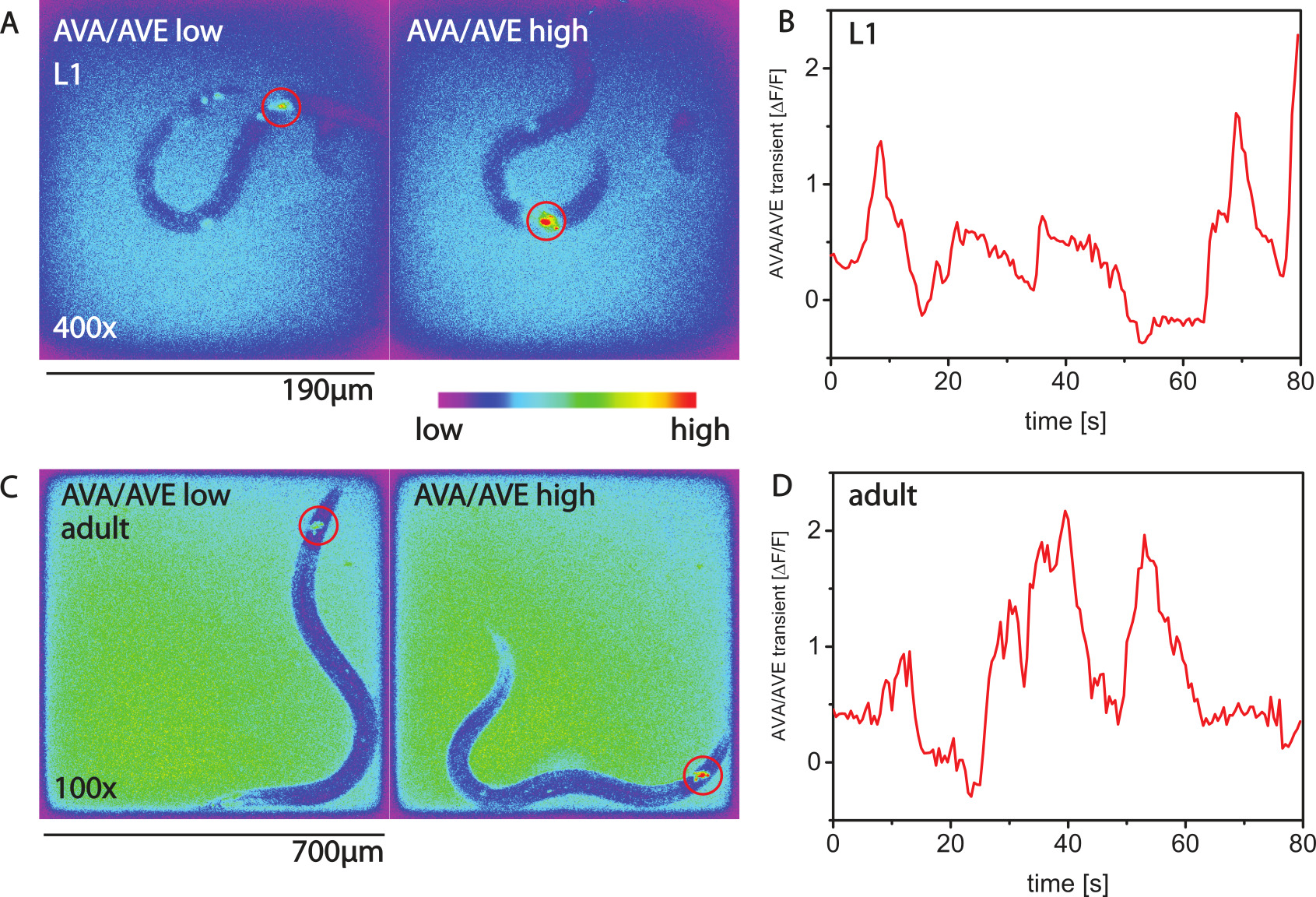
الشكل 2. الكالسيوم التصوير مع AMI. (A) التصوير الكالسيوم مع GCaMP3 في عصبون قيادة AVA من L1 اليرقات باستخدام الرنين المغناطيسي النووي المروج-1. يظهر نوعان من الصور كاذبة اللون. في الصورة اليسرى، ونشاط AVA منخفضة ودودة لا يجعل حركة إلى الوراء. في الصورة الصحيحة نشاط AVA هو عالية، ودودة تتحرك إلى الوراء. العابرين (B) الكالسيوم مع مرور الوقت لدودة L1. (C، D) العابرين الكالسيوم في حيوان بالغ. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.

الرقم 3. التصوير الديدان متعددة في نفس الوقت عن طريق تصغير. (A) التصوير في وقت واحد من 30 الديدان L1 في الإطار باستخدام 190 × 190 ميكرون غرف والتكبير 100X (باستخدام الهدف 10X)، و16،6 × 14 مم كاميرا رقاقة. (B) التصوير في وقت واحد من أربعة الديدان L3 في الإطار باستخدام 370 X 370 ميكرون غرف والتكبير 100X والمنطقة من اهتمام من 16.6 × 14 مم كاميرا رقاقة.وآخرون = "_ فارغة"> اضغط هنا لمشاهدة نسخة أكبر من هذا الرقم.
Discussion
المعدات
سيكون تركيز المجهر الانجراف عادة خلال الحصول على الصور على المدى الطويل. لالمجاهر المركبة، والتركيز لحفظ الأنظمة يمكن شراؤها من المصنعين المجهر الكبرى. في حالة المجهر المركب مع تركيز الرقابة ثمنا للغاية، فإن البديل يكون بسيط لاستخدام stereomicroscope. المجاهر المركبة تسمح باستخدام الأهداف مع الفتحة العددية عالية (NA)، ويمكن أن يكون آليا بسهولة. الأهداف النفط 40X هي مناسبة تماما. العدسات غمر المياه ليست مثالية بسبب التبخر أثناء التصوير على المدى الطويل. فرق التدخل النقيض (DIC) يولد النقيض لطيفة التي تساعد على متابعة التغيرات الشكلية والسلوكية، ولكن يمكن أيضا أن تستخدم التصوير حقل مشرق بسيط. لDIC أو التصوير حقل مشرق، استخدم الضوء الأحمر عن طريق وضع مرشح الضوء الأحمر في مسار ديا-إضاءة المجهر. لمسح عدة microchambers مرحلة الآلية ضرورية. أفضل أداء ميلانhieved عند استخدام المرحلة التي لديها التسارع والتباطؤ غير الخطية ويمكن وضعها لانخفاض سرعة المسح الضوئي لمنع إزعاج الحيوانات خلال المسح الضوئي. لم نلحظ الاستجابات السلوكية أو زيادة الكالسيوم في الخلايا العصبية mechanosensitive (ALM وPLM) خلال المسح الضوئي، مما يدل على أن المسح بطيئة في الواقع لا يتم تنشيط النظام mechanosensitive من دودة (لا تظهر البيانات). يمكن استخدام أنظمة الصمام التجارية. العديد من الشركات تقدم حلولا جاهزة للاستخدام والتي تشمل المصابيح عند أطوال موجية مختلفة. يجب أن يكون LED خيار اثار خارجيا LED مع إشارة TTL. وهناك حاجة إلى كاميرا حساسة للغاية للتصوير الكالسيوم الانتقال الحيوانات. كاميرات EMCCD هي الكاميرات الأكثر حساسية في السوق. تحتاج الكاميرا لإخراج TTL خلال التعرض (وتسمى أيضا "النار" الإخراج). مطلوب سخان غطاء لمنع التكثيف على الغطاء إذا باستخدام مجهر مقلوب. على مجهر تستقيم، سيتم وضع الطبق بحيث واي غطاءسوف تكون في أسفل وبالتالي يتم منع التكثيف وليس هناك حاجة التدفئة الغطاء. الغطاء يجب أن تغلق بإحكام الطبق لمنع تبخر الماء أثناء التصوير على المدى الطويل.
PDMS الطوابع
يواجه سطح ختم PDMS الذي يحتوي على هيكل لصب الاغاروز بعيدا عن شريحة زجاجية، والتي تدعم الطابع PDMS. ويمكن الاطلاع على القائمة مع الشركات التي تقدم رقائق ميكروفلويديك الجمركية على ويكيبيديا ( http://en.wikipedia.org/wiki/List_of_microfluidics_related_companies ).
ملء النيماتودا إلى غرف بهم
هذه هي الخطوة الأكثر أهمية في البروتوكول وينبغي النظر في النقاط التالية: أ) [مويستنس من الاغاروز أمر بالغ الأهمية لنقل الديدان وللتصوير. إذا كان الاغاروز رطبا جدا، أي هناك COV السائلتعافي مساحة عدة microchambers، فإنه لن يكون من الممكن توزيع المواد الغذائية والديدان البكتيرية في الطريقة التي تسيطر عليها لأن السائل سيجعل تدفق البكتيريا بعيدا. إذا كان الاغاروز جافة جدا ثم البكتيريا والديدان قد لا تحصل قبالة بيك بسهولة مما يعني أن زيادة قوة تحتاج إلى استخدامها لإسقاط الديدان والبكتيريا التي تسبب بسهولة الأضرار التي لحقت الاغاروز. عند تعبئة الكثير من الديدان الاغاروز قد تجف. في أسوأ الحالات الاغاروز سوف تكون جافة جدا في النهاية أن الدوائر سوف ينهار. إذا كان الاغاروز جاف جدا يمكن ممهى ذلك عن طريق وضع قطرة صغيرة (حوالي 2 ميكرولتر) من S-بصل على جانب من الشريحة التي لا توجد فيها الديدان. ثم تراجع سلك البلاتين اختيار في السائل وحتى سحب بعض من السائل في المنطقة حيث تمتلئ غرف مع الديدان. B) وكمية من المواد الغذائية أمر بالغ الأهمية للتصوير ناجحة على المدى الطويل. إذا لم يكن هناك ما يكفي من الغذاء، قد تعمل الديدان للخروج منه. إذا كان هناك الإفراط في الطعام تجويف الغرفةلن تتصرف مثل السائل ولكن ليس مثل صلبة وتسمح الديدان للهروب من الغرفة عن طريق دفع قبالة البكتيريا. تهدف إلى الحصول على تعليق البكتيرية التي تملأ الغرفة بأكملها. الديدان هي في اتصال جسدي دائم مع سطح أجار والزجاج على طول معظم طولها خلال التجربة ويظهر السلوك الزحف لتكون مشابهة لحركة على طبق من ذهب ومتباينة لسحق في السائل. C) الميكانيكية ضررا من الاغاروز يمكن أن تدمر التجربة. A اختيار جيد أمر ضروري. لا ينبغي أن يكون زوايا حادة. A رمش لينة تعلق على طرف الماصة يمكن استخدامها لنقل البكتيريا أو الديدان في غرف بدلا من استخدام معول البلاتين. في معظم الحالات، ومع ذلك، الاغاروز overdried هو سبب الضرر. المعول أو رمش ينبغي، من الناحية المثالية، فقط بالكاد تلمس الاغاروز نفسها، والفيلم المياه على سطح الاغاروز يجب سحب قبالة الديدان والبكتيريا. عندما ختم الدوائر، مرة أخرى، والرطوبة في الاغاروز أمر ضروري. لا ينبغي هناكأن يكون أي السائل الحرة على سطح الاغاروز لأن هذا قد يغسل البكتيريا والديدان خلال الختم. يمكن إزالة فقاعات كبيرة من خلال رفع بلطف زاوية من لوح أجار. الفقاعات الصغيرة التي تكون أصغر من الغرفة في كثير من الأحيان الحصول على المحاصرين داخل الغرف. هذه الفقاعات ليست مشكلة، وسوف تختفي عن طريق الامتصاص. بعد تجميع الطبق، والتحقق مرة أخرى أن الاغاروز ليست جافة جدا أو رطبة جدا. الدوائر يجب أن تكون مختومة بشكل جيد ويجب ألا يكون هناك أي تدفق السائل بين المجلسين. إذا كان الاغاروز هو الرطب جدا، فإن غرف لا ختم صحيح. الديدان قد يهرب أو سيتم غسلها طعامهم بعيدا. إذا كانت العينة رطبة جدا وبسيطة فتح الغطاء، والسماح للالاغاروز الجافة لمدة دقيقة أو اثنين. إذا كان الاغاروز هو جاف جدا، ويجوز للغرف تنهار وسوف الديدان من الهرب.
تصعيد من قبل التصغير
للتصوير مضان، التصغير محدودة بسبب انخفاض كمية الضوء التي تم الحصول عليها في تكبير السفلى. أيضا، Eهي الأمثل كاميرات MCCD للحساسية وغالبا ما يكون دقة منخفضة نسبيا. ومع ذلك، رفع مستوى التصوير أربعة أضعاف من الممكن أيضا. على سبيل المثال، يمكن أن أربع غرف من 190 ميكرون × 190 ميكرون تناسب على إطار واحد عند استخدام 140X التكبير (باستخدام 20X الهدف وكاميرا 0.7X جبل تحقيقه) و512 X 512 بكسل، 8 × 8 ملم الكاميرا. كاميرا عالية الدقة مع شريحة كبيرة (مثل الكاميرات sCMOS، 16.6 مم × 14 مم رقاقة، 2560 X 2560 بكسل = 5.5 ميجابيكسل) يحسن توسيع نطاق مدينة دبي للإنترنت والتصوير حقل مشرق. على سبيل المثال، تصل إلى 30 الديدان L1 في 190 ميكرون × 190 ميكرون الدوائر يمكن أن يصلح على كل إطار من هذه الكاميرا عند استخدام التكبير 100X (انظر الشكل 3). من حيث المبدأ، التصغير ويمكن أيضا الجمع بين المسح الضوئي للحصول على أعداد أكبر من الحيوانات. معظم الخلايا العصبية البقاء بشكل جيد في التركيز، بحيث تحتاج البؤري واحدة فقط ليتم تصويرها. إذا تم العثور على الخلايا العصبية للخروج من التركيز، من الألف إلى الياء المسح الضوئي باستخدام محرك بيزو يمكن اتخاذها في كل مرة عoint.
التكيف مع السلوكيات مختلفة
هذا البروتوكول يعطي فكرة جيدة عن السلوك عبر فترات زمنية طويلة. ومن الواضح أن توقيت رشقات نارية يحتاج إلى أن تتكيف مع السلوكيات المختلفة ومراحل الحياة.
القيود المفروضة على تقنية
عدة عوامل تحد من مدة التصوير. والأهم هو كمية الطعام. مرة واحدة يتم استهلاك الطعام، تتوقف اليرقات النامية. وهكذا، في غرف صغيرة (190 × 190 ميكرون) الديدان تتطور حتى المرحلة L3 ثم القبض عليهم. إذا كنت بحاجة لوقت أطول التصوير وغرف أكبر لا بد من استخدامها. المدة القصوى للتصوير على المدى الطويل هي في حدود 2.5 - 3 أيام. إذا كنت بحاجة التصوير البعيد، تحتاج الديدان ويمكن انتشالها وضعها في غرف جديدة. عندما التصوير الديدان البالغة، هو سبب آخر عن طريق الحد من الأبناء من هذه الديدان. الديدان البالغة تضع بيضها يفقس يرقات التي. وهذه اليرقات أيضا البقاء داخل غرفة، وتستهلك المواد الغذائية، ويمكن أن تعكر صفو تحليل الصور. إذا ذرية مشكلة، والحل هو إما استخدام البالغين العقيمة أو لوضع مرارا الديدان إلى غرف جديدة. لاسترداد الديدان، ويتم قطع لوح الاغاروز تحتوي على غرفة مجانية مع مشرط، يتم سحبها من ساترة، ويتم وضعها على لوحة NGM من الديدان التي يمكن استردادها. حد آخر هو تقييد الديدان إلى مناطق صغيرة نسبيا. قد تكون هذه مشكلة إذا تحتاج الحركة بعيدة المدى ليتم تحليلها. بينما الحيوانات في الدوائر يمكن أن يكون حافزا ميكانيكيا وoptogenetically 21،27،34،35، فإن طبيعة مختومة من الغرفة تجعل من الصعب تطبيق المنشطات قابلة للذوبان أو المتقلبة. يمكن غازات الهامة من الناحية البيولوجية مثل الأكسجين أو ثاني أكسيد الكربون منتشر بحرية في أجار. خزان الهواء كبير في الطبق يجب الحفاظ على تركيزات غازات في غرف ثابتة على مر الوقت اللازم لإجراء التجارب. ومع ذلك، فإنه ينبغي أن يوضع في الاعتبار أن concentratio الأكسجين المحليةن في الغرفة قد تشبه أكثر الظروف وجدت في ثقافة السائل من الثقافة على لوحة.
أهمية فيما يتعلق بأساليب القائمة
أجهزة ميكروفلويديك تقدمت كثيرا السلوكية والتنموي درس في C. ايليجانس. في كثير من الأحيان، يتم إجراء الهياكل ميكروفلويديك من PDMS 12. نحن هنا وصف بروتوكول لتوليد غرف الثقافة ميكروفلويديك مصنوعة من الاغاروز. قوة هذه التقنية هي مزيج من جودة التصوير عالية، ارتباط السلوك مع القياسات الفسيولوجية، والتصوير على المدى الطويل، وإنتاجية عالية إلى حد معقول. ويتحقق صورة عالية الجودة عن طريق التصوير من خلال ساترة الزجاج باستخدام الأهداف NA عالية. ونتيجة لذلك، والتصوير مضان مثل التصوير الكالسيوم والتصوير متحد البؤر الهياكل التحت خلوية يمكن أن يؤديها. لأنه لم يتم يجمد الحيوانات كما هو الحال في الأنظمة الأخرى، لأنها تتيح الربط بين السلوك مع القياسات الفسيولوجية. تيروause الحيوانات لها الطعام وافرة، ومواصلة تطوير السماح التصوير على المدى الطويل. هذا النظام يمكن أن صورة العديد من الديدان في تشغيل واحد ليتم تقييد الحيوانات لغرف بهم محددة. وهكذا، وهذه الطريقة يمكن تحجيمها بسهولة 9،27،34-36.
التطبيقات المستقبلية
حتى الآن، وقد استخدم هذا النظام أساسا لدراسة سلوك النوم في C. ايليجانس L1 اليرقات. ومع ذلك، فإن التكيف لجميع المراحل تجعل من الممكن لدراسة مجموعة واسعة من السلوكيات أيضا في dauers والكبار. وهناك مجموعة واسعة من السلوكيات يمكن دراستها مع هذه التقنية بدءا من التزاوج لوضع البيض.
Disclosures
تعلن الكتاب أنه ليس لديهم المصالح المالية المتنافسة.
Acknowledgements
مولت جمعية ماكس بلانك وراتب مدرسة غوتنغن العليا المجموعة جديد لHB هذا العمل.
Materials
| Name | Company | Catalog Number | Comments |
| High melting point agarose | Fisher Bioreagents | BP(E)164-1000 | |
| Top Vision low melting point agarose | Thermo Scientific | R0801 | |
| LED system | CoolLED | pE-2 | |
| Compound microscope | Nikon | TiE | |
| Stereomicroscope | Leica | M5 | |
| EMCCD camera | Andor | iXon 897 | now sold as iXon Ultra 897 |
| sCMOS camera | Andor | Neo | |
| Plasma cleaner | Harrick | PDC-23G2 | |
| Lid heater | MPI workshop | custom made | |
| Plastic dish | Falcon | 08-757-100A | |
| Z-stage for the microscope | Prior | Nano Scan Z | |
| X-Y stage for the microscope | Prior | Proscan III | |
| PDMS stamp | Abbott Laboratories | custom made | |
| Red light filter | Chroma | ET660/50m | |
| 35 mm Petri dish | Falcon | Falcon Disposable Petri Dishes, Sterile, Corning | |
| Double sided sticky tape | Sellotape/Henkel | double sided 25 mm x 33 m | alternatively advance double sided sticky tape from Rubance Adhesives can be used. |
References
- Brenner, S. The genetics of Caenorhabditis elegans. Genetics. 77, 71-94 (1974).
- Husson, S. J., Costa, W. S., Schmitt, C., Gottschalk, A. Keeping track of worm trackers. WormBook. , 1-17 (2012).
- Yemini, E., Jucikas, T., Grundy, L. J., Brown, A. E., Schafer, W. R. A database of Caenorhabditis elegans behavioral phenotypes. Nature Methods. 10, 877-879 (2013).
- Likitlersuang, J., Stephens, G., Palanski, K., Ryu, W. S. C. elegans tracking and behavioral measurement. Journal of Visualized Experiments : JoVE. , e4094 (2012).
- Yemini, E., Kerr, R. A., Schafer, W. R. Tracking movement behavior of multiple worms on food. Cold Spring Harbor Protocols. 2011, 1483-1487 (2011).
- Swierczek, N. A., Giles, A. C., Rankin, C. H., Kerr, R. A. High-throughput behavioral analysis in. C. elegans. Nature Methods. 8, 592-598 (2011).
- Ramot, D., Johnson, B. E., Berry, T. L., Carnell, L., Goodman, M. B. The Parallel Worm Tracker: a platform for measuring average speed and drug-induced paralysis in nematodes. PLoS One. 3, e2208 (2008).
- Larsch, J., Ventimiglia, D., Bargmann, C. I., Albrecht, D. R. High-throughput imaging of neuronal activity in Caenorhabditis elegans. Proceedings of the National Academy of Sciences U S A. 110, E4266-E4273 (2013).
- Bringmann, H. Agarose hydrogel microcompartments for imaging sleep- and wake-like behavior and nervous system development in Caenorhabditis elegans larvae. Journal of Neuroscience Methods. 201, 78-88 (2011).
- Yu, C. C., Raizen, D. M., Fang-Yen, C. Multi-well imaging of development and behavior in Caenorhabditis elegans. Journal of Neuroscience Methods. 223, 35-39 (2014).
- Luke, C. J., Niehaus, J. Z., O'Reilly, L. P., Watkins, S. C. Non-microfluidic methods for imaging live. C. elegans. Methods. 68, 542-547 (2014).
- San-Miguel, A., Lu, H. Microfluidics as a tool for C. elegans research. WormBook. , 1-19 (2013).
- Shi, W., Qin, J., Ye, N., Lin, B. Droplet-based microfluidic system for individual Caenorhabditis elegans assay. Lab Chip. 8, 1432-1435 (2008).
- Krajniak, J., Lu, H. Long-term high-resolution imaging and culture of C. elegans in chip-gel hybrid microfluidic device for developmental studies. Lab Chip. 10, 1862-1868 (2010).
- Chalfie, M., Tu, Y., Euskirchen, G., Ward, W. W., Prasher, D. C. Green fluorescent protein as a marker for gene expression. Science. 263, 802-805 (1994).
- Kerr, R., et al. Optical imaging of calcium transients in neurons and pharyngeal muscle of. C. elegans. Neuron. 26, 583-594 (2000).
- Suzuki, H., et al. In vivo imaging of C. elegans mechanosensory neurons demonstrates a specific role for the MEC-4 channel in the process of gentle touch sensation. Neuron. 39, 1005-1017 (2003).
- Hilliard, M. A., et al. In vivo imaging of C. elegans ASH neurons: cellular response and adaptation to chemical repellents. EMBO Journal. 24, 63-72 (2005).
- Frokjaer-Jensen, C., et al. Effects of voltage-gated calcium channel subunit genes on calcium influx in cultured C. elegans mechanosensory neurons. Journal of Neurobiology. 66, 1125-1139 (2006).
- Kerr, R. A. Imaging the activity of neurons and muscles. WormBook. , 1-13 (2006).
- Miyawaki, A., Griesbeck, O., Heim, R., Tsien, R. Y. Dynamic and quantitative Ca2+ measurements using improved cameleons. Proceedings of the National Academy of Sciences U S A. 96, 2135-2140 (1999).
- Nakai, J., Ohkura, M., Imoto, K. A high signal-to-noise Ca(2+) probe composed of a single green fluorescent protein. Nature Biotechnology. 19, 137-141 (2001).
- Akerboom, J., et al. Genetically encoded calcium indicators for multi-color neural activity imaging and combination with optogenetics. Frontiers in Molecular Neuroscience. 6 (2), (2013).
- Tian, L., et al. Imaging neural activity in worms, flies and mice with improved GCaMP calcium indicators. Nature Methods. 6, 875-881 (2009).
- Edwards, S. L., et al. A novel molecular solution for ultraviolet light detection in Caenorhabditis elegans. PLoS Biology. 6, e198 (2008).
- Ward, A., Liu, J., Feng, Z., Xu, X. Z. Light-sensitive neurons and channels mediate phototaxis in C. elegans. Nat Neurosci. 11, 916-922 (2008).
- Turek, M., Lewandrowski, I., Bringmann, H. An AP2 transcription factor is required for a sleep-active neuron to induce sleep-like quiescence in. C. elegans. Current Biology. 23, 2215-2223 (2013).
- Singh, K., et al. C. elegans Notch Signaling Regulates Adult Chemosensory Response and Larval Molting Quiescence. Current Biology. 21, 825-834 (2011).
- Raizen, D. M., et al. Lethargus is a Caenorhabditis elegans sleep-like state. Nature. 451, 569-572 (2008).
- Iwanir, S., et al. The microarchitecture of C. elegans behavior during lethargus: homeostatic bout dynamics, a typical body posture, and regulation by a central neuron. Sleep. 36, 385-395 (2013).
- Nagy, S., Raizen, D. M., Biron, D. Measurements of behavioral quiescence in Caenorhabditis elegans. Methods. , (2014).
- Nagy, S., et al. A longitudinal study of Caenorhabditis elegans larvae reveals a novel locomotion switch, regulated by Galphas signaling. eLife. 2, e00782 (2013).
- Cassada, R. C., Russell, R. L. The dauerlarva, a post-embryonic developmental variant of the nematode Caenorhabditis elegans. Developmental Biology. 46, 326-342 (1975).
- Schwarz, J., Lewandrowski, I., Bringmann, H. Reduced activity of a sensory neuron during a sleep-like state in Caenorhabditis elegans. Current Biology. 21, R983-R984 (2011).
- Schwarz, J., Spies, J. P., Bringmann, H. Reduced muscle contraction and a relaxed posture during sleep-like Lethargus. Worm. 1, 12-14 (2012).
- Schwarz, J., Bringmann, H. Reduced sleep-like quiescence in both hyperactive and hypoactive mutants of the Galphaq Gene egl-30 during lethargus in Caenorhabditis elegans. PLoS One. 8, e75853 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved