Method Article
الكالوري الضوئي التفاضلية - منهج في تقييم الثبات الحراري والتشكل من البروتين مستضد
In This Article
Summary
فرق المسح الكالوري يقيس درجة الحرارة الحرارية الانتقالية (ق) ومجموع الطاقة الحرارية اللازمة لتفسد البروتين. وتستخدم النتائج التي تم الحصول عليها لتقييم الاستقرار الحراري للمستضدات البروتين في تركيبات اللقاح.
Abstract
التفاضلي الكالوري المسح الضوئي (DSC) هو تقنية تحليلية الذي يقيس قدرة الحرارة المولية للعينات بوصفها وظيفة من درجة الحرارة. في حالة العينات البروتين، وتوفر لمحات DSC المعلومات حول الاستقرار الحراري، وإلى حد ما بمثابة "بصمة" الهيكلية التي يمكن استخدامها لتقييم التشكل الهيكلي. يتم تنفيذ ذلك باستخدام المسح المسعر التفاضلي الذي يقيس درجة حرارة التحول الحراري (درجة حرارة انصهار، تي م) والطاقة اللازمة لعرقلة التفاعلات استقرار الهيكل الثالث (المحتوى الحراري، ΔH) للبروتينات. يتم إجراء مقارنات بين الصيغ، فضلا عن الكثير الإنتاج، والاختلاف في القيم المستمدة تشير إلى الاختلافات في الاستقرار الحراري والتشكل الهيكلي. يتم توفير البيانات التي توضح استخدام DSC في بيئة صناعية للدراسات الاستقرار فضلا عن رصد خطوات التصنيع الرئيسية كدليل على فعالية هذا المواليةtocol. بالمقارنة مع الطرق الأخرى لتقييم الاستقرار الحراري للالتشكل البروتين، DSC فعالة من حيث التكلفة، ويتطلب بضع خطوات إعداد العينات، ويوفر أيضا لمحة الحرارية الكامل من العملية الجارية البروتين.
Introduction
فرق المسح الكالوري (DSC) هو المنهج التجريبي الذي يقيس مباشرة الفرق في امتصاص الطاقة الحرارية التي تجري في العينة بالنسبة إلى إشارة خلال تغيير منظم درجة الحرارة 1، 2، 3، 4، 5، 6، 7، 8، 9 ، 10، 11، 12. نفذت في المسعر التفاضلي المسح الضوئي، والطريقة تنطوي بإدخال الطاقة الحرارية في خلية العينة ومرجع الخلية في وقت واحد مع زيادة مماثل درجة حرارة كل من الخلايا على مر الزمن 2، 13،14. نظرا للاختلاف في تكوين عينة والإشارة، سوف تكون هناك حاجة كمية مختلفة من الطاقة لرفع درجة حرارة الخلايا 2 و 12 و 13. وبالتالي، يتم قياس كمية كبيرة من الطاقة اللازمة لتعويض الفرق في درجة الحرارة بين الخلايا وترتبط مباشرة إلى الخصائص الحرارية محددة من العينة 1 و 3.
في 1960s، وضعت وزارة العدل اونيل وهاء واتسون من بيركن إلمر أول المسعر المسح التفاضلي لقياس تدفق الحرارة من المواد الصلبة 2، 3، 4. في موازاة ذلك، PL Privalov وDR Monaseldze EL معهد الفيزياء، التي أنشئت جمهورية جورجيا (الاتحاد السوفياتي السابق) مسعر ثابت الحرارة التفاضلية فريدة من نوعها والتي يمكن استخدامها FOص بحوث الكيمياء الحيوية 5، 6. وفي وقت لاحق، وفريق Andronikashvili في معهد الفيزياء، جمهورية جورجيا، حسبما ذكرت والسعة الحرارية من الجزيئات الحيوية مثل البروتينات الليفية وكروية، الحمض النووي، والحمض النووي الريبي باستخدام DSC 7 و 8 و 9. عدة فرق من Sturtevant 10، 11، 12، 13 براندتس، وPrivalov 14، 15، 16 بقيادة ركزت على تطوير النظرية والتطبيقات العملية لDSC للتحقيق في تفاصيل الحرارية من البروتين تتكشف. كما تم الإبلاغ عن قيمة DSC في دراسة هياكل supramolecular كبيرة مثل فاجات، بلاستيدات الخضراء، البلورات السائلة فوسفورية، والبروتينات اللحوم 17 سوب>، 18، 19، 20.
أصبح DSC الآن شائعا في البحث والتطوير الصيدلانية لتقييم الثبات الحراري من الجزيئات الحيوية، وخاصة البروتينات 1 و 21 و 22. هذا يرجع في معظمه إلى التقدم من حيث الحساسية وأتمتة الأجهزة التي تستخدم في إجراء التجربة 23، 24 هذا. هنا، والنتيجة النهائية للتجربة DSC، وهي السعة الحرارية المولي بوصفها وظيفة من درجة الحرارة، ويستخدم لتقدير معلمات الحرارية التالية (التغيير في السعة الحرارية (ΔCp)، المحتوى الحراري (ΔH)، الكون (ΔS) وجيبس الطاقة الحرة (ΔG)) باستخدام المعادلة التالية:
eq1.jpg "/> (1)
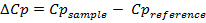 (2)
(2)
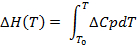 (3)
(3)
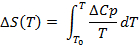 (4)
(4)
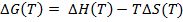 (5)
(5)
حيث يتم قياس قدرة حزب المحافظين الحرارة. ف هو تدفق الحرارة في مادة الاختبار؛ T 0 و T هي درجة حرارة الأولية والنهائية للمرحلة الانتقالية على التوالي 22 و 25. ومن الجدير بالذكر أيضا أن المعادلات أعلاه تنطبق على البروتينات مجال واحد التي يمكن أن تخضع لانتقال الدولتين وقابلة للانتكاس الحرارية التي تتكشف 22. تحليل المزيد من البروتينات المعقدة (البروتينات على سبيل المثال، غير الدولتين، والأوليغومرات) حافي أبلغت عنها Friere وآخرون. 26؛ جونسون وآخرون. 27؛ وKasimova وآخرون. 28.
لتحديد ما إذا كان البروتين يخضع انتقال الدولتين أو أشكال وسيطة أثناء تمسخ الحراري، والمحتوى الحراري المستمدة تجريبيا (ΔH، يشار إلى المحتوى الحراري كما المسعر ΔH كال أيضا) وبالمقارنة مع المحتوى الحراري المستمدة باستخدام معادلة فانت هوف الواردة أدناه (أيضا يشار إلى فانت هوف المحتوى الحراري، ΔH VH):
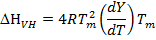 (6)
(6)
حيث T م هي درجة الحرارة منتصف الفترة الانتقالية، R هو الغاز ثابت المثالي (1.987 كال مول -1 K -1) و Y هو جزء من السكان البروتين في حالتها غير المطوية 16، 29. إذاΔH VH يساوي ΔH كال. أو ΔH VH / ΔH كال يساوي 1، ثم البروتين يخضع ل"كل شيء أو لا شيء" التحول (أي الانتقال الدولتين) 16، 25، 29. ومع ذلك، إذا ΔH VH أقل من ΔH كال. أو ΔH VH / ΔH كال هو أقل من 1، البروتين يخضع انتقال غير الدولتين 16، 25، 29. نسبة ΔH VH / ΔH كال تتطابق ايضا مع نسبة هيكل البروتين الذي يذوب كوحدة التعاونية الحرارية أو نطاق 26.
المعلمات الحرارية المذكورة أعلاه مثل ΔG وΔH توفر معلومات مفيدة عن الاستقرار الحراري من البروتينات، بما في ذلك البيولوجية 30. ومع ذلك، سيتم التشديد على تي م وΔH في هذا المنشور، لأنها هي القيم ذكرت لهذا البروتوكول. تي م هي درجة الحرارة منتصف الفترة الانتقالية، حيث مطوية ودول تكشفت من البروتين هي في التوازن (أي ΔG = 0) 25، 31. وارتفاع T م من البروتين، وارتفاع الاستقرار الحراري ل31. ΔH يتوافق مع المنطقة الواقعة تحت الذروة (ق) من السعة الحرارية مقابل الرسم البياني درجة الحرارة (المعروف أيضا باسم حراري) التي تم إنشاؤها في نهاية التجربة DSC 16 و 25. وهذه هي الطاقة اللازمة لتفسد البروتينات، ويمكن استخدامها لتقدير جزء النشط (F أ) في صيغة البروتين (أي نسبة من البروتينات مع التشكل نشط في عينة) باستخدام المعادلة التالية:
jove_content ">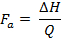 (7)
(7) حيث ΔH هو المحتوى الحراري المستمدة تجريبيا من العينة البروتين وس هو المحتوى الحراري المقررة للإشارة جيدا اتسم أو البروتين موحد 22. تقدير F ومهم لرصد الاستقرار في الوقت الحقيقي من المنتجات، وكذلك إجراء دراسات الاستقرار تحت ظروف الإجهاد كما هو مطلوب من قبل الإرشادات التراث الثقافي غير المادي (32). يوفر مقارنة ΔH أيضا معلومات عن الاكتناز من التشكل بنية التعليم العالي من البروتين 31.
تفاصيل هذا البروتوكول إجراء لتقييم الاستقرار الحراري من البروتينات في بيئة صناعية، واستخدمت على نطاق واسع لصياغة اللقاحات. تم تطويره باستخدام التفاضلية المسح المسعر الآلي الذي يولد نتائج استنساخه وأو تركيزات البروتين منخفضة تصل إلى 300 ميكروغرام / مل.
Protocol
1. صك البدء
- التبديل على الفرق المسح المسعر وزيادة الضغط في الخلايا لقمع غليان العينات وكذلك منع تكون فقاعات في درجات حرارة مرتفعة. ويتحقق ذلك عادة من خلال توفير النيتروجين في النظام.
- اعتمادا على المواد المنشئة للخلية (على سبيل المثال، التنتالوم، الذهب، البلاتين، الخ)، وضبط ضغط من إمدادات غاز النيتروجين وفقا لضغط الموصى بها من المصنع لتجنب إتلاف الخلايا. على سبيل المثال، تعيين الضغط من إمدادات غاز النيتروجين إلى 45 رطل لالأداة المستخدمة لتطوير هذا الإجراء، والضغط فوق 80 رطل قد يؤدي إلى تلف الخلايا.
- تأكد من أن تمتلئ جميع الخزانات تنظيف وكيل لحجم المطلوب. تشمل مواد التنظيف المطلوبة المنظفات والماء لغسل وتنظيف الخلية على التوالي بعد تشغيل كل عينة.
- ضبط درجة حرارة المقصورة عينة عقدإلى قيمة مناسبة، ويفضل 5 درجات مئوية، للحفاظ على سلامة العينة السابقة لهذه التجربة.
إعداد 2. عينة
- Dialyze العينة ضد المنطقة العازلة التي سيتم استخدامها كمرجع للتجربة. بدلا من ذلك، شطف العازلة التي تم جمعها في الخطوة الأخيرة من تنقية البروتين (أي العمود شطف) يمكن استخدامها.
- تحديد تركيز العينة البروتين باستخدام تركيز البروتين طريقة تحديد أنسب مثل طريقة Kjedahl 33 أو طريقة لوري 34. وعلى سبيل المقارنة الموضوعية من النتائج، استخدم نفس الأسلوب باستمرار في نفس الدراسة. قد تختلف نطاق التركيز المطلوب اعتمادا على نموذج من الصك. لالأداة المستخدمة في هذا البروتوكول، ومجموعة العمل الأفضل هو 0،5-1 ملغ / مل.
- ديغا المخزن المؤقت عينة والمرجعية في الفراغ للتخلص من microbubbles التي يمكن أن تسبب حجم inaccurACY. هذه الخطوة يمكن تخطي لنماذج المسعر أحدث.
- باستخدام micropipette ونصائح العقيمة في مجلس الوزراء الاحتواء البيولوجي تدفق الصفحي، تحميل العينات وعازلة كل منهما في أزواج في 96 لوحات جيدة متوافقة مع الصك. ملء أزواج الأولين من الآبار مع العازلة وأزواج الماضيين مع الماء لالعازلة العازلة والفحص المياه على التوالي. مسح عازلة عازلة تحقق من مدى ملاءمة الصك قبل أخذ عينات قياس (أي تقييم خطأ القياس)، وكذلك إنشاء خط الأساس. في حين يتم تشغيل بمسح المياه لتنظيف الخلايا.
- تغطية لوحة 96-جيدا مع فيلم الختم، والتأكد من أن الآبار مغلقة بشكل صحيح قبل اتخاذ وحة من سلامة الأحيائية مجلس الوزراء لتجنب تلوث العينة.
- وضع لوحة في مقصورة عينة عقد في الاتجاه الصحيح.
الإعداد 3. التجريبية معلمة
ملاحظة: اعتمادا على طnstrumentation، والعينات ويمكن تحميلها في الخلية إما يدويا باستخدام حقنة، أو تلقائيا باستخدام الاوتوماتيكى. في هذه الحالة (أي بيئة صناعية)، يتم استخدام الاوتوماتيكى لتوفير الوقت.
- باستخدام برنامج الاستحواذ، أدخل المعلومات عينة بالترتيب تم تحميل لوحة حسب القسم 2.4. أدخل تركيزات إن وجدت، وإلا، إدخال قيم تركيز في برامج التحليل قبل تحليل البيانات (القسم 4.2).
- حدد الخيار الذي يضمن تنظيف الخلايا مع المنظفات قبل كل فحص العينة، والتي ينبغي أن تتبعها عدة خطوات شطف المياه لضمان عدم وجود بقايا المنظفات ويترك في الخلايا.
- ضبط درجة الحرارة بدءا من التجربة إلى 20 درجة مئوية، ولكن هذا يمكن أن تختلف تبعا معرفة مسبقة من العينة. للبروتينات معروفة، محددة مسبقا في درجة الحرارة انطلاق يمكن استخدامها، في حين أن انخفاض درجة الحرارة انطلاق يمكن تطبيقها على عينات غير معروفة.
- ضبط درجة الحرارة النهائيةمن التجربة، على سبيل المثال 100 درجة مئوية. قد تختلف درجة الحرارة النهائية اعتمادا على معرفة مسبقة من العينة.
- تعيين معدل المسح التجربة، على سبيل المثال 60 ° C / ساعة، وهو معدل المسح نموذجي. ومع ذلك، معدل المسح قد تختلف تبعا لمعرفة مسبقة من العينة، على سبيل المثال 90 ° C / ساعة أو 120 درجة مئوية / ساعة. فإنه من المستحسن لفحص عينات غير معروفة بأسعار مسح مختلفة لتقييم حركية تتكشف.
- عينات إعادة تفحص للتحقيق في العودة إلى الوراء لالحرارية التي تتكشف. تتكشف من البروتين يعتبر عكسها إذا كان المحتوى الحراري التي تم الحصول عليها الفحص الثاني هو لا يقل عن 80٪ من قيمة المحتوى الحراري للمسح الأول.
- ضبط ترموستات بعد التجربة إلى 10 درجة مئوية للحفاظ على سلامة خلايا المسعر و.
- تحقق من أن معلمات الإعداد التجربة صحيحة قبل تنفيذ التجربة. إذا كان كل شيء في المكان، بدء التجربة.
4. البياناتalysis
- استرداد البيانات الخام من التجربة واختيار عينة واحدة في وقت لتحليلها. مسح طرح المرجعية، أي العازلة، من الفحص عينة.
ويتم المرجعي الطرح خارج تلقائيا من قبل النماذج الجديدة من الأدوات DSC: ملاحظة. - أدخل قيمة تركيز العينة إذا تم حذفها كما في القسم 3.1.
- تناسب وطرح الخط الرئيسي من المشروع حراري المكتسبة لمراعاة الفروق في القدرات حرارة الدول مطوية وتكشفت من البروتين الذي ينجم عن التعرض للجماعات الكارهة للماء إلى ماء على تتكشف. الخطي أو مكعب المناسب منحنى يمكن تطبيقها تبعا لشكل الشخصية DSC للعينة. من أجل التناسق، ونفس النوع من المناسب أن يتم استخدامها أثناء الدراسة، على سبيل المثال دراسة الاستقرار في الوقت الحقيقي. هذه الخطوة مطلوبة لمعالجة منحنى لذروة التكامل للحصول على المحتوى الحراري الانتقالية.
- أداء التكامل ذروة استخدام غير الخطية لائقا الأقل مربع. على أساس المنتجالمعرفة تنطبق الدولتين أو نموذج غير الدولتين. نموذج الدولتين يمكن أن تستخدم لالتحولات تعاونية واحدة الحرارية، والبروتينات غير معروفة، وتطبيق نموذج غير الدولتين حتى لا مزيد من المعرفة بالمنتجات المتاحة. إذا كان ذلك ممكنا، وضبط منحنى المناسب باستخدام منحنى وظيفة مناسبة متكررة من البرمجيات المعدات حتى تظل قيمة مربع كاي ثابتة.
- وسوف تظهر النتائج التي تم الحصول عليها قيم منتصف درجات الحرارة الانتقالية (تيم)، المحتوى الحراري المسعر (ΔH)، وفانت هوف المحتوى الحراري (ΔH VH) من العينة.
النتائج
وتعرض البيانات الخام من معظم التجارب DSC كما تدفق الحرارة مقابل الرسم البياني درجة الحرارة، كما المسعر يقيس فعلا الفرق في معدل تدفق الحرارة في حل عينة والعازلة 35. لذلك، إذا كان كل من الخلايا (أي عينة والمرجعية الخلايا) تحتوي على حلول مماثلة خلال التجربة، يجب أن تكون البيانات الخام من الفحص خط ثابت مع عدم وجود قمم ملاحظتها. أي الذروة لاحظ يمكن أن يعزى إلى خطأ الأجهزة (مثل التالفة أو الملوثة خلايا)، وهذا هو السبب تشغيل المسح العازلة قبل عينة التحليل هو اختبار الكافي نظام ملاءمة. ويوضح الشكل (1) ونتيجة لمسح عازلة نموذجية مشيرا إلى أن المسعر كان في حالة عمل جيدة قبل عينة التحليل.
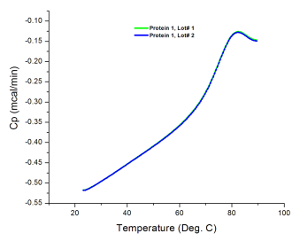
ويبين الشكل 2 حملت البيانات الخام لتجربة DSC خارجا على فرقالكثير erent من عينتين من البروتين. وكما يتضح في وقت سابق، والقمم التي تمت ملاحظتها الاختلافات في تدفق الحرارة من العينات والمخازن الخاصة بكل منها. الاختلافات في تركيز العينة يمكن أن يسبب تغيرات في قدرة الحرارة التي سجلتها المسعر. ومع ذلك، فإن هذه الاختلافات هي طبيعية خلال تحليل عينة حسب القسم 4.2 من هذا الإجراء. يمكن أن تركيزات أعلى تكشف أيضا عن المجالات الحرارية الإضافية لا تسهم في الانتقال بتركيزات أقل. وبالإضافة إلى ذلك، يمثل كل انتقال مجال الحرارية التي قد تشمل واحدة أو أكثر من المجالات الهيكلية للبروتين 36. في هذه الحالة، والبروتين 1 على ثلاثة مجالات الهيكلية التي تذوب بشكل تعاوني.
ويبين الشكل 3 النتائج التي تم إنشاؤها من تحليل البيانات الخام للبروتين 1 و 2 المعروضة في الشكل 2، أي بعد الطرح خط الأساس وتكرارية فاي منحنىtting. وقد تم تعديل هذا thermograms مما أدى لمعدل المسح الضوئي (التي تقوم تلقائيا من قبل خوارزمية محددة مسبقا في برامج التحليل) والتركيز؛ وبالتالي، وعرض نتائج التجربة في السعة الحرارية مقارنة مقابل الرسوم البيانية درجة الحرارة. يستخدم برمجيات تحليل البيانات من السعة الحرارية مقابل الرسوم البيانية درجة الحرارة، مثل تي م وΔCp، لاستخلاص نتائج القياسات الأخرى باستخدام أشكال مختلفة من المعادلات المذكورة أعلاه بناء على cooperativity من البروتين تتكشف.
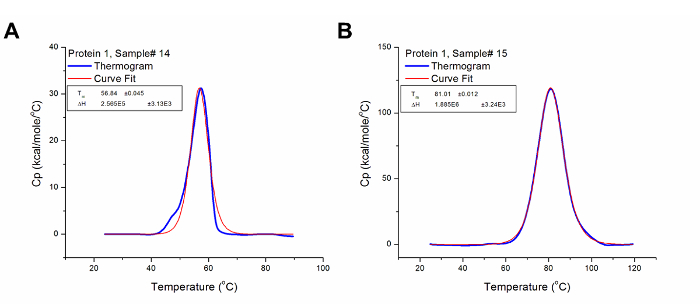
عند اختبار عينات غير معروفة، وتحديد مدى درجة الحرارة المناسبة أمر بالغ الأهمية. خلاف ذلك، قد thermograms ناقصة تؤدي، كما هو موضح في الشكل (4). على الرغم من أن تي متر من هذه الملامح يمكن اشتقاق، ΔH لا يمكن تحديده بدقة. لذلك، لا بد من إعادة اختبار العينة مع درجة حرارة تتراوح أكبر لالتقاط تماما الانتقال الحراري. بعض البروتينات أيضا إعادةالمجاميع شكل adily بعد تمسخ كاملة، مما أدى إلى زيادة القدرة الحرارة ما بعد المرحلة الانتقالية: هذا غالبا ما يظهر على أنه حراري ناقصة كما هو موضح في الشكل 2B. ومع ذلك، إعادة الاختبار مع ارتفاع درجة الحرارة النهائية يمكن أن تساعد في تأكيد ما إذا كان هناك حدوث انتقال بتكوين في تلك المنطقة من حراري أو هو مجرد تأثير الحرارة استيعاب المجاميع البروتين.
الاستقرار الحراري هي واحدة من الخصائص الفيزيائية أهم من البروتينات والمنتجات القائمة على البروتين في صناعة 37. في المستحضرات الصيدلانية، ويتم استخدامه لتحديد استقرار البيولوجية في ظل ظروف مختلفة، بما في ذلك مخازن صياغة والعوامل البيئية مثل الرطوبة ودرجة الحرارة. كما انها تستخدم لمراقبة رئيسية التصنيع خطوة (على سبيل المثال، وتنقية وإزالة السموم) لضمان الاتساق بتكوين بين الكثير الإنتاج. > أرقام 5 و 6 توضيح استخدام DSC لدراسة الآثار المترتبة على إزالة السموم وظروف التخزين الكيميائية على التوالي على الاستقرار والتشكل الهيكلي لاثنين من البروتينات المختلفة. الفوارق الكبيرة في تيم وΔH تشير التغيرات متعلق بتكوين وتدهور البروتين على التوالي. وبالإضافة إلى ذلك، فقدان التحول الثالث في الشكل 6 يوضح مزيد من التدهور في مجال وهو ما أكده انخفاض في الوزن الجزيئي عندما تم تحليل العينات باستخدام الحجم الاستبعاد اللوني مع متعددة زاوية تشتت الضوء (SEC-ملس) ( البيانات غير ظاهرة).
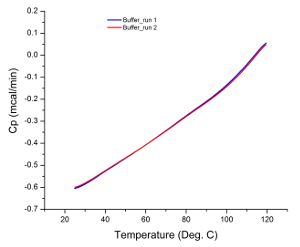
الشكل 1: المخزن المؤقت المسح. التشابه في التدرج من كل فحص مع عدم وجود قمم ملاحظتها إلى أن الصك هو في حالة عمل جيدة وتحقيق نتائج قابلة للتكرار.//ecsource.jove.com/files/ftp_upload/55262/55262fig1large.jpg "الهدف =" _ فارغة "> الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
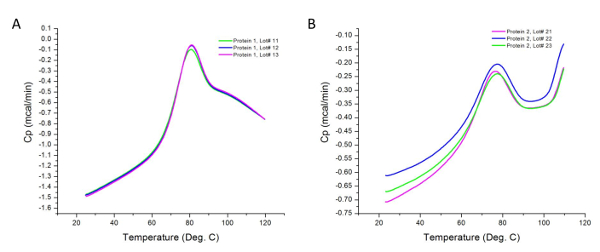
الشكل 2: البيانات الخام التي تم جمعها من التجارب DSC. هذه الرسوم البيانية هي تمثيلات جيدة من البيانات unanalyzed (الخام) المكتسبة بعد التشغيل التجريبي (أي قبل الطرح الأساسي ومنحنى المناسب). كل سطر يمثل الكثير الإنتاج. بروتين 2 يميل إلى تجميع بسهولة أكبر عند التسخين، مما أدى إلى زيادة في السعة الحرارية أعلى من 100 درجة مئوية في منطقة ما بعد المرحلة الانتقالية للحراري. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
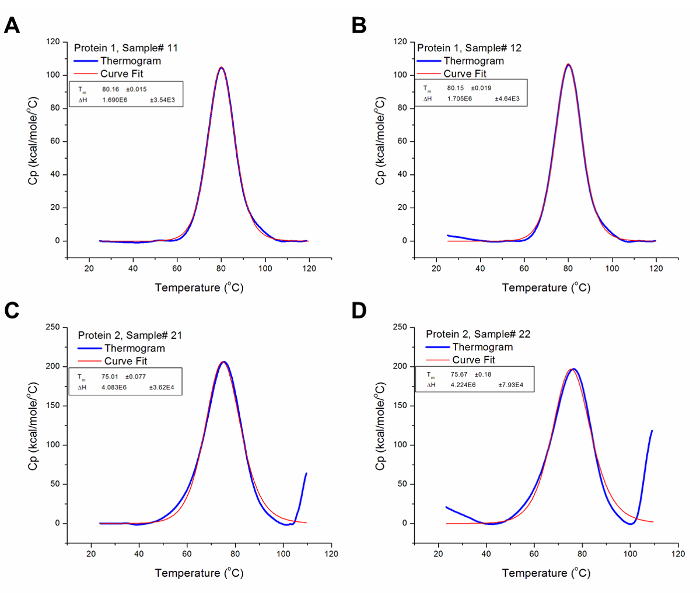
الشكل (3): حلل DSC البيانات. هذه الرسوم البيانية هي تمثيلات جيدة من البيانات DSC تحليلها (أي بعد الطرح الأساسي ومنحنى المناسب). يمثل الخط الأزرق حراري بعد الطرح الأساس، بينما يمثل الخط الأحمر منحنى مع الأنسب لحراري. (أ) T م وΔH للبروتين 1 نموذج رقم 12 هم 80.16 درجة مئوية و 1.69 × 10 6 كال / مول على التوالي. (ب) T م وΔH للبروتين 1 نموذج رقم 13 هم 80.15 درجة مئوية و 1.71 × 10 6 كال / مول على التوالي. (ج) T م وΔH للبروتين 2 نموذج رقم 21 هم 75.01 درجة مئوية و 4.08 × 10 6 كال / مول على التوالي. (D) تي م وΔH للبروتين 2 نموذج رقم 22 هم 75.67 درجة مئوية و 4.22 × 10 6 كال / مول على التوالي. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
الشكل (4): وثيرموغرام غير كاملة. جمع بيانات أولية للبروتين 1 تحليل في نطاق درجة حرارة كافية. تم ضبط درجة الحرارة النهائية من التجربة إلى 90 درجة مئوية والتي لم تستوعب الشخصية الانتقال برمتها من البروتين بالمقارنة مع التجربة عن الشكل 2A الذي كان من المقرر أن 120 درجة مئوية. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
الرقم 5: حلل البيانات التي توضح تأثير السموم الكيميائية على الهيكل العالي من البروتين 1. (أ) البروتين 1 هو السم في التشكل الأصلي الخاص به وهاق في تي م بسعر 56.84 درجة مئوية وΔH في 2.57 × 10 5 كال / مول. (ب) شكل سميته البروتين 1 (أي توكسيد) له T م وقيم ΔH من 81.01 درجة مئوية و 1.89 × 10 6 كال / مول على التوالي. وبالتالي، فإنه يمكن استنتاج أن الخطوة إزالة السموم أدخلت نوعا من الاختلاف في التشكل الهيكلي من البروتين (1) الذي يضفي مزيدا من الاستقرار (أعلى T م) إلى شكله سميته. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
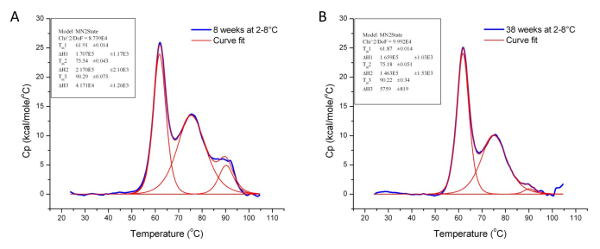
الشكل 6: حلل البيانات التي توضح تأثير ظروف التخزين على التشكل من البروتين 3. هذه الرسوم البيانية توضح تأثير درجة حرارة التخزين (2-8 درجة مئوية) على استقرار وبنية التعليم العالي من بروالبروتين 3 أكثر من 30 أسابيع. وبالنظر إلى T م وقيم ΔH للبروتين 3 في ال 8 (A) والأسبوع ال 38 (ب) من التخزين في الجدول 1 أدناه. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
| عينة | تيم 1 (درجة مئوية) | ΔH 1 (كالوري / مول) | تيم 2 (درجة مئوية) | ΔH 2 (كالوري / مول) | تيم 3 (درجة مئوية) | ΔH 3 (كالوري / مول) |
| البروتين 3 تخزينها في 2-8 درجة مئوية لمدة 8 أسابيع | 61.91 | 1.71 × 10 5 | 75.54 | 2.17 × 10 5 | 90.29 | 4.17 × 10 5 |
| 61.87 | 1.66 × 10 5 | 75.18 | 1.46 × 10 5 | 90.22 | 5.76 × 10 5 |
الجدول 1: تيم وΔH قيم البروتين 3 في الأسبوع ال 8 و 38 تشرين التخزين في 2-8 درجة مئوية. على الرغم من أن القيم م T في كل نقطة زمنية متشابهة، والفرق في قيم ΔH يشير إلى أن هيكل التعليم العالي من البروتين 3 قد تدهورت أكثر من 30 أسابيع تحت ظروف التخزين المحددة.
Discussion
وقد أدرج هذا الإجراء بنجاح في مختلف حزم اختبار التوصيف، بما في ذلك الاستقرار والقابلية للمقارنة المنتج الدراسات 21. في الدراسات الاستقرار في الوقت الحقيقي، ويستخدم DSC لمراقبة تي م، وكذلك تقدير F لمن البيولوجية مع مرور الوقت لتحديد صلاحيتها. وفيما يتعلق المقارنة المنتج، ويتم استخدامها لتقييم تأثير عملية التغيير ومرافق وغيرها من أثر خطوات التصنيع الرئيسية في التشكل الهيكلي الكثير المنتجة. هذا عادة ما ينطوي على المقارنة المباشرة للΔH من الكثير المنتجة للمنتج المرجعية التي حددت على أنها المنتج المثالي. وبالإضافة إلى ذلك، وقد ثبت DSC ليكون أداة تحليلية مفيدة للدراسات تركيبة المنتج 37. تي م من البروتين في مخازن مختلفة، وبتركيزات مختلفة يمكن استخدامها لتحديد الصيغة التي proffers أكثر استقرار لالبروتين.
لضمان موثوقية هذه الطريقة وموضوعية نتائجها، فمن المهم للحفاظ على المعلمات اختبار متسقة من التشغيل لتشغيل داخل نفس الدراسة (على سبيل المثال، لقاح دراسة صياغة). ومع ذلك، فإن الإجراء يمكن تعديلها لاستيعاب الاختلافات في الخصائص الفيزيائية للبروتينات مختلفة. مثال على التعديل الذي يمكن أن يتم ويغير معدل المسح التجربة 38، 39. البروتينات التي كانت عرضة للمجاميع تشكيل عند تسخينها تم فحص بمعدل مسح أسرع (على سبيل المثال، 120 ° C / ساعة) لتجنب مساهمة المجاميع إلى الوضع الانتقال الحراري وكذلك انسداد الشعيرات الدموية في المسعر. ومن الجدير بالذكر أن معدل المسح يمكن أن تؤثر على نتائج تجربة DSC 38. وقد لوحظ توسيع ذروة التحول الحرارية مع زيادة معدلات المسح في بعض المؤيدينالبروتينات. ومع ذلك، ظلت T م ثابتا إلى حد ما 38. وعلاوة على ذلك، وغسيل الكلى والتفريغ خطوات لإعداد عينة هي أيضا حاسمة جدا للحصول على نتائج دقيقة 31. غسيل الكلى يضمن أن الفرق الوحيد في توزيع العينة والمخزن المؤقت هو البروتين. وبالتالي، كل الحرارة الزائدة التي تمتصها عينة يمكن أن يعزى إلى السعة الحرارية من البروتين. التفريغ يضمن تحليل حجم الدقيق، واستقراء المعلمة الحرارية يفترض أن الحدث تتكشف يحدث تحت حجم وضغط 31 ثابت. يتم احتساب الجزء الضغط المستمر من افتراض عليها الضغط من النيتروجين النظام كما في القسم 1.1 من هذا الإجراء.
بالمقارنة مع غيرها من أساليب تحديد استقرار التشكل البروتين مثل التعميم ازدواج اللون (CD) والإسفار مطيافية، DSC يوفر عددا من المزايا في كوموضع mercial بما في ذلك وفورات في التكاليف والوقت. أولا، تصميم ثابت الحرارة من المسعر التفاضلي المسح يسمح لقياس الاستقرار الحراري مع أفضل درجة حرارة الدقة مقارنة القياسات مع الأجهزة لمؤتمر نزع السلاح والإسفار مطيافية 6. ثانيا، على عكس CD، دقة البيانات DSC لا تعتمد على helicity من البروتين 39، 40؛ ومع ذلك، يوفر CD حصول على معلومات إضافية حول تتكشف للهيكل الثانوي، والتي ستكون مكملة لDSC 41. بالإضافة إلى ذلك، الضغط على نظام DSC يسمح للاختبار مع مجموعة واسعة درجة الحرارة دون درجة الغليان العينة. وبالتالي، مجموعة واسعة من البروتينات يمكن اختبارها من قبل DSC.
في حين DSC هو نهج سريع نسبيا واضحة لتحديد الاستقرار الحراري للالبيولوجية، فإنه ليس من دون قيود. الأولى، قاعدةخطوة خط الطرح يقدم نوعا من التناقض البشري في تحليل البيانات الخام. وبالتالي، والاختلافات في النتائج يمكن ملاحظة بين مختلف المستخدمين. ثانيا، التفاضلية سعرات حرارية المسح الضوئي لها حدود تركيز الدنيا التي قد يكون من الصعب تحقيق على نطاق واسع التصنيع بكميات كبيرة. الثالث، ΔH من تمسخ الحرارية لا رجعة فيه ليست مطلقة. مما يعني أن ΔG المشتقة (مؤشرا على استقرار البروتين) في سيناريوهات مماثلة يمكن أن تكون مضللة. وعلاوة على ذلك، فإن الأسلوب يعمل بشكل أفضل لعينات النقاء. جود شوائب إما أن يسبب تحولا في تي م إذا كان هناك تفاعل مع البروتين قيد التحقيق، أو ظهور التحولات الحرارية الجديدة إذا لم يكن هناك تفاعل. في أي حال هذه ميزات اضافية على thermograms يمكن أن يعزى بشكل خاطئ العينات، وبالتالي تؤثر على تفسير النتائج. وعلى الرغم من هذه القيود، لا يزال DSC طريقة موثوق بها يمكن أن توفر معلومات تفصيلية حول الحرارية عشرالبروتين ه العملية الجارية إذا نفذت بشكل صحيح 42.
في الختام، DSC تقدم ميزة كبيرة كأداة قراءات بتكوين لمنتجات لقاح وسيطة لها. المعلمتين، T م وΔH، التي تم جمعها لمجموعة من الكثير من نفس المنتج يمكن أن تصبح الأساس التجريبية التي يمكن استخدامها لدراسة تأثير التغيرات العملية، وصياغة، وظروف التخزين على بنية التعليم العالي والاستقرار من البروتين و المضادات الفيروسية 21، 43.
Disclosures
كل الكتاب والعاملين في شركة سانوفي باستور. وقد تم تمويل هذا العمل من قبل شركة سانوفي باستور، ودفعت رسوم النشر لهذا الفيديو المقال من قبل شركة سانوفي باستور. الكتاب ليس لديهم انتماءات ذات الصلة أو المشاركة المالية مع أي منظمة أو كيان له النزاع المالي مع الموضوع أو المواد التي نوقشت في المخطوطة. وتشمل هذه العمالة، والاستشارات، وملكية الأسهم أو الخيارات، أو الإتاوات.
تم استخدام أي مساعدة الكتابة في إنتاج هذه المخطوطة.
Acknowledgements
الكتاب ممتنون جدا ليوسف مانشيني (سابقا مع شركة جنرال الكتريك للرعاية الصحية)، باول Czudec، توماس قفص (مالفيرن صكوك المحدودة) لدورهم في التركيب والتدريب على المسعر التفاضلي المسح، Sasmit ديشموخ وبستر Magcalas لمناقشاتهم.
Materials
| Name | Company | Catalog Number | Comments |
| Differential Scanning Calorimeter | Malvern Instruments Ltd | 28428948 (Via GE Healthcare) | Has an autosampler for automated dispensing of samples into the cell to reduce human effort and errors. |
| Contrad 100 | Decon Laboratories Inc | 1504 | Dilute with water to 20% before use |
| 500 µL Polypropylene round bottom 96 well plate | Canadian Life Science | ML072100 | Equivalent plates from other suppliers (e.g., VW) can also be used |
| MicroCal ThermoVac | Malvern Instruments Ltd | N/Ap | provided with the Cap VP DSC |
| Biosafety cabinet | Labconco | Logic+ - A2 | biocontainment laminar flow cabinet for sample preparation |
| Slide-A-Lyzer dialysis cassette | Thermo Scientific | 66810 or 66380 | to equilibrate the sample and buffer |
References
- Gill, P., Moghadam, T. T., Ranjbar, B. Differential scanning calorimetry techniques: applications in biology and nanoscience. J. Biomol. Tech. 21 (4), 167-193 (2010).
- Watson, E. S., O'Neil, M. J. Differential microcalorimeter. Patent. , (1966).
- O'Neill, M. J. The Analysis of a Temperature-Controlled Scanning Calorimeter. Anal. Chem. 36 (7), 1238-1245 (1964).
- O'Neil, M. J. Measurement of Specific Heat Functions by Differential Scanning Calorimetry. Anal. Chem. 38 (10), 1331-1336 (1966).
- Privalov, P. L., Monaselidze, D. R. . Mol. Biol. 6, 7-33 (1975).
- Privalov, P. L., Plotnikov, V. V. Adiabatic differential microcalorimeter. Адиабатический дифференциальный микрокалориметр. , (1970).
- Andronikashvili, E. L., et al. Calorimetric study of the nature of the intramolecular fusion of collagen, isolated from transplantable tumor. Dokl. Akad. Nauk. 183 (1), 212-214 (1968).
- Andronikashvili, E. L., et al. . Conformational Changes of Biopolymers in Solution. , 171-173 (1973).
- Andronikashvili, E. L. Malignant transformation and changes in various physic-chemical properties of macromolecules and supramolecular structures. Biofizika. 32 (5), 782-799 (1987).
- Velicelebi, G., Sturtevant, J. M. Thermodynamics of the denaturation of lysozyme in alcohol-water mixtures. Biochemistry. 18 (7), 1180-1186 (1979).
- Sturtevant, J. M. Heat capacity and entropy changes in processes involving proteins. Proc. Natl. Acad. Sci. 74 (6), 2236-2240 (1977).
- Sturtevant, J. M. Biochemical applications of differential scanning calorimetry. Annu. Rev. of Phys. Chem. 38, 463-488 (1987).
- Jackson, W. M., Brandts, J. F. Thermodynamics of protein denaturation. A calorimetric study of the reversible denaturation of chymotrypsinogen and conclusions regarding the accuracy of the two-state approximation. Biochem. 9 (11), 2294-2301 (1970).
- Privalov, P. L., Khechinashvili, N. N., Atanasov, B. P. Thermodynamic analysis of thermal transitions in globular proteins. I. Calorimetric study of chymotrypsinogen, ribonuclease and myoglobin. Biopolymers. 10 (10), 1865-1890 (1971).
- Privalov, P. L., Khechinashvili, N. N. A thermodynamic approach to the problem of stabilization of globular protein structure: a calorimetric study. J. Mol. Biol. 86 (3), 665-684 (1974).
- Privalov, P. L., Potekhin, S. A. Scanning microcalorimetry in studying temperature-induced changes in proteins. Methods Enzymol. 131, 4-51 (1986).
- Veprintseva, O. D., Emelyanenko, V. I., Konstantinova, V. V., Shnyrov, V. L. The importance of structural changes in bacteriophage T4 tail proteins. Biofizika. 33, 954-961 (1988).
- Shutilova, N., Semenova, G., Klimov, V., Shnyrov, V. Temperature-induced functional and structural transformations of the photosystem II oxygen-evolving complex in spinach subchloroplast preparations. Biochem. Mol. Biol. Int. 35 (6), 1233-1243 (1995).
- Sanina, N. M., Kostetsky, E. Y. a., Shnyrov, V. L. Calorimetric investigation of phosphatidyl choline from membranes of marine invertebrates. J. Evol. Biokhim. Physiol. 23, 451-460 (1987).
- Oreshkin, E. F., et al. Conformational changes in the muscle proteins of cured beef during heating. Meat Science. 16 (4), 297-305 (1986).
- Kirkitadze, M., Hu, J., Tang, M., Carpick, B. Qualification of a differential scanning calorimetry method for biophysical characterization of monoclonal antibodies and protein vaccine antigens. Pharm. Bioprocess. 2 (6), 491-498 (2014).
- Jiskoot, W., Daan, C. . Methods for structural analysis of protein pharmaceuticals. 3, (2005).
- Plotnikov, V. V., Brandts, M., Lin, L. N., Brandts, J. F. A new ultrasensitive scanning calorimeter. Anal. Biochem. 250 (2), 237-244 (1997).
- Plotnikov, V. V., et al. An autosampling differential scanning calorimeter instrument for studying molecular interactions. Assay Drug Dev. Technol. 1 (1), 83-90 (2002).
- Freire, E. Differential scanning calorimetry. Protein Stability and Folding: Theory and Practice. Method in Molecular Biology. 40, 191-218 (1995).
- Freire, E., van Osdol, W. W., Mayorga, O. L., Sanchez-Ruiz, J. M. Calorimetrically determined dynamics of complex unfolding transitions in proteins. Annu. Rev. Biophys. Biophys. Chem. 19, 159-188 (1990).
- Johnson, C. R., Morin, P. E., Arrowsmith, C. H., Freire, E. Thermodynamic analysis of the structural stability of the tetrameric oligomerization domain of p53 tumor suppressor. Biochemistry. 34 (16), 5309-5316 (1995).
- Kasimova, M. R., Sam, J. M., Freire, E. The conformational equilibrium of human growth hormone. J. Mol. Biol. 277 (2), 409-418 (1998).
- Saboury, A. A., Moosavi-Movahedi, A. A. Clarification of calorimetric and van't hoff enthalpies for evaluation of protein transition states. Biochem Edu. 22 (4), 210-211 (1994).
- Privalov, P. L. Microcalorimetry of proteins and their complexes. Protein Structure, Stability, and Interactions. Method in Molecular Biology. 490, 1-39 (2009).
- Dehghan-Nayeri, N., Rezaei-Tavirani, M. The Interpretation of Protein Structure Through Relationship of Melting Point (Tm) and Enthalpy of Unfolding (ΔHU). Int J Anal Pharma Biomed Sci. 4 (1), 47-50 (2015).
- . Stability testing of new drug substances and products. Guideline, ICH Harmonised Tripartite. 1 (2), (2003).
- Kjeldahl, J. Neue Methode zur Bestimmung des Stickstoffs in organischen Körpern (New method for the determination of nitrogen in organic substances). Zeitschrift für analytische Chemie. 22 (1), 366-383 (1883).
- Lowry, O. H., Rosebrough, N. J., Farr, A. L., Randall, R. J. Protein measurement with the Folin phenol reagent. J. Biol. Chem. 193 (1), 265-275 (1951).
- HÖhne, G., Hemminger, W., Flammersheim, H. J. . Differential Scanning Calorimetry. , (2003).
- Porter, L. L., George, D. R. A thermodynamic definition of protein domains. Proc. Natl. Acad. Sci. USA. 109 (24), 9420-9425 (2012).
- Frokjaer, S., Daniel, E. O. Protein drug stability: a formulation challenge. Nature Reviews Drug Discovery. 4, 298-306 (2005).
- Johnson, C. M. Differential scanning calorimetry as a tool for protein folding and stability. Arch. Biochem. Biophys. 531, 100-109 (2013).
- Chiu, M. H., Elmar, J. P. Differential scanning calorimetry: an invaluable tool for a detailed thermodynamic characterization of macromolecules and their interactions. J. Pharm. Bioallied Sci. 3 (1), 39-59 (2011).
- Hirst, J. D., Charles, L. B. Helicity, circular dichroism and molecular dynamics of proteins. J. Mol. Biol. 243 (2), 173-178 (1994).
- Kirkitadze, M. D., et al. Central modules of the vaccinia virus complement control protein are not in extensive contact. Biochem. J. 344 (1), 167-175 (1999).
- Freire, E., SchÖn, A., Hutchins, B. M., Brown, R. K. Chemical denaturation as a tool in the formulation optimization of biologics. Drug disc today. 18 (19), 1007-1013 (2013).
- Wen, J., et al. Applications of differential scanning calorimetry for thermal stability analysis of proteins: qualification of DSC. J. Pharm. Sci. 101 (3), 955-964 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved