A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
الجهد المشبك فلوروميتري في
In This Article
Summary
توضح هذه المقالة تعزيز التقليدية الجهد المشبك فلوروميتري (فف) حيث يتم استخدام الفلورسنت الأحماض الأمينية غير طبيعية (فوا) بدلا من الأصباغ ماليميد، لتحقيق إعادة ترتيب الهيكلي في القنوات الأيونية. ويشمل الإجراء زينوبوس البويضات حقن الحمض النووي، رنا / فوا سوينجكتيون، والقياسات الحالية والضوضاء في وقت واحد.
Abstract
وكان الجهد المشبك فلوروميتري (فف) تقنية الاختيار للتحقيق في هيكل ووظيفة البروتينات الغشاء الإلكتروجيني حيث القياسات في الوقت الحقيقي من مضان والتيارات تقرير في وقت واحد على إعادة ترتيب المحلية والوظيفة العالمية، على التوالي 1 . في حين أن تقنيات عالية الدقة الهيكلية مثل المجهر الإلكتروني البرد أو الأشعة السينية البلورات توفر صور ثابتة للبروتينات من الفائدة، فف يوفر البيانات الهيكلية الديناميكية التي تسمح لنا لربط إعادة الهيكلة الهيكلية (مضان) لبيانات وظيفية ديناميكية (الكهربية). حتى وقت قريب، والكيمياء ثيول رد الفعل المستخدمة في وضع العلامات الموجهة فلورزنت الموقع من البروتينات يقيد نطاق النهج لأنه سيتم وصفها جميع سيستينس الوصول إليها، بما في ذلك الذاتية. وبالتالي كان مطلوبا لبناء البروتينات خالية من السيستين الذاتية. كما تم وضع العلامات على المواقع التي يمكن الوصول إليها من خارج الخليةجانب. هذا تغير مع استخدام الفلورسنت الأحماض الأمينية غير طبيعية (فوا) لدمج على وجه التحديد مسبار الفلورسنت الصغيرة ردا على وقف قمع الكودون باستخدام الحمض الريبي النووي النقال متعامد ورنا الحمض الريبي النووي النقال سينثيتاس 2 . تحسين فف يتطلب فقط إجراء حقن من خطوتين من حقن الحمض النووي (الحمض الريبي النووي النقال / زوج سينثيتاس) تليها الحمض النووي الريبي / فوا شارك في الحقن. الآن، وضع العلامات على كل من الخلايا والمواقع المدفونة ممكن، واستخدام فف توسعت بشكل كبير. وبالتالي فإن تقنية فف تصبح جذابة لدراسة مجموعة واسعة من البروتينات، والأهم من ذلك - يسمح التحقيق في العديد من الآليات التنظيمية عصاري خلوي.
Introduction
وقد تم دمج أكثر من 200 من الأحماض الأمينية غير الطبيعية من مختلف الخصائص الكيميائية والفيزيائية وراثيا في البروتينات في E. القولونية والخميرة وخلايا الثدييات 3 . يتم تضمين الأحماض الأمينية غير الطبيعية ردا على كودون وقف معين عن طريق زوج متعامد المهندسة الحمض الريبي النووي النقال / سينثيتاس. وقد وفرت النهج الوراثي لتعديل البروتينات رؤى قيمة في هيكل البروتين وظيفة. هنا، نقدم بروتوكول لاستخدام الجهد المشبك فلوروميتري (فف) في تركيبة مع وا الفلورسنت.
في فف، ومراقبة في وقت واحد من البيانات الوظيفية وإعادة الهيكلة الهيكلي المترجمة حول مسبار الفلورسنت (~ 5 Å) يسمح لنا للحصول على معلومات ديناميكية مع ميلي ثانية واحدة القرار 1 . تحقيقات الفلورسنت تغير حالة التبريد الخاصة بهم على حركة محلية من البروتين. حركة فقط 1-2 Å كافية تؤدي إلى تغييرات كبيرة في مضانكثافة 4 . بعد تحديد موقع الفائدة في البروتين المستهدف، يتم تحور الموقع عن طريق طفرة نقطة. بشكل كلاسيكي، تم تحوير بقايا إلى السيستين في حين الآن، يتم إدخال كودون وقف العنبر (تاج) لدمج فوا الوراثية. ثم يتم في البروتين المختبر كتب في المختبر .
في حين أن أنظمة التعبير الأخرى (على سبيل المثال، خلايا الثدييات) يمكن استخدامها 5 ، 6 ، 7 ، والبويضات القيطم هي الأفضل للدراسات هيكل وظيفة بسبب حجمها أكبر، مما يؤدي إلى التلاعب أسهل وكثافة أعلى مضان (أكثر فلوروفوريس)، وبالتالي، إلى نسبة الضوضاء. وعلاوة على ذلك، البويضات القيطم لها خلفية منخفضة من البروتينات الذاتية 2 ، 8 ، والتصبغ الظلام على الدروع القطب الحيواني ضد مضان الخلفية من رانه سايتوسول. يتم إزالة البويضات القيطم جراحيا ويتم حقن الحمض النووي ترميز الحمض الريبي النووي النقال متعامد / الحمض الريبي النووي النقال-سينثيتاس محددة ل فوا في نواة البويضات. بعد 6-24 ساعة ساعة الحضانة، يتم حقن الحمض النووي الريبي البروتين مع فوا في السيتوسول من البويضات، تليها فترة الحضانة 2-3 أيام. من أجل منع أي ضرر على فوا (فوتوبلاشينغ)، والإجراءات بما في ذلك أناب يجب أن تنفذ تحت الضوء الأحمر لتجنب فلورفور الإثارة.
يتم دراسة البويضات على قطع مفتوحة البويضة الجهد المشبك الإعداد، والتي هي التي شنت على المجهر مضان تستقيم، وتسجيل التيار الكهربائي والتغيرات مضان في وقت واحد 9 ، 10 . بدلا من ذلك، اثنين من القطب الكهربائي المشبك الجهد 1 أو التصحيح المشبك تكوينات 11 يمكن استخدامها. مضان هو متحمس من قبل الأطوال الموجية المناسبة مع انخفاض الضوضاء رمز و الانبعاثات المسجلة باستخدام الثنائي الضوئي مرتبطة مكبر للصوت مع التضخيم عالية.
هناك العديد من المزايا من استخدام الفلورسنت الأحماض الأمينية غير طبيعية (فواس) في فلوريوميتري الجهد المشبك. واحد هو الوصول إلى الجانب عصاري خلوي من البروتينات الغشاء. وتقع العديد من العمليات التنظيمية هنا (على سبيل المثال، كا 2 + - أو المواقع النوكليوتيدات ملزمة، سريع وإغلاق الدولة تعطيل قنوات أيون الجهد بوابات، افتتاح المسام، اقتران وحدة). كل هذه العمليات يمكن الوصول إليها الآن لوضع العلامات الفلورسنت.
ميزة أخرى هي صغر حجم التحقيق مما يؤدي إلى أقل اضطراب في البروتين. حتى الآن، تم تصميم اثنين من أزواج الحمض الريبي النووي النقال / ترنا سينثيتاس متعامد ل فواس 12 ، 13 ، حيث 3- (6-أسيتيلنافثالين 2-يلامينو) -2-أمينوبروبانويك حمض (أناب) هو فوا الوحيد الذي تم استخدامه في البويضات القيطم 2 ،"كريف"> 8. أناب هو فلوروفور حساسة بيئيا مع الوزن الجزيئي من 272.3 ز / مول وهي أكبر قليلا فقط من التربتوفان 12 ( أرقام 1A، 1B ). نظرا لصغر حجمها، من المرجح أن يتم إدخال عدد أقل من التأثيرات المجسمة بواسطة الفلورفور مقارنة مع الفلوروفوريس التقليدي المرفق عبر رابط (عادة أكثر من 500 جم / مول). وعلاوة على ذلك، في حالة أناب، ويقع فلورفور أقرب إلى العمود الفقري البروتين من تلك المرتبطة سيستينس، وبالتالي، أناب هو البحث عن إعادة ترتيب أكثر محلية. وأخيرا، إزالة السيستين الذاتية في فف التقليدية من أجل ضمان وضع العلامات على الموقع لم يعد شرطا في وا-فف وبالتالي (1) يترك البروتينات في (تقريبا) حالتهم الأصلية و (إي) يسمح فف ليتم تطبيقها لدراسة مجموعة واسعة من البروتينات التي يمكن تغيير وظيفة من خلال استبدال السيستين.

الشكل 1 : أناب و مضان الأطياف. ( A ) التركيب الكيميائي لل أناب. ( B ) طيف الامتصاص تطبيع وأطياف الانبعاثات ل 1 نانومتر أناب، مما يدل على حساسية مضان أناب إلى مسعور المائي. تم الحصول على أطياف الانبعاث مثيرة في 350 نانومتر. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
العيب من استخدام وارس الفلورسنت هو أن السكان غير المتجانسة من البروتينات قد ينتج عن وقف كودون ريدثرو، إعادة التأهيل متعدية، C- محطة اقتطاع البروتينات أو الحديث المتبادل مع أمينواسيلاتيون الذاتية إذا كان كمية ترناس أمينواسيلاتد نادرة. وينبغي دائما التحقق من هذا التعبير تسرب لفي غياب فوا ورنا الحمض الريبي النووي النقال / الحمض الريبي النووي النقال سينثيتاس الزوج. لقد تناولنا مسألة الانتقالوكيفية تكرارها، وكيفية التحايل عليها من أجل مواقع الإدراج N-ترمينال سابقا 14 . ومع ذلك، عندما فوا، ترنا و ترنا سينثيتاس موجودة في كميات مشبعة، لا يزال هناك احتمال ضئيل للتعبير تسرب.
الاختلاف الإجرائي الرئيسي بين فوا-فف و فف التقليدي هو الحقن والتعامل مع البويضات. حقن الحمض الريبي النووي النقال ترنا الحمض الريبي النووي النقال و ترنا سينثيتاس (باناب) يليه إدخال أناب، والتي هي إما شارك في حقن مع مرنا البروتين أو بدلا من ذلك إضافة إلى حل الحضانة كما استر أسيتوكسيميثيل (آم).
Protocol
تم إجراء التلاعب الضفدع وفقا للمبادئ التوجيهية الكندية وتمت الموافقة عليها من قبل لجنة الأخلاقيات (كديا، بروتوكول رقم 15-042) من جامعة مونتريال.
1. مرنا إعداد ل فوا التأسيس
- اختيار موقع من الفائدة في البروتين حيث من المتوقع أن تحدث التغييرات التوافقية. حدد حمض أميني في هذه المنطقة ليكون بديلا عن فوا.
ملاحظة: ويستند اختيار الموقف على إعادة ترتيب الهيكلي التي من المتوقع. في حالة وجود بنية عالية الدقة وفرضية للحركات المتوقعة، يجب وضع ال أناب بحيث تتغير البيئة الكيميائية؛ وهذا قد يكون إما تغيير في ثابت العزل (مسعور مقابل بيئة ماء) أو، على الأرجح، التبريد بواسطة حمض أميني آخر. أفضل مخمدات هي تريبتوفانز. يجب أن يكون أناب على اتصال مع القشرة في حالة واحدة (التداخل من فان-دير-والس رادي) وخالية منه فيالأخرى. إذا لم يكن هناك هياكل عالية الدقة أو نماذج موجودة، سيكون للمرء أن تفحص المنطقة ذات الاهتمام. في كلتا الحالتين، فإنه من المستحسن لتحديد عدة مواقع قريبة لزيادة احتمال الحصول على التعبير والإشارة مضان. من أجل تقليل الآثار الاستثنائية خلال نضوج البروتين و / أو وظيفة، يمكن للمرء أن يختار لاستبدال الأحماض الأمينية الكبيرة والعطرية (ف، ترب، تير). ومع ذلك، فقد شهدت المؤلفون أن مسح منطقة ذات أهمية لإدخال فوا بغض النظر عن الأحماض الأمينية استبدالها، هو أكثر إنتاجية. - إدراج كودون وقف العنبر (تاج) في الموقع المحدد باستخدام الطفرات الموجهة للموقع 15 . تأكد من أن البروتين من الفائدة لا تنتهي على كودون وقف العنبر (تاج). إذا كان الأمر كذلك، تحور إلى واحد مختلف (مغرة أو أوبال كودون وقف). تضخيم وعزل وتسلسل الحمض النووي. الحصول على البروتين مرنا مع في المختبر النسخ 16 وتخزين مرنا في 20 درجة مئوية أو 80 درجة مئوية.
- جراحيا الحصول على المرحلة الخامسة أو البويضات السادس من القيطم الضفادع الضفادع وتحلل مع كولاجيناز كما هو موضح سابقا 17 .
- تخدير الضفادع مع مخدر مناسب وفقا لبروتوكول الحيوان المعتمدة (هنا: 3-أمينوبنزواك حمض إيثيل استر). عندما تفشل في الاستجابة لقرصة لطيف إلى أخمص القدمين طرف (فقدان الانسحاب منعكس)، ثم يتم تخدير مناسب للجراحة.
- قم فورا بإزالة الضفادع من محلول التخدير وشطف الجلد جيدا بالماء العذب. وهذا شطف منع الحيوان من الوقوع في مستويات أعمق من التخدير عن طريق إزالة الكيميائية غير الممتصة من سطح الجلد.
- إزالة العقد المبيض من جانب واحد جراحيا وبعناية فتح العقد باستخدام ملقط اثنين. احتضان البويضات وتحريكها في "حل البويضات القياسية" (سوس) التي تحتوي على 1٪ (ث / ت) كولاجيناز لمدة 20-30 دقيقةإلى تحلل. يغسل ثلاث مرات مع حل سوس.
- حدد البويضات الكبيرة والصحية بشكل فردي واحتضان لهم في حل بارث تستكمل مع المضادات الحيوية (100 U / مل البنسلين، 100 ميكروغرام / مل الستربتومايسين، 10 ملغ / 100 مل كانامايسين) و 5٪ الحصان المصل في 18 درجة مئوية لمدة 4 ساعات على الأقل قبل الحقن .
ملاحظة: بعد 2 - 4 العمليات الجراحية مع تأخير 4 أشهر في بين الموت الرحم القيطم الموت الرحيم من قبل فترة طويلة (> 1 ساعة) الحضانة مع 3-أمينوبنزواك حمض إثيل استر.
- للحقن النووي من الحمض النووي، وإعداد طرف حقن طويلة ورقيقة لتكون قادرة على الوصول إلى النواة وتجنب الإضرار البويضة. ملء طرف الحقن مع النفط وجبله على الجهاز نانوينجكتور.
- تثبيت نانو حاقن تحت المجهر ستيريو واستخدام ملقط لكسر نهاية طرف. إخراج النفط حتى لا يكون هناك فقاعات الهواء المحاصرين داخل نهاية طرف.
- مكان 1 ميكرولتر من 0.1 ميكروغرام /# 181؛ L باناب في نوكليس خالية من المياه التي تحتوي على هيدروكسيد الصوديوم (1٪ من 1 N هيدروكسيد الصوديوم) على قطعة من بارافيلم تحت المجسام وملء طرف حقن مع الحمض النووي.
- نقل 40 البويضات إلى طبق حقن المغلفة شبكة تحتوي على حل بارث تستكمل مع المضادات الحيوية.
ملاحظة: لجعل طبق حقن المغلفة شبكة، وقطع قطعة بحجم مناسب من 800 ميكرون شبكة النايلون لملء طبق بيتري البوليسترين. إضافة الكلوروفورم إلى المركز ثم ضع شبكة على القمة. عقد شبكة شقة حتى مجموعات من البلاستيك. - كما يقع نواة البويضة في حيوان (الظلام) القطب، وتهدف طرف الحقن في وسط القطب الحيوان و إمبال مثل أن غيض يصل بالقرب من مركز نصف الكرة الحيوانية (أو 2-3X عمق مقارنة حقن الحمض النووي الريبي ). حقن 9.2 نل من البناب في نواة كل البويضة. قد يؤدي طرف الرقيقة والحجم الصغير للحقن إلى حقن غير منتظم أو طرف مسدود. أحيانا تحقق ما إذا كان الحقن يعمل عن طريق الحقن في الهواء.
ملاحظة: ما إذا كان يحصل على حقن الحمض النووي بشكل صحيح في النواة غير مؤكد. نتوقع بالتالي 10 - 40٪ من البويضات لا تعبر عن الحمض الريبي النووي النقال / سينثيتاس الزوج. انظر مناقشة لمزيد من التوضيح. - احتضان البويضات في 2 مل حل بارث تستكمل مع المضادات الحيوية و 5٪ مصل الحصان (هس) في 18 درجة مئوية لمدة 6-24 ساعة للسماح التعبير القوي من أناب ترناس محددة و ترنا-سينثيتاسس.
ملاحظة: الوقت حاضنة الحمض النووي يمكن أن تستمر عدة أيام قبل حقن الحمض النووي الريبي، لكنه لا يزيد التعبير. - إعداد نانو حاقن لحقن رنا (نفس الخطوة 2.2 ولكن لا يحتاج طرف الحقن لتكون رقيقة مثل حقن الحمض النووي). تعمل فقط تحت الضوء الأحمر من هذه النقطة لمنع فوتوبلاشينغ من أناب.
- مزيج 1 ميكرولتر من 1 ملي أناب مع 1 ميكرولتر من 1-2 ميكروغرام / ميكرولتر مرنا مباشرة على قطعة من بارافيلم وملء طرف حقن مع الحل المختلط. إمبال أسفل الغشاء في النباتي(مشرق) وحقن 46 نل في كل بويضة حقن البويضة.
ملاحظة: تركيز مرنا المطلوب يعتمد على البروتين من الفائدة. - احتضان البويضات المحمية من الضوء في مربع أو ملفوفة في رقائق الألومنيوم، في حل بارث تستكمل المضادات الحيوية و 5٪ الحصان المصل في 18 درجة مئوية لمدة 2-3 أيام. تبادل مع حل بارث جديدة كل يوم وإزالة البويضات الميتة لتجنب التلوث.
- تثبيت قطع البويضات الجهد المشبك المعدات كما هو موضح سابقا 18 .
- جبل نظام تسجيل الكهربية على المجهر مضان تستقيم عن طريق تثبيت غرفة التسجيل على شريط التمرير الذي يسمح تحريكه بين المجسام القياسية لوضع البويضة والمجهر لأداء القياسات مضان ( الشكل 2C ).
ملاحظة: هندسة الغرفة لقطع البويضات مفتوحة ليست مناسبة لاستخدام ترا العادينسميد ضوء للإضاءة أثناء التلاعب. ولذلك، يتم استخدام مصباح "الهجين" مع فلتر أحمر لإلقاء الضوء جانبية من أعلى. المكثف من المجهر يمكن إزالتها جعل الفضاء لخفض المرحلة لغرفة الكهربية. - ربط نظام الكشف عن فوتوديود إلى منفذ الخروج C- جبل المجهر مضان ( الشكل 2A ). توصيل قراءات فوتوكرنت إلى قناة الإدخال الثانية في معالج الإشارات الرقمية (دسب، التناظرية / الرقمية - الرقمية / التناظرية تحويل).
- استخدام 100 واط، 12 فولت مصباح الهالوجين كمصدر للضوء الإثارة مضان.
ملاحظة: بدلا من ذلك، يمكن استخدام الشعلات زئبق، ولكن يجب أن يتم تخفيض في شدة لمنع فوتوبلاشينغ سريع جدا أثناء التسجيلات. يوصى إضاءة ليد فقط إذا كانت المصابيح منها تظهر كثافة كبيرة في مجموعة الإثارة (على سبيل المثال، ~ 350 نانومتر ل أناب). معظم المصابيح البيضاء لا تصل بعيدا في الطيف الأشعة فوق البنفسجية. - إنسإرت مصراع كهربائيا تسيطر بين مصدر ضوء الإثارة والمجهر وربط سيطرتها (عادة تل نبض) إلى إخراج رقمي من دسب. وقت تل-نبض في برنامج التسجيل (انظر وثائق الشركة المصنعة)، بحيث يفتح مصراع ~ 100 مللي ثانية قبل بداية التسجيل. وبهذه الطريقة، فإن أي اهتزاز أثناء عملية الافتتاح لا يتداخل مع التسجيل. الوقت يعتمد على سرعة والاهتزاز من مصراع الكاميرا. إنهاء 5ms نبض قبل نهاية التسجيل كما هو مبين في الشكل 4 . وبهذه الطريقة، يتم تسجيل قيمة لمضان الكلي أيضا.
- إدراج مكعب مرشح المناسبة (مرشح الإثارة، ومرآة مزدوج اللون وتصفية الانبعاثات) في برج المكعب فلتر. بالنسبة ل أناب، استخدم المثال السابق: 377/50 نانومتر باندباس، ثنائي اللون 409 نانومتر لونغباس، و إم: 470/40 نانومتر باندباس.
- اتبع خطوات التحضير لقطع مفتوحة البويضات الجهد المشبك كما هو موضح سابقا وتصور 18 (إعداد جسر أجار، تصاعد البويضة، سابونين بيرمابيليزاتيون). ومع ذلك، والعمل تحت الضوء الأحمر في كل وقت لتجنب تبييض فلورفور قبل التسجيلات. عند وضع البويضة، تأكد من أن القطب الحيوان يواجه صعودا. تصبغ تحت الدروع القطب الحيواني غشاء ضد تألق ذاتي الناشئة من السيتوسول وبالتالي يقلل من مضان الخلفية.
- حرك الغرفة لأكثر من المجهر والتركيز باستخدام الهدف 4X.
- إمبال البويضة مع الجهد الاستشعار V1 القطب (3 M بوكل)، والتحول إلى 40X الماء الغمر (نا 0.8 - 0.9) الهدف. التركيز على القطب الحيوان الذي يواجه صعودا.
- إيقاف الضوء الأحمر. حدد المكبس مرشح الحق عن طريق تحويل برج المكعب فلتر ومخرج الخروج البصري متصلا الضوئي. بدوره على الهالوجإن مصباح في أعلى كثافة وقريبا تبديل مصراع مفتوح لمدة 2-5 ثانية لقراءة شدة الخلفية مضان الناشئة من البويضة. مع الإعداد الموصوف يجب أن تكون القيمة حوالي 50-200 با ل أناب.
- بدوره على المشبك، الوجه حمام / الحرس التبديل إلى نشطة وضبط إمكانات الغشاء (V1 - V2) إلى إمكانات الأمر عن طريق تحويل مقبض الباب على هادستاج I.
- حدد عقد المحتملة، بروتوكول خطوة، وعدد وطول البقول وما إلى ذلك في برنامج التسجيل. سجل التيارات التي تعتمد على الجهد وشدة مضان أناب.
- لمراقبة موقعين في نفس البروتين في وقت واحد، تحور حمض أميني خارج الخلية ويمكن الوصول إليها في السيستين، وإزالة سيستينس أخرى لضمان وضع العلامات محددة مع ثيول الكيمياء.
- تنفيذ الخطوة 2.1-2.5.
- قبل تسجيلات فف، واحتضان البويضات في 5 ميكرومتر تمر-ماليميد في حل وسم لمدة 15 دقيقة (أو صبغ آخرمع أطياف غير متداخلة بالمقارنة مع أناب).
- غسل البويضات مع وضع العلامات حل ثلاث مرات لإزالة الصبغة الزائدة.
- تنفيذ الخطوة 4.1-4.6.
- إدراج مكعب فلتر مناسب ل تمر (الإثارة تصفية، ومرآة ثنائي اللون وفلتر الانبعاثات) في برج المكعب مرشح. التبديل إلى مكعب فلتر تمر عن طريق تحويل برج مرشح.
- قراءة مضان الخلفية ل تمر كما هو موضح ل أناب في الخطوة 4.4.
ملاحظة: وضع العلامات مع ثيول الكيمياء النتائج في مضان خلفية عالية بسبب وضع العلامات غير محددة في الغشاء. لذلك، قد مضان الخلفية تمر تشبع مكبر للصوت (> 2000 با). في هذه الحالة، لا تقلل من شدة الضوء، ولكن ببساطة طرح مضان الخلفية عن طريق إضافة تيار الإزاحة إلى الضوئي. في الأنظمة المتاحة تجاريا استخدام ميزة "العينة والعقد" على نظام الكشف. لاحظ قيمة مضان الخلفية (باستخدام مرشح 10X كثافة محايدة) في مختبر jأورنال، حيث لن يتم تسجيل هذه القيمة (التشبع). - سجل التيارات التي تعتمد على الجهد وتمر مضان شدة في وقت واحد كما في الخطوة 4.6.
2. إعداد البويضات والحقن
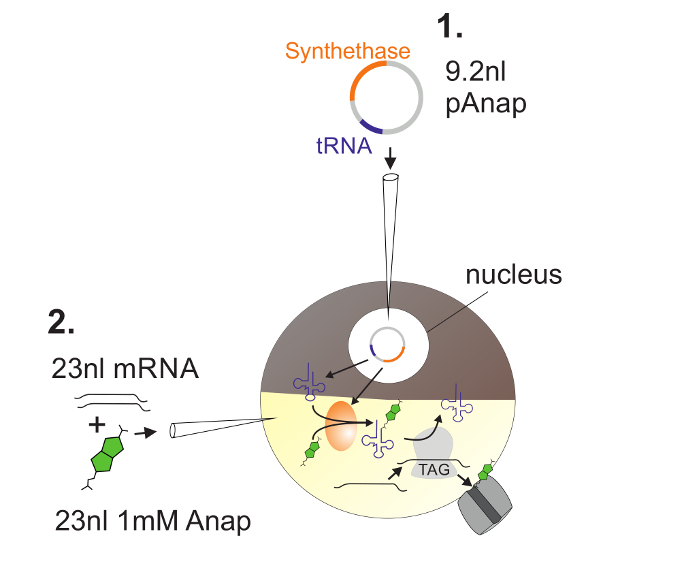
الشكل 2 : تصوير الحمض النووي وحقن الحمض النووي الريبي في البويضات القيطم ل أناب التأسيس.
أولا، يتم حقن باناب في نواة البويضات القيطم ( 1 ). بعد 6-24 ح، يتم سرد أناب والقناة رنا في القطب النباتي ( 2 ). سوف أناب أمينواسيلاتد أورثوغونالي مع الحمض الريبي النووي النقال تحمل وقف العنبر مكافحة كودون، من قبل سيناسيتاس أمينواسيل الحمض الريبي النووي النقال التي يتم ترميزها من قبل باناب. وبهذه الطريقة، يتم التعرف على أناب-ترناس أمينواسيلاتد من قبل الريبوسوم في كودون العنبر إدراج إدراج في تشانل رنا، مما أدى إلى قمع كودون وقف وإدراج أناب. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
3. إعداد فف

الشكل 3 < / سترونغ> : إعداد فف. ( A ) عرض الجانب من الإعداد فف تظهر مسار الضوء داخل المجهر. يحتوي مكعب الترشيح على فلتر الإثارة، ومرآة مزدوجة اللون، ومرشح انبعاث. ( B ) أبعاد غرفة البويضة مختارة هي 3.4 سم لنصف قطرها الغرفة العليا (1)، 5.5 سم لطول الغرفة السفلى (2)، 1.4 سم لعرض الغرفة السفلي (3) و 1.7 سم لعرض الغرفة الوسطى (4). ( C ) عرض الجبهة من الإعداد فف. أول العين على اليسار هو لتركيب البويضة في قطع مفتوحة الجهد المشبك غرفة و بيرمابيليزاتيون. ثم، انزلق الغرفة تحت المجهر في العين الثانية إلى اليمين. هنا، يتم إدخال القطب V1 في البويضة باستخدام الهدف 4X، ويتم تسجيل مضان باستخدام الغمر المياه 40X الهدف. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
5. لونين فف
النتائج
ويبين الشكل 4 مثالا على تسجيلات فف التي تم الحصول عليها من البويضة معربا عن قنوات شاكر مع تعطيل سريع إزالتها (إر)، L382stop-W434F في وجود باناب و أناب. يحول الطفرة W434F تيارات البوتاسيوم الأيونية، مما يجعل من الممكن قياس تشريد تهمة النابضة العابرة (ت...
Discussion
في أمينواسيلاتيون في الجسم الحي من ترناس التي يجري بشكل مستمر يجري نسخها جنبا إلى جنب مع الحمض الريبي النووي النقال-سينثيتاس، يجعل من الممكن الحصول على مستويات التعبير عالية لقياسات مضان. لدمج فوا كفاءة، فمن الأهمية بمكان أن يتم حقن باناب بشكل صحيح في النو?...
Disclosures
الكتاب ليس لديهم ما يكشف.
Acknowledgements
وكان باناب هدية نوع من الدكتور بيتر شولتز (معهد سكريبس للبحوث). وقد تم تمويل هذا العمل من قبل المعاهد الكندية لبحوث الصحة المنح موب-102689 و موب-136894 (إلى رب) والمؤسسة الكندية للابتكار منحة 950-225005.
Materials
| Name | Company | Catalog Number | Comments |
| Solutions | |||
| Barth's solution | |||
| NaCl | Sigma-Aldrich | S7653 | 90 mM |
| KCl | Fisher Scientific | BP366-500 | 3 mM |
| MgSO4 | Sigma-Aldrich | M-9397 | 0.82 mM |
| CaCl2 | Sigma-Aldrich | C-7902 | 0.41 mM |
| Ca(NO3)2 | Sigma-Aldrich | C-1396 | 0.33 mM |
| HEPES | Sigma-Aldrich | H4034 | 5 mM |
| NaOH hydrate | BDH | BDH7225-4 | pH 7.6 |
| Penicilin | Invitrogen | 15140122 | 100 U/mL |
| Streptomycin | Invitrogen | 15140122 | 100 µg/mL |
| Kanamycin | Invitrogen | 15160054 | 10 mg/100mL |
| Horse Serum (HS) | Invitrogen | 16050122 | 5% |
| SOS Standard Oocyte Solution | |||
| NaCl | Sigma-Aldrich | 746398 | 102 mM |
| KCl | Sigma-Aldrich | 746436 | 3 mM |
| MgCl2 | Sigma-Aldrich | M9272 | 1 mM |
| HEPES | Sigma-Aldrich | H4034 | 5 mM |
| External recording solution | |||
| N-methyl-D-glucamine (NMDG) | Alfa Aesar | L14282 | 115 mM |
| HEPES | Sigma-Aldrich | H4034 | 10 mM |
| Calcium hydroxide | Sigma-Aldrich | 239232 | 2 mM |
| MES hydrate | Sigma-Aldrich | 258105 | pH 7.2 |
| Internal recording solution | |||
| N-methyl-D-glucamine (NMDG) | Alfa Aesar | L14282 | 115 mM |
| HEPES | Sigma-Aldrich | H4034 | 10 mM |
| Ethylenediamine Tetraacetic Acid (EDTA) | Fisher Scientific | E478-500 | 2 mM |
| MES hydrate | Sigma-Aldrich | 258105 | pH 7.2 |
| Labeling solution | |||
| KOH | Fisher Scientific | P250-1 | 115 mM |
| HEPES | Sigma-Aldrich | H4034 | 10 mM |
| Calcium hydroxide | Sigma-Aldrich | 239232 | 2 mM |
| MES hydrate | Sigma-Aldrich | 258105 | pH 7.2 |
| TMR stock solution | |||
| Tetramethylrhodamine-5-maleimide (TMR) | Molcular Probes by Life Technologies | T6027 | 5 mM in DMSO |
| Anap stock solution | |||
| Anap | ABZENA (TCRS) | Custom synthesis TCRS-170 | 1 mM in nuclease-free water and 1% NaOH 1 N |
| Name | Company | Catalog Number | Comments |
| Material/Equipment | |||
| pAnap | Addgene | 48696 | |
| High Performance Oocyte Clamp | Dagan Corporation | CA-1B | |
| Gpatch Acquisition software | Department of Anesthesiology, University of California, Los Angeles | ||
| Analysis software | Department of Anesthesiology, University of California, Los Angeles | ||
| Recording Chamber | Custom machined | ||
| Photo diode detection system | Dagan Corporation | PhotoMax-200/PIN | |
| Electrical shutter driver | UNIBLITZ | VCM-D1 |
References
- Mannuzzu, L. M., Moronne, M. M., Isacoff, E. Y. Direct physical measure of conformational rearrangement underlying potassium channel gating. Science. 271 (5246), 213-216 (1996).
- Kalstrup, T., Blunck, R. Dynamics of internal pore opening in K(V) channels probed by a fluorescent unnatural amino acid. Proc Natl Acad Sci U S A. 110 (20), 8272-8277 (2013).
- Xiao, H., Schultz, P. G. At the Interface of Chemical and Biological Synthesis: An Expanded Genetic Code. Cold Spring Harb Perspect Biol. 8 (9), (2016).
- Blunck, R. Chapter 9. Handbook of Ion Channels. , 113-133 (2015).
- Chatterjee, A., Guo, J., Lee, H. S., Schultz, P. G. A genetically encoded fluorescent probe in mammalian cells. J Am Chem Soc. 135 (34), 12540-12543 (2013).
- DeBerg, H. A., Brzovic, P. S., Flynn, G. E., Zagotta, W. N., Stoll, S. Structure and Energetics of Allosteric Regulation of HCN2 Ion Channels by Cyclic Nucleotides. J Biol Chem. 291 (1), 371-381 (2016).
- Shen, B., et al. Genetically encoding unnatural amino acids in neural stem cells and optically reporting voltage-sensitive domain changes in differentiated neurons. Stem Cells. 29 (8), 1231-1240 (2011).
- Aman, T. K., Gordon, S. E., Zagotta, W. N. Regulation of CNGA1 Channel Gating by Interactions with the Membrane. J Biol Chem. 291 (19), 9939-9947 (2016).
- Haddad, G. A., Blunck, R. Mode shift of the voltage sensors in Shaker K+ channels is caused by energetic coupling to the pore domain. J Gen Physiol. 137 (5), 455-472 (2011).
- Batulan, Z., Haddad, G. A., Blunck, R. An intersubunit interaction between S4-S5 linker and S6 is responsible for the slow off-gating component in Shaker K+ channels. J Biol Chem. 285 (18), 14005-14019 (2010).
- Kusch, J., et al. How subunits cooperate in cAMP-induced activation of homotetrameric HCN2 channels. Nat Chem Biol. 8 (2), 162-169 (2012).
- Lee, H. S., Guo, J., Lemke, E. A., Dimla, R. D., Schultz, P. G. Genetic incorporation of a small, environmentally sensitive, fluorescent probe into proteins in Saccharomyces cerevisiae. J Am Chem Soc. 131 (36), 12921-12923 (2009).
- Summerer, D., et al. A genetically encoded fluorescent amino acid. Proc Natl Acad Sci U S A. 103 (26), 9785-9789 (2006).
- Kalstrup, T., Blunck, R. Reinitiation at non-canonical start codons leads to leak expression when incorporating unnatural amino acids. Sci Rep. 5, 11866 (2015).
- Liu, H., Naismith, J. H. An efficient one-step site-directed deletion, insertion, single and multiple-site plasmid mutagenesis protocol. BMC Biotechnol. 8, 91 (2008).
- Beckert, B., Masquida, B. Synthesis of RNA by in vitro transcription. Methods Mol Biol. 703, 29-41 (2011).
- Goldin, A. L. Maintenance of Xenopus laevis and oocyte injection. Methods Enzymol. 207, 266-279 (1992).
- Rudokas, M. W., Varga, Z., Schubert, A. R., Asaro, A. B., Silva, J. R. The Xenopus oocyte cut-open vaseline gap voltage-clamp technique with fluorometry. J Vis Exp. (85), (2014).
- Zhao, J., Blunck, R. The isolated voltage sensing domain of the Shaker potassium channel forms a voltage-gated cation channel. Elife. 5, (2016).
- Posson, D. J., Ge, P., Miller, C., Bezanilla, F., Selvin, P. R. Small vertical movement of a K+ channel voltage sensor measured with luminescence energy transfer. Nature. 436 (7052), 848-851 (2005).
- Chanda, B., Asamoah, O. K., Blunck, R., Roux, B., Bezanilla, F. Gating charge displacement in voltage-gated ion channels involves limited transmembrane movement. Nature. 436 (7052), 852-856 (2005).
- Taraska, J. W., Puljung, M. C., Zagotta, W. N. Short-distance probes for protein backbone structure based on energy transfer between bimane and transition metal ions. Proc Natl Acad Sci U S A. 106 (38), 16227-16232 (2009).
- Baker, B. J., et al. Genetically encoded fluorescent sensors of membrane potential. Brain Cell Biol. 36 (1-4), 53-67 (2008).
- Miranda, P., et al. State-dependent FRET reports calcium- and voltage-dependent gating-ring motions in BK channels. Proc Natl Acad Sci U S A. , (2013).
- Sisido, M., Ninomiya, K., Ohtsuki, T., Hohsaka, T. Four-base codon/anticodon strategy and non-enzymatic aminoacylation for protein engineering with non-natural amino acids. Methods. 36 (3), 270-278 (2005).
- Hohsaka, T., Ashizuka, Y., Murakami, H., Sisido, M. Five-base codons for incorporation of nonnatural amino acids into proteins. Nucleic Acids Res. 29 (17), 3646-3651 (2001).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved