Method Article
والعزلة وتصوير الأسفار لتعمير واحد-الجسيمات Chlamydomonas Centrioles
In This Article
Summary
قمنا بتطوير استراتيجية لتنقية والصورة عدد كبير من centrioles في توجهات مختلفة قابلة للفحص المجهري القرار فائقة والجسيمات واحد في المتوسط.
Abstract
Centrioles تجميعات الجزيئات الكبيرة الهامة للتنفيذ السليم للعمليات البيولوجية الخلية الأساسية مثل انقسام الخلية أو حركية الخلية إشارات الخلية. الطحالب الخضراء رينهاردتي تشلاميدوموناس ثبت أن طراز الثاقبة في دراسة الهندسة المعمارية مريكز، الدالة، وتكوين البروتين. وعلى الرغم من التقدم الكبير نحو فهم بنية سينتريولار، أحد التحديات الراهنة تحديد التعريب الدقيق لمكونات سينتريولار داخل المناطق الهيكلية مريكز من أجل فهم أفضل لدورها في مريكز نشوء حيوي. قيداً رئيسيا يكمن في حل مجهرية الأسفار، مما يعقد تفسير التعريب البروتين في هذا عضية مع أبعاد قريبة من الحد حيود. لمعالجة هذه المسألة، ونحن نقدم وسيلة لتنقية والصورة عدد كبير من رينهاردتي C. centrioles مع توجهات مختلفة باستخدام الفحص المجهري القرار فائقة. هذا الأسلوب يسمح لمزيد من المعالجة للبيانات عن طريق فلوري واحد-الجسيمات المتوسط (فلوو-سبأ) نظراً للعدد الكبير من centrioles المكتسبة. فلوو-سبأ يولد متوسطات الملون centrioles C. رينهاردتي في توجهات مختلفة، وبالتالي تيسير إضفاء الطابع المحلي على البروتينات متميزة في المناطق الفرعية سينتريولار. الأهم من ذلك، يمكن تطبيق هذا الأسلوب بصورة centrioles من الأنواع الأخرى أو التجميعات الجزيئات الكبيرة الأخرى.
Introduction
مريكز هو عضية تقحم مصانة التي تكمن في صميم سينتروسومي في الخلايا الحيوانية، ويمكن أن تعمل كهيئة القاعدية (المشار إليها ك centrioles أدناه) بأهداب القالب أو سياط في كثير من حقيقيات النوى1،2. على هذا النحو، حاسمة بالنسبة للعمليات البيولوجية الخلية الأساسية تتراوح بين الجمعية المغزل إلى الخلية إشارات centrioles. ولذلك، ارتبطت مع العديد من الأمراض البشرية بما في ذلك سيليوباثيس والسرطانات3عيوب في الجمعية مريكز أو دالة.
Centrioles تضاعف، متناظرة، ميكروتوبولي الثلاثي القائم على الهياكل الاسطوانية التي هي، عادة، ~ 450 نانومتر طويلة و ~ 250 نانومتر واسعة4،5،،من67. المجهر الإلكتروني التقليدية والتصوير المقطعي cryo-إلكترون من centrioles من الأنواع المختلفة قد كشفت عن أن centrioles هي الاستقطاب على طول محورها طويل مع ثلاث مناطق متميزة: منطقة الدانية، ونواة مركزية، و منطقة البعيدة5 , 7 , 8 , 9 , 10 , 11-الأهم من ذلك، كل من هذه المناطق يعرض السمات الهيكلية المحددة. أولاً، يتضمن تجويف منطقة شمال البحر الأبيض المتوسط طوله الدانية 100 هيكل عجلة العربة متصلة بالثلاثي ميكروتوبولي من خلال عنصر رأس الدبوس12. ثانيا، يتضمن منطقة وسط شمال البحر الأبيض المتوسط طوله 300-400 كثافة ليفية في السمات الهيكلية والتجويف على طول الوجه الداخلي ميكروتوبوليس: رابط على شكل Y والذيل ج-A-9كعب الروتين. وأخيراً، منطقة شمال البحر الأبيض المتوسط 50 – 100 القاصي المعارض الملاحق الفرعية البعيدة والبعيدة التي تحيط بالجزء الأعلى من5،مريكز13.
لقد اتسمت في العقدين الأخيرين باكتشاف عدد متزايد من البروتينات سينتريولار، مما أدى إلى إجراء تقدير الحالي لبروتينات مميزة حوالي 100 كونها جزءا من مريكز14،،من1516، 17-وعلى الرغم من أوجه التقدم هذه، التعريب الدقيق لهذه البروتينات داخل مريكز يظل بعيد المنال، لا سيما داخل المناطق الفرعية الهيكلية. الأهم من ذلك، تعيين ترجمة دقيقة للمناطق الهيكلية مريكز أمر حاسم لفهم أفضل لوظيفتها. وفي هذا الصدد، centrioles رينهاردتي C. قد ساعدت في كلا من الجوانب بأول واﻻستعانة السمات الهيكلية المختلفة على طول الاسطوانة9،18،19، مما أتاح ثم الباحثين للربط بين إضفاء الطابع المحلي على مجموعة فرعية بروتينات باستخدام مجهر فلوري إلى منطقة شبه هيكلية. ويشمل هذا، على سبيل المثال، البروتينات Bld12p و Bld10p، الذي ترجمة في المنطقة الدانية، وفي هيكل عجلة العربة خاصة20،21،،من2223. كما تشمل قائمة البروتينات الهيكلية المترجمة POB15 و POC16، هما البروتينات الرواية حددها الكتلي التي تزين المنطقة الداخلية الأساسية المركزية centrioles رينهاردتي جيم- 17.
تقدم هذه الورقة وصف كامل للطريقة التي وضعت لعزل والصورة centrioles رينهاردتي C. للفحص المجهري القرار فائقة اللاحقة والجسيمات واحد في المتوسط. ولتحقيق هذا الهدف، من المهم أن تحدد القيود التقنية التي يتعين التغلب عليها. أولاً، يمكن أن تؤثر على تنقية مريكز البنيان الشامل، مع هيكل عجلة العربة وكثيراً ما يتم فقدان أثناء الخطوات المختلفة لعزل9. وثانيا، أبعاد مريكز قريبة جداً من الحد حيود في المجهر الضوئي. في الواقع، هو القرار الجانبية التي يمكن الحصول عليها في الفحص المجهري [كنفوكل] حوالي 200 نانومتر24، مماثلة للقطر مريكز، والقرار في ض-محور عن 2 – 3 س أقل، مما يؤدي إلى وحدة تخزين متباين. وثالثاً، يمكن أن يحد إلى التباين في اتجاه وضع العلامات ومريكز جسم تفسير الحاجة إلى ترجمة بروتين في منطقة سينتريولار الفرعية محددة. وأخيراً، توجد centrioles في نسختين فقط كل خلية، مما يجعل من الصعب الحصول على عدد كبير من الصور، والبحث عن اتجاه مريكز لا لبس فيها. للالتفاف حول هذه المسائل التقنية، قمنا بتطوير أسلوب يعتمد على تطبيق القرار فائقة مجهرية على عدد كبير من centrioles المعزولة التي تعتمد التوجهات المختلفة. نحن سوف تصف أول بروتوكول لتنقية رينهاردتي C. centrioles التي تمكن من تنقية centrioles سليمة هيكلياً وبروسينتريوليس التي تحتوي على عجلة العربة. ثم، ونحن سوف تصف بروتوكول خطوة بخطوة للتركيز centrioles على كوفيرسليبس للتصوير بواسطة التقليدية أو مجهرية فائقة القرار الفلورسنت. تسمح هذه الخطوة هامة لزيادة عدد centrioles تصويرها في اتجاهات متعددة. وأخيراً، نحن سوف تصف إجراء لإجراء واحد-الجسيمات في المتوسط على البيانات التي يحصل عليها من شأن المجاهر الفلورسنت التي تسهل الكشف عن centrioles في اتجاهات مختلفة. إجمالاً، يمكن تطبيقها على الصورة centrioles هذا الأسلوب من مختلف الأنواع أو التجميعات الجزيئات الكبيرة الأخرى.
Protocol
1-وسائل الإعلام "إعداد" الثقافة رينهاردتي C. و "عزل مريكز"
-
إعداد الوسائط للخلايا رينهاردتي جيم- الثقافة
ملاحظة: تصف الخطوات التالية إعداد حلول الأسهم 1 × المتوسطة (تريس-خلات الفوسفات) الصنبور.- إعداد المخزن مؤقت فوسفات (pH 7)، بمزج 250 مل من م 1 ك2هبو4 (174.2 ز ك2هبو4 تكملة للأم 1 مع الماء المقطر) مع مل ~ 170 1 م خ2ص4 (136.09 ز خ2ص4 في 1 لتر). ضبط المخلوط للوصول إلى درجة الحموضة 7.
- إعداد الحل (س 40) عن طريق خلط ز 96.8 في تريس و 40 مل من المخزن المؤقت للفوسفات (pH 7) 40 مل من حمض الخليك، وضبط الحل إلى 1 لتر بالماء المقطر.
- إعداد حل ب (40 x) باستخدام 16 ز NH4Cl وز 2 كاكل2ز 4 مجسو4. كن حذراً حل كاكل2 في الماء المقطر بشكل منفصل قبل إضافته إلى المكونات الأخرى. ضبط الحل إلى 1 لتر بالماء المقطر.
- إعداد هوتنير للعناصر النزرة المخزن المؤقت25 كما يلي.
- 1 لتر من المخزن المؤقت، لحل كل مجمع في حجم المياه المشار إليها: ثنائي يدتا الملح (50 غ في 250 مل)، زنسو4.7H2س (22 غ في 100 مل)، ح3بو3 (ز 11.4 في 200 مل)، والحركة2.4H2س (ز 5.06 في 50 مل) ، كوكل2.6H2س (ز 1.61 في 50 مل) وخصصت4.5H2س (ز 1.57 في 50 مل)، 6Mo (NH4)724س.4H س2(1.10 ز في 50 مل) وفيسو4.7H2س (ز 4.99 في 50 مل).
ملاحظة: يجب حل يدتا في الماء المغلي، و فيسو4 -يجب إعداد آخر لتجنب الأكسدة. - مزيج جميع الحلول إلا يدتا معا وتقديمهم إلى يغلي. ثم قم بإضافة يدتا، والحل الذي يجب أن يتحول إلى اللون الأخضر. بعد حل كل شيء، بارد الحل إلى 70 درجة مئوية. في هذا درجة حرارة, إضافة 85 مل حل كوه 20% الساخنة (20 غ في 100 مل). ضبط حل ل 1 مع الماء المقطر في درجة حرارة الغرفة (RT).
- إضافة المكونات القطن قارورة وترك الحل الوقوف لمدة أسابيع 1 أو 2، تهتز لها 1 × يوميا. الحل ينبغي أن يكون في البداية خضراء ثم قم بتشغيل الأرجواني، تاركاً ترسبات الصدأ-براون؛ إزالة ترسبات استخدام ورق الترشيح حتى الحل الواضح. تجميد في مختبرين وتخزينها في-20 درجة مئوية.
- 1 لتر من المخزن المؤقت، لحل كل مجمع في حجم المياه المشار إليها: ثنائي يدتا الملح (50 غ في 250 مل)، زنسو4.7H2س (22 غ في 100 مل)، ح3بو3 (ز 11.4 في 200 مل)، والحركة2.4H2س (ز 5.06 في 50 مل) ، كوكل2.6H2س (ز 1.61 في 50 مل) وخصصت4.5H2س (ز 1.57 في 50 مل)، 6Mo (NH4)724س.4H س2(1.10 ز في 50 مل) وفيسو4.7H2س (ز 4.99 في 50 مل).
- إعداد 1 × المتوسطة برنامج المشورة التقنية لزراعة الخلايا رينهاردتي جيم بخلط المكونات التالية: 25 مل من محلول (س 40) و 25 مل من محلول ب (40 x) مع 1 مل عناصر التتبع هوتنير للمخزن المؤقت25، وضبط المخلوط إلى 1 لتر بالماء المقطر. تعقيم المخلوط باستخدام عامل تصفية 0.4 ميكرومتر.
-
إعداد الوسائط لتنقية مريكز
- إعداد المخزن مؤقت ديفلاجيلاتيون استخدام السكروز 5% في 10 مم هيبيس (pH 7) في وحدة تخزين نهائي 500 مل يعدل مع الماء المقطر.
- تحضير 250 مل حمض الخليك 0.5 متر.
- تحضير 250 مل حل م كانابيب الأسهم 1 (الرقم الهيدروجيني 7.2) بأول إضافة 50 مل ح2س لإذابة مسحوق أنابيب، ثم إضافة 10 كوه ن حتى الحل يبدأ لتصبح واضحة. تيتراتي إلى الرقم الهيدروجيني 7.2 مع 10 N و 1 ن كوه وضبط الحل نهائي حجم 250 مل مع H2o.
- إعداد حلول السكروز 5 (w/w) على النحو التالي.
ملاحظة: جميع السكروز الحلول تحتاج لتتم تصفيته بعد solubilization باستخدام عامل تصفية 0.4 ميكرومتر موصول حقنه. ملاحظة أن 60% و 70% السكروز الحلول صعبة لجعل، وينبغي أن توضع في حمام مائي استعد مسبقاً عند 60 درجة مئوية لتسهيل سولوبيليزيشن. مزيج كل 10 دقائق حتى يذوب في السكروز تماما.- إعداد السكروز 25% وتزن 25 جرام سكروز وضبط الوزن 100 غرام بإضافة 10 مم كالانابيب (الرقم الهيدروجيني 7.2).
- إعداد السكروز 60% وتزن 60 غراما سكروز وضبط الوزن 100 غرام مع 10 مم كالانابيب (الرقم الهيدروجيني 7.2).
- إعداد حلول السكروز للتدرج السكروز. إعداد السكروز 40% التي تزن 40 غراما سكروز وضبط الحل إلى 100 غرام مع 10 مم كالانابيب (الرقم الهيدروجيني 7.2). وبالمثل، يعد 50% (w/w) و 70% (w/w) السكروز.
- تخزين الحلول عند-20 درجة مئوية. كن حذراً ريسوسبيند حلول السكروز بشكل صحيح بعد ذوبان الجليد.
- إعداد 100 مل العازلة تحلل بخلط 1 مم حبيس (pH 7)، مجكل 0.5 مم2، 1 NP-40 في المائة والحفاظ عليها في 4 درجات مئوية. دائماً إعداد الطازجة المخزن المؤقت هذا اليوم من هذه التجربة. إضافة أقراص مضادة مبطلات اليوم من عزلة مريكز.
- إعداد 1 × الفوسفات المالحة المخزن المؤقت (PBS) (الرقم الهيدروجيني 7.4) بخلط 8 غرام من كلوريد الصوديوم وز 2 من بوكل ز 1.44 غ2هبو40.24 ز خ2ص4 في 800 مل مقطر ح2O. ضبط الأس الهيدروجيني إلى 7.4 مع HCl. إحضار حجم الخليط إلى 1 L مع المقطر H2o.
2-عزل Centrioles رينهاردتي جيم
ملاحظة: انظر الشكل 1.
-
الثقافة وتوسيع نطاق من الخلايا رينهاردتي جيم
- وفي المساء في اليوم 1، تطعيم سلالة cw15- من صفيحة صلبة إلى ثقافة قارورة Erlenmeyer التي تحتوي على 10 مل 1 × الصنبور. تنمو الخلايا تحت مصابيح الفلورسنت الأبيض (60 µE/م2s) لمدة 2-3 أيام في 23 درجة مئوية.
- في يوم 3، تضعف ثقافة 10 x (إلى 100 مل) في س 1 اضغط وتنمو الخلايا تحت الضوء لمدة 2 – 3 أيام في 23 درجة مئوية.
- في يوم 6، تضعف ثقافة 10 x في 1 x اضغط للحصول على 1 لتر ثقافة. تنمو الخلايا تحت الضوء في 23 درجة مئوية حتى تصل إلى الثقافة لون أخضر داكن يشير بكثافة خلية تقريبي ~ 1 × 107 خلايا/مل26 (يوم 9-10).
-
تنقية رينهاردتي C. centrioles
- الطرد المركزي cw15- الخلايا في 600 x ز لمدة 10 دقائق في أنابيب مخروطية 50 مل. أغسل بيليه من خلايا س 1 مع 50 مل من س 1 برنامج تلفزيوني، وتدور في 600 x غ لأدنى 10 ريسوسبيند بيليه في 100 مل من درجة حرارة الغرفة العازلة ديفلاجيليشن مع ماصة.
- ديفلاجيلاتي الخلايا مع صدمة درجة حموضة بإضافة قطرات حمض الخليك 0.5 م ببطء إلى الرقم الهيدروجيني نهائي من 4.5 – 4.7 في محرض مغناطيسية واحتضان الخلايا لإضافة 2 كحد أدنى ببطء قطرات كوه ن 1 لاستعادة درجة الحموضة إلى 7.0.
- الطرد المركزي الخلايا في 600 x ز لمدة 10 دقيقة لإزالة أي سياط منفصلة. إزالة المادة طافية وتخزين بيليه على الجليد. أغسل بيليه 2 x مع 50 مل من برنامج تلفزيوني 1 x بريكوليد في 4 درجات مئوية. وبعد ذلك، تدور بيليه في 600 x ز لمدة 10 دقائق في 4 درجات مئوية.
- ريسوسبيند بيليه في 30 مل من س 1 برنامج تلفزيوني وتحميل التعليق على وسادة 25%-سكروز من 20 مل ببطء دون خلط (الشكل 1ب).
- تدور في 600 x ز لمدة 15 دقيقة عند درجة 4 مئوية لإزالة سياط المتبقية في المادة طافية؛ وتنتشر الخلايا في السكروز 25% (الشكل 1ج). الاحتفاظ فقط في الأسفل 20 مل (سهم أحمر، الشكل 1ج) بواسطة يسفط المادة طافية باستخدام الشافطة عناية.
- غسيل المتبقية 20 مل بإضافة 20 مل من برنامج تلفزيوني الباردة x 1. تدور العينة في 600 x ز لمدة 10 دقائق في 4 درجات مئوية. ريسوسبيند بيليه في 10 مل من برنامج تلفزيوني الباردة 1 x (في 4 درجات مئوية). تأكد من أن هناك لا كتل حتى تحلل التالية عدد مرات تصفح الموقع كافة الخلايا في وقت واحد.
- نقل بيليه ريسوسبينديد باستخدام زجاجة 250 مل جديدة. إضافة 100 مل من المخزن المؤقت تحلل تستكمل مع 000 5 وحدة من الدناز إلى الخلايا. من المهم إضافة المخزن المؤقت تحلل للخلايا، وليس العكس. احتضان المخلوط ح 1 في 4 درجات مئوية ومزجها بعناية بعكس الزجاجة كل 15 دقيقة دون تشكيل أي فقاعات.
- الطرد المركزي الخلايا ليسيد في 600 x ز لمدة 10 دقيقة في 4 درجات مئوية في أنبوب 50 مل مخروطية لإزالة أي حطام الخلايا. إذا تم أداؤه تحلل بشكل صحيح، يجب أن تكون بيليه خلية بيضاء (الشكل 1د). جمع المادة طافية مع ماصة وتحميلها على أنبوب أسفل جولة 30 مل تحتوي على وسادة سكروز 60%، على الجليد. ثم، تدور الأنبوب في 10,000 س ز لمدة 30 دقيقة في 4 درجات مئوية.
ملاحظة: عدة أنابيب مستديرة القاع (جدول المواد) قد تكون ضرورية، تبعاً لحجم المادة طافية. - نضح أعلى طافية إلى 1 مل فوق وسادة السكروز. ملاحظة الواجهة الصفراء 1 مل من المادة طافية المتبقية بين 2 مل من وسادة السكروز. مزيج بلطف السكروز والمادة طافية المتبقية مع تلميح P1000 قطع. عدم دوامة في هذه الخطوة؛ خلاف ذلك، يمكن أن تضيع بروسينتريوليس في هذه المرحلة. تجمع جميع السكروز الوسائد وتخزينها على الجليد.
- إعداد تدرج في المائة إلى 70 في المائة السكروز 40 في أنبوب البولي بروبلين مل 38.5 رقيقة الجدران بإضافة 3 مل سكروز 70% (عند 4 درجة مئوية)، تليها 3 مل من 50%، وأخيراً، 3 مل من محلول السكروز 40% بلطف. تحميل واجهات المجمعة على 40% إلى 70% السكروز التدرج؛ القيام بذلك ببطء لأن السكروز الباردة لزجة جداً. تحقيق التوازن بين الأنابيب مع المخزن المؤقت 10 مم كالانابيب (الرقم الهيدروجيني 7.2) والطرد المركزي لهم في س 68,320 ز (مثلاً، مع دوار SW32Ti) عن 1 ساعة و 15 دقيقة عند 4 درجة مئوية.
- جمع 12 × 500 ميليلتر الكسور في 4 درجات مئوية بجعل ثقب في الجزء السفلي من الأنبوب بإبرة 0.8 ملم دون الإخلال بطبقات مختلفة من السكروز. مع تلميح P200 قطع ماصة، إعداد إضافية مختبرين 10 ميليلتر من كل جزء التي سيتم استخدامها الفلورة التالية. الأداة الإضافية-تجميد الكسور في نيتروجين سائل.
ملاحظة: يمكن تحليل centrioles معزولة بالميكروسكوب الإلكتروني لضمان الحفاظ على أولتراستروكتوري العام centrioles.
3-تحديد مقدار Centrioles معزولة عن كوفيرسليبس: الطرد المركزي والفلوره
ملاحظة: انظر الشكل 2.
-
إعداد أنابيب وكوفيرسليبس
- استخدام أنبوب الجولة-أسفل الزجاج 1 (15 مل) كل جزء لتحليل الكسور سينتريولار (أنابيب 12 في المجموع).
- وضع محول دعم مخصص ساترة (يسمى محول الآخرة) في أنبوب أسفل المائدة المستديرة. ضع ساترة عقيمة 12 مم في أنبوب أسفل المائدة المستديرة.
ملاحظة: هنا كنا كوفيرسليبس 12 ملم، ولكن البروتوكول يمكن تكييفها كوفيرسليبس 18 ملم باستخدام أنابيب أسفل الجولة 30 مل. - إضافة 5 مل ليبرد قبل 10 مم كالانابيب (الرقم الهيدروجيني 7.2) في 4 درجات مئوية. تأكد من ساترة لا يتحرك ويبقى أسفل على المحول. وضع الأنابيب على الجليد.
-
الطرد المركزي من centrioles
- تمييع كل جزء 10 ميليلتر مع 100 ميليلتر من البرد 10 مم كالانابيب (الرقم الهيدروجيني 7.2). ريسوسبيند تمييع جيدا حتى الاختفاء التام السكروز (الشكل 2أ). تحميل كل جزء المخفف في أنبوب أسفل المائدة المستديرة.
- تدور الأنبوب في 10,000 س ز لمدة 10 دقيقة (مثلاً، مع دوار دلو يتأرجح شبيبة-13.1) في 4 درجات مئوية.
- استرداد ساترة بإدراج جهاز التوصيل المصنوعة يدوياً في حفرة موجودة في فترة زمنية محددة حافة المحول وأرفع بلطف.
ملاحظة: يمكن إجراء الجهاز التوصيل المصنوعة يدوياً مع إبرة حقنه مدمن مخدرات ومصبوب على عصا محلية صنع (أرقام 2B-2D) يدوياً. - عند الوصول إلى الجزء العلوي من الأنبوب القاع المستديرة، فخ حافة المحول مع إصبع القفاز وإزالة ساترة مع ملاقط. احرص على تذكر أي جانب من ساترة يحتوي على centrioles. المضي قدما لعلاج كوفيرسليبس الفلورة.
-
الفلورة تلطيخ والتصوير من عزل centrioles رينهاردتي جيم
ملاحظة: انظر الشكل 2.- إعداد المواد اللازمة الفلورة تلطيخ كما يلي.
- إعداد رف زجاج غطاء المصبوغة في مربع مختبر انتقال البوليستيرين كريستال (60 ملم في الطول من 50 ملم في العرض من 43 مم في الارتفاع). ملء مع 100 ٪ الميثانول وتخزينها في-20 درجة مئوية.
- إعداد دائرة رطبة. ولهذا الغرض، تجميع الدائرة الرطبة عن طريق وضع أنسجة هوميديفيد المياه جنبا إلى جنب مع الداخل حواف مربع صحن بتري (الشكل 2ه). إضافة قطعة من مختبر ختم التفاف (انظر الجدول للمواد) في وسط صحن بيتري الذي سيتم وضع خلطات جسم أثناء الإجراء الفلورة (الخطوات 3.3.2–3.3.3). تغطية الغطاء والغرفة الرطبة مع رقائق الألومنيوم لحمايتها من الضوء.
- إيمونوستين centrioles معزولة كالتالي.
- إصلاح كوفيرسليبس مع centrioles مباشرة بعد الطرد المركزي (الخطوة 3.2.4) التي تفرخ منهم لمدة 5 دقائق في المربع مليئة الميثانول-20 درجة مئوية (الخطوة 3.3.1.1).
- إزالة كوفيرسليبس بملاقط ومكان لهم في مربع مختبر شفافة (انظر الجدول للمواد) مليئة 50 مل من س 1 برنامج تلفزيوني وغسلها لمدة 5 دقائق في درجة حرارة الغرفة.
- "الماصة؛" 60 ميليلتر من مزيج الأجسام المضادة الأولية [الأجسام المضادة الأساسي المخفف في ألبومين المصل البقري 1% (BSA) و 0.05% 20 توين في برنامج تلفزيوني] على قطعة مختبر ختم التفاف في قاعة الرطبة. بعناية على عاتق كوفيرسليبس على رأس هذا المزيج جسم centrioles مباشرة تواجه الانخفاض. احتضان كوفيرسليبس لمدة 45 دقيقة مع الأجسام المضادة الأولية.
ملاحظة: هي الأجسام المضادة الأولية التي تم استخدامها لتوليد نتائج الممثل أرنب Bld12 [بولكلونل] (رافعة) والماوس α-توبولين (DM1A) (رافعة). - إزالة كوفيرسليبس وغسلها لمدة 5 دقائق في برنامج تلفزيوني 1 x، كما هو موضح في الخطوة 3.3.2.2. احتضان كوفيرسليبس لمدة 45 دقيقة مع الأجسام المضادة الثانوية في برنامج تلفزيوني يحتوي على جيش صرب البوسنة 1% و 0.05% توين-20.
ملاحظة: هي الأجسام المضادة الثانوية التي تم استخدامها لتوليد نتائج الممثل الماوس المضادة الماعز بالإضافة إلى أليكسا 488 (1:1، 000) وارنب المضادة الماعز بالإضافة إلى 568 أليكسا (1:1، 000). - إزالة كوفيرسليبس وغسلها لمدة 5 دقائق في برنامج تلفزيوني 1 x، كما هو موضح في الخطوة 3.3.2.2.
- جبل في كوفيرسليبس على شريحة زجاج بإضافة 3 ميليلتر من تصاعد المتوسطة على الشريحة ووضع بعناية كوفيرسليبس في أعلى (centrioles تواجه المتوسطة التركيب). ختم على حافة ساترة مع طلاء الأظافر.
- صورة centrioles معزولة في مجهر [كنفوكل] في 63 × الهدف النفط مع N.A. 1.4 أثناء تطبيق deconvolution27 (انظر الجدول للمواد).
ملاحظة: هنا، استخدام الإعدادات التالية هي: 500 – 545 نانومتر ل 488 أليكسا و 580-635 نانومتر ل 568 أليكسا.
- إعداد المواد اللازمة الفلورة تلطيخ كما يلي.
4-تركيز Centrioles في وسط كوفيرسليبس
ملاحظة: انظر الشكل 3.
-
إعداد المواد
- إعداد أنبوب 15 مل قاع مستديرة زجاج على الجليد، ومحول دعم مخصص ساترة (يسمى محول الآخرة، قدم ملف.stl التكميلية ملف 1)، مركزات مخصص (ملف.stl المقدمة التكميلية ملف 2)، ومم 10 كالانابيب (pH 7.2) في 4 درجات مئوية.
- تحضير بولي-د-يسين (PDL)-المغلفة كوفيرسليبس. تمييع 10 × 1 ملغ/مل PDL الحل الأسهم مع H2o. أولاً، أغسل كوفيرسليبس مع 70% EtOH وإزالة الإيثانول واسمحوا الجاف كوفيرسليبس. معطف كوفيرسليبس مع PDL واحتضانها لهم لمدة 30 دقيقة في درجة حرارة الغرفة. أغسل كوفيرسليبس 3 x مع المياه والسماح لهم الجافة.
ملاحظة: معطف كوفيرسليبس مع PDL زيادة عدد centrioles معزولة إرفاقه كوفيرسليبس.
-
الطرد المركزي
- ضع ساترة عقيمة 12 مم على راحة، ونهاية السفلي من مركزات، إبقاء PDL معطف facedown. كاب ساترة بوضع المحول مباشرة في أعلى. عكس أنبوب أسفل المائدة المستديرة ووضعه على مركزات وساترة، ومحول.
- بلطف دفع الفرقة مع الملقط حتى تصل إلى الجزء السفلي من الأنبوب أسفل المائدة المستديرة، وعكس الأنبوب. إضافة 10 مم كالانابيب العازلة (الرقم الهيدروجيني 7.2) إلى الأنبوبة المستديرة لأسفل حتى يأتي إلى الجزء العلوي من مركزات. تأكد من أن لا تبقى هناك أي فقاعات في الاسطوانة المركزية من مركزات.
- إضافة 100 ميليلتر من 10 مم كالانابيب العازلة (الرقم الهيدروجيني 7.2) بلطف إلى قاسمة واحد يحتوي على كسر مريكز المخصب ومزيج دقيق الحجم.
- إزالة 100 ميليلتر من 10 مم كالانابيب العازلة (الرقم الهيدروجيني 7.2) من مركز جوفاء من مركزات وإضافة 100 ميليلتر من الكسر سينتريولار المخصب في 10 مم كالانابيب العازلة (الرقم الهيدروجيني 7.2) إلى مركز جوفاء من مركزات، مع الحرص على أن تظل المحتويات في مركز جوفاء.
- الطرد المركزي في 10,000 س ز لمدة 10 دقيقة (مثلاً، مع دوار دلو يتأرجح شبيبة-13.1) في أجهزة الطرد مركزي يبرد قبل الساعة 4 درجات مئوية.
- إزالة مركزات مع ملاقط.
- استرداد ساترة بإدراج جهاز التوصيل المصنوعة يدوياً في حفرة موجودة في فترة زمنية محددة حافة المحول وأرفع بلطف. عند الوصول إلى الجزء العلوي من الأنبوب القاع المستديرة، فخ حافة المحول مع إصبع القفاز وإزالة ساترة مع ملاقط. احرص على تذكر أي جانب من ساترة تتضمن centrioles. المضي قدما لعلاج كوفيرسليبس الفلورة.
ملاحظة: يمكن إجراء الجهاز التوصيل المصنوعة يدوياً بإبرة حقنه مدمن مخدرات ومصبوب على عصا محلية صنع (أرقام 2B-د) يدوياً. - إجراء التثبيت وتلطيخ الفلورة من centrioles مركزة كما فعلت في الخطوة 3.3.2–3.3.4.
5-واحد الجسيمات في المتوسط
ملاحظة: انظر الشكل 4.
- التصوير للجسيمات واحد في المتوسط
- جبل ساترة على شريحة باستخدام وسيلة منتظمة يتلاشى لمكافحة تصاعد. تؤدي الإضاءة منظم مجهرية (2D SIM) التصوير باستخدام هدفا CFI أبوتشرومات TIRF (100 X، 1.49 نا، WD 0.12 ملم) والخلفي مضيئة الكاميرا "م اتفاقية مكافحة التصحر".
ملاحظة: تم تعيين وقت اكتساب 100 مللي ثانية في كاميرا قراءة من أصل 3 ميغاهيرتز. واستخدمت عدسة X 2.5 لتصوير سيم.
ملاحظة: مجموعة البيانات المقدمة هنا تم اقتناؤها في مجهر سيم ثلاثي الأبعاد (انظر الجدول للمواد). - صورة إشارة centrioles قبل الحصول على كومة كبيرة من الصور تضم مريكز الإجمالية، بإعداد موقف أعلى وأسفل Z-المكدس أعلاه وأدناه إشارة مريكز، على التوالي. المضي قدما في المشروع المكدس وتأدية الجسيمات واحد في المتوسط وفقا للخطوات 5.2 و 5.3.
- جبل ساترة على شريحة باستخدام وسيلة منتظمة يتلاشى لمكافحة تصاعد. تؤدي الإضاءة منظم مجهرية (2D SIM) التصوير باستخدام هدفا CFI أبوتشرومات TIRF (100 X، 1.49 نا، WD 0.12 ملم) والخلفي مضيئة الكاميرا "م اتفاقية مكافحة التصحر".
- إسقاط كدسة
- افتح المكدس الصورة مع إيماجيج. ثم انقر فوق '← رصات الصور ← المشروع Z'. قم بتعيين نوع الإسقاط اسمكثافة ماكس'.
- عكس الصورة بالنقر فوق 'تحرير ← عكس'. حفظ الإسقاط الذي تم إنشاؤه (تنسيق tif.).
- واحد-الجسيمات المحاذاة مع سسيبيون
- إنشاء مشروع جديد في سسيبيون عن طريق الضغط الأحمر '' منالمشروع إنشاءالزر في الجزء العلوي من الصفحة. في اللوحة اليمنى، انقر نقراً مزدوجاً فوق 'الواردات ← استيراد ميكروجرافس'.
- ملء 'دليل ملفات' و 'نمط' الحقول وفقا لدليل البيانات وأسماء. تبقى المعلمات الافتراضية. انقر على 'تنفيذ'.
- انقر نقراً مزدوجاً فوق 'الجسيمات ← الانتقاء ← xmipp3-دليل الانتقاء (الخطوة 1)'. انقر على أيقونة عدسة مكبرة مقربة من الحقل 'ميكروجرافس الإدخال' وحدد ميكروجرافس المستوردة من الخطوة 5.3.1. انقر على 'تنفيذ'.
- في النافذة المفتوحة حديثا، وتحديد جزيئات من ميكروجرافس مختلفة بالنقر فوقها. عند الانتهاء مع كل صورة مجهرية، انقر على الزر الأحمر على + تنسيق '.
- انقر نقراً مزدوجاً فوق 'الجسيمات ← استخراج ← xmipp3-استخراج جزيئات'. انقر على أيقونة عدسة مكبرة مقربة من الحقل 'إدخال إحداثيات' وتحديد إحداثيات المنتقاة من الخطوة 5.3.4. ملء 'مربع حجم الجسيمات (px)' وفقا لإبعاد الجسيمات. في علامة التبويب 'بريبروسيس' ، قم "إزالة الغبار": أي (ويمكن أن تولد التحف)؛ عكس النقيض: أي (خلفية الجزيئات السوداء، البيضاء)؛ مرحلة التقليب: لا (مرتبط بتصحيح لجنة الحقيقة والصداقة)؛ تطبيع: نعم.
- ثم انقر على 'تنفيذ'. عندما يتم إنجاز المهمة، تحقق من الجزيئات المستخرجة عن طريق تحديد المربع للوظيفة (الحدود تصبح أكثر سمكا) وانقر على 'تحليل النتائج (اليسار أسفل القائمة الرئيسية).
- انقر نقراً مزدوجاً فوق '2D ← xmipp3 ← محاذاة-محاذاة مع cl2d'. انقر على أيقونة عدسة مكبرة مقربة من الحقل 'إدخال جزيئات' وحدد الجزيئات المستخرجة من الخطوة 5.3.5. لا تستخدم صورة مرجعية. انقر على 'تنفيذ'.
- انقر نقراً مزدوجاً فوق 'محاذاة 2D ← ← xmipp3 ← المزيد-تطبيق المحاذاة 2d'. انقر على أيقونة عدسة مكبرة مقربة من الحقل 'إدخال جزيئات' وحدد محاذاة الجسيمات من الخطوة 5.3.7.
- انقر على 'تنفيذ' كما هو الحال في الخطوة 5.3.6. يمكن التحقق من النتائج بالنقر فوق 'تحليل النتائج' بعد اختيار مربع المهمة.
- انقر نقراً مزدوجاً فوق 'الجسيمات ← قناع ← xmipp3--تطبيق قناع 2d'.
- انقر على أيقونة عدسة مكبرة مقربة من الحقل 'إدخال جزيئات' وحدد محاذاة الجسيمات من الخطوة 5.3.9. تعيين 'قناع المصدر' إلى 'هندسة'. ثم تعيين معلمات القناع كنوع القناع: التعميم؛ دائرة نصف قطرها (px): ابحث عن أحد الجسيمات (مريكز) دون أي شيء حوله، انقر فوق 'عصا سحرية' رمز على اليسار الذي يفتح نافذة للمساعدة في العثور على قيمة الكمال؛ تحول مركز: لا (إذا كان يتم توسيط الجسيمات تماما) أو نعم (إذا كان يتم إزاحة الجسيمات)؛ إزاحة س-مركز: وفقا لموضع الجسيمات؛ إزاحة ص-مركز: وفقا لموضع الجسيمات. انقر على 'تنفيذ'.
- استخدم الزر 'تحليل النتائج' للتحقق إذا كان يتم تطبيق القناع بشكل صحيح. إذا لم يكن الأمر كذلك، انقر بالزر الأيمن على وظيفة 'تطبيق قناع 2d' وتحديد 'تحرير'. قم بتعديل المعلمات قناع (حجم و/أو التحولات) وتشغيل فإنه مرة أخرى مع 'تنفيذ' زر.
- انقر نقراً مزدوجاً فوق '← 2D Classify ← xmipp3-cl2d'.
- انقر على أيقونة عدسة مكبرة مقربة من الحقل 'إدخال جزيئات' وحدد الجسيمات ملثمون من الخطوة 5.3.11. ينبغي أن يكون عدد الصفوف للحصول على حوالي 50 الجسيمات في الصف الواحد. انقر على 'تنفيذ'.
- التحقق من النتائج بالنقر فوق الزر 'تحليل النتائج' . في النافذة المفتوحة، انقر فوق الرمز 'العين' بجوار "ما لإظهار".
- يسمح الإطار الجديد التفتيش على الفئات التي تم إنشاؤها عن طريق تحديد 'Classes2D' في القائمة 'الكتلة' . التحقق من المحتوى لكل فئة باختيار 'Class00N_Particles' في نفس القائمة. افحص كل فئة لتحديد تلك التي تحتوي على جزيئات سيئة فقط. العودة إلى طريقة العرض 'Classes2D' وحدد الفئات مع جزيئات جيدة بالنقر فوق كل منها. فمن الممكن لتحديد فئات عدة عن طريق الحفاظ على المفتاح 'Ctrl' الضغط أثناء التحديد.
- عندما تم تحديد كافة الفئات مع جزيئات جيدة، انقر على '+ جزيئات' لإنشاء مجموعة فرعية مع هذه الجسيمات.
- في نفس الإطار، حدد مجموعات قليلة من الفئات التي تمثل توجهات مختلفة من الجسيمات. إنشاء مجموعة فرعية جديدة بواسطة النقر فوق '+ المتوسطات'.
- لكل اتجاه/المتوسط المحدد، القيام بما يلي.
- انقر نقراً مزدوجاً فوق '2D ← xmipp3 ← محاذاة-محاذاة مع cl2d'.
- انقر على أيقونة عدسة مكبرة مقربة من الحقل 'إدخال جزيئات' وحدد الجسيمات جيدة من الخطوة 5.3.17. تعيين 'استخدام صورة مرجعية' إلى 'نعم'. انقر على أيقونة عدسة مكبرة مقربة من الحقل 'صورة مرجعية' وانقر على يسار السهم الأبيض للوظيفة 'إنشاء مجموعة فرعية' من الخطوة 5.3.18 وقم بتحديد الصورة استخدامها كمرجع. انقر نقراً مزدوجاً فوق كائن لفتحه في نافذة منفصلة، والاختيار الذي يعترض عليه. انقر على 'تنفيذ'.
- انقر نقراً مزدوجاً فوق 'محاذاة 2D ← ← xmipp3 ← المزيد-تطبيق المحاذاة 2d'. انقر على أيقونة عدسة مكبرة مقربة من الحقل 'إدخال جزيئات' وحدد محاذاة الجسيمات من خطوة 5.3.19.2.
- انقر على 'تنفيذ'.
- التحقق من نتيجة للمحاذاة ('تحليل النتائج)؛ وسوف تظهر الجسيمات الانحياز ومتوسط هذه الجسيمات.
- إذا كان المتوسط جيد والجسيمات جميعا التوجه بنفس الطريقة، حفظ المتوسط عن طريق النقر على 'متقدمة ← إيماجيج' وحفظ الصورة مع إيماجيج.
- إذا كان يمكن تحسين المتوسط، حدد كافة الصور الموجهة جيدا وإنشاء مجموعة فرعية جديدة باستخدام الزر '+ جزيئات' . نكرر الخطوات 5.3.19.1–5.3.19.4 حتى يتم تنظيف مجموعة فرعية (جميع سيئة الجسيمات إزالتها). في كل مرة يتم المحاذاة المنجز (الخطوة 5.3.19.2)، يتم تعيين المرجع إلى متوسط ولدت آخر (من التكرار للتكرار، الزيادات في متوسط الجودة).
النتائج
جيم-رينهاردتي "مريكز العزلة":
لعزل centrioles، cw15-نمت في الثقافة السائل لعدة أيام تحت ضوء الخلايا رينهاردتي C. والقريبون في وقت لاحق باستخدام الطرد المركزي في 600 x ز للخلايا بيليتيد 10 دقيقة تم غسلها x 1 مع برنامج تلفزيوني وحراكه في ديفلاجيليشن المخزن المؤقت قبل ديفلاجيليشن عن طريق إجراء صدمة الأس الهيدروجيني باستخدام حمض الخليك 0.5 M إلى الرقم الهيدروجيني نهائي من 4.5 – 4.7 لمدة 2 دقيقة(الشكل 1). واستخدم إضافة 1 ن كوه لاستعادة درجة الحموضة 7.0. فصل سياط منفصلة عن الهيئات الخلية، تم فصل الخلايا ديفلاجيلاتيد أولاً لإزالة الجزء الأكبر من سياط. بيليه ثم غسلها x 2 مع برنامج تلفزيوني وحراكه في 30 مل من برنامج تلفزيوني قبل تحميله ببطء على وسادة 25%-سكروز (الشكل 1ب). وكان نسج الأنبوب في 600 x ز لمدة 15 دقيقة عند 4 درجة مئوية لإزالة معظم سياط منفصلة. بعد الطرد المركزي، الهيئات الخلية التي كانت تنتشر في وسادة السكروز (الشكل 1ج) واستردادها عن طريق إزالة حوالي 30 مل من المادة طافية (حتى السهم الأحمر في الشكل 1ج). ثم حراكه في 20 مل من برنامج تلفزيوني الباردة 20 مل الناتجة من الخلايا غسلها وفصل في 600 x ز لمدة 10 دقائق. بعد ذلك، تم تجاهل المادة طافية، وكانت حراكه الخلايا تماما في 10 مل من برنامج تلفزيوني. نقل الخلايا إلى زجاجة 250 مل وتحلل المخزن المؤقت تمت إضافتها إلى الخلايا ريسوسبينديد في وقت واحد. إضافة إلى تحلل الدناز والمحتضنة ح 1 في 4 درجات مئوية. بعد خطوة الطرد المركزي لإزالة الحطام الخلية (انظر بيليه الأبيض في الشكل 1د)، تم جمع المادة طافية وتحميلها بعناية على وسادة سكروز 60% 2 مل قبل الطرد المركزي في 10,000 س ز لمدة 30 دقيقة في 4 درجات مئوية. لاحظ أنه بالنسبة 100 مل تحلل، استخدمت أنابيب 8 من 15 مل للقيام بهذه الخطوة، تناظر 12.5 مل من المخزن المؤقت تحلل تحميل في 2 مل سكروز كل أنبوب. بعد الطرد المركزي، تمت إزالة معظم المادة طافية يصل إلى 1 مل فوق وسادة. 1 مل من المادة طافية المتبقية ثم جمعها مع وسادة 2 مل وثم مختلطة وتجميعها للحصول على وحدة تخزين نهائي لمل 24. ثم تم تحميل التجمع اليوم 40%، 50%، 70%-السكروز التدرج ونسج في س 68,320 ز ح 1 و 15 دقيقة في 4 درجات مئوية. وأخيراً، جمعت centrioles معزولة بثقب في الجزء السفلي من الأنبوب الطرد المركزي باستخدام إبرة وتم جمع القطرات في 12 × 500 ميليلتر الكسور. بسبب كثافة عالية من السكروز مختلفة، شكلت الانخفاض ببطء شديد في البداية (السكروز 70%)، ومن ثم أكثر سرعة (السكروز 40%).
الفلورة Centrioles معزولة
لتقييم نوعية إجراءات العزل، ثم كان تثفيل 10 ميليلتر لكل جزء الانحدار التي تم جمعها إلى ساترة استخدام محول دعم ساترة (الشكل 2A-2D). الأهم من ذلك، لإزالة بأمان ساترة، وقد صمم جهاز التوصيل مخصص (الشكل 2ب). بعد ذلك، حللت كوفيرسليبس واسطة الفلورة. واستخدمت في هذه الدراسة يشير إلى وجود هيكل عجلة العربة و α-توبولين (DMA1) لتسليط الضوء على الجدار سينتريولار أجسام مضادة ضد CrSAS-6(Bld12p). عد عدد centrioles التي كانت إيجابية بالنسبة كرساس-6 و α-tubulin كل مجال الرؤية وثم حساب إجمالي عدد centrioles كل الكسور، كان من الممكن لتحديد الكسور التي كانت إثراء لعزل centrioles ( الشكل 2 واو-ح 2). من المثير للاهتمام، كانت أثري الكسور 6 ل centrioles (الشكل 2 واو ز 2، الكسور #1 – 6)، مع ذروة للكسر #3، بينما كسور الأخير لم تكن، مشيراً إلى أنه يعمل التنقية. علما أن 95% centrioles مجموع في هذه التجربة خاصة، كانت إيجابية كرساس-6 و α-tubulin في كسر #3. يشير هذا إلى أن centrioles الأكثر عزلة الاحتفاظ بهم كارتوهيلس. إذا لوحظ لا إثراء centrioles في كسور الأولى، لم تنجح إجراءات العزل وينبغي تكراره. لاحظ أنه يمكن ملاحظة بعض القطع فلاجلر معظمها في كسور تخلو من centrioles.
المقبل، لحساب إجمالي عدد centrioles كل ميليلتر، ينبغي أن تضاعف عدد مريكز كل مجال الرؤية بالنسبة المبينة في الشكل 2ح. ثم تقسم الرقم الناتج بحجم الكسر المستخدمة الفلورة للحصول على عدد centrioles كل ميليلتر. في هذا الإجراء عزلة خاصة، الوارد الكسر المخصب الأكثر centrioles حوالي 37 لمنطقة 0.00846 مم2 (مع مجال رؤية من 92 × 92 ميكرومتر2). وكان سطح المقطع أنبوب 7.5 ملم في دائرة نصف قطرها بإجمالي مساحة 176 مم2. كانت النسبة المقابلة ثم 176/0.00846 = 20,803.8، لذا ما مجموعة centrioles 769,740 (37 × 20، 803.8) في 10 ميليلتر. ولذلك، كان عدد centrioles في 1 ميليلتر 76,974.
تركيز Centrioles المعزولة في كوفيرسليبس:
زيادة عدد centrioles كل حقل يزيد من فرصة للكشف عن اتجاه مريكز لا لبس فيها، فضلا عن زيادة فرصة للكشف عن التوجهات المماثلة التي يمكن استخدامها لزيادة إجراءات حساب المتوسطات الجسيمات. كما لا تزال متناثرة في ساترة centrioles من الكسور تتركز، قمنا بتطوير ملحق الطرد المركزي لتركيز centrioles في وسط ساترة (الشكل 3أ) اسمه مركز. لاحظ أن ملف.stl مع التدابير المحددة للطباعة ثلاثية الأبعاد يتم توفيرها مع هذه المخطوطة.
أولاً، قد شنت ساترة واحدة من 12 ملم على مركزات (الشكل 3ب). المحول وضعت على رأس ساترة وأنبوب أسفل المائدة المستديرة كان مقلوب ووضعها فوق محول تجميعها والمكثف. أنبوب أسفل المائدة المستديرة كان ثم بلطف مقلوب، مما يسمح لتحميل العينة (الخطوة 4، 2 منالبروتوكول ). ثم كانت تثفيل في centrioles في 10,000 س ز لمدة 10 دقائق في 4 درجات مئوية. وبعد ذلك تعرضوا الفلورة centrioles والملون كرساس-6/Bld12p و α-tubulin (الشكل 3-3E). الأهم من ذلك، دون مركزات، centrioles حوالي 30 شوهدت كل مجال الرؤية (الشكل 3ج)، بينما شوهدت 183 centrioles كل مجال الرؤية عندما كان مركزات المستخدمة (الشكل 3D-3F). علما بأن centrioles تغطي فقط قرص من 4 مم في القطر في منتصف ساترة. هذه النتيجة تبين أن هذه الخطوة تركيز يعمل ويسمح إثراء 6-fold centrioles في منطقة محددة من كوفيرسليبس، وبالتالي تخفيف الكشف عنها والتصوير.
واحد-الجسيمات الفلورية المتوسط لعزل جيم-رينهاردتي Centrioles:
هنا، باستخدام الفحص المجهري سيم أنه يمكن التوصل إلى حل لحوالي 120 نانومتر، centrioles الملون لتعديل توبولين في ميكروتوبوليس سينتريولار، مونوجلوتاميلاتيد توبولين (GT335، الرقم 4)، كانت المصورة24. رينهاردتي C. centrioles هي حوالي 500 نانومتر طويلة، دائماً في أزواج، وكثيراً ما وجدت مع المرتبطة وحديثا تكرار الهيئات بروباسال (المشار إليها بروسينتريوليس أدناه) و striated الألياف المرتبطة ميكروتوبولي19. ولذلك، كان هذا التجميع النهائي حوالي 1 ميكرومتر كبيرة. لهذا السبب، ومن أجل صورة centrioles في مجملها، نوصي بالحصول على كدسة Z في centrioles معزولة.
هنا، بعد اكتساب، تم إنشاء صورة نهائية عن طريق إجراء إسقاطات أقصى كثافة استخدام ImageJ28 (الصورة/رزمة/Z المشروع/ماكس كثافة الإسقاط، الشكل 4ب). من مثل هذه الصور، أجرى تحليل واحد-الجسيمات استخدام برامج الفحص المجهري الإلكترون البرد جعل فئات centrioles مع توجهات مماثلة، ومن ثم حساب متوسط أجرى. للقيام بذلك، وكان لون الصورة مقلوب أولاً بغية تحسين تصور الكائنات (الشكل 4ج). اختار centrioles يدوياً في مربع تتوسط كل الجسيمات باستخدام البرمجيات Scipion متاحة بحرية29 أن يدمج العديد من البرامج الميكروسكوب الإلكتروني مثل Xmipp3 (الشكل 4د). علما بأن حجم المربع وقد ليتم تعريفها من قبل المستخدم. هنا، المربعات 50 × 50 بكسل لحجم بكسل 31.84 استخدمت شمال البحر الأبيض المتوسط. بعد ذلك، كانت جميع الجزيئات المستخرجة (الشكل 4ﻫ) ومحاذاتها باستخدام Xmipp3 (الشكل 4و). بعد ذلك، تم تطبيق قناع دائرية 12 بكسل في دائرة نصف قطرها لعزل كل مريكز من سينتريولار-الزوج (الشكل 4ز). ثم تم تصنيف الجسيمات، باستخدام Xmipp3، لتوليد عدة متوسطات. وأبقى فقط المتوسطات فئة متجانسة، بمعنى أن الجزيئات التي تحيد عن المتوسطات فئة مستبعدة يدوياً. وتكررت هذه الخطوة بغية توليد بمتوسط شبه مثالية لكل التوجه الذي تم اختياره. بعد خمسة تكرارات، تولدت فئتان من المتوسطات: عرض طريقة عرض أعلى من الكائنات 63 (الشكل 4ح) وجانب من جزيئات 98 (الشكل 4أنا) مونوجلوتاميلاتيد centrioles. وتحددت أبعاد الكائن بقياس المسافة بين القمم للتشكيل الجانبي كثافة الأرض على طول إشارة مونوجلوتاميليشن.
الأهم من ذلك، هو طول متوسط فئة عرض الجانب 260 nm يبلغ قطرها 250 نانومتر، قابلة للمقارنة إلى إشارة tubulin مونوجلوتاميلاتيد المقاس الذي يظهر إلى ترجمة إلى منطقة من 286 ± 33 شمال البحر الأبيض المتوسط في الطول داخل نواة مريكز17.
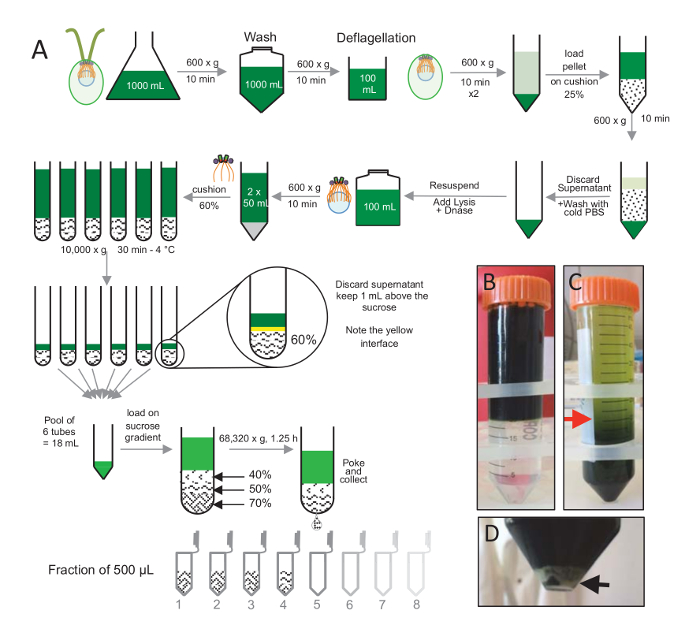
الشكل 1 : تنقية جيم-رينهاردتي centrioles. (أ) هذا تمثيل تخطيطي لكل خطوة تؤدي إلى عزل رينهاردتي C. centrioles. أنه يتضمن خطوات الممثل (ج) لبروتوكول (ب) قبل وبعد الطرد المركزي على التدرج 25%-السكروز. يشير السهم الأحمر في لوحة ج إلى حجم الحد الأدنى للحفاظ على بعد الطرد المركزي. (د) هذا الفريق يظهر بيليه الأبيض لتفكيك الخلايا بعد الطرد المركزي. السهم الأسود يشير إلى بيليه. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
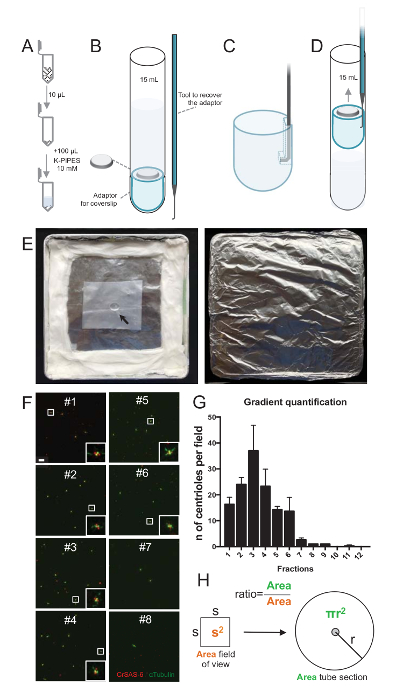
الشكل 2 : الإعداد الطرد المركزي لأداء الفلورة على عزل centrioles. (A) 10 ميليلتر لكل جزء المجمعة هو المخفف أولاً في 100 ميليلتر من 10 مم كالانابيب (الرقم الهيدروجيني 7.2). (ب) هذا تمثيل تخطيطي لأجهزة الطرد المركزي، تشمل أنبوب أسفل جولة 15 مل، ساترة 12 مم، محول ساترة، وجهاز التوصيل مصنوعة خصيصا لاسترداد ساترة بعد الطرد المركزي. لوحات C و D إظهار الرسومات التي تشرح كيفية استعادة ساترة بعد الطرد المركزي. (ج) مكان الأداة مدمن مخدرات في حفرة موجودة في فترة زمنية محددة حافة محول و (د) سحب بلطف. (ﻫ) هذه صور لقاعة الرطبة اللازمة للقيام بتصوير الفلورة. يشير السهم إلى ساترة 12 مم. (و) هذه الصور [كنفوكل] الممثل في 63 X (تكبير 2) للكسور التدرج #1-8، التي تم جمعها خلال عملية التنقية والملون كرساس-6 (أحمر) و α-tubulin (أخضر). وتناظر insets المنطقة أشارت إلى جانب مربع أبيض في آراء التكبير أقل. شريط المقياس = 10 ميكرون. (ز) هذا الرسم بياني الذي يمثل عدد centrioles الإيجابية كرساس-6 و α-tubulin كل مجال الرؤية في كل جزء. ملاحظة في الإثراء في الكسور #1-6. متوسط عدد centrioles كل حقل في كل جزء: #1 = ± 16.3 4.7، #2 = ± 24.0 4.6، #3 = ± 37.0 17.0، #4 = 23.3 ± 11.4، #5 = 14.3 ± 2، 1، #6 = 13.7 ± 9.3، #7 = 2.7 ± 1، 2، #8 = ± 1.0 0.0، #9 = ± 1.0 0.0، #10 = ± 0.0 0.0، #11 = ± 0.3 0.6، #12 = 0.0 ± 0.0. لكل جزء، تم تصويرها 3 حقول عشوائية. لاحظ أنه عند حساب الكسر المخصب الأكثر #3، وجدنا أن 95% centrioles إيجابية كرساس-6 و α-tubulin (n = 205 centrioles). (ح) نسبة عدد centrioles موجودة في منطقة ميكروجرافس قياس يستخدم لحساب العدد الإجمالي ل centrioles الحالية في مجال الأنبوب. ويمكن حساب عدد مريكز كل ميليلتر من الكسور 10 ميليلتر تثفيل أصلاً. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
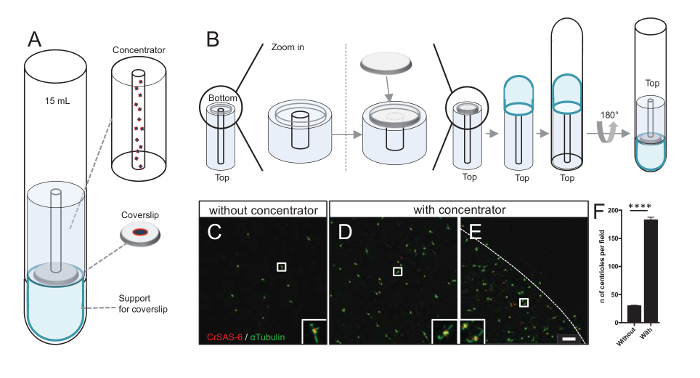
الشكل 3 : هي تثفيل centrioles المعزولة باستخدام مركزات. (أ) هذا الفريق يظهر أجهزة الطرد المركزي اللازمة لتركيز centrioles على كوفيرسليبس قبل الفلورة، بما في ذلك أنبوب أسفل جولة 15 مل ومركز وساترة 12 مم وجهاز محول دعم. (ب) هذا الفريق يوضح الخطوات لتجميع جهاز الطرد المركزي. لوحات ج-ه تظهر الصور [كنفوكل] من centrioles ملطخة مركزات كرساس-6 (أحمر) و α-tubulin (الأخضر) (ج) دون أو (د-ه). وتناظر insets المنطقة أشارت إلى جانب مربع أبيض في آراء التكبير أقل. شريط مقياس من 10 ميكرون. علما أن centrioles هي أثري في منتصف ساترة (خط منقط يمثل حدود منطقة مركزة). (و) هذا الرسم البياني تمثل عدد centrioles كل مجال الرؤية دون ومع مركزات. وجرى تحليل خمسة حقول نظر عشوائية. هو متوسط عدد centrioles، دون مركزات، 29.8 ± 2.9، ومع المكثف، ± 182.6 11.5، ف < 0.0001. كان تقييم الدلالة الإحصائية مزاوج تي-اختبار. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
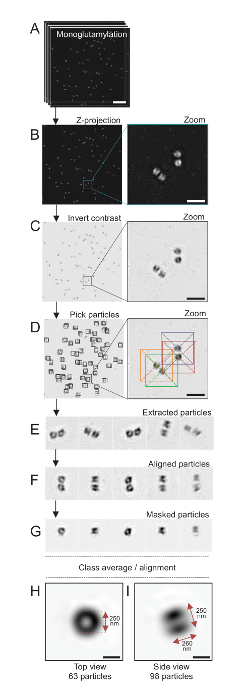
الشكل 4 : جسيم واحد في المتوسط في عزلة جيم-رينهاردتيي centrioles. (أ) هذا الفريق صور المكدس يظهر Z centrioles ملطخة GT335 واكتسب استخدام مجهر سيم. (ب) إظهار هذه الألواح إسقاطاً Z شدة قصوى لصور مكدسة. مقياس بار = 1 ميكرومتر. (ج) تظهر هذه اللوحات صورة ممثل مع تباين مقلوب. ويمثل اقحم تكبير في تصور centrioles أفضل. (د) هذه الجسيمات تظهر لوحات الانتقاء. اقحم يبين كيف تم انتقاء الجزيئات. (ﻫ) وهذه أمثلة من 5 استخراج الجسيمات. (و) هذا الفريق يظهر الجسيمات بعد المحاذاة. (ز) هذا الفريق يظهر الجسيمات بعد تطبيق قناع. تظهر لوحات ح ، و هما فئة المتوسطات: عرض (ح) أعلى (الجسيمات 63) و (أنا) وجهة نظر جانب (الجسيمات 98). السهم المزدوج يشير إلى أبعاد إشارة GT335. شريط المقياس = 250 نيوتن متر. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
الملف التكميلي 1. اضغط هنا لتحميل هذا الملف.
الملف التكميلي 2- اضغط هنا لتحميل هذا الملف.
Discussion
أحد التحديات في مجال البيولوجيا فك التعريب الدقيق للبروتينات في سياق معمارية. مريكز بنية مثالية لتطبيق هذه الأساليب، كما درست الهندسة المعمارية استخدام التصوير المقطعي الإلكترون البرد، تكشف عن ملامح ultrastructural مثيرة للاهتمام على طوله. ومع ذلك، بسبب أبعادها قريبة من حد القرار بالمجهر الضوئي، من الصعب دقة ترجمة بروتين من الفلورة إلى منطقة مريكز استخدام المجاهر التقليدية30الفرعية هيكلية.
يقتصر القرار في المجهر الضوئي من حيود الضوء الذي يعطي، تقريبا، قرارا أقصى أفقي من 200 نانومتر في المجهر الضوئي24. ومع ذلك، قد هذا الحد تجنبت بواحدة من كبرى إنجازات السنوات ال 20 الماضية في المجهر الضوئي: اختراع أساليب القرار فائقة. هذه النهج يمكن الصورة خارج حدود حيود في قرارات مختلفة: 120 نانومتر سيم حوالي 50 نانومتر ليحث إذاعة استنزاف (STED) و 20 – 40 نانومتر للتعريب جزيء واحد مجهرية (سملم)24. مع هذه التطورات الجديدة من الفحص المجهري القرار فائقة، قابلة المناطق الفرعية الهيكلية من مريكز. ومع ذلك، في الممارسة العملية، ما زال من الصعب تحديد دقة التعريب من البروتين لعنصر هيكلي للسبب الرئيسي في أن centrioles ناضجة موجودة في نسخ 2 فقط لكل خلية والتوجهات العشوائية، مما يجعل تفسير الترجمة الصعبة. لهذا السبب، تم بروتوكول إنشاء الذي يسمح للباحثين صورة فائقة القرار عدد كبير من centrioles، زيادة فرصة لمراقبة التوجهات غير غامضة. الأهم من ذلك، حيث يعتمد هذا الأسلوب على استخدام centrioles معزولة، ونحن نقدم وسيلة لتنقية سليمة رينهاردتي C. centrioles التي تحتوي على centrioles ناضجة وبروسينتريوليس.
وأخيراً، نظراً لمجموعة التوجهات مريكز التي يمكن تصويرها بهذا البروتوكول، تحليل الجسيمات واحد يمكن تطبيقها استخدام البرمجيات الميكروسكوب الإلكتروني. ينتج عن هذا الجيل من متوسط فئات centrioles في اتجاه معين. الأهم من ذلك، يمكن استخدام هذه الصور 2-د الناتجة ثم تقييم التعريب بروتين محددة على طول مريكز. وفي الواقع، هذا الأسلوب يمكن تطبيقها على الصور ذات الدقة الفائقة المزدوج-لون، ويمكن استخدام لون واحد للكشف عن مريكز هيكل عظمى (مثلاً، توبولين)، في حين الألوان الأخرى يمكن أن يعزى إلى بروتين سينتريولار محددة. عن طريق طرح المتوسطات التي تم الحصول عليها مع لون واحد أو لونين، يصبح من الأسهل لتسجيل نسبة بروتين على طول مريكز (الدانية أو المركزية أو البعيدة). علما أنه ينبغي مواءمة القناتين بدقة لمنع أي تفسيرات مضللة. وعلاوة على ذلك، سوف تساعد المتوسطات لآراء كبار فك إذا كان بروتين يموضع داخل التجويف سينتريولار، على طول الجدار microtubule، أو خارج مريكز.
ويمتاز هذا الأسلوب للتأكد من إضفاء الطابع المحلي على البروتينات المحددة التي يمكن أن تكون صعبة لتعريب خلاف ذلك بسبب العلامات غير متجانسة. نلاحظ أن أساليب أخرى لتعيين البروتينات داخل centrioles قد وصف في الارتباطية سيم/سملم ثلاثي الأبعاد مع، على سبيل المثال، تقييم توجهات محددة centrioles بتحديد الشخصية اهليلجية علامة تشكيل الحيد حول مريكز بتصوير سيم. تستخدم هذه المعلمة، من الممكن ترجمة البروتين بدقة من 4 – 5 نانومتر30. لاحظ أيضا أن يستخدم الأسلوب الموصوفة هنا centrioles معزولة مع سليمة بروسينتريوليس، إشارة إلى أن بنية مريكز الأكثر احتمالاً يحافظ إلى حد كبير. ومع ذلك، لا يمكننا أن نستبعد أن بعض المعالم المعمارية باﻻنزعاج أثناء تنقية، مثل قطر مريكز متفاوتة مع تركيز الكاتيونات divalent كما تتضخم مع عزلة centrosome البشرية5.
واحدة من الخطوات الحاسمة للبروتوكول المعروضة هنا الحصول على مركزة بما فيه الكفاية centrioles معزولة في توجهات مختلفة قابلة لقطع-سبأ. للقيام بذلك، تأكد أولاً من النقاء وكفاءة إجراءات العزل مريكز. تركيز منخفض من centrioles معزولة يمنع التصوير السليم والاستمرار في معالجة الصورة. لهذا الغرض، ونحن نقدم وسيلة لإثراء عدد centrioles كل مجال الرؤية. اعتماداً على عدد centrioles في الكسر المستخدمة، ينبغي تعديل وحدة التخزين المحملة في مركزات، مع وحدة تخزين كحد أقصى من 250 ميليلتر.
الأهم من ذلك، أن هذا الأسلوب قد وضعت لجدار الخلية ناقص الخلايا رينهاردتي cw15--جيم . في هذه السلالة، هشاشة جدار الخلية يسمح تحلل سليم للخلايا، ومن ثم تحرير المحتوى الخاص به. هذا البروتوكول ليس من الكفاءة للبرية من نوع C. رينهاردتي الخلايا، كما يمنع جدار الخلية تحلل سليم. الاستراتيجيات البديلة مثل سونيكيشن أو حضانة قبل الخلايا مع أوتوليسين، إنزيم يمكن أن تتحلل في جدار الخلية31، يتعين أن توضع بتغيير الخلية جدار قبل تطبيق البروتوكول العزلة المعروضة هنا.
يمكن استخدام هذا الإعداد مع أنواع مختلفة من المجاهر، تتراوح بين المجاهر التقليدية [كنفوكل] المجاهر القرار فائقة الإنتاجية العالية مخصصة. لاحظ أن عند القيام سملم، المخزن مؤقت خاص المطلوب للتصوير السليم، وهكذا، ينبغي أن تستخدم غرفة مكيفة ساترة 12 مم مع المخزن المؤقت على رأس ساترة. سيتم إجراء تصوير اللاحقة مع المجهر المقلوب. إذا كان لا يسمح بتركيب المجهر ساترة 12 مم، يمكن تطبيقها البروتوكول المعروضة هنا على كوفيرسليبس 18 ملم باستخدام أنبوب أسفل جولة 30 مل ومحول تم التعديل والمكثف. كما أن من المهم ملاحظة أن نوعية إعادة إعمار سملم النهائي سيتوقف على النوعية لتلطيخ وجسم الأولية المستخدمة، فضلا عن طريقة التثبيت.
وباختصار، نحن نقدم أسلوب التي يمكن تطبيقها على الصورة التي أعقبت centrioles العديد من فلوو-سبأ التي سوف تولد متوسطات centrioles في التوجهات المختلفة، مما يساعد على ترجمة البروتين سينتريولار بدقة. الأهم من ذلك، يمكن تطبيق هذا الأسلوب أكثر عموما centrioles معزولة من الأنواع الأخرى، العضيات الأخرى، أو جمعيات الجزيئات الكبيرة. وأخيراً، نهج إعداد عينة المعروضة هنا، جنبا إلى جنب مع تطوير خوارزمية الأخيرة لتحليل واحد-الجسيمات الفلورية سملم البيانات32، يمكن أن تفتح المزيد من تحسين في الخرائط الجزيئية الكبيرة الجزيئات التجميعات.
Disclosures
الكتاب ليس لها علاقة بالكشف عن.
Acknowledgements
ونشكر بيير Gönczy وبيويماجينج والبصريات منصة (بيوب) في مدرسة البوليتكنيك Fédérale دي لوزان، لوزان، سويسرا، حيث تم اقتناء صور سيم centrioles. كلنا نيكولاي ودافيدي جامباروتو معتمدة من قبل مجلس البحوث الأوروبي (ERC) ابتداء منح (الجنيه الاسترليني) 715289 (تمييز) وجينك Le Maeva، بول كيشار، والفرنسية فيرجيني هامل من PP00P3_157517 مؤسسة العلوم الوطنية السويسرية (سنسف). سوزان بورجيرس معتمد من قبل جامعة جنيف.
Materials
| Name | Company | Catalog Number | Comments |
| Mouse monoclonal anti-apha tubulin (clone DM1A) | Abcam | ab7291 | dilution 1:300 |
| DNaseI | Roche | 10104159001 | |
| 12 mm coverslips | Roth | YX03.1 | |
| 18 mm coverslips | Roth | LH23.1 | |
| K2HPO4 | Fluka | 60355 | |
| KH2PO4 | Fluka | 60230 | |
| Tris base | Biosolve Chimie SARL | 0020092391BS | |
| acetic acid | Carlo Erba Reagents | 524520 | |
| NH4Cl | Sigma | A-4514 | |
| CaCl2 | Sigma | C-7902 | |
| MgSO4 | Sigma | 63140-500G-F | |
| steritop filter | Millipore | SCGPT05RE | |
| sucrose | Sigma | S7903-1KG | |
| HEPES | AppliChem PanReac | A3724,0250 | |
| PIPES | Sigma | P6757-500G | |
| MgCl2 | ACROS ORGANICS | 197530010 | |
| NP-40 | AppliChem PanReac | A1694,0250 | |
| Round-bottom (Kimble) tubes 15 mL | Fisherscientific | 09-500-34 | |
| Round-bottom (Kimble) tubes 30 mL | Fisherscientific | 09-500-37 | |
| cover glass staining rack | Thomas scientific | 8542E40 | |
| crystal polystyrene transmission lab box | FISHERS | 11712944 | |
| Methanol | VWR | 20864.32 | |
| BSA | Roche | 10735086001 | |
| Triton X100 | Roth | 3051.3 | |
| goat anti-mouse coupled to Alexa 488 | invitrogen | A11029 | dilution 1:1,000 |
| goat anti-rabbit coupled to Alexa 568 | invitrogen | A11036 | dilution 1:1,000 |
| mounting medium | abcam | ab188804 | |
| Tube, thinwall polypropylene | Beckman Coulter | 326823 | |
| Poly-D-Lysine 1 mg/mL | SIGMA | A-003-E | |
| Mouse monoclonal anti-Polyglutamylation modification mAb (GT335) | Adipogen | AG-20B-0020 | dilution 1:1,000 |
| glycerol mounting medium with DAPI and DABCO | Abcam | ab188804 | |
| 50 mL conical tubes | Falcon | 14-432-22 | |
| Eppendorf 5810R centrifuge | Eppendorf | 5811000622 | |
| Beckman JS-13.1 swinging bucket rotor | Beckman Coulter | 346963 | |
| Beckman SW 32Ti rotor | Beckman Coulter | 369694 | |
| parafilm | Bemis | 13-374-10 | |
| Leica TCS SP8 with Hyvolution mode | Leica | ||
| OSRAM L18W/954 LUMILUX | Luxe Daylight/ OSRAM | ||
| Whatman filter paper | Sigma | WHA1001325 | |
| CrSAS-6/Bld12 antibody | dilution 1:300 (Hamel el al., 2014) | ||
| Scipion | http://scipion.i2pc.es/ | ||
| EM CCD camera (Andor iXON DU897) | Andor |
References
- Bornens, M. The centrosome in cells and organisms. Science. 335 (6067), 422-426 (2012).
- Nigg, E. A., Holland, A. J. Once and only once: mechanisms of centriole duplication and their deregulation in disease. Nature Reviews Molecular Cell Biology. 19 (5), 297-312 (2018).
- Nigg, E. A., Raff, J. W. Centrioles, centrosomes, and cilia in health and disease. Cell. 139 (4), 663-678 (2009).
- Gönczy, P. Towards a molecular architecture of centriole assembly. Nature Reviews Molecular Cell Biology. 13 (7), 425-435 (2012).
- Paintrand, M., Moudjou, M., Delacroix, H., Bornens, M. Centrosome organization and centriole architecture: their sensitivity to divalent cations. Journal of Structural Biology. 108 (2), 107-128 (1992).
- Winey, M., O'Toole, E. Centriole structure. Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 369 (1650), (2014).
- Dippell, R. V. The development of basal bodies in paramecium. Proceedings of the National Academy of Sciences of the United States of America. 61 (2), 461 (1968).
- Allen, R. D. The morphogenesis of basal bodies and accessory structures of the cortex of the ciliated protozoan Tetrahymena pyriformis. The Journal of Cell Biology. 40 (3), 716-733 (1969).
- Li, S., Fernandez, J. -. J., Marshall, W. F., Agard, D. A. Three-dimensional structure of basal body triplet revealed by electron cryo-tomography. The EMBO Journal. 31 (3), 552-562 (2012).
- Guichard, P., Chrétien, D., Marco, S., Tassin, A. -. M. Procentriole assembly revealed by cryo-electron tomography. The EMBO Journal. 29 (9), 1565-1572 (2010).
- Guichard, P., et al. Native architecture of the centriole proximal region reveals features underlying its 9-fold radial symmetry. Current Biology. 23 (17), 1620-1628 (2013).
- Hirono, M. Cartwheel assembly. Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 369 (1650), (2014).
- Bornens, M., Paintrand, M., Berges, J., Marty, M. C., Karsenti, E. Structural and chemical characterization of isolated centrosomes. Cell Motility and the Cytoskeleton. 8 (3), 238-249 (1987).
- Keller, L. C., Romijn, E. P., Zamora, I., Yates, J. R., Marshall, W. F. Proteomic analysis of isolated chlamydomonas centrioles reveals orthologs of ciliary-disease genes. Current Biology. 15 (12), 1090-1098 (2005).
- Kilburn, C. L., et al. New Tetrahymena basal body protein components identify basal body domain structure. The Journal of Cell Biology. 178 (6), 905-912 (2007).
- Bauer, M., Cubizolles, F., Schmidt, A., Nigg, E. A Quantitative analysis of human centrosome architecture by targeted proteomics and fluorescence imaging. The EMBO Journal. 35 (19), 1-15 (2016).
- Hamel, V., et al. Identification of Chlamydomonas Central Core Centriolar Proteins Reveals a Role for Human WDR90 in Ciliogenesis. Current Biology. 27 (16), 2486-2498 (2017).
- Cavalier-Smith, T. basal body and flagellar development during the vegetative cell cycle and the sexual cycle of Chlamydomonas reinhardii. Journal of Cell Science. 16 (3), 529 (1974).
- Geimer, S., Melkonian, M. The ultrastructure of the Chlamydomonas reinhardtii basal apparatus: identification of an early marker of radial asymmetry inherent in the basal body. Journal of Cell Science. 117, 2663-2674 (2004).
- Nakazawa, Y., Hiraki, M., Kamiya, R., Hirono, M. SAS-6 is a cartwheel protein that establishes the 9-fold symmetry of the centriole. Current Biology. 17 (24), 2169-2174 (2007).
- Hamel, V., et al. Correlative multicolor 3D SIM and STORM microscopy. Biomedical Optics Express. 5 (10), 3326 (2014).
- Guichard, P., et al. Cell-free reconstitution reveals centriole cartwheel assembly mechanisms. Nature Communications. 8, 14813 (2017).
- Hiraki, M., Nakazawa, Y., Kamiya, R., Hirono, M. Bld10p constitutes the cartwheel-spoke tip and stabilizes the 9-fold symmetry of the centriole. Current Biology. 17 (20), 1778-1783 (2007).
- Sahl, S. J., Hell, S. W., Jakobs, S. Fluorescence nanoscopy in cell biology. Nature Reviews Molecular Cell Biology. 18 (11), 685-701 (2017).
- Hutner, S. H., Provasoli, L., Schatz, A., Haskins, C. P. Some Approaches to the Study of the Role of Metals in the Metabolism of Microorganisms. Proceedings of the American Philosophical Society. 94 (2), 152-170 (1950).
- Keller, L. C., Marshall, W. F. Isolation and proteomic analysis of chlamydomonas centrioles. Methods in Molecular Biology. 432 (1), 289-300 (2008).
- Borlinghaus, R. T., Kappel, C. HyVolution-the smart path to confocal super-resolution. Nature Methods. 13 (3), (2016).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nature Methods. 9 (7), 671-675 (2012).
- de la Rosa-Trevín, J. M., et al. Scipion: A software framework toward integration, reproducibility and validation in 3D electron microscopy. Journal of Structural Biology. 195 (1), 93-99 (2016).
- Gartenmann, L., et al. A combined 3D-SIM/SMLM approach allows centriole proteins to be localized with a precision of ∼4-5 nm. Current Biology. 27 (19), 1054-1055 (2017).
- Jaenicke, L., Kuhne, W., Spessert, R., Wahle, U., Waffenschmidt, S. Cell-wall lytic enzymes (autolysins) of Chlamydomonas reinhardtii are (hydroxy)proline-specific proteases. European Journal of Biochemistry. 170 (1-2), 485-491 (1987).
- Salas, D., et al. Angular reconstitution-based 3D reconstructions of nanomolecular structures from superresolution light-microscopy images. Proceedings of the National Academy of Sciences of the United States of America. 114 (35), 9273-9278 (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved