A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
البوليمرات المركبة كتلة متوافقة بيولوجيا ً وظيفية من الميثيونين لتسليم الحمض النووي البلازميد المستهدف
* These authors contributed equally
In This Article
Summary
يعرض هذا العمل إعداد البوليمرات المركبة (mBG) القابلة للإلغاء من خلال طريقة نقل سلسلة الإضافة والتجزؤ (RAFT) القابلة للعكس. كما تم التحقيق في قدرة الحمض النووي البلازميد على تعقيد mBG التي تم الحصول عليها وكفاءتها في الانعتراب. طريقة RAFT مفيدة جدا للبوليمرات مونومرات التي تحتوي على مجموعات وظيفية خاصة.
Abstract
عكسها إضافة تجزئة سلسلة نقل (RAFT) البلمرة يدمج مزايا البلمرة الراديكالية والبلمرة الحية. يعرض هذا العمل إعداد البوليمرات المشتركة للكتل المتوافقة بيولوجياً وظيفية من الميثيونين عن طريق بوليمرة RAFT. أولا، N، N-bis(2-هيدروكسي إيثيل) ميثاكريلاميد-ب-N-(3-أمينوبروبيل) ميثاكريلاميد (BNHEMA-ب- APMA، BA) تم تصنيعها عن طريق البلمرة طوف باستخدام 4،4'-azobis (4-حمض السيانوفاليريك) (ACVA) باعتبارها بدء وكيل و4-سيانوبينتانويك حمض ثنائي ثيوبنزوات (CTP) كعامل نقل سلسلة. في وقت لاحق، N،N-bis(2-هيدروكسي إيثيل) ميثاكريلاميد-ب-N-(3-guanidinopropyl) ميثاكريلاميد (ميثيونين المطعمة BNHEMA-ب-GPMA، mBG) تم إعدادها عن طريق تعديل مجموعات الأمين في APMA مع الميثيونين وغوانيدين مجموعات. تم تصنيع ثلاثة أنواع من البوليمرات كتلة، mBG1، mBG2، وmBG3، للمقارنة. وقد استخدم رد فعل النينهيرين لتحديد كمية محتوى APMA; وكان mBG1، mBG2، وmBG3 21٪، 37٪، و 52٪ من APMA، على التوالي. وأظهرت نتائج التصوير اللوني للجل أن البوليمرات المركبة با تمتلك أوزاناجزية تبلغ 200 16 (BA1) و 900 20 (BA2) و 27200 (BA3) غرام/مول. كما تم التحقيق في قدرة الحمض النووي البلازميد (pDNA) على تعقيد ناقلات الجينات البوليمرية التي تم الحصول عليها. وكانت نسب الشحن (N/P) 8 و16 و4 عندما تم تعقيد pDNA تماما مع mBG1، mBG2، mBG3، على التوالي. عندما كانت نسبة N /P من بوليبليكسس mBG/pDNA أعلى من 1، كانت إمكانات زيتا من mBG إيجابية. في نسبة N /P بين 16 و 32، كان متوسط حجم الجسيمات من mBG / pDNA polyplexes بين 100-200 نانومتر. عموما، يوضح هذا العمل بروتوكول بسيط ومريح لتوليف الناقل copolymer كتلة.
Introduction
في السنوات الأخيرة، ظهر العلاج الجيني للتسليم العلاجي للأحماض النووية كأدوية لعلاج جميع أنواع الأمراض1. تطوير الأدوية الجينية بما في ذلك الحمض النووي بلازميد (pDNA) وصغيرة التدخل RNA (siRNA) يعتمد على استقرار وكفاءة نظام تسليم المخدرات (DDS)2. بين جميع DDS، الناقلين البوليمر الموجبة لديها مزايا الاستقرار الجيد، وانخفاض المناعة، وإعداد سهل ةوتعديل، والتي تعطي الناقلين البوليمر الموجبة آفاق تطبيق واسعة 3،4. للتطبيقات العملية في الطب الحيوي، يجب على الباحثين العثور على الناقل البوليمرالموجبة مع كفاءة عالية، وانخفاض السمية، وقدرة استهداف جيدة 5. بين جميع ناقلات البوليمر، كتلة البوليمرات هي واحدة من أنظمة تسليم المخدرات الأكثر استخداما على نطاق واسع. يتم دراسة البوليمرات المشتركة كتلة بشكل مكثف لممتلكاتهم التجميع الذاتي والقدرات لتشكيل micelles، microspheres، والجسيمات النانوية في تسليم المخدرات5. يمكن تصنيع البوليمرات المشتركة كتلة عن طريق البلمرة الحية أو انقر فوق أساليب الكيمياء.
في عام 1956، أثار Szwarc وآخرون موضوع البلمرة الحية، وتعريفه كرد فعل دون ردود فعل كسر سلسلة6،7. ومنذ ذلك الحين، تم تطوير تقنيات متعددة لتجميع البوليمرات باستخدام هذه الطريقة؛ وهكذا، ينظر إلى البلمرة الحية باعتبارها معلما من علم البوليمر8. يمكن تصنيف البلمرة الحية إلى البلمرة الأنيونية الحية، والبلمرة الموجبة الحية، وتعطيل البلمرة الجذرية القابلة للعكس (RDRP)9. البلمرة الأنيونية /الموجبة الحية لها نطاق محدود من التطبيق بسبب ظروف رد الفعل الصارمة10. البلمرة الراديكالية الخاضعة للرقابة / المعيشة (CRP) لديها ظروف رد فعل خفيفة، والتصرف مريحة، وغلة جيدة، وبالتالي كان التركيز البحثي الرئيسي في السنوات الأخيرة11. في CRP، يتم تمرير سلاسل الانتشار النشطة بشكل عكسي إلى سلاسل خاملة للحد من تركيز الجذور الحرة وتجنب التفاعل الثنائي الجزيئي لتكاثر الجذور المتسلسلة. إضافة البلمرة يمكن أن تستمر فقط إذا كانت سلاسل نشر الخاملة غير النشطة هي الرسوم المتحركة عكسها في سلسلة الجذور. باعتبارها واحدة من أكثر الأشكال الواعدة من البلمرة الراديكالية الحية، عكسها إضافة تجزئة سلسلة نقل (طوف) البلمرة هو وسيلة قابلة للتطبيق لإنتاج البوليمرات كتلة مع الوزن الجزيئي الخاضعة للرقابة والهيكل، والوزن الجزيئي الضيق التوزيع، وحمل المجموعات الوظيفية12. المفتاح إلى ناجحة طوف بلمرة التأثير من سلسلة إنتقال عاملات, عادة [ديثيوسترس], أيّ يملك جدّا عال سلسلة إنتقال ثابتة.
في هذه الورقة، تم تصميم طريقة البلمرة RAFT لإعداد BNHEMA-ب-APMA كتلة البوليمر، مع 4،4'-azobis (4-حمض السيانوفاليريك) (ACVA) كعامل بدء و4-سيانوبينتانويك حمض ثنائي ثيوبنزوات (CTP) كعامل نقل سلسلة. وقد استخدمت البلمرة طوف مرتين لإدخال BNHEMA في ناقلات البوليمر الموجبة. وفي وقت لاحق، تم تعديل مجموعات الأمين في سلسلة APMA مع الميثيونين وكاشف غوانيدينيليل 1-أميديينوبيرازول هيدروكلوريد. الاستفادة من الشحنات الإيجابية من الكاشف guanidinylation وميثاكريلاميد هيكل عظمي البوليمر، تم تحسين كفاءة الانتفاء الخلوية من ناقلات البوليمر كتلة تم الحصول عليها.
Protocol
1. توليف من البوليمر BNHEMA (PBNHEMA)
- حل 1.87 غرام من N، N-مكررا(2-هيدروكسي إيثيل) ميثاكريلاميد (BNHEMA) في 1 مل من الماء المقطر في زجاجة البلمرة.
ملاحظة: زجاجة البلمرة هي قارورة مستديرة القاع مع سدادة مطاطية وتحريك المغناطيسي. - حل 0.03 غرام من 4-سيانوبينتانويك حمض ثنائي ثيوبنزوات (CTP) و 0.02 غرام من 4,4'-أزوبيس (4-سيانوفافاليسيد) (ACVA) في 0.5 مل من 1,4-ديوكسان في كوب 5 مل. ثم قم بإضافة حل CTP و ACVA إلى زجاجة البلمرة من الخطوة 1.1.
- تهوية نظام التفاعل في زجاجة البلمرة مع النيتروجين عن طريق ثلاث دورات تجميد مضخة ذوبان.
- بالتفصيل، تجميد الحل في زجاجة البلمرة باستخدام فخ المكثفات، وإصلاح زجاجة البلمرة لدعم الحديد، وفراغ وحقن النيتروجين في خليط التفاعل عبر قناة يميل مع إبرة (إبرة #9، القطر الداخلي 0.65 ملم، القطر الخارجي 0.9 مم). ختم زجاجة البلمرة وذوبان الحل في درجة حرارة الغرفة لمدة 30 دقيقة.
- كرر دورات تجميد مضخة ذوبان ثلاث مرات.
- وضع زجاجة البلمرة في حمام النفط 70 درجة مئوية والسماح للحل تتفاعل لمدة 24 ساعة تحت الغلاف الجوي النيتروجين.
- قم بتبريد زجاجة البلمرة عند درجة حرارة 0 درجة مئوية وفتح سدادة المطاط لإنهاء عملية البلمرة.
- الأسيتون قبل الباردة في -20 درجة مئوية لمدة 2 ساعة ثم مزجها مع حل رد الفعل من الخطوة 1.5 في 50:1 (v/v). بعد ذلك، الطرد المركزي في 8200 × ز لمدة 10 دقائق لإزالة الأسيتون وجمع الترسيب.
- لتنقية PBNHEMA توليفها، حل الترسيب التي تم جمعها في 2 مل من الماء النقي ومن ثم مزجها مع 100 مل من الأسيتون المبردة مسبقا، في نسبة 1:50 (V / V). الطرد المركزي الحل في 8200 × ز لمدة 10 دقائق وجمع التعجيل. كرر هذه العملية ثلاث مرات.
- تجفيف PBNHEMA المنتجة باستخدام 50 درجة مئوية فراغ أكثر جفافا. مرة واحدة المجففة، وتزن المسحوق مع التوازن. حساب معدل العائد وفقا للمعادلة 1.
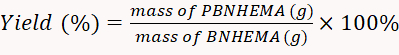 (1)
(1)
ملاحظة: في هذه التجربة، كان العائد الذي تم الحصول عليه 77.2%.
2. توليف من BNHEMA-ب-APMA البوليمر (BA)
- حل 0.96 غرام من N-(3-أمينوبروبيل) ميثاكريلاميد هيدروكلوريد (APMA) و 0.93 غرام PBNHEMA في 5 مل من الماء المقطر في كوب 10 مل.
- حل 0.01 غرام من 4،4'-azobis (4-حمض السيانوفالريك) (ACVA) في 0.5 مل من 1،4-ديوكسان ومزيج مع الحل APMA-PBNHEMA من الجزء 2.1.
- نقل الخليط في زجاجة البلمرة والتهوية مع النيتروجين الجاف لمدة 1 ساعة.
- وضع زجاجة البلمرة في حمام النفط 70 درجة مئوية والسماح لها تتفاعل لمدة 24 ساعة تحت الغلاف الجوي النيتروجين.
- قم بتبريد زجاجة البلمرة عند درجة حرارة 0 درجة مئوية وفتح سدادة المطاط لإنهاء عملية البلمرة.
- نقل الحل إلى الأسيتون المبردة من الخطوة 1.6، ومن ثم الطرد المركزي الحل في 8200 × ز لمدة 10 دقيقة لتسريع مكتبة الإسكندرية.
- إذابة مكتبة الإسكندرية في 2 مل من الماء المقطر ويعجل البوليمر في الأسيتون المبردة. كرر ثلاث مرات.
- تجفيف BA المنتجة في 50 درجة مئوية فراغ أكثر جفافا وتزن مسحوق تم الحصول عليها. حساب معدل العائد وفقا للمعادلة 2.
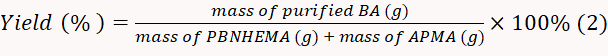
ملاحظة: في هذه التجربة، تم حساب معدل العائد على 82.0%.
3. تحديد نسبة الخلد من APMA في بوليمر با عن طريق طريقة النينهيدين
ملاحظة: يتم استخدام قياس الطيف لتحديد محتويات الأحماض الأمينية متعددة المكونات. المبدأ هو رد فعل لون النينهيدين والأحماض الأمينية حيث يرتبط الامتصاص مع محتوى الأحماض الأمينية إلى حد ما13،14.
- حل 5 غرام من النينهيرين في 125 مل من الماء المقطر المغلي. أيضا، حل 5 غرام من فيتامين C في 250 مل من الماء المقطر الدافئ. إضافة 250 مل من محلول فيتامين C قطرة إلى محلول النينهيرين تحت التحريك المغناطيسي. استمر في التحريك لمدة 15 دقيقة ثم قم بتبريد محلول التفاعل في ثلاجة 4 درجة مئوية.
- خذ الحل من الثلاجة وتصفية عن طريق شفط باستخدام قمع Buchner للحصول على انخفاض النينهيرين. جمع عجل والحفاظ عليه في المجفف بينكسيد أكسيد الفوسفور.
- حل 85 ملغ من النينهيرين و 15 ملغ من انخفاض النينهيرين في 10 مل من الإيثيلين غليكول أحادي ميثيل الأثير لإعداد محلول النينهيرين التلوين.
ملاحظة: Ninhydrin-التلوين الحل يمكن أن تتفاعل مع α-الأمينية في APMA وتشكل مركب البنفسجي مع هيكل كما هو موضح في دراسة سابقة15. - تخفيف 1 مل من 0، 1، 10، 100، 1000 ملغ / مل APMA حلول مونومر مع 1 مل من خلات العازلة (2 M، درجة الحموضة 5.4)، ثم إضافة 1 مل من محلول النينهيرين التلوين، على التوالي.
- تُسخّن المخاليط لمدّة 15 دقيقة في حمام ماء مغلي ثم ّ تُبرّد باستخدام الماء الجاري. دع الحلول تُحدّد لمدة 5-10 دقائق وتُخفّفها بـ 3 مل من الكحول الإيثيلي بنسبة 60% وتُمزج هاً جيداً. قياس الامتصاص في 570 نانومتر باستخدام مقياس الطيف ورسم المنحنى القياسي(المعادلة3).
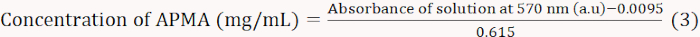
ملاحظة: استمدت المعادلة 3 من التركيب الخطي للامتصاص عند 570 نانومتر مقابل تركيز APMA. - حل 0.01 غرام من مكتبة الإسكندرية في 1 مل من الماء المقطر. إضافة 1 مل من خلات العازلة (2 M، درجة الحموضة 5.4) و 1 مل من محلول التلوين النينهيرين. حساب المحتوى المولي من APMA وفقا للامتصاص في 570 نانومتر.

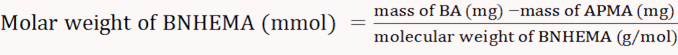 (5)
(5)
ملاحظة: صيغ الحساب كما يلي(المعادلات 3-6).
4. توليف ميثيونين المطعمة با البوليمر (mBA)
- حل 8.9 ملغ من Fomc-ميثيونين في 5 مل من DMSO في قارورة الانتعاش.
- إضافة 6.92 ملغ من 1-إيثيل-3-(3-ثنائي ميثيل أمينوبروبيل) هيدروكلوريد كاربوديميد (EDCl) و 4.86 ملغ من 1-هيدروكسي بنزوترازول (HOBT) إلى قارورة الانتعاش وتتفاعل عند 0 درجة مئوية لمدة 0.5 ساعة.
- حل 2.59 غرام من مكتبة الإسكندرية في 5 مل من محلول DMSO ثم إضافة 50 ميكرولتر من ثلاثي ميثيل أمين. إضافة هذا الحل قطرة إلى قارورة الانتعاش (الخطوة 4.2) والسماح للحل تتفاعل لمدة 0.5 ساعة في درجة حرارة الغرفة.
- Dialyze لإزالة DMSO وtrimethylamine من حل مكتبة الإسكندرية في الخطوة 4.3 باستخدام كيس غسيل الكلى (MWCO 10 kDa) في كوب 2 L لمدة 24 ساعة؛ استبدال المياه منزوعة الأيونات كل 6 ح.
- تجميد الجافة mBA التي تم الحصول عليها وتزن لحساب معدل العائد وفقا للمعادلة 7.
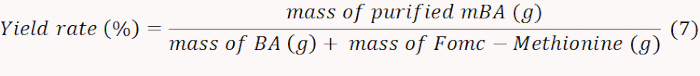
ملاحظة: في هذه الحالة، تم تحديد معدل العائد على 71%. - قياس NH2 التي تحتوي على mBA عن طريق قياس امتصاص في 570 نانومتر لحساب كمية الميثيونين المطعمة. حساب المحتوى المولي من الميثيونين وفقا للمعادلة 8.

5. توليف من البوليمر guanidinated والميثيونين المترافقة BNHEMA-ب-APMA البوليمر (mBG)
ملاحظة: تم تصنيع ثلاثة mBA1 مختلفة، mBA2 وmBA3 كوبوليمر. يتم استخدام البوليمر المشترك mBA3 كمثال في الخطوات التالية.
- حل mBA3 التي تحتوي على 60 ميكرومول من مجموعة أمينية في 5 مل من الماء النقي.
ملاحظة: تم تحديد محتوى المجموعة الأمينية كمياً باستخدام أسلوب النينهيدين كما هو موضح في الخطوة 3.5. - حل 40.6 ملغ (300 ميكرومول) من الكاشف غوانيدينيليل 1-أميديينوبرازول هيدروكلوريد في حلول mBA.
- ضبط درجة الحموضة إلى 9.0 مع الحل المشبعة من كربونات الصوديوم والسماح لها الاستقرار لمدة 24 ساعة في درجة حرارة الغرفة.
- دياليزي المنتج mBG مع الماء منزوع الأيونات باستخدام كيس غسيل الكلى في كوب (MWCO 10 kDa، 2 L) والحفاظ عليه في شكل مسحوق تجميد المجففة.
تم حساب نسبة العائد لتكون 85٪ عن طريق المعادلة 8.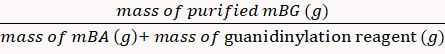 (8)
(8) - حل مسحوق mBG في D2O في أنابيب NMR وتميزه باستخدام 1H مطيافيال الرنين المغناطيسي النووي (1 H NMR)16.
6. إعداد وتوصيف mBG / pDNA polyplexes
- حل 50 ميكروغرام من pDNA في 50 درجة مئوية من المياه الخالية من RNase/DNase.
- حل 1 ملغ من البوليمرات coBG في 1 مل من المياه الخالية من RNase / DNase.
- إضافة حل البوليمرات coBG مباشرة في محلول pDNA وفقا لنسب التغذية المختلفة، وهذا هو، نسب N / P مختلفة (1:1، 4: 1، 8: 1، 16:1، و 32:1).
ملاحظة: تُعرَّف نسبة N/P بأنها نسبة الأضراس لمجموعة غوانيدين في البوليمر ومجموعة الفوسفات في pDNA، وهي نسبة الأضراس في سلسلة GPMA في البوليمر وmononucleotide في pDNA. يتم حساب نسبة N /P وفقا للأوزان الجزيئية للنيتروجين الأميني (N) في مجموعة mBG والفوسفات (P) في pDNA . - خلط الحلول مع خلاط دوامة والسماح لهم بالوقوف لمدة 30 دقيقة في درجة حرارة الغرفة. بعد ذلك، تفريق الخليط في محلول المخزن المؤقت الفوسفات (PBS، درجة الحموضة 7.4) والحفاظ على mBG / pDNA polyplexes التي تم الحصول عليها في 4 درجة مئوية لتجارب المتابعة.
ملاحظة: تم الكشف عن متوسط حجم الجسيمات وإمكانات زيتا من mBG والمجمعات باستخدام تشتت الضوء الديناميكي (DLS)17. - تمييع 10 ميكرولتر من الحلول متعددة البليكس mBG/pDNA مع 1 مل من PBS (درجة الحموضة 7.4) في خلايا العينة المحتملة DLS وZeta.
ملاحظة: تم إجراء حجم الجسيمات والكشف المحتمل زيتا ثلاث مرات وتم أخذ متوسط القيم الثلاث.
7. تجربة التخلف الكهربائي من بوليبليكسm /pDNA
ملاحظة: أجريت تجربة تخلف كهربائي لتحديد الحد الأدنى لنسبة الشحن.
- خذ خمس مجموعات من الـ mBG/pDNA polyplexes مع نسب N/P مختلفة (1:1، 4:1، 8:1، 16:1، و32:1) تحتوي على 50 ميكروغرام من pDNA .
- إضافة المخزن المؤقت التحميل 6X إلى عينات بوليبليكس mBG/pDNA إلى تركيز نهائي 1x.
- إضافة الحلول إلى 1.5٪ هلام أغاروز وتشغيل هلام في 90 mV لمدة 15 دقيقة، وذلك باستخدام pDNA كتحكم.
- التقاط صور من المواد الهلامية باستخدام صورة هلام.
8. السمية الخلوية من بوليبليكسm/pDNA
- بذور الخلايا MCF-7 في لوحات 96 جيدا في كثافة 104 خلايا في البئر. ثم، زراعة الخلايا لمدة 12 ساعة باستخدام DMEM المتوسطة (10٪ FBS و 1٪ المضادات الحيوية) في حاضنة 37 درجة مئوية رطبة الموردة مع 5٪ CO2.
- استبدال وسط الثقافة مع وسائل الإعلام ثقافة DMEM خالية من المضادات الحيوية التي تحتوي على 10٪ مصل البقر الجنيني (FBS) وmBG / pDNA polyplexes من نسب تهمة مختلفة (N / P 4، 8، 16، و 32، ن = 6) لمدة 6 ح، مع الخلايا المضافة مع كميات متساوية من محلول PBS كعنصر تحكم. بعد ذلك, يستبدل الثقافة وسط مع 150 [فل] من طازجة 1640 وسط وثقافة بعيدة الخلايا ل 24 [ه].
- يضاف 5 ملغم/مل 3-(4,5-ثنائي ميثيل ثيازول-2-yl)-2,5-ثنائي الفينيل بروميد تيترايزوليوم (MTT) الحل (20 ميكرولتر/بئر) إلى لوحات 96 بئراً والمزيد من زراعة الخلايا لمدة 4 ساعة.
- إزالة الحل وإضافة 150 درجة مئوية من DMSO إلى كل بئر ويهز لوحات 96 جيدا 30 ثانية.
- قياس الكثافة البصرية (OD) في 490 نانومتر مع قارئ لوحة صغيرة لإظهار صلاحية الخلية. حساب النسبة المئوية لصلاحية الخلية وفقًا للمعادلة 9.
نسبة صلاحية الخلية = (9)
(9)
9. كفاءة التغوط من mBG / GFP-pDNA polyplexes
- حل 50 ميكروغرام من pDNA التي تحتوي على الجين مراسل البروتين الفلورسنت الأخضر (GFP) pDNA (GFP-pDNA) في 50 ميكرولتر من المياه الخالية من RNase/DNase. ثم حل 1 ملغ من البوليمرات coBG في 1 مل من RNase / DNase خالية من المياه. مزيج pDNA وmBG الحل في نسبة تهمة (N / P) من 1:1، 4:1، 8:1، 16:1، و 32:1 وحضانة لمدة 30 دقيقة في درجة حرارة الغرفة. تفريق mBG / GFP-pDNA حل polyplexes باستخدام الموجات فوق الصوتية (30 ثانية) وتخزينها في 4 درجة مئوية لتجارب المتابعة.
ملاحظة: يتم حساب نسبة N /P وفقا للأوزان الجزيئية للنيتروجين الأميني (N) في مجموعة mBG والفوسفات (P) في pDNA . - بذور MCF-7 الخلايا في كثافة 2 × 105 خلايا لكل بئر في لوحة 6 جيدا والثقافة لهم في 37 درجة مئوية و 5٪ CO2 في حاضنة رطبة لمدة 12 ساعة.
- استبدل وسط الثقافة بوسط الثقافة الطازجة الذي يحتوي على بوليبليكس mBG/GFP-pDNA من نسب N/P مختلفة (4 و8 و16 و32) لمدة 6 ساعة.
- استبدل المتوسط بـ 2 مل من الـ RPMI1640 المتوسطة والثقافة الطازجة لمدة 48 ساعة.
- جمع الخلايا والكشف عن الفلورة الخضراء مع مقياس التدفق.
النتائج
وقد تم تغذية BNHEMA وفقا لدرجة الهدف من البلمرة المبينة في الجدول1؛ يظهر الإجراء التوليفي لـ mBG في الشكل 1. أولا، تم إعداد BNHEMA homopolymer عن طريق عكسها إضافة تجزئة سلسلة نقل (RAFT) في نظام الماء ديوكسان، وذلك باستخدام 4-سيانوبينتانويك حمض dithiobenzoate كعامل نقل سلسلة. ثانيا، تم است...
Discussion
قدمت هذه الدراسة سلسلة من BNHEMA-b-APMA كتلة البوليمر الناقلين الجينات الموجبة. تم تصنيع هذه البوليمرات كتلة عن طريق عكسها إضافة تجزئة سلسلة نقل (RAFT) طريقة. تم إدخال الجزء المائي BNHEMA لتحسين الذوبان. تم تعديل مجموعات الميثيونين والغوانيدين لتحسين القدرة المستهدفة وكفاءة الانتفاء5. ز...
Disclosures
ويشهد أصحاب البلاغ بعدم وجود تضارب في المصالح مع أي منظمة مالية فيما يتعلق بالمواد التي نوقشت في هذه المادة.
Acknowledgements
وقد تم دعم هذا البحث من قبل البرنامج الوطني للبحث والتطوير الرئيسي في الصين (رقم 2016YFC0905900)، المؤسسة الوطنية للعلوم الطبيعية في الصين (الرقم 81801827، 81872365)، برنامج البحوث الأساسية لمقاطعة جيانغسو (مؤسسة العلوم الطبيعية، رقم. BK20181086)، وصندوق البحوث العلمية في مستشفى جيانغسو للسرطان (رقم ZK201605).
Materials
| Name | Company | Catalog Number | Comments |
| 1-hydroxybenzotriazole | Macklin Biochemical Co., Ltd,China | H810970 | ≥97.0% |
| 1,4-dioxane | Sinopharm chemical reagent Co., Ltd, China | 10008918 | AR |
| 1-amidinopyrazole Hydrochloride | Aladdin Co., Ltd., China | A107935 | 98% |
| 1-ethyl-3-(3-dimethylaminopropyl)carbodiimide hydrochloride | Aladdin Co., Ltd., China | E106172 | AR |
| 4,4’-azobis(4-cyanovaleric acid) | Aladdin Co., Ltd., China | A106307 | Analytical reagent (AR) |
| 4-cyano-4-(phenylcarbonothioylthio)pentanoic Acid | Aladdin Co., Ltd., China | C132316 | >97%(HPLC) |
| Acetate | Sinopharm chemical reagent Co., Ltd, China | 81014818 | AR |
| Acetone | Sinopharm chemical reagent Co., Ltd, China | 10000418 | AR |
| Agarose | Aladdin Co., Ltd., China | A118881 | High resolution |
| Ascorbic acid | Aladdin Co., Ltd., China | A103533 | AR |
| DMSO | Aladdin Co., Ltd., China | D103272 | AR |
| Ethylene glycol | Aladdin Co., Ltd., China | E103319 | AR |
| N-(3-aminopropyl)methacrylamide hydrochloride | Aladdin Co., Ltd., China | N129096 | ≥98.0%(HPLC) |
| N,N-bis(2-hydroxyethyl)methacrylamide | ZaiQi Bio-Tech Co.,Ltd, China | CF259748 | ≥98.0%(HPLC) |
| Ninhydrin | Aladdin Co., Ltd., China | N105629 | AR |
| PBS buffer | Aladdin Co., Ltd., China | P196986 | pH 7.4 |
| Plasmid DNA | BIOGOT Co., Ltd, China | pDNA-EGFP | pDNA-EGFP |
| Plasmid DNA | BIOGOT Co., Ltd, China | Pdna | pDNA |
| Sodium carbonate decahydrate | Aladdin Co., Ltd., China | S112589 | AR |
| Trimethylamine | Aladdin Co., Ltd., China | T103285 | AR |
References
- Flotte, T. R. Gene and Cell Therapy in 2018: A Look Ahead. Human Gene Therapy. 29, 1-1 (2018).
- Huang, W., et al. Nanomedicine-based combination anticancer therapy between nucleic acids and small-molecular drugs. Advanced Drug Delivery Reviews. 115, 82-97 (2017).
- Wu, Y., et al. Reversing of multidrug resistance breast cancer by co-delivery of P-gp siRNA and doxorubicin via folic acid-modified core-shell nanomicelles. Colloids & Surfaces B Biointerfaces. 138, 60-69 (2016).
- Quader, S., Kataoka, K. Nanomaterial-Enabled Cancer Therapy. Molecular Therapy. 25, 1501-1513 (2017).
- Wu, Y., et al. Multivalent methionine-functionalized biocompatible block copolymers for targeted siRNA delivery and subsequent reversal effect on adriamycin resistance in human breast cancer cell line MCF-7/ADR. Journal of Gene Medicine. 19, e2969 (2017).
- Szwarc, M. ‘Living’ Polymers. Nature. 178, 168-169 (1956).
- Szwarc, M., Rembaum, A. Polymerization of methyl methacrylate initiated by an electron transfer to the monomer. Journal of Polymer Science. 22 (100), 189-191 (1956).
- Mukhopadhyay, R. D., Ajayaghosh, A. Living supramolecular polymerization. Science. 349, 241 (2015).
- Ozkose, U. U., Altinkok, C., Yilmaz, O., Alpturk, O., Tasdelen, M. A. In-situ preparation of poly(2-ethyl-2-oxazoline)/clay nanocomposites via living cationic ring-opening polymerization. European Polymer Journal. 88, 586-593 (2017).
- Wu, W., Wang, W., Li, J. Star polymers: Advances in biomedical applications. Progress in Polymer Science. 46, 55-85 (2015).
- Boyer, C., et al. Copper-Mediated Living Radical Polymerization (Atom Transfer Radical Polymerization and Copper(0) Mediated Polymerization): From Fundamentals to Bioapplications. Chemical Reviews. 116, 1803-1949 (2016).
- Keddie, D. J. A guide to the synthesis of block copolymers using reversible-addition fragmentation chain transfer (RAFT) polymerization. Chemical Society Reviews. 43, 496-505 (2014).
- Wu, Y., et al. Guanidinylated 3-gluconamidopropyl methacrylamide-s-3-aminopropyl methacrylamide copolymer as siRNA carriers for inhibiting human telomerase reverse transcriptase expression. Drug Delivery. 20, 296-305 (2013).
- Qin, Z., Liu, W., Guo, L., Li, X. Studies on Guanidinated N-3-Aminopropyl Methacrylamide-N-2-Hydroxypropyl Methacrylamide Co-polymers as Gene Delivery Carrier. Journal of Biomaterials Science, Polymer Edition. 23, 1-4 (2012).
- Friedman, M. Applications of the Ninhydrin Reaction for Analysis of Amino Acids, Peptides, and Proteins to Agricultural and Biomedical Sciences. Journal of Agricultural and Food Chemistry. 52, 385-406 (2004).
- Habuchi, S., Yamamoto, T., Tezuka, Y. Synthesis of Cyclic Polymers and Characterization of Their Diffusive Motion in the Melt State at the Single Molecule Level. Journal of Visualized Experiments. (115), 1-9 (2016).
- Rao, D. A., Nguyen, D. X., Mishra, G. P., Doddapaneni, B. S., Alani, A. W. Preparation and Characterization of Individual and Multi-drug Loaded Physically Entrapped Polymeric Micelles. Journal of Visualized Experiments. 102, 1-5 (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved