Method Article
المجهر الضوئي ورقه الخفيفة والمؤتمتة الخلايا النسب تحليلات لكتالوج Caenorhabditis الاجنه الجنينية مع القرار تحت الخلوية
In This Article
Summary
هنا ، نقدم نهج التوافقية باستخدام المجهر عاليه الدقة ، والاداات الحسابية ، ووضع العلامات خليه واحده في الاجنه c. ايليجنس المعيشة لفهم ديناميات خليه واحده اثناء النمو العصبي.
Abstract
كاجورهابديستيس ايلينتس (C. اليجايليس) تبرز باعتبارها الكائن الوحيد الذي يمكن ملاحظه التحدي المتمثل في فهم الأصول الخلوية للجهاز العصبي بأكمله ، مع دقه خليه واحده ، في الجسم الحي. هنا ، ونحن نقدم بروتوكول متكامل لفحص النمو العصبي في الاجنه c. اليجس . يجمع بروتوكولنا بين التصوير والتتبع والتعقب التشريحي العصبي للخلايا المفردة في الاجنه النامية. ونحن نحقق علي المدى الطويل ، وأربعه الابعاد (4D) التصوير من الاجنه الحية c. ايلينيسس مع الدقة المكانية الانسيابية تقريبا من خلال استخدام المزدوج عرض المقلوب الانتقائي الاضاءه الطائرة المجهرية (dispim). النوى والهياكل العصبية في الاجنه الديدان الخيطية واندمجت ايزوتروبيكالي لإنتاج الصور مع دقه ~ 330 نانومتر في جميع الابعاد الثلاثة. وبعد ذلك يتم تحليل مجموعات البيانات رباعيه الابعاد ذات الدقة العالية لربط الهويات النهائية للخلايا بالتعبير الجيني والديناميكيات المورفولوجية عند مستويات التفاصيل أحاديه الخلية والخلوية. تم تنظيم البروتوكول الخاص بنا لتمكين التنفيذ المعياري لكل من الخطوات الموصوفة وتعزيز الدراسات حول تولد الاجنه أو التعبير الجيني أو التطور العصبي.
Introduction
C. اليجاناس تبرز باعتبارها الكائن الوحيد الذي يمكن ملاحظه كل خليه في الجنين في جميع انحاء النمو العصبي. مع الخلية بأكملها السلالة المعروفة والثابتة1، ومع تطوير أدوات جديده تسمح بوضع العلامات والتصوير المستمر للخلايا واحده في الاجنه ، يمكن لعلماء الاحياء الآن البدء في دراسة خطوات مختلفه في تطوير الديدان الخيطية العصبي النظام من جميع الزوايا-الولادة الخلية. الهجرة والتمايز ؛ تشكيل العصب ، والنمو المستهدف والفاسسيكوليشن ؛ تشكيل المشبك. وضبط الدوائر الوظيفية. التقاط ديناميات الخلايا العصبية الناتجة في الجنين c. اليجس ، من خلال الجمع بين المراسلين والمجهر المجهري المعبر عنه باقتدار ، هو قيمه للمجتمع العلمي.
الدراسات التنموية في c. وغالبا ما الاستفادة من الخلايا الثابتة السلالة وخرائط مصير الخلية من هذا النوع لزيادة فهم السياقية علي مستوي خليه واحده داخل الكائن السليم1. تحليل لصناعه السيارات في الشيخوخة-باستخدام starrynite2،3،4 و اسيتري5،6،7،8 البرمجيات-فوائد من التباين العالي ، وارتفاع القرار صور لنوى الفلورسنت. للعمل علي النحو الأمثل ، StarryNite/اسيتري يعتمد أيضا علي التوجه مقيده يمكن التنبؤ بها من الاجنه الذين تتراوح أعمارهم بين اثناء التنمية. المجهر البؤري ، الذي تم في c. الاجنه التي تم ضغطها بين اثنين من الشفتين ، وكانت الطريقة القياسية لصناعه السيارات في الشيخوخة المجهر لأكثر من عقد لأنه يوفر علي حد سواء عاليه التباين/عاليه الدقة والتي يمكن التنبؤ بها مقيده اتجاه من الجنين7,8. وصفنا سابقا بناء واستخدام رواية الضوء المستندة إلى ورقه مزدوجة المقلوب المجهر الاضاءه الطائرة الانتقائية (dispim) لتصوير عينه حيه مثل الاجنه c. ايليزسيس9،10 , 11 , 12 , 13. ضوء ورقه المجهر ، بشكل عام ، ويوفر السمية الضوئية منخفضه ، وسرعه عاليه ، والتصوير علي المدى الطويل من العينات 3d حيه14،15. الأسلوب diSPIM ، علي وجه التحديد ، وتنتج أربعه الابعاد (4D) الصور مع دقه المكانية تقريبا من 330 نانومتر تقريبا9.
مقارنه مع المجهر البؤري ، diSPIM يقدم اعلي اشاره إلى الضوضاء والسرعة ، والدقة المكانية أكثر الانسيابية ، وأكثر ملاءمة للأجل الطويل في الجسم الصور16. ولذلك عملنا علي تكييف بيانات diSPIM لإدخالها في StarryNite/اسيتري والتحقيق في ما إذا كان هذا من شانه ان يعزز تحليلات الشيخوخة. والعقبة الرئيسية هي ان العينات diSPIM لا يمكن تقييدها بسهوله بواسطة ضغط قشر البيض لاعتماد الاتجاات المتوقعة ل StarryNite/اسيتري. ان الاتجاه العشوائي لمواضع الخلايا في وحده التخزين التي يتم تحليلها يحط من دقه تحليل الاصطفاف التلقائي.
ولذلك استخدمنا العرض الخلوي ، واجهه المستخدم الموجهة للمشاهد والتي تسمح للمستخدمين باختيار الاتجاه الدقيق ثلاثي الابعاد للجنين اثناء المعالجة المسبقة للصور diSPIM ، مما يؤدي إلى بيانات الصورة التي يتم تحسين جودتها وادراك السياق للإدخال في StarryNite السيد/اسيتري. عند اختيار المستخدم من الاجنه الذين تتراوح أعمارهم بين ، والعرض الخلوي تنسق خط أنابيب معالجه البيانات المؤتمتة. يتم حفظ صور الاجنه التي تم اقتصاصها وطرحها في الخلفية ضمن ملفات مكدس TIFF لكل موضع ونقطه زمنيه وطريقه عرض. العرض الخلوي ثم بشكل متكرر يدعو برنامج spimfusion للاشتراك في التسجيل وتفكيكها معا وجات النظر قبل معالجتها ، وذلك باستخدام ريتشاردسون-لوسي17،18 خوارزميه لإنتاج الصور الحجمي عاليه الدقة الانسيابية. تم تحسين مجموعه محدده من المعلمات diSPIM ل StarryNite لتحكم سلوكها اثناء تقسيم الصورة وتتبع النواة في الصور المنصهرة. ثم يتم تحرير الصور تنصهر ونتائج الشيخوخة باستخدام اسيتري, الذي يسمح للمستخدمين لتحديد وإصلاح اي أخطاء في تتبع السلالة السيارات التي تم إنشاؤها بواسطة StarryNite. يمكن أيضا ان تقدم اسيتري شجره النسب والأداءات الثلاثية الابعاد علي غرار النوى المتعقبة في الجنين. نجد ان سرعه الاصطفاف التلقائي والدقة تتعزز بشكل ملحوظ باستخدام الصور المنصهرة ، بالمقارنة مع الصور الخام من كاميرا SPIM. بروتوكول لدينا ، في حين ان الأمثل لتطبيق c. اليجس وصفت هنا ، يمكن تكييفها عموما لصناعه السيارات في الشيخوخة من dispim البيانات المنتجة للأنواع الأخرى أو العينات. إذا كان هذا هو الاستخدام المقصود من البروتوكول ، يرجى ملاحظه ان ضبط اضافيه من المعلمات starrynite من المرجح ان تكون مطلوبه للعينات جديده ، كما هو موضح3،4.
التنفيذ الناجح لهذا البروتوكول ينتج عنه صور ذات دقه رباعيه الابعاد وتمكن علماء الاحياء من تتبع سلاله الخلايا ، مع تحديد وتحليل الخلايا العصبية في نفس الوقت في الجنين النامي. وعلاوة علي ذلك ، من خلال دمج عده خوارزميات ما بعد المعالجة-مع تسارع الاجهزه التي تستهلك الوقت الأكثر من هذه-يمكننا الآن تحليل كل من التفاصيل الفرعية الدقيقة والخلايا الخلوية ومصائر الخلايا من الاجنه الحية في الوقت الحقيقي أساسا. يسمح هذا البروتوكول الجديد بالتلاعب الدقيق والمستنير ومراقبه سلوك الخلية اثناء الدراسات الاثباتيه للتمييز والتكوين الخلوي في الجسم المجري. في هذه المخطوطة ، نقدم شرحا مفصلا للبروتوكولات المحسنة التي قمنا بتطويرها لتتبع السلالات وتعقب الخلايا في تطوير أجنه ج. ايليجنس ، لتعزيز دراسات الاجنه ، التعبير الجيني أو النمو العصبي.
Protocol
1. تجميع dispim غرفه التصوير الصلب مع بولي-L-يسين المغلفة كوفيرسليب
ملاحظه: الخطوات أدناه كلها مطلوبه لتحسين وأتمته تحليل النسب من الاجنه الديدان الخيطية بواسطة StarryNite/اسيتري. قد يتم حذف العديد من الخيارات (المشار اليها علي هذا النحو) للتجارب التي لا تتطلب تتبع لسلالات الخلايا c. اليجس .
- ارسم مستطيلا صغيرا (2mm x 5mm) في وسط المشبك المستطيل النظيف (رقم 1.5 ، 24 مم × 50 مم) مع الفطيرة (أو القلم المشابه).
- الوجه كوفيرسليب إلى جانب غير الموسومة ومكان 10 μl من بولي-L-ليسين (القط. P1524) علي المستطيل ملحوظ.
ملاحظه: جعل تركيز العمل من 1 ملغ/مل بولي-L-يسين المذاب في المياه المصفاة (أو ما يعادلها). للتخزين علي المدى الطويل ، واعداد 5-10 مل الارصفه وتخزين في − 20 درجه مئوية. وبمجرد تذويبها ، يمكن تخزين الارصفه في درجه حرارة الغرفة (23 درجه مئوية) لمده 3 – 4 أسابيع. - السماح لبولي-L-ليسين لمعطف كوفيرسليب لمده 5 دقائق (الشكل 1a). ويستخدم بولي L-ليسين لطلاء الغطاء الزجاجي ينزلق حيث سيتم تركيب الاجنه, السماح لقشر البيض الجنين علي التمسك بحزم إلى coverslip, حتى عندما يتم مغمورة الأهداف في وسط التصوير.
- وضع بولي-L-يسين المغلفة كوفيرسليب في النصف السفلي من غرفه التصوير الصلب.
- وضع النصف العلوي من غرفه التصوير الصلب علي النصف السفلي مع كوفيرسليب وتشديد مع المسامير الاربعه المرتبطة بالغرفة. تحقق بصريا من الجانب للتاكد من ان النصف العلوي يجلس بالتساوي في النصف السفلي (الشكل 1B).
- ملء الغرفة مع 7-8 مل من مسنومكس العازلة19، العازلة متساوي الحركة الذي يساعد علي منع الاجنه في مرحله مبكرة من الخضوع للضغط اوموتيك غير طبيعي. 1-خليه ، وحتى 2-خليه الاجنه حساسة بشكل غير طبيعي ويمكن ان تتطور بشكل غير عادي إذا لم يكن في هذا العازلة متساوي الصوت. وتميل الاجنه أيضا إلى الاعتقال في مرحله الثلاثة اضعاف إذا تم استبدال مسنومكس بالماء.
2. اعداد عينات الجنين c. اليجس للتركيب
ملاحظه: ما يقرب من 18 ساعة قبل التصوير ، وخمسه الشباب (1 يوم منذ النهائي molt) البالغين وعشره يرقات المرحلة 4 (L4) c. يتم انتقاؤها إلى المتوسطة نمو الديدان الخيطية (ngm) لوحه أجار المصنفة مع e. القولونية سلاله OP50. وتستخدم اختيارات الأسلاك البلاتين لنقل اليرقات والشباب البالغين c. اليجايليس دون الاضرار الحيوانية19.
- اعداد 1 ٪ ميثيل السليلوز (القط. H7509-25G) الحل في المخزن المؤقت مسنومكس.
ملاحظه: يجب ان يحرك ميثيل السليلوز في الحارة مسنومكس حتى يذوب. وبمجرد الاستعداد ، يمكن تخزين هذا الحل في درجه حرارة الغرفة. - أضافه 500 μL من 1 ٪ ميثيل السليلوز في الحل في الاكتئاب من شريحة المجهر المقعر. سيتم استخدام هذا العازل اللزج في مناسبتين: 1) عند حصاد الاجنه المبكرة عن طريق تشريح الديدان البالغة و 2) عند غسل الاجنه المتاخره المرحلة المنتقية مباشره من صفيحه NGM.
ملاحظه: يستخدم ميثيل السليلوز لمنع الاجنه من التصاق بشريحة المجهر. - لتصوير الاجنه في مرحله متاخره ، قم بانتقاء أجنه من الدرجة الاولي (يفضل ان تكون من لوحه ngm مع البالغين الشباب الحاضرين) باستخدام اختيار رمش ، ونقل الاجنه إلى 1 ٪ ميثيل السليلوز علي شريحة المجهر المقعر. يساعد اختيار الرموش علي تقليل القوه التالي تقليل الضغط أو التلف الذي يصيب الاجنه اثناء المناولة. يتم تغطيه الاجراء لجعل اختيار رمش من قبل هارت20.
- مع اختيار رمش الثانية (في اليد المعاكسة) ، والاستفادة من كل من الرموش بلطف معا لتعليق الاجنه في ميثيل السليلوز.
- اختياري: إذا كان التخطيط لنسب الخلايا الجنينية مع StarryNite ، يجب علي المرء ان جبل 1 خليه إلى 4 خلايا الاجنه. للقيام بذلك ، أولا تحديد البالغين الشباب من لوحه NGM ونقلها إلى محلول السليلوز ميثيل مسنومكس علي شريحة المجهر المقعر باستخدام اختيار سلك البلاتين.
- اختياري: مع النصائح شحذ من الابر تحت الجلد (no. 18G x 1 1/2) ، شريحة بشكل مستعرض الحيوانية في منتصف الجسم للإفراج عن خليه 1 إلى 4-خليه الاجنه.
3. ماصه الفم: تجميع أنبوب الشفط مع ماصه ميكروشعري
ملاحظه: نحن نستخدم أنبوب الشفط مع اليد سحبت ماصه الشعرية الصغيرة ادراجها في طوقا مطاطيه من الأنبوب. وهذا يسمح لنا لنقل الاجنه من الشريحة تشريح إلى السطح بولي-L-يسين-المغلفة في غرفه التصوير العازلة مملوءة.
- اسحب الماصة الشعرية المجهرية يدويا علي لهب مفتوح لإنشاء نصفين مع نصائح امتدت.
- تاخذ نصف الماصة ميكروشعري وادراج نهاية حاده في طوقا مطاطيه من أنبوب الطامح (الشكل1C). تعيين النصف الآخر من ماصه ميكروشعري جانبا للاستخدام في وقت لاحق (إذا لزم الأمر).
- مع أنبوب الشفط المجمع المزود بماصه الشعيرات المجهرية ، اكسر برفق طرف ماصه الشعيرات المجهرية وأنشئ فتحه تناسب حوالي 1 – 2 مضغه (من هنا علي هذا الجهاز يسمي "ماصه الفم").
4. الاجنه المتصاعدة c. اليجس علي بولي-L-يسين المغلفة كوفيرسليب
- مع اللسان الطامح عقد بلطف بين الأسنان ، قبل ملء ماصه ميكروشعري مع 10-15 μL من مسنومكس العازلة ومن ثم تمتص برفق عده أجنه من الشريحة مقعره في الشعرية.
- نقل الاجنه إلى غرفه التصوير الصلب مليئه مسنومكس العازلة ، وضع الطرف الشعرية بحيث الاجنه سوف تقع في المستطيل المركزي للكوفرشفه.
- تجنب أصابه الاجنه ، حركها برفق مع اختيار رمش أو استخدام ماصه الفم لوضع الاجنه عموديا ، لتوجيه الاجنه بحيث يكون المحور الطويل للجنين متعامدا مع المحور الطويل للكوفرشفه (الشكل 1B أقحم ، لوحه أسفل).
ملاحظه: تحديد موضع الجنين في هذا الاتجاه يقلل من عدد الشرائح إلى الصورة ، التالي تقليل الجرعة الخفيفة ووقت معالجه البيانات مع تحسين سرعه الاستحواذ. - وضع غرفه التصوير الصلب في حامل العينة علي مرحله المجهر (الشكل 1D).
5. الجمعية ، واعداد البرامج والليزر الأمثل للتصوير الجنيني باستخدام diSPIM
- انظر التعليمات خطوه بخطوه حول كيفيه تجميع diSPIM بألياف بأكملها من الأجزاء المتاحة تجاريا في كومار وآخرون10,11 وفي http://www.dispim.org. وهناك أيضا بروتوكول فيديو لكيفيه تجميع diSPIM متاح علي موقع ASI (http://www.asiimaging.com).
ملاحظه: اعداد الصك لهذا البروتوكول مطابق ل كومار et al.10,11 dispim, الذي يجعل استخدام 40x 0.8 na المياه الغمر العدسات للتصوير. الفرق الوحيد بين الاعداد في هذا البروتوكول و كومار et al.10,11 هو أضافه مراه ثنائيه اللون (تقسيم في 560 نانومتر) والأحمر والأخضر مرشحات ممر داخل جهاز تقسيم التصوير (نموذج A12801) المثبتة علي كل من diSPIM الاسلحه التصوير. أضافه البصريات تقسيم الصورة يسمح التقاط في وقت واحد من الصور من اثنين من الفلوبورس متميزة-متحمس من قبل 561 nm و 488 nm الليزر-عن طريق فصل عصابات الانبعاثات علي نصفين من نفس رقاقه الكاميرا. - بعد الجمعية الصك ، والتحقق من محاذاة البصرية diSPIM قبل التصوير.
ملاحظه: لمحاذاة diSPIM راجع https://youtu.be/qnOrg30NNuE ومعلومات الاجهزه http://dispim.org/hardware/objectives و http://www.asiimaging.com بشكل صحيح. - استخدام منصة مفتوحة المصدر الصغرى مدير (https://micro-manager.org/)21، الذي تم تحسينه لتشغيل المجاهر ورقه الخفيفة للتصوير الخلوي عاليه الانتاجيه22. نوصي باستخدام المساعد ASI diSPIM لاكتساب متعدد المواقف ، والذي يسمح بالتصوير المتزامن لما يصل إلى 30 مضغه كما هو موضح في23.
- مع مدير مايكرو مفتوحة ، وتعيين كثافة الليزر إلى ~ 179 μW (0.5) ل488 نانومتر و ~ 79 μW (0.25) ل 561 nm (الشكل 2A ، المستطيل الأحمر ).
ملاحظه: هذه هي الإعدادات الموصي بها للتصوير علي المدى الطويل من الاجنه c. التي تستخدم فترات دقيقه واحده. خلال التصوير المزدوج ألوان علي المدى الطويل ، يتم استخدام الليزر 561 nm لصوره نوى (Mcherry:: Histone) حتى تكون الاجنه في مرحله الفاصوليا ، وعند هذه النقطة الليزر 488 nm ثم تتحول إلى صوره أيضا الخلايا العصبية المسمية gfp. هذه الظروف التصويرية هي الأمثل للتقليل من السمية الضوئية وضمان البقاء والفقس من الاجنه في حين تمكين لفترات طويلة (12-14 ساعة) الاستحواذ المستمر للبيانات النمو العصبي والشيخوخة. - في مايكرو مدير ، واختيار الإضافات القائمة > جهاز التحكم ≫ asi dispim لفتح النافذة عاصي Dispim ( الشكل2b). اختر علامة التبويب الاستحواذ. في قسم إعدادات حفظ البيانات في علامة التبويب هذه (المستطيل الأخضر) ، وقسم إعدادات وحده التخزين (المربع الأزرق) ، ومقطع إعدادات الشريحة (المربع البرتقالي) ، تاكد من تعيين كل معلمه كما هو موضح في الشكل 2b.
ملاحظه: تم تكييف برنامج تحليل الصور الخاص بنا للعمل مع تنسيقات بيانات المخرجات الاختيارية الأخرى مثل سلسله ملفات OME-TIFF المجمعة وسلسله ملفات TIFF-ستاك التي تم إنشاؤها بعد الاستحواذ من خلال استخدام وظيفة التصدير المضمنة في المدير الصغير. بشكل عام ، يتم استخدام تنسيق بيانات الملفات التي تم تجميعها من نقطه واحده في الوقت المفرد لأنه يسمح بالعرض والمعالجة في الوقت الحقيقي لحجم الصورة بمجرد الحصول علي البيانات الاوليه.
6. معلمات التركيز البؤري التلقائي الأمثل للتصوير علي المدى الطويل من الاجنه c. ايليجنس
- اضبط معلمات التركيز البؤري التلقائي للمدير المصغر علي الإعدادات التي تم تحسينها لتناسب النسب الطويلة الأمد-الجودة التي يتم بها التصوير بالصور الخاصة باجنه c. ايليجنس . في النافذة ASI diSPIM ، انقر فوق علامة التبويب التركيز البؤري التلقائي (الشكل 2c). في قسم خيارات التركيز البؤري التلقائي العام (المربع الأسود) ، حدد المعلمات بدقه كما هو موضح. لاحظ ان قناه التركيز البؤري التلقائي (المربع الأحمر) يجب ان تحدد قناه القناة النووية الفلورية في تجارب الشيخوخة.
ملاحظه: إذا كانت الازاحه القصوى أكبر من 5 μm ، فان الصور تميل إلى الانحراف عن التركيز. - انقر فوق ، الإضافات > أدوات الاستحواذ > تراكب النقش.
- في نافذه تراكب النقش ، انقر فوق إظهار الشبكة.
- في الإطار ASI diSPIM ، انقر فوق علامة التبويب التنقل.
- انقر فوق خانات الاختيار لشعاع وورقه من المسار A أو B ثم انقر فوق Live. يبدا اكتساب الصورة. يتم فتح اطار عرض مباشر . حدد منطقه تحليل التركيز التلقائي للجنين عن طريق رسم مربع حول الجنين علي القناة المحددة من 6.1.
ملاحظه: نحن عاده التقاط 420 النقاط الزمنيه ل 10 الاجنه في جلسة التصوير. وعاده ما تكون البيانات الاوليه لكل جلسة صوره 1.7 تيرابايت ، في حين ان البيانات المجهزة بالتفكيك و StarryNite هي 1.4 تيرابايت (انظر الخطوتين 9 و 10). نوصي باستخدام الاقراص الصلبة كبيره السعه (18 تيرابايت علي نظامنا الحالي) للحصول علي الصور ، والمنصات السحابية لتخزين الصور. - انقر فوق بدء الاستحواذ في علامة التبويب "اكتساب " لبدء التقاط الصور متعدد الابعاد علي المدى الطويل (الشكل 2b).
7. فتح الخام الصغيرة مدير الصور في العرض الخلوي
- قم بتنزيل حزمه البرامج من http://dispimlineage.wormguides.org.
ملاحظه: سيتم تحميل حزمه البرامج كملف .zip وسوف تحتاج إلى استخراج إلى "C:\" دليل قبل الاستخدام. يتم إعطاء مزيد من التفاصيل للتثبيت في http://dispimlineage.wormguides.org/diSPIMlineaging_InstallationInstructions.htm. - انقر نقرا مزدوجا فوق الملف C:\سيتوشويداكساسيفوركشويدسيتوهيابيدجنلب لبدء تشغيل العرض الخلوي.
- اختر ملف القائمة > جديد > Dispim مراقب (مايكرو مدير). حدد موقع مجلد مجموعه البيانات الجذر حيث تم حفظ مجلدات النقطة الزمنيه الاستحواذ. حدد اي مجلد مرجعيه ثم انقر فوق فتح. نوافذ الملاحة متعددة الابعاد (ودعا Dispim مراقبه ويندوز) يتم فتح تلقائيا لكلا spima و spima (الشكل 3a).
ملاحظه: هذه الإطارات سيتم مراقبه مجلد البيانات الجذر لمكدسات الوقت الخام المحفوظة حديثا (في حاله انه لا يزال يتم تسجيل نموذج). بعد الحصول علي كل نقطه زمنيه جديده ، سيتم تحديث كل من النوافذ التي تراقب أذرع SPIM المميزة ومواضع العينات لعرض مجموعه البيانات المتعددة القناات رباعيه الابعاد بأكملها لكل جنين.
8. توليد الصور الإسقاط ماكس مع العرض الخلوي
وحتى قبل التفكيك ، يمكن معالجه البيانات الاوليه بسرعة لتقييم الخصائص العالمية للعينه.
- انقر علي الزر Z- الباقة علي اللوحة الجانبية اليسرى لنافذه الصورة (الشكل 3a ، المستطيل الأحمر) لجعل الحد الأقصى للتوقعات من خلال العمق الكامل والدورة الكاملة لموقف معين أو ذراع spim. ستظهر نافذه التكديس الفوقي للإسقاط Z .
- في اطار المكدس الفائق العرض Z ، قم بتعيين نوع الإسقاط إلى اقصي كثافة. حدد القناات والشرائح وإطارات النقاط الزمنيه لمعالجتها استنادا إلى تفضيل المستخدم.
- انقر فوق "موافق" عند إكمال.
- حدد موقع المجلد لحفظ المخرجات شده الحد الأقصى من اطار حوار الملف ثم انقر فوق موافق. السماح لبعض الوقت (15-20 دقيقه ، اعتمادا علي حجم مجموعه البيانات وقوه المعالجة من الكمبيوتر) لعرض السيتوضوئي لتوليد الصور الإسقاط.
9. تحليل السلالات الخلية في البيانات الحجمي عاليه الدقة الانسيابية
- اختياري: مع فتح البيانات الخام عبر مراقبه Dispim في العرض الخلوي ، حدد أداه تحديد المضلع (الشكل3a ، الأسهم السوداء) وانقر فقط خارج الجنين الامامي والخلفي والظهري والبطني الحواف (في هذا الترتيب الدقيق) إلى توليد نمط "bowtie" علي الجنين. القيام به لكلا وجات النظر (SPIM-A و SPIM-B ، الشكل 3A).
ملاحظه: يحدد هذا التحديد منطقه الفائدة البيضاوية (ROI) التي يتركز فيها الجنين ويسجل المحور الامامي الخلفي للجنين. العظة نمط ربطه الإشارات الخلوية ان المستخدم يخطط لمزيد من تحديد دوران دقيق لوحدات التخزين النهائية تنصهر في الاتجاه الذي هو الأمثل لتحليلات الشيخوخة من قبل starrynite/اسيتري. في الحالات التي لا تكون فيها السلالة StarryNite جزءا من الخطة التجريبية ، قد يتم اختيار أدوات واشكال التحديد الأخرى لتعيين عائد الاستثمار لمعالجه الصور. - إذا كانت الاجنه متعددة في وقت واحد باستخدام خيار اكتساب متعددة المواقف ، فتح وتنفيذ الخطوة 9.1 لجميع الاجنه. وهذا سيسمح بالتنفيذ المتوازي للخطوات المستقبلية لجميع الاجنه في جلسة واحده. إغلاق ويندوز سيما والنوافذ SPIMB لأي الاجنه كنت لا ترغب في معالجه.
- انقر فوق الزر dispim علي لوحه الجانب الأيسر من نافذه مراقبه dispim (الشكل 3a، وأبرز باللون الأصفر). وهذا يكشف عن لوحه فرعيه من عناصر التحكم الخاصة بمعالجه diSPIM.
- محاذاة القناات الخضراء والحمراء لكل ذراع SPIM. لأنه يتم استخدام الشرائح قناه الانبعاثات للتقاط الصور الحمراء والخضراء متميزة في وقت واحد علي نفس الكاميرا ، فمن المهم لمحاذاة بصريا تسجيل بكسل الدقيق لهذين الحقلين صوره المتجاورة فعليا عندما تكون مضافه. ومن الممكن عاده أعاده استخدام تعديلات المحاذاة نفسها علي العديد من جلسات التصوير المتتابعة ، ولكن يجب التحقق منها (كما هو الحال في الخطوات 9.4.1 – 9.4.5).
- بدءا من لوحه SPIMA ، حدد القناة الحمراء عن طريق تحريك شريط التمرير CM إلى اليسار (الشكل 3a، السهم البرتقالي ، لوحه اليسار).
- باستخدام x-، y-، و z-التسويات (الشكل 3A، البرتقالي مربع) ، وتحويل القناة الحمراء لتتناسب مع الأخضر.
- انقر فوق الزر Dispim (الشكل 3a، وأبرز باللون الأصفر) ، لإغلاق اللوحة الفرعية ونشر الزناد من نفس التحولات إلى جميع النوافذ الموقف الأخرى.
- تاكد من ان المحاذاة الصحيحة التي تم نشرها إلى الإطارات والنقاط الزمنيه الأخرى عن طريق تحريك شريط التمرير "z" (الشكل3a، السهم الأزرق ، اللوحة اليسرى) و/أو "t" شريط التمرير (الشكل 3a، السهم الأخضر ، اللوحة اليسرى). وإذا تم الحصول علي الحيازة المتعددة والاجنه العديدة (الخطوة 5.3) ، فان المحاذاة ينبغي ان تنتشر أيضا إلى تلك الاجنه. تاكد من خلال فحص الأرقام أيضا ل x-، y-، و z-التسويات (الشكل 3A، البرتقالي مربع ، والتي ينبغي ان تكون هي نفسها للوحه spima من جميع الاجنه).
- كرر الخطوات 9.4.1 – 9.4.4 لنافذه المراقبة SPIMB diSPIM (الشكل 3A، اللوحة اليمني).
- انقر علي زر "Dispim" ثم زر "فيوز" (الشكل3a ، مستطيل ازرق) لفتح مربع حوار يسمي "تفكيك وحدات تخزين البيانات الاوليه ديفولفي/فيوز Dispim" (الشكل3a). تعيين المعلمات كما هو موضح في الشكل 3 ب. يتم تناول هذه المعلمات بإيجاز في الخطوات الفرعية التالية:
- تعيين مفتاح التسجيل علي قناه 1 (488 nm الليزر) أو 2 (561 nm الليزر). حدد القناة ذات الإشارات الأكثر كثافة أو الأكثر انتشارا. لتجارب السلالات دائما تحديد القناة المستخدمة للصورة النووية الحجرية في كل مكان.
- تعيين الاتجاه النسبي لوحدات تخزين الإدخال إلى + 1 أو-1. يعتمد مؤشر الاتجاه الصحيح علي مواضع الكاميرا المحددة في diSPIM (الشكل 4).
ملاحظه: إذا كان غير مؤكد ، اختبار كل خيار عن طريق تكرار نقطه زمنيه واحده من كلا SPIM A و B Dispim مراقبه الإطار، التالية الخطوات 9.1 – 9-12 واختيار بشكل تعسفي وحدات تخزين إدخال الاتجاه النسبي للاختبار. ستسفر الاتجاات غير الصحيحة عن صور ضبابية مع القطع الاثريه ، بينما ستسفر الاتجاات الصحيحة عن صور واضحة. يمكن بعد ذلك أعاده استخدام قيمه الاتجاه النسبي لوحدات تخزين الإدخال التي تعطي الصورة الواضحة لكافة البيانات المستقبلية من الاداه dispim المعطية. - اختر ما إذا كانت وحده التخزين المنصهرة يجب ان توجه نفس وحده التخزين المدخلة A أو B (استنادا إلى تفضيل المستخدم).
- حدد "تسجيل جديد لكل وحده تخزين". يتحكم هذا الخيار في كيفيه حساب SpimFusion مصفوفات التسجيل لكل زوج وحده تخزين في كل نقطه زمنيه. الخيار "الطازجة" يسمح الخوارزميه لتحسين التسجيل بشكل متكيف في كل نقطه زمنيه.
- تعيين عدد تكرارات أزاله التشكيل إلى 10. هذا العدد يميل إلى العائد بشكل موثوق الدقة العالية المطلوبة بطريقه فعاله من حيث الوقت.
- اختياري: إذا كان المطلوب لصناعه السيارات في الشيخوخة (موصي به للغاية) ، تحقق السيارات-إطلاق StarryNite سلاله من وحدات التخزين تنصهر. هذا الخيار سوف تطلق StarryNite تلقائيا لتقسيم وتتبع الخلايا في الاحجام التي تنتجها SpimFusion.
- اختياري: للحصول علي اعلي دقه في السلالة المؤتمتة ، فمن الأفضل لتغيير حجم الاجنه المنصهرة ايزوتروبيكالي إلى "العدل" المتعارف عليه (Aتشطيب [x-غرب] ، Dorsal [y-الشمال] ، الاتجاه الأيسر [z-القريب]). حدد الخيار تعريف اتجاه إخراج وحده التخزين في المعاينة للاشاره إلى هذا الخيار. سوف الاستجابة الخلوية عن طريق معالجه زوج الاولي من وحدات التخزين المنصهرة ، مما يسمح للمستخدم لمراقبه عن كثب وتحديد التناوب اللازمة لتحقيق التسجيل العدل.
- انقر فوق نعم بمجرد تحديد كافة المعلمات.
- حدد دليل الإخراج الذي سيتم حفظ الملفات المعالجة فيه. انقر فوق موافق.
- اختياري: إذا تم تحديد تحديد اتجاه إخراج وحده التخزين في المعاينة ، قم بتعيين شريط التمرير t (الشكل 3a، السهم الأخضر ، اللوحة اليسرى) في نافذه spim-A إلى النقطة الزمنيه المبكرة التي وصلت فيها خلايا ABa و الجسر الأكاديمي إلى الغيبية. تعيين شريط التمرير t في اطار spim-B إلى مرحله فاصله اللاحقة من التطوير. سيساعد هذا في تحديد اتجاه العدل.
- اختياري: انقر فوق موافق عند الاستعداد. إذا تم تحديد خيار المعاينة في 9.5.7 أعلاه ، سيتم دمج وحدات تخزين المعاينة اثنين فقط للنقاط الزمنيه المشار اليها بواسطة المتزلجون من نوافذ الصور SPIM-A و SPIM-B. ويمكن استخدام نقطتي المعاينة الزمنيين لتحديد الضبط الدقيق لاحجام الاجنه الناتجة إلى اتجاه العدل ، كما هو موضح أدناه.
- حدد موقع 3DProjY_Decon-Fuse_ المعروضة حديثا.... اطار. انقل شريط التمرير t إلى النقطة الزمنيه 2 من نافذه المعاينة هذه. حرك منزلق Z حتى تظهر الصورة مباشره أسفل المحور الطويل للجنين.
- نقل شريط التمرير t مره أخرى إلى النقطة الزمنيه 1 من 3DProjY_Decon-fuse_.... اطار. اختر أداه تحديد الخط وارسم تحديدا للخط من الخلية EMS (النواة المدورة الأكثر) من خلال الطائرة من لوحات الخلايا الغيبية AB.
- انقر فوق الزر معاينه البرتقالي diSPIM علي 3DProjY_Decon-Fuse_.... اطار. سيتم حفظ التعديلات الدقيقة لاتجاه وحده التخزين التي تمت معاينتها للاستخدام في معالجه مجموعه البيانات الكاملة.
- اختياري: سيظهر مربع الحوار وحدات تخزين البيانات الاوليه الخاصة بتفكيك/فيوز diSPIM مره ثانيه ، تماما كما في الخطوة 9.5 أعلاه. انقر فوق نعم بدون اختيار تعريف اتجاه إخراج وحده التخزين في المعاينة الخيار. حدد "مجلد الإخراج" لتشغيل معالجه البيانات بالبالكامل.
- تعيين أشرطه التمرير t (الشكل 3a، السهم الأخضر ، اللوحة اليسرى) من الإطارات المراقبة dispim إلى نقطه البداية (spima) ونقطه النهاية الزمنيه (spima) من الفترة الكاملة من الصور لمعالجه. ثم انقر فوق موافق.
- ومع تقدم SpimFusion ، فان العرض الخلوي يفتح وينعش نافذه متعددة الابعاد تبين الحجم المنصهر لكل جنين ، بالاضافه إلى نافذتين مع توقعات الكثافة القصوى الدورية رباعيه الابعاد للحجم المتساوي الانسيابي. خلال هذا الوقت ، لا تعطيل أو إغلاق اي نافذه العرض الخلوي حتى اكتمال الانصهار الانسيابية وتتبع النسب.
- اختياري: لاحظ انه بمجرد ظهور شاشه البداية StarryNite واختفي في وقت لاحق ، تم إكمال خط أنابيب المعالجة الكاملة للبيانات. يجب ان لا يتم إغلاق هذا الإطار اثناء المعالجة أو سيتم مقاطعه StarryNite.
10. فتح StarryNite سلسله تتبع النسب في اسيتري (اختياري)
- فتح النسخة المخصصة من "AceTree_16BitCompat" المقدمة.
- اختر قائمه الملف > فتح تكوين الملف. حدد موقع دليل الإخراج المشار اليه مسبقا إلى عرض الجهاز الخلوي. افتح المجلد الفرعي Decon_fuse_.. . _Pos [n ] للجنين [n]. حدد aaa_edited وفتح.
- استخدام القائمة اسيتري تحرير > تحرير الاداات لفتح المسار تحرير وضبط أو حذف الخلايا النوافذ.
- انقر فوق دائره نصف مظلله الشكل 5B ، المربع الأحمر لضبط كثافة الأحمر والأخضر.
- المضي قدما في التصور النسب والتحرير كما هو موضح سابقا5,6,8 (المخطوطات مدرجه أيضا في حزمه التحميل لدينا).
النتائج
لقد قمنا أولا بالتحقق من صحة الاجنه التي تستخدم معلمات البروتوكول لاكتساب diSPIM (الأقسام 1-6). وفي الوقت نفسه ، كانت عشره أجنه في سن 20 درجه مئوية ، وحجم واحد/جنين/دقيقه ، من المرحلة الثانية إلى المرحلة الثانية (7.5 ساعة ، 451 حجما/جنينا). لمراقبه الانقسامات الخلية في جميع انحاء الاجنه ، استخدمنا سلاله BV514 ، والتي تعبر بشكل مطلق عن Mcherry::histone مراسل يبني من مصفوفة ترانسجين متكاملة ujIs11324. ويبين الشكل 6 جدولا زمنيا لهذا النصف الأول من النمو الجنيني لأحد الاجنه التي لا عمر لها. وتمثل كل صوره إسقاطا لاقصي كثافة عرض واحد (التي تنتجها الخطوات 7-8) من الجنين الذي لا عمر له. ووجدنا ان البروتوكولات المحسنة لم تحفز اي تسمم ضوئي قابل للكشف علي الاجنه ، وفقا لتقدير توقيت انقسامات الخلايا (غير المعروضة) ، ووقت الفقس ، والتوقيت المتعلق بالمعالم الانمائيه (الشكل 6 والمراجع1 , 25 , 26).
ثم قمنا بتطبيق البروتوكول لتحليل ديناميات النمو من الخلايا العصبية واحده في تطوير الاجنه. نحن تصوير DCR7692 (olaex4655) ، سلاله الديدان الخيطية المحورة وراثيا التي تعبر عن gfp قباله المروج نيوروببتيد flp-19 في مجموعه فرعيه من الخلايا غير المعروفة (DACR2819 ، الجبهة الثورية-19 (3.6 kb):: Syn21:: gfp:: caax::p 10 3 ' utr) . بعد خطوات البروتوكول المبين هنا ، قررنا ان الخلايا غير المعروفة تتوافق مع الحركية العصبية RMDDL و RMDDL ، إلى خليه قناه الإخراج ، والي خليتين العضلات (الشكل 7). ثم درسنا وكميه ديناميات النمو من الخلايا العصبية RMDDL و RMDDL. لاحظنا ان RMDDL و RMDDL الخلايا العصبية علي شكل غير المباشر في وقت مبكر 360 دقيقه بعد الإخصاب ، مع المحور الخلوي أطول يمثل المحور اللاحق لنمو العصب العصبي (الشكل 7 و S1 الفيلم). باستخدام "تتبع العصب بسيطه" المساعد في فيجي وتطبيقه علي أعاده بناء 3d من وحدات التخزين المنصهرة ايزوتروبيكالي ، ونحن ثم كمي نمطي ثمره من rmddl و rmddl العصبية لسته أجنه. قررنا ان ديناميات النمو كانت نمطيه لل RMDDL و RMDDL عبر الاجنه (هنا تسمي Rmddl). من 385-410 دقيقه بعد الإخصاب, العصب RMDDs الموسعة 6.0 ± 0.5 μm (يعني ± SEM; n = 12 العصب) الامامي من الهيئات الخلية (الشكل 7 ب، ج ، ط). من 415-445 دقيقه بعد الإخصاب ، كلا العصبين توسيع دورسالي إلى وحول حلقه العصب المفترض (النجمة في الشكل 7D). في المتوسط ، كل RMDD العصبية الموسعة 11.0 ± 0.6 μm (يعني ± SEM ؛ n = 12 العصب) من جسم الخلية قبل الاجتماع متزامن نظيره المقابل في قمة الحلبة (الشكل7i). والاهم من ذلك ، ان نتائجنا التمثيلية تثبت اننا قادرون علي دراسة ومقارنه وقياس الخصائص التنموية العصبية للخلايا الوحيدة القابلة للتحديد باستخدام بروتوكولنا المتكامل (الشكل 7 والشكل 8).
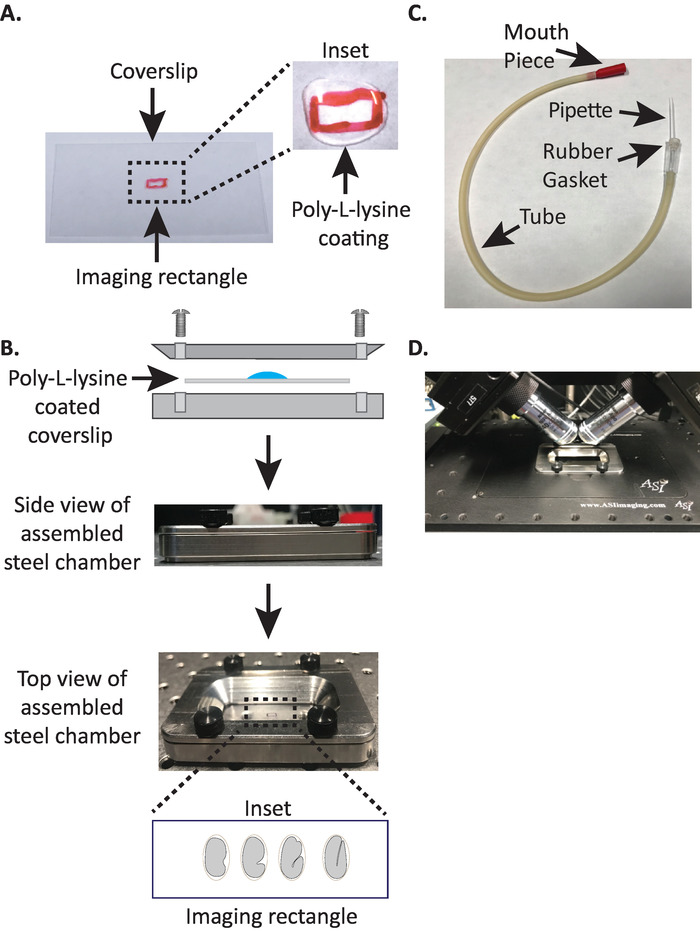
الشكل 1: الاعداد المتزايد لنموذج diSPIM. (ا) اعداد كوفيرسليب مع بولي-L-يسين. في الداخل ، تم استخدام 10 μL من بولي-L يسين لمعطف المشبك لمده 5 دقائق. بولي-L-يسين يسمح لقشر البيض الجنين لعصا بحزم إلى كوفيرسليب في المستطيل. (ب) التخطيطي لغرفه التصوير الفولاذية والغرفة المجمعة. في الداخل ، يتم توجيه الاجنه التمثيلية مع المحور الامامي الخلفي عمودي علي المحور الطويل علي الشفة المخروطية. (C) أنبوب الشفط المجمعة مع ماصه ميكروشعري. (د) غرفه التصوير الفولاذية المثبتة في حامل العينات في اطار أهداف dispim 40x. يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.
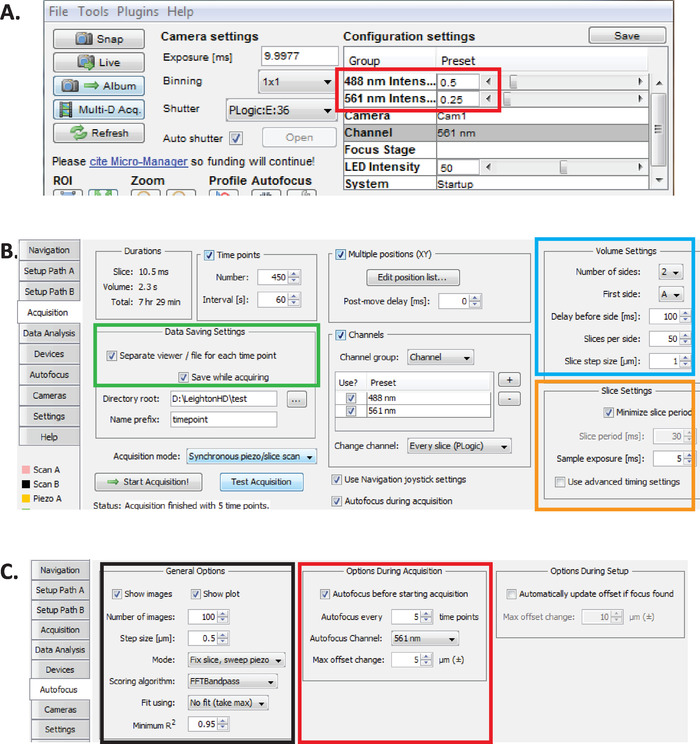
الشكل 2: اعداد التصوير diSPIM طويل الأمد في المدير الصغير. (ا) الموصي بها dispim معلمات الطاقة بالليزر (المستطيل الأحمر) الأمثل للتصوير لفترات طويلة مع الحد من السمية الضوئية (كما يتم تقييمها من قبل معدل الفقس اعلي من الاجنه c. ايليجنس ). تعيين 561 nm الليزر إلى 79 μW (0.25) و 488 nm الليزر إلى 179 μW (0.5). لاحظ ان المعايرة الدقيقة لإعدادات البرنامج لقوه الليزر تختلف بين عمليات التثبيت diSPIM. فمن المستحسن ان المستخدمين قياس ومعايره قوه الليزر من أجل تحقيق 79 μW (561 nm) و 179 μW (488 nm) قوه الليزر. (B) معلمات dispim لحفظ البيانات (المستطيل الأخضر) ، وإعدادات الصوت (المربع الأزرق) ، وإعدادات الشريحة (المربع البرتقالي). (ج) معلمات التركيز البؤري التلقائي dispim للتصوير علي المدى الطويل من الاجنه c. اليجس (انظر الخطوات 6.1-6.6). يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.

الشكل 3: التصور المصور واعداد معالجه البيانات باستخدام العرض الخلوي. (ا) صور dispim الخام التي تم فتحها بواسطة العرض الخلوي. العرض الخلوي قادر علي فتح الصور الملتقطة بواسطة مسارات الكاميرا (SPIM A و B). يتم فتح هذه الصور الخام في إطارات متعددة الابعاد تسمي شاشه Dispim. في شاشه Dispim، يتم إنشاء "نمط bowtie" لتحديد الحواف الاماميه والخلفية والظهرية والبطنية للجنين (انظر الخطوة 9.1). القوس التعادل التحديدات تشير إلى اتجاه الجنين لأزاله التشكيل و StarryNite-بمساعده تتبع الشيخوخة. (ب) المعلمات المحسنة المستخدمة لتوليد الصور الانسيابية. في اثناء الحصول علي نافذه ، قم بتعيين المعلمات المحددة في الخطوات 9.5.1-9.5.8. يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.
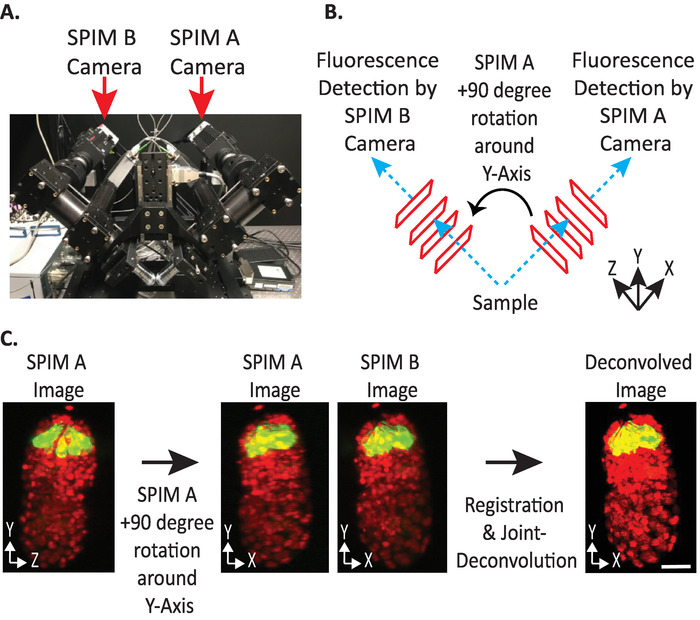
الشكل 4: تكوين الكاميرا diSPIM. (ا) صوره لمواضع وتوجات كاميرا dispim. (ب) تصوير + 90 درجه دوران Spim A لمطابقه صور Spim B التي تم جمعها. (ج) حجم المدخلات بالنسبة إلى مؤشر الاتجاه + 1 استنادا إلى تكوين الكاميرا dispim الخاص بنا (انظر الخطوة 9.5.2). نحن تدوير SPIM صوره (ق) + 90 درجه حول Y-محور قبل التسجيل لمطابقه SPIM B صوره (ق). قضبان المقياس = 10 μm. الصور هي العرض التمثيلي الوحيد ، والإسقاطات ذات الكثافة القصوى ، والصور غير الحلزونية للجنين ال1.5 بالنواة المسمية (561-nm ، والأحمر) والخلايا العصبية (488-nm ، والأخضر). يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.
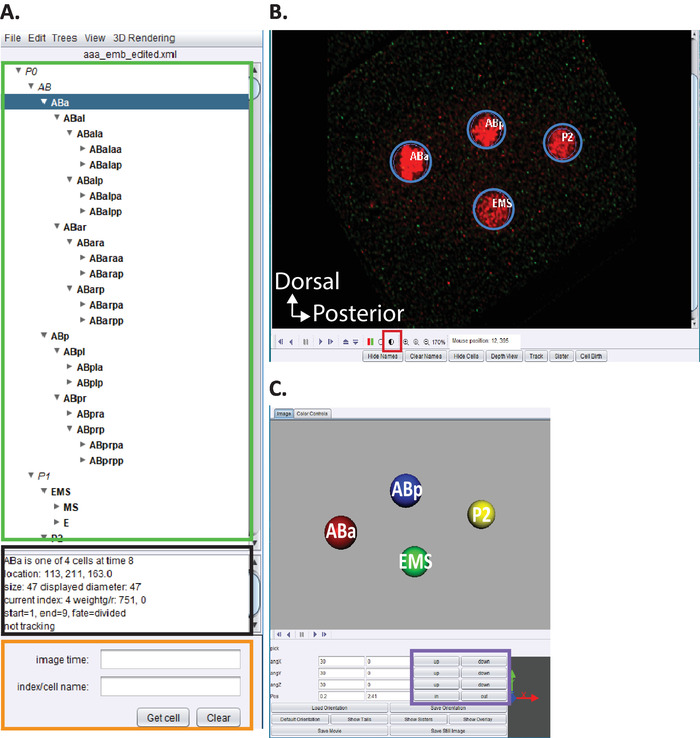
الشكل 5: التجعيد والتحرير السلالة الجنينية c. اليجس في اسيتري. (ا) نستخدم اسيتري لتحرير اثار سلاله starrynite (انظر المراجع5،6،8؛ المخطوطات مدرجه أيضا في حزمه التنزيل لدينا). سوف اسيتري عرض الأسماء النظامية c. اليجس لكل نواه (المستطيل الأخضر) عند الانتهاء من الخطوات 10.1-10.2. يوفر هذا الإطار (A) معلومات (مستطيل اسود) حول كل خليه في تتبع النسب (ABa ، المميز باللون الأزرق) التي تساعد في توجيه المستخدمين عند تعقب وتحرير اثار النسب. من المستحسن ان يقوم المستخدمون بالتحقق من الخلايا الخلوية ومقارنه مواضعها بسلاله الخلايا الجنينية c. التي سبق الإبلاغ عنها من قبل sulston et al.1 بالاضافه إلى ذلك ، إذا كان المستخدمون مهتمين بتحديد مواقع خلايا محدده في سلسله البيانات التي تم تفكيكها (انظر أدناه ، B) ادخل الاسم المنهجي c. اليجس في شريط البحث (مستطيل برتقالي). (ب) ان سلسله البيانات التي يقوم المستخدم بتفكيكها تفتح أيضا تلقائيا عند الانتهاء من الخطوات من 10-1 إلى 10-2. تظهر هنا صوره تنصهر فيها الاجنه ذات الخلايا الاربعه مع نوى مسماه باللون الأحمر. اثناء تتبع نوى ، يجب علي المستخدمين تغيير كثافة الصورة (المربع الأحمر) والتنقل عبر الزمن و z باستخدام مفاتيح الأسهم علي لوحه المفاتيح الخاصة بهم (الوقت اليسار/اليمين ، z-اعلي/أسفل). (ج) رسوم متحركة ثلاثية الابعاد للنقطة الزمنيه في (ب) مع وظائف معينه (مستطيل أرجواني) تمكن من تدوير المرئيات ثلاثية الابعاد. للحصول علي نظره عامه علي اسيتري ووظائفه ثلاثية الابعاد ، راجع المراجع5،6،8. يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.
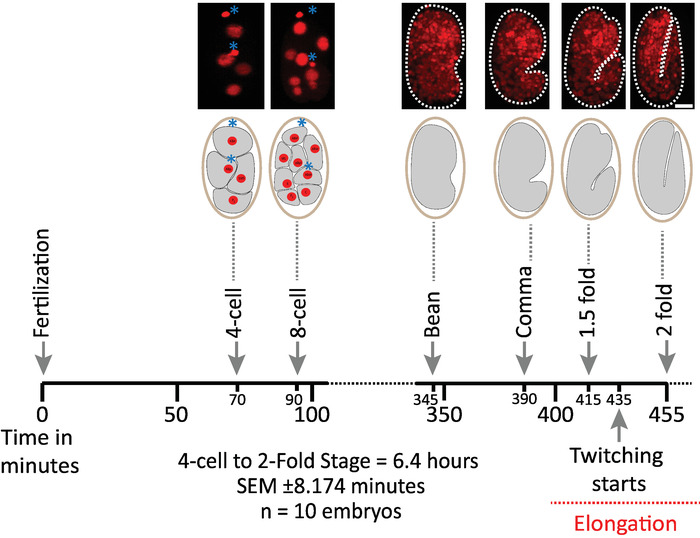
الشكل 6: ديناميات النمو الموقوتة لأجنه c. ايليجنس علي dispim. لوحه العلوي ، diSPIM الصور التي تظهر النصف الأول من النمو الجنيني لأحد الاجنه الذين تتراوح أعمارهم بين (سلاله BV514 ujIs11324). وكانت الاجنه مستمرة في العمر ، كل دقيقه ل7.5 ساعة (عند درجه حرارة 20 مئوية). تمثل أول صورتين من اللوحة العلوية أجنه من 4 إلى 8 خلايا مع نوى (احمر) ومواضع من الأجسام القطبية (المجالات الحمراء الكثيفة ، التي تتميز بالعلامات النجميه الزرقاء). وتمثل كل صوره عرضا فرديا لاقصي كثافة للجنين الذي لا يزيد عن العمر. قضبان المقياس = 10 μm. الخط الزمني (شريط أفقي) يمثل دقائق بعد الإخصاب (m.p.f.) لتطوير الاجنه c. ايليجنس . وقد تحققنا من ان بارامترات البروتوكول الخاصة بالاستحواذ علي diSPIM لم تحفز اي تسمم ضوئي قابل للكشف علي الاجنه التي يتم تقييمها بالقدرة علي البقاء ، وتوقيت انقسامات الخلايا ، وتوقيت الفقس وتوقيت المراحل التنموية (انظر المراجع 1 , 25 , 26). نلاحظ ان توقيت المراحل التنموية كانت قابله للتكرار عبر الاجنه مع معلمات التصوير لدينا (SEM ± 8.174 دقيقه لجلسات التصوير الطويلة 6.4 ساعة ؛ n = 10). يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.
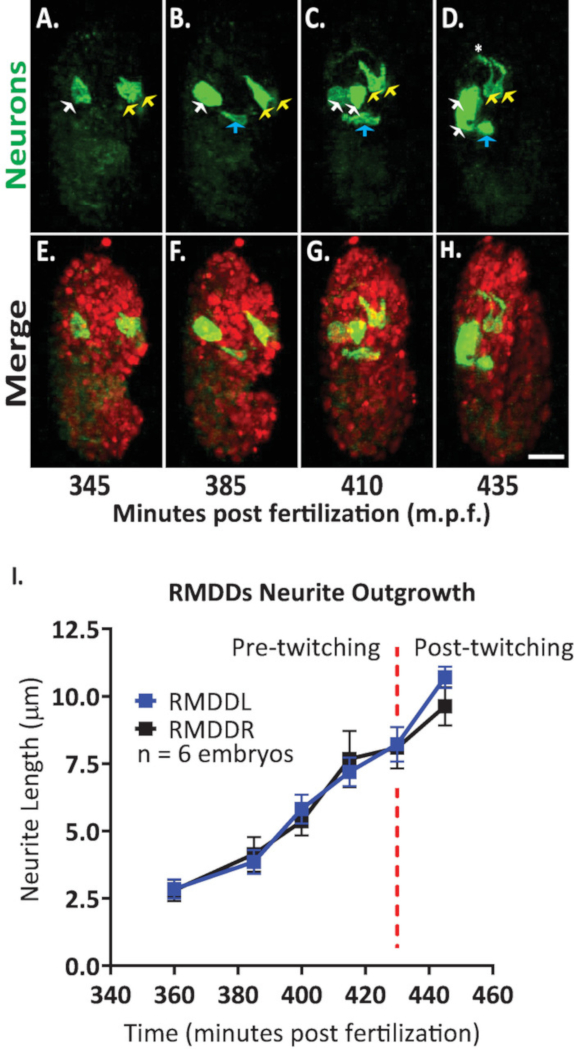
الشكل 7 الهوية الخلوية وتوصيف خليه واحده من ديناميات العصب العصبي في تطوير الاجنه c. اليجس . التصوير بألوان المزدوجة لسلاله التي ادلي بها عبور BV514 ujIs11324 (لسلاله) و DCR7692 (olaex4655) ، سلاله الديدان الخيطية المحورة وراثيا التي تعبر عن gfp قباله المروج نيوروببتيد flp-19 في مجموعه فرعيه من الخلايا غير المعروفة. (ا-ح) بعد خطوات البروتوكول المبين هنا ، قررنا ان الخلايا غير المعروفة تتوافق مع الحركية RMDDL و RMDDL (الأسهم الصفراء) ، إلى خليه قناه الإخراج (الأسهم الزرقاء) ، والي خليتين العضلات (السهام البيضاء). (ط) القياس الكمي لديناميكيات النمو العصبي RMDDL و RMDDL باستخدام فيجي المساعد "تتبع العصبية بسيطه" وتطبيقه علي أعاده بناء 3d من وحدات التخزين المنصهرة ايزوتروبيكالي. لاحظ كيف كلا rmddl و rmddl تظهر ديناميات نمطي ثمره ، كل تمديد بشكل متزامن لطول إجمالي 11.0 ± 0.6 μm (يعني ± SEM; ن = 12 العصب) والاجتماع في قمة الظهرية من حلقه العصب (انظر أيضا الفيلم S1). يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.
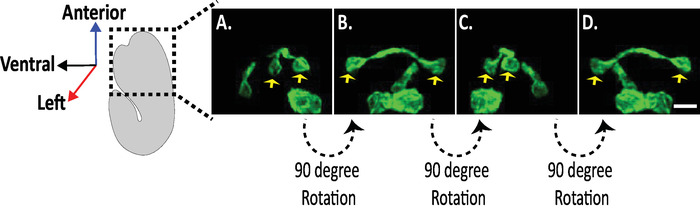
الشكل 8: فحص الصور الانسيابية للخلايا العصبية في أجنه ج. التصور الانسيابي للخلايا العصبية AVHL و AVHL (الأسهم الصفراء). باستخدام diSPIM ، يمكن القبض علي مورفولوجيس العصبية الغلة الصور رباعيه الابعاد (4D) مع الاستبانة المكانية الانسيابية من حوالي 330 نانومتر. يسمح diSPIM للمستخدمين بتدوير احجام الصور تقريبا بدقه متطابقة في كل الاتجاات. الصور في A-D هي إسقاطات الكثافة القصوى لنفس الصورة المنصهرة dispim وحده التخزين من التناوب متميزة حول محور الجنين طويلة. قضبان المقياس = 5 μm. الرجاء النقر هنا لعرض نسخه أكبر من هذا الرقم.
الفيلم التكميلي S1: c. اليجس الجنين النامية من 280 إلى 434 دقيقه بعد الإخصاب. الفيلم الانسيابي لسلاله DCR7692 (olaex4655) التعبير عن ujIs113 اوبيتامسلي مع DACR2819 التسميات العصبية rmdd قليله (الشكل 7a-D، والسهام الصفراء). DACR2819 أيضا التسميات اثنين من خلايا العضلات (الشكل 7a-d، السهام البيضاء) وخليه قناه الإخراج (الشكل7a-d، السهم الأزرق) اثناء النمو الجنيني (الشكل7a-d). قضبان المقياس = 10 μm. الرجاء الضغط هنا لتحميل هذا الملف.
Discussion
C. اليجاناس تبرز باعتبارها الكائن الوحيد مع المواقف النهائية والاتصال لكل الكبار العصبية المعروفة27. ومع ذلك ، فان الديناميكيات التنموية التي تؤدي إلى تنظيم دوائر العمل والشبكات التي تشكل الاتصالات الخاصة بالعاملين في c. لا تزال غير معروفه. استنادا إلى الفرص الناشئة من التقدم في المجهر الضوئي ، يمكننا الآن التقاط وتحليل مواقف الخلايا ، والتكوين العصبي ، وتكوين الأعصاب في جميع انحاء التنمية الجنينية c. اليجس .
الإجراءات التي وصفناها والتي نستخدمها بشكل روتيني في المختبر تعطي صورا رباعيه الخواص من الخلايا العصبية المسمية ونوى لسلاله الخلايا في الاجنه c. ايلينس . الأهم من ذلك ، لدينا الأمثل ظروف التصوير علي المدى الطويل مع diSPIM والمقرونة قدرات السلالة شبه المؤتمتة مع الصور عاليه الدقة لتحسين سرعه ودقه تحليل الاجنه c. اليجس . هذا البروتوكول المتكامل سيمكن المستخدمين من تصور وتحديد الخلايا والسمات ثلاثية الابعاد مثل الهجرة العصبية والفاسسيكوليشن العصبية من خلال بداية الوخز المبكر. هذا الاجراء يمكن تكييفها بسهوله في اي مرفق مع نظام diSPIM ASI ، ونحن نوصي هذا النظام علي وجه التحديد لهذا البروتوكول. قد تختلف تركيبات SPIM الأخرى المعروضة تجاريا من التكوين ASI في غرفه العينة والخصائص البصرية. ومع ذلك ، يمكن أيضا وضع البيانات المصدرة من منصات أخرى من خلال خط أنابيب البيانات لدينا. ولذلك ، فان تقييم قيمتها في الشيخوخة ، واختبار المطالبة من جوده الصورة واستقرار الصك ، أمر ممكن. علي الرغم من اننا نستخدم بنشاط diSPIM لصوره بانتظام العينات الأخرى (مثل دروفيسيلا والاجنه الزبرافيش) ، لا يزال تحليل السلالات الموصوفة والشاملة من الاجنه تقتصر حاليا علي أنواع الديدان الخيطية. بالنسبة للعينات الكبيرة أو السميكة ، فاننا نختار استخدام نهج المسح الضوئي للمرحلة ، والتي تفحص العينات من خلال ورقه ضوء ثابته. وقد سبق ان أظهرت كومار وآخرون هذا التحسن diSPIM الخضوع للحصول علي صور عاليه الجودة من عينات سميكه دون تعديلات اضافيه علي diSPIM10.
وتشمل الخطوات الهامه داخل البروتوكول تركيب أجنه من طراز c. اليجينز علي المشبك المغطي بالبولي-L-ليسين ، والحصول علي البيانات ، ومعالجه البيانات. حصاد وتركيب الاجنه c. اليجس علي الزجاج كوفيرسليب يمكن ان يكون تحديا للمستخدمين عديمي الخبرة ، ولكن هنا نقدم بروتوكول مفصل من الخطوات الرئيسية لتسهيل التعلم. إذا كان من المرغوب فيه التصوير علي المدى الطويل ، ونحن الحصول علي أفضل النتائج حصاد أربع خلايا أو الاجنه في وقت سابق من 8-10 الشباب البالغين28. لاحظ ان البالغين القدامى اقل رغبه في حصاد الاجنه المرحلة المبكرة لأنها تميل إلى احتواء الاجنه الأكبر سنا في الرحم والبيض غير المخصب. وفيما يتعلق بالاجنه المتصاعدة ، فان المشاكل مثل الانسداد في الشفط المجمع (ماصه الفم) أو الفتحة الكبيرة جدا في الماصة الشعرية المجهرية قد تمنع التركيب السليم للجنين وتوجيهها. للتحضير للتصوير الأمثل ، نقوم باجراء اختبار ما قبل الاستحواذ علي الاجنه المبكرة والمتاخره قبل الوخز للتحقق من أداء الصفائح الضوئية والكاميرات والأهداف والتركيز البؤري التلقائي. نحصل علي أفضل النتائج عندما يتم اختبار جميع هذه العمليات وتسفر عن صور عاليه الجودة خلال اختبارات ما قبل الاستحواذ. وهذا مهم بشكل خاص لتوليد الصور ذات الاستبانة المكانية الانسيابية ، والتي يجب ان تكون الصور الخام المكتسبة من كلا الوجهين (الأهداف) ذات جوده عاليه. بعد اكتساب ، تتم معالجه وحدات التخزين التي تم الحصول عليها لكل طريقه عرض للحصول علي صور الانسيابية. من المهم استخدام بطاقة وحده معالجه الرسومات (GPU) المناسبة كما هو موضح في هذا البروتوكول (انظر أدناه). ويؤدي ذلك إلى تحسين سرعه المعالجة التي يتم بها إنشاء الصور المنصهرة التي يتم دمجها ، وتقصير الوقت في تحليل البيانات. ومن الضروري أيضا ان المستخدمين يقومون بتشغيل أحدث إصدار من سيتوتري وتستخدم المعلمات المقدمة مع حزمه التحميل لدينا ل StarryNite لصناعه السيارات في الشيخوخة. إذا كان المستخدمون مهتمون باستخدام الاصطفاف التلقائي للعينات الأخرى (علي سبيل المثال ، zebrafish ، دروفبيلا الخ) ، سيتطلب الأمر تحسينا إضافيا للمعلمات المستخدمة في starrynite (انظر المراجع3،4).
علي الرغم من ان بروتوكولنا المتكامل يوفر الصور ونتائج الشيخوخة في الجنين قبل الوخز ، يجب علي المستخدمين ان يدركوا ان السلالة اليه في الجنين ما بعد الوخز غير ممكنة حاليا: تتغير المواقع النووية علي ترتيب الثواني في جنين ما بعد الوخز ، بسرعة كبيره جدا للسماح بتتبع النسب. ومع ذلك ، فقد أظهرت dispim بالفعل قدره واعده للتقاط الاحداث العصبية وتتبع بعض المواقع الخلوية في مراحل ما بعد الوخز من الاجنه23،29. إذا كان المستخدمون مهتمون في فحص الجنين ما بعد الوخز ، فان diSPIM لا توفر السرعة للحصول علي لقطات الحجمي وتتبع الاحداث العصبية الدقيقة ، مثل النمو العصبي ، في الاجنه تتحرك بسرعة.
سيكون هذا البروتوكول تاسيسيا لإكمال الخلية بالخلية لوورمجويديس atlas30، حيث انه سيوفر نهجا متكاملا مع صور ذات خواص عاليه الاستبانة لتحديد والتقاط مورفولوجيس ثلاثية الابعاد للخلايا العصبية المسمية اثناء أول 430 دقيقه من تولد الاجنه. وكما هو الوضع ، فان النموذج الاولي لأطلس وورمجويديس يوفر مواقع نوويه للخلايا في الجنين النامي ويهدف إلى التقاط الديناميكيات التنموية لمجموعه فرعيه من الخلايا العصبية الجنينية. سيكون هذا البروتوكول مفتاحا لدمج الخلايا العصبية النامية الاضافيه في أطلس وورمجويديس30.
سيبسط بروتوكولنا المتكامل أيضا استكشاف الملامح الجديدة للتعبيرات الجينية في جنين c. اليجس . في المحور الوراثي c. اليجايليس, العديد من المروجين الخاصة الخلية مكانيا ووقتيا السيطرة علي التعبير عبر الجينات. في حين ان أنماط التعبير من معظم الجينات وقد اتسمت علي نطاق واسع في الحيوانية البالغين31,32,33,34, تقريبا كل ما زال يتعين ان تتميز في البلدان النامية (وخاصه في مرحله متاخره) الجنين. وقد كانت الشركة التشجيعية الخاصة بالديدان موردا مفيدا لمجتمع الدودة لدفع التعبير عن الجينات الخلوية الخاصة بالخلايا ، فضلا عن تحديد ما إذا كانت الوظيفة الجينية مستقله عن الخلية أو غير مستقله. ان التقاط أنماط التعبير الديناميكية عاليه الاستبانة والديناميكية للجينات ، وتحديد الخلايا المعبرة عن طريق الشيخوخة بدقه ، سيكون مفيدا للكثيرين في المجتمع العلمي.
وتتكون الاجنه من عمليتين رئيسيتين متشابكتين ، هما التمايز الخلوي ونشاه الانسجه. يعرف الكثير عن أليات والجزيئات التي تحدد أنواع الخلايا المتميزة اثناء تطوير c. اليجايليس. ومع ذلك ، لا يعرف سوي القليل عن أليات الهامه لهجره الخلايا ، والتصاق الخلايا ، وشكل الخلية في الجنين c. اليجايليس . مع سلاله الخلايا الثابتة c. المعروفة ، يسمح لنا بروتوكولنا بسهوله تمييز التشريح المفهرس ثلاثي الابعاد للجنين خلال المراحل الجديدة من التفصيل: علي سبيل المثال ، محور الفاسسيكوليشن ، synaptogenesis ، والنشاط العصبي. وقد أظهرت ardiel وآخرون في السابق قوه diSPIM للتقاط العابرين الكالسيوم علي مستوي الخلايا العصبية واحده في الاجنه c. ايلينتس 23. العديد من الجوانب الأخرى من فسيولوجيا النمو هي ناضجه للتحقيق من قبل هذه الأساليب.
وأخيرا ، فان هذا البروتوكول إلى حد كبير الألى ويقلل بشكل منهجي من الوقت المستغرق لتوليد الصور غير الحلزونية وأداء خليه الشيخوخة عبر StarryNite و اسيتري. ويمكن تطبيق استراتيجيات البرمجيات المستخدمة في هذا البروتوكول علي العديد من المسائل البيولوجية النائية من المجالات المحددة جدا التي أظهرنا لهم هنا.
تفاصيل حول توافق البرامج والوصول إلى التنزيلات
معلومات عن المدير الجزئي والإضافات للتصوير diSPIM متاحه في http://dispim.org/software/micro-manager و https://micro-manager.org/wiki/ASIdiSPIM_Plugin.
يتطلب خط أنابيب معالجه البيانات حاليا نظام تشغيل Windows. لقد قمنا بتجميع ملف أرشيف واحد لتبسيط تركيب جميع البرامج المطلوبة لمعالجه البيانات وملفات الدعم. انها متاحه للتحميل في http://dispimlineage.wormguides.org.
يعتمد العرض الخلوي (http://run.cytoshow.org/) علي منصة تحليل الصور المستخدمة علي نطاق واسع والمفتوحة المصدر ، ImageJ (v1). يجب تثبيت java وتحديثها علي جهاز الكمبيوتر لاستخدام "العرض الخلوي" ، ويتم نشرها بشكل تلقائي عبر جافا ويب ستارت. العديد من الوظائف المستندة إلى ImageJ من العرض الخلوي كما هو موضح والموضحة في https://imagej.nih.gov/ij/docs/examples/index.html. وقد تم تخصيص العرض الخلوي لعرض البيانات الخام متعددة الابعاد من diSPIM ASI ، فضلا عن غيرها من برامج التصوير التي تخلق TIFF الإخراج. من حيث المبدا ، يمكن دعم أنظمه التصوير SPIM الأخرى متعددة المشاهدات بتعديلات طفيفه لبرنامج العرض الخلوي للسماح بتنفيذ هذا البروتوكول علي أنظمه المجهر المختلفة.
تم كتابه SpimFusion في CUDA/c + + باستخدام Visual Studio 2013 مع مجموعه أدوات CUDA v 7.5. تشغيل SpimFusion يتطلب أجهزه كمبيوتر معينه: بطاقة وحده معالجه الرسومات NVIDIA (GPU) مع CUDA القدرة علي حساب 1.0 أو اعلي والحد الأدنى من 2 غيغابايت ذاكره بطاقة الرسومات. في وقت نشر بروتوكولنا ، SpimFusion غير منشوره (مين قوه وهاري Shroff) ولكنها متوفرة في أرشيف حزمه البرمجيات المذكورة أعلاه.
يتطلب إصدار سطر أوامر مضمن بشكل خاص من StarryNite ان يتم تثبيت وقت تشغيل المحول البرمجي MATLAB المتوفرة بحريه ، ولكن لا يتطلب ترخيصا لبرنامج MATLAB التجارية. يتم تضمين وقت تشغيل المحول البرمجي MATLAB في أرشيف حزمه البرامج المذكورة أعلاه. رمز StarryNite كما هو مستخدم في هذا البروتوكول هو أساسا دون تغيير من تلك المستخدمة في الصور البؤرية6. ومع ذلك ، العديد من المسائل التشغيلية في إنشاء الصور المدخلة لمعالجه StarryNite ومعالجه النتائج StarryNite قد تم تناولها هنا عن طريق أساليب في العرض الخلوي التي تمكن من خط أنابيب معالجه البيانات المستمر لتنصهر الانسيابية diSPIM وحدات التخزين. يتم أتمته هذه التغييرات بواسطة التعليمات البرمجية التي تعالج هذه الخطوات السابقة واللاحقة للمعالجة. كما يقوم العرض الخلوي بتحرير معلمه StarryNite التي تم تحسينها مسبقا والتي تم تعيينها لضبط خوارزميه التجزئة تلقائيا علي كثافة النوى في البيانات التي تم تحديدها. يتم حفظ المعلمات الفريدة المستخدمة من قبل StarryNite علي كل مجموعه بيانات diSPIM في ملف مع صوره الإخراج وبيانات الخط.
الإصدار المخصص من اسيتري الذي يعمل مع الصور ذات 16-بت ويحافظ علي التوافق مع تقديم جافا 3d هو الأنسب لهذا البروتوكول. كما انها مدرجه في أرشيف حزمه البرامج المذكورة أعلاه.
Disclosures
وليس لدي المؤلفين ما يفصحون عنه.
Acknowledgements
ونحن نشكر جون موراي لسلاله متكاملة ، ujIs113 ، لتوليد سلاله سلال BV514 ؛ براندون هارفي (NIBIB) للحصول علي مساعده في اختبار البروتوكول; جون دانيلز وغاري Rondeau (الاجهزه العلمية التطبيقية) للحصول علي المساعدة مع مايكرو مدير وأداه diSPIM; وأندرو يورك وهانك عدن لردود فعلهم النقدية علي نظام diSPIM. ونشكر أيضا برنامج مركز البحوث لمؤسسات الأقليات ومعهد خوسيه ديل كاستيلو (جامعه بورتوريكو) علي توفير منبر للاجتماعات والعصف الذهني. وقد اجري الكثير من هذا العمل في المختبر البيولوجي البحري في وودز هول من خلال برنامج ويتمان. وقد تم دعم هذا العمل من قبل البرامج البحثية داخل المعهد الوطني للصحة والتصوير الطبي والهندسة الحيوية والمعاهد القومية للصحة المنح لا. U01-HD075602 ولا. R24-OD016474. تم دعم مارك دبليو مويل من قبل F32-NS098616 و لايتون h. دنكان كان مدعوما بملحق التنوع لR24-OD016474.
Materials
| Name | Company | Catalog Number | Comments |
| Steps 1-4 | |||
| Concavity slides | ThermoFisher Scientific | 1519006 | 5-18mm diameter, 0.6-0.8mm deep, 1.2-1.5mm |
| Dissecting microscope with 10×–50× zoom range | Motic | SMZ-171 | |
| E. coli (OP50) | Caenorhabditis Genetics Center (CGC) | OP50 | |
| Glass coverslips, no. 1.5, 24 × 50 mm | VWR International | 48393-241 | |
| M9 Buffer | Stiernagle, T. Maintenance of C. elegans. WormBook. 1-11, doi:10.1895/wormbook.1.101.1, (2006). | ||
| Methyl cellulose | Sigma-Aldrich | H7509-25G | |
| Microcapillary pipette aspirator tube | Sigma-Aldrich | A5177 | |
| Microcapillary pipettes, 0.4-mm i.d | Drummond Scientific | 1-000-800 | |
| Needle, no. 18G x 1 ½ (1.2mm x 40mm) | BD Precision Glide | 305196 | |
| NGM plates | prepared as described by Brenner (1974) | ||
| O-ring for imaging chamber | O-Rings West | M1.5X40 | |
| Pasteur pipette | Corning/Sigma-Aldrich | CLS7095D5X | |
| Platinum wire, 0.5-mm diameter | Sigma-Aldrich | 267201 | |
| Poly-L-lysine | Sigma-Aldrich | P1524 | |
| Stainless steel rectangular chamber (76.0 mm x 50.5 mm) | Applied Scientifics Instrumentations (ASI) | I2450 | |
| Worm Eyelash Pick | Hart, A. C. Behavior. WormBook. (2006). | ||
| Worm Pick | Stiernagle, T. Maintenance of C. elegans. WormBook. 1-11, doi:10.1895/wormbook.1.101.1, (2006). | ||
| Name | Company | Catalog Number | Comments |
| Steps 5-6 | |||
| 488 nm long-pass filter | Semrock | LP02-488 RU-2 | |
| 561-nm notch filter | Semrock | NF03-561E-25 | |
| BLP02-561R-25, quantity 2 | Semrock | 561 nm EdgeBasic best-value long-pass edge filter | |
| Control software for bottom camera | Jenoptik | ProgRes CapturePro | |
| diSIPM assembly video | Applied Scientifics Instrumentations (ASI) | https://youtu.be/TAgbr6IrTqw ; http://www.asiimaging.com | |
| diSPIM alignment video | Applied Scientifics Instrumentations (ASI) | https://youtu.be/qnOrg30NNuE | |
| diSPIM imaging PC | Intel | Intel Xeon CPU E5-2630 2.6GHz, 12 cores in total, 64 GB memory, Windows 7 | |
| FF01-525/45-25, quantity 2 | Semrock | 525/45 nm BrightLine single-band bandpass filter | |
| FF555-DI03-25X36, quantity 2 | Semrock | 555 nm edge BrightLine single-edge dichroic beamsplitter | |
| Imaging PC Graphics Card | NVIDIDA | NVIDIA GeForce GTX 1080 Ti graphics cards | |
| Kumar et al diSPIM Setup | Applied Scientifics Instrumentations (ASI) | Instrument setup for this protocol is identical to Kumar et al 10,11 diSPIM, which makes use of 40x 0.8NA water immersion lenses for imaging. (See steps 5.1 and note) | |
| Micro Manager | Micro-Manager | https://micro-manager.org/ | |
| Modifications to Kumar et al diSPIM Setup (see below) | |||
| Optical table with isolators, 4 feet × 6 feet × 12 inches | TMC | 784-651-02DR and 14-416-34 | |
| Name | Company | Catalog Number | Comments |
| Steps 7-10 | |||
| Analysis PC | Intel | Intel Core i7-8700K CPU 3.70GHz, 6 cores in total, 64 GB memory, Windows 10 | |
| Analysis PC Graphics Card | NVIDIDA | NVIDIA GeForce GTX 1080 Ti graphics cards | |
| Installation instructions | Software bundle | http://dispimlineage.wormguides.org/diSPIMlineaging_InstallationInstructions.htm | |
| Software bundle | Software bundle | http://dispimlineage.wormguides.org |
References
- Sulston, J. E., Schierenberg, E., White, J. G., Thomson, J. N. The embryonic cell lineage of the nematode Caenorhabditis elegans. Developmental Biology. 100 (1), 64-119 (1983).
- Bao, Z., et al. Automated cell lineage tracing in Caenorhabditis elegans. Proceedings of the National Academy of Sciences of the United States of America. 103 (8), 2707-2712 (2006).
- Santella, A., Du, Z., Bao, Z. A semi-local neighborhood-based framework for probabilistic cell lineage tracing. BMC Bioinformatics. 15, 217 (2014).
- Santella, A., Du, Z., Nowotschin, S., Hadjantonakis, A. K., Bao, Z. A hybrid blob-slice model for accurate and efficient detection of fluorescence labeled nuclei in 3D. BMC Bioinformatics. 11, 580 (2010).
- Boyle, T. J., Bao, Z., Murray, J. I., Araya, C. L., Waterston, R. H. AceTree: a tool for visual analysis of Caenorhabditis elegans embryogenesis. BMC Bioinformatics. 7, 275 (2006).
- Katzman, B., Tang, D., Santella, A., Bao, Z. AceTree: a major update and case study in the long term maintenance of open-source scientific software. BMC Bioinformatics. 19 (1), 121 (2018).
- Murray, J. I., et al. Automated analysis of embryonic gene expression with cellular resolution in C. elegans. Nature Methods. 5 (8), 703-709 (2008).
- Murray, J. I., Bao, Z., Boyle, T. J., Waterston, R. H. The lineaging of fluorescently-labeled Caenorhabditis elegans embryos with StarryNite and AceTree. Nature Protocols. 1 (3), 1468-1476 (2006).
- Wu, Y., et al. Spatially isotropic four-dimensional imaging with dual-view plane illumination microscopy. Nature Biotechnology. 31 (11), 1032-1038 (2013).
- Kumar, A., et al. Using Stage- and Slit-Scanning to Improve Contrast and Optical Sectioning in Dual-View Inverted Light Sheet Microscopy (diSPIM). The Biological Bulletin. 231 (1), 26-39 (2016).
- Kumar, A., et al. Dual-view plane illumination microscopy for rapid and spatially isotropic imaging. Nature Protocols. 9 (11), 2555-2573 (2014).
- Wu, Y., Christensen, R., Colon-Ramos, D., Shroff, H. Advanced optical imaging techniques for neurodevelopment. Current Opinion in Neurobiology. 23 (6), 1090-1097 (2013).
- Wu, Y., et al. Inverted selective plane illumination microscopy (iSPIM) enables coupled cell identity lineaging and neurodevelopmental imaging in Caenorhabditis elegans. Proceedings of the National Academy of Sciences of the United States of America. 108 (43), 17708-17713 (2011).
- Huisken, J., Stainier, D. Y. Selective plane illumination microscopy techniques in developmental biology. Development. 136 (12), 1963-1975 (2009).
- Stelzer, E. H. Light-sheet fluorescence microscopy for quantitative biology. Nature Methods. 12 (1), 23-26 (2015).
- Winter, P. W., Shroff, H. Faster fluorescence microscopy: advances in high speed biological imaging. Current Opinion in Chemical Biology. 20, 46-53 (2014).
- Lucy, L. B. An iterative technique for the rectification of observed distributions. Astronomical Journal. 76 (6), 745-754 (1974).
- Richardson, W. H. Bayesian-Based Iterative Method of Image Restoration. JOSA. 62 (1), 55-59 (1972).
- Stiernagle, T. Maintenance of C. elegans. WormBook. , 1-11 (2006).
- Hart, A. C. Behavior. WormBook. , (2006).
- Edelstein, A., Amodaj, N., Hoover, K., Vale, R., Stuurman, N. Computer control of microscopes using microManager. Current Protocols in Molecular Biology. Chapter 14, (2010).
- Gualda, E. J., et al. SPIM-fluid: open source light-sheet based platform for high-throughput imaging. Biomedical Optics Express. 6 (11), 4447-4456 (2015).
- Ardiel, E. L., et al. Visualizing Calcium Flux in Freely Moving Nematode Embryos. Biophysical Journal. 112 (9), 1975-1983 (2017).
- Walton, T., et al. The Bicoid class homeodomain factors ceh-36/OTX and unc-30/PITX cooperate in C. elegans embryonic progenitor cells to regulate robust development. PLoS Genetics. 11 (3), e1005003 (2015).
- Altun, Z. F. . WormAtlas. , (2002).
- Wood, W. B. Embryology: In the nematode C. elegans. Cold Spring Harbor Laboratory Press. Chapter 8, 215-241 (1988).
- White, J. G., Southgate, E., Thomson, J. N., Brenner, S. The structure of the nervous system of the nematode Caenorhabditis elegans. Philosophical Transactions of the Royal Society B: Biological Sciences. 314 (1165), (1986).
- Bao, Z., Murray, J. I. Mounting Caenorhabditis elegans embryos for live imaging of embryogenesis. Cold Spring Harb Protoc. (9), (2011).
- Christensen, R. P., et al. Untwisting the Caenorhabditis elegans embryo. eLife. 4, (2015).
- Santella, A., et al. WormGUIDES: an interactive single cell developmental atlas and tool for collaborative multidimensional data exploration. BMC Bioinformatics. 16, 189 (2015).
- Dupuy, D., et al. A first version of the Caenorhabditis elegans Promoterome. Genome Research. 14 (10B), 2169-2175 (2004).
- Reece-Hoyes, J. S., et al. Insight into transcription factor gene duplication from Caenorhabditis elegans Promoterome-driven expression patterns. BMC Genomics. 8 (27), (2007).
- . WormBase Available from: https://www.wormbase.org (2019)
- Lee, R. Y. N., et al. WormBase 2017: molting into a new stage. Nucleic Acids Research. 46 (D1), D869-D874 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved