Method Article
استخراج الأيض المائي من خلايا ملتصقة مثقفه للتحليل الأيضي بواسطة الكهربائي الكهربي-الطيف الكتلي
In This Article
Summary
والغرض من هذه المادة هو وصف بروتوكول لاستخراج الأيض المائي من خلايا ملتصقة مثقف لتحليل الأيض ، وخاصه ، الكهربي الشعرية-قياس الطيف الكتلي.
Abstract
تحليل الأيض هو نهج الاوميكس واعده ليس فقط فهم التنظيم الأيضي محدده في الخلايا السرطانية مقارنه بالخلايا العادية ولكن أيضا لتحديد المؤشرات الحيوية للكشف عن السرطان في المرحلة المبكرة والتنبؤ بالعلاج الكيميائي الاستجابة في مرضي السرطان. ويعد اعداد عينات موحده للتحليل الأيضي مساله حاسمه لا يزال يتعين معالجتها. هنا ، ونحن نقدم بروتوكول سهله وموثوق بها لاستخراج الأيض المائي من خلايا ملتصقة مثقف لتحليل الأيض باستخدام الكهربائي الشعرية-الطيف الكتلي (م-MS). يتم تحليل الأيض المائية من الخلايا المستزرعة عن طريق الخياطة وغسل الخلايا ، وعلاج الخلايا مع الميثانول ، واستخراج الأيض ، وأزاله البروتينات والجزيئات مع أعمده تدور لتحليل م-MS. النتائج التمثيلية باستخدام خطوط خلايا سرطان الرئة تعامل مع diamide ، كاشف الاكسده ، وتوضيح التحول الأيضي يمكن ملاحظتها بوضوح من الخلايا تحت الاكسده. هذه المادة ستكون ذات قيمه خاصه للطلاب والمحققين المشاركين في البحوث الأيض, الذين هم جديده لحصاد الأيض من خطوط الخلايا للتحليل بواسطة م-MS.
Introduction
ولاحظ اوتو واربورغ ان الخلايا السرطانية تكتسب القدرة غير العادية علي تناول الجلوكوز وتخميره لإنتاج اللاكتات في وجود الأكسجين الكافي — وهي ظاهره توصف بأنها تاثير warburg أو التحلل الهوائي1,2. وتكهنت عيوب التنفس الميتوكوندريا كاساس أساسي لتحلل الهوائية في الخلايا السرطانية3. في الواقع ، فان تاثير warburg هو الأساس للتصوير بالأورام بواسطة فلوروديكسيكلوكوز (fdg)-بوزيترون التصوير المقطعي (PET) ، والذي يستخدم علي نطاق واسع في الممارسة السريرية4،5. ويعتبر معدل عاليه من تحلل الهوائية سمه رئيسيه من سمات السرطان ، وقد اعتمدت مؤخرا باعتبارها واحده من المعروفة جيدا "السمات المميزة للسرطان" ، كما وصفها د. هاناهان و b. واينبرغ6. الطفرات الجسدية في الجينات التناسلية والجينات المثبطة للورم — مثل راس الخيمة/kras/nras, egfr, braf, myc, TP53, ايزوسيمعدل ديجينداز (ده), وفومارات هيدراتاسي (FH ) — تم ربطها بتغييرات ايضيه محدده في الخلايا السرطانية ، ويعتقد انها نتيجة لتاثير واربورغ7.
تحليل الأيض هو نهج واعد ليس فقط لفهم التنظيم الأيضي في الخلايا السرطانية ولكن أيضا لتحديد العلامات البيولوجية السرطانية في مرحله مبكرة والتنبؤ العلاج الكيميائي الاستجابة. بعد العلاج من الخلايا السرطانية الحساسة أو المقاومة مع المركبات المضادة للسرطان ، وتتبع الاستجابات الايضيه يسهل تحديد المؤشرات الحيوية الايضيه للتنبؤ فعاليه العلاجات المضادة للسرطان محدده في مرضي السرطان8 ،9،10،11. في هذه المقالة ، تم استخدام خطوط الخلايا السرطانية المشتقة من سرطان الغدد الرئوية مع طفرة Egfr تعامل مع diamide-الذي يسبب الاكسده-كنماذج لتحليل الأيض. الاستفادة من هذه الطريقة التحليلية باستخدام الكهربائي الشعرية-الطيف الكتلي (م-MS) هو قياس شامل لنواتج الأيض مشحونة مع مجموعه كتله m/z 50-100012,13. والغرض من هذه المادة هو تزويد المبتدئين ببروتوكول بصري مفصل متدرج لاعداد نواتج الأيض المائية من الخلايا السرطانية المستزرعة والتحليل الأيضي اللاحق ، ولا سيما من قبل السيدة الام.
Protocol
1-ثقافة الخلية في اليوم الأول
ملاحظه: كل عينه لاستخراج المستقلب يجب ان تكون مستعدة من صحن واحد 100 الانسجه ملم الثقافة التي هي معتدله ولكن ليس تماما متموج (تحتوي علي ما يقرب من 2-5 مليون خليه). حساب عدد الاطباق اللازمة لفحص واعدادها وفقا لذلك.
- الثقافة HCC827 و PC-9 الخلايا في 5 ٪ CO2 في 37 درجه مئوية في rpmi-1640 المتوسطة المضافة مع المصل البقري الجنينية 10 ٪.
- يستنشق وسائل الاعلام الثقافة الخلية من الاطباق الثقافة 100 mm.
- غسل الخلايا علي كل طبق باستخدام 2 مل من الفوسفات المحلول الملحي مخزنه (تلفزيوني) محلول دون الكالسيوم والمغنيسيوم. صخره بلطف كل طبق بحيث الحل تلفزيوني يغطي تماما سطح الطبق.
- يستنشق المخزن المؤقت للغسيل من الاطباق الثقافية.
- الدافئة 0.25 ٪ تريبسين-أدتا الحل إلى 37 درجه مئوية وأضافه 2 مل من الحل تريبسين-أدتا مع ماصه 5 مل المصلية. صخره بلطف كل طبق بحيث التريبسين يغطي تماما سطح الطبق.
- احتضان الاطباق الثقافية في 37 درجه مئوية لمده 5 دقائق تقريبا.
- أضف 4 مل من متوسط النمو الكامل قبل التسخين لكل طبق. أعاده تعليق الخلايا في الوسط عن طريق الأنابيب برفق عده مرات.
- نقل كل تعليق خليه إلى أنبوب مخروطي 15 مل منفصلة وأجهزه الطرد المركزي في 800 × g لمده 5 دقائق.
- أعاده التعليق علي كل خليه بيليه في 2 مل من المتوسط النمو الكامل قبل حرارة.
- تحديد العدد الإجمالي والنسبة المئوية لبقاء الخلايا باستخدام عداد الخلايا المؤتمت و 0.4% الحل الأزرق التريبين.
- مزيج 10 μL من تعليق الخلية و 10 μL من 0.4% الحل الأزرق التريبين.
- تحميل 10 μL من عينه في خليه عد غرفه الشريحة من خلال العمل الشعرية.
- ادخل شريحة الحجرة في عداد الخلية المؤتمت. يضيء الضوء المرسل تلقائيا ويركز الجهاز تلقائيا علي الخلية.
- اضغط علي زر التقاط للتقاط الصورة وعرض النتائج.
- إذا لزم الأمر ، أضافه المزيد من النمو المتوسطة للحصول علي تركيز الخلية المطلوب.
- البذور ما يقرب من 1-2.5 مليون خليه لكل 100 مم طبق ثقافة الخلايا.
ملاحظه: سيتم تطبيع تركيزات المستقلب التي يحددها تحليل CE-MS استنادا إلى عدد الخلايا القابلة للحياة. لغرض عد الخلايا ، من الضروري اعداد طبق واحد علي الأقل للثقافة المصنفة لكل مجموعه. - احتضان الاطباق الثقافية في 5 ٪ CO2 في 37 درجه مئوية لمده 18 ساعة.
2. اعداد الكواشف
- تمييع الحل التجاري الداخلي القياسية بما في ذلك L-ميثيونين سولفون و d-الكافور-10-حمض السلفونيك 1000-اضعاف في المياه نقاء.
ملاحظه: للحصول علي اقل من 80 العينات ، ببساطه مزيج 50 μl من الحل القياسي الداخلي 1 و 45 ml من المياه نقاء في قارورة الحجمي 50 mL ، ثم جلب الحل تصل إلى 50 ml مع المياه نقاء. - اعداد 0.05 الحل مانيتول g/mL في المياه نقاء كما يغسل العازلة.
ملاحظه: لأقل من 30 عينات ، ببساطه حل 25 غراما من مانيتول في 500 مل من الماء نقاء. مطلوب حوالي 15 مل من المخزن المؤقت للغسيل لكل طبق الثقافة 100 ملم ، لذلك اعداد كميه كافيه من العازلة غسل وفقا لعدد من العينات.
3. قبل غسل وحدات تصفيه الطرد المركزي
- ماصه 250 μl من الماء نقاء في كوب فلتر من كل وحده تصفيه الطرد المركزي (انظر جدول المواد).
ملاحظه: مطلوب وحدتي تصفيه لكل نموذج. - كاب وحدات تصفيه باحكام وأجهزه الطرد المركزي في 9,100 × ز في 4 درجه مئوية لمده 5 دقائق.
- تحقق من حجم كل الترشيح — في حاله تراكم الترشيح الكبير خلال الدورة القصيرة الاولي ، قد تكون وحده الفلتر معيبه. في هذه الحالة ، تجاهل وحده التصفية واستخدام وحده تصفيه جديده بدلا من ذلك.
- إغلاق أغطيه وحدات التصفية باحكام وأجهزه الطرد المركزي مره أخرى في 9,100 × ز في 4 درجه مئوية لمده 30 دقيقه.
- ضمان عدم بقاء الماء الفائق النقاء في اي من أكواب الفلتر ؛ أزاله الماء فائق النقاء المصفاة في كل أنبوب جمع مع ماصه وتجاهل.
ملاحظه: لا تحاول أزاله المياه المتبقية في كوب فلتر مع ماصه لأنها قد تضر عامل التصفية. - استبدل أكواب الفلتر في أنابيب التجميع الخاصة بها.
ملاحظه: استخدام وحدات تصفيه الطرد المركزي في غضون ساعة منذ الفلاتر قد تصبح معطوبة عند التجفيف.
4-ثقافة الخلية في اليوم الثاني
-
إخراج الاطباق الثقافة 100 mm من الحاضنة.
ملاحظه: مده ثقافة الخلية الموصي بها هي 18 ساعة. - يستنشق المتوسطة ثقافة الخلية من كل طبق الثقافة 100 ملم.
- أضافه 10 مل من المتوسطة ثقافة الخلية التي تشمل التركيزات المناسبة من المركبات أو المخدرات لكل طبق ، مع الحرص علي عدم إزعاج طبقه الخلية.
ملاحظه: لأغراض العرض التوضيحي ، وأضاف نحن 10 μL من 250 mM diamide المذاب في تلفزيوني (التركيز النهائي من 250 μM) في هذه التجربة. - احتضان الاطباق الثقافية في 37 درجه مئوية لمده 30 دقيقه في وجود diamide أو تلفزيوني كعنصر تحكم.
- يستنشق المتوسطة ثقافة الخلية من كل طبق الثقافة 100 ملم.
- غسل الخلايا عن طريق أضافه بلطف 2 مل من محلول مانيتول 5 ٪ إلى حافه كل طبق ، مع الحرص علي عدم إزعاج طبقه الخلية ، ثم أماله قليلا الطبق.
ملاحظه: يتعارض المحلول التلفزيوني أو المحلول الملحي مع التحليل الأيضي المستند إلى MS ويؤثر سلبا علي نتائج القياس ، التالي لا ينبغي استخدامه كمخزن مؤقت للغسيل. - يستنشق المخزن المؤقت للغسيل من كل طبق الثقافة ، ثم يغسل الخلايا مره أخرى عن طريق أضافه بلطف 10 مل من العازلة غسل لكل طبق ويميل قليلا الطبق.
- يستنشق تماما العازلة غسل من حافه كل طبق الثقافة.
ملاحظه: يستنشق كما غسل المخزن المؤقت قدر الإمكان ، في حين التفات إلى عدم يستنشق الخلايا. قد تتداخل مانيتول المتبقية مع تحليل م-MS ؛ سوف شفط الخلايا إنقاص عدد الخلايا التالي تصبح مصدرا للخطا في تطبيع البيانات.
5. استخراج الأيض من الخلايا المستزرعة
- أضافه 800 μL من 99.7 ٪ الميثانول لكل طبق الثقافة. صخره بلطف كل طبق الثقافة ذهابا وإيابا لتغطيه سطحه بأكمله. اترك الاطباق في درجه حرارة الغرفة لمده 30 ثانيه.
- ببطء أضافه 550 μL من المحلول القياسي الداخلي المخفف لكل طبق من خلال غمر غيض من ماصه في الميثانول والأنابيب بلطف صعودا وهبوطا عده مرات.
- صخره بلطف كل طبق الثقافة ذهابا وإيابا لتغطيه سطحه بأكمله.
- اترك الاطباق في درجه حرارة الغرفة لمده 30 ثانيه.
6. الترشيح الفائق لمقتطفات الخلايا
- نقل المحلول المستخرج من كل طبق الثقافة إلى منفصلة 1.5 mL أنبوب الطرد المركزي.
- الطرد المركزي أنابيب في 2,300 × ز في 4 درجه مئوية لمده 5 دقائق.
- نقل 350 μl من كل ماده طافي إلى وحدتين فلتر الطرد المركزي لكل عينه.
ملاحظه: من كل طبق الثقافة ، يتم نقل ما مجموعه 700 μL من المحلول المستخرج إلى اثنين من أنابيب التصفية (350 μL/tube). - الطرد المركزي أنابيب فلتر في 9,100 × ز في 4 درجه مئوية لمده 2 ساعة تقريبا حتى لا يبقي السائل في أكواب فلتر.
- قم بازاله أكواب الفلتر واغلق أغطيه أنابيب التجميع باحكام.
7. عينه التبخر
- اعداد المبخر الطرد المركزي-عاده ، وهذا يتكون من المبخر ، فخ الباردة ، ومضخة فراغ.
- وضع أنابيب جمع في المبخر الطرد المركزي.
ملاحظه: اترك أغطيه الأنابيب مفتوحة. - تتبخر الحلول عينه المستخرجة تحت ظروف فراغ في درجه حرارة الغرفة.
ملاحظه: التكوينات النموذجية لعدد من التناوب والضغط هي 1,500 لفه في الدقيقة و 1,000 باسكال ، علي التوالي ، وعاده ما يستغرق حوالي 3 ح لتتبخر تماما العينات. - تاكد من ان اي سائل لا يزال في اي من أنابيب جمع وإغلاق أغطيه الأنابيب باحكام.
- تخزين أنابيب جمع في درجه حرارة منخفضه جدا (− 80 درجه مئوية) الفريزر العميق حتى تحليل الأيض.
8. تحليل الأيض بواسطة م-MS
- أعاده تعليق الترشيح في 50 μl من الماء نقاء مباشره قبل CE-MS التحليل.
- اجراء تحليل ce-ms عن طريق الأساليب الموصوفة سابقا12,13 باستخدام نظام الكهربائي الشعرية والوقت من الطيران نظام مطياف الكتلة مجهزه مضخة اسقراطيه, محول م-ms, والبخاخ ce-ESI-ms.
ملاحظه: كلا النظامين يمكن التحكم بها من قبل البرنامج من البائعين وترتبط بواسطة الشعرية السيليكا تنصهر (50 μm القطر الداخلي × 80 سم طول الإجمالي).- اعداد الاداات وقنينات عينه ، واعداد الشعرية مع كاسيت الشعرية ، وتجديد السوائل غمد والمخازن المؤقتة الكهربائية المناسبة اعتمادا علي انيون أو وضع تحليل الموجبة ، ومن ثم تطبيق الفولتية.
ملاحظه: الاجهزه والظروف التحليلية موصوفه بالتفصيل في مكان آخر12،13. - فتح البرنامج واعداد قائمه العمل التي تحتوي علي أساليب الحصول علي البيانات وعينه المعلومات.
- بدء تشغيل اختبار والتحقق من البيانات مثل كثافة الاشاره وشكل ذروه المعايير الداخلية ودقه الذروة من المركبات القياسية الأخرى.
- صقل الظروف التحليلية إذا لزم الأمر.
- حقن نموذج الحلول في 50 ميليبار لمده 3 ليالي والجهد من 30 كيلو فولت.
ملاحظه: تم اجراء CE-MS اما في وضع أيون ايجابيه أو سلبيه. تعيين مطياف لمسح نطاق كتله m/z 50-1000. تم تعيين الجهد الشعرية في 4 kV; معدل تدفق غاز النيتروجين (درجه حرارة السخان 300 درجه مئوية). النسبة للوضع الإيجابي ، تم تعيين الموجه المجزاه ، والمقشده ، والجهد الكهربي في 75 ، 50 و 125 فولت علي التوالي. لوضع الأيونات السالبة ، تم تعيين fragmentor ، مقشده ، و OCT RFV الجهد في 100 ، 50 ، و 200 V ، علي التوالي.
- اعداد الاداات وقنينات عينه ، واعداد الشعرية مع كاسيت الشعرية ، وتجديد السوائل غمد والمخازن المؤقتة الكهربائية المناسبة اعتمادا علي انيون أو وضع تحليل الموجبة ، ومن ثم تطبيق الفولتية.
- تحليل بيانات الطيف.
- استخراج القمم من البيانات الطيفية الشاملة باستخدام برامج التكامل التلقائي من أجل الحصول علي معلومات الذروة بما في ذلك m/z، منطقه الذروة ، ووقت الهجرة (MT).
ملاحظه: يتم وصف الأسلوب بالتفصيل في مكان آخر14. - استبعاد القمم اشاره المقابلة لنظائرها ، أيونات القناة ، وأيونات المنتجات الأخرى من نواتج الأيض المعروفة.
- أضافه تعليقات إلى القمم المتبقية مع معلومات من قاعده بيانات المستقلب HMT وفقا لقيم m/z و MTs.
- تطبيع المناطق من القمم المشروحة إلى مستويات القياسية الداخلية واعداد الخلايا لكل عينه.
- تقييم تركيز كل المستقلب في الخلايا المستزرعة (pmol/106 خلايا) باستخدام المنحنيات القياسية المعدة لكل المستقلب.
- استخدام تركيزات المستقلب الكمية للتحليلات الاحصائيه اللاحقة والتفسيرات البيولوجية14.
- استخراج القمم من البيانات الطيفية الشاملة باستخدام برامج التكامل التلقائي من أجل الحصول علي معلومات الذروة بما في ذلك m/z، منطقه الذروة ، ووقت الهجرة (MT).
النتائج
وبما ان تركيزات المستقلب في الخلايا السرطانية (pmol/106 خلايا) يتم تطبيعها إلى عدد من الخلايا القابلة للحياة ، ينبغي وضع الظروف التجريبية مع الرعاية وذلك للتقليل من الاختلاف في عدد الخلايا القابلة للحياة بين الظروف. علي سبيل المثال ، كان العلاج diamide في تركيز عاليه نسبيا (250 μm) ولكن لفتره قصيرة للسماح لجميع الخلايا بالنمو علي قدم المساواة قدر الإمكان ، التالي تحقيق المساواة في عدد الخلايا القابلة للحياة تحليلها. وفي ظل هذه الظروف التجريبية ، نمت خلايا HCC827 و PC-9 بالتساوي لمده 3 ساعات (الشكل 1). تحليل م-MS من الخلايا المعالجة diamide بالمقارنة مع الخلايا المعالجة (التحكم) كشفت 175 و 150 الأيض التفاضلية في HCC827 و PC-9 الخلايا ، علي التوالي. ومن بين هذه ، كانت عده وسيطات في مسار الفوسفات البنتوز (PPP) وفي تحلل الجلوكوز العلوي اعلي بكثير في الظروف المعالجة diamide في كل من خطوط الخلايا ، في حين ان عددا قليلا من الأنواع الوسيطة لدوره حمض الترياربوكليك كانت اقل في المعالجة (الشكل 2 والشكل 3).
يولد PPP الحد من المكافئات في شكل انخفاض نيكوتيناميد ادينين دينوكليوتيد الفوسفات (NADPH) ، والذي يستخدم لأعاده الاكسده التوازن الصيانة والأحماض الدهنية التخليق الحيوي15. بعد العلاج diamide, مستوي حمض الغلوكونيك — الجلوكوز المؤكسد — زيادة 12 اضعاف في خلايا HCC827 و 10 اضعاف في الخلايا PC-9; المثل ، وبعد العلاج diamide ، ومستوي الجلوكوز 6-الفوسفات (G6P)-وهو الجلوكوز الفوسفوليلاتيد والمنتج الأول الذي يحفز هيككينداز التحلل-أيضا زيادة 6.3-و 3.5-اضعاف في HCC827 و PC-9 الخلايا ، علي التوالي (الشكل 4). الاضافه إلى ذلك ، بعد العلاج diamide ، ومستويات 6-فوسفولوكوناتي (6PG)-الوسيط الأول في PPP-زادت بشكل كبير 89-اضعاف في خلايا HCC827 و 231-اضعاف في الخلايا PC-9 مقارنه مع المستويات التي ينظر اليها في الضوابط التلفزيونية (الشكل 4). وعلي النقيض من ذلك ، لم تتغير مستويات وسيطات تحلل الأخرى ، مثل الفركتوز 6-الفوسفات (F6P) والفركتوز 1 ، 6-بيفسفات (F1 ، 6p) ، في حاله التجريبية diamide (الشكل 4). وكانت النسبة الاجماليه لفوسفات الديكليوكليوتيد نيكوتيناميد الادينين (NADP +) مساويه تقريبا بين المعالجة الثنائية وشروط التحكم في البرنامج التلفزيوني (الشكل4) ، مما يوحي بان الجلوكوز قد تم هدمه بشكل رئيسي عن طريق PPP.
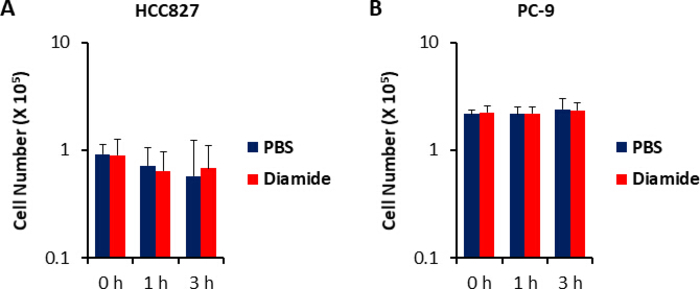
الشكل 1 أرقام الخلايا دون تغيير علي العلاج diamide. تم قياس الاستجابات نمو الخلايا إلى 250 μm من diamide باستخدام التلطيخ الأزرق التريان. يتم عرض أرقام الخلايا من (ا) HCC827 و (ب) الخلايا PC-9 تعامل مع تلفزيوني (الأزرق) أو diamide (الأحمر ؛ 250 μm) لمده 1 أو 3 h. يتم عرض البيانات كمتوسط ± SD (n = 6). يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.
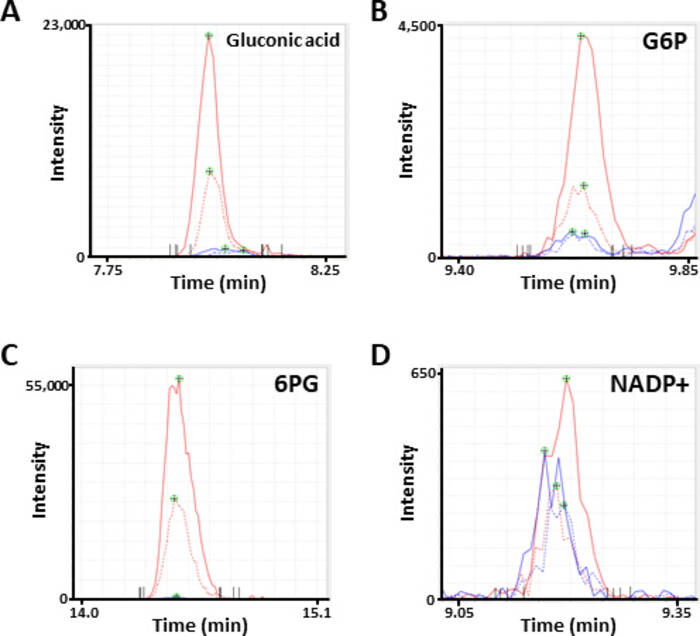
الشكل 2 التمثيلية MS قمم الأيض. الكهربائية المشروح كما (ا) حمض الغلوكونيك ، (ب) الجلوكوز 6-الفوسفات (G6P) ، (ج) 6-فوسفوجليكوناتي (6pg) ، و (د) نيكوتيناميد الفوسفات الديكليوكليوتيد اللحمية (nadp +) التي حصلت عليها تحليل CE-MS. كل سطر يشير إلى خط الخلية (الصلبة ، HCC827 ؛ منقط ، PC-9) والعلاج (الأزرق ، والتلفزيونية ، والأحمر ، diamide) المستخدمة. يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.
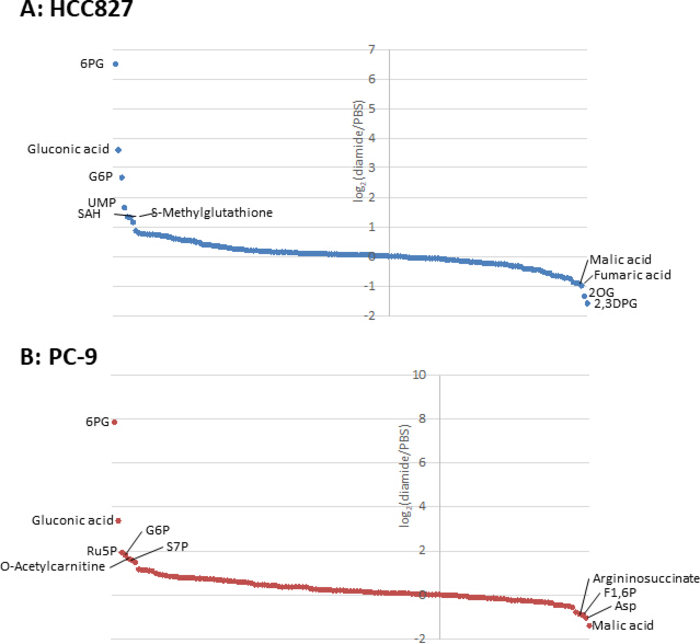
الشكل 3 ملامح الأيض من الأيض داخل الخلايا. وتظهر التغييرات اضعاف من نواتج الأيض في (ا) HCC827 و (ب) PC-9 الخلايا المعالجة مع diamide كما سجل2(diamide/تلفزيوني). وفي المجموع ، كانت 175 و150 من نواتج الأيض مشروحه في خلايا HCC827 و PC-9 علي التوالي. يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.
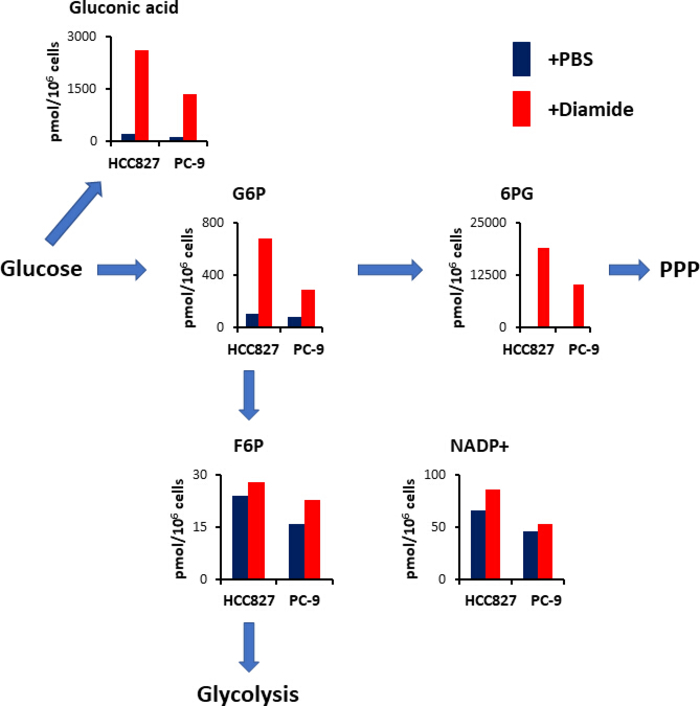
الشكل 4 [أوب-رغلايشن] من [تعادل] علي معالجه [ديميد]. تركيزات داخل الخلايا (pmol/106 خلايا) من الأيض الرئيسية المشاركة في تحلل الجلوكوز ومسار الفوسفات خماسية (PPP) بعد العلاج مع diamide وتظهر. تم استخراج نواتج الأيض من HCC827 والخلايا PC-9 تعاملمع تلفزيوني (الأزرق) أو diamide (الأحمر ، 250 μm) لمده 30 دقيقه الأيض التمثيلية مثل حمض الغلوكونيك ، الجلوكوز 6-الفوسفات (G6P)، الفركتوز 6-الفوسفات (F6P)، 6 -فوسفولوكوناتي (6Pg) ، ويتم عرض نيكوتيناميد ادينين دينوكليوتيد الفوسفات (nadp +). يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.
Discussion
هنا ، ونحن وصف منهجيه يمكن الوصول اليها علي نطاق واسع لاعداد نواتج الأيض من الخلايا السرطانية المثقفة لتحليل الأيض المستندة إلى MS CE. واحده من أكثر النقاط الحرجة في هذا البروتوكول هي الاعداد السليم للخلايا السرطانية ، لان تركيزات المستقلب المقيسة يتم تطبيعها مع عدد الخلايا القابلة للحياة. للحصول علي تقدير دقيق لرقم الخلية ، من الضروري اعداد طبق ثقافة إضافي واحد علي الأقل لكل مجموعه تجريبية لحساب عدد الخلايا القابلة للاستمرار بالتوازي مع استخراج نواتج الأيض للتحليل الأيضي. الاضافه إلى ذلك ، يجب ان يكون المصنف نفس العدد من الخلايا في كل طبق لنسخ متماثلة وفي الطبق للعد ؛ في المستقبل ، وهذا من شانه ان يساعد من قبل سريعة والإجهاد خاليه (علي سبيل المثال ، خاليه من التريبسين) بروتوكول جرد الخلايا التي تسمح لنفس الطبق لاستخدامها في كل من العد خلايا قابله للحياة واستخراج الأيض. يجب توخي الحذر اثناء الغسيل بحيث لا تنفصل الخلايا عن سطح الاطباق. اختبارات الخلوية الشديدة وغيرها من التجارب التي تقلل من التصاق الخلية قد تكون غير صالحه لهذا البروتوكول الاستخراج بسبب احتمال فقدان الخلايا اثناء اجراء الغسيل.
من المهم استخدام محلول مانيتول 5 ٪ كمخزن مؤقت لاستخراج الأيض من الخلايا المستزرعة لتحليل الأيض القائم علي التصلب المناعي الذاتي ، لان المخازن المؤقتة القائمة علي الملح ، مثل تلفزيوني ، تتداخل مع تحليل الأيض وتؤثر سلبا علي القياس.
يمكن الجمع بين اثنين أو ثلاثه اطباق كعينه واحده عن طريق استخراج الأيض بشكل فردي من كل طبق ومن ثم تجميع العينات. ومع ذلك ، الجمع بين اطباق متعددة في كثير من الأحيان يزيد مانيتول المتبقية في محلول المستقلب المستخرجة. وهذا قد تتداخل أيضا مع تحليل الأيض بواسطة CE-MS. ومن ثم ، فمن المستحسن عدم استخدام اطباق متعددة أو الآبار كعينه واحده.
وقد تم تطوير هذه الطريقة تحليل الأيض باستخدام م-MS لقياس شامل لجزيئات مشحونة مع الأوزان الجزيئية بين 50 و 1000 دا; التالي ، يتم تحسين هذا البروتوكول لاستخراج مركبات مائية ومنخفضه الوزن الجزيئي. ولذلك ، هذا البروتوكول ليست مناسبه لاستخراج الأيض مسعور مثل الدهون أو الجزيئات مثل البروتينات والأحماض النووية. وبما ان هناك طلبا متزايدا علي التحاليل الدهنية الشاملة أو الدهون في عينات الخلايا المستزرعة ، فانه يلزم وضع بروتوكول سهل وفعال لاستخراج الأيض المائي والخافض للماء في وقت واحد.
الخطوة الاولي من استخراج المستقلب-الشفط المتوسطة والخلايا الغسيل مع mannitol-ينبغي ان تجري في أسرع وقت ممكن للتقليل من التغييرات في الملف الأيضي للخلايا. علاج الخلايا مع الميثانول بعد الغسيل مع مانيتول يفترض ان البروتينات التالي منع الانزيمات من تحفيز المزيد من التفاعلات الايضيه. ومع ذلك ، حتى بعد العلاج الميثانول ، قد تحدث التفاعلات الكيميائية غير الانزيميه — مثل ردود فعل الاكسده ، وبعض العمليات نزع الكربوكسيل ، والروابط ثيول —. وعلي هذا النحو ، ينبغي تفسير اي تركيزات لنواتج الأيض التي تنطوي عليها هذه التفاعلات مقيسة بهذا البروتوكول بحذر. علي النقيض من الجينوم أو الناسخ ، يتكون الأيض من جزيئات مع مجموعه واسعه من الخصائص الكيميائية. التالي ، لا يمكن لبروتوكول واحد استخراج جميع نواتج الأيض دون اي خسارة أو اضطراب. لمزيد من القياسات الدقيقة لهذه الأيض عاليه التفاعل ، والبروتوكول المصمم خصيصا لاستخراج مجموعات معينه من نواتج الأيض ، والتي تتطلب التجزئة والديريفاتيزيشنز ، وينبغي التشاور. البروتوكول المعروض هنا ، ومع ذلك ، يصف استخراج بسيطه وسريعة من الأيض المائي من عينات الخلايا المستزرعة لتحليل الأيض بواسطة CE-MS. وفي هذه الورقة ، لم نتمكن من وصف كيفيه اعداد الماجستير بالتفصيل لان تركيز المخطوطة الحالية مختلف ، ولكن وصف الخطوات التفصيلية لإنشاء الماجستير قد يتطلب ماده منفصلة مخصصه.
Disclosures
وليس لدي المؤلفين ما يفصحون عنه.
Acknowledgements
نشكر جميع أعضاء مركز شوناي الإقليمي لتعزيز الصناعة علي مساعدتهم. وكان هذا العمل مدعوما جزئيا بأموال البحوث من محافظه ياماغاتا ومدينه Tsuruoka ، من قبل الصندوق الوطني للبحوث والتنمية التابع للمركز [المنحة رقم 28-A-9] ، ومن جانب الجمعية اليابانية لتعزيز العلوم (JSPS) KAKENHI [رقم المنحة 17K07189] إلى جلاله الأمير.
Materials
| Name | Company | Catalog Number | Comments |
| Automated cell counter | Thermo Scientific | AMQAX1000 | Countess II automated cell counter |
| Automatic integration software | Agilent Technologies | MassHunter G3335-60041 | version B.02.00 |
| CE system | Agilent Technologies | Agilent 7100 CE system | |
| CE/MS adapter kit | Agilent Technologies | G1603A | |
| CE-ESI-MS Sprayer kit | Agilent Technologies | G1607A | |
| Cell counting chamber slide | Thermo Scientific | C10282 | Countess cell counting chamber slides |
| Centrifugal filter device, 5 kDa | Human Metabolome Technologies | ULTRAFREE MC PLHCC, UFC3LCCNB-HMT | |
| Conical sterile polypropylene tube, 15 ml | Thermo Scientific | N339651 | |
| Conical sterile polypropylene tube, 50 ml | Thermo Scientific | N339653 | |
| Costar stripette, 10 ml | Corning | 4488 | |
| Costar stripette, 5 ml | Corning | 4487 | |
| D(-)-Mannitol | Wako | 133-00845 | 500 g |
| Dulbecco's phosphate buffered saline (DPBS) | Sigma-Aldrich | D8537-500ML | |
| Electrophoresis buffer | Human Metabolome Technologies | H3301-1001 | for cation analysis |
| Electrophoresis buffer | Human Metabolome Technologies | H3302-1021 | for anion analysis |
| Fetal bovine serum | Biowest | S1780 | |
| Filter tip, 1000 μl | Watson | 124P-1000S | |
| Filter tip, 20 μl | Watson | 124P-20S | |
| Filter tip, 200 μl | Watson | 1252-703CS | |
| Fused silica capillary | Polymicro Technologies | TSP050375 | 50 μm i.d. × 80 cm total length |
| HCC827 | American Type Culture Collection | CRL-2868 | |
| Internal standard solution | Human Metabolome Technologies | H3304-1002 | |
| Isocratic pump | Agilent Technologies | Agilent 1100 Series Isocratic Pump | |
| Methanol | Wako | 138-14521 | 1 L, LC/MS grade |
| Microtube, 1.5 ml | Watson | 131-415C | |
| Operating Software | Agilent Technologies | ChemStation G2201AA | version B.03.01 for CE |
| PC-9 | RIKEN Bio Resource Center | RCB4455 | |
| RPMI-1640 | Sigma-Aldrich | R8758-500ML | |
| Sterile tissue culture dish, 100 mm | Corning | 430167 | |
| Time-of-flight mass spectrometer | Agilent Technologies | Agilent G1969A Time-of-Flight LC/MS | |
| Trypan blue solution, 0.4% | Thermo Scientific | T10282 | |
| Trypsin-EDTA solution | Sigma-Aldrich | T4049-100ML | |
| Ultrapure water | Merck | Milli-Q water | 18.2 MΩ·cm pure water |
| Volumetric flask, 50 ml | Iwaki | 5640FK50E | TE-32 |
References
- Lunt, S. Y., Vander Heiden, M. G. Aerobic glycolysis: meeting the metabolic requirements of cell proliferation. Annual Review Cell and Developmental Biology. 27, 441-464 (2011).
- Soga, T. Cancer metabolism: key players in metabolic reprogramming. Cancer Science. 104 (3), 275-281 (2013).
- Zong, W. X., Rabinowitz, J. D., White, E. Mitochondria and Cancer. Molecular Cell. 61 (5), 667-676 (2016).
- Fukuda, H., et al. Experimental study for cancer diagnosis with positron-labeled fluorinated glucose analogs: [18F]-2-fluoro-2-deoxy-D-mannose: a new tracer for cancer detection. European Journal of Nuclear Meddicine and Molecular Imaging. 7 (7), 294-297 (1982).
- Miles, K. A., Williams, R. E. Warburg revisited: imaging tumour blood flow and metabolism. Cancer Imaging. 8, 81-86 (2008).
- Hanahan, D., Weinberg, R. A. Hallmarks of cancer: the next generation. Cell. 144 (5), 646-674 (2011).
- Levine, A. J., Puzio-Kuter, A. M. The control of the metabolic switch in cancers by oncogenes and tumor suppressor genes. Science. 330 (6009), 1340-1344 (2010).
- Makinoshima, H., et al. Epidermal growth factor receptor (EGFR) signaling regulates global metabolic pathways in EGFR-mutated lung adenocarcinoma. The Journal of Biological Chemistry. 289 (30), 20813-20823 (2014).
- Makinoshima, H., et al. Signaling through the Phosphatidylinositol 3-Kinase (PI3K)/Mammalian Target of Rapamycin (mTOR) Axis Is Responsible for Aerobic Glycolysis mediated by Glucose Transporter in Epidermal Growth Factor Receptor (EGFR)-mutated Lung Adenocarcinoma. The Journal of Biological Chemistry. 290 (28), 17495-17504 (2015).
- Makinoshima, H., et al. Metabolic Determinants of Sensitivity to Phosphatidylinositol 3-Kinase Pathway Inhibitor in Small-Cell Lung Carcinoma. Cancer Research. 78 (9), 2179-2190 (2018).
- Sato, Y., et al. Metabolic Characterization of Antifolate Responsiveness and Non-responsiveness in Malignant Pleural Mesothelioma Cells. Frontiers in Pharmacology. 9, 1129 (2018).
- Ohashi, Y., et al. Depiction of metabolome changes in histidine-starved Escherichia coli by CE-TOFMS. Molecular BioSystems. 4 (2), 135-147 (2008).
- Ooga, T., et al. Metabolomic anatomy of an animal model revealing homeostatic imbalances in dyslipidaemia. Molecular BioSystems. 7 (4), 1217-1223 (2011).
- Sugimoto, M., Wong, D. T., Hirayama, A., Soga, T., Tomita, M. Capillary electrophoresis mass spectrometry-based saliva metabolomics identified oral, breast and pancreatic cancer-specific profiles. Metabolomics. 6 (1), 78-95 (2010).
- Patra, K. C., Hay, N. The pentose phosphate pathway and cancer. Trends in Biochemical Sciences. 39 (8), 347-354 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved