Method Article
إعداد واستخدام خلايا العضلات الملساء الإنسان معزولة حديثا لتوصيف 9-فينانترول الحساسة التيارات التيشن
In This Article
Summary
نحن نصف طريقة لإعداد واحد معزولة حديثا خلايا العضلات الملساء معزولة من عينات المثانة البولية البشرية التي تستخدم إجراء الأنزيمية خطوتين. يمكن دراسة خلايا DSM القابلة للحياة التي تم الحصول عليها من خلال تقنيات خلية واحدة مختلفة بما في ذلك الفيزيولوجيا الكهربية المثبتة في البوهوتريسين-B الموصوفة للكشف عن الخصائص الفسيولوجية والدوائية.
Abstract
الخلايا العضلية الملساء (DSM) الموجودة داخل جدار المثانة البولية تسهل في نهاية المطاف تخزين البول وإبطاله. إعداد خلايا DSM قابلة للحياة، طازجة، معزولة يمثل تحديا تقنيا هاما الذي يوفر إنجازا الخلايا المثلى للدراسات الوظيفية والجزيئية اللاحقة. الطريقة التي تم تطويرها وتفصيلها هنا ، وتستخدم بنجاح من قبل مجموعتنا لأكثر من عقد من الزمان ، تصف تشريح عينات المثانة البولية البشرية التي تم الحصول عليها من جراحات المثانة المفتوحة تليها علاج أنزيم من خطوتين لقطع DSM والثلاثي الميكانيكي للحصول على خلايا DSM معزولة حديثًا. الخطوة الأولى تنطوي على تشريح لفصل طبقة DSM (المعروف أيضا باسم بروبريا العضلات) من الغشاء المخاطي (المسالك البولية، الصفيحة بروبريا، والغشاء المخاطي العضلي) والأنسجة الضامة المجاورة، والأوعية الدموية، والأنسجة الدهنية الحالية. ثم يتم قطع DSM إلى قطع (2-3 مم × 4-6 مم) في Caالاسمية 2 +- تحتوي على محلول التشريح / الهضم (DS). يتم نقل قطع DSM التالية إلى وتعامل بشكل متسلسل بشكل منفصل مع DS التي تحتوي على الباباين والكولاجين في ~ 37 درجة مئوية لمدة 30-45 دقيقة لكل خطوة. بعد غسل مع DS التي تحتوي على مصل البقر الخالي من الإنزيم والثلاثي مع ماصة مصقولة بالنار ، تطلق القطع خلايا DSM واحدة. خلايا DSM المعزولة حديثًا مناسبة بشكل مثالي للتوصيفات الكهروفيزيولوجية والدوائية للقنوات الأيونية. على وجه التحديد، نظهر أن Channel Blocker TRPM4 9-phenanthrol يقلل من الجهد خطوة التيارات الملقط أثار المسجلة مع نهج المشبك المشبك المشبك أمفوريسين-B المبلل. ويمكن أيضا أن تدرس خلايا DSM من قبل تقنيات أخرى مثل خلية واحدة RT-PCR، تحليل الميكروريف، والكيمياء المناعية، في تحليل ربط القرب الموقعي، وتصوير كاليفورنيا2+ . الميزة الرئيسية لاستخدام خلايا DSM واحدة هو أن الملاحظات التي أجريت تتصل مباشرة خصائص خلية واحدة كشفت. وقد وفرت الدراسات التي أجريت على خلايا DSM الإنسان معزولة حديثا رؤى هامة تميز خصائص قنوات الأيون المختلفة بما في ذلك الميشن نفاذة في المثانة البولية، وسوف تستمر كمعيار الذهب في توضيح الخصائص الخلوية DSM والآليات التنظيمية.
Introduction
تشكل خلايا العضلة الملساء (DSM) الأكثر وفرة في المثانة وتتحكم في نهاية المطاف في تخزين البول وإبطاله من خلال الاسترخاء والانكماش ، على التوالي. تشكل خلايا DSM حزم العضلات الملساء التي تتشابك مع الأنسجة الضامة المجاورة والعمليات العصبية والخلايا الخلالية وأنواع الخلايا الأخرى1. وقد تحقق الفهم الحالي لدور خلايا DSM في وظيفة المثانة البولية من خلال نهج متكامل متعدد المستويات. كل طريقة تجريبية - سواء كانت تستند إلى خلايا مفردة معزولة في المختبر ، وشرائط الأنسجة التي تحتوي على حزم العضلات الملساء في المختبر / الجسم الحي السابق ، أو في تحديدات الجسم الحي (مثل قياس الخلايا وتقييمات وظيفة الإبطال) - توفر رؤى مهمة ومحددة في الخصائص الفسيولوجية والدوائية لـ DSM (يرجى الاطلاع على المراجعات1،2،3،4، 6للحصول على التفاصيل). ومع ذلك، فإن تفسير النتائج التي تم الحصول عليها من الخلايا المفردة المعزولة يسمح بعزو الاستنتاجات على وجه التحديد إلى نوع الخلية الواحدة نفسه. وقد تم هذا الإدراك القوة الدافعة لإنشاء طريقة موثوقبها وقابلة للاستنساخ للحصول على خلايا DSM معزولة حديثا من عينات المثانة البولية سمك كامل. على عكس العديد من أنواع الخلايا الأخرى ، لا يمكن أن تكون خلايا العضلات الملساء مثقفة بشكل موثوق بسبب فقدان النمط الظاهري الأصلي بما في ذلك تغييرات محددة في خصائصها الكهروفيزيولوجية والتعاقدية7،8. هذه الحقيقة يعزز كذلك أهمية الدراسات التي أجريت على خلايا DSM المعزولة حديثا النشطة من الناحية الفسيولوجية.
في أواخر عام 1980 وأوائل عام 1990 ، نشرت مجموعة Isenberg (ألمانيا) سلسلة من الدراسات الكهروفيزيولوجية على خلايا DSM المعزولة حديثًا التي تم الحصول عليها من المثانة البولية لخنزير غينيا9،10،11،12،13 ( الجدول1). وسلطت هذه الطريقة الضوء على ملاحظتين هامتين ساعدتا في الحصول على خلايا حيوية وكانت بمثابة مبدأ توجيهي أولي يتبعه الآخرون. كانوا 1) قبل علاج قطع DSM معزولة مع كاليفورنيا2 +حل حر / المتوسطة قبل العلاج الأنزيمي و 2) هضم الأنسجة مع حل يحتوي على الكولاجين. وقد أدرجت هاتين الخطوتين الحاسمتين في جميع المتغيرات اللاحقة لإجراءات التفكيك الخلوي DSM(الجدول 1). حاليا، مجموعتنا توظف نهج انفصال الباباين الكولاجيني متتابعة من خطوتين. يتم التعامل أولا ً مع قطع DSM مع محلول إنزيم يحتوي على الباباين ثم مع الكولاجين من النوع الثاني solubilized في نفس الحل (DS ، محلول التشريح / الهضم). هذا النهج ينتج خلايا DSM واحدة من أنواع مختلفة بما في ذلك خنزير غينيا والخنزير والجرذ والفأر ، والأهم من ذلك الإنسان(الجدول 1).
توفر خلايا DSM المفردة مصدرًا للعديد من التجارب البيولوجية والفسيولوجية الجزيئية. حتى الآن، البروتين والحمض النووي الريبي التعبيرات درس مع الكيمياء المناعية، أو RT-PCR/qRT-PCR كشفت عن مستويات عالية من الكشف عن قنوات الأيون المختلفة بما في ذلك الجهد التوصيل كبيرة- وكاليفورنيا2 +-تنشيط (BK)، التوصيل الصغيرة Ca2 +- تنشيط K+ نوع 3 (S K3)، الجهد مسور K+ (Kv)،L-نوع الجهد مسور كاليفورنيا2 + (كاليفورنياالخامس)،ومستقبلات عابرة المحتملة melastatin نوع 4 (TRPM4) قنوات، فضلا عن مبادل نا / كاليفورنيا2 + 14،15،16،17،18،19،20،21،22. ويعتقد أنهم جميعا للسيطرة على excitability DSM, داخل الخلايا كاليفورنيا2 + المستويات وانقباض. التصحيح المشبك النهج الكهروفيزيولوجية، التي أجريت مباشرة على خنزير غينيا، الماوس، الفئران، أو خلايا DSM الإنسان، قدمت مظاهرة مباشرة من الخصائص الفيزيائية الحيوية والدوائية من L-نوع كاليفورنياV،Kv (Kv.2.x Kv7)، SK، BK، وقنوات TRPM417،19،20،21،22،23،24،25 ،26،27،28،29،30،31. وشملت النهج التقليدية الجهد الخلية الكاملة المشبك، والجهد المبوّج، وتسجيلات ذات قناة واحدة (خلية المرفقة، من الداخل إلى الخارج والخارج تكوينات). بالإضافة إلى ذلك، فإن التسجيل المحتمل للغشاء DSM باستخدام المشبك الحالي قدم أدلة على أن العوامل الدوائية التي تستهدف الانخراط تغير من مدى الجاذبية الخلية. على سبيل المثال، تسبب مثبط TRPM4 9-فينانثول فرط الاستقطاب في خلايا DSM التي تم الحصول عليها من البشر، خنزير غينيا، والمثانة البولية الفئران19،20،22،31. من بين الأساليب الكهربية المختلفة ، توفر تسجيلات المشبك الكهربي الكهربي (amphotericin-B) (والنيستاتين والجراميسيدين وα-escin) ميزة رئيسية من خلال الحفاظ على جزيئات ومسارات الإشارات داخل الخلايا الجوهرية. فقط منخفضة الوزن الجزيئي المكاشنات وإلى حد أقل، Cl- ولكن ليس البروتينات أو الجزيئات إشارة بما في ذلك كاليفورنيا2 + - هي نفاذة من خلال المسام غشاء البلازما التي شكلتها أمبوشتيريسين-B أو نيستاتين32. تعتمد النتيجة الناجحة لتجارب المشبك المشبك المعلل على العديد من المتغيرات العامة الفريدة لهذه التقنية. هنا ، ونحن نصف تفاصيل الإجراء باستخدام amphotericin - B أن مجموعتنا قد استخدمت بنجاح على مدى سنوات15،22،33،34،35،36،37،38،39.
يمكن القول إن قنوات الميشن غير الانتقائية لا تزال واحدة من أنواع القنوات الأقل فهمًا في خلايا DSM. ويعود التقرير الأول لقناة غير انتقائية شبيهة بالتبليغ إلى عام 1993. ورقة من قبل ويلنر وIsenberg11 وصف 33 pS تمتد تنشيط قناة واحدة عرض ترتيب الترتيب التالي من نفاذية الأيون: K+> نا+>Cs+> > B2 +> Ca + 2+، وتثبيط نشاط القناة من قبل GD 3+، وهو مثبط عام من قنوات cation غير انتقائية. ما يقرب من عقد من الزمان في وقت لاحق، ثورنلو ونيلسون40 وصف نا+ التيارات الميشن نفاذة في خلايا DSM الماوس، التي تمنعها GD3 +، وذلك باستخدام التسجيلات الخلية الكاملة. وبما أن الهويات الجزيئية لقنوات التعامُن غير الانتقائية وتوصيفاتها البيوفيزيائية لم تحدد بعد، فإن هناك ما يبرر إجراء تحقيقات في المستقبل في هذا المجال البحثي. البروتوكول الموصوف هنا لتسجيل التيارات قناة المكاية غير انتقائية - باستخدام الحلول خارج الخلية وماصة داخل الخلايا التي تحتوي على Cs+، TEA+، ونيفديبين(الجدول 2)أن من الناحية الفسيولوجية والدوائية تخفيف Kالخامس وCaالخامس التيارات - وكان وسيظل مفيدا في التحقيقات الكهربية الفسيولوجية من قنوات المقاسم غير انتقائية. لقد استخدمنا هذا البروتوكول المحدد لتحديد مدى تثبيط التيارات الملجة الخلية الكاملة من قبل TRPM4 قناة مانع 9-phenanthrol في غينيا الخنزير والجرذ والإنسان DSM الخلايا19،20،22.
معا، والطريقة الموصوفة هنا للحصول على خلايا DSM واحدة معزولة حديثا من المثانة البولية البشرية يوفر خلايا قابلة للحياة مناسبة للغاية للتحقيقات الكهروفيزيولوجية باستخدام تكوينات مختلفة من تقنية التصحيح المشبك، كاليفورنيا2 +-التصوير، والكيمياء المناعية، في الموقع تحليل التقاضي القريب، وخلية واحدة RT-PCR/qRT-PCR فضلا عن تقنيات البيولوجيا الجزيئية المتقدمة بما في ذلك تحليل الميكروريس، RNA-seq، وCHIP-seq يحافظ استخدام طريقة المشبك المبكر على المشبك المبكر على بيئة الخلية الأصلية على عكس التكوينات الأخرى. عندما نفذت باستخدام الشروط المحددة المبينة هنا، تهدف إلى نفي مساهمات K+ وCa2+ التيارات في خلايا DSM، الجهد خطوة المستحثة التيارات عرض خصائص التيارات المكاية غير انتقائية مناسبة للتوصيفات البيوفيزيائية والدوائية.
Protocol
تمت الموافقة على جميع الأساليب الموصوفة هنا من قبل لجان مجلس المراجعة المؤسسية لمركز العلوم الصحية بجامعة تينيسي (ممفيس ، TN ، IRB # 17-05714-XP) ، والجامعة الطبية في ولاية كارولينا الجنوبية (تشارلستون ، SC ، IRB # 00045232). تسمح الإجراءات المعتمدة بعينات المثانة البولية الكاملة (>1 سم بنسبة > 1 سم) - التي تحتوي على جميع الطبقات بما في ذلك الغشاء المخاطي والعضلات الملساء المنسّبة وserosa وكذلك الأوعية الدموية المرفقة والأنسجة الدهنية) - ليتم جمعها من المرضى والمتبرعين الذين يخضعون لعملية استخراج جزئية جراحية من المثانة. المتبرعين بالمريض بالغون (الفئة العمرية التي تمت دراستها حتى الآن: 25 إلى 87 سنة) ، إما ذكرًا أو أنثى ، مع أو بدون أعراض فرط نشاط المثانة (كما هو مصنف من قبل جمعية المسالك البولية الأمريكية I-PSS النتيجة41). تنطوي العمليات الجراحية على مجموعة متنوعة من الحالات الطبية بما في ذلك استئصال المثانة الجذري لسرطان المسالك البولية، والورم الغدي. في مثل هذه الحالات ، تكون عينة المثانة البولية التي تم جمعها بعيدة عن موقع الورم.
1. تشريح أنسجة DSM وإعداد قطع DSM خالية من الغشاء المخاطي
- فحص كامل سمك المثانة البولية العينة التي وصلت إلى المختبر من غرفة العمليات في وعاء مختومة بإحكام مليئة بتشريح الباردة / حل الهضم(الشكل 1 والجدول 2 لتكوين DS).
ملاحظة: عادة ما يتم الاحتفاظ بالعينة في DS الباردة من بضع ساعات إلى بين عشية وضحاها قبل الوصول إلى المختبر. للتخزين لفترة أطول، يتم استكمال DS(الجدول 2)مع 1 MM CaCl2. - إزالة وشطف الإنسان كله سمك عينة DSM (التي تحتوي على جميع الطبقات بما في ذلك الغشاء المخاطي، DSM، وserosa) مع الجليد الباردة DS لغسل الحطام المرفقة والدم.
- دبوس عينة المثانة البولية، الغشاء المخاطي التي تواجه صعودا وserosa أسفل، على enantiomer سيليكون المغلفة(جدول المواد)150 ملم طبق جولة قطرها مليئة الجليد الباردة DS(الشكل 1B).
- إزالة الأنسجة الدهنية المجاورة، والأوعية الدموية، ظهارة (المسالك البولية) والغشاء المخاطي العضلي من العينة عن طريق تشريح حاد باستخدام المقص الدقيق والملقط.
- قطع عدة قطع DSM خالية من الغشاء المخاطي (~ 2-3 ملم طويلة و4-6 ملم واسعة)(الشكل 1C).
2. التفكك الأنزيمي لقطع DSM تسفر عن خلايا DSM واحدة معزولة حديثا
- ضع 3 إلى 6 قطع DSM في أنبوب يحتوي على 1 إلى 2 مل من درجة حرارة مسبقة (~ 37 درجة مئوية) DS التي تحتوي على الباباين وdithiothreitol (DS-P، الجدول 2)واحتضان قطع DSM في DS-P لمدة 30-45 دقيقة في ~ 37 درجة مئوية تهتز الأنبوب بلطف في بعض الأحيان (مرة واحدة كل 10-15 دقيقة).
ملاحظة: للتحكم الأمثل في درجة الحرارة للعلاج الأنزيمي ، يتم وضع الأنابيب مع قطع الأنسجة وحلول الإنزيم إما في غرفة الأنسجة الزجاجية المليئة بالماء المتصل بحمام الماء الساخن المتداول(الشكل 1D)أو حمام ماء اهتزاز عالي الدقة يتم التحكم فيه بدرجة الحرارة(الشكل 1E). - إزالة DS-P من الأنبوب، وغسل لفترة وجيزة قطع DSM مع الجليد الباردة DS، تجاهل DS الباردة من أنبوب ترك قطع DSM يجلس في الجزء السفلي من الأنبوب.
- إضافة 1 إلى 2 مل من الكولاجين المحتوي على DS النوع الثاني (DS-C، الجدول 2)إلى أنبوب مع قطع DSM، مزيج بلطف؛ واحتضان لمدة 25-40 دقيقة في ~ 37 درجة مئوية يهز بلطف أنبوب في بعض الأحيان (كل 10-15 دقيقة).
- تخلص من DS-C واغسل قطع DSM المعالجة بالإنزيم 5-10 مرات مع DS الباردة.
- بعد غسل الماضي, ترك حل DS داخل الأنبوب; ثلاثية بلطف مع ماصة باستور المصقول ة النار عدة مرات لإطلاق سراح خلايا DSM واحدة.
- ضع بضع قطرات من محلول DS يحتوي على خلايا DSM مشتتة على غرفة ذات قاع زجاجي أو قسيمة تغطية وفحص بصريًا للجودة تحت المجهر (باستخدام هدف 20x أو 40x) بعد 5 دقائق على الأقل بعد التطبيق للسماح للخلايا بالالتزام الجزء السفلي.
- استخدم على الفور خلايا DSM معزولة حديثًا لإجراء التجارب الكهروفيزيولوجية أو تخزين الخلايا في أنبوب يحتوي على DS عند 4 درجات مئوية ~ إما على الجليد أو في الثلاجة حتى الاستخدام (عادة لمدة تصل إلى 8 ساعات من التحضير).
ملاحظة: ضمن نفس الإعداد تختلف نوعية الخلايا من قابلة للحياة للغاية إلى خلايا DSM الميتة المهضمة أكثر من اللازم(الشكل 2). عندما ينتج عن طريقة الباباين-الكولاجين اتّهات عدد كبير جدًا من الخلايا غير القابلة للحياة ، يتم التخلص من التحضير ، ويتم إجراء عملية هضم جديدة لقطع DSM ولكن مع فترات حضانة منخفضة. إذا كان الإجراء يؤدي إلى عدد قليل جدا من خلايا DSM ثم للهضم اللاحقة من القطع DSM، يتم زيادة فترات الحضانة. النشاط المناعي الإيجابي لأكتين العضلات الملساء α يؤكد هوية خلايا DSM(الشكل 3).
3. تسجيل الجهد خطوة التيارات المكمّلة المستحثة من خلايا DSM باستخدام أمبورتريكسين-B مبلل كامل خلية الجهد التصحيح المشبك تقنية
- ماسيت 0.25-1 مل من تعليق الخلية على غرفة أسفل الزجاج يجلس على خشبة المسرح من المجهر مقلوب والسماح للخلايا على التمسك القاع الزجاجي.
- بعد الاحتضان لمدة 45 دقيقة على الأقل، قم بإزالة DS من الحمام واستبداله بمحلول E(الجدول 2)عن طريق الصهر الفائق حيث يتدفق المحلول بمساعدة الجاذبية عبر أنابيب الأنابيب المُدخلة يستبدل DS بالحل الجديد بينما يقوم أنبوب المأخذ المتصل بوعاء نفايات فراغي بإزالة محلول الغرفة ويمنع التجاوز. لاحظ أن الحل E يحتوي على رباعي الإيثيلامونيوم (TEA+)والمواد الأيونية (Cs+) لتثبيط التيارات K+ .
- إعداد حل مخزون العمل من الأمفوتريكسين-B في ثنائي ميثيل سولفوكس (DMSO) (1 ملغ لكل 10 ميكرولتر من DMSO). لإذابة مسحوق الأمفوتريكسين بالكامل ، سونيكات (15 دقيقة على الأقل) ودوامة الحل بشكل جيد.
ملاحظة: عادة ما تستغرق هذه الخطوة أقل من 10 دقيقة. إذابة 3-4 ملغ من أمبورتريكسين-B في 30-40 ميكرولتر من DSMO في أنبوب طرد مركزي صغير 1.5 مل يعمل بشكل جيد. كميات أعلى من amphotericin-B تتطلب المزيد من المذيبات DSMO مما يؤدي عادة إلى فترة أطول لخلط وذوبان غير مكتملة من الجسيمات الصلبة amphotericin-B الموجودة في الأنبوب. - حل محلول المخزون من أمبورتريكسين-B في محلول ماصة (الحل P، الجدول 2)للحصول على تركيز نهائي من 200-500 ميكروغرام/مل. تتطلب هذه الخطوة صوتنة واسعة النطاق ودوامة في إعداد عالية السرعة (8-10/10) ل ~ 30 إلى 60 دقيقة لكل خطوة لضمان الاختلاط الأمثل والوقاية من تشكيل أمبوشتيريسين-B في محلول الماصة.
ملاحظة: سوف أمبوريريسين-B عجل أكثر من الوقت وحساسة للضوء. يتم فحص محلول ماصة العمل الذي يحتوي على Amphotericin-B للذوبان ، ومختلطة يدويًا قبل ملء الماصة ، والاحتفاظ بها في الظلام. - سحب أقطاب التصحيح متعددة، نصائح القطب القطب النار البولندية، و (إذا لزم الأمر) معطف النصائح مع شمع الأسنان.
- ملء غيض من القطب التصحيح مع حل ماصة (الحل P، الجدول 2)دون amphotericin-B عن طريق غمس لفترة وجيزة القطب في الحل.
- ملء القطب مع نفس محلول ماصة تحتوي على amphotericin-B.
- قم بتركيب القطب على حامل متصل بمسرح رأس مكبر للصوت المشبك.
- باستخدام micromanipulator، ضع القطب فقط تحت سطح الحل خارج الخلية بحيث يتم غمر طرف القطب فقط.
- في وضع الجهد المشبك، تعيين إمكانية عقد إلى 0 mV وضبط التيار إلى 0 pA مع الاتصال الهاتفي إزاحة ماصة على مكبر للصوت التجاري(جدول المواد).
- تحديد مقاومة القطب باستخدام نافذة اختبار الغشاء / وظيفة برنامج الاستحواذ التجاري(جدول المواد). لتنشيط انقر فوق أدوات > اختبار الغشاء > تشغيل أو رمز اختصار في البرنامج. يجب أن تكون مقاومة القطب الكهربائي المحددة في نطاق 2 إلى 5 MΟ.
ملاحظة: يمكن استخدام وظيفة اختبار الغشاء المنصوص عليها في برنامج الاستحواذ التجاري أو خيار اختبار الختم على مكبر الصوت لمراقبة مقاومة القطب الكهربائي عن طريق تطبيق خطوات الجهد بشكل متكرر. - مواصلة رصد مقاومة القطب مع تقدم القطب نحو خلية DSM المختارة مع micromanipulator(الشكل 4A).
ملاحظة: لكي تعتبر خلية DSM قابلة للتطبيق، يجب أن تظهر الخلية مورفولوجيا ممدودة على شكل مغزل، هالة محددة جيداً حول الخلية، حواف هش، وشبه متقلص (ثعبان) المظهر. - عند لمس سطح الخلية مع القطب - المشار إليه بزيادة سريعة في مقاومة القطب الكهربائي تقاس مع وظيفة اختبار الغشاء - تشكل ختم جيجا عن طريق تطبيق الضغط السلبي السريع لطيف إلى حامل القطب عن طريق الأنابيب. وهذا يؤدي إلى الضغط السلبي الذي تم إنشاؤه في طرف القطب الذي يسحب غشاء الخلية إلى القطب الذي يساعد في تشكيل ختم جيجا أو اتصال ضيق جدا بين القطب وغشاء البلازما(الشكل 4B).
- مرة واحدة في أشكال جيغا ختم، تعويض الكمصانة ماصة عن طريق ضبط بطلب سريع وبطيء على مكبر للصوت التجاري ورصد الاستقرار جيغة ختم (تسرب الحالية) باستخدام وظيفة اختبار الغشاء.
- السماح للوقت، وعادة 30-60 دقيقة، لأمبوشتيريسين-B لنشر أسفل ماصة ويكون إدراجها في غشاء البلازما تشكيل المسام انتقائية في المقام الأول إلى المرؤوسات أحادية التكافؤ. خلال هذه الخطوة، ومواصلة رصد جيغة ختم مع وظيفة اختبار الغشاء. كما يزيد من الزيادات الخلية حتى لا السعة من العابرين السعة (مقارنة الشكل 4B مقابل الشكل 4C عرض عدم وجود وفاعلية انقسام الخلية، على التوالي) تقاس مع وظيفة اختبار الغشاء.
- عندما يكون الانقطع الترقيع الأمثل (الحكم عليها بمقاومة سلسلة مستقرة عادة أقل من 50 MΟ), إلغاء المؤقتين الكم ببضبط بطلب لطاقة الخلية وسلسلة المقاومة على مكبر للصوت. يمكن أيضًا إجراء تعويض مقاومة السلسلة في هذا الوقت(الشكل 4D).
- مرة واحدة مستقرة الجهد خطوة التيارات المكمّلة المستحثة التي أثارها البروتوكول المحدد، وتطبيق حالة مركب أو فسيولوجية لاختبار بواسطة الدمج الفائق وتسجيل الاستجابات للتحكم، واختبار الشرط، واغتسال (إذا كان ذلك ممكنا) مع برامج الاستحواذ التجارية.
- سجل التيارات مع بروتوكول خطوة الجهد الروتينية التي تنطوي على عقد خلايا DSM في -64 أو -74 mV ويخطو الجهد في زيادات 10 mV ل400 أو 500 مللي ثانية من -94 إلى +96 أو +106 mV والعودة إلى القدرة على عقد.
ملاحظة: يتم تعديل القيم المحتملة للغشاء لاحتمال تقاطع السائل من 14 mV (باستخدام حلول P و E، الجدول 2). يتم الحصول على إمكانات تقاطع السائل في برنامج الاستحواذ التجاري(جدول المواد)عن طريق النقر على(أدوات > إمكانات التقاطع)وإدخال تركيزات مكونات أيون الحل. يمكن أيضًا استخدام بروتوكول منحدر للحصول على التسجيلات الحالية. - تشغيل الجهد بروتوكول في فترة زمنية مستمرة ~ 1 دقيقة أثناء اختبار تسجيل التيارات للتحكم قبل إضافة، حالة الاختبار، واغتسال.
- سجل التيارات مع بروتوكول خطوة الجهد الروتينية التي تنطوي على عقد خلايا DSM في -64 أو -74 mV ويخطو الجهد في زيادات 10 mV ل400 أو 500 مللي ثانية من -94 إلى +96 أو +106 mV والعودة إلى القدرة على عقد.
4- تحليل البيانات وتصورها
- فتح الملفات المسجلة في برنامج تحليل البيانات التجارية(جدول المواد)للتحكم وحالة الاختبار والغسل عن طريق النقر على ملف > فتح البيانات واختيار الملفات ذات الأهمية لفتح.
ملاحظة: للتحليل عادة ثلاثة ملفات (كل تحتوي على مجموعة واحدة من آثار لتشغيل بروتوكول واحد) لكل شرط يتم فتح وتحليل. يتم في المتوسط الردود في وقت لاحق للحصول على استجابة متوسط لكل شرط. يحتوي البرنامج المستخدم للحصول على البيانات على خيار لجمع عمليات تشغيل اختبار متعددة يحددها المستخدم تلقائيًا ومتوسطها لملف إخراج واحد يمكن استخدامه كبديل. - الحصول على متوسط الاستجابة على مدى الماضي 200 مللي ثانية لتتبع الحالي يقاس في كل الجهد؛ يعكس الفاصل الزمني للفترة المختارة مستوى ثابت من التنشيط الحالي خطوة الجهد. للقيام بذلك اتبع الخطوات التالية.
- حدد ملف ًا مهمًا للتحليل في برنامج التحليل التجاري(جدول المواد).
ملاحظة: يضع البرنامج أحدث ملف تم استيراده في إطار العرض النشط الخاص به. يعرض الملف المفتوح سلسلة من الآثار المتداخلة التي تم الحصول عليها باستخدام بروتوكول خطوة الجهد. بشكل افتراضي، داخل الإطار النشط يتم عرض أربعة مؤشرات (عرض قيم x و y للتتبع المميز). - اختيار نطاق للتحليل عن طريق تحديد المواقع المؤشر 2 في نهاية الخطوة الجهد 400 أو 500 مللي ثانية والمؤشر 1 في الفترة الفاصلة من 200 مللي ثانية قبل ذلك بحيث يكون نطاق التحليل هو 200 مللي ثانية.
- الحصول على استجابات لكل الجهد عن طريق النقر على تحليل > الرسم البياني السريع > IV (أو رمز اختصار IV) (في إطار موجه قبل إنشاء البيانات تؤكد أنه لخيارات المنطقة إشارة المحور ص (الحالي)"المؤشرات 1..2" و"متوسط"يتم تحديد). انقر فوق موافق لإنشاء الرسم البياني I-V ووضع البيانات في ورقة عمود النتائج التي يمكن عرضها عن طريق الوصول إلى Windows > النتائج.
- تحليل ملفات إضافية عن طريق تكرار الخطوات 4.2.1 - 4.2.3. انقر فوق تحليل > رسم بياني سريع > IV أو اختصار رمز IV، حدد الملحق بدلاً من الاستبدال لإضافة بيانات إضافية إلى ورقة النتائج عند معالجة الآثار.
- نسخ البيانات إلى جدول بيانات عن طريق تحديد الأعمدة ذات الأهمية والضغط على CTRL +C للنسخ وCTRL +V للصقها. تخزين ورقة عمل النتائج في برنامج التحليل التجاري(جدول المواد)بتنسيق (*.rlt) بالنقر فوق File>Save As.
- حدد ملف ًا مهمًا للتحليل في برنامج التحليل التجاري(جدول المواد).
- لكل خلية، تطبيع الاستجابات لجميع الشروط الثلاثة إلى قيمة خطوة الجهد الأقصى للتحكم قبل إضافة (وفقا للصيغة: استجابة /استجابة التحكم ماكس)والرسم البياني الاستجابات والحالية (أو كثافة الحالية) القيم مقابل علاقات الجهد(الشكل 6).
- في معالج ورقة العمل، حدد متوسط الاستجابات إما التيارات (pA) أو الكثافات الحالية (pA/pF) للتحكم وحالة الاختبار (في هذا المثال، 9-phenanthrol)، والغسل في كل خطوة جهد.
- تقسيم القيم لكل جهد لكل شرط (التحكم، 9-فيناندرول، والغسل) من قبل استجابة التحكم القصوى التي تم الحصول عليها في أعلى جهد (+96 mV في الشكل 6)للتحكم قبل إضافة التالية الصيغة: استجابة طبيعية للشرط (x) = استجابة (x)/استجابة التحكم ماكس ل (x).
- للتحليل الموجز، قم بترتيب البيانات بتنسيق يمكن نسخه بسهولة إلى برنامج رسومي (مثل GraphPad Prism) للتصور.
النتائج
التفكك الأنزيمي لقطع DSM يوفر خلايا DSM صحية معزولة حديثًا تستخدم بشكل روتيني في الدراسات الوظيفية والجزيئية مثل: الفيزيولوجيا الكهربائية المشبك والمناعة. يلخص الشكل 1 خطوات التشريح وتصور الإعدادات المستخدمة للتحكم في درجة الحرارة لخطوات العلاج الأنزيمية. يوضح الشكل 2 الصور المشرقة الميدانية لخلايا DSM التي تم الحصول عليها من ثلاث عينات من المثانة البولية البشرية لكل منها من متبرع مختلف من المرضى. تتميز خلايا DSM واحدة صحية من قبل مورفولوجيا مغزل على شكل، حواف واضحة محددة جيدا، هالة محددة جيدا حول الخلية، وشبه contractile (مثل الثعبان) مظهر عندما ينظر إليها تحت المجهر (انظر خلايا DSM demarked من قبل السهام البيضاء في الشكل 2). كما أنها تستجيب لعوامل تحفيز الانكماش مثل كاربالو الناضوين الموسكاريني أو تطبيقات K+ (60 مM). تظهر خلايا DSM نشاطًا مناعيًا إيجابيًا للعضلات الملساء التي تؤكد هويتها(الشكل 3).
خلايا DSM مناسبة بشكل مثالي للتحقيقات الكهربية الكهربية المشبك التصحيح من خصائص قناة أيون. هنا ، ونحن نصف amphotericin - B مبلل التصحيح المشبك طريقة تسجيل باستخدام ماصة وحلول خارج الخلية(الجدول 2)لتسجيل الأمثل الجهد خطوة المغنطيسية الناجمة عن القنوات. وفي ظل الظروف المحددة المستخدمة، كفل الحصار المفروض على تيارات Kv وL-Ca+مع Cs+/TEA+ ونيفديبين، على التوالي، إلغاء مساهمة هذه المكونات الأيونية في التيارات التي تثير الجهد الخلوي بالكامل. ويبين الشكل 4 والشكل 5، على التوالي، الخطوات التجريبية لطريقة المشبك المشبك المبكر وتيارات الخلايا الكاملة التمثيلية التي تقاس إما بالخطوة الفولتية المستحثة أو بروتوكول منحدر في ثلاث خلايا مختلفة من خلايا DSM البشرية، كل منها من متبرع مريض مختلف. لاحظ أن التسجيلات تعرض درجة معينة من التباين من حيث السعة الحالية والتصحيح الخارجي. وكشفت تجارب إضافية أن 9-فينانثرول, مثبط قناة TRPM4, بشكل فعال وعكسالتيارات الموجبة DSM الإنسان في الفولتية السلبية والإيجابية(الشكل 6). يوضح المكون الحالي الحساس 9-phenanthrol تثبيط أقوى في الفولتية الإيجابية والتصحيح الخارجي(الشكل 6C).
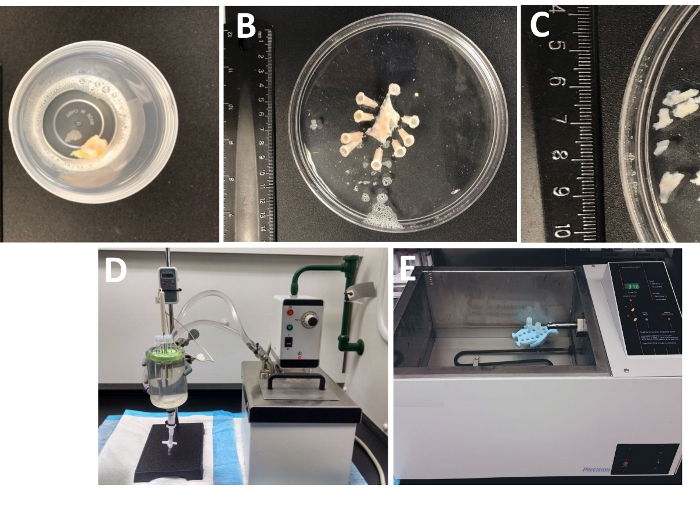
الشكل 1: ملخص خطوات تشريح مما أدى إلى إعداد قطع العضلات الملساء (DSM) والإعداد المستخدمة للانفصام الأنزيمي. تظهر صور:(أ)عينة المثانة البولية البشرية سمك كامل المقدمة من جراحة المثانة المفتوحة كمادة جراحية غريبة في الجليد الباردة DS،(B)نفس الإعداد بعد التثبيت مع طبقة DSM تشريح جزئيا،(C)DSM قطع من أبعاد متغيرة قطع من طبقة DSM جاهزة للهضم الأنزيمي (قطع أصغر) أو غيرها من التحقيقات التجريبية (قطع أكبر)،(D، E)الاجهزة البديلة المستخدمة للهضم الأنزيمي من القطع DSM تتكون من إما (1) حمام مائي متداول يتم التحكم فيه في درجة الحرارة متصل عبر الأنابيب إلى غرفة كبيرة من الأنسجة الزجاجية مليئة بالماء ، حامل مطاطي للأنابيب والأنابيب البلاستيكية التي تحتوي على قطع DSM وحلول الإنزيم المعدة في محلول التشريح / الهضم (DS ، إما DS-P أو DS-C ، الجدول 2)ومسبار درجة الحرارة المرتبط بشاشة تسمح بالمراقبة المستمرة (D) ، أو (2) حمام كبير مملوء بحرارة يحتوي على حامل وأنابيب مع قطع DSM وحلول إنزيم (E) ). يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.
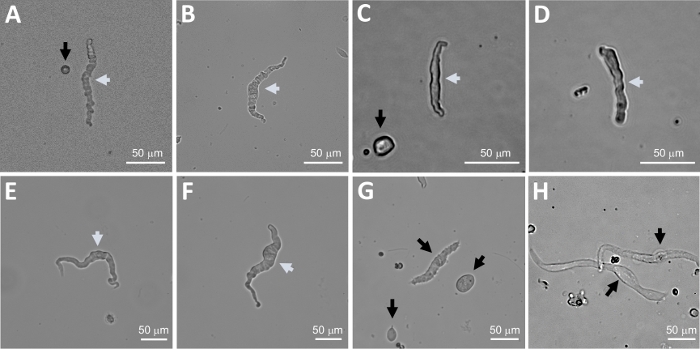
الشكل 2: صور تمثيلية مشرقة المجال لخلايا DSM الإنسان المعزولة حديثا التي تم الحصول عليها باستخدام طريقة هضم الباباين الكولاجين يُستخدم في التسلسل. (A-F) يتم عرض صور لخلايا DSM النشطة من الناحية الفسيولوجية والقابلة للحياة التي تعتبر مرشحين مناسبين لمحاولة تسجيل المشبك اللاصق المبلل. (G, H) صور الخلايا غير القابلة للحياة أو المفرطة في الهضم؛ تم تجنب مثل هذه الخلايا لتجارب التصحيح المشبك. السهام البيضاء والسوداء في لوحات(A-H)نقطة إلى خلايا DSM تعتبر قابلة للحياة وغير قابلة للحياة، على التوالي، لمحاولة تسجيلات التصحيح المشبك. لاحظ أن الأسهم السوداء في لوحات(A، C، و G)تشير إلى شظايا الخلية (القطع الدائرية) أو الخلايا الصغيرة التي تفتقر إلى مورفولوجيا DSM وفي (H)تظهر الخلايا شاحبة ومتوسعة. الصور هي من ثلاث عينات مختلفة المثانة البولية(A و B : مصدر المريض المانح ة واحد، C و D: مصدر المريض المانحة اثنين، وE-H: مصدر المريض المانحة ثلاثة). يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.
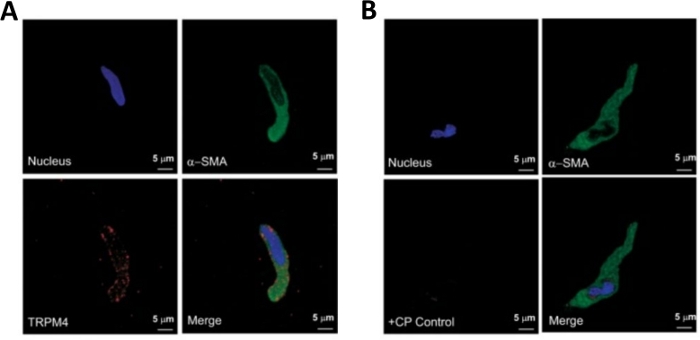
الشكل 3: تعبيرات مستقبلات عابرة المحتملة melastatin نوع 4 (TRPM4) قناة وα-ملساء العضلات الأنشطة المناعية المعينة في خلايا DSM الإنسان واحد عن طريق تحليل الكيمياء المناعية. (أ)هو مبين هي الصور confocal تظهر الكشف المناعي للكشف عن التعبير البروتين قناة TRPM4 في خلية DSM الإنسان. تلطيخ أحمر (أسفل اليسار) يشير إلى بروتينات قناة TRPM4; الأزرق (DAPI) تلطيخ يكشف نواة الخلية (أعلى اليسار)؛ يشير تلطيخ الأخضر إلى الأكتين العضلي الملساء α (α-SMA، أعلى اليمين)؛ توضح الصورة المدمجة (أسفل اليمين) تداخل جميع الصور الثلاث. (ب)الصور المعتمة التي توضح توهين الكشف المناعي الكيميائي للتعبير البروتيني قناة TRPM4 في وجود الببتيد المتنافسة TRPM4 محددة (CP) في خلايا DSM الإنسان معزولة. الأزرق (DAPI) تلطيخ يشير إلى نواة الخلية (أعلى اليسار)؛ تلطيخ الأخضر هو لα-ملساء العضلات actin (α-SMA، أعلى اليمين)؛ توضح الصورة المدمجة (أسفل اليمين) تداخل جميع الصور الثلاث. تم التحقق من النتائج في أربع تجارب منفصلة باستخدام الأنسجة الكاملة DSM أو خلايا DSM متعددة معزولة عن أربعة مرضى. الصور مأخوذة من هريستوف وآخرون (2016)22 وتستخدم بإذن. يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.
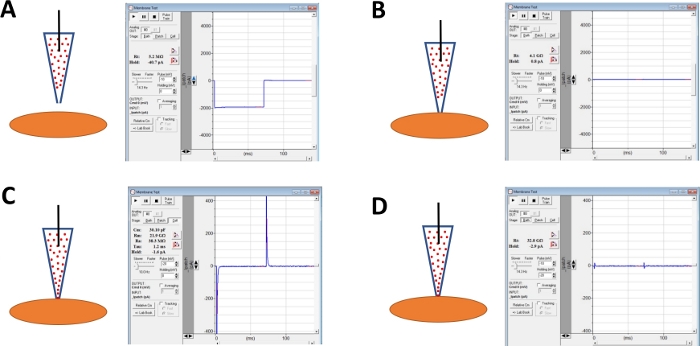
الشكل 4: التوضيح التخطيطي للخطوات المشاركة في تشكيل جيقة-الفقمة وينطم الأمبورتريكسين-B من خلايا DSM البشرية. يتضح من المواقع المكانية لأمبوشتيريسين-B التي تحتوي على ماصة وخلية DSM جنبا إلى جنب مع الاستجابات المرتبطة لاختبارات الأغشية التي تم الحصول عليها في برنامج الاستحواذ التجاري(جدول المواد)عن طريق تغيير خطوات الجهد (إما -10 أو -20 mV في هذا المثال) تحديد المقاومة. التكوينات هي:(A)قبل نهج الخلية مع القطب الكهربائي،(B)بعد تشكيل جيجا ختم التي تم الحصول عليها عن طريق تحديد موضع أمبورتريكسين-B التي تحتوي على ماصة (أمبوشتيريسين-B ممثلة بالنقاط الحمراء) على سطح الخلية وتطبيق الضغط السلبي،(C)التكوين على الخلية هو مبين ~ 45 دقيقة بعد تشكيل جيشا ختم، في هذا الوقت نقطة amphotericin-B قد انتشرت أسفل ماصة وجزيئاتها قد أدخلت في غشاء البلازما في غيض من القطب تشكيل الميشن المسام نفاذة، و(D)نفس التكوين كما هو الحال في(C)ولكن مع عابري القدرات إلغاء باستخدام بطلب لمكثفة الخلية الكاملة ومقاومة سلسلة على مكبر للصوت. يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.
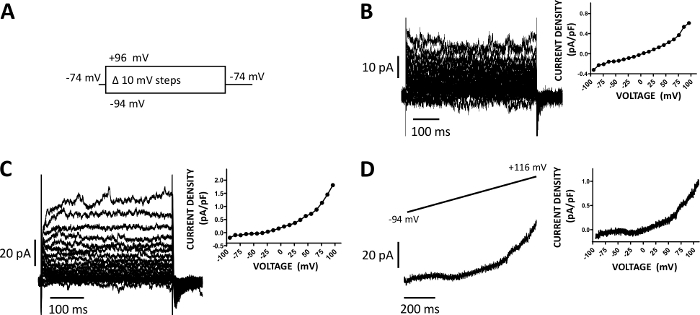
الشكل 5: التيارات الملجة الخلية الكاملة المسجلة مع طريقة المشبك المبجل ة المثبتة في الخلايا البشرية DSM. (أ)رسم تخطيطي لبروتوكول خطوة الجهد يوضح إمكانية الاحتفاظ بـ -74 mV والجهد الخطوات من 400 مللي ثانية مدة من -94 إلى +96 mV نفذت في 10 mV الزيادات ثم عاد إلى -74 mV. (ب، ج) آثار الحالية التمثيلية جنبا إلى جنب مع المؤامرات الجهد الكثافة الحالية من اثنين من الخلايا DSM الإنسان مختلفة، كل من عينة المثانة البولية مختلفة / المريض المانحة التي تم الحصول عليها مع بروتوكول الخطوة الجهد الموصوفة في (A). (D)مثال على التتبع الحالي الذي تم الحصول عليه باستخدام بروتوكول منحدر (ممثلة بيانياً في الجزء العلوي من النسق كتغير في الجهد من -94 إلى +116 mV على مدى 1 s في 0.21 mV/ms، وكان عقد المحتملة -94 mV). على اليمين في لوحات(B-D)، والرسوم البيانية عرض العلاقة الحالية كثافة الجهد لكل خلية DSM المسجلة. يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.
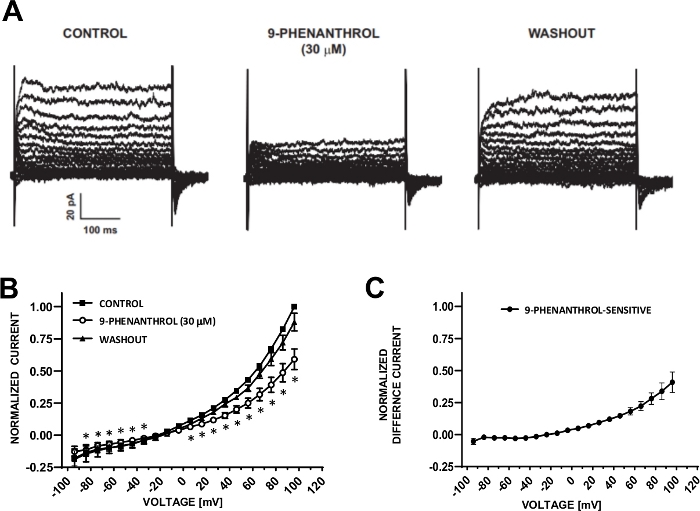
الشكل 6: TRPM4 قناة مانع 9-فينانثرول بوساطة تثبيط التيارات التائية الناجمة عن الجهد خطوة في خلايا DSM الإنسان. (A)هو مبين التيارات التمثيلية تقاس مع بروتوكول خطوة الجهد وصفها في الشكل 5A للسيطرة، 9-فينانثرول، والغسل. (ب)ملخص الاستجابات العادية مقابل الجهد للتحكم، 9-فينانثرول، والاغتسال في سبع خلايا DSM (من سبعة متبرعين مختلفين من المرضى). (C)اختلاف التيار للمكون الحساس 9-فينانترول التي تم الحصول عليها عن طريق طرح القيم في وجود 9-فينانثرول (30 ميكرومتر) من تلك الخاصة بعنصر التحكم المبين في(B). يتم عرض البيانات في(B)و(C)كوسيلة مع أشرطة الخطأ لSEM ، * يصور أهمية (p <lt;0.05 ، اختبار الطالب المقترن) لمقارنة التحكم مقابل 9-phenanthrol في كل جهد. تم استنساخ الألواح(A)و(B)من Hristov et al. (2016)22 واستخدامها بإذن. يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.
| الانواع | تفاصيل الإجراء | مراجع | |
| خنزير غينيا | DSM قطعة شطف مع Ca2 +- المتوسطة الحرة (في mM: 100 NaCl، 10 KCl، 1.2 KH2PO4،5 MgCl2،20 الجلوكوز، 50 التورين، قياس pCa = 6 (أو 1 mM) ثم قطع إلى قطع ومعالجتها عادة 90-120 دقيقة (4 فترات من 30 دقيقة) مع إنزيم (في mM: 130 كوه، 20 تورين, 5 بيروفات, 5 الكرياتين, 10 mM HEPES, تعديلها مع حمض الميثانولفونيك إلى درجة الحموضة 7.4, 1 ملغ/مل الكولاجين, 0.2 ملغ/مل بروناس E, 1 ملغ/مل الأحماض الدهنية الحرة الزلالين, pCa = 4.2 (63 مم) أو 3.7 (200 mM). تم تخزين خلايا DSM واحدة في كرافت بروه (KB) المتوسطة (في mM: 85 KCl, 30 K2PO4, 5 MgSO4, 5 Na2ATP, 5 K-pyruvate, 5 creatine, 20 التورين, 5 بيتا-OH-butyrate, 1 ملغ/مل الزلال الحر, تعديلها مع كوه إلى pH 7.2). طريقة بديلة: DSM قطعة شطف لمدة 10 دقيقة في كاليفورنيا2 +حرة المتوسطة (في mM): 140 NaCl، 5 KCl، 1.2 MgCl2،10 الجلوكوز، 20 التورين، 5 HEPES، تعديلها مع NaOH إلى الرقم الهيدروجيني 7.4). ثم قطع DSM، المحتضنة في نفس كاليفورنيا2 +- المتوسطة الحرة تكملها مع 5 ملغ الكولاجين٪، 2 ملغ٪ بروناس و 100 ميكرومتر CaCl2 ل2x20 دقيقة التحريك. | كلوكنر وإيزنبرغ (1985)13،34 Klockner وIsenberg (1986)35 شنايدر وآخرون (1991)10 Bonev & Isenberg (1992)9 Weidelt & Isenberg (2000)36 مور وآخرون (2004)14 | |
| خنزير غينيا، خنزير لاندراس، والإنسان | DSM القطع قبل احتضان لمدة 5 دقيقة في كاليفورنيا2 +مجانا كريم حل ثم قطع إلى قطع وهضم هاضم في Ca2 +- حل كريبس الحرة التي تحتوي على 0.5-2 ملغ / مل الكولاجين نوع الأول و 0.1-0.5 ملغ / مل pronase في 36 درجة مئوية لمدة 20-30 دقيقة أثار باستمرار. في بعض الحالات، تم تحريك القطع المهضومة بشكل أكبر بواسطة ماصة حادة أو عن طريق الغزل حتى الخلايا الإنتاجية. تم تخزين الخلايا المعزولة في محلول كريبس المعدل (الموصوف في Klockner & Isenberg13)وكانت تستخدم عادة في غضون 3 ساعة. كان تكوين محلول كريبس (mM): 140 Na+، 6 K+، 2 Ca2 +، 1.2 ملغ2 +، 152.4 Cl-، 10 الجلوكوز ، 10 HEPES ، درجة الحموضة 7.35-7.4 مع تريس. بالنسبة للحلول المجانية Ca2+، تم حذف Ca2 + و Mg2+ من حل Krebs. | إينو وبرادينغ (1990)37 إينو وبرادينغ (1991)38 ناكاياما وبرادينغ (1995)39،40 | |
| الانسان | DSM قطعة وضعت في كاليفورنيا2 +مجانا حل HEPES Tyrode (في mM: 105.4 NaCl، 20.0 أو 22.3 NaHCO3، 3.6 KCl ، 0.9 MgCl2، 0.4 NaH2PO4، 19.5 أو 4.9 HEPES ، 5.4 أو 5.5 الجلوكوز ، 4.5 أو 5.5 Na-pyruvate) ومقطعة إلى قطع DSM. قطع DSM غارقة في محلول إنزيم (Ca2 + حل HEPES مجاني مع 0.7 ملغ / مل الكولاجين من النوع الأول ، 0.7 ملغ / مل باباين ، 1 ملغ / مل الزلال) بين عشية وضحاها عند 4 درجة مئوية. ثم تم تسخين الشرائط عند 36.5 درجة مئوية لمدة 15 إلى 30 دقيقة ، وغسلها وtriturated بلطف في محلول جديد. الخلايا المعزولة التي تم تخزينها في Ca2 + التي تحتوي على محلول HEPES Tyrode أو تستخدم على الفور للتجارب. | مونتغمري وفراي (1992)24 غاليغوس وفراي (1994)41 فراي وآخرون (1994)42 سوي وآخرون (2001)43 وو وآخرون (2002)44 | |
| خنزير غينيا | DSM مقطعة إلى قطع في PSS (في mM: 137 NaCl، 5.4 KCl، 2 MgCl2، 2 CaCl2، 0.42 KH2P04، 4.17 NaHCO3، 10 الجلوكوز ، 10 HEPES ، pH 7.4 مع NaOH). DSM قطعة وضعت لمدة 10 دقيقة في حل الهضم التالية (في mM: 80 نا غلوتامات، 55 NaCl, 6 KCl, 10 HEPES, 11 الجلوكوز, 2 MgCl2,و 0.2 CaCl2)ومن ثم نقل هاإلى قارورة تحتوي على نفس الحل ولكن مع 1 ملغ/ مل الكولاجين 2, 1 ملغ/مل مثبط التربسين (حذف أحيانا), 1 ملغ/مل الزلال البقري خالية من الدهون, ل ~ 70 دقيقة في 35°C أو ~ 60 دقيقة في 37°C. تم الحصول على خلايا DSM واحدة عن طريق التطفل عن طريق ماصة باستور في نفس الحل دون الكالسيوم والإنزيمات. بعد الترجيط، تمت إضافة Ca2+ (1 mM) وتم تخزين الخلايا عند 4 درجات مئوية. وكانت الزنزانات تستخدم دائما في نفس اليوم. | بونيف ونيلسون (1993)53،54 هيبنر وآخرون (1997)26 بيتكوف وآخرون (2001)47 شيه وآخرون (2001 ، 2007)48،49 | |
| خنزير غينيا والفأر والجرذ والإنسان | بروتوكول يستخدم علاج التفكك الأنزيمي خطوتين بعد تشريح حاد في كاليفورنيا2 +حل الهضم الحر (في mM: 80 نا غلوتامات, 55 NaCl, 6 KCl, 10 HEPES, 11 الجلوكوز, و 2 MgCl2). أولاً، عولجت قطع DSM لمدة 25-45 دقيقة عند 37 درجة مئوية مع 1-2 ملغم/مل من الباباين، 1 ملغ/مل ديثيويتيريثريتول و1 ملغ/مل بوملين مصل البقر في محلول التفكك (في mM: 80 غلوتامات أحادية الصوديوم، 55 NaCl, 6 KCl, 2 MgCl2,10 HEPES, و 10 الجلوكوز, معدلة إلى درجة الحموضة 7.3 مع NaOH) ثم قطع DSM نقلإلى حل الهضم التي تحتوي على 1-5 ملغ / مل الكولاجين الحادي عشر (سيغما) أو الكولاجين نوع 2, 1 ملغ / مل الألبومين مصل البقر, 0 أو 1 ملغ/مل مثبط التربسين و 100 ميكرومتر كاليفورنيا2+, لمدة 6-30 دقيقة بعد الحضانة، تم غسل الأنسجة المهضومة عدة مرات في محلول الهضم دون الإنزيمات وCa2+ ثم triturated بلطف لإنتاج خلايا العضلات الملساء واحد. | بيتكوف وآخرون (2001)50 ثورنلوي ونيلسون (2003)51 ثورنلوي ونيلسون (2004)33 بيتكوف ونيلسون (2005)27 هريستوف وآخرون (2008)52 لاين وآخرون (2010)53 هريستوف وآخرون. (2011)15 Xin et al. (2012)54 Parajuli et al. (2012)25 Malysz et al. (2013)29 Parajuli et al. (2013)31 Lee et al. (2013)55 Malysz et al. (2014)23 Smith et al. (2013)19, 20 هريستوف وآخرون (2016)22 لي وآخرون (2017)56 ياروتسكي وآخرون (2018)57 | |
الجدول 1: ملخص النهج الأنزيمية المستخدمة لعزل خلايا DSM واحدة من المثانة البولية من مختلف الأنواع.
| نوع الحل | التكوين (في mM) |
| DS (تشريح / حل الهضم) | 80 نا غلوتامات، 55 NaCl، 6 KCl، 10 HEPES، 2 MgCl2،و 11 الجلوكوز، درجة الحموضة المعدلة إلى 7.4 (مع 10 M NaOH) |
| DS-P (DS التي تحتوي على الباباين) | DS تحتوي على 1-2 ملغ/مل الباباين، 1 ملغ/مل ديثيوثتول و 1 ملغ/مل بوملين مصل البقر |
| DS-C (الكولاجين المحتوي على DS) | حل DS يحتوي على 1-2 ملغ/مل الكولاجين من النوع الثاني، 1 ملغ/مل بومالين مصل البقر، 0 أو 1 ملغ/مل مثبط التربسين و 100-200 ميكرومتر كاليفورنيا2+ |
| P (ماصة) | 110 CsOH، 110 حمض الأبارتيك، 10 NaCl، 1 MgCl2،10 HEPES، 0.05 EGTA، و 30 CsCl، درجة الحموضة المعدلة إلى 7.2 مع CsOH، وتكملها أمبورهوتيريسين-B (300-500 ميكروغرام/مل) |
| E (خارج الخلية) | 10 رباعي ththylammonium كلوريد (TEA)، 6 CsCl، 124 NaCl، 1 MgCl2،2 CaCl2،10 HEPES، و 10 الجلوكوز، درجة الحموضة المعدلة إلى 7.3-7.4 مع NaOH أو CsOH، و 0.002-3 (2-3 م M) نيفديبين |
الجدول 2: تراكيب محلول التشريح/الهضم (DS)، والمحاليل ماصة وخارج الخلية المستخدمة في تجارب المشبك المشبك المبوّج.
Discussion
الإجراءات الموصوفة هنا شرح الخطوات التي ينطوي عليها إعداد قابلة للحياة, خلايا DSM معزولة حديثا من عينات المثانة البولية البشرية سمك كامل باستخدام الهضم الأنزيمي وفي تسجيل التيارات الملقط الخلية الكاملة حساسة لمثبط قناة TRPM4 9-فينانثرول توظيف نهج المشبك المشبك المشبك المبجسة أمفوريسين-B. يعتمد الإجراء الأنزيمي على التعرض التسلسلي من خطوتين المشار إليه هنا باسم طريقة هضم الباباين-كولاكولاز المتتابعة. يتم التعامل أولا أنسجة DSM مع الباباين وdithiothreitol (عامل استقرار إنزيم) تحت Caالاسمية 2 +حالة خالية، تليها في الخطوة الثانية من نوع الكولاجين الثاني في وجود منخفض كاليفورنيا2 +. الأساس المنطقي لتنفيذ هضم الباباين في ظل انخفاض كاليفورنيا2 + الظروف في خلايا العضلات الملساء يعود تاريخها إلى أواخر عام 1980. معزولة حديثا خلايا العضلات الشريان السباتي ملساء أعدت مع papain عرض شكل ممدود، وأظهرت قابلية البقاء (المقاومة لحصة تريبان الأزرق) واستجابت لمحفزات العقد (أعلى كاليفورنيا2 + والهستامين)65. بعد سنوات، تم تطبيق هذه الطريقة في إعداد خلايا DSM (انظر الجدول 1). اختيار الكولاجين من النوع الثاني بدلا من أنواع أخرى تتعلق بنشاطها البروتيني عالية نسبيا مناسبة بشكل مثالي للأنسجة العضلية الملساء بما في ذلك DSM. في الواقع، يمكن أن تنتج علاج الكولاجين وحده خلايا DSM واحدة وإن كان يتطلب التعرض انزيم واسعة النطاق (≥ 60 دقيقة)53،54. منذ نشاط الكولاجين يعتمد على كاليفورنيا2 + والإنزيم غير نشط في ظل الظروف كاليفورنيا2 +الحرة، الهضم الأنزيمي الأمثل من قطع DSM يتطلب وجود كاليفورنيا 2+ 66. في حالتنا، يحتوي DS-C على 100-200 ميكرومتر [Ca2+](الجدول 2). بعد العلاج الأنزيمي ، يتم غسل قطع DSM المهضومة بلطف عدة مرات مع DS الباردة دون إنزيمات أو Ca2 + لإزالة أي إنزيم مرتبط بالأنسجة. يساعد DS البارد على الحفاظ على سلامة الخلايا DSM والحد من النشاط الأنزيمي لأي باباين أو كولاجيناز متبقية. في الخطوة الأخيرة، ترجيط قطع DSM المعالجة بالإنزيم مع ماصة باستور مصقول النار تطلق خلية DSM واحدة. يتم وضع خلايا DSM على الفور على غرفة تسجيل لدراسات المشبك أو أنواع أخرى من التجريب أو تخزينها على الجليد في DS لاستخدامها في وقت لاحق من نفس اليوم (عادة في غضون 8 ساعات من التحضير ، ولكن الخلايا لا تزال قابلة للحياة لمدة تصل إلى 24 ساعة).
حددنا العديد من الاعتبارات الهامة للحصول بنجاح على خلايا DSM واحدة. الأول يتعلق بنوعية مصدر عينة DSM البشرية. للحفاظ على سلامة الأنسجة على النحو الأمثل، يتم وضع عينات DSM التي تم الحصول عليها من جراحات المثانة المفتوحة في DS الباردة في أقرب وقت ممكن والحفاظ عليها في بيئة باردة. على وجه التحديد ، عند الاستخراج الجراحي من المريض ، يتم وضع عينة المثانة على الفور على طاولة جانبية معدة بالكامل في غرفة العمليات. الفحص الإجمالي للعينة بأكملها (التي يتم الحصول عليها عادة أثناء استئصال المثانة الجذري أو البسيط) ويتبعون افتتاحه. بعد الفحص البصري ، تتم إزالة قطعة من عينة سلم بولي ة كاملة السماكة من منطقة نائية من العينة غير متورطة بشكل كبير مع الورم وتوضع على الفور في كوب (إما 50 أو 100 مل) يحتوي على محلول تشريح بارد (~ 4 درجة مئوية) (DS)(الجدول 2)ثم مغلق بإحكام مع غطاء. ونظرا للطبيعة المخططة لحصاد الأنسجة، يتم تنبيه موظفي غرفة العمليات والموظفين المساعدين الذين يقومون بالحصاد في بداية الحالة الجراحية من أجل توفير المواد في غرفة العمليات وقت استخراج الأنسجة. هذه الاحتياطات جنبا إلى جنب مع الطبيعة الروتينية والمتكررة من خطوات المعالجة الحفاظ على وقت نقص التروية الدافئة للأنسجة - من الاستخراج إلى وضع في حاوية مبردة مع محلول DS - إلى أقل من 5 دقيقة. ثم توضع الحاوية في ثلاجة أو على الجليد في مبرد للحفاظ على البيئة الباردة وتنقل (باردة الجليد) إلى المختبر. بمجرد وصول العينة إلى المختبر ، تبدأ خطوات التشريح والانفصام الأنزيمي. من الصعب جدا التنبؤ ما إذا كانت عينة DSM معينة سوف تسفر عن خلايا DSM عالية الجودة بعد التفكك الأنزيمي ، لذلك نمضي قدما في خطوات التفكك الأنزيمي. في كثير من الحالات، بالتوازي مع التجارب الكهروفيزيولوجية، تجري مجموعتنا تسجيلات التوتر متساوي القياس على شرائط DSM المعدة من نفس عينات DSM. لقد وجدنا أنه يمكننا عادة الحصول على خلايا DSM عالية الجودة من الاستعدادات التي توفر أيضًا شرائط قابلة للتطبيق لدراسات الانكماش متساوي القياس (ملاحظتنا غير المنشورة).
العامل الثاني يتعلق بتقلبات مختلفة لإنزيم. لاحظنا أنه بالنسبة لكل من الباباين والكولاجين من النوع الثاني ، في كل مرة يصل فيها الكثير من الإنزيم الجديد من مورد ، يمكن أن يختلف نشاط الإنزيم في DS لهضم الأنسجة. نحن، وبالتالي، تحسين بشكل روتيني تركيز الانزيم وفترات الحضانة لكل الكثير جديدة. لتقليل مساهمة التغير الكبير، نحن من أجل كميات أكبر من نفس الكثير وجعل دفعة كبيرة من حلول الأسهم في 2 مل aliquots من الإنزيمات وتخزينها في ~ -20 درجة مئوية حتى الاستخدام. ومع مرور الوقت، يمكن أن تفقد المخزونات المجمدة (المخزنة حتى أسبوعين) نشاطها الأنزيمي. ويتعلق المتغير الثالث لدرجة حرارة علاجات هضم الإنزيم. الأنشطة الأنزيمية من كل من الباباين والكولاجين عرض درجة الحرارة التبعية. Papain والكولاجين من النوع الثاني المعرض النشاط في نطاقات درجة الحرارة التي تشمل وظائف الأعضاء الجسم العادي67،68. لذلك ، نحن نهدف إلى الحفاظ على علاجات الإنزيم مستقرة عند ~ 37 درجة مئوية لتجنب درجات حرارة أعلى للحفاظ على سلامة خلايا DSM. ويتعلق الاعتبار الرابع بتقلب نوعية خلايا DSM الموجودة داخل كل إعداد تتراوح بين قابلة للحياة للغاية (عرض خصائص العضلات الملساء الكلاسيكية الممتازة) إلى الخلايا غير الصحية والمفرطة في الهضم. فترة حضانة الإنزيم المطولة هي أحد الأسباب الرئيسية للحصول على عدد كبير من الخلايا التالفة. كما أن علاجات الإنزيم المفرطة تضعف هياكل البروتين في القنوات الأيونية والمستقبلات والناقلين، مما يؤثر سلبًا على وظائفها. وينبغي أن يضع تفسير النتائج التي تم الحصول عليها من الخلايا المعزولة حديثاً التي تم الحصول عليها بشكل أنزيمي هذا الاعتبار في الاعتبار. الأمثل للظروف الهضم الانزيم يهدف إلى زيادة النسبة المئوية للخلايا قابلة للحياة للغاية. النهج التجريبية التي تعتمد على عدد أكبر من الخلايا القابلة للحياة مثل تحليلات microarray تتطلب تحسينات أكثر قوة من تلك التي أجريت بنجاح على عدد أقل من الخلايا مثل الفيزيولوجيا الكهربائية المشبك التصحيح خلية واحدة أو كاليفورنيا2 + التصوير. وقد وجهت النظر في العوامل المذكورة أعلاه جهودنا البحثية على مدى العقد الماضي في الحصول على خلايا DSM واحدة ذات جودة عالية.
كانت تقنية المشبك الترقيعي المبشور نهجًا كهربائيًا فسيولوجيًا أساسيًا لأكثر من ربع قرن. وتقدم عدة منشورات تفاصيل عن الاعتبارات التقنية69,70,71,72,73. يمكن الحصول على انكمل الخلية مع أمبوشتيريسين-B، نيستاتين، غراميسيدين، أو α-escin (انظر المرجع32للحصول على نظرة عامة على كل منها). الميزة الرئيسية لتسجيلات المشبك المشبك الترقيع المبلل على النهج الكهربية الأخرى هي أن البيئة داخل الخلايا الأصلية - بما في ذلك Ca داخل الخلايا2+ويتم الحفاظ على جزيئات الإشارة (على سبيل المثال، cAMP، PKA، الفوسفات، والفوسفوديستراز) - هذه التقنية ، وبالتالي ، مناسبة بشكل مثالي للتحقيق في تيارات قناة الأيون الخلية الكاملة وآلياتها التنظيمية في ظل ظروف فسيولوجية قريبة. والتحذير الرئيسي هو أن تكوين الخلية داخل الخلايا لا يمكن التحكم فيها بدقة على عكس الطرق الكهروفيزيولوجية الأخرى مثل الخلايا الكاملة التقليدية والتسجيلات الاستئصالية أحادية القناة (داخل وخارج الخارج). في تجربتنا، ثلاثة عوامل تساهم بشكل روتيني في النتائج التجريبية الناجحة لتجارب المشبك المشبك البروبوريسين-B-المبوّق. الأول هو جودة الخلية DSM التي تم اختيارها لمحاولة التسجيل. عندما تكون خلايا DSM قابلة للتطبيق للغاية لعرض شبه التعاقد (مثل الثعبان) ، ومظهر لامع عالي التباين مع هالة محددة جيدا حول سطح الخلية ونعلق بإحكام على الجزء السفلي الزجاجي من غرفة التسجيل ثم تشكيل جيقة ختم وانقسام الخلية تحدث سهلة نسبيا. ويتعلق العاملان الثاني والثالث للنجاح، على التوالي، بنوعية المصدر وذوبان الأمفوثيرسين - باء (في محلول ثنائي الميثيل سولفوكسيد/DMSO ومحلول ماصة داخل الخلايا). لاحظنا وجود اختلافات بين الموردين المختلفين من حيث المصادر وتقلبات اللوت. كل يوم ونحن نعد حلا جديدا من محلول الأسهم أمبوشتيريسين-B من مسحوق تليها تخفيف في محلول ماصة داخل الخلايا. هذه الخطوات تتطلب سونيكيشن واسعة النطاق والدوامة. مع المصنوعة حديثا amphotericin-B التي تحتوي على ماصة الحل، وانقسام الخلية الناجحة (<50 MΩ) following giga-seal formation can be usually obtained within 30 min. The concentration of amphotericin-B in the pipette solution also requires optimization dependent on the amphotericin-B lot and source. Under our experimental conditions, the final amphotericin-B concentrations in the pipette range from 200 to 500 µg/mL. Since amphotericin-B exhibits light sensitivity, its solutions need to be kept in the dark. Using the amphotericin-B perforated patch-clamp technique, our group recorded voltage-step induced K mω)="" following="" giga-seal="" formation="" can="" be="" usually="" obtained="" within="" 30="" min.="" the="" concentration="" of="" amphotericin-b="" in="" the="" pipette="" solution="" also="" requires="" optimization="" dependent="" on="" the="" amphotericin-b="" lot="" and="" source.="" under="" our="" experimental="" conditions,="" the="" final="" amphotericin-b="" concentrations="" in="" the="" pipette="" range="" from="" 200="" to="" 500="" µg/ml.="" since="" amphotericin-b="" exhibits="" light="" sensitivity,="" its="" solutions="" need="" to="" be="" kept="" in="" the="" dark.="" using="" the="" amphotericin-b="" perforated="" patch-clamp="" technique,="" our="" group="" recorded="" voltage-step="" induced="">+كاليفورنيا2+، والتيارات الملجة غير الانتقائية من الإنسان، خنزير غينيا، الماوس، و / أو خلايا DSM الفئران17,21,22,23,29,30,31,35,60. هنا، ونحن نصف شروط لتسجيل التيارات التائية غير انتقائية في خلايا DSM الإنسان. 9-فينانثول, مانع من قنوات TRPM4, تخفيف الجهد خطوة التيارات المستحثة دعم دور هذه القنوات في السيطرة على استثارة DSM. كملاحظة، فإنه عادة ما يتطلب ما لا يقل عن 45 دقيقة بعد الحصول على ختم جيجا وبدء الانقلاط لتسجيل الأمثل مستقرة الجهد خطوة الناجمة التيارات الملكمة غير انتقائية. يمكن أيضًا استخدام سلالم الجهد كبديل لبروتوكولات خطوة الجهد30,64. هنا ، تم تفضيل بروتوكول خطوة الجهد من احتمال ية عقد مفرط الاستقطاب بدلاً من بروتوكول منحدر لأن النهج السابق يقلل من تأثير التنشيط الذي يعتمد على الجهد ويسمح بمتوسط التيار المستحضر على مدى مدة من الجهد خطوة حيث المنحدر يوفر نقطة بيانات واحدة لكل الجهد. النقطة الأخيرة ينطبق بشكل خاص على خلايا DSM الإنسان كما تظهر التيارات نشاط متغير خلال خطوات الجهد (الشكل 5والشكل 6). كانت تقنية المشبك المبكر من أمبورتريكسين-B ضرورية في تحديد خصائص خلايا DSM وأنواع الخلايا الأخرى، وسوف تستمر في المساعدة في توفير الاكتشافات الجديدة في المستقبل. وعلاوة على ذلك، يمكن استخدام خلايا DSM واحدة معزولة حديثا بنجاح لقياس الخلية الكاملة K+Cl-، وكا2+التيارات مع الوضع التقليدي لتقنية التصحيح المشبك، تسجيل غشاء المحتملة مع المشبك الحالي، وتسجيلات قناة واحدة كما يتضح من تقاريرنا السابقة23,29,35,64.
بالإضافة إلى طرق المشبك المشبك خلية واحدة، يمكن دراسة خلايا DSM معزولة حديثا مع النهج التقنية الأخرى بما في ذلك التصوير كاليفورنيا2 +، RT-PCR/q-RT-PCR، والكيمياء المناعية، في تحليل ربط القرب الموقع، والنهج الجينومية (على سبيل المثال، microarray، RNA-seq، CHIP-seq)15،18،30،33،34. كما تستمر أساليب تحديد النسخ وحيدة الخلية في التطور وتصبح حساسة للغاية ، فإننا نتصور في القدرة المستقبلية على ربط الخصائص الكهربائية أو الدوائية لخلايا DSM الفردية مع ملفات تعريف النسخ / البروتيوم الخاصة بهم بشكل روتيني ومحدد. وسيتم تحقيق ذلك عن طريق التسجيل الأول من خلية DSM ومن ثم استخراج مرنا أو البروتين تليها التحليلات المحضرية / البروتينية. على الرغم من أن هذه الأساليب قد تم اختبارها بالفعل في الخلايا غير DSM ، فهي في الوقت الحاضر صعبة من الناحية الفنية ، وتفتقر إلى الحساسية التي يمكن اعتبارها روتينية ، وتقتصر على الكشف الناجح عن عدد قليل من المنتجات الجينية المختارة74. سوف وظيفة - التعبير الشخصي الجزيئي ربط الدراسات عند القيام به على خلايا DSM التي تم الحصول عليها من المثانة البولية المستمدة من السيطرة والمرضى المرضى المتبرعين تقديم رؤى في العمليات الفسيولوجية الضرورية لقيادة وظائف DSM العادية، ومسببات الأمراض، وفي تحديد أساليب علاجية جديدة فعالة.
Disclosures
اي.
Acknowledgements
تم دعم هذا العمل من قبل المعاهد القومية للصحة-R01DK106964 وP20DK123971 منح لجورجي ف. بيتكوف. يشكر المؤلفان الدكتور فيكتور ياروتسكي والسيدة سارة ماكسويل على التقييم النقدي للمخطوطة. ونحن ممتنون أيضا لجراحي المسالك البولية في MUSC وUTHSC: الدكتورتوماس كين، هاري كلارك، ستيفن سافاج، روس رامز، سانديب براساد، جوناثان بيكارد، كريستوفر ليدبيتر، وأنتوني باترسون، فضلا عن MUSC والمقيمين في المسالك البولية UTHSC: الدكتور تايلور فوغان، صامويل ووكر نكلز، ماثيو يونغ، إيرين بيرنز، جاستن إليت، ريان ليفي، أوستن يونغر، مارك كورين، نيما باراداران، أولوغميسولا ماكوي، تريسي تيبتون، برايس وايت، أليسا غريمان، سارة ستاروستا، آرون بلوخ، كريستين كالاواي، لوسيل كوكس، كريستيان ديوان، إيرين هيتمان، برادلي هيوستن، ستيفن ليغ، روبرت ليبي، كول لوكلير، كريستين مارلي، مونيكا أوهانلون، باتريك بروبست، سينثيا شارالدين، إليزابيث تورفيل، دانيال زاباتا لمساعدتهم في جمع الأنسجة البشرية.
Materials
| Name | Company | Catalog Number | Comments |
| 5 ml polystyrene round-bottom tube | Falcon | 352054 | Tubes for DS containing enzymes used in digestion steps |
| 9-Phenanthrol | Sigma-Aldrich | 211281 | TRPM4 channel inhibitor |
| Amphotericin-B | Fisher | BP928-250 | Used for patch/cell perforation |
| Amphotericin-B | European Pharmacopoeia Reference Standards | 5 | Used for patch/cell perforation |
| Amphotericin-B | Sigma-Aldrich | A9528-100MG | Used for patch/cell perforation |
| Analog vortex mixer | VWR | 58816-121 | |
| Aspartic acid | Sigma-Aldrich | A9006 | Intracellular pipette solution |
| Bovine serum albumin | Sigma-Aldrich | A7906 | DS |
| CaCl2 | Sigma-Aldrich | C1016 | Extracellular solution and DS |
| Capillary Glass | Sutter | BF150-110-7.5 | Capillary for preparation of pulled patch electrodes |
| Cesium hydroxide hydrate | Sigma-Aldrich | C8518 | Intracellular pipette solution |
| Clampex ver. 10 software includes data acqusition (Clampex) and analysis (Clampfit) programs | Axon Instruments/ Molecular Devices | pCLAMP-10 | Commerical software and part of patch-clamp rig setup |
| Collagenase type 2 | Worthington Biochemical Corporation | LS004177 | DS-C |
| CsCl | Sigma-Aldrich | 203025 | Extracellular and intracellular solutions |
| Dental wax | Miltex Dental Wax Technologies, Inc. | 18058351 | |
| Digital Thermometer with Probe | Fisher Scientific | 15-077-32 | Placed in tissue bath to monitor temperature |
| Dimethyl sulfoxide (DMSO) | Sigma-Aldrich | D2650 | Solvent |
| DL-Dithiothreitol (DDT) | Sigma-Aldrich | D9779 | Reducing agents used together with Papain |
| EGTA | Sigma-Aldrich | E3889 | Ca2+ chelator, used in intracellular pipette solution |
| Flaming/Brown micropipette puller | Sutter | P-97 | Required to pull electrodes with very fine tips |
| Floating foam tube rack/holder | VWR Scientific | 82017-634 | Used for holding tubes with enzymes for temperature control |
| Glucose | Sigma | G8270 | |
| Glutamic acid (Na salt) | Sigma-Aldrich | G1626 | DS |
| HEPES | Sigma-Aldrich | H3375 | pH Buffer |
| KCl | Fisher Scientific | BP366-1 | Extracellular solution |
| Low Noise Data Acquisition System | Axon Instruments/ Molecular Devices | Digidata 1440A | Part of patch-clamp rig setup |
| Magnetic stirrer | VWR | 01-442-684 | |
| MgCl2 (hexahydrate) | Sigma-Aldrich | M2670 | Extracellular and intracellular solutions |
| MicroForge | Narishige | MF-830 | Used for fire-polishing electrodes |
| NaCl | Sigma-Aldrich | S7653 | Extracellular and intracellular solutions |
| NaOH | Sigma-Aldrich | S8045 | |
| Nifedipine | Sigma-Aldrich | N7634 | L-type voltage-gated Ca2+ channel blocker |
| Nikon inverted microscope, TS100 with T1-SM stage with 5x, 10x, 20x, and 40x objectives | Nikon | Discontinued | Part of Patch-clamp rig setup |
| Non-metalic syringe needle, MicroFil | WPI | MF-34G-5 | Filling of intracellular pipette solution |
| Papain | Worthington Biochemical Corporation | LS003126 | DS-P |
| Pasteur pipette | FisherBrand | 13-678-20A | Tips are broken off and fire-polished and used for titration of enzymatically treated tissues to release single DSM cells from pieces |
| Patch-clamp amplifier | Axon Instruments/ Molecular Devices | Axon Axopatch 200B | Part of patch-clamp rig setup |
| PC computer | DELL | Custom configuration | Part of patch-clamp rig setup |
| pH Meter | Aspera Instruments | PH700 | |
| Polyethylene tubing | Intramedic | 427-436 | Tubing for superfusion of extracellular bath connected to glass-bottom recording chamber |
| Tetraethylammonium chloride | Sigma-Aldrich | T2265 | Ion channel blocker of Kv and BK channels added to the extracellular bath solution |
| Thermo Scientific Precision shaking water bath (model 2870) | Thermo Scientific | Discontinued | Water bath for temperature control of enzymatic digestion employed as an alternative to tissue chamber-circulating bath setup |
| Tissue bath, 100 mL | Radnoti | 1583-101 | Connected to a circulating bath and filled with water, tubes with DS and DSM pieces are placed in the setup to control the temperature of digestion steps |
| Vinyl tubing | ColePalmer | 06405-3 | Multiple uses including for connecting tissue bath to circulating water bath |
| Water circulator bath, Haake D1 L | Haake | Discontinued | Connected to tissue bath |
| Weighting scale | Mettler Toledo | XS64 | |
| ZeissAxiovert 40C inverted microscope with 10x and 40x objectives | Carl-Zeiss | Discontinued | Part of patch-clamp rig setup |
References
- Andersson, K. E., Arner, A. Urinary bladder contraction and relaxation: physiology and pathophysiology. Physiological Reviews. 84 (3), 935-986 (2004).
- Brading, A. F., Brain, K. L., Andersson, K. E., Michel, M. C. Ion channel modulators and urinary tract function. Urinary Tract. 202, 375-393 (2011).
- Brading, A. F. Spontaneous activity of lower urinary tract smooth muscles: correlation between ion channels and tissue function. Journal of Physiology. 570, 13-22 (2006).
- Brading, A. F., Heaton, J. P., Hashitani, H. A survey of commonalities relevant to function and dysfunction in pelvic and sexual organs. International Journal of Impotence Research. 20 (1), 1-16 (2008).
- Petkov, G. V. Role of potassium ion channels in detrusor smooth muscle function and dysfunction. Nature Reviews Urology. 9 (1), 30-40 (2012).
- Andersson, K. E. Treatment-resistant detrusor overactivity--underlying pharmacology and potential mechanisms. International Journal of Clinical Practice Supplement. 151, 8-16 (2006).
- Sui, G. P., Wu, C., Fry, C. H. The electrophysiological properties of cultured and freshly isolated detrusor smooth muscle cells. Journal of Urology. 165 (2), 627-632 (2001).
- Kropp, B. P., et al. Characterization of cultured bladder smooth muscle cells: assessment of in vitro contractility. Journal of Urology. 162 (5), 1779-1784 (1999).
- Bonev, A., Isenberg, G. Arginine-vasopressin induces mode-2 gating in L-type Ca2+ channels (smooth muscle cells of the urinary bladder of the guinea-pig). Pflügers Archive - European Journal of Physiology. 420 (2), 219-222 (1992).
- Schneider, P., Hopp, H. H., Isenberg, G. Ca2+ influx through ATP-gated channels increments [Ca2+]i and inactivates ICa in myocytes from guinea-pig urinary bladder. Journal of Physiology. 440, 479-496 (1991).
- Wellner, M. C., Isenberg, G. Properties of stretch-activated channels in myocytes from the guinea-pig urinary bladder. Journal of Physiology. 466, 213-227 (1993).
- Wellner, M. C., Isenberg, G. Stretch-activated nonselective cation channels in urinary bladder myocytes: importance for pacemaker potentials and myogenic response. Experientia Supplementum. 66, 93-99 (1993).
- Klockner, U., Isenberg, G. Action potentials and net membrane currents of isolated smooth muscle cells (urinary bladder of the guinea-pig). Pflügers Archive - European Journal of Physiology. 405 (4), 329-339 (1985).
- Moore, E. D., et al. Organization of Ca2+ release units in excitable smooth muscle of the guinea-pig urinary bladder. Biophysical Journal. 87 (3), 1836-1847 (2004).
- Hristov, K. L., Chen, M., Kellett, W. F., Rovner, E. S., Petkov, G. V. Large conductance voltage- and Ca2+-activated K+ channels regulate human detrusor smooth muscle function. American Journal of Physiology - Cell Physiology. 301 (4), 903-912 (2011).
- Afeli, S. A., Rovner, E. S., Petkov, G. V. SK but not IK channels regulate human detrusor smooth muscle spontaneous and nerve-evoked contractions. American Journal of Physiology - Renal Physiology. 303 (4), 559-568 (2012).
- Hristov, K. L., et al. Kv2.1 and electrically silent Kv channel subunits control excitability and contractility of guinea pig detrusor smooth muscle. American Journal of Physiology - Cell Physiology. 302 (2), 360 (2012).
- Afeli, S. A., Malysz, J., Petkov, G. V. Molecular expression and pharmacological evidence for a functional role of Kv7 channel subtypes in Guinea pig urinary bladder smooth muscle. PLoS One. 8 (9), 75875 (2013).
- Smith, A. C., et al. TRPM4 channel: a new player in urinary bladder smooth muscle function in rats. American Journal of Physiology - Renal Physiology. 304 (7), 918-929 (2013).
- Smith, A. C., et al. Novel role for the transient potential receptor melastatin 4 channel in guinea pig detrusor smooth muscle physiology. American Journal of Physiology - Cell Physiology. 304 (5), 467 (2013).
- Hristov, K. L., Smith, A. C., Parajuli, S. P., Malysz, J., Petkov, G. V. Large-conductance voltage- and Ca2+-activated K+ channel regulation by protein kinase C in guinea pig urinary bladder smooth muscle. American Journal of Physiology - Cell Physiology. 306 (5), 460-470 (2014).
- Hristov, K. L., et al. Novel regulatory mechanism in human urinary bladder: central role of transient receptor potential melastatin 4 channels in detrusor smooth muscle function. American Journal of Physiology - Cell Physiology. 310 (7), 600-611 (2016).
- Malysz, J., Afeli, S. A., Provence, A., Petkov, G. V. Ethanol-mediated relaxation of guinea pig urinary bladder smooth muscle: involvement of BK and L-type Ca2+ channels. American Journal of Physiology - Cell Physiology. 306 (1), 45-58 (2014).
- Montgomery, B. S., Fry, C. H. The action potential and net membrane currents in isolated human detrusor smooth muscle cells. Journal of Urology. 147 (1), 176-184 (1992).
- Parajuli, S. P., Soder, R. P., Hristov, K. L., Petkov, G. V. Pharmacological activation of small conductance calcium-activated potassium channels with naphtho[1,2-d]thiazol-2-ylamine decreases guinea pig detrusor smooth muscle excitability and contractility. Journal of Pharmacology and Experimental Therapeutics. 340 (1), 114-123 (2012).
- Heppner, T. J., Bonev, A. D., Nelson, M. T. Ca2+-activated K+ channels regulate action potential repolarization in urinary bladder smooth muscle. American Journal of Physiology - Cell Physiology. 273 (1), 110-117 (1997).
- Petkov, G. V., Nelson, M. T. Differential regulation of Ca2+-activated K+ channels by beta-adrenoceptors in guinea pig urinary bladder smooth muscle. American Journal of Physiology - Cell Physiology. 288 (6), 1255-1263 (2005).
- Herrera, G. M., Etherton, B., Nausch, B., Nelson, M. T. Negative feedback regulation of nerve-mediated contractions by KCa channels in mouse urinary bladder smooth muscle. American Journal of Physiology - Regulatory Integrative Comparative Physiology. 289 (2), 402-409 (2005).
- Malysz, J., Rovner, E. S., Petkov, G. V. Single-channel biophysical and pharmacological characterizations of native human large-conductance calcium-activated potassium channels in freshly isolated detrusor smooth muscle cells. Pflügers Archive - European Journal of Physiology. 465 (7), 965-975 (2013).
- Provence, A., Angoli, D., Petkov, G. V. Kv7 channel pharmacological activation by the novel activator ML213: role for heteromeric Kv7.4/Kv7.5 channels in guinea pig detrusor smooth muscle function. Journal of Pharmacology and Experimental Therapeutics. 364 (1), 131-144 (2018).
- Parajuli, S. P., et al. Control of urinary bladder smooth muscle excitability by the TRPM4 channel modulator 9-phenanthrol. Channels (Austin). 7 (6), 537-540 (2013).
- Ishibashi, H., Moorhouse, A. J., Nabekura, J., Okada, Y. Perforated whole-cell patch-clamp technique: a user's guide. Patch Clamp Techniques: From Beginning to Advanced Protocols. 4, 71-83 (2012).
- Provence, A., Rovner, E. S., Petkov, G. V. Regulation of transient receptor potential melastatin 4 channel by sarcoplasmic reticulum inositol trisphosphate receptors: Role in human detrusor smooth muscle function. Channels (Austin). 11 (5), 459-466 (2017).
- Hristov, K. L., et al. Suppression of human detrusor smooth muscle excitability and contractility via pharmacological activation of large conductance Ca2+-activated K+ channels. American Journal of Physiology - Cell Physiology. 302 (11), 1632-1641 (2012).
- Xin, W., Soder, R. P., Cheng, Q., Petkov, G. V. Inhibition of phosphodiesterases relaxes detrusor smooth muscle via activation of the large conductance voltage- and Ca2+-activated K+ channel. American Journal of Physiology - Cell Physiology. 302 (9), 1361-1370 (2012).
- Hristov, K. L., et al. Neurogenic detrusor overactivity is associated with decreased expression and function of the large conductance voltage- and Ca2+-activated K+ channels. PLoS One. 8 (7), 68052 (2013).
- Hristov, K. L., Parajuli, S. P., Provence, A., Rovner, E. S., Petkov, G. V. Nongenomic modulation of the large conductance voltage- and Ca2+-activated K+ channels by estrogen: A novel regulatory mechanism in human detrusor smooth muscle. Physiological Reports. 5 (14), (2017).
- Parajuli, S. P., et al. Functional link between muscarinic receptors and large-conductance Ca2+ -activated K+ channels in freshly isolated human detrusor smooth muscle cells. Pflügers Archiv - European Journal of Physiology. 467 (4), 665-675 (2015).
- Malysz, J., Rovner, E. S., Petkov, G. V. Single-channel biophysical and pharmacological characterizations of native human large-conductance calcium-activated potassium channels in freshly isolated detrusor smooth muscle cells. Pflügers Archiv - European Journal of Physiology. 465 (7), 965-975 (2013).
- Thorneloe, K. S., Nelson, M. T. Properties of a tonically active, sodium-permeable current in mouse urinary bladder smooth muscle. American Journal of Physiology - Cell Physiology. 286 (6), 1246-1257 (2004).
- Barry, M. J., et al. The American Urological Association symptom index for benign prostatic hyperplasia. The Measurement Committee of the American Urological Association. Journal of Urology. 148 (5), 1549-1557 (1992).
- Klockner, U., Isenberg, G. Calcium currents of cesium loaded isolated smooth muscle cells (urinary bladder of the guinea pig). Pflügers Archiv - European Journal of Physiology. 405 (4), 340-348 (1985).
- Klockner, U., Isenberg, G. Tiapamil reduces the calcium inward current of isolated smooth muscle cells. Dependence on holding potential and pulse frequency. European Journal of Pharmacology. 127 (3), 165-171 (1986).
- Weidelt, T., Isenberg, G. Augmentation of SR Ca2+ release by rapamycin and FK506 causes K+-channel activation and membrane hyperpolarization in bladder smooth muscle. British Journal of Pharmacology. 129 (7), 1293-1300 (2000).
- Inoue, R., Brading, A. F. The properties of the ATP-induced depolarization and current in single cells isolated from the guinea-pig urinary bladder. British Journal of Pharmacology. 100 (3), 619-625 (1990).
- Inoue, R., Brading, A. F. Human, pig and guinea-pig bladder smooth muscle cells generate similar inward currents in response to purinoceptor activation. British Journal of Pharmacology. 103 (4), 1840-1841 (1991).
- Nakayama, S., Brading, A. F. Possible contribution of long open state to noninactivating Ca2+ current in detrusor cells. American Journal of Physiology - Cell Physiology. 269 (1), 48-54 (1995).
- Nakayama, S., Brading, A. F. Interaction of Ca2+ agonist and depolarization on Ca2+ channel current in guinea pig detrusor cells. Journal of General Physiology. 106 (6), 1211-1224 (1995).
- Gallegos, C. R., Fry, C. H. Alterations to the electrophysiology of isolated human detrusor smooth muscle cells in bladder disease. Journal of Urology. 151 (3), 754-758 (1994).
- JournalFry, C. H., Gallegos, C. R., Montgomery, B. S. The actions of extracellular H+ on the electrophysiological properties of isolated human detrusor smooth muscle cells. Journal of Physiology. 480, 71-80 (1994).
- Sui, G. P., Wu, C., Fry, C. H. A description of Ca2+ channels in human detrusor smooth muscle. BJU International Journal. 92 (4), 476 (2003).
- Wu, C., Sui, G., Fry, C. H. The role of the L-type Ca2+ channel in refilling functional intracellular Ca2+ stores in guinea-pig detrusor smooth muscle. Journal of Physiology. 538, 357-369 (2002).
- Bonev, A. D., Nelson, M. T. Muscarinic inhibition of ATP-sensitive K+ channels by protein kinase C in urinary bladder smooth muscle. American Journal of Physiology - Cell Physiology. 265 (6), 1723-1728 (1993).
- Bonev, A. D., Nelson, M. T. ATP-sensitive potassium channels in smooth muscle cells from guinea pig urinary bladder. American Journal of Physiology - Cell Physiology. 264 (5), 1190-1200 (1993).
- Petkov, G. V., Heppner, T. J., Bonev, A. D., Herrera, G. M., Nelson, M. T. Low levels of KATP channel activation decrease excitability and contractility of urinary bladder. American Journal of Physiology - Regulatory Integrative Comparative Physiology. 280 (5), 1427-1433 (2001).
- Shieh, C. C., et al. Functional implication of spare ATP-sensitive K+ channels in bladder smooth muscle cells. Journal of Pharmacology and Experimental Therapeutics. 296 (3), 669-675 (2001).
- Shieh, C. C., et al. Characterization of a novel ATP-sensitive K+ channel opener, A-251179, on urinary bladder relaxation and cystometric parameters. British Journal of Pharmacology. 151 (4), 467-475 (2007).
- Petkov, G. V., et al. Beta1-subunit of the Ca2+-activated K+ channel regulates contractile activity of mouse urinary bladder smooth muscle. Journal of Physiology. 537, 443-452 (2001).
- Thorneloe, K. S., Nelson, M. T. Properties and molecular basis of the mouse urinary bladder voltage-gated K+ current. Journal of Physiology. 549, 65-74 (2003).
- Hristov, K. L., et al. Stimulation of beta3-adrenoceptors relaxes rat urinary bladder smooth muscle via activation of the large-conductance Ca2+-activated K+ channels. American Journal of Physiology - Cell Physiology. 295 (5), 1344-1353 (2008).
- Layne, J. J., Nausch, B., Olesen, S. P., Nelson, M. T. BK channel activation by NS11021 decreases excitability and contractility of urinary bladder smooth muscle. American Journal of Physiology - Regulatory Integrative Comparative Physiology. 298 (2), 378-384 (2010).
- Lee, H., Koh, B. H., Peri, L. E., Sanders, K. M., Koh, S. D. Functional expression of SK channels in murine detrusor PDGFRalpha+ cells. Journal of Physiology. 591 (2), 503-513 (2013).
- Lee, H., et al. Premature contractions of the bladder are suppressed by interactions between TRPV4 and SK3 channels in murine detrusor PDGFRalpha+ cells. Scientific Reports. 7 (1), 12245 (2017).
- Yarotskyy, V., Malysz, J., Petkov, G. V. Properties of single channel and whole-cell Cl- currents in guinea pig detrusor smooth muscle cells. American Journal of Physiology - Cell Physiology. 316 (5), 698-710 (2019).
- Driska, S. P., Porter, R. Isolation of smooth muscle cells from swine carotid artery by digestion with papain. American Journal of Physiology - Cell Physiology. 251 (3), 474-481 (1986).
- Seltzer, J. L., Welgus, H. G., Jeffrey, J. J., Eisen, A. Z. The function of Ca2+ in the action of mammalian collagenases. Archives of Biochemistry and Biophysics. 173 (1), 355-361 (1976).
- Skelton, G. S. Papaya proteinases. I. Temperature-and pH-stability curves. Enzymologia. 35 (5), 270-274 (1968).
- Petrova, D., Derekova, A., Vlahov, S. Purification and properties of individual collagenases from Streptomyces sp. strain 3B. Folia Microbiologica (Praha). 51 (2), 93-98 (2006).
- Sharpe, E. J., St Clair, J. R., Proenza, C. Methods for the isolation, culture, and functional characterization of sinoatrial node myocytes from adult mice. Journal of Visualized Experiments. (116), (2016).
- Brueggemann, L. I., Mani, B. K., Haick, J., Byron, K. L. Exploring arterial smooth muscle Kv7 potassium channel function using patch clamp electrophysiology and pressure myography. Journal of Visualized Experiments. (67), e4263 (2012).
- Jarriault, D., Grosmaitre, X. Perforated patch-clamp recording of mouse olfactory sensory neurons in intact neuroepithelium: functional analysis of neurons expressing an identified odorant receptor. Journal of Visualized Experiments. (101), e52652 (2015).
- Rae, J., Cooper, K., Gates, P., Watsky, M. Low access resistance perforated patch recordings using amphotericin B. Journal of Neuroscience Methods. 37 (1), 15-26 (1991).
- Knutson, K., et al. Whole cell electrophysiology of primary cultured murine enterochromaffin cells. Journal of Visualized Experiments. (139), (2018).
- Devienne, G., Le Gac, B., Piquet, J., Cauli, B. Single cell multiplex reverse transcription polymerase chain reaction after patch-clamp. Journal of Visualized Experiments. (136), (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved