Method Article
الامتزاز الجزيئي المستحث بالضوء من البروتينات باستخدام نظام بريمو لزخرفه الصغرى لدراسة استجابات الخلايا للبروتينات المصفوفة خارج الخلية
* These authors contributed equally
In This Article
Summary
هدفنا العام هو فهم كيف الخلايا حاسة الإشارات خارج الخلية التي تؤدي إلى النمو محواري الموجهة. هنا ، ونحن وصف منهجيه الضوء المستحث الجزيئية الامتزاز من البروتينات ، وتستخدم لإنتاج النماذج الدقيقة المحددة من مكونات مصفوفة خارج الخلية من أجل دراسة احداث محدده التي تحكم النمو العصبي والباثيه.
Abstract
الخلايا تستشعر مجموعه متنوعة من العظة خارج الخلية ، بما في ذلك تكوين وهندسه مصفوفة خارج الخلية ، والتي يتم توليفها وتشكيلها من قبل الخلايا نفسها. هنا ، نقدم طريقه الامتصاص الجزيئي الناجم عن الضوء من البروتينات (LIMAP) باستخدام نظام بريمو كتقنية زخرفه لإنتاج ركائز المصفوفة خارج الخلية الصغيرة المنقوشة (ECM) باستخدام واحد أو مزيج من البروتينات. الأسلوب يتيح طباعه أنماط ECM في قرار ميكرون مع استنساخ ممتازة. نحن نقدم بروتوكول خطوه بخطوه وشرح كيف يمكن تطبيق هذا لدراسة عمليات النتائج المرضية العصبية. لدي LIMAP مزايا كبيره علي طرق الطباعة الدقيقة الموجودة من حيث سهوله زخرفه أكثر من مكون واحد والقدرة علي توليد نمط مع اي الهندسة أو التدرج. ويمكن بسهوله تكييف البروتوكول لدراسة مساهمه اي عنصر كيميائي تقريبا نحو مصير الخلية وسلوك الخلية. وأخيرا ، نناقش القضايا المشتركة التي يمكن ان تنشا وكيف يمكن تجنبها.
Introduction
وفي السنوات الاخيره ، استخدمت العلوم البيولوجية بشكل متزايد التطورات التي توفرها العلوم المادية. واحده مثال بارزه ال [ميكرو-زخرفه] من ركائز, اي يستطيع كنت استعملت ان يدرس استجابه خلوية مثل خليه انتشار1,2التمايز3,4,5,6، ترحيل الخلايا7,8,9والتقصي10,11. وهناك عدد من التقنيات المتاحة التي تمكن زخرفه الصغرى من ركائز ، مثل الكيمياء الضوئية متحمس متعدد الفوتونات12، فؤاد تراجع-القلم نانوليثوغرافي13، دبوس والنافثة للحبر الطباعة المباشرة14، والطباعة الحجرية شعاع الكترون15أو ميكروفلويديكس16. ومع ذلك ، فان اثنين من التقنيات التي تستخدم علي نطاق واسع في المجال البيولوجي هي الطباعة ميكرواتصال17,18,19أو زخرفه بمساعده الليزر3(الشكل 1). ويعتبر زخرفه بمساعده الليزر لتقديم نتائج أكثر موثوقيه من حيث البروتين والاستقرار PEG والحبس الخلوي علي الأنماط ، بالمقارنة مع الطباعة ميكرواتصال20. وهناك نهج أكثر رواية لزخرفه الصغرى الموصوفة هنا هو استخدام الضوء المستحث الامتزاز الجزيئي للبروتينات21(LIMAP,الشكل 1 د) باستخدام نظام متاح تجاريا (بريمو ،جدول المواد). ولكل من هذه الأساليب مزايا وقيود يرد وصفها بإيجاز أدناه. تستخدم الطباعة بالاتصال المجهري قوالب PDMS (طوابع) مع الميزات الدقيقة المطلوبة التي يتم إنشاؤها من السادة الحجرية. حضنت الدمغ مع بروتين مختاره اي يكون بعد ذلك [ترنسفرد] (يختم) فوق الخلية ثقافة ركيزة18(الشكل 1 علي). يستخدم الليزر بمساعده زخرفه ضوء الاشعه فوق البنفسجية ليلتصق فيلم المضادة للحشف22,23,24,25، وتعريض المناطق التي يمكن ان تكون في وقت لاحق المغلفة مع البروتين من الفائدة (الشكل 1 ب). بينما القرار يحقق مع [فوتو-زخرفه] مقاربه في ال [ميكرون رنج]25,26، ومعظم هذه التقنيات تتطلب قناع الصورة ، اما في اتصال مع العينة ، أو تقع في الطائرة كائن من هدف المجهر23,27,28. ويمكن ان تكون متطلبات الاقنعه في كل من الطباعة المجهرية والصور الزخرفته قيدا ؛ أقنعه محدده مطلوبه لكل نمط هندسي وحجم ، والتي يمكن ان تكون مكلفه وتستغرق وقتا طويلا لتوليد. علي النقيض من هذه التقنيات ، LIMAP لا يتطلب قناع (الشكل 1 د). استخدام نظام بريمو ل LIMAP يمكن ان تكون باهظه التكلفة في البداية لأنه يتطلب شراء المعدات. ومع ذلك ، يتم استخدام البرمجيات مفتوحة المصدر لتصميم أنماط من اي الهندسة المطلوبة ، وإعطاء المزيد من الحرية والسماح للتجارب أكثر تعقيدا بما في ذلك استخدام التدرجات تركيز البروتين. يتم التحكم في الليزر بريمو وإخراجه بواسطة جهاز ميكرو أو DMD المتحكم به رقميا لخلق أنماط في اي عدد من الهندسي المعرفة من قبل المستخدم. يتطلب LIMAP سطح الثقافة لتكون مغلفه مع الجزيئات التي تمنع المرفقات الخلية. البولي إيثيلين غليكول (PEG) هو الأكثر شيوعا كمثل هذا الكاشف "انتيقاذورات"; فانه يشكل فيلم كثيفه المضادة للاصقه علي سطح الزجاج أو البلاستيك29. وفي وقت لاحق ، يتم أضافه البادئ الصورة التي تسمح للفيلم PEG لأزالها بدقه عاليه من خلال اليه التصوير الضوئي30بواسطة التعرض المحلي للاشعه فوق البنفسجية تحت سيطرة DMD. هذه المناطق الخالية من الوتد يمكن ان تكون مغلفه مع البروتينات التي كثف إلى سطح محفورة بالليزر ، وتوليد نمط الصغرى. من خلال تغيير قوه الليزر ، يمكن أزاله كميات مختلفه من PEG من السطح مما يسمح للمستخدم لتوليد التدرجات البروتين. ويمكن تكرار أزاله الوتد واجراء الطلاء لخلق أنماط مع اثنين أو أكثر من البروتينات المتميزة في نفس الصغرى جيدا21. توفر الأنماط الصغيرة التي تم إنشاؤها أسطح لاصقه للخلايا ، مما يسمح بدراسة سلوك الخلايا. في الدراسات لدينا ، ونحن نستخدم الزخرفة الصغرى لدراسة العصب أو المسار العصبي من خط الخلايا العصبية (CAD (كاثيكهولامينجيك-المتمايزة) الخلايا31) أو الرئيسية الفئران الظهرية الجذر العقدة (DRG) الخلايا العصبية ، علي التوالي. هنا ، نحن الخطوط العريضة لبروتوكول خطوه بخطوه ل LIMAP (الشكل 2) باستخدام نظام بريمو المتاح تجاريا وبرنامج ليوناردو المصاحب. ونحن نظهر كيف يمكن استخدامه لتوليد أنماط مع الهندسي المحددة والبروتينات المتعددة ، والتي نستخدمها لدراسة الاكتشاف المرضي محواري. نحن نناقش القضايا المشتركة التي يمكن ان تنشا وكيف يمكن تجنبها.
Protocol
1. تصميم قوالب نمط
ملاحظه: يتم إنشاء قوالب لزخرفه مع برنامج الرسم الرقمي (جدول المواد). الرسم في مختلف المستويات الرمادية سيحدد كثافة الليزر. استخدام البرمجيات لتصميم قوالب نمط يسمح الجيل السريع من أنماط مع اي الهندسة المطلوبة والتدرجات (الشكل 3).
- رسم قالب النقش المطلوب رقميا باستخدام برنامج الرسم. حدد حجم صوره 1824 بكسل طول و 1140 بكسل العرض (التي في هذه الدراسة يتوافق مع طول 415 μm و 260 μm العرض). احفظ قالب النقش كملف Tiff 8 بت.
ملاحظه: يتوفر بروتوكول خطوه بخطوه لإنشاء قوالب عند الطلب للعلامة التجارية التي تقوم بتسويق معدات الزخرفة الصغيرة (جدول المواد).
2. تنظيف البلازما
ملاحظه: النتائج المثلي تتطلب تنظيف البلازما من الأسطح قبل زخرفه ، والتي سوف تزيل جميع المواد العضوية وتنشيط السطح. وفي هذه الحالة ، يكون الهواء المحيط كافيا لتنشيط السطح. تم استخدام منظف البلازما (جدول المواد) مع ضغط العملية من 1000-1300 mTorr وقوه 29.6 W لمده 1-5 دقيقه.
- استخدام طبق الزجاج السفلي/es مع 20 ملم حجم البئر الداخلية وسماكه الزجاج من 0.16-0.19 مم. لاختبار الحالات المتعددة ، استخدم طبقا سفليا من الزجاج بسته ابار. خلاف ذلك ، استخدم طبق واحدمن الزجاج السفليبشكل جيد (جدول المواد).
ملاحظه: يتوفر بروتوكول خطوه بخطوه لتنظيف البلازما عند الطلب للعلامة التجارية التي تقوم بتسويق معدات تنظيف البلازما (جدول المواد).
3. التخميل
ملاحظه: هذه الخطوة بإنشاء فيلم انتيشف الذي يمنع الامتزاز البروتين علي سطح الزجاج. PEG يوفر مقاومه عاليه للبروتين الامتزاز29 كعامل مضاد للحشف. يستخدم LIMAP الصورة البادئ لأزاله PEG محليا من خلال الاشعه فوق البنفسجية. سيمتص البروتين/[س] الفائدة بعد ذلك إلى هذا [بيج-فر] سطوح21, يلد [ميكرو-لمنت].
- التخميل مع PLL-PEG
- في ظل ظروف معقمه ، وقطع الاستنسل PDMS (انظر الشكل 4A ، B وجدول المواد) للتاكد من انها تناسب في أسفل الزجاج الداخلي بشكل جيد ، وأزاله الحشوات الداخلية الصغرى بشكل جيد مع ملقط معقمه. عصا الاستنسل علي الزجاج جيدا باستخدام ملقط.
- تاكد من ان الاستنسل عصا باحكام علي الزجاج جيدا ، ومنع تشكيل فقاعات الهواء التي يمكن ان تسبب تسرب اثناء عمليه التخميل.
ملاحظه: يمكن أيضا ان تكون ملفقه pdms الاستنسل في المنزل باستخدام البروتوكولاتالمنشورة 18 ،32. - اعداد PLL-PEG الحل (جدول المواد، 0.1 ملغ/مل) في الفوسفات-مخزنه المالحة (تلفزيوني). أضافه 20 μL من PLL-PEG حل لكل الصغرى جيدا واحتضان في درجه حرارة الغرفة ، ل 1 ح.
- أزاله 15 μL من PLL-PEG من الآبار الصغيرة ويغسل لهم خمس مرات مع 20 μL من تلفزيوني (جدول المواد) دون السماح لهم الجافة.
ملاحظه: ترك دائما تقريبا 5 μL من التلفزيونية في بين يغسل. ونظرا لصغر حجمها ، فان الآبار الصغيرة معرضه بوجه خاص للجفاف. وسوف يؤدي التجفيف في النماذج الصغرى من نوعيه رديئه. - اما الحفاظ علي الطبق الثقافي في الاذاعه التلفزيونية (3 مل لكل بئر) في 4 درجه مئوية لمده تصل إلى 3 أيام أو الاستمرار مع الخطوة التالية (الخطوة 3-1-5).
- أزاله 18 μL من تلفزيوني من واحد الصغرى جيدا (علي سبيل المثال ، اعلي اليسار الصغرى جيدا ، انظر الشكل 4د) ، أضافه 5 μl من الصورة البادئ (plpp ، جدول المواد) وترك 20 μl من تلفزيوني في الآبار الصغرى المتبقية. سيستخدم هذا البئر الصغير مع PLPP لإنشاء نمط مرجعي (انظر الشكل 4D ، E) اثناء خطوه معايره النظام (الخطوة 4). إبقاء PLPP محمية من الضوء.
- التخميل مع طويلة الأمد PEG-SVA
ملاحظه: لتوليد المضادة--لاصقه سطح يمكن للمرء ان استخدام: 1) شماعة مرتبطة بولي-L-ليسين (PLL-PEG ، الخطوة 3.1) أو 2) وربط-سكسينات ن-الهيدروكسيل (PEG-SVA). يعتمد قرار اختيار خيار التخميل الآخر علي خيارات التخزين (انظر الخطوة 10). الاطباق الثقافية المحتضنة مع PEG-SVA تتطلب كميه مزدوجة من التخميل والوقت فوتوباتيرنينج.- اعداد الاستنسل كما هو موضح في الخطوة 3-1-1.
- أضافه 20 μL من 0.01 ٪ بولي-L-ليسين (PLL ، جدول المواد) لكل الصغرى جيدا واحتضان في درجه حرارة الغرفة لمده 30 دقيقه إلى ما قبل معطف مع pll.
- أزاله 15 μL من PLL من الآبار الصغيرة ويغسل لهم ثلاث مرات مع 20 μL من 1 M HEPES العازلة (جدول المواد) دون السماح لتجف الآبار.
ملاحظه: دائما ترك ما يقرب من 5 μL من HEPES أو تلفزيوني في بين يغسل. ونظرا لصغر حجمها ، فان الآبار الصغيرة معرضه بوجه خاص للجفاف. وسوف يؤدي التجفيف في النماذج الصغرى من نوعيه رديئه. - اعداد PEG-SVA الحل. PEG-SVA الحل (50 ملغ/مل في HEPES العازلة 1M) يجب ان تعد طازجه في كل مره قبل الاستخدام مباشره. اعداد 20 μL من PEG-SVA لكل الصغرى جيدا.
- يجب ان يكون العازل المؤقت HEPES درجه الحموضة بين 8-8.5. اختبار HEPES pH قبل اعداد الحل PEG-SVA مع ورقه الأس الهيدروجيني. تزن PEG-SVA في أنبوب الطرد المركزي باستخدام مقياس الدقة. أضافه العازلة HEPES ودوامه 30 s حتى يذوب. يتم حل PEG-SVA تماما عندما يكون الحل شفافا.
ملاحظه: SVA هو استر الذي يسمح ربط PEG إلى PLL المغلفة سابقا. مره واحده يتم أضافه العازلة HEPES إلى PEG-SVA ، و SVA لديه نصف عمر من 15 دقيقه وينبغي ان تستخدم علي الفور. - أضافه 20 μL من الحل PEG-SVA لكل الصغرى حسنا واحتضان في درجه حرارة الغرفة ، ل 1 ح. أزاله 15 μL من PEG-SVA من الآبار الصغيرة ويغسل خمس مرات مع 20 μL من تلفزيوني (جدول المواد) دون السماح الآبار تجف.
- اما اعداد طبق الثقافة للتخزين علي المدى الطويل (تصل إلى 1 شهر ، انظر الخطوة 10.2) أو المضي قدما إلى الخطوة التالية (خطوه 3.2.8).
- أزاله 18 μL من تلفزيوني من واحده صغيره-حسنا (علي سبيل المثال ، العلوي الأيسر الصغرى ، انظر الشكل 4د) ، أضافه 5 ΜL من Plpp (جدول المواد) وترك 20 μl من تلفزيوني في الآبار الصغرى المتبقية. ستستخدم هذه البئر الصغيرة لإنشاء نمط مرجعي (انظر Fi غوري 4D, E). تاكد من ان PLPP متجانسة علي السطح بأكمله من البئر الصغيرة. إبقاء PLPP محمية من الضوء.
4. معايره النظام
ملاحظه: في هذه الخطوات ، سيتم تعديل تركيز الليزر إلى نوع معين من طبق الثقافة (الخطوة 4.1). سيتم إنشاء نمط مرجعي في واحد فقط الصغرى-حسنا (الخطوة 4.2) تليها الحضانة مع محلول البروتين (الخطوة 4.3) لضمان ظروف التركيز الأمثل لليزر (الخطوة 4.4) ، اللازمة للحصول علي أنماط حاده ومحدده.
- معايره الليزر
ملاحظه: خلال عمليه المعايرة ، سيتم إسقاط صوره ليزر المعايرة علي سطح زجاجي فلوريسسينتلي (المعايرة جيدا ، مع تمييز الفلورسنت ، الشكل 4ج) ، والتي تحتاج إلى وضعها في التركيز علي المجهر.- استخدم أداه تمييز الفلورسنت (جدول المواد) لوضع علامة علي الزجاج الداخلي الفارغ جيدا.
ملاحظه: المعايرة جيدا يجب ان يكون لها نفس سماكه الزجاج (0.16-0.19 mm) كما طبق الثقافة التي سيتم توليد الأنماط الصغرى. إذا تم استخدام طبق سفلي من الزجاج بسته ابار ، يمكن استخدام البئر الفارغ للمعايرة ويجب وضع علامة عليه مع أداه تمييز الفلورسنت تحت ظروف معقمه. - التبديل علي المجهر ، والمسرح والكمبيوتر. التبديل علي المعدات زخرفه الصغرى بريمو ، مفتوحة مدير مايكرو وبرنامج ليوناردو. يتم تشغيل برنامج ليوناردو من خلال مدير الصغرى تحت الإضافات. تحقق من العلامات التجارية/كتالوج الأرقام من المعدات والبرمجيات في جدول المواد.
- في القائمة الاوليه من ليوناردو ، حدد معايره. تحقق من ان المكعب المخصص لفلتر بريمو في الموضع الصحيح (المسار البصري) في برج الفلتر. حدد الهدف 20X (0.75 DIC S خطه فلور ، لا حلقه المرحلة) علي حد سواء علي المجهر وعلي برنامج ليوناردو.
ملاحظه: يتم تعديل هذا البروتوكول إلى الإصدار 4.4 ليوناردو. قد يحتاج البروتوكول إلى تعديل للإصدارات الأخرى. - ضع المعايرة التي تم تمييزها مسبقا جيدا (الشكل 4ج) فوق الهدف. حدد مسار الكاميرا. ضبط التركيز الموضوعي حتى الإسقاط الليزر من كل من شعار بريمو وخط العلامة رعاية الخلايا الخاصة بك هي في التركيز.
- اترك وقت تعرض الكاميرا الافتراضي عند 25 مللي ثانيه. ضبط كثافة الليزر لرؤية الحرف I من الإسقاط شعار بريمو في اللون الرمادي وبقية الحروف في الأبيض.
- تسجيل Z-الموقف من المستوي البؤري ، (ارتفاع الهدف إلى العينة) في وقت لاحق يشار اليه باسم Z-موقف المعايرة. سيكون هذا تقريبا للتركيز الأمثل الذي تم الحصول عليه بعد توليد النمط المرجعي (انظر الخطوة 4.2-4.4).
- استخدم أداه تمييز الفلورسنت (جدول المواد) لوضع علامة علي الزجاج الداخلي الفارغ جيدا.
- النمط المرجعي
- وضع طبق الثقافة مع الصغرى--جيدا التي تحتوي علي الصورة البادئ (نمط المرجعية الصغرى--حسنا ، الشكل 4د) فوق الهدف وحدد نمط الآن في برنامج ليوناردو.
- تصور حافه البئر الصغير مع الضوء المرسل من خلال الكاميرا واختر رمز عائد الاستثمار من القائمة اليمني. تعيين قطر دائره العائد علي الاستثمار إلى 4000 μm ومحاذاة حافه عائد الاستثمار الرقمي مع حافه الحالية الصغرى-حسنا.
- تاكد من وجود تداخل دقيق بين عائد الاستثمار الرقمي والمستوي الحالي المتناهي الصغر من خلال تحريك المرحلة حول حواف البئر الصغير. سيقترن موقف العائد علي الاستثمار إلى حركات المرحلة.
- حدد قفل في برنامج ليوناردو لتامين عائد الاستثمار في الموضع المطلوب. إيقاف الضوء المرسل.
- حدد بريمو لتحميل قالب النقش المطلوب ، والذي سيتم إسقاطه علي عائد الاستثمار كوحدة تصميم (انظر الشكل 5). ستظهر النقوش في قائمه منسدلة يشار اليها بالإجراءات وتظهر في قائمه الإجراءات علي البرنامج.
ملاحظه: يجب تصميم قوالب النقش مسبقا (راجع الخطوة 1) وحفظها كملف Tiff 8 بت قبل تحميل القالب في البرنامج. - ولا يلزم سوي نمط صغير للنمط المرجعي ؛ علي سبيل المثال ، 3 أسطر ، عمود واحد (انظر الشكل 4هاء والشكل 5ب). في القائمة النسخ المتماثل تعيين العدد المطلوب من الاعمده والصفوف (خطوط في برنامج ليوناردو). انقر فوق تحديث لمراقبه معاينه رقميه لتصميم النقش.
- تعيين جرعه الليزر في القائمة النسخ المتماثل . جرعه الليزر الأمثل في هذا الاعداد واستخدام PLL-PEG هو 1390 mJ/mm2.
ملاحظه: يمكن ان تختلف قوه الليزر بين 5-7.5 ميغاواط/مم2. في هذه الحالة ، فمن 7.5 mW/mm2، والذي ياخذ حوالي 30 ثانيه إلى نمط كل وحده تصميم ، وذلك باستخدام جرعه ليزر من 1390 mJ/مم2. قد تكون هناك حاجه إلى جرعات الليزر العليا إذا كانت الثقافة سطح الطبق هو تخفف مع PEG-SVA (تقريبا جرعه الليزر مزدوجة مقارنه PLL-PEG). ويجب اختبار ذلك مسبقا. - انتقل إلى منطقه هامشيه من البئر الصغيرة ، (علي سبيل المثال ، الجزء العلوي) بعيدا عن المنطقة الرئيسية للاهتمام لتوليد نمط (المنطقة الوسطي) من البئر الصغرى (انظر الشكل 4E) وحدد قفل. انتظر حتى يتم عرض النقش.
- اضبط التركيز علي موضع المعايرة Z (انظر الخطوة 4.1.6).
ملاحظه: من المستحسن القيام بخطوه معايره نظام اضافيه إذا كان مستخدم آخر يستخدم نفس المجهر بين جولات فوتوباتيرنينج. - حدد رمز التشغيل لبدء زخرفه. تاكد من ان الليزر في البرنامج. انتظر حتى تنتهي عمليه زخرفه. سيتم عرض مده زخرفه في "لوحه الوقت المقدرة ". علي برنامج ليوناردو الإصدار 4.4 يتم إكمال زخرفه عندما تظهر كافة الإجراءات الزرقاء في القائمة المرئيات.
- حضانة البروتين علي النمط المرجعي
- تحت ظروف معقمه ، وغسل النمط المرجعي الصغرى جيدا ثلاث مرات مع 20 μL من تلفزيوني لأزاله PLPP.
- أضافه 20 μL من بروتين ECM المسمي فلوريسسينتلي (10 ميكروغرام/مل laminin ، فيبروكتين أو الفيبرينوجين في الاذاعه التلفزيونية ، انظر جدول المواد والخطوة 6) إلى النمط المرجعي الصغرى-حسنا. احتضان في درجه حرارة الغرفة ل 10-20 دقيقه (اعتمادا علي البروتين) المحمية من الضوء (التفاف الطبق في رقائق ألومنيوم).
- بعد الحضانة ، وأزاله 18 μL من محلول البروتين ويغسل ثلاث مرات مع 20 μL من تلفزيوني. الحفاظ علي الآبار الصغيرة التي لا تستخدم لإنشاء نمط مرجعي (انظر الشكل 4د ، ه) في 20 μl من تلفزيوني.
- التصور ووضع التركيز الليزر الأمثل
- تصور النمط المرجعي باستخدام المجهر الكتابي ، والبرنامج الموضوعي والمناسب 20X (تحقق من البرمجيات المستخدمة في هذه الدراسة في جدول المواد). وينبغي ان يكون النمط المرجعي ظاهرا في المنطقة الهامشية (مثل منطقه البئر العلوية) ، التي تم فيها إنشاء النمط المرجعي (انظر الشكل 4(ه)).
- اضبط التركيز علي حواف النقش من خلال مسار الكاميرا. تسجيل Z-الموقف وفقا لأفضل التركيز علي نمط المرجع. هذا المعدل Z-الموقف سيكون التركيز بالليزر الأمثل المستخدمة لزخرفه اللاحقة.
5-اعداد البرامج والفوتوباتيرنينج
ملاحظه: بمجرد الانتهاء من معايره النظام (الخطوة 4) ، سيقوم المستخدم بتحميل قوالب النقش المطلوبة (تكوين القالب ، الشكل 5) لفوتوباتيرنينج ، مع خيار لتوليد أنماط لبروتين واحد أو عده في كل الصغرى جيدا. وتنطوي عمليه الزخرفة الصغرى علي خطوات لفوتوباتيرنينج وحضانة البروتين (انظر الشكل 2).
- تحت ظروف معقمه ، وأزاله 18 μL من تلفزيوني من جميع الآبار الصغيرة وأضافه 5 μL من PLPP لكل الصغرى جيدا. التاكد من ان PLPP متجانسة علي كامل سطح الآبار الصغيرة.
- ضع الطبق الثقافي مع النمط المرجعي الصغير (الشكل 4د ، ه) فوق الهدف وحدد النمط الآن في برنامج ليوناردو.
- تصور البئر الصغير مع الضوء المنقول من خلال مسار الكاميرا واختر رمز عائد الاستثمار. تعيين قطر عائد الاستثمار إلى 4,000 μm وتتداخل حافه عائد الاستثمار الرقمي إلى حافه الحالية الصغرى جيدا. حدد تامين.
ملاحظه: يعتمد شكل وقطر عائد الاستثمار علي تصميم استنسل PDMS المستخدم وحجمه. علي سبيل المثال ، إذا كنت تستخدم 5,000 x 5,000 ميكرومتر PDMS التربيعية الاستنسل ، استخدم 5,000 x 5,000 μm التربيعية ROI. - كرر الخطوة المتراكبه (الخطوة 5.3) لكل بئر صغير من الطبق. عند الانتهاء ، قم بإيقاف تشغيل الضوء المرسل.
- انتقل إلى مركز النمط المرجعي الصغير ، بعيدا عن منطقه النمط المرجعي ، وحدد بريمو لتحميل قالب النقش المطلوب ، والذي سيتم إسقاطه علي عائد الاستثمار كوحدة تصميم (انظر الشكل 5). ستظهر النقوش في قائمه منسدلة يشار اليها بالإجراءات وتظهر في قائمه الإجراءات علي البرنامج.
ملاحظه: يجب تصميم قوالب النقش قبل التجربة وحفظها كملف Tiff 8 بت قبل تحميل القالب في البرنامج. - من أجل إنشاء نمط عبر كامل الجزئي-حسنا ، وحده التصميم يحتاج إلى تكرار. وتغطي وحده التصميم حوالي 0.1 مم2 من منطقه البئر الصغيرة. في قائمه النسخ المتماثل ، قم بتعيين العدد المطلوب من الاعمده والصفوف (الأسطر في البرنامج) (انظر الشكل 5).
- لإنشاء نمط مستمر ، اضبط التباعد بين الاعمده والأسطر. في هذه الدراسة ، يتم الحصول علي أنماط من المشارب المستمر باستخدام-20 إلى-35 μm تباعد (تباعد سالب) بين الاعمده. ويخلق هذا التباعد السالب تداخلا بين وحدات التصميم (الشكل 5ب ، ج).
- تعيين جرعه الليزر في القائمة النسخ المتماثل . جرعه الليزر الأمثل في هذا الاعداد واستخدام PLL-PEG هو 1390 mJ/mm2. سيتم عرض مده الزخرفة في "لوحه الوقت المقدرة ".
ملاحظه: في هذه الحالة قوه الليزر هو 7.5 mW/mm2، مع اتخاذ ما يقرب من 30 s إلى نمط كل وحده تصميم ، وذلك باستخدام جرعه من 1390 mJ/مم2. علي سبيل المثال ، وحده تصميم (0.1 mm2) المنسوخة في 4 أعمده و 4 خطوط (حوالي 1.6 مم2) ، سيستغرق 8 دقيقه لتكون منقوشة. قد تكون هناك حاجه إلى جرعات الليزر العليا إذا كانت الثقافة سطح الطبق هو تخفف مع PEG-SVA (تقريبا جرعه الليزر مزدوجة مقارنه PLL-PEG). - حدد تامين وانتظر حتى يتم عرض النقش فعليا.
- لتحديث معلمات النقش ، انقر علي الاجراءذي الصلة ، ثم افتح المعلمات وقم بتحديثها. حدد تامين مره أخرى عند اكتمال تحديث النقش.
- يتطلب الزخرفة من بروتينات متعددة في ال نفسه [ميكرو-وب] (متسلسلة [ميكرو-زخرفه] جولات) محاذاة دقيقه من الأنماط. لتحقيق هذه المحاذاة ، وتحميل جميع مجموعات من قوالب النمط المطلوب في وقت واحد (أنماط من جولات فوتوباتيرنينج الاولي والثانية).
- قم بتعيين معلمات النسخ المتماثل والجرعة لقوالب النقش. بعد تعيين المعلمات ، ستظهر النقوش كاجراءات في قائمه الإجراءات . احفظ تكوين القالب هذا كملف في البرنامج (انظر الشكل 5D).
- في قائمه الإجراءات ، حدد فقط الإجراءات المحددة التي سيتم نقشها اثناء جولة الزخرفة الاولي والغ تحديد الإجراءات التي سيتم نقشها اثناء الجولة الزخرفته الثانية (انظر الشكل 5D).
- انتقل إلى المنطقة التي تم فيها إنتاج النمط المرجعي في الخطوة 4.2 (علي سبيل المثال ، المنطقة العلوية للنمط المرجعي الصغير ، انظر الشكل 4ه). اضبط التركيز علي الموضع Z الأمثل (تم الحصول عليه في الخطوة 4.4).
ملاحظه: ينصح بشده لتحديد نظام التركيز المثالي علي المجهر المستخدمة (إذا كانت متوفرة) ، والتي تضمن ان الأمثل Z-الموقف لزخرفه سيتم الحفاظ عليها طوال عمليه فوتوباتيرنينج كامل. - حدد رمز التشغيل لبدء زخرفه. سيتم عرض مده زخرفه في "لوحه الوقت المقدرة ". علي برنامج ليوناردو الإصدار 4.4 يتم إكمال زخرفه عندما تظهر كافة الإجراءات الزرقاء في القائمة المرئيات .
6. حضانة البروتين
ملاحظه: يتم احتضان الآبار الصغرى مع البروتينات ECM (ويفضل فلوريسسينتلي المسمي). هذه سوف ربط فقط إلى المناطق التي تم المشقوق PEG من خلال عمليه فوتوباتيرنينج الموصوفة في الخطوة 5. كل بئر يحتوي علي الاستنسل PDMS مع 4 الآبار الصغيرة ، والتي سوف تسمح اختبار 4 ظروف مختلفه في وقت واحد ، علي سبيل المثال ، الحضانة من البروتين مختلفه في كل الصغرى جيدا (انظر الشكل 4د).
- استخدم البروتينات المسمية فلوريسسينتلي (علي سبيل المثال ، laminin ، الفيبروكتين أو الفيبرينوجين مترافقة مع الفلوبيدوريس الأحمر أو الأخضر) من أجل تصور الأنماط الصغرى (انظر الخطوة 6.7 و 9.4). وبدلا من ذلك ، يمكن تصور البروتينات غير المسمية الممتصة في مراحل لاحقه باستخدام المناعي.
ملاحظه: يمكن تسميه البروتينات ECM (علي سبيل المثال ، fibronectin) باستخدام البروتوكولات الموجودة33 والمتاحة تجاريا مجموعات الوسم الفلورية (اي ، اليكسا 488 وضع العلامات) ، أو شراؤها بسهوله المسمي (علي سبيل المثال ، مترافق فيبرينوجين-488 أو laminin-احمر روناميني فلوري ، انظر جدول المواد). - في ظل ظروف معقمه ، واعداد التركيز المطلوب من البروتينات ECM (10 ميكروغرام/مل laminin ، فيبروكتين أو الفيبرينوجين في التلفزيونية العامة ، انظر جدول المواد والخطوة 4.3).
ملاحظه: بروتينات ECM المسمية فلوريسسينتلي حساسة للضوء ويجب حمايتها من الضوء (طبق لف في رقائق ألومنيوم) وينبغي الاحتفاظ بها علي الجليد في جميع الأوقات. - في ظل ظروف معقمه ، وغسل الآبار الصغرى ثلاث مرات مع 20 μL من تلفزيوني لأزاله PLPP.
- أزاله 18 μL من تلفزيوني من جميع الآبار الصغيرة وأضافه 20 μL من محلول بروتين ECM لكل الصغرى جيدا. احتضان في درجه حرارة الغرفة ، لمده 20-30 دقيقه وحماية من الضوء.
ملاحظه: قد تختلف أوقات الحضانة الطلاء الأمثل تبعا لنوع وتركيز البروتينات. - بعد الحضانة ، وأزاله 15 μL من محلول البروتين ECM وغسل الآبار الصغيرة ثلاث مرات مع 20 μL من تلفزيوني.
ملاحظه: ترك دائما تقريبا 5 μL من التلفزيونية في بين يغسل. - إذا زخرفه مع بروتين واحد فقط (جولة واحده من الزخرفة الدقيقة) ، انتقل اما إلى تخزين طبق الثقافة (الخطوة 10) أو إلى الطلاء الخلوي (الخطوة 11 ، وانظر الشكل 2). إذا كان أداء الجولة الثانية من الزخرفة الدقيقة مع بروتين مختلف في نفس الدقيقة ، والمضي قدما اما إلى تخزين طبق الثقافة (الخطوة 10) أو لحجب مواقع ملزمه غير محدده (الخطوة 7 ، وانظر الشكل 2).
- اختياري خطوه مراقبه الجودة: تصور وصوره أنماط المطبوعة باستخدام المجهر الكتابي قبل الطلاء الخلايا. حدد القناات الفلورية المناسبة واضبط أوقات التعرض وفقا لذلك.
ملاحظه: لمقارنه كثافة الفلورية من النقوش بين التجارب ، فمن الضروري استخدام نفس أوقات التعرض للبروتينات نفسها.
7. حجب مواقع ملزمه غير محدده (فقط لأنماط البروتين متعددة)
ملاحظه: تتضمن الزخرفة الصغرى مع العديد من البروتينات في نفس البئر الصغرى خطوات زخرفه متسلسلة (انظر الشكل 2). ويضاف عامل الحجب (PLL-PEG أو الجيش الصربي البوسني) إلى الآبار الصغرى لمنع الربط التبادلي ، الذي يحدث عندما يربط البروتين المحتضن الثاني (الخطوة 9) بأول بروتين محتضن (الخطوة 6) ، التالي تجنب خليط من البروتينات داخل الأنماط.
- تحت ظروف معقمه ، أضافه 20 μL من PLL-PEG (0.1 ملغ/مل في الاذاعه التلفزيونية) أو جيش صرب الجمهورية (1 ٪ بوسنيا في الاذاعه التلفزيونية) كخطوه عرقله لمنع الربط التبادلي.
ملاحظه: قد تختلف فعاليه الحجب تبعا لطبيعة البروتينات المستخدمة والتقارب بينها. فمن المستحسن لاختبار كل PLL-PEG وجيش الصرب البوسني كوكلاء حظر مسبقا (الشكل 10D-I). - احتضان وكيل حجب في درجه حرارة الغرفة لمده 1 ساعة وحماية من الضوء. أزاله 15 μL من عامل الحجب وغسل جميع الآبار الصغيرة ثلاث مرات مع 20 μL من تلفزيوني. دائما ترك تقريبا 5 μL من التلفزيونية في بين يغسل.
- أزاله 18 μL من تلفزيوني من جميع الآبار الصغيرة وأضافه 5 μL من PLPP لكل الصغرى حسنا ، وضمان ان PLPP متجانسة علي السطح كله من الآبار الصغيرة.
8. الجولة الثانية من فوتوباتيرنينج (فقط لأنماط البروتين متعددة)
ملاحظه: بعد الجولة الاولي من فوتوباتيرنينج والبروتين الحاضنة ، يتم إنشاء نمط الصغرى. وخلال الجولة الثانية من فوتوباتيرنينج ، سيتم توليد نمط البروتين الثاني في نفس البئر الصغيرة (انظر الشكل 2جيم والشكل 5د). في البرنامج ، حدد قوالب النقش الصحيحة (الإجراءات) ، والتي سيتم نقشها خلال هذه الجولة (انظر الشكل 5د).
- انتقل إلى البئر الصغرى الاولي (الشكل 4د). ضمان التداخل المناسب بين عائد الاستثمار الرقمي والبئر الصغير.
- قم بتحميل تكوين القالب الذي تم حفظه مسبقا (الخطوة 5.12) وحدد الإجراءات التي سيتم نقشها اثناء الجولة الثانية فوتوباتيرنينج (الغ تحديد الإجراءات من الجولة الاولي ، انظر الشكل 5D).
- حدد رمز التشغيل لبدء زخرفه. تاكد من ان الليزر في البرنامج.
9. الجولة الثانية من البروتين الحاضنة (فقط لأنماط البروتين متعددة)
ملاحظه: في هذا الجزء من البروتوكول ، سيتم احتضان البروتين المسمي فلوريسسينتلي/s علي طبق الثقافة بعد الجولة الثانية من الفوتوباتيرنينج.
- تحت ظروف معقمه ، وغسل الصغرى جيدا ثلاث مرات مع 20 μL من تلفزيوني لأزاله PLPP. أزاله 18 μL من تلفزيوني وأضافه 20 μL من محلول بروتين ECM لكل الصغرى جيدا. احتضان في درجه حرارة الغرفة لمده 20-30 دقيقه وحماية من الضوء.
ملاحظه: قد تختلف أوقات الحضانة الطلاء الأمثل تبعا لنوع وتركيز البروتينات. - بعد الحضانة ، وأزاله 15 μL من محلول البروتين ECM وغسل الآبار الصغيرة ثلاث مرات مع 20 μL من تلفزيوني. دائما ترك تقريبا 5 μL من التلفزيونية في بين يغسل.
- اما المضي قدما إلى تخزين طبق الثقافة (الخطوة 10) أو لطلاء الخلية (الخطوة 11 ، وانظر الشكل 2).
- اختياري خطوه مراقبه الجودة: باستخدام المجهر الكتابي ، تصور وصوره أنماط المطبوعة قبل الطلاء الخلايا. حدد القناات الفلورية المناسبة واضبط وقت التعريض.
ملاحظه: لمقارنه كثافة الفلورية من النقوش بين التجارب ، فمن الضروري استخدام نفس أوقات التعرض للبروتينات نفسها.
10-تخزين الأنماط الدقيقة
ملاحظه: يمكن تخزين الأنماط الدقيقة مع البروتينات الممتصة خلال خطوات مختلفه من البروتوكول (انظر الشكل 2). وإذا كانت الزخرفة الصغرى ذات البروتينات المتعددة ، يمكن تخزين الأنماط الصغرى بعد الجولة الاولي من الزخرفة الصغرى أو بعد الانتهاء من جولتين متسلسلتين من الزخرفة الصغرى (انظر الشكل 2ب).
- عندما تخفته مع PLL-PEG ، تخزين الصغيرة-أنماط في التلفزيونية الخاصة (3 مل لكل بئر) في 4 درجه مئوية لمده تصل إلى 3 أيام.
- إذا كان الطبق الثقافة تخفته مع PEG-SVA ، يمكن تخزين أنماط الصغرى لمده تصل إلى 1 شهر. من أجل القيام بذلك ، شطف النماذج الصغيرة بشكل مكثف مع الماء المقطر مزدوجة منزوعة الأيونات وجافه مع بندقية الهواء المعقمة من الارجون أو النيتروجين ، علي الرغم من ان الهواء العادي يمكن أيضا ان تستخدم. بعد التجفيف ، يمكن تخزين الأنماط الدقيقة في 4 درجات مئوية لمده تصل إلى شهر واحد (فريق دعم نظام بريمو ، والاتصالات الشخصية).
11. طلاء الخلايا
ملاحظه: خلال الخطوات التالية ، سيتم طلاء الخلايا علي الطبق الثقافي الصغير المعد بنقوش صغيره. في هذه الدراسات ، يتم استخدام خط الخلايا العصبية (خلايا CAD)31. ومع ذلك يمكن تعديل هذا البروتوكول لدراسة أنواع الخلايا الأخرى من الفائدة (ضبط بروتوكول الطلاء الخلية علي النحو المطلوب).
- التفريق بين الخلايا CAD ل 48 h باستخدام التمايز المتوسطة (DMEM تستكمل مع 1 ٪ الجلوتامين ، دون المصل ، ومع 1 ٪ القلم/بكتيريا ، انظر جدول المواد).
- لوحه 1 مل من المتوسطة مع الخلايا في الزجاج الداخلي جيدا ، وتغطي جميع الآبار الصغيرة ووضع طبق الثقافة في 37 درجه مئوية ، 5 ٪ CO2 حاضنه.
النتائج
يتبع البروتوكول أعلاه النتائج في السطوح الصغيرة منقوشة ، والمغلفة مع ECM البروتين/ق من الفائدة. نحن نستخدم هذه الأنماط لتتبع النتائج المرضية العصبية.
يجب ان تكون الأنماط التي تم إنشاؤها تمثيلا دقيقا للقالب. ويظهر مثال في الشكل 6 حيث قالب النمط الرقمي (الشكل 6ا) الذي يمثل وحده تصميم واحده (الشكل 5ب) ، ادي إلى أنماط دقيقه محدده ، تتراوح بين 20 إلى 2 ميكرومتر ، مغلفه بالملصق الفيبرينوجين (الشكل 6ب). باستخدام imagej ، تم الحصول علي قياسات كثافة الفلورية عموديا (الشكل 6ج) وأفقيا (الشكل 6E) علي طول الشريط ومن المنطقة الخلفية المقابلة 15 ميكرومتر فوق كل شريط. تم طرح قياسات الخلفية من قياسات النقش لكل عرض شريطي.
أحد القيود علي النظام هو انه يمكن ملاحظه تاثير الحافة (الشكل 6ب، الشريط العلوي) عند ميزات الطباعة ≥ 20 μm ، مع اشاره كثافة اعلي في حواف نمط مقارنه مع المركز (الشكل 6د، الذروة الاولي من كثافة الفلورسنت الشخصي). في تجاربنا كان الحد القرار تقريبا 2 μm; في هذا العرض لاحظنا انخفاضا كبيرا (بنسبه 50 ٪ تقريبا) في كثافة الفيبرينوجين مضان بالمقارنة مع كثافة المشارب أوسع (الشكل 6F ، G). وقد أنتجت زخرفه باستخدام نظام بريمو والبروتوكول المبين هنا أنماطا قابله للتكرار ، مع الانحراف المعياري الأعلى لمتوسط كثافة الفلورسنت مقيسا بعرض 2 ميكرومتر من أربع وحدات تصميم متماثلة فرديه (الشكل 6 ز). ووجد أيضا ان التباين داخل المشارب منقوشة منخفضه; وتراوح معامل التباين بين 3 و 10 في المائة ، مع وجود أكبر تباين داخلي بين الخطوط التي تبلغ 20 ميكرومتر و 2 μm. ومن المرجح ان يكون ذلك نتيجة لتاثير الحافة والحد الأقصى لدقه النظام ، علي التوالي. لاحظ انه بالنسبة لهذه القياسات نقيس فقط كثافة في وسط المشارب ، لتجنب الاضاءه غير المتساوية الناتجة عن الهدف المستخدم للحصول علي هذه الصور (التظليل ، الشكل 6ه).
قد تنطوي بعض التجارب علي اسئله تتطلب تركيزات بروتين محدده ، والتي يمكن تحقيقها بطريقتين: 1) متفاوتة تركيز البروتين (الشكل 7ا ، ب). الحضانة مع تركيزات مختلفه من laminin ، والنتائج في كثافة فلوري مختلفه إلى حد كبير ، مع زيادة تركيزات البروتين اعلي (الشكل 7ب). 2) الجرعة بالليزر التي يتم استخدامها ليلتصق الفيلم المضادة للاصقه (PEG) يمكن ان تكون متنوعة. سوف جرعات الليزر العليا أزاله الفيلم انتيشف إلى حد أكبر ، وتوليد المزيد من مواقع ملزمه للبروتينات من الفائدة (الشكل 7ج ، د) مما ادي إلى كثافة مختلفه بشكل كبير فلوري ، وزيادة مع ارتفاع الليزر جرعات (الشكل 7د).
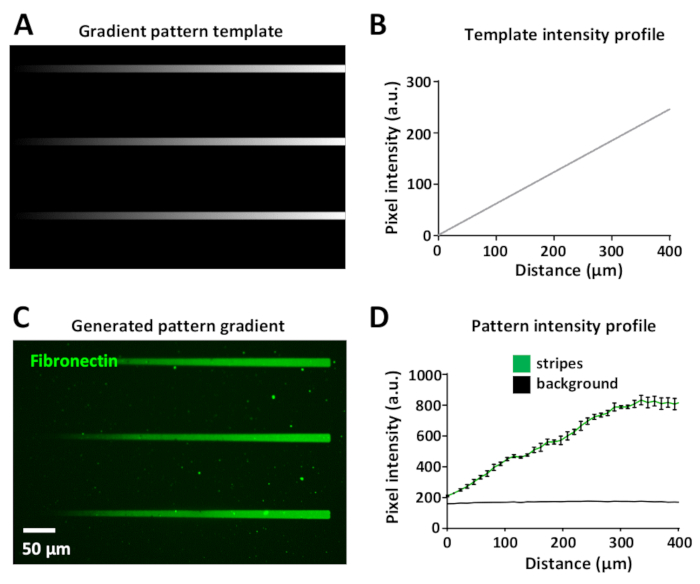
تختلف جرعه الليزر يسمح لتوليد التدرجات البروتين في نفس النمط. يتم عرض هذا في الشكل 8ا، حيث تم تصميم قالب تدرج باستخدام مستويات رمادية مختلفه ، من الأسود (لا توجد طاقة الليزر) إلى الأبيض (الحد الأقصى لطاقة الليزر).
كثافة الليزر يتناسب مع مستوي الرمادي من القالب (تتراوح بين 0 إلى 255 في صوره 8 بت) ، وتوليد التدرجات من الاضاءه فوق البنفسجية. قياس الكثافة الفلورية علي طول شريط التدرج هو خطي في قالب النقش (الشكل 8ب) وفي نمط التدرج المتولد (الشكل 8ج ، د). هذا هو استنساخ بين جميع المشارب التدرج داخل نفس القالب ونمط التدرج (الشكل 8ب ، د). جيل من هذه التدرجات مفيد للغاية ويساعد علي تقليد في بيئات فيفو حيث الخلايا غالبا ما تستجيب لتدرجات البروتينات النشطة بيولوجيا34،35،36،37.
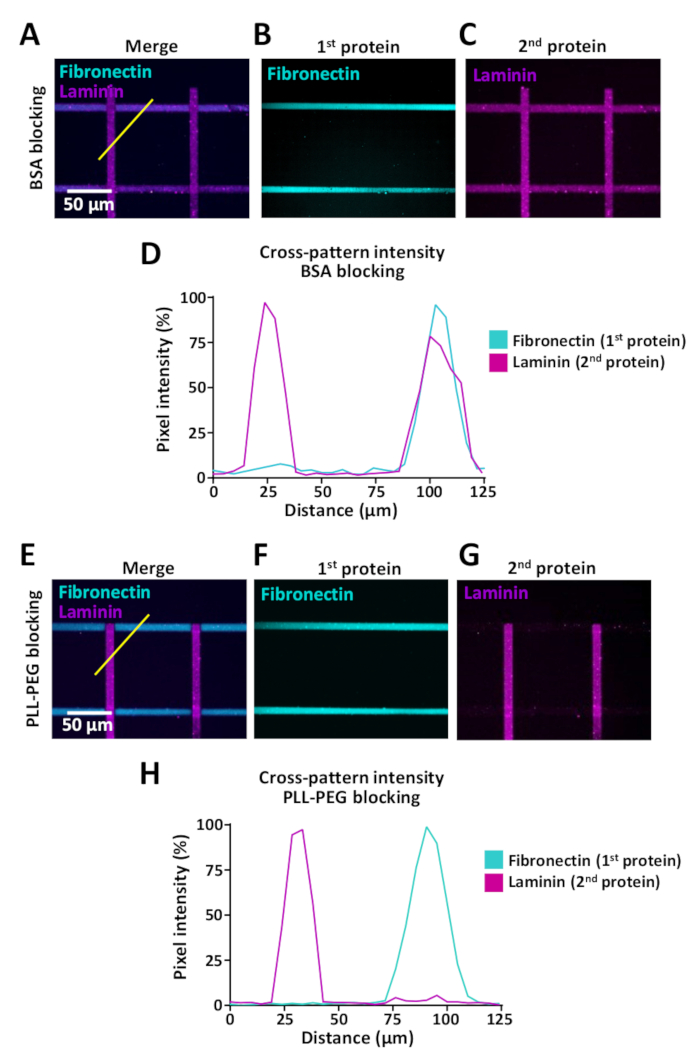
استشعار الخلايا تغيير البيئات خارج الخلية ولكن المقايسات التي تمكن دراسة سلوك الخلية عندما تواجه الخلايا مثل هذه التغييرات محدوده. LIMAP يمكن استخدامها لنمط الصغرى مع البروتينات المتعددة في نفس الصغرى-حسنا. وتظهر الامثله في الشكل 9 حيث تم إنشاء أنماط متقاطعة مع شرائط من الفيبرونكتين (أفقي) و laminin (عمودي). عند إنشاء أنماط مع بروتينات متعددة ، فمن المهم لاستخدام خطوه حجب بين حضانة البروتين الأول والثاني ، لمنع الربط بين البروتينات (انظر الخطوة 7). قد تختلف كفاءه حجب اعتمادا علي الخصائص البيوكيميائية للبروتينات التي تستخدم للطلاء ونحن ننصح اختبار المخازن المؤقتة حجب عده بما في ذلك PLL-PEG (0.1 ملغ/مل) وجيش صرب الجمهورية (1 ٪). لتقييم هذا التاثير عبر ملزمه ، قمنا باجراء قياسات كثافة مضان باستخدام imagej (الشكل 9) وأظهرنا ان الربط عبر يمكن تخفيضها بشكل كبير ، وذلك باستخدام pll-PEG العازلة (0.1 ملغ/مل) ل الفيبرونكتين جنيني و laminin الأنماط المتقاطعة (الشكل 9دال ، حاء).
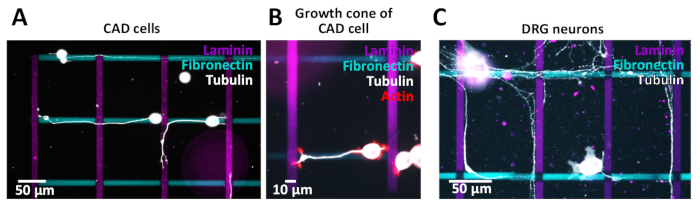
وقد استخدمت الأنماط المتقاطعة المتولدة لاختبارات خلوية مع خلايا CAD (الشكل 10ا ، ب) أو الفئران العصبية العقديه (Drg) (الشكل 10ج). هم [نيويتس] ([كد]) و [اكسنس] ([درغ]) ينمو علي طول خطوط مختلفه. وتستخدم الخلايا CAD كنموذج للخلايا العصبية لأنها تظهر التكامل مماثله التعبير الشخصي مقارنه بالخلايا العصبية الاوليه وانها لا تزال عرض الأقماع النمو الغنية actin بعد 48 h في الثقافة (الشكل 10B) ، مما يجعلها مناسبه لتقصي المسارات الدراسات.
من أجل التحقيق في الآثار السامة للخلايا المحتملة للأنماط الصغيرة المتولدة نحو الخلايا العصبية الاوليه ، تم عزل الخلايا العصبية DRG ومثقف علي الأنماط الصغرى بعد بروتوكول نشرت سابقا38. وتبين النتائج ان الخلايا العصبية الاوليه تتسامح مع بيئة الأنماط الصغرى (الشكل 10ج). ونحن ندرس حاليا كيف ان مجموعه متنوعة من البروتينات ECM تؤثر علي النتائج المرضية (نيوريت). سيتم مزيد من التحقيق في الادله الاوليه من المفاهيم الموجودة في خلايا CAD باستخدام الخلية العصبية DRG. من أجل التحقق من جوده الأنماط الصغيرة التي تم إنشاؤها ، فمن المستحسن ان أنماط الصورة عن طريق المجهر مضان لضمان تحديد حواف النمط جيدا قبل الانتقال إلى طلاء الخلايا. خلال عمليه التصوير ، من المهم لضمان التكيف البصري بين المجهر والكاميرا لتجنب تاثير سواد الطرفية (التظليل) الذي يؤثر علي التحليل الخلفي وتفسير البيانات. بالاضافه إلى ذلك ، يمكنك الحصول علي صوره لمنطقه خاليه من النقوش باستخدام نفس أوقات التعرض التي سيتم استخدامها لتصوير النقوش وطرح هذه الصورة من صوره النقش.
وباختصار ، لنوعيه جيده الصغرى نمط الجيل ، فانه من المستحسن لتقييم تركيز البروتين (الشكل 7ا ، ب) ، جرعات الليزر (الشكل 7ج ، د) ، مستويات البروتين الخلفية (الشكل 6E ، F ، H) خطوه منع فعاله (الشكل 9) عند استخدام بروتينات متعددة. وبشكل حاسم ، فان نوعيه الأنماط الدقيقة المتولدة مع LIMAP ضرورية من أجل الحصول علي بيانات موثوقه وقابله للتكرار من الاختبارات الخلوية.

الشكل 1: مخطط تقنيات الزخرفة الصغرى: الطباعة بالاتصال المجهري والزخرفة بمساعده الليزر. (ا) تستخدم الطباعة بالاتصال المجهري ربانا حجريا مع سمات دقيقه محدده لتوليد ختم pdms الذي يتم احتضانه ببروتين الفائدة. ثم يتم نقل هذا البروتين (مختومه) علي سطح الزجاج ، وتوليد البروتين الصغيرة الأنماط. (ب) وتشمل تقنيات الزخرفة بمساعده الليزر زخرفه فوتوباتيرنينج والليزر المباشر. (ج) معظم النهج فوتوباتيرنينج استخدام مصدر ضوء الاشعه فوق البنفسجية و ضوئي (اما في اتصال مع سطح الركيزة أو في المستوي البؤري للهدف) مع الهندسي المرغوب فيه من أجل يلتصق سطح المضادة للحشف في مواضع محدده ، إنشاء نمط محدد. خطوه حضانة البروتين اللاحقة نتائج في الامتزاز البروتين فقط إلى المناطق المشقوقة بالليزر. (د) limap هو تقنيه الفوتوباتيرنينج التي لا تتطلب ضوئي في اتصال مع الركيزة (اي النهج غير المرتبط وتماس). LIMAP يستخدم البادئ الصورة ، التي يتم تنشيطها بجرعات منخفضه من الليزر ، المرابط المناطق المعرضة للضوء من PEG. يؤدي هذا إلى إنشاء مواقع المرفقات لامتصاص البروتين المتسلسل. (ه) زخرفه الليزر المباشر يستخدم ضوء الطاقة العالية لحفر مباشره الفيلم PEG ، مما يسمح البروتين ملزمه في تلك المناطق محفورا. يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.
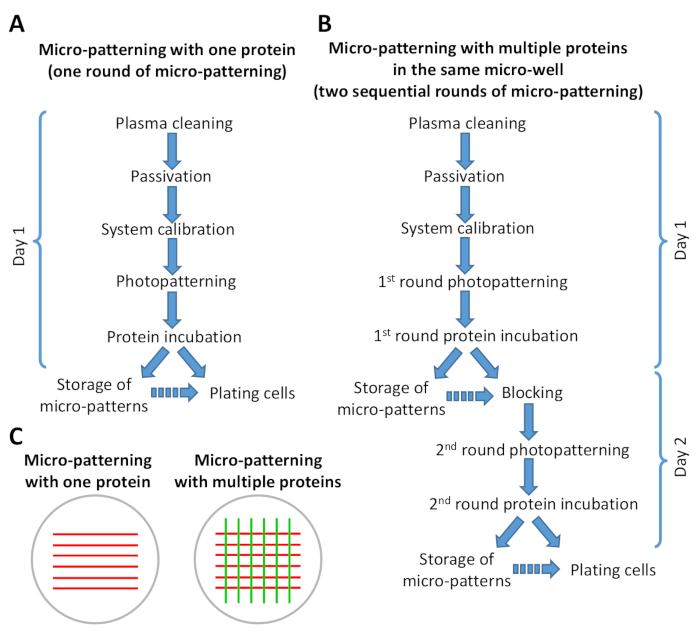
الشكل 2: مخطط يبين ملخصا للخطوات في بروتوكول الزخرفة الصغرى. (ا) الزخرفة المتناهية الصغر مع بروتين واحد لا ينطوي الا علي جولة واحده من الزخرفة الصغرى (الفوتوباتيرنينج وحضانة البروتين) ويمكن ان يؤديها في اقل من 8 ح. (ب) الزخرفة الصغرى مع البروتينات المتعددة يتطلب جولتين متتابعتين من زخرفه الصغرى ويمكن ان تكتمل في 1-2 أيام ، اعتمادا علي عدد من الأنماط الدقيقة التي يجري اعدادها. فمن الممكن ان تذهب من خلال النسخة B من البروتوكول في يوم واحد من العمل. تشير الأسهم المستمرة إلى التدفق المباشر للخطوات في البروتوكول. تشير الأسهم المتقطعة إلى وجود فجوه زمنيه كبيره بين خطوه واحده والأخرى (انظر الخطوة 6.6 و 9.3). (ج) عرض تخطيطي للأنماط التي تم الحصول عليها بعد جولة واحده من الزخرفة الصغرى (خطوط حمراء) أو جولتين متسلسلتين من الزخرفة الصغرى (خطوط حمراء وخضراء). يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.

الشكل 3: جيل قالب النقش متعدد الاستخدامات مع LIMAP. (الف ، باء) أمثله من قوالب النقش المصممة مع ImageJ (A الأقواس ، حروف B). وكانت الاشكال المرسومة باللون الأبيض متوقعه عند الحد الأقصى لقوه الليزر ولم يتم إسقاط الاشكال المرسومة باللون الأسود. (جيم ، دال) النماذج الدقيقة التي تم الحصول عليها مع LIMAP من القوالب بعد الاحتضان مع 10 ميكروغرام/مل فيبرينوجين (الأخضر). (C) الأقواس هي عرض 50 μm و 50 μm ارتفاع متباعدة بواسطة 75 μm أفقيا و 50 μm عموديا. (د) الرسائل هي 80 μm العرض و 85 μm الارتفاع. القضبان مقياس في C و D يمثل 50 μm. الرجاء النقر هنا لعرض نسخه أكبر من هذا الرقم.

الشكل 4: المواد الاساسيه لبروتوكول LIMAP. (ا) الاستنسل المستخدمة في هذا البروتوكول هي قطرها 20 ملم ، ورقيقه دائريه الشكل قطع pdms (250 μm سمك) التي تحتوي علي 4 الآبار الصغيرة (4 ملم قطر كل منهما). وتتراوح الكميات المستخدمة في الآبار الصغرى من 5 إلى 20 μL ، مما يقلل إلى حد كبير من كميه الكواشف والبروتينات اللازمة لكل تجربه. (ب) 6 طبق الزجاج السفلي جيدا حيث تم وضع الاستنسل بالفعل في كل بئر. تحتوي الآبار الصغيرة علي 20 μL من التلفزيوني لجعلها مرئية. (ج) طبق معايره الذي تم وضع علامة الزجاج الداخلي جيدا مع قلم تمييز الأخضر ، والتي سيتم استخدامها لمعايره التركيز بالليزر. (د) العرض التخطيطي لاعلي اليسار جيدا من الطبق السفلي 6-بئر الزجاج في B (المبينة مع دائره حمراء متقطعه). يتم تمثيل البئر أسفل الزجاج الداخلي باللون الأبيض ويظهر الاستنسل باللون الرمادي. يحتوي الاستنسل علي 4 ابار صغيره (مرقمه 1-4) ، لاختبار 4 ظروف تجريبية مختلفه (علي سبيل المثال ، تركيزات البروتين المختلفة ، ونمط هندسي ، وتركيبات من البروتينات ، وما إلى ذلك). تمثل العلامة النجميه الصغيرة التي تحتوي علي النمط المرجعي. (ه) العرض التخطيطي للصغر-البئر حيث تم إنشاء نمط مرجعي في الجزء العلوي (سهم براس أسهم ممتلئ). هذا النمط المرجعي مطلوب للحصول علي التركيز الأمثل بالليزر لزخرفه (انظر الخطوة 4). السهم مع راس السهم فارغ يشير إلى المنطقة الوسطي من البئر الصغيرة ، والتي سيتم استخدامها لزخرفه اللاحقة بعد معايره النظام. يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.
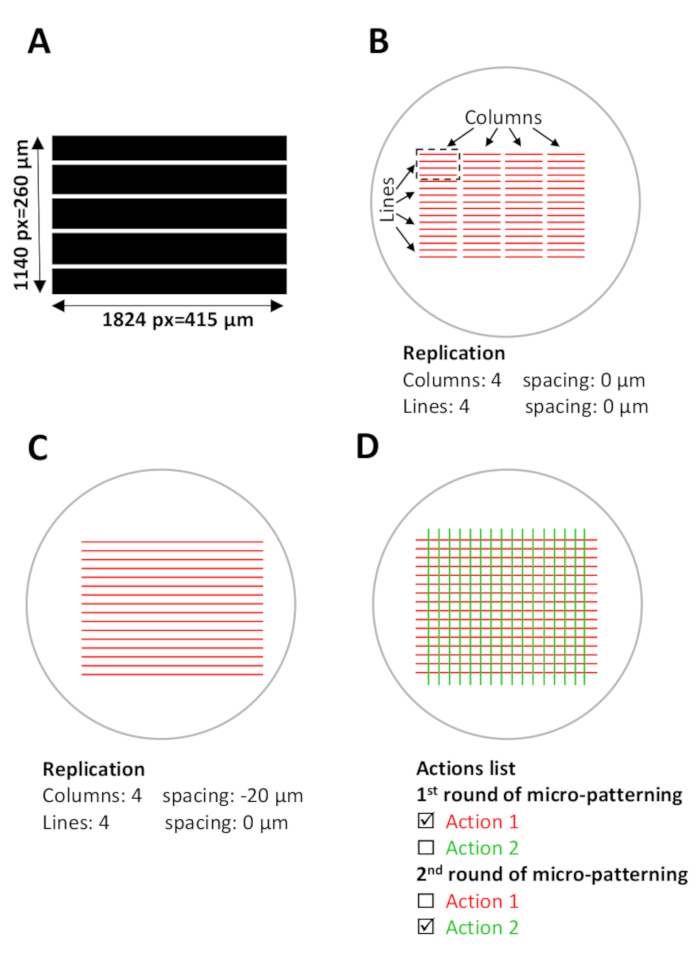
الشكل 5: اعداد البرمجيات لزخرفه الصغرى. (A) قالب نمط مع خطوط متوازية مصممه مع imagej وحفظها كملف Tiff 8 بت. (ب-د) عرض تخطيطي للرواط الرقمية (مناطق الاهتمام) التي ستتداخل مع الآبار الصغرى الحالية حيث ستتولد الأنماط الصغرى. (ب) قالب النقش الذي سيستخدم (الطول 1824 بكسل = 415 μm ، العرض 1140 بكسل = 260 μm) يتم اختياره علي ليوناردو ويتم إسقاطه علي عائد الاستثمار كوحدة تصميم (خطوط حمراء في المستطيل المتقطع الأسود) ، والتي ستغطي حوالي 0.1 مم2 من منطقه صغيره البئر. يتم نسخ وحده التصميم في 4 أعمده و 4 أسطر في القائمة النسخ المتماثل (تكوين قالب) ، إنشاء نقش عبر الصغيرة جيدا. لاحظ المسافة بين الاعمده. (ج) لنمط الخطوط المستمرة ، يجب تعديل التباعد بين الاعمده. في هذه الحالة ، لتحقيق تداخل بين وحدات التصميم يتم تعيين التباعد بين الاعمده في قائمه النسخ المتماثل كتباعد سالب،-20 μm. (د) من أجل نمط البروتينات المتعددة في نفس الدقيقة-حسنا ، والمحاذاة الدقيقة للأنماط هو مطلوب. اثناء خطوه اعداد البرنامج (الخطوة 5) ، قم بتحميل جميع قوالب النقش المطلوبة في نفس الوقت. في قائمه الإجراءات ، حدد فقط الإجراءات المحددة التي سيتم نقشها اثناء كل جولة زخرفه والغ تحديد باقي الإجراءات (الخطوة 5.12 ، 5.13 و 8.2). يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.
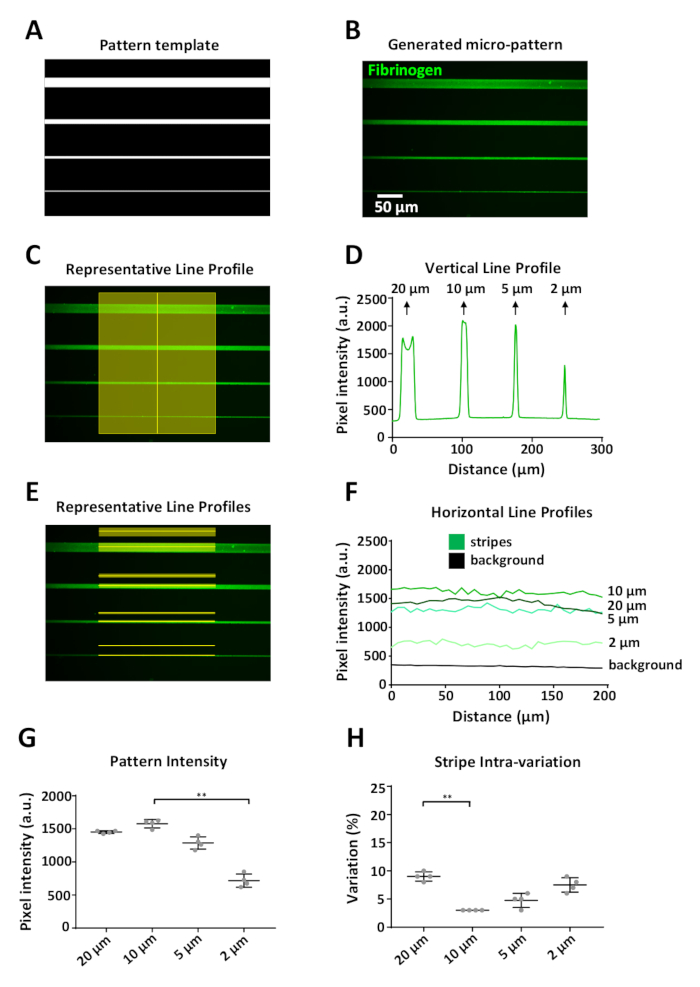
الشكل 6: تحليل تغير النمط باستخدام LIMAP. (ا) قالب نمط مصممه مع imagej تستخدم لنمط الصغرى أربعه خطوط من عرض متفاوتة (20 ، 10 ، 5 ، 2 μm ، من الأعلى إلى الأسفل). (ب) النمط الصغير الذي تم الحصول عليه بعد الاحتضان باستخدام 10 ميكروغرام/مل من الفيبرينوجين المسمي فلوريسسينتلي (الأخضر). (ج) قياسات الكثافة علي طول خط عمودي يعبر خطوط النمط الجزئي. (د) الصورة الراسية لكثافة الفلورية التي يتم الحصول عليها من القياس في (ج). لاحظ انه في عرض أكبر (20 μm) هناك اختلاف في التشكيل الجانبي الراسي الناجم عن تراكم البروتين علي حواف الشريط ، مما ادي إلى اثنين من القمم كثافة الفلورية متميزة (تاثير الحافة). وينظر فقط هذا التاثير في عرض شريطيه ≥ 20 μm. (ه) قياسات الكثافة علي طول الخطوط الافقيه المبينة (الفلورية والخلفية). (و) الملامح الافقيه لكثافة المضان التي يتم الحصول عليها من القياسات في (ه). (ز) رسم بياني يبين الكثافة المتوسطة لكل عرض شريطي ، مقيسا من أربع وحدات تصميم منسوخه نسخا متماثلا (التباين بين الأنماط). لاحظ انخفاض الامتزاز البروتين إلى أنماط من عرض شريطي 2 μm. (ح) كان التباين داخل الخطوط المنقوشة (معامل التباين) منخفضا بالنسبة لجميع العروض الشريطية ، التي تراوحت بين 3 و 10 في المائة. البيانات في G و H كما هو مبين يعني ± SD. تم اجراء التحليل الإحصائي في G و H باستخدام الاختبار غير الحدودي في اتجاه واحد (كروكال واليس) مع مقارنات متعددة. قيمه P هي < 0.001 ل * * اهميه. يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.
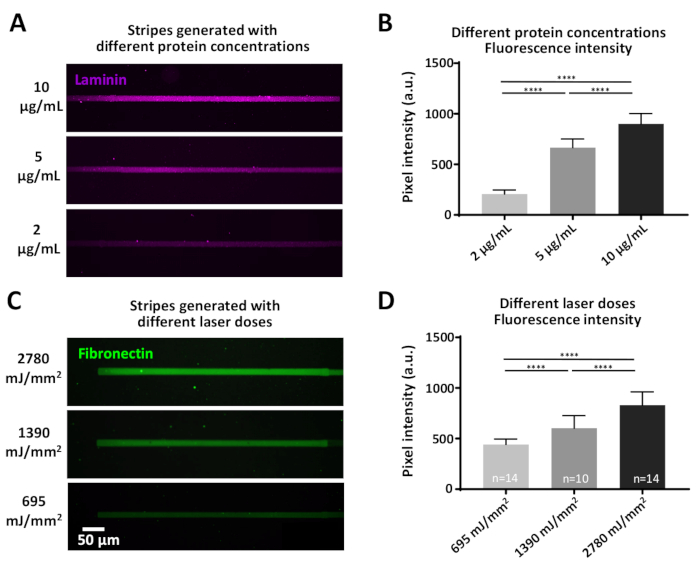
الشكل 7: تاثير الاختلافات في قوه الليزر وتركيز البروتين لكفاءة امتصاص البروتين. (ا) كان سطح PLL-PEG الليزر-المشقوق مع جرعه ليزر ثابته (1390 مللي جول/مم2) وحضن مع تركيزات المشار اليها من laminin (أرجواني). (ب) القياس الكمي لكثافة الفلورية لخطوط الlaminin في (ا). (ج) تم تطبيق جرعات الليزر المختلفة المشار اليها متبوعه بالاحتضان بنفس التركيز (10 ميكروغرام/مل) من الفيبرونكتين فلوريسسينتلي (الأخضر). (د) القياس الكمي لكثافة الفلورية لخطوط الفيبرونكتين في (ج) تبين ان جرعات الليزر العالية ترتبط بمستويات اعلي من البروتين الممتدي. جميع القياسات هي الخلفية طرح. يتم الاشاره إلى أرقام العينات في الجزء السفلي من الاعمده; يتم عرض البيانات كما يعني ± SEM. واجري التحليل الإحصائي باستخدام اختبار غير بارامتريه مان-ويتني مع حساب ثنائي الذيل. P-القيمة هي < 0.0001 ل * * * * اهميه. يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.
الشكل 8: توليد تدرج تركيز البروتين داخل النمط الصغير. (ا) قالب نمط التدرج في المقياس الرمادي. (ب) الصورة الجانبية لكثافة الفلورية مقيسة من (ا). (ج) نمط تم الحصول عليه مع limap من قالب النقش في (A) بعد الاحتضان مع 10 ميكروغرام/مل من الفيبرونكتين فلوريسسينتلي (الأخضر). (د) الجانبي كثافة مضان من ن = 3 المشارب والخلفية الممثلة باعتبارها يعني ± SEM ، والتي تبين الزيادة الخطية في كثافة التدرج البروتين. يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.
الشكل 9: تاثير الربط المتقاطع عند زخرفه العديد من البروتينات بالتتابع. (الف-جيم ، هاء-زاي) الأنماط المتقاطعة مع خطوط 10 ميكرومتر من الفيبرونكتين فلوريسسينتلي (سماوي ، أفقي) وlaminin فلوريسسينتلي المسمي (أرجواني ، عمودي). (ا-ج) العينات المعالجة مع المخزن المؤقت حجب الجيش الصربي. (بالانكليزيه والفرنسية) عينات تعامل مع PLL-PEG لحجب مواقع ملزمه غير محدده (الخطوة 7). (الف ، هاء) القناات الفلورية المدمجة تظهر كل من الفيبرونكتين والlaminin. (باء ، واو) صوره تظهر فيبرونكتين فقط. (جيم ، زاي) الصورة تظهر laminin فقط. ل [ك], لاحظت الوجود laminin أيضا علي أفقيه [فيبرونكتين] خطوط ايجابيه اي يكون واجبه إلى ال [بلوكسد] غير مشغولة من [فلود] ملزمه مع [بوسني]. بالنسبة ل G ، لاحظ ان الحجب باستخدام PLL-PEG يمنع الربط الفعال لlaminin بخطوط الفيبرونكتين. (د ، ح) لمحات كثافة الفلورية التي تم الحصول عليها من القياسات المشار اليها (الخط الأصفر المائل) في A و E ، علي التوالي. يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.
الشكل 10: الأنماط المتقاطعة للتحقيق في النتائج العصبية/العصبية. (ا-ج) الأنماط المتقاطعة مع خطوط 10 ميكرومتر من الفيبرونكتين فلوريسسينتلي (سماوي ، أفقي) وlaminin فلوريسسينتلي المسمي (أرجواني ، عمودي). (الف ، باء) الصور الفلورية للخلايا CAD مع العصب المتزايد علي طول الأنماط الصغرى. لتصور العصبية ، تم استزراع الخلايا ل 48 h ، ثابته مع 4 ٪ PFA وملطخه لأنابيب (A) أو الأنابيب و الاكتين (B). (C) الفئران الظهرية الجذر العقدة (drg) الخلايا العصبية مع محاور المتزايد علي طول الأنماط الصغرى. لتصور axons ، تم استزراع الخلايا العصبية DRG ل 72 h ، ثابته مع 4 ٪ PFA وملطخه لأنابيب. يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.
الشكل 11: أمثله علي النتائج السلبية الشائعة التي تم الحصول عليها عند توليد الأنماط الصغرى مع LIMAP. (ا-ج) خطوط منقوشة دون الأمثل من 10 ميكروغرام/مل فلوريسسينتلي المسمي الفيبرينوجين (الأخضر) التي تم الحصول عليها في ظل ظروف مختلفه. (ا) الدقيق الجاف المجفف اثناء توليد الأنماط. لاحظ مستويات عاليه من الفلورية في الخلفية (السهم) ووجود بلورات تلفزيوني (asterisks). (ب) لم يتم تعديل الخياطة بين الخطوط بشكل صحيح اثناء اعداد البرمجيات مما ادي إلى خطوط متقطعه مع فجوات (السهم) بين وحدات التصميم (انظر الخطوة 3.4.7). (ج) كان التركيز بالليزر دون الأمثل مما تسبب في المشارب المنتشرة (الأسهم) التي لا تمثل العرض الشريطي الفعلي لقالب النقش ، الذي ينبغي ان يكون 20 ، 10 ، 5 ، 2 μm من الأعلى إلى الأسفل ، كما في (ب). يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.
Discussion
LIMAP (بريمو) الزخرفة الصغرى المزايا والمقارنة مع الطباعة ميكرواتصال
في حين الطباعة microcontact هو ربما الأكثر شيوعا تقنيه زخرفه الصغرى في المجال البيولوجي39، يبدو ان هناك عددا متزايدا من الباحثين باستخدام التكنولوجيا limap40،41،42 ,43,44. هنا ، قدمنا بروتوكولا باستخدام بريمو ، وهو نظام متاح تجاريا ل LIMAP. أدناه ونحن نناقش بإيجاز المزايا المحتملة والقيود من الطباعة microcontact و LIMAP الصورة-زخرفه.
تتطلب الطباعة بالاتصال المجهري الرئيسية التي تم إنتاجها بواسطة الطلاء الدوار قناع الصور (SU-8 عموما) علي الزجاج أو رقاقه السيليكون ، والذي هو بعد ذلك محفورة بالليزر مع الميزات الدقيقة المطلوبة. يتم استخدام هذه الأساسيات كقوالب لإنشاء ختم PDMS45. يتم احتضان الطوابع مع البروتين المختار الذي يمتص اليها ، ثم يتم نقله (مختومه) علي طبق ثقافة الخلية. عمليه الامتزاز من البروتين إلى ختم PDMS يعتمد علي تركيز البروتين, العازلة ووقت الحضانة. هذه المعلمات تحتاج إلى اختبارها مسبقا للحصول علي أفضل النتائج46.
يمكن استخدام الماجستير في عدد كبير من التجارب ، التي تدوم لأشهر أو حتى سنوات ، إذا تم الحفاظ عليها بشكل صحيح. ومع ذلك ، فان العامل المقيد لهذه التكنولوجيا هو ضرورة أعاده تصميم الأساسيات الحجرية الجديدة لكل تعديل مطلوب. وقد تؤدي التغييرات في التصاميم التجريبية إلى الإنتاج المستهلك للوقت لأسياد جدد (حتى عده أسابيع) مما يؤخر التجارب. في المقارنة ، لا يتطلب فوتوباتيرنينج LIMAP سيد المادية; فانه يستخدم قوالب النماذج التي تم إنشاؤها من قبل البرمجيات التي يمكن استخدامها للتكيف بمرونة الهندسي المطلوب من الأنماط الصغرى إلى الاسئله البحثية المتغيرة. ويمكن أيضا ان تستخدم LIMAP لتوليد التدرجات البروتين داخل نفس النمط الصغير (الشكل 8) ، والتي هي أصعب للحصول علي بطريقه استنساخه باستخدام الاتصال المصغر الطباعة47.
وعلاوة علي ذلك ، فان القرار الخاص بالنمط الجزئي الذي تم التوصل اليه مع LIMAP ، في حالتنا ، هو 2 μm (الشكل 6ب).
وقد زاد الاقتراب من هذا القرار من التباين داخل الأنماط وفيما بينها. وكان توليد أنماط حول أو فوق 10 μm عرض استنساخه للغاية (الشكل 6G ، H). علي العكس من ذلك ، مع الطباعة ميكرواتصال من الصعب الحصول باستمرار علي قرارات اقل من 10 μm وانه من الشائع ان تجد التحف عند ختم الميزات الصغيرة (البيانات لم تظهر).
وقد أظهرنا ان LIMAP يمكن استخدامها لبروتينات متعددة النمط الجزئي (الشكل 9) داخل نفس الصغيرة البئر ، مما يسمح باضافه مستويات اضافيه من التعقيد إلى التجارب. علي الرغم من ان هذا يمكن ان يتحقق مع الطباعة microcontact ، محاذاة البروتينات المختلفة مع مستوي عال من الدقة يمكن ان تكون من الناحية الفنية تتطلب بدلا من ذلك. بينما زخرفه بروتينات متعددة باستخدام LIMAP يبدو علي التوالي إلى الامام ، فمن المهم ان نذكر ان الربط بين البروتينات من خلال إجراءات طلاء متسلسلة يمكن خفضها من خلال حجب الكواشف ولكن لم يتم القضاء كليا (الشكل 9).
وفيما يتعلق بتكلفه واحده أو تقنيه أخرى ، LIMAP كما هو موضح هنا يتطلب شراء معدات الزخرفة الصغيرة (بريمو) التي يمكن تركيبها علي المجاهر المختلفة فلوري ويتطلب مرحله الميكانيكية. علي الرغم من ان هذا الاستثمار هو في البداية التكلفة المكثفة ، لا توجد مشتريات اضافيه غير المواد الاستهلاكية (الاستنسل ، PEG و PLPP) علي المدى الطويل المرتبطة LIMAP. بدلا من ذلك ، يمكن أيضا ان تنتج الاستنسل pdms في المختبر من قبل مجرب الخاصة التالية البروتوكولات المنشورة18،32. ويمكن ان تكون أكبر التكاليف المتعلقة بالطباعة بالاتصال المجهري مرتبطة بإنتاج أسياد جدد ، وهو ما يمكن ان يصبح كبيرا إذا كانت التجارب تتطلب أنماطا جديده.
عيب واحد من LIMAP هو نهج الانتاجيه منخفضه نسبيا من هذه التقنية. يمكن الطباعة microcontact إنتاج عدد كبير من النماذج الصغيرة بسرعة وكفاءه في خطوه ختم في وقت واحد ، بالمقارنة مع المطلوبة الليزر الصغيرة متسلسلة زخرفه مع LIMAP. علي سبيل المثال ، فمن الممكن لإنتاج 6 الزجاج مختومه الشفتين في حوالي 2 ح مع الطباعة microcontact باستخدام الطوابع PDMS (باستثناء اعداد الطوابع) ؛ زخرفه منطقه مماثله (6-حسنا طبق) مع LIMAP سوف يستغرق حوالي 4 ساعة ، باستثناء اجراء التخميل السطحية (بالنظر إلى تكوين قالب نمط الموصوفة في الخطوة 5.12 وانظر الشكل 5ب).
ومن العوامل الأخرى التي تحد من عامل التكنولوجيا LIMAP هو وقت الاضاءه الطويل اللازم لزخرفه المساحات الكبيرة (30 ثانيه لكل وحده تصميم بالليزر 7.5 ميغاواط/مم2 ). في هذه الحالات ، قد تكون طباعه الاتصال المصغر خيارا مفضلا. وهناك الجديدة المتاحة الصورة البادئ (PLPP هلام ، جدول المواد) ينبغي ان تقلل إلى حد كبير من الوقت الذي اتخذ لزخرفه ، والسماح للجيل من مئات من الأنماط الصغرى في مناطق واسعه (تصل إلى 8 مم2) في بضع دقائق فقط.
ومن العوامل الهامه الأخرى التي يجب مراعاتها عند الأسطح زخرفه الصغرى لثقافة الخلايا هو استنساخ الأنماط الصغرى بين التكرارات التجريبية المختلفة ، بالمقارنة مع التغيرات التي تم الحصول عليها مع الطباعة بالاتصال المجهري. علي سبيل المثال ، الرسوم البيانية المبينة في الشكل 7B ، D هي بيانات تمثيليه لثلاثه تكرارات تجريبية مستقله مع نتائج مشابهه جدا (البيانات غير معروضه). استنادا إلى تجربتنا والمنشورات السابقة ، وهذا المستوي من استنساخ من الصعب تحقيق مع الطباعة microcontact48،49،50،51،52.
علي النقيض من غيرها من التقنيات زخرفه الصور التي تتطلب اما الكيمياء مخصصه لهندسه المواد الحساسة أو استخدام الصور المحسسات ، والتي هي عموما ليست حيوية جدا3، والعنصر الحساس للضوء LIMAP (plpp ) متوافقة بيولوجيا وجيده التحمل من قبل الخلايا21؛ في ايدينا لم تشهد اي السمية الخلوية عبر مجموعه متنوعة من الخلايا ، بما في ذلك CAD ، DRG الخلية العصبية (الشكل 10) ، الخلايا الليفية ، الظهاريه ، وخلايا سرطان الجلد (البيانات لم تظهر). ميزه أخرى من limap باستخدام بريمو مقارنه مع غيرها من التقنيات زخرفه الصورة هو انه لا يتطلب ضوئي. علي غرار الطباعة microcontact ، ستحتاج نباتات جديده ليتم تصميمها وتوليدها لكل نمط المرجوة.
جميع القيود المذكورة أعلاه للطباعة ميكرواتصال ، والرجوع إلى النهج اليدوي لهذه التقنية. ومع ذلك ، فمن الممكن لتعزيز الانتاجيه واستنساخ الطباعة microcontact باستخدام جهاز مؤتمت مع تحميل الطوابع والتحكم في الضغط53.
الخطوات الرئيسية للبروتوكول وحل المشاكل ل LIMAP باستخدام بريمو
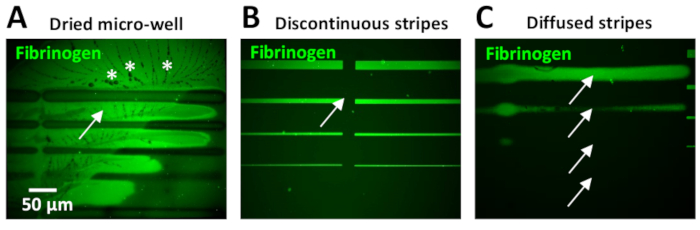
واحده من المشاكل الأكثر شيوعا وجدت خلال هذا البروتوكول هو وجود مستويات عاليه من الخلفية الفلورية داخل الأنماط الصغرى. وهذا يمكن ان يكون نتيجة لتجفيف الآبار الصغيرة التي غالبا ما يحدث بسبب حجمها الصغير. وعند حدوث ذلك ، غالبا ما تظهر بلورات الاذاعه التلفزيونية المحيطة بأنماط ECM (الشكل 11ا).
خطوات الغسيل غير كافيه أو غير فعاله بعد حضانة البروتين يمكن ان يؤدي أيضا إلى مستويات عاليه من مضان الخلفية. ويمكن ملاحظه ذلك علي وجه الخصوص عند استخدام تركيزات البروتين من 10 ميكروغرام/مل (الشكل 11ب) أو اعلي. ويمكن تخفيض الفائض من البروتين في الخلفية بما في ذلك خطوات الغسيل اضافيه مع تلفزيوني.
وجود خلفيه البروتين يحتاج إلى ان تقاس وتتميز في كل تجربه ، وحساب كثافة الخلفية الفلورية (الشكل 6ه) وطرحها من كثافة الأنماط الصغرى (الشكل 6F-H والشكل 7باء ، دال). قد يكون للخلفية عاليه البروتين تاثير في المرفق والتوجيه من خلايا CAD, المساومة علي تفسير النتائج.
وجود ثغرات بين وحدات التصميم مشكله شائعه عندما يكون لدي المستخدمين خبره محدوده (الشكل 11ب) ، والتي تحدث نتيجة لعدم كفاية التداخل بين الأنماط. يمكن تعديل معلمتين في برنامج ليوناردو للتغلب علي هذا: 1) قد تكون هناك حاجه إلى تباعد سالب بين الاعمده ، اعتمادا علي تصميم النمط (الخطوة 5.7 وانظر الشكل 5ب ، ج). بدلا من ذلك ، 2) استخدم خيار التدرج في قائمه الخبراء لغرزه الاعمده. يمكن اجراء اختبار سريع لتحديد معلمات التباعد الأمثل باستخدام لاصق الاشعه فوق البنفسجية (جدول المواد). يتم تطبيق قطره صغيره من هذه اللاصقة علي شريحة زجاجيه ، والتي يتم تغطيتها بعد ذلك مع الزجاج coverslip ، مما يجعل الفيلم. يتم فوتوباتيرنيد لاصقه الاشعه فوق البنفسجية المضمنة مع قالب النمط من الفائدة باستخدام جرعه ليزر منخفضه (30 مللي جول/مم2). سيتم الشفاء من المناطق المعرضة للاشعه فوق البنفسجية من ماده لاصقه مضمنه ، لتصبح مرئية تحت المجهر الميداني الساطع. يتم تصور نتائج الاختبار لتقييم التباعد الذي تم الحصول عليه ضمن النقش. في تجاربنا العصبية ، قد الفجوة بين المشارب تؤثر سلبا علي سلوك الخلية ، وإنتاج الاختلافات في ديناميات النمو (اما انخفاض السرعة أو التخلي عن المسار).
في آخر تحديث لبرنامج ليوناردو (في وقت النشر ، ليوناردو 4.11) ، من الممكن تحميل قوالب النقش الأكبر المصممة سابقا والتي تغطي مساحة أكبر بكثير (حتى 8 مم2 باستخدام الهدف 20x) لسطح البئر الصغيرة بالمقارنة مع الحالي 0.1 مم2 لكل وحده التصميم ، والقضاء علي الحاجة إلى غرزه معا وحدات تصميم أصغر. يمكن ان تنتج الحواف غير المعرفة عن عدم وجود تعديل للتركيز بالليزر اثناء إنشاء النمط (الشكل 11ج). ولذلك فمن الضروري معايره الليزر وتنفيذ خطوات النمط المرجعي (انظر الخطوة 4) قبل زخرفه. المشارب المحددة بشكل سيئ ينتج عنها اختلافات في عرض الشريط ، مما يجعل الارتباط بين ديناميات نمو المحور وعرض الشريط صعبا. Axons تميل أيضا إلى التخلي عن المشارب التي لها حواف منتشرة. بالاضافه إلى ذلك ، يمكن أيضا العثور علي تباين في الحواف عند طباعه المشارب من 10-20 μm عرض أو اعلي ، مما ادي إلى ارتفاع محتوي البروتين علي حواف مقارنه بالمناطق الوسطي من النمط (الشكل 6ب ، د). أنتجت هذا حافه تاثير بانتشار [نون-لهوموكل] من ال [فوتو-بادئ] اثناء ال [فوتوباتيرنينج عمليه. رد فعل التصوير الضوئي هو الأكسجين المعتمدة ، والتي ينتشر أكثر علي الحواف. هذا تاثير حافه يستطيع كنت قللت مجانسه الصورة-بادئ مع ماصه في ال [ميكرو-ول] اثناء العملية فوتوباتيرنينج. وعلاوة علي ذلك ، يمكن للمبتكر الصور الجديدة (PLPP هلام) أيضا تقليل تاثير الحافة (بريمو فريق دعم النظام ، والاتصالات الشخصية).
يمكن ان يؤدي الطباعة الدقيقة لأكثر من بروتين واحد إلى الربط التبادلي (الشكل 9ا-د). ويمكن التقليل من ذلك عن طريق زيادة كفاءه الحجب المستخدمة لاحتلال مواقع ربط غير محدده بين خطوات الحضانة للبروتينين المختلفين. ويمكن للربط بين البروتينات ان يزعج استنساخ النتائج التجريبية وقد يؤدي إلى سوء تفسير البيانات ، لأنه من الصعب تحديد مساهمه كل بروتين في ديناميات نمو الخلايا العصبية وسلوكيات الخلية الأخرى.
الختام
نامل ان البروتوكول المقدم باستخدام LIMAP يسهل توليد أنماط البروتين الصغرى من خلال استخدام نظام بريمو. بينما يركز بروتوكولنا علي كيفيه إنتاج النماذج الصغيرة بشكل موثوق في الأسطح الزجاجية ثنائيه الابعاد ، اظهر البعض الآخر انه من الممكن استخدام LIMAP لزخرفه الصغيرة من الركائز اللينة54، والأسطح المجهرية للثقافات ثلاثية الابعاد42. هذه الأنماط الصغيرة يمكن ان تكون أداه متعددة الاستعمالات لدراسة الاستجابات الخلوية للتغيرات في بيئتها الصغرى.
Disclosures
وليس لدي المؤلفين ما يفصحون عنه.
Acknowledgements
ويدعم هذا العمل من قبل BBSRC ، EPSRC ، مومباسا و Wellcome الثقة. مختبر C.B. هو جزء من مركز الثقة Wellcome للبحوث مصفوفة الخلية ، جامعه مانشستر ، والتي تدعمها التمويل الأساسي من الثقة Wellcome (منحه رقم 088785/Z/09/Z). ويود أصحاب البلاغ التنويه بالتمويل المقدم من مجلس بحوث التكنولوجيا الاحيائيه والعلوم البيولوجية (BBSRC) إلى سي ام ، K.J. (BB/M020630/1) والدراسة السنوية (BB/P000681/1) ومجلس بحوث الهندسة والعلوم الفيزيائية (EPSRC) والطبي مركز مجلس البحوث لتدريب الدكتوراه في الطب التجديدي لA.K. (EP/L014904/1). ويشكر المؤلفون Alvéole علي مراسلاتهم وفريق دعم ما بعد البيع. ويشكر المؤلفان بيتر مارس وروجر ميدوز من مرفق التصوير الحيوي بجامعه مانشستر لمساعدتهما في المجهر. تم شراء المجاهر مرفق التصوير الحيوي المستخدمة في هذه الدراسة مع منح من BBSRC ، ويلكوم ترست والصندوق الاستراتيجي لجامعه مانشستر.
Materials
| Name | Company | Catalog Number | Comments |
| Alexa 488 protein labeling kit | Invitrogen | A10235 | Working concentration: N.A. |
| Alexa 647 protein labeling kit | Invitrogen | A20173 | Working concentration: N.A. |
| CAD cells | ECACC | 8100805 | Working concentration: N.A. |
| Conjugated fibrinogen-488 | Molecular Probes | F13191 | Working concentration: 10 μg/ml |
| DMEM culture medium | Gibco | 11320033 | Working concentration: N.A. |
| Epifluorescence Microscope** | Nikon | Eclipse Ti inverted | Working concentration: N.A. |
| Fibronectin | Sigma | F4759 | Working concentration: 10 μg/ml (after labelling with Alexa 488 protein labeling kit, see above) (diluted in PBS) |
| Fiji-Image J | www.imagej.nih.gov | Version 2.0.0-rc-54/1.51f | Working concentration: N.A. |
| Fluorescent highlighter | Stabilo | Stabilo Boss Original | Working concentration: N.A. |
| HEPES | Gibco | 15630080 | Working concentration: 1M |
| Inkscape software | Inkscape | Check last update | Working concentration: N.A. |
| Laminin-red fluorescent rhodamine | Cytoskeleton, Inc. | LMN01 | Working concentration: 10 μg/ml (diluted in PBS) |
| Leonardo software | Alvéole | version 4.11 | Working concentration: N.A. |
| L-Glutamine | Sigma | G7513 | Working concentration: 1% |
| Micro-manager software | Open imaging | Check last update | Working concentration: N.A. |
| Motorized x/y stage | PRIOR Scientific | Proscan II | Working concentration: N.A. |
| NIS Elements Software | Nikon | NIS Elements AR 4.60.00 64-bit (With Nikon jobs) | Working concentration: N.A. |
| PBS (without Ca2+, Mg2+) | Sigma | D8537 | Working concentration: 1X |
| PDMS Stencils | Alvéole | visit www.alveolelab.com | Working concentration: N.A. |
| PEG-SVA | Laysan bio, Inc. | MPEG-SVA-5000-1g | Working concentration: 50 mg/ml |
| Phalloidin 405 | Abcam | ab176752 | Working concentration: 1:1000 |
| Photo-initiator (PLPP) | Alvéole | Classic PLPP | Working concentration: 14.5 mg/ml |
| Photo-initiator (PLPP gel) | Alvéole | PLPP gel | Working concentration: 4.76% diluted in ethanol |
| Plasma cleaner | Harrick Plasma | PDC-32G (115V) | PDC-32G-2 (230V) | Working concentration: N.A. |
| PLL-PEG | SuSoS (also distributed by Alvéole) | www.alveolelab.com | Working concentration: 0.1 mg/ml (diluted in PBS) |
| Poly-L-Lysine | Sigma | P4707 | Working concentration: 0.01% |
| Primo equipment | Alvéole | www.alveolelab.com | Working concentration: N.A. |
| Pen/Strep | Thermo Fisher | 15140122 | Working concentration: 1% |
| Tubulin anti-alpha antibody | Abcam | DM1A | Working concentration: 1:1000 CAD cells |
| Tubulin anti-beta 3 antibody | Sigma | T8660 | Working concentration: 1:500 DRG neurons |
| UV adhesive | Norland Products | NOA81 | Working concentration: N.A. |
| 1 well glass bottom dish | Cellvis | D35-20-1.5-N | Working concentration: N.A. |
| 6 well glass bottom dish | Cellvis | P06-20-1.5-N | Working concentration: N.A. |
| 20x objective** | Nikon | no phase ring (check updated catalogue) | Working concentration: N.A. **Epifluorescence microscope: images were acquired and patterns were generated on an Eclipse Ti inverted microscope (Nikon), coupled to PRIMO micro-patterning equipment (Alvéole), using a 20x objective (0.75 S Plan Fluor (nophasering, Nikon). Nikon specific filter sets for GFP, mCherry and Cy5 were used and fluorescent light source was LED (Lumencor) although other fluorescence sources and filter sets can be used. The microscope has an automated x/y stage (PRIOR Scientific) for the printing of multi-field patterning and Nikon Perfect Focus to prevent focus drift. The images were collected using a Retiga R6 (Q-Imaging) camera. |
References
- Alamdari, O. G., Seyedjafari, E., Soleimani, M., Ghaemi, N. Micropatterning of ECM Proteins on Glass Substrates to Regulate Cell Attachment and Proliferation. Avicenna Journal of Medical Biotechnology. 5 (4), 234-240 (2013).
- Sunami, H., Yokota, I., Igarashi, Y. Influence of the pattern size of micropatterned scaffolds on cell morphology, proliferation, migration and F-actin expression. Biomaterials Science. 2 (3), 399-409 (2014).
- Thery, M. Micropatterning as a tool to decipher cell morphogenesis and functions. Journal of Cell Science. 123 (Pt 24), 4201-4213 (2010).
- Marino, A., et al. Two-photon polymerization of sub-micrometric patterned surfaces: investigation of cell-substrate interactions and improved differentiation of neuron-like cells. ACS Applied Materials & Interfaces. 5 (24), 13012-13021 (2013).
- Joo, S., et al. Effects of ECM protein micropatterns on the migration and differentiation of adult neural stem cells. Scientific Reports. 5, (2015).
- Morgani, S. M., Metzger, J. J., Nichols, J., Siggia, E. D., Hadjantonakis, A. K. Micropattern differentiation of mouse pluripotent stem cells recapitulates embryo regionalized cell fate patterning. Elife. 7, (2018).
- Javaherian, S., O'Donnell, K. A., McGuigan, A. P. A Fast and Accessible Methodology for Micro-Patterning Cells on Standard Culture Substrates Using Parafilm (TM) Inserts. Plos One. 6 (6), (2011).
- Smirnov, M. S., Cabral, K. A., Geller, H. M., Urbach, J. S. The effects of confinement on neuronal growth cone morphology and velocity. Biomaterials. 35 (25), 6750-6757 (2014).
- Albert, P. J., Schwarz, U. S. Dynamics of Cell Ensembles on Adhesive Micropatterns: Bridging the Gap between Single Cell Spreading and Collective Cell Migration. PLOS Computational Biology. 12 (4), (2016).
- Evans, A. R., et al. Laminin and fibronectin modulate inner ear spiral ganglion neurite outgrowth in an in vitro alternate choice assay. Developmental Neurobiology. 67 (13), 1721-1730 (2007).
- Nichol, R. H., Hagen, K. M., Lumbard, D. C., Dent, E. W., Gomez, T. M. Guidance of Axons by Local Coupling of Retrograde Flow to Point Contact Adhesions. Journal of Neuroscience. 36 (7), 2267-2282 (2016).
- Burdick, J. A., Khademhosseini, A., Langer, R. Fabrication of gradient hydrogels using a microfluidics/photopolymerization process. Langmuir. 20 (13), 5153-5156 (2004).
- Schwartz, P. V. Molecular transport from an atomic force microscope tip: A comparative study of dip-pen nanolithography. Langmuir. 18 (10), 4041-4046 (2002).
- Barbulovic-Nad, I., et al. Bio-microarray fabrication techniques--a review. Critical Reviews in Biotechnology. 26 (4), 237-259 (2006).
- Shafagh, R. Z., Vastesson, A., Guo, W. J., van der Wijngaart, W., Haraldsson, T. E-Beam Nanostructuring and Direct Click Biofunctionalization of Thiol-Ene Resist. Acs Nano. 12 (10), 9940-9946 (2018).
- Kobayashi, J., Yamato, M., Itoga, K., Kikuchi, A., Okano, T. Preparation of microfluidic devices using micropatterning of a photosensitive material by a maskless, liquid-crystal-display projection method. Advanced Materials. 16 (22), (2004).
- Bernard, A., et al. Printing patterns of proteins. Langmuir. 14 (9), 2225-2229 (1998).
- Ruiz, S. A., Chen, C. S. Microcontact printing: A tool to pattern. Soft Matter. 3 (2), 168-177 (2007).
- Qin, D., Xia, Y., Whitesides, G. M. Soft lithography for micro- and nanoscale patterning. Nature Protocols. 5 (3), 491-502 (2010).
- Fink, J., et al. Comparative study and improvement of current cell micro-patterning techniques. Lab Chip. 7 (6), 672-680 (2007).
- Strale, P. O., et al. Multiprotein Printing by Light-Induced Molecular Adsorption. Advanced Materials. 28 (10), 2024-2029 (2016).
- Belisle, J. M., Correia, J. P., Wiseman, P. W., Kennedy, T. E., Costantino, S. Patterning protein concentration using laser-assisted adsorption by photobleaching, LAPAP. Lab Chip. 8 (12), 2164-2167 (2008).
- Belisle, J. M., Kunik, D., Costantino, S. Rapid multicomponent optical protein patterning. Lab Chip. 9 (24), 3580-3585 (2009).
- Heinz, W. F., Hoh, M., Hoh, J. H. Laser inactivation protein patterning of cell culture microenvironments. Lab Chip. 11 (19), 3336-3346 (2011).
- Azioune, A., Carpi, N., Tseng, Q., Thery, M., Piel, M. Protein Micropatterns: A Direct Printing Protocol Using Deep UVs. Microtubules: In Vivo. 97, 133-146 (2010).
- Vignaud, T., Ennomani, H., Thery, M. Polyacrylamide hydrogel micropatterning. Methods in Cell Biology. 120, 93-116 (2014).
- Waldbaur, A., Waterkotte, B., Schmitz, K., Rapp, B. E. Maskless projection lithography for the fast and flexible generation of grayscale protein patterns. Small. 8 (10), 1570-1578 (2012).
- Kang, J., Choi, J. C., Kim, M., Jung, H. R., Doh, J. Photopatterning with a printed transparency mask and a protein-friendly photoresist. Methods in Cell Biology. 119, 55-72 (2014).
- Falconnet, D., Csucs, G., Grandin, H. M., Textor, M. Surface engineering approaches to micropattern surfaces for cell-based assays. Biomaterials. 27 (16), 3044-3063 (2006).
- Morlat, S., Gardette, J. L. Phototransformation of water-soluble polymers. Part II: photooxidation of poly(ethylene oxide) in aqueous solution. Polymer. 44 (26), 7891-7897 (2003).
- Qi, Y., Wang, J. K., McMillian, M., Chikaraishi, D. M. Characterization of a CNS cell line, CAD, in which morphological differentiation is initiated by serum deprivation. Journal of Neuroscience. 17 (4), 1217-1225 (1997).
- Shrirao, A. B., et al. A Versatile Method of Patterning Proteins and Cells. Journal of Visualized Experiments. (120), (2017).
- Pankov, R., Momchilova, A. Fluorescent labeling techniques for investigation of fibronectin fibrillogenesis (labeling fibronectin fibrillogenesis). Methods in Molecular Biology. 522, 261-274 (2009).
- Dertinger, S. K., Jiang, X., Li, Z., Murthy, V. N., Whitesides, G. M. Gradients of substrate-bound laminin orient axonal specification of neurons. Proceedings of the National Academy of Sciences of the United States of America. 99 (20), 12542-12547 (2002).
- Chelli, B., et al. Neural cell alignment by patterning gradients of the extracellular matrix protein laminin. Interface Focus. 4 (1), (2014).
- Tang, Y., Qiu, Q. F., Zhang, F. L., Xie, M., Huang, W. H. Quantifying orientational regeneration of injured neurons by natural product concentration gradients in a 3D microfluidic device. Lab Chip. 18 (6), 971-978 (2018).
- Srinivasan, P., Zervantonakis, I. K., Kothapalli, C. R. Synergistic effects of 3D ECM and chemogradients on neurite outgrowth and guidance: a simple modeling and microfluidic framework. PLoS One. 9 (6), (2014).
- de Luca, A. C., Faroni, A., Reid, A. J. Dorsal root ganglia neurons and differentiated adipose-derived stem cells: an in vitro co-culture model to study peripheral nerve regeneration. Journal of Visualized Experiments. (96), (2015).
- Khadpekar, A. J., Khan, M., Sose, A., Majumder, A. Low Cost and Lithography-free Stamp fabrication for Microcontact Printing. Scientific Reports. 9 (1), (2019).
- Delepine, C., et al. Altered microtubule dynamics and vesicular transport in mouse and human MeCP2-deficient astrocytes. Human Molecular Genetics. 25 (1), 146-157 (2016).
- Decock, J., Schlenk, M., Salmon, J. B. In situ photo-patterning of pressure-resistant hydrogel membranes with controlled permeabilities in PEGDA microfluidic channels. Lab Chip. 18 (7), 1075-1083 (2018).
- Stoecklin, C., et al. A New Approach to Design Artificial 3D Microniches with Combined Chemical, Topographical, and Rheological Cues. Advanced Biosystems. 2 (7), (2018).
- Toraille, L., et al. Optical Magnetometry of Single Biocompatible Micromagnets for Quantitative Magnetogenetic and Magnetomechanical Assays. Nano Letters. , (2018).
- Theodoly, O., et al. Live nanoscopic to mesoscopic topography reconstruction with an optical microscope for chemical and biological samples. PLoS One. 13 (12), (2018).
- Ermis, M., Antmen, E., Hasirci, V. Micro and Nanofabrication methods to control cell-substrate interactions and cell behavior: A review from the tissue engineering perspective. Bioactive Materials. 3 (3), 355-369 (2018).
- von Philipsborn, A. C., et al. Microcontact printing of axon guidance molecules for generation of graded patterns. Nature Protocols. 1 (3), 1322-1328 (2006).
- Ricoult, S. G., Kennedy, T. E., Juncker, D. Substrate-bound protein gradients to study haptotaxis. Frontiers in Bioengineering and Biotechnology. 3, (2015).
- Bietsch, A., Michel, B. Conformal contact and pattern stability of stamps used for soft lithography. Journal of Applied Physics. 88 (7), 4310-4318 (2000).
- Hui, C. Y., Jagota, A., Lin, Y. Y., Kramer, E. J. Constraints on microcontact printing imposed by stamp deformation. Langmuir. 18 (4), 1394-1407 (2002).
- Sharp, K. G., Blackman, G. S., Glassmaker, N. J., Jagota, A., Hui, C. Y. Effect of stamp deformation on the quality of microcontact printing: theory and experiment. Langmuir. 20 (15), 6430-6438 (2004).
- Delamarche, E., Schmid, H., Michel, B., Biebuyck, H. Stability of molded polydimethylsiloxane microstructures. Advanced Materials. 9 (9), 741-746 (1997).
- Perl, A., Reinhoudt, D. N., Huskens, J. Microcontact Printing: Limitations and Achievements. Advanced Materials. 21 (22), 2257-2268 (2009).
- Chakra, E. B., Hannes, B., Dilosquer, G., Mansfield, C. D., Cabrera, M. A new instrument for automated microcontact printing with stamp load adjustment. Review of Scientific Instruments. 79 (6), (2008).
- Pasturel, A., Strale, P., Studer, V. Tailoring 3D cell culture templates with common hydrogels. bioRxiv. , (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved