Method Article
كيانات السومو الملزمة (SUBEs) كاداات لإثراء وعزل وتحديد وتوصيف بروتين السومو في سرطان الكبد
In This Article
Summary
هنا ، نقدم بروتوكولا لإثراء وعزل وتحديد وتوصيف البروتينات التي تم تعديلها من قبل السومو في الجسم البشري سواء من خلايا كبديه بشريه أو أورام الكبد التي تم الحصول عليها من نماذج الفئران من سرطان الخلية الكبدية باستخدام كيانات السومو الملزمة (SUBEs).
Abstract
تعديل ما بعد الانتقالية هو اليه رئيسيه تنظم التوازن البروتين ووظيفة في الخلايا حقيقية النواة. من بين جميع البروتينات الشبيهة بالاوبييتين في سرطان الكبد ، تم إعطاء التعديل من قبل السومو (معدل اوبيكويتين الصغيرة) الاهتمام الأكبر. عزل البروتينات SUMOylated الذاتية في الجسم الحيوي هو تحدي بسبب وجود بروتينيه نشطه محدده السومو. واستندت الدراسات الاوليه من SUMOylation في الجسم المجري علي الكشف الجزيئي للبروتينات Sumoylation محدده (علي سبيل المثال ، بواسطة لطخه الغربية). ومع ذلك ، في كثير من الحالات ، الأجسام المضادة ، المصنوعة عموما مع البروتين المؤتلف غير المعدلة ، لم إيمونوبريسيبيتاتي اشكال SUMOylated من البروتين من الفائدة. وكان الفصل اللوني النيكل النهج الآخر لدراسة SUMOylation من خلال التقاط الإصدارات الموسومة histidine من جزيئات السومو. ويستخدم هذا النهج أساسا في الخلايا التي تعبر بثبات أو عابره مع جزيئاته السومو. للتغلب علي هذه القيود ، تم تطوير الكيانات الملزمة السومو (SUBEs) لعزل البروتينات SUMOylated الذاتية. هنا ، ونحن وصف جميع الخطوات اللازمة لإثراء ، والعزلة ، وتحديد ركائز SUMOylated من خلايا الكبد البشرية والانسجه الكبدية من نموذج الماوس سرطان الكبد باستخدام SUBEs. أولا ، ونحن وصف الأساليب التي تنطوي عليها في اعداد وتحلل خلايا الكبد البشرية وعينات الانسجه الكبدية الأورام. بعد ذلك, شرح شامله من التحضير من [سوبس] وتحكمات بالتفصيل مع البروتوكول ل ال بروتين يسحب إلى أسفل اختبارات. وأخيرا ، قدمت بعض الامثله فيما يتعلق بالخيارات المتاحة لتحديد وتوصيف بروتيمي SUMOylated ، وهي استخدام تحليل لطخه الغربية للكشف عن الركيزة SUMOylated محدده من أورام الكبد أو استخدام من البروتينات بواسطة قياس الطيف الكتلي لتوصيف الانتاجيه العالية للبروسوم السوموليه والبينية في خلايا الورم الكبدي.
Introduction
سرطان الكبد هو سادس أكثر السرطانات شيوعا في جميع انحاء العالم والسبب الثاني للوفيات المرتبطة بالسرطان1. سرطان الخلايا الكبدية هو الشكل الأكثر شيوعا من سرطان الكبد الاولي. ومن الناحية التاريخية ، شملت عوامل الخطر الشائعة لتطوير الاسمنت التهاب الكبد المزمن B أو C وتعاطي الكحول المسيء. في العقود الاخيره ، ظهرت متلازمة الأيض ، ومرض السكري من النوع 2 غير الكحولية الدهنية (NAFLD) كعوامل الخطر لتطوير المقر2. وتعتبر المركبة غير متجانسة للغاية ، سواء من الناحية الظاهرية أو الوراثية ، حيث تتعطل شبكه معقده من مسارات الإشارات. في السنوات الاخيره ، علي الرغم من ان هناك زيادة في معرفتنا حول المسارات الجزيئية المتورطة في التسبب في مرض السرطان ، لا توجد حتى الآن نهج علاجيه فعاله لأداره المقر. يتم تنشيط العديد من المسارات في المقر وتثبيط واحد عموما يدفع التعويض من قبل مسارات أخرى3. وقد كانت هذه أحدي الصعوبات الرئيسية عند علاج السرطان. وهكذا ، فان اتباع نهج أكثر عالميه قد يوفر نهجا علاجيا محتملا للاداره السريرية لسرطان الكبد ، علي سبيل المثال ، استهداف التعديلات بعد الانتقالية (PTMs) ، حيث يمكن تنظيم مسارات الإشارات المتعددة في نفس الوقت بواسطة PTMs من البروتينات.
وتعتبر التعديلات بعد الانتقالية أليات الرئيسية التي تنظم التوازن البروتين ووظائف4. يتم إدخال التغييرات الهيكلية والوظيفية بواسطة PTMs ، التالي زيادة التنوع البروتيني. وتشمل الأكثر شيوعا Ptorylation ، ميثيل ، اسيتيل ، غليكوزيليشن ، اوبيتاميليشن ، واقتران البروتينات مثل اوبيكويتين (UbLs). من بين جميع UbLs ، وقد اجتذبت تعديل البروتين من قبل السومو (الصغيرة اوبيكويتين معدل) الاهتمام بالتعاون مع دورها الحاسم في مجموعه متنوعة من العمليات الخلوية ، بما في ذلك النسخ ، والتعريب الخلوي ، وإصلاح الحمض النووي ، وتطور دوره الخلية 5. في الاونه الاخيره ، وأظهرت sumoylation ليتم تغييرها في سرطان الكبد6،7،8،9، وتم وصف التغييرات في sumoylation من البروتينات محدده للعب دور في تطور الامراض المرتبطة بالسرطان9.
في الثدييات ، هناك خمسه paralogues السومو ، السومو-1 إلى سومو-5. حتى الآن, لا تتوفر أدله تجريبية حول وجود السومو الذاتية-4 وردود الفعل الذاتية السومو-5 الاقتران علي مستوي البروتين10,11,12. يتم اجراء SUMOylation في الثدييات من قبل الانزيميه ثيول استر تتالي التي تنطوي علي ثلاثه انزيمات ، هيتيروديميريك السومو تنشيط الانزيم (SAE1/SAE2) أو E1 ، والانزيم السومو الاقتران (Ubc9) أو E2 و سومو-E3-ligase محدده لكل البروتين المستهدف. يبدو ان عمل العديد من عائلات السومو E3s في توازن ديناميكي مع البرواسات الخاصة السومو (الحمالات أو SENPs)13 مما يجعل رد الفعل SUMOylation عكسية للغاية. وعلاوة علي ذلك ، فقط جزء صغير من البروتين SUMOylated مقابل البروتين الكلي غير SUMOylated موجود. التالي ، عزل البروتينات SUMOylated الذاتية في الجسم الفيفو هو تحديا بدلا13.
تمت دراسة SUMOylation في الجسم المجري في البداية من قبل لطخه الغربية باستخدام الأجسام المضادة ضد البروتين من الفائدة14. تم اجراء ايمونوبريسيبيتيشن من البروتين مع الأجسام المضادة محدده ومن ثم تم تنفيذ لطخه الصفحة الغربية مع الأجسام المضادة لمكافحه السومو. المشكلة الرئيسية مع هذه الاستراتيجية هي ان الأجسام المضادة المتولدة ضد البروتين المؤتلف غير المعدلة ليست دائما قادره علي إيمونوبريسيبيتاتي الشكل SUMOylated من البروتين. بدلا من ذلك ، اللوني النيكل بعد التعبير عابره من الموسومة حامض (His6) الإصدارات من جزيئات السومو والبروتين من الفائدة وقد استخدمت لدراسة sumoylation في الخلايا. علي هذا الأساس ، سيكون أكثر ملاءمة للكشف عن النماذج المعدلة السومو من الخلايا التي تعبر بثبات His615. بالنسبة للدراسات المجرية ، تم التدليل علي الإثراء القائم علي التفاعل بين السومو والسومو (SIM) لتنقيه بوليسومو من الاقتران16. وقد تم استخدام مجموعات أخرى العلامات الأجسام المضادة الموسومة سومو النهج توفير أداه ممكنة للتحقيق في المحلية sumoylation في الخلايا الاوليه, الانسجه, والاجهزه17,18. وفي الاونه الاخيره ، استخدمت نيلسن وزملاءه الإثراء القائم علي الأجسام المضادة لتحديد السومو الذاتية والخاصة بالموقع في الخلايا والانسجه19.
من أجل توفير معلومات تكميليه عن دور SUMOylation في الجسم الآخر ، تم تطوير الكيانات السومو ملزمه (SUBEs) ، والمعروف أيضا باسم الفخاخ السومو ،20. ومن الاهميه ، تعتبر الكيانات الملزمة بالترادف (أنابيب) السلائف المفاهيمية لل SUBEs وهي أدوات متاحه تجاريا للكشف عن وعزل البروتينات polyubiquitylated21. SUBEs هي البروتينات المؤتلف التي تتالف من تكرار جنبا إلى جنب من سيمز التالي الاعتراف جزيئات السومو علي البروتينات المعدلة مع زيادة في التقارب العام لركائز السومو. تم تصميم الفخاخ السومو من خلال إدخال E3 اوبيكويتين-البروتينات المشتقة RNF4 SIM2 و SIM3 الزخارف في ترادف ، إلى ناقل يحتوي علي الجلوتاثيون S-ترانسفيراسي (GST) ، وهو البروتين الناقل غير المتجانسة20. علي الرغم من ان SUBEs لا يمكن استخدامها بشكل صحيح للتعرف علي البروتينات الهدف أحاديه SUMOylated ، وهذا الأسلوب يوفر أداه لتسهيل تنقيه وتحديد البروتينات الهدف بولي السومو في الجسم المجري. هنا ، ونحن وصف تطبيق SUBEs لعزل البروتينات SUMOylated علي حد سواء في خلايا الكبد البشرية والخزعات الكبد الفار ، أداه هامه لدراسة سرطان الكبد. ويرد في الشكل 1مخطط عام للبروتوكول الموصوف في هذه المخطوطة.
Protocol
وقد تمت الموافقة علي جميع التجارب من قبل لجان المؤسسات المؤسسية لرعاية الماشية والتعامل معها. وبذلت جميع الجهود للتقليل إلى ادني حد من المعاناة الحيوانية وتقليل عدد الماشية المستخدمة. 3-أشهر من الذكور الجليسين N-ميثيلترانسفيتاز (gnmt) ناقص (gnmt−/-) وكانت تستخدم البرية الخاصة بأصحاب الأنواع (gnmt +/+) .
1. اعداد الخلية والتحلل
ملاحظه: هنا ، هاه-7 (الإنسان خط خليه كبديه) و THLE2 (البشرية الكبد خط الخلية) واستخدمت.
- الحفاظ علي الخلايا في لوحات P100 في وسائل الاعلام النمو القياسية في 37 درجه مئوية في جو مرطب من 5 ٪ CO2-95 ٪ الرطوبة.
- تنمو الخلايا في لوحات P100 الطلاء في كثافة من 1.2 – 1.5 × 106 خلايا لكل طبق من خلال عد الخلايا باستخدام دائره العد الدموي نويباور.
- ثقافة هاه-7 في DMEM تستكمل مع 10 ٪ الجنين البقري المصل (الدم) ، 1 ٪ البنسلين-ستربتوميسين-amphotericin B (PSA) و 1 ٪ الجلوتامين.
- الثقافة THLE2 الخلايا في الاطباق الثقافية قبل المغلفة مع 0.01 ملغ/مل fibronectin ، 0.01 mg/mL الزلال المصل البقري (جيش الصرب البوسنيين) و 0.03 ملغ/مل نوع الكولاجين انا حلت في النمو المتوسطة التي تتكون من الشعب الهوائية ظهاري نمو القاعدية (BEGM) تستكمل عوامل النمو (0.4 ٪ bpe ، 0.1 ٪ الانسولين ، 0.1 ٪ هيدروكورتيزون ، 0.1 ٪ حمض الريتينويك ، 0.1 ٪ ترانسفيرين ، 0.1 ٪ ثلاثي يودوثيرونين ، فضلا عن 10 ٪ من العناصر ، 1 ٪ PSA ، 5 نانوغرام/مل عامل النمو البشرة (egf) و 70 نانوغرام/مل فوسفونوثانولامين.
- في نهاية التجربة ، يستنشق وسائل الاعلام من لوحات ويغسل الخلايا مع 5 مل من العقيمة 1x الفوسفات-مخزنه المالحة (تلفزيوني). الخلايا lyse مباشره علي لوحه وضعت علي الجليد باستخدام 500 μL من تحلل العازلة (50 مم تريس الأس الهيدروجيني 8.5 ، 150 mM كلوريد الصوديوم ، 5 مم أدتا ، 1 ٪ nonidet P-40 (NP40) ، تستكمل مع كامله خاليه من الانزيمات البروتينية المثبطة أدتا و 50 μM PR-619 لكل P100 طبق. باستخدام مكشطه الخلية ، كشط برفق الخلايا قباله الجزء السفلي من لوحه في وسط تحلل.
ملاحظه: التحقق من ان جميع الخلايا قد فصل من لوحه من قبل التفتيش بصريا قاعده لوحه بعد العلاج. - بدلا من ذلك ، حصاد الخلايا عن طريق الترسينه عن طريق شفط وسائل الاعلام الخلية وأضافه 1 مل من 1x (0.05 ٪) تريبسين-أدتا إلى لوحه ، بما فيه الكفاية لتغطيه الخلايا ووضع لوحه في الحاضنة تعيين في 37 درجه مئوية ، 5 ٪ CO2، و 95 ٪ الرطوبة ل ~ 5 دقيقه ضمان جميع الخلايا قد فصل من لوحه. أضف 2 مل من متوسط النمو الذي تم تسخينه مسبقا من أجل إيقاف التريسيسينايشن. الطرد المركزي في 150 g لمده 10 دقيقه ويستنشق supernatant. غسل مع 1x تلفزيوني وأجهزه الطرد المركزي في 150 x ز ل 10 دقيقه. بعد الشفط supernatant ، أضافه 500 μL من تحلل العازلة (50 mM تريس الأس الهيدروجيني 8.5 ، 150 mM كلوريد الصوديوم ، 5 مم أدتا ، 1 ٪ NP40 ، تستكمل مع كامله خاليه من الانزيمات البروتينية المثبطة أدتا و 50 μM PR-619 لكل P100 طبق.
ملاحظه: أضافه ال619 العلاقات الخاصة الحرجة. - الطرد المركزي في 15,500 x ز و 4 درجه مئوية لمده 10 دقيقه. نقل ماده طافي إلى أنبوب آخر وتجاهل بيليه.
ملاحظه: يمكن إيقاف البروتوكول مؤقتا هنا ، والعينات المخزنة في-80 درجه مئوية حتى مزيد من التحليل.
2. اعداد الانسجه والتحلل
- علي التضحية الحيوانية ، وجمع كبد الفار ، وغسل مع الباردة تلفزيوني ، والمفاجئة تجميد فورا في النيتروجين السائل. تخزين العينات − 80 درجه مئوية حتى مزيد من التحليل.
- المجانسة 75 ملغ شظايا من المفاجئة المجمدة/أو كبد الطازجة في 1 مل من الجليد الباردة تحلل العازلة (50 mM تريس الأس الهيدروجيني 8.5 ، 150 mM كلوريد الصوديوم ، 5 مم أدتا ، 1 ٪ NP40 ، تستكمل مع كامله الخالية من الانزيمات البروتينية المثبطة أدتا و 50 μM. تشغيل الخالط في 6500 x دوره في الدقيقة ، 2 × 60 s لكل منهما ، مع وقفه 30 s (انظر جدول المواد).
- الطرد المركزي العينات في الطارد المجهري في 15 ، 500 x ز و 4 درجه مئوية لمده 10 دقيقه. نقل ماده طافي إلى أنبوب آخر وتجاهل بيليه.
- بدلا من ذلك ، تريلوريتي 75 ملغ من الانسجه المجمدة في النيتروجين السائل. ثم استعاده الانسجه في 1 مل من تحلل العازلة.
- الطرد المركزي العينة في الطارد المجهري في 15 ، 500 x ز و 4 درجه مئوية لمده 10 دقيقه. نقل ماده طافي إلى أنبوب آخر وتجاهل بيليه.
ملاحظه: يمكن إيقاف البروتوكول مؤقتا هنا ، والعينات المخزنة في-80 درجه مئوية حتى مزيد من التحليل.
3. ملزم من GST-SUBEs أو GST السيطرة علي الخرز الجلوتاثيون-اجنشا
ملاحظه: التوليف من GST-SUBEs أو GST السيطرة خارج نطاق هذه المخطوطة ويمكن مراجعتها في المؤلفات المنشورة سابقا20. بدلا من ذلك ، GST-والتحكم SUBEs متاحه تجاريا (علي سبيل المثال ، SignalChem).
- اعداد الخرز الجلوتاثيون
- أضافه 1 مل من المياه دي المتاينه إلى 70 ملغ من الخرز الجلوتاثيون المجففة بالتجميد. أعاده تشكيل الخرز بين عشيه وضحيها في 4 درجه مئوية (أو علي الأقل 30 دقيقه في درجه حرارة الغرفة).
- غسل الخرز جيدا بعد تورم (لأزاله اللاكتوز والايثانول التي عاده ما تكون موجودة في الخرز مسحوق مجفف بالتجميد). للقيام بذلك ، يغسل أولا مع 10 مل من المياه دي المتاينه أو تلفزيوني تليها طرد في 300 x ز ل 5 دقيقه في درجه حرارة الغرفة. تنفيذ هذا ثلاث مرات.
- بعد 3 يغسل ، أعاده تعليق الخرز في 1 مل من تلفزيوني للحصول علي 50 ٪ (v/v) الطين.
ملاحظه: وحده التخزين هذه مناسبه لتحليل 10 عينات.
- لكل عينه ، أضافه 100 ميكروغرام من GST-SUBEs أو GST السيطرة (انظر المرجع20) إلى 100 μl من الطين الخرز الجلوتاثيون و 500 ΜL من تلفزيوني.
ملاحظه: الوفرة النسبية للبروتينات SUMOylated من الفائدة يحدد كميه GST-SUBEs المستخدمة للسحب الهبوط. لكل نموذج تجريبي جديد, تحليل الشرط قبل التجربة الفعلية التي الغربية التنقيط المدخلات, ملزمه, وتدفق من خلال (FT) المواد باستخدام المضادة-SUMO2/3 الأضداد أو ضد البروتينات من الفائدة (الكبد كيناز B1 (LKB1). - احتضان جميع GST-SUBEs أو GST السيطرة مع الخرز التي أعدت في 3.2 ، الدورية ببطء في دوار أو الاسطوانه الصغيرة (انظر جدول المواد) في 4 درجه مئوية لمده 2 ساعة علي الأقل (رد فعل ملزم بطيئه).
ملاحظه: أضافه 1 مم ديثيوثريتول (dtt) يحسن الربط GST إلى الخرز الجلوتاثيون. - استعاده الخرز الاغاروزها من قبل طرد في 300 x ز ل 5 دقيقه في درجه حرارة الغرفة. في النهاية ، أعاده تعليق الخرز في الاذاعه التلفزيونية للحصول علي 50 ٪ (v/v) الطين.
ملاحظه: يمكن إيقاف البروتوكول مؤقتا هنا ، والعينات المخزنة في-80 درجه مئوية حتى مزيد من التحليل.
4. GST هدم الفحص
- بعد الخطوة 1.5 ، 2.3 أو 2.5 ، واتخاذ 1/10 من إجمالي حجم (علي سبيل المثال ، 50 μL) وتمييع في نفس الحجم من العازلة 3x الغليان (250 mM تريس-HCl pH 6.8 ، 500 mM β-mercaptoethanol ، 50 ٪ الجلسرين ، 10 ٪ SDS ، بروموفينول الأزرق). يعتبر هذا الكسر كمدخل.
- أضافه 450 μl من محلله الموضحة من الخطوات 1.5 ، 2.3 أو 2.5 إلى 100 μl الجلوتاثيون الخرز الطين. احتضان محلله مع الخرز ، بالتناوب ببطء في 4 درجه مئوية لمده 2 ساعة علي الأقل.
ملاحظه: بدلا من ذلك ، 100-200 ميكروغرام من إجمالي البروتين من الخطوات 1.5 ، 2.3 أو 2.5 (كميا مع المقايسة برادفورد) في حجم إجمالي من 450 μL يمكن استخدامها. - تدور الخرز في الطارد المجهري في 300 x ز لمده 5 دقائق وجمع ماده طافي للتحليل. نقل 1/10 من الحجم الإجمالي (علي سبيل المثال ، 50 μL) في أنبوب منفصل وتمييع في حجم متساو من العازلة 3x الغليان. هذا الكسر هو جزء التدفق من خلال (FT).
- غسل العينة المتبقية ثلاث مرات مع 1 مل الجليد الباردة ، 0.05 ٪ توين 20 ، تدور في 4 درجه مئوية و 300 x ز لمده 1 دقيقه. يستنشق بعناية ضمان عدم وجود بقايا السائل. الخرز تتوافق مع SUBEs منضم (SB) كسر.
- Elute العينة مع 15 μL من 3x الغليان العازلة و 15 μL من المخزن المؤقت تحلل. يسمي هذا "الكسر المنضم".
5. تحديد وتوصيف أهداف السومو بواسطة تحليل لطخه الغربية
- اجراء تحليل لطخه الغربية باستخدام المضادة لSUMO2/3 الأضداد أو اي أجسام أخرى محدده من الاختيار كما هو موضح سابقا22.
6-تحديد وتوصيف البروتينات البروتينية بواسطة قياس الطيف الكتلي
ملاحظه: في حاله تحليل قياس الطيف الكتلي (MS) ، تمت معالجه العينات باستخدام طريقه اعداد العينة بمساعده عامل التصفية (FASP) الموصوفة من قبل Wisniewski et al.23.
- Desalt الببتيدات باستخدام المرحلة غيض C18 الاعمده المجهرية وأعاده تعليقها في 0.1 ٪ حمض الفورميك (FA) قبل تحليل MS.
- قم بتحميل العينات علي نظام LC-MS (انظر جدول المواد) وحللها في ثلاثي النسخ (التقنيات المتماثلة) (الشكل 2 ب).
- الاستمرار في التعرف علي البروتين وحساب الوفرة باستخدام البرامج المرتبطة.
- للتحليل الإحصائي وتوليد خريطة الحرارة ، تحميل البيانات علي منصة ساوس (http://www.perseus.tufts.edu/hopper/). تطبيق معدل اكتشاف زائف المستندة إلى الطفرة (روزفلت)-تصحيح t-اختبار للمقارنة من وفره. واعتبرت البروتينات مع q < 0.05 ونسبه SUBEs/GST أكبر من 2 والمخصب24.
ملاحظه: البروتينات التي تم تحديدها مع اثنين علي الأقل الببتيدات المختلفة تعتبر في التحليل النهائي.
النتائج
تحديد الركيزة SUMOylation محدده في الخزعات ورم الكبد بواسطة التحليل لطخه الغربية
الكبد كيناز B1 (LKB1) وقد ثبت مؤخرا sumoylation ان يكون السائق المهم اونكوغينيك في سرطان الكبد9,25. الفئران الناقصة في الجليسين N-ميثيلترانسفيتاز (gnmt)، والتي غالبا ما يشار اليها باسم gnmt−/−، هو النموذج الذي يتطور تلقائيا سرطان الخلايا الكبدية (سرطان الكبد) ، وهو النوع الأكثر شيوعا للسرطان الكبدي الاولي. وقد استخدمت subes لإثراء وعزل البروتينات sumoylated علي حد سواء في gnmt−/- الفئران مع الفئران سرطان الكبد وأصحابها البرية نوع (gnmt +/+). في الشكل 2a، وشملت التلطيخ S من الكسور الثلاثة المختلفة (المدخلات ، FT ومنضم) التي تم الحصول عليها في الفحص subes السحب إلى أسفل. وصمه عار هو مفيد للسيطرة علي تاثير ضار محتمل علي تحميل البروتينات التي يتم تقييمها من قبل نشف الغربية. يظهر في الشكل 2b تحليل لطخه الغربية من LKB1 باستخدام subes للتقاط الذاتية SUMOylated LKB1. يتم زيادة مستويات LKB1 SUMOylation في أورام الكبد. وفي حاله التحليل الغربي للطخه ، لوحظت الأحمال المتساوية والبروتينات المنقولة من خلال تلطيخ بونسو لكسر المدخلات ولم يتم تغييرها بشكل كبير بعد غسل (تدفق من خلال كسر). وكانت كميه البروتين التي تم التقاطها مع SUBEs اعلي بكثير, لا سيما في الأورام. بدلا من ذلك ، تلطيخ هلام مكرره مع كوماسي blue يمكن ان توفر معلومات مماثله. قد ترتبط البروتينات اللزجة مثل p53 أو الاشكال SUMOylated من بعض البروتينات إلى التحكم GST. لأزاله الخلفية ، استخدم الخرز المنخفض الكثافة ، وقم بالطلاء بالجيش البوسني الصربي ، أو أدمج الغسول الإضافي. ومع ذلك ، قد يؤثر ذلك علي تطبيقات مثل قياس الطيف الكتلي وقد يؤدي إلى فقدان البروتينات المتفاعلة ذات التقارب المنخفض.
توصيف التفاعل السومو في خلايا الكبد البشرية عن طريق تحليل الطيف الكتلي
للتحقيق في قدره الفخ السومو للتفاعل مع البروتينات SUMOylated بشكل طبيعي ، هاه-7 (ورم كبدي البشري) وغير متحولة الكبد ظهاره الإنسان THLE2 خطوط الخلايا واستخدمت. الخطوة الاولي هي التصور من المواد الاجماليه التي تم التقاطها مع SUBEs واستخدام GST كعنصر تحكم سلبي. لهذا الغرض ، يمكننا استخدام بروتوكولات تلطيخ البروتين التقليدية كما هو مبين في الشكل 3a. ثم ، أجرينا تحليل الطيف الكتلي. وتم تحديد ما متوسطه 2268 من البروتينات في عينات Huh7 GST (2339 ، 2297 و 2168 لكل حموله ، علي التوالي) ، في حين تم تحديد البروتينات 2812 في المتوسط في عينه Huh7 SUBEs (2815 ، 2817 و 2806). بعد الطرح ، تم إثراء البروتينات 742 في SUBEs. ومن ناحية أخرى ، تم تحديد ما متوسطه 2497 من البروتينات في عينات GST (2476 ، 2520 و 2495 علي التوالي) و 2763 في الفئات الفرعية (2823 و 2783 و 2684). ومن بين هذه ال577 ، اعتبرت الكميات التي تم إثراءها في عينات SUBEs. تحليل نسخ متماثلة التقنية يسترد خريطة الحرارة المبينة في الشكل 3b، الذي تم حسابه باستخدام الإعدادات الافتراضية المتاحة (المسافة الاقليديه ، متوسط الربط ومعالجتها مسبقا مع ك-الوسائل). وتصور خريطة الحرارة توزيع البروتينات البالغة 100 الأكثر والمخصبة حصرا في كل خط خلوي.
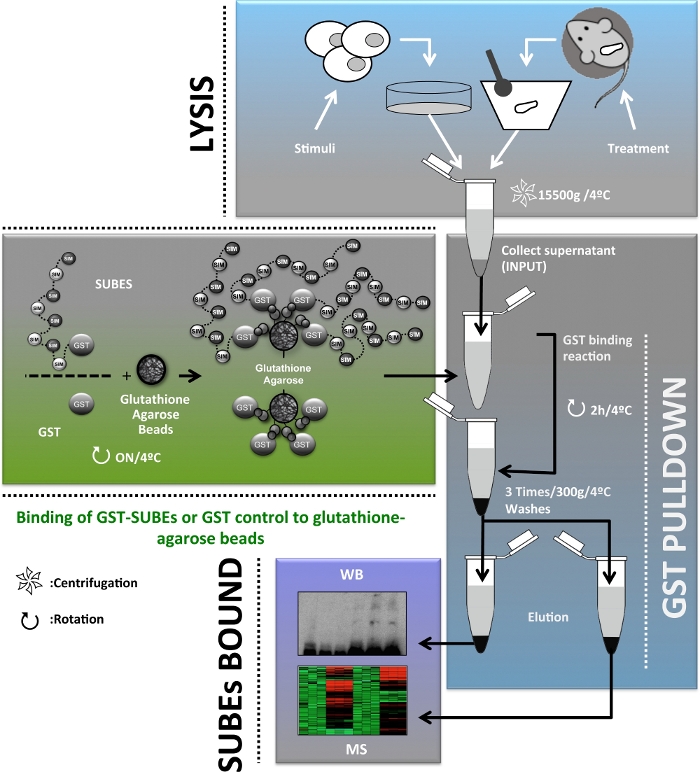
الشكل 1: رسم تخطيطي لمخطط تدفق البروتوكول المستخدم لإثراء وعزل وتحديد وتوصيف البروتين البروتيني SUMOylated في الجسم المجري لدراسة سرطان الكبد. يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.
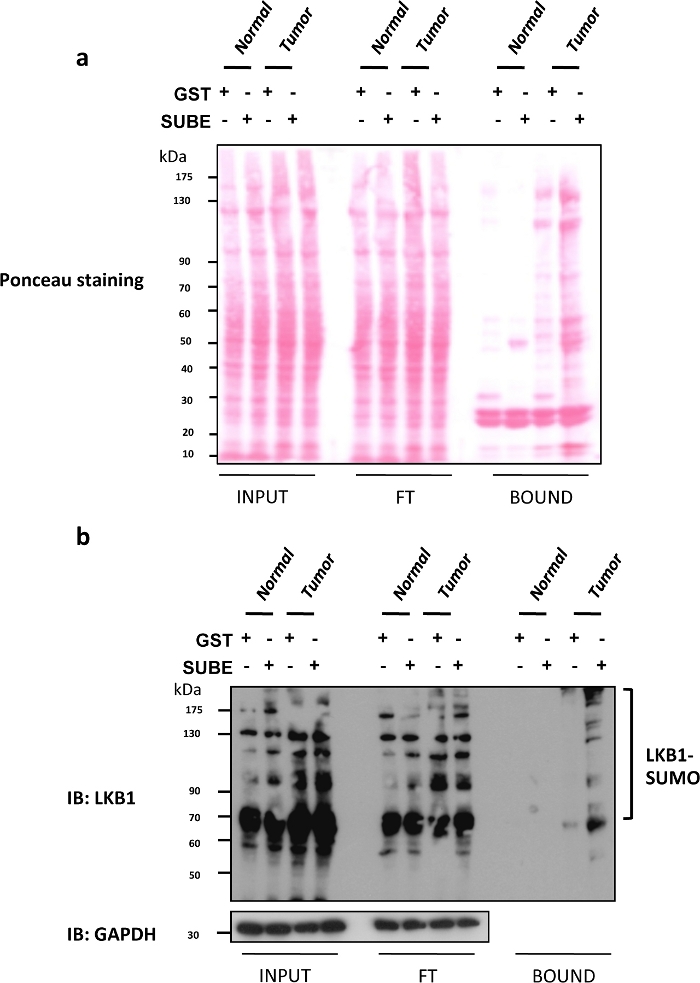
الشكل 2: تعديل LKB1 بواسطة السومو-2 في نماذج الماوس من سرطان الخلايا الكبدية.
(ا) تلوين الأجزاء الثلاثة المختلفة (المدخلات والتدفقات من خلال (FT) والمنضم) التي تم الحصول عليها في الفحص المنسدل subes. (ب) التحليل الغربي للطخه LKB1 باستخدام الكيانات الملزمة السومو (subes) للتقاط LKB1 SUMOylated الذاتية ؛ يتم استخدام جابDH كعنصر تحكم تحميل. يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.
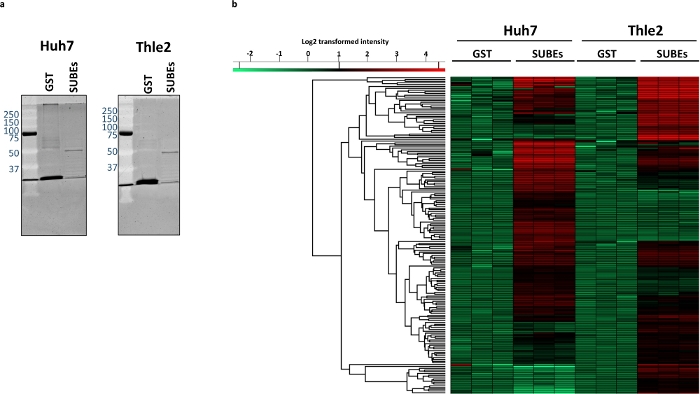
الشكل 3: الاختلافات بين بروتينيه SUMOylated بين التورم هاه-7 وغير متحولة الكبد الظهاريه THLE2 خطوط الخلايا البشرية.
(ا) تلطيخ sypro من مواد البروتين الملتقطة ، مع GST (التحكم السلبي) و subes. (ج) خريطة للحرارة تصور البروتينات المخصبة بشكل مختلف في عينات Huh-7 و THLE2 sube. يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.
Discussion
هنا ، قدمنا وصفا كاملا ومفصلا للمنهجية التي تبلغ عن استخدام SUBEs لإثراء والعزلة وتحديد وتوصيف البروتينات SUMOylated في النماذج المجرية من سرطان الكبد. علي حد سواء في أورام الكبد الفئران وخلايا الكبد البشرية, كنا قادرين علي عزل بشكل صحيح وتحديد البروتينات SUMOylated من الفائدة وأداء توصيف عاليه الانتاجيه من بروتيسوم SUMOylated و interactome. علي الرغم من ان توليف SUBEs خارج نطاق هذه المخطوطة ، لمزيد من المعلومات ينبغي النظر في الإشارات التالية في26. البروتوكول الموصوف سريع وحساس جدا والخطوة الحاسمة في البروتوكول تتضمن استخدام مثبطات الانزيمات (PR-619). في البديل ، مثبطات ايزوبيبتيداز الكيميائية مثل نيم (ن-ايثيل مالايميد) والاكاديميه الكترونيه (2-ايودواسيتاميد) في المخزن المؤقت تحلل يمكن استخدامها ، ومع ذلك ، فقد أظهرت التقارير السابقة ان لبروتوكول subes ، واستخدام PR-619 مفيد مثل الآخر مثبطات تتداخل مع GST ملزمه لحبات الجلوتاثيون20.
SUBEs هي البروتينات المؤتلف التي تتالف من تكرار جنبا إلى جنب من سيمز التالي الاعتراف جزيئات السومو علي البروتينات المعدلة مع زيادة في التقارب العام لركائز السومو. نظرا لخصوصيته العالية وحساسيته ، فان استخدام SUBEs للعزل بروتيسوم SUMOylated مفيد بالنسبة للنهج الأخرى في الأدب مثل الكشف عن طريق الغرب-لطخه من البروتينات SUMOylated معينه باستخدام الأجسام المضادة ضد البروتين من الفائدة أو اللوني النيكل باستخدام مختلف الإصدارات الموسومة histidine من جزيئات السومو. ومع ذلك ، يجب ان يؤخذ في الاعتبار انه كما يتم تنفيذ بروتوكول SUBEs تحت ظروف غير الدفن ، يتم الحفاظ علي التفاعل بين البروتينات SUMOylated وغيرها من البروتينات المتفاعلة. لذلك ، نحصل علي معلومات حول التفاعل السومو بدلا من قائمه فقط من البروتينات الهدف SUMOylated. التالي ، من الضروري اجراء المزيد من التجارب للتاكد من ان البروتين المحدد هو هدف السومو أو عامل تفاعل. القيود الأخرى من SUBEs هو حقيقة ان الفخاخ التحكم GST المستخدمة قادره علي التقاط العديد من البروتينات الخلفية المتعلقة الاكسده. هذه المسالة ذات اهميه خاصه خلال تحليل MS نظرا لحساسية عاليه من هذه التقنية. [أين وردر تو] تجاوزت هذا قصور, [بيوينتيلتد] [سومو]-فخاخ ([بيوسومس]) يتلقى يكون طورت26. هناك قيد آخر من SUBEs يكمن في حقيقة اننا قادرون فقط علي التقاط البروتينات المعدلة من قبل السومو 2 و السومو 3 في حين السومو 1-البروتينات المعدلة لا يمكن ان تكون معزولة.
ويتصل الاهتمام الآخر باستخدام المواد الفرعية بمقدار المادة الاوليه اللازمة للاجراء. مواد البداية المستخدمة للتقاط البروتينات SUMOylated يجب ان تنظر في الظروف التجريبية المختلفة استكشافها. في حين تم الإبلاغ SUMOylation القاعدية في مختلف السياقات الخلوية ، SUMOylation هو عمليه التي يتم المستحثة بقوة بعد ظروف الإجهاد متعددة/المحفزات. في حاله مقارنه العينات غير المعالجة مقابل المعالجة ، يجب التاكد من ان العمود غير مشبع ، ويمكن ملاحظه الاختلافات بين هذه الشروط. في حاله الأنماط الظاهرية الماوس ونحن نحلل ، لم يتم استخدام العلاجات ومستويات SUMOylation القاعدية منخفضه. لهذا السبب ، تم استخدام كميات عاليه من البروتينات. يجب التحكم في مستوي الخلفية باستخدام GST وإذا كان الربط غير محدد مرتفعا ، يجب تقليل مقدار مواد البدء أو وقت الربط. تحليل الكسر FT يمكن ان يكون مؤشرا علي كفاءه التقاط حتى لو كانت هذه الفخاخ تفضل البروتينات بولي SUMOylated واستنفاد الكلي لا ينبغي ان يكون متوقعا ، والحد من Sumoylated الكلي هو في العام لوحظ جيدا عندما كفاءه التقاط هو الامثل.
وأخيرا ، والتطبيق الآخر من التكنولوجيا SUBEs يشمل الجمع بين التكنولوجيا SUBEs مع الوقت الحقيقي سطح Plasmon الرنين (موارد البرنامج الخاصة) السماح للتفاعل في الوقت الحقيقي مع البروتينات SUMOylated من مقتطفات الخلية27. أيضا ، في الاونه الاخيره ، تم تطوير الفخاخ السومو الحيوية (bioSUBEs) مع ميزه للحد من الخلفية المرتبطة بعلامات أكبر ، علي سبيل المثال ، خلال تحليل الطيف الكتلي26. الاضافه إلى ذلك ، يمكن استخدام النسخة bioSUBE للكشف عن البروتينات SUMOylated في الخلايا الحية من قبل فلوري باستخدام العقديات الموسومة مع الاصباغ الفلورية متميزة مع الاستفادة من الربط العقديات إلى البيوتين. أيضا ، يمكن النظر في طرق الكشف والتقدير الكمي للبروتينات SUMOylated مع كل من GST و bioSUBEs الإصدارات مثل تم القيام به مع الكيانات ملزمه اوبيكويتين (أنابيب)21.
وعموما ، فان استخدام SUBEs للعزل وتوصيف بروتيسوم SUMOylated ذات الصلة في سرطان الكبد هو طريقه سريعة وحساسة توفير معلومات واسعه علي دور لا يزال غير معروف إلى حد ما من مسار Sumoylated في سرطان الكبد.
Disclosures
الدكتور مارتينيز-شابار ينصح بالاستشارات المحدودة.
Acknowledgements
وكان هذا العمل مدعوما بمنح من المعهد الوطني للسرطان ، وفرنسا ، ومنحه الانكا PLBIO16-251 (PLBIO16) ، والمنحة CONACyT-(المكسيك) 0280365 وبرنامج الاتحاد ل[اكيتني] ، فرنسا (M.S.R.). أيضا, المعاهد القومية للصحة (الولايات الامريكيه وزاره الصحة والخدمات الانسانيه)-R01AR001576-11A1, Gobierno فاسكو-Departamento de Salud 2013111114 (إلى M.L.M.), ELKARTEK 2016, Departamento de الصناعية ديل Gobierno فاسكو, MINECO: SAF2017-87301-R تكامل en el خطه Estatal de الدراسة العلمية والبحثية والابتكارية 2013-2016 cofinanciado con Fondos FEDER, BIOEF (المؤسسة الباسكية للابتكار والبحوث الصحية): ايكوت ماراتويا BIO15/CA/014; معهد السلام كارلوس الثالث: PIE14/00031 ، الخطة المتكاملة للبحوث العلمية والعلمية والابتكار 2013-2016 cofinanciado con Fondos FEDER (إلى M.L.M.) ، رابطه الاسبانيه كونترا el Cáncer (t. c. D, m. m-C), جائزه دانيال Alagille من EASL (إلى t. c. D) ، مؤسسه Científica de la رابطه الاسبانيه كونترا السرطان (مؤسسه AECC العلمية) ورم نادر يدعو 2017 (إلى م. م) ، برنامج مؤسسه لا كايكسا (إلى م. م). نشكر شركه MINECO علي اعتماد التميز في سيفيرو اوتشوا لشركه CIC بيوثون (سيف-2016-0644).
Materials
| Name | Company | Catalog Number | Comments |
| (Gnmt−/−)/ (Gnmt+/+) mice | CIC bioGUNE | ||
| 0.5% Trypsin-EDTA | Life Technologies | 15400-054 | |
| BEBM | Lonza/Clonetics Corporation | cc-3171 | |
| BEGM Bullet Kit | Lonza/Clonetics Corporation | CC3170 | |
| Bromophenol blue | Sigma | 115-39-9 | |
| BSA | Sigma | A4503 | |
| C18 microcolumns | Millipore | Z720070 | |
| Collagen type I | Santa Cruz Biotechnology | sc-136157 | |
| Complete tablets EDTA-free | Roche | 4693132001 | |
| DMEM | Life Technologies | A14431-01 | |
| DTT | Sigma | 43815 | |
| EDTA | Sigma | E6758 | |
| EGF | Sigma | e9644 | |
| FBS | Life Technologies | 10270 | |
| Fibronectin | Life Technologies | 33010018 | |
| Glutamine | Life Technologies | 25030-024 | |
| Glutathione agarose beads | Sigma | G4510 | |
| Glycerol | Sigma | G5516 | |
| GST-Control | SignalChem | G52-30H | |
| GST-SUBEs | SignalChem | S291-340G | |
| Huh7 | CLS (Cell Lines Service) | 300156 | https://clsgmbh.de/ |
| IAA (2-Iodoacetamide) | Merck | L58046844 | |
| LKB1 antibody | Santa Cruz Biotechnology | sc-32245 | |
| Mini LabRoller Rotator | LABNET | H5500 | https://www.labnetinternational.com |
| NaCl | Merck | 106404041000 | |
| nanoElute | BRUKER | https://www.bruker.com/ | |
| NEM (N-Ethylmaleimide) | Sigma | E3876 | |
| NP40 | Fluka | 74385 | |
| PBS | Life Technologies | 14190-094 | |
| Peaks software | Bioinformatics Solutions Inc. | http://www.bioinfor.com/ | |
| Phosphoetanolamine | Sigma | P0503 | |
| Ponceau S solution | Sigma | P7170 | |
| PR-619 | Merck | 662141 | |
| Precellys 24 | Bertin Technologies | P000669-PR240-A | |
| PSA | Life Technologies | 151-40-122 | |
| PSG | Life Technologies | 10378-016 | |
| SDS | Sigma | L3771 | |
| SUMO2/3 antibody | Abcam | Ab3742 | |
| THLE-2 | ATCC | ATCC CRL-2706 | http://www.lgcstandards-atcc.org |
| timsTOF Pro with PASEF mass spectrometer | BRUKER | https://www.bruker.com/ | |
| β-mercaptoethanol | Sigma | 60-24-2 |
References
- Forner, A., Llovet, J. M., Bruix, J. Hepatocellular carcinoma. Lancet. 379 (9822), 1245-1255 (2012).
- Gerbes, A., et al. Gut roundtable meeting paper: selected recent advances in hepatocellular carcinoma. Gut. , (2017).
- Avila, M. A., Berasain, C., Sangro, B., Prieto, J. New therapies for hepatocellular carcinoma. Oncogene. 25 (27), 3866-3884 (2006).
- Grotenbreg, G., Ploegh, H. Chemical biology: dressed-up proteins. Nature. 446 (7139), 993-995 (2007).
- Hendriks, I. A., Vertegaal, A. C. A comprehensive compilation of SUMO proteomics. Nature Reviews in Molecular Cell Biology. 17 (9), 581-595 (2016).
- Seeler, J. S., Dejean, A. SUMO and the robustness of cancer. Nature Reviews Cancer. 17 (3), 184-197 (2017).
- Tomasi, M. L., et al. S-adenosyl methionine regulates ubiquitin-conjugating enzyme 9 protein expression and sumoylation in murine liver and human cancers. Hepatology. 56 (3), 982-993 (2012).
- Li, J., et al. Cbx4 governs HIF-1alpha to potentiate angiogenesis of hepatocellular carcinoma by its SUMO E3 ligase activity. Cancer Cell. 25 (1), 118-131 (2014).
- Zubiete-Franco, I., et al. SUMOylation regulates LKB1 localization and its oncogenic activity in liver cancer. EBioMedicine. 40, 406-421 (2019).
- Sarge, K. D., Park-Sarge, O. K. SUMO and its role in human diseases. Internationa Review of Cell and Molecular Biology. 288, 167-183 (2011).
- Da Silva-Ferrada, E., Lopitz-Otsoa, F., Lang, V., Rodriguez, M. S., Matthiesen, R. Strategies to Identify Recognition Signals and Targets of SUMOylation. Biochemical Research International. , 875148 (2012).
- Liang, Y. C., et al. SUMO5, a Novel Poly-SUMO Isoform, Regulates PML Nuclear Bodies. Science Reports. 6, 26509 (2016).
- Mikolajczyk, J., et al. Small ubiquitin-related modifier (SUMO)-specific proteases: profiling the specificities and activities of human SENPs. Journal of Biologucal Chemistry. 282 (36), 26217-26224 (2007).
- Hilgarth, R. S., Sarge, K. D. Detection of sumoylated proteins. Methods in Molecular Biology. 301, 329-338 (2005).
- Vertegaal, A. C., et al. A proteomic study of SUMO-2 target proteins. Journal of Biological Chemistry. 279 (32), 33791-33798 (2004).
- Bruderer, R., et al. Purification and identification of endogenous polySUMO conjugates. EMBO Reports. 12 (2), 142-148 (2011).
- Becker, J., et al. Detecting endogenous SUMO targets in mammalian cells and tissues. Nature Structural Molecular Biology. 20 (4), 525-531 (2013).
- Barysch, S. V., Dittner, C., Flotho, A., Becker, J., Melchior, F. Identification and analysis of endogenous SUMO1 and SUMO2/3 targets in mammalian cells and tissues using monoclonal antibodies. Nature Protocols. 9 (4), 896-909 (2014).
- Hendriks, I. A., et al. Site-specific characterization of endogenous SUMOylation across species and organs. Nature Communications. 9 (1), 2456 (2018).
- Da Silva-Ferrada, E., et al. Analysis of SUMOylated proteins using SUMO-traps. Science Reports. 3, 1690 (2013).
- Hjerpe, R., et al. Efficient protection and isolation of ubiquitylated proteins using tandem ubiquitin-binding entities. EMBO Reports. 10 (11), 1250-1258 (2009).
- Embade, N., et al. Murine double minute 2 regulates Hu antigen R stability in human liver and colon cancer through NEDDylation. Hepatology. 55 (4), 1237-1248 (2012).
- Wisniewski, J. R., Zougman, A., Nagaraj, N., Mann, M. Universal sample preparation method for proteome analysis. Nature Methods. 6 (5), 359-362 (2009).
- Meier, F., et al. Online Parallel Accumulation-Serial Fragmentation (PASEF) with a Novel Trapped Ion Mobility Mass Spectrometer. Molecular and Cellular Proteomics. 17 (12), 2534-2545 (2018).
- Ritho, J., Arold, S. T., Yeh, E. T. A Critical SUMO1 Modification of LKB1 Regulates AMPK Activity during Energy Stress. Cell Reports. 12 (5), 734-742 (2015).
- Lang, V., Da Silva-Ferrada, E., Barrio, R., Sutherland, J. D., Rodriguez, M. S. Using Biotinylated SUMO-Traps to Analyze SUMOylated Proteins. Methods in Molecular Biology. 1475, 109-121 (2016).
- Xolalpa, W., Rodriguez, M. S., England, P. Real-Time Surface Plasmon Resonance (SPR) for the Analysis of Interactions Between SUMO Traps and Mono- or PolySUMO Moieties. Methods in Molecular Biology. 1475, 99-107 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved