A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تجميع وتوصيف Micelles مجمع البولي كتروليت
In This Article
Summary
نحن نقدم بروتوكولات وبيانات تمثيلية لتصميم وتجميع وتوصيف micelles المعقدة polyelectrolyte ، والجسيمات النانوية الأساسية قذيفة التي شكلتها polyelectrolytes وهيدروفيلية مشحونة كتلة copolymers.
Abstract
الخلايا المتعددة الكهربية المعقدة (PCMs) ، الجسيمات النانوية الأساسية shell التي شكلتها التجميع الذاتي للبوليمرات المشحونة في محلول مائي ، توفر منصة قوية لاستكشاف فيزياء التفاعلات البولي الكهرروليتية وتوفر أيضًا حلًا واعدًا لـ المشكلة الملحة لتقديم oligonucleotides العلاجية في الجسم الحي. وقد ثبت أن تطوير علاقات بنية تنبؤية وممتلكات لمركبات الـ PCMs أمر صعب، ويرجع ذلك جزئياً إلى وجود مصائد حركية قوية أثناء التجميع الذاتي للجسيمات النانوية. تناقش هذه المقالة معايير اختيار البوليمرات لبناء PCM وتوفر بروتوكولات تستند إلى طلاء الملح الذي يمكّن تجميع الجسيمات النانوية القابلة للتكرار والمنخفضة التشتت. كما نناقش توصيف PCM باستخدام تشتت الضوء، وتشتت الأشعة السينية بزاوية صغيرة، والمجهر الإلكتروني.
Introduction
عندما يتم خلط polyelectrolytes مشحونة على العكس في محلول مائي، الانتروبيا كسب من الإفراج عن عداداتها يسبب demixing من الحل في مرحلة مكثفة البوليمر الغنية وسوبرناتانت البوليمر المنضب1،2،3،4،5،وهي ظاهرة تعرف باسم مجمع البولي كترولكروليت. إذا تم اقتران كتلة مائية محايدة إلى واحد أو كليهما من polyelectrolytes، يحدث فصل المرحلة النانوية بدلاً من ذلك(الشكل 1A). ويشار إلى الجسيمات النانوية الأساسية التي تم تجميعها ذاتيًا الناتجة بشكل مختلف باسم micelles المعقدة متعددة الكهرليلايت (PCMs) ، أو الميسيلات المعقدة البولية ، أو مجمعات الأيونومير ، أو micelles coacervate-core عن طريق القياس على micellization السطحي ، على الرغم من أن جميع مكونات النظام هيدروفيلية6،7. قدرة PCM على تغليف الجزيئات المائية مثل البروتينات والأحماض النووية ، وكذلك القابلية الواسعة التي تقدمها بنية حامل copolymer كتلة يجعلها مرشحةجذابة لتقديم الجزيئات العلاجية في الجسم الفي48،9،10،11،12،13.
إن توصيل الأحماض النووية العلاجية إلى الأهداف الخلوية هو تحدٍ مهم بشكل خاص، وهو تحدٍ يوفر له PCMs العديد من المزايا. الأحماض النووية العلاجية (الحمض النووي الوراثي، مرنا، وoligonucleotides مثل siRNA) لديها إمكانات هائلة لتحسين صحة الإنسان، ولكن يجب التغلب على العديد من الحواجز البيولوجية والمادية لتحقيق أن المحتملة14،15،16. يتم تدهور الأحماض النووية العارية عن طريق المصل وnucleases الخلوية ، ويتم تطهيرها بسرعة من الدورة الدموية ، وشحنها السلبي القوي يجعل من الصعب عليها اختراق أغشية الخلايا دون مساعدة. وتشمل النُهج الحالية للتغلب على هذه الحواجز تعديلات كيميائية مكلفة لمنع الضرر الناجم عن النويلاوات و/أو التغليف في مختلف الجسيمات النانوية الدهنية التي يتم تجميعها عن طريق التفاعلات الكارهة للماء15و17و18. في حين أثبتت هذه الأساليب فعاليتها في الحقن المحلي واستهداف الكبد ، فإن الاستخدام النظامي يمثل قيودًا كبيرة على السمية ، والمناعة ، والتوزيع الحيوي المحدود16. وعلى النقيض من ذلك، تستخدم أجهزة الـPCM الشحنة السلبية للأحماض النووية لتكثيفها داخل النواة المنفصلة عن المرحلة، في حين توفر الهالة المحايدة حاجزًا ستريكيًا ضد التدهور بالإضافة إلى منصة لدمج الليغاند لتعزيز الاستهداف أو الاستيعاب11،19. في المختبر والدراسات الحيوانية أظهرت أن PCMs يمكن أن توفر على نحو فعال مختلف الحمولات الحمض النووي20،21،22،23،24، ولكن نقاط الضعف في قدرتنا على التنبؤ خصائص PCM مثل الحجم والشكل والاستقرار من خصائص البوليمرات المكونة قد أعاقت اعتمادها على نطاق أوسع.
وقد بدأ العمل الأخير من قبل مجموعتنا وغيرها في هذا المجال لمعالجة هذه المشكلة من خلال تطوير هيكل الملكية، وفي بعض الحالات هيكل- الملكية وظيفة العلاقات لPCMs شكلت من الأحماض النووية والبوليمرات المختلفة محايدة الموجبة7،25،26،27. وهناك موضوعان متسقان انبثقا عن هذه الدراسات هما أهمية وضع بروتوكولات قابلة للرقابة بشكل جيد وقابلة للتكرار لتجميع الـ PCM والاستفادة من استخدام تقنيات متعددة لتوصيف الجسيمات النانوية الناتجة. البولي كهرتوليتس، ولا سيما تلك ذات الكثافة عالية الشحن مثل الأحماض النووية، تتفاعل مع بعضها البعض بقوة جدا، ويبدو أن تصبح بسهولة المحاصرين حركيا عند خلط، مما أدى إلى استعدادات PCM التي هي حساسة للغاية للاختلافات الصغيرة في الإجراء وعرض تعدد التشتت عالية وتكرار الفقراء من دفعة إلى دفعة. وقد ثبت أيضاً أن الـ PCMs تعتمد مجموعة واسعة من الأشكال والأحجام اعتماداً على تكوينات المستوى الذري لمكوناتها، والتقاط هذا التنوع بأي تقنية توصيف فردية أمر صعب للغاية، لا سيما وأن بعض التقنيات الشائعة مثل تشتت الضوء الديناميكي (DLS) تتطلب افتراضات حول شكل الجسيمات لتفسيرها.
في هذه المقالة، نناقش تصميم المواد واختيار PCMs، مع التركيز على oligonucleos وcopolymers ثنائي كتلة محايدة الموجبة. ثم نصف بروتوكول الصلب الملح الذي يستخدم تركيزات عالية من الملح تليها غسيل الكلى بطيئة لتجنب الملائمة الحركية أثناء تجميع PCM. يتم خلط polyelectrolytes في ظروف الملح العالية حيث يتم فحص عوامل الجذب الكهروستاتيكية ، ثم يتم خفض تركيز الملح ببطء للسماح للبوليكتروليتاتيات بالاستقرار في تكويناتها الأكثر ملاءمة بنشاط ، على غرار عملية التبريد البطيء للصلب الحراري. باستخدام هذا البروتوكول، ونحن قادرون بانتظام على تحقيق تعدد التشتت منخفضة بشكل استثنائي وتكرار عالية لPCMs oligonucleotide7،26. وأخيراً، فإننا نصف كيف يمكن استخدام أربع تقنيات قياس منفصلة لتوصيف الـ PCMs عبر مجموعة واسعة جداً من مقاييس الطول، من المورفولوجيا الخارجية إلى الهيكل الداخلي: DLS، تشتت الضوء متعدد الزوايا (MALS)، بزاوية صغيرة بتشتت الأشعة السينية (SAXS)، والمجهر الإلكتروني للإرسال (TEM). ونأمل أن تمكن هذه البروتوكولات المزيد من الباحثين من استكشاف قدرات هذه الجسيمات النانوية المثيرة للاهتمام على نحو فعال.
اختيار البوليمر والتحضير
تتأثر خصائص PCM بشدة بالخصائص الفيزيائية والكيميائية للبوليمرات المكونة ، مما يجعل اختيار البوليمر خطوة حاسمة في عملية التصميم. أكثر تتميز copolymers كتلة لPCMs الحمض النووي هي ديبل خطي مثل بولي (ليسين) بولي (جلايكول الإيثيلين) (pLys-PEG)، ولكن يمكن تشكيل PCMs بين polyelectrolytes ومجموعة متنوعة من البوليمرات محايدة المائية المشحونة، والتي يمكن إنشاؤها بطريقة إنتاجية عالية28. اختيار المجموعة المشحونة يؤثر بشدة على استقرار الاقتران الأيون وشكل micelles26، وقد ثبت حجم PCM لزيادة مع طول كتلة مشحونة5،7،26 (الشكل 2)، مما يسمح خصائص PCM ليتم ضبطها لمتطلبات التطبيق المطلوب. بالنسبة للكتل الخطية ، وجدنا أن الكتلة المشحونة يجب أن تحتوي على 10 رسوم على الأقل وأن تكون مشحونة بشدة في درجة الحموضة المطلوبة. كتل أطول مشحونة قد تعزز تشكيل PCM مع oligonucleotides مثل siRNA، والتي يصعب تعقيدها مع كتل أقصر21. لقد لاحظنا بنجاح تشكيل PCM مع أطوال كتلة تصل إلى 200، ويصف الأدب البوليمرات أطول. يتوفر المزيد من المرونة في اختيار الكتل المحايدة24، ولكن التجربة أظهرت أن الكتل المحايدة القصيرة جدًا تؤدي إلى التجميع بدلاً من تكوين الجسيمات النانوية ، وأن الحد الأدنى من الطول المحايد يزيد مع طول الكتلة المشحون. بالنسبة لـ pLys-PEG ، يلزم وجود PEG MW بما لا يقل عن 3000-5000 لأطوال pLys أقل من ~ 50 ، ويلزم أطوال أطول حيث يتم زيادة الكتلة المشحونة بشكل أكبر. زيادة طول كتلة محايدة النتائج في زيادة حجم PCM، وخاصة سمك قذيفة، وذلك بسبب ازدحام الرّسيقيّة من البوليمرات المحايدة.
تقدم هذه المخطوطة بروتوكولًا لإعداد PCMs من pLys-PEG عالي النقاء والقلة من الكمية المعروفة ، ولكن يجب أن تكون قابلة للتكيف بسهولة مع الأنظمة الأخرى أيضًا. لقد اختبرنا بنجاح مع العديد من البولي ببتيدات مشحونة، بما في ذلك البوليارجينين وحمض البوليغلوتاميك، فضلا عن العديد من البولي ترولاتيس الاصطناعية، مثل حمض البولي أكريليك وبولي (الفينيلبنزيلاميوم). كما وصف ناحضّر PCMs مع نسبة stoichiometric من رسوم البوليكتروليت، ولكن هذا يتم تعديلها بسهولة. نجد أنه من الأسهل للعمل في وحدات تركيز المسؤول (c.c.)، والتي تستوعب أيضا بشكل طبيعي البوليمرات التي ليست مشحونة بالكامل. إذا لم يكن أي من البوليمرين جيد التوصيف ، فيجب الحرص على تحديد أطوال / كتل البوليمر بدقة وضمان عدم وجود الملح الزائد بعد ما هو مطلوب لتحييد الشحن عن طريق غسيل الكلى ، على سبيل المثال. كما ينبغي حساب وجود أي ماء محتفظ به عند حساب التركيزات. ويمكن قياس تركيز الحمض النووي بشكل ملائم عن طريق الامتصاص عند 260 نانومتر، وينبغي النظر في وجود أو عدم وجود الفوسفات الطرفي عند حساب c.c.
عند استخدام oligonucleotides والبوليانيونات، والدولة التهجين والتركيب الكيميائي تساعد على تحديد الميل للتجميع الذاتي وخصائص PCM الناتجة5،7،26. ومن شأن تحسين هذه الهياكل، ضمن متطلبات الفعالية البيولوجية إذا ما استخدم جهاز الـ PCMs للإيصال، أن يزيد من احتمال تشكيل الهياكل المطلوبة. أدوات مفيدة لتحليل التهجين وتشمل وظائف MATLAB للأحماض النووية، NUPACK29،وIDT OligoAnalyzer. نوصي بتحليل تسلسل المرشح لفهم قوة الربط إلى 1) نفسها في تشكيل دبوس الشعر؛ 2) نسخة أخرى من نفس التسلسل (الذاتي الخافت)؛ و 3) إلى oligonucleotides الأخرى الموجودة في النظام. كما يمكن حساب درجات حرارة ذوبان الحمض النووي والحمض النووي الريبي لتسلسل معين باستخدام طريقة أقرب جار30،31. التميّز الحراري للأحماض النووية (الخطوة 2.3) يُحطّم أي بنية ثانوية متبقية في النوكليوتيدات الفردية ويعزز طي التوازن.
PCM توصيف وتحليل
تتوفر مجموعة واسعة من التقنيات لتوصيف الجسيمات النانوية ، بما في ذلك تشتت الضوء الساكن والديناميكي ، وتشتت الزاوية الصغيرة للإلكترونات أو النيوترونات ، والمجهر الإلكتروني. في هذه المقالة، نقدم بروتوكولات لتقنيتين مبعثرتين للضوء، وبزاوية صغيرة بتشتت الأشعة السينية، وتقنيتين مجهريتين إلكترونيتين.
يقيس DLS الارتباط التلقائي للتقلبات الزمنية في كثافة التشتت في زاوية واحدة من الحركة البراونية للعينة. تركيب هذه البيانات يمكن أن توفر نصف قطر هاروميودينامية وpolydispersity للخلايا الكروية(الشكل 3). يقيس تشتت الضوء متعدد الزوايا (MALS) كثافة التشتت الثابتة في العديد من الزوايا. يصف هذا الاعتماد الزاوي شكل الجسيمات النانوية ولكنه يقتصر على مقاييس الطول التي تزيد عن ~ 50 نانومتر للضوء المرئي ، مما يحد من فعاليته للجسيمات النانوية الصغيرة. وتستند كلتا التقنيتين إلى عدم تطابق المؤشر الانكساري وتصف في المقام الأول الأبعاد الخارجية للجسيمات النانوية.
زاوية صغيرة بزاوية الأشعة السينية (SAXS) يستخدم الأشعة السينية كما التحقيق التشتت، وأقصر الطول الموجي يسمح القياسات على مدى ~ 0.1-100 نانومتر. تركيب كثافة التشتت الملاحظة مقابل الزاوية (التي يتم التعبير عنها تقليدياً كـ نقل الزخم q)يوفر معلومات عن مورفولوجيا PCM (أي الحجم والشكل) وكذلك البنية الداخلية. إذا كانت معايرة الكثافة المطلقة متوفرة ، وإذا كان من الممكن استقراء كثافة التشتت إلى زاوية صفر ، يمكن أيضًا تقدير كتلة PCM ورقم التجميع32، مما يجعل SAXS طريقة متعددة الاستخدامات وقيمة للغاية. زاوية صغيرة النيوترون التشتت (SANS) حساسة على مدى مماثل من جداول الطول ولكن لا يتوفر إلا في المرافق المتخصصة ولن تناقش صراحة في هذه المادة33،34،35.
شهدت السنوات الأخيرة ظهور أدوات SAXS على مقاعد البدلاء ، لكننا نجد أن مصادر السنكروترون أكثر ملاءمة لتوصيف PCM ، حيث تسمح كثافتها الأعلى بجمع البيانات بشكل أسرع لهذه العينات منخفضة التباين. نحن نقدم بروتوكولًا موجزًا للحصول على بيانات PCM SAXS في Beamline 12-ID-B في مصدر الفوتون المتقدم (مختبر أرغون الوطني ، الولايات المتحدة الأمريكية) من منظور المستخدم. وينبغي أن ينطبق هذا البروتوكول على معظم مصادر السنكروترون، ولكن يوصى بشدة بالتشاور مع الموظفين المحليين قبل اقتراح تجربة ما. كما نقدم بروتوكول الحد من البيانات والتحليل باستخدام Irena36، مجموعة مجانية من وحدات الماكرو مكتوبة لايغور برو. Irena يتضمن مجموعة متنوعة من عوامل النموذج لنمذجة بيانات SAXS ويسمح لبناء نماذج متعددة المكونات التي هي قادرة على وصف ملف تعريف تشتت معقدة من PCMs (انظر النتائج التمثيلية، الشكل 4). إيرينا لديها أيضا وثائق شاملة والدروس المتاحة على الانترنت. قبل محاولة الإجراءات أدناه، نوصي الإلمام بهذه، ولا سيما البرنامج التعليمي "نمذجة بيانات SAXS مع اثنين من السكان التشتت الرئيسي".
والضرر الإشعاعي مصدر قلق لتناثر الأشعة السينية، ولكن يمكن استخدام عدة تدابير للتقليل إلى أدنى حد ممكن. على وجه الخصوص، نوصي باستخدام إعداد خلية تدفق مع مضخة حقنة وعينة PCM تتدفق أثناء الحصول على البيانات، بدلا ً من الشعيرات الدموية مختومة. هذا أيضا يبسط إلى حد كبير الطرح الخلفية. كما نقترح أخذ التعرضات المتعددة للعينة المتدفقة بدلاً من عينة أطول من أجل الحد من التدفق الذي يراه أي حجم واحد من العينة والسماح بمقارنة بيانات التعرض لتحديد أي ضرر.
وعلى النقيض من تقنيات التشتت، التي تتطلب عموماً تركيباً لتفسيرها، يوفر المجهر الإلكتروني المنقول (TEM) صورة بصرية فضائية حقيقية للجسيمات النانوية عن طريق تمرير شعاع إلكترون عبر العينة وإبراز صورة على شاشة تلألؤ(الشكل 5). نقدم بروتوكولات لتقنيات TEM اثنين في هذه المقالة. Cryo TEM يجمد عينات micelle في طبقة رقيقة من الجليد الزجاجي، والحفاظ على تشكيل الهيكلية مع الحد الأدنى من المواد الغريبة، الأمثل للmicelles ≤ ~ 10-100 نانومتر في دائرة نصف قطرها. السلبية وصمة عار تيم يستخدم ملح المعادن الثقيلة (على سبيل المثال، اليورانيوم) لإحاطة العينة بعد أن تم تجفيفها على سطح الشبكة. سوف البقع الكثيفة مبعثر الإلكترونات أكثر من العينة، مضيفا التباين وإنتاج صورة سلبية للعينة. يوصى بـ Cryo TEM للحصول على صور عالية الجودة. ومع ذلك، فهي أكثر تكلفة، وتستغرق وقتا طويلا، وقد لا توفر تباينا كافيا. عندما يكون هذا مصدر قلق، يجب استخدام عينات ملطخة سلبية. وترد أمثلة لكل منها في الشكل 5.
كل من هذه التقنيات تقارير عن جوانب مختلفة قليلا من الجسيمات النانوية، مع نقاط القوة والقيود المختلفة. إن تشتت الضوء متاح بسهولة، وغالباً ما يكون النهج الأسرع، ولكن له قيود كبيرة في الحجم ودقة الشكل. يمكن أن توفر SAXS معلومات على نطاق واسع من مقاييس الطول بمعدل إنتاجية مرتفع بشكل معقول ، ولكنها تتطلب معدات متخصصة للحصول على البيانات ، بالإضافة إلى النمذجة لتفسيرها. صور TEM واضحة للتفسير ولكن يمكن أن تكون محدودة في المقابل وهي بطبيعتها إنتاجية منخفضة. وقد أظهرت تجربتنا أن استخدام تقنيات متعددة للتوصيف يزيد بشكل كبير من المعلومات التي يمكن الحصول عليها حول خصائص PCM ويبسط تفسير مجموعات البيانات التي تم الحصول عليها من كل واحد فقط. على سبيل المثال، يقوم SAXS و TEM بفحص النواة الكثيفة لـ PCM في المقام الأول، بينما يقوم الضوء بتشتيت التقارير حول الأبعاد الإجمالية للجسيمات النانوية. وبالتالي ، فإن الجمع بينهما يسمح بقياس كل من الحجم الأساسي والحجم التاجي. يمكن أن توفر قدرة TEM على الحصول على صور فضائية حقيقية بيانات الحقيقة الأرضية لتمكين اختيار عوامل الشكل المناسبة لنمذجة بيانات SAXS التي قد تكون غامضة. توضح هذه المقالة بروتوكولات لكافة التقنيات الأربعة، ويتم إعطاء عملية مثال لاستخدامها لتوصيف عينة غير معروفة في قسم المناقشة.
Protocol
1. إعداد المواد
- تزن بها بوليمرات diblock lyophilized وإضافة ما يصل الى الماء ما يقرب من حجم المطلوبة لمحلول الأسهم من التركيز النهائي 10 ملغ / مل. دوامة في السرعة القصوى لمدة 2 دقيقة.
- Sonicate لمدة 5 دقيقة. قد تتطلب diblocks طويلة جدا سونيكيشن إضافية. يجب أن يظهر حل المخزون شفافًا ومتجانسًا تمامًا.
- ضبط درجة الحموضة إلى 7.4 باستخدام NaOH أو HCl حسب الحاجة. إضافة الماء إلى وحدة التخزين النهائية. حلول pLys-PEG مستقرة إلى حد ما ولكن يجب تبريدها للتخزين على المدى الطويل ويجب فحص درجة الحموضة قبل الاستخدام. Lyophilization هو أفضل من تجميد.
- إعادة تعليق oligonucleotide (ق) في تركيز المخزون المطلوب، وعادة 2-5 MM تركيز الجزيئيل لأطوال من 50 NT أو أقل. دوامة بدقة لضمان حل كامل.
- حساب تركيزات المولي باستخدام الوزن الجزيئي أو الطول كما هو موضح في المقدمة.
- حساب تركيزات شحنة الضرس (c.c.)، حيث
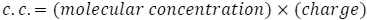
تهمة البولي كروليتهو عدد من مونومرات مشحونة، في حين أن تهمة الحمض النووي هو عدد من القواعد ناقص 1، على افتراض عدم الفوسفور. ضع في اعتبارك أن الحمض النووي المزدوج الذي تقطعت به السبل سيكون له ضعف عدد الشحنات لكل جزيء مقارنة بالحمض النووي أحادي المدى.
- إنشاء مخزون مخفف في 20 mM c.c. لكل بوليمر.
2. الحمض النووي Polyelectrolyte إعداد Micelle
- في أنبوب طرد مركزي صغير 1.5 مل، اخلط ما يلي إلى حجم إجمالي قدره 280 ميكرولتر:
- 200 ميكرولتر من المياه الخالية من النوكلو(مياه فائقة النقاء لـ PCMs لا تحتوي على أحماض نووية).
- 40 ميكرولتر من 10x الفوسفات العازلة المالحة (PBS، 137 mM كلوريد الصوديوم، 10 mM الفوسفات، درجة الحموضة 7.4 عندما المخفف إلى 1x) أو غيرها من العازلة المناسبة37.
- 40 ميكرولتر من 20 م. م. ج. أوليغونوكليوتيد. بالنسبة لثنائي الانتقافي لموجات القلة، أضف 20 ميكرولتر من كل حبلا ً عند 20 م. ج.
- احتضان محلول oligonucleotide لمدة 5 دقيقة في 70 درجة مئوية. إذا كانت درجة حرارة الذوبان المحسوبة للأوليغونوكليوتيدات أعلى ، فيجب زيادة درجة الحرارة وفقًا لذلك. لاحظ أن الحمض النووي الريبي سوف تتحلل في درجات حرارة مرتفعة، لذلك يجب أن لا تكون هذه الخطوة أطول إذا كان هذا أو غيرها من المكونات الحساسة موجودة.
- بارد لمدة 15 دقيقة. إضافة 40 ميكرولتر من 20 mM c.c. diblock، ثم دوامة على الفور لمدة 20 ث في السرعة القصوى. احتضان 5 دقيقة في درجة حرارة الغرفة (RT).
- أداء الصلب الملح.
- أضف 80 ميكرولتر من 5 م كلوريد الصوديوم لتركيز نهائي قدره 1 م NaCl وحجم نهائي قدره 400 ميكرولتر. دوامة لمدة 10 s في السرعة القصوى.
- احتضان لمدة 10 دقيقة في درجة حرارة الغرفة، ثم تحميل في خراطيش غسيل الكلى. لاحظ أن القطع اتحدان الوزن الجزيئي المذكورة يتم تحديدها للبروتينات الكروية ولن تكون دقيقة بالنسبة للبوليمرات الخطية. نجد أن خرطوشة MWCO 2k يتجنب فقدان العينة ويوفر أيضا تغييرات تدريجية في القوة الأيونية.
- إعداد حمامات غسيل الكلى.
- حساب حجم حمام غسيل الكلى اللازمة:
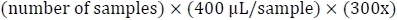
- مزيج 10x PBS (أو غيرها من العازلة المطلوبة)، 5 M NaCl، والمياه فائقة النقاء للحصول على حل نهائي من 1x PBS و 0.5M NaCl، فضلا عن حلين من 1x PBS.
- حساب حجم حمام غسيل الكلى اللازمة:
- تحميل خراطيش غسيل الكلى.
- خراطيش التسمية مع علامة دائمة. نقع خراطيش في المخزن المؤقت لمدة 2 دقيقة على الأقل لترطيب الأغشية.
- إزالة الغطاء عن طريق التواء عكس عقارب الساعة. تحميل عينة باستخدام هلام تحميل تلميح ماصة. إزالة الهواء الزائد عن طريق الضغط بلطف الأغشية. استبدال الغطاء.
- وضع خراطيش في 1x PBS، 0.5 M كلوريد الصوديوم حمام غسيل الكلى. يجب أن تطفو الخراطيش ، مع تعرض كلا الغشاءين للحمام. يمكن استخدام الرغوة يطفو إذا لزم الأمر.
- غسيل الكلي
- احتضان لمدة 24 ساعة التحريك ببطء مع شريط ضجة المغناطيسي.
- نقل خراطيش إلى حمام جديد من 1x PBS أو غيرها من العازلة العمل المطلوب. احتضان لمدة 24 ساعة، واثارة ببطء مع شريط اثارة المغناطيسي. كرر هذه الخطوة.
- استرداد العينة.
- إزالة خراطيش من الحمام. إزالة الغطاء واسترداد عينة باستخدام هلام تحميل تلميح ماصة. لاحظ أن الحجم المسترد قد يكون أعلى من 400 ميكرولتر الأولية بسبب تورم الغشاء. سجل حجم المستردة إذا تم تخفيف طفيف هو مصدر قلق.
- ضع العينة في أنبوب طرد مركزي صغير نظيف 1.5 مل. وينبغي أن تكون الـ PCMs المعدة بهذه الطريقة مستقرة لعدة أشهر عند تبريدها، شريطة تجنب التلوث بالنُوكليس.
3. تشتت الضوء الديناميكي
- ولضمان الظروف الخالية من الغبار، ينبغي تصفية المخازن المؤقتة بعناية (تمت تصفيتها 3x من خلال حقنة 0.22 ميكرومتر أو فلتر فراغ) وتنظيف الأواني الزجاجية بدقة بين العينات. ومن المهم أيضا التأكد من أن العينة قد وصلت إلى التوازن الحراري قبل إجراء القياس.
- تمييع عينة PCM إلى 0.2 mM c.c. (10x إذا كان استخدام البروتوكول المذكور أعلاه) مع المخزن المؤقت العمل المطلوب والتحميل في كوفيت مناسبة. نحن نستخدم كفيت صغيرة الحجم ، والتي تتطلب ~ 200 ميكرولتر من العينة بعد التخفيف.
- تعيين DLS موقف كاشف إلى 90 درجة.
- ضبط قوة الليزر و / أو المهلون حتى معدل العد هو 100،000-200،000 التهم في الثانية (cps) ، إذا كان ذلك ممكنا. ويمكن استخدام معدلات العد المنخفضة التي لا تُستخدم إلى 10 كبس، ولكن قد يلزم تمديد أوقات القياس للحصول على إحصاءات جيدة (الخطوة 4-1). وينبغي تجنب معدلات العد الأعلى، لأن التشتت المتعدد سيُربك القياس.
- الحصول على بيانات لمدة دقيقة واحدة. يجب أن يكون معدل العد ثابتًا طوال وقت الاستحواذ؛ وإذا لم يكن الأمر كذلك، فإن هذا يشير إلى أن بعض مكونات العينة أو الصك لم يتم بعد معادلة.
- فحص بيانات الارتباط التلقائي. يجب أن يكون خط الأساس لفترة طويلة مسطحًا جدًا ، ويجب أن يكون منحنى الارتباط التلقائي سلسًا ، مع الحد الأدنى من التشتت ، كما هو موضح في الشكل 3A. ويشير الانجراف الأساسي إلى انعدام التوازن، ويمكن تحسين الضوضاء في البيانات عن طريق الحصول على مزيد من البيانات.
- تناسب وظيفة الارتباط التلقائي.
- استخدام REPES38،39 لأداء التحول لابلاس معكوس ة انتظام لتقديم توزيع أوقات الاسترخاء ومعامل الانتشار ، D. ثم يقوم هذا الأسلوب بحساب نصف القطر الهيدروديناميكي ، Rh، باستخدام معادلة ستوكس آينشتاين:
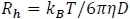
ويبين الشكل 1باء تمثيل Rh والشكل 3B يبين نتيجة REPES. - بدلاً من ذلك، استخدم أساليب أخرى، بما في ذلك CONTIN40أو41 (خوارزمية تسوية بديلة) أو غير سالبة أقل المربعات المناسبة (NNLS). النتائج المتسقة من طرق التركيب المتعددة هي توقيع على بيانات عالية الجودة. لاحظ أن التحليل المتراكم (قياسي في العديد من الأدوات) يعطي قيمًا غير فيزيائية لتوزيعات الحجم/الطول متعددة الوسائط.
- استخدام REPES38،39 لأداء التحول لابلاس معكوس ة انتظام لتقديم توزيع أوقات الاسترخاء ومعامل الانتشار ، D. ثم يقوم هذا الأسلوب بحساب نصف القطر الهيدروديناميكي ، Rh، باستخدام معادلة ستوكس آينشتاين:
4. متعددة الزاوية الضوء التشتت
ملاحظة: يمكن قياس شدة تشتت الضوء مقابل الزاوية على مجموعة متنوعة من الأدوات. لقد حصلنا على نتائج جيدة باستخدام كل من الأدوات القائمة على مقياس الزهو والأدوات متعددة الكاشفين ، التي تعمل في وضع الدفعي.
- ضبط تركيز PCM وكثافة الإضاءة لتوفير إشارة كافية / الضوضاء مقابل عينة عازلة فقط في جميع الزوايا دون تشبع أي كاشف. ويمكن اختبار هذا الأخير عن طريق إعداد عينات في مختلف عوامل التخفيف والتحقق من خطية الكثافة مقابل التركيز (على افتراض الحد الأدنى من التفاعل بين الـ PCMs).
- سجل معدل تشتت الضوء من 15 درجة إلى 135 درجة لمدة دقيقة واحدة لكل زاوية. إذا تم معادلة العينة والأداة بشكل صحيح، فإن معدل التشتت سيكون ثابتًا خلال وقت القياس.
- رسم معدل التشتت تطبيع، وأناالخطيئة (ο)، مقابل س،حيث أنا معدل التشتت. س هو متجه التشتت (نقل زخم الفوتون) كما هو محدد بواسطة
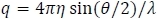
حيث = مؤشر الانكسار المذيب، ο = زاوية القياس، و = الطول الموجي لمصدر الضوء. ويبين الشكل 4 قطعة من كثافة تشتت MALS.
5. زاوية صغيرة بأشعة X مبعثر
- الحصول على البيانات
- إعداد عينات PCM كما هو موضح أعلاه في تركيز تهمة 2 m لPCMs oligonucleoل لتشتت وافرة فوق الخلفية. وبالنسبة لمركبات الـPCMs التي تفتقر إلى الذرات الثقيلة (مثل الفوسفور في الأحماض النووية)، قد تكون هناك حاجة إلى تركيزات أعلى. يمكن تقدير كثافات الكثافة الطولية المتناثرة باستخدام الآلات الحاسبة مثل SASSIE42.
- من أجل تقليل الضرر الإشعاعي عن طريق مسح الجذور الحرة، إضافة الجلسرين من مركزة (على سبيل المثال، 50٪) حل الأسهم بحيث يحتوي حل micelle على 1٪ (v/v) الجلسرين. لاحظ أن الجلسرين الأنيق لزج للغاية ويصعب قياسه بدقة. يوصى بشدة بالتخفيف بالماء أو العازلة.
- إعداد كمية كبيرة من المخزن المؤقت العمل مع 1٪ الجلسرين للاستخدام كشاشة خلفية.
- إعداد جهاز خلية تدفق محددة شعاع ومعايرة كاشف. يستخدم البروتوكول الشعيرات الدموية الكوارتزية قطرها 3 مم متصلة بمضخة حقنة يتم التحكم فيها بالكمبيوتر بقطر صغير ، وأنابيب البولي إيثيلين ذات الطول الأدنى. هناك حاجة إلى حجم الحد الأدنى من ~ 140 ميكرولتر لكل عينة مع هذا الإعداد.
- تحديد معلمات التعرض للعينة. سيختلف التعرض الأمثل استنادًا إلى شدة الحزمة ، وحساسية الكاشف ، والتركيز ، وقوة التشتت ، والتعرض للتلف للعينة ، ولكن الهدف هو تعريض العينة إلى الحد الأدنى من التدفق المطلوب للحصول على كثافة تشتت كافية على نطاق الفائدة q.
- بالنسبة لـ oligonucleotide/pLys-PEG PCMs، فإن التعرض 30x 0.2 s بمعدل تكرار 1 هرتز ينتج جودة بيانات جيدة مع تلف ضئيل ملموس. بالنسبة للعينات الجديدة، قد يكون الإجراء التالي مفيداً:
- إعداد عينات PCM على مجموعة من التركيزات (على سبيل المثال، 10-10،000 ميكرومتر مئوي).
- بدءاً من تركيز متوسط، PCM بديل وعينات المخزن المؤقت فقط مع أوقات التعرض متفاوتة. انظر أدناه للحصول على البيانات وإجراءات التخفيض. يجب أن تحتوي إشارة العينة على إحصائيات جيدة (خطأ إحصائي صغير ، أو اختلاف سلس عبر q). إذا كانت الإحصاءات ضعيفة، يمكن زيادة وقت التعرض.
- وينبغي أيضاً تمييز إشارة العينة بوضوح عن الخلفية على نطاق الفائدة س. حساب ورسم (إشارة-الخلفية)/نسبة الخلفية مقابل س لتحديد نسبة الإشارة/الخلفية. إذا كانت نسبة الإشارة/الخلفية منخفضة، يجب زيادة تركيز العينة.
- تحقق من أن كثافة التشتت (التي يتم تطبيعها إلى التركيز) مستقلة عن تركيز العينة عن طريق الحصول على بيانات بتركيزات أعلى وأقل، وقياس وقت التعرض إذا لزم الأمر. وستكون التفاعلات بين الجسيمات (السبب الأكثر احتمالاً للاعتماد على التركيز) أكثر وضوحاً في النطاق المنخفض لـ Q.
- الحصول على بيانات لعينات PCM والخلفية (أي، المخزن المؤقت مع الجلسرين).
- قم بتشغيل مضخة الحقنة لتحريك العينة عبر الشعيرات الدموية. إما حركة ثنائية الاتجاه أو مرة واحدة من خلال الحركة مقبولة، ولكن ينبغي توخي الحذر لعزل كل عينة (على سبيل المثال، عن طريق إدخال فقاعة الهواء بين العينات). ويمكن استعادة العينات ويمكن إعادة استخدامها إذا لم يُشاهد أي ضرر إشعاعي.
- بمجرد بدء التدفق ، تشغيل التعرض بالأشعة السينية وبرنامج الحصول على البيانات الموضح أعلاه. وينبغي توخي الحذر من أن التعرض شعاع ينتهي قبل تدفق السوائل لا.
- بعد كل عينة، قم بإجراء متوسط السمتوال ورسم الملفات الشخصية 1D (أي الكثافة مقابل س)لكل تعرض معاً. وينبغي أن تكون متطابقة في الخطأ الإحصائي. تغيير الإشارة مع مرور الوقت يمكن أن تشير إلى الضرر الإشعاعي.
- قد تشير الملامح الشاذة المعزولة إلى وجود فقاعات صغيرة. إذا لوحظت فقاعات في كثير من الأحيان، وانخفاض معدل التدفق قد يساعد.
- متوسط ملفات تعريف التشتت 1D.
- الحصول على بيانات لعينات المخزن المؤقت فقط بشكل متكرر (مرة واحدة لكل 4-5 عينات PCM) ومقارنة هذه مع مرور الوقت. وتشير زيادة الإشارة من عينات المخزن المؤقت فقط إلى أن الشعيرات الدموية قد تكون ملوثة بالعينة التالفة بالإشعاع.
- عندما يلاحظ التلوث، اغسل الشعيرات الدموية بالتبييض، وفكر في تقليل وقت التعرض إذا أمكن.
- الحد من البيانات وتحليلها باستخدام إيرينا
- استيراد micelle والخلفية مجموعات البيانات ASCII(SAS / بيانات استيراد وتصدير / استيراد بيانات ASCII SAS).
- طرح تشتت الخلفية من بيانات العينة. عادة، تظهر أعلى قيم q (على سبيل المثال q > 0.5) تشتت غير متماسك من المذيبات التي تهيمن على الإشارة. إن قياس بيانات الخلفية لمطابقة بيانات العينة عبر هذا النطاق س يزيل أي اختلاف بسبب اختلاف كثافة الحزمة وتركيز العينة.
- رسم العينة والخلفية معا على مقياس سجل. تحقق من كثافة مسطحة في س عالية(SAS / معالجة البيانات / معالجة البيانات I). حساب نسبة العينة/الخلفية(Data1/Data 2)،رسم على مقياس سجل خطي، والتحقق من المتقاربة عاليةq.
- حساب متوسط (عينة/ خلفية) نسبة عبر هذا النطاق س (استخدام ماكرو مخصص أو نسخ / لصق في جدول بيانات من مستعرض البيانات).
- باستخدام الماكرو معالجة البيانات، قم بقياس الخلفية (على سبيل المثال، تعديل البيانات 2)باستخدام النسبة المحسوبة أعلاه ورسم نسبة الإشارة المطروحة في الخلفية إلى الخلفية مقابل q ([Data1-Data2]/Data2)، والتحقق من أنه الآن يتدرج إلى الصفر عند qعالية . تسجيل هذه النسبة؛ وينبغي أن يكون < 1-2٪ بعيدا عن 1.0 لكل عينة.
- رسم إشارة طرح الخلفية(Data1-Data2)مقابل q وحفظ البيانات مع اسم جديد. لا تقم بالكتابة فوق البيانات الأصلية.
- إذا لم تتوفر بيانات عاليةq، فاستخدم عامل قياس 1 للطرح في الخلفية، ولكن كن على علم بأنه قد يتم إدخال عدم الدقة في نطاقات q حيث تكون نسبة الإشارة/الخلفية صغيرة.
- فتح الماكرو النمذجة ،(SAS / النمذجة)، ثم تحميل ورسم البيانات المطروحة في الخلفية(بيانات cntrls / إضافة البيانات). لا تقم بالمقياس في هذا الماكرو.
- أولاً، العثور على نموذج تقريبي للسطح الخارجي للPCM (حجم/شكل micelle):
- في بيانات cntrls، حدد نطاق q منخفض إلى معتدل (على سبيل المثال ، ~ 0.003Å-1 < q < ~ 0.1Å-1). إذا كانت التذبذبات مرئية، قم بتضمينها.
- اختر عامل نموذج مناسب للبيانات. المنحدر عند س منخفضة يدل على شكل الجسيمات النانوية، والتي يمكن أيضا التحقق من خلال TEM و / أو MALS. استخدام شولتز زيم spheroid(س0)،اسطوانة(q-1)،أو اسطوانة مرنة(q-2)نماذج. Irena يوفر أدوات لتركيب قوانين الطاقة(SAS / أدوات الدعم للمؤامرات والجداول).
- في نموذج cntrls، حدد أول عدد من التشتت(1P)وتأكد من أنه الوحيد في الاستخدام (حدد استخدام؟
- حدد الحجم المذهول للطراز واختر نوع التوزيع المطلوب وعامل النموذج. تعيين المعلمات الأولية للبحث عن طريق إدخال القيم في حقول المقياس والحجم المتوسط والعرض وانقر فوق حساب الطراز لرسم عامل النموذج الناتج.
ملاحظة: يمكن إضافة عامل نموذج الأسطوانة المرنة كعامل نموذج المستخدم وتنزيله من https://usaxs.xray.aps.anl.gov/software/irena. تتوافق المعلمات 1 و2 مع طول الأسطوانة وطول كوهن، على التوالي. - بمجرد العثور على معلمات معقولة، انقر فوق احتواء الطراز لتنفيذ مربعات أقل خطية تناسب البيانات. نموذج توزيع الحجم يعطي متوسط نصف قطر وعرض.
لحساب استخدام تعدد التشتت (PDI)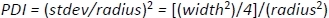
كما هو الحال مع أي إجراء تركيب غير خطي ، قد يكون من الضروري ضبط نطاق البيانات(منطقة q) ومعلمات البدء من أجل الحصول على تناسب مستقر ومعقول جسديا. - مرة واحدة يتم الحصول على نوبة معقولة، حفظه(مخزن في دفتر الملاحظات/مخزن في مجلد).
- بعد ذلك ، نموذج تشتت البوليمرات الفردية داخل نواة PCM. ويمكن التقاط ذلك من خلال نموذج قانون السلطة (على سبيل المثال،q-2 للسلاسل المثالية،q-5/3 للسلاسل المتورمة، إلخ). إيرينا ينفذ هذا من خلال نموذج Beaucage43:
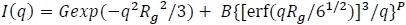
حيث P هو قانون السلطة وG و B هي prefactors.- ضبط عناصر تحكم البيانات لتغطية نطاق q بأكمله وإعادة رسم النموذج(حساب الطراز). عادة، سوف يلاحظ التشتت الزائد في نطاق Q المتوسط إلى العالي (على سبيل المثال، q > ~ 0.1Å-1).
- استخدم عناصر تحكم البيانات لتحديد نطاق q حيث يتم ملاحظة التشتت الزائد (>10x نموذج عامل النموذج).
- إضافة عدد التشتت الثاني(2P)وتأكد من أنه هو الوحيد في الاستخدام (إلغاء تحديد استخدام؟ ل1P).
- حدد المستوى الموحد للطراز. B و P هي المعلمات ذات الصلة. استخدم أدوات دعم التخطيط أو Fit P/B بين ماكرو csrs للحصول على تخمين أولي لهذه المعلمات، وضبط عوامل Guinier G و Rg لضمان عدم توقع النموذج للتشتت المفرط في qالمنخفض .
- أما بالنسبة لعامل النموذج، قم بإجراء تناسب غير خطي وسجل المعلمات والطراز.
- بعد ذلك ، إذا كانت ذروة الحيود موجودة ، كما هو الحال في الشكل 4، أضف نموذجًا ثالثًا لذروة الحيود في نطاق الفائدة q (q = ~ 0.22 Å-1 في هذه الحالة).
- بمجرد الحصول على قيم الملاءمة التقريبية للمجموعات الفردية المتناثرة، قم بتشغيل الثلاثة معًا (حدد الاستخدام؟ لكل منها) وتحسين الملاءمة المجمعة.
- تأكد من أن كل قيمة تبقى معقولة مادياً. يجب أن تكون نتيجة هذا الإجراء نموذجمركب يصف بيانات SAXS بشكل جيد عبر مجموعة كبيرة من مقاييس الحجم ، كما هو موضح في الشكل 4. حفظ احتواء باستخدام زر مخزن في مجلد لتخزين داخل ايغور.
6. المجهر الإلكتروني انتقال (TEM)
- Cryo TEM
- حدد الشبكة. نوصي فيلم دعم الكربون holey على شبكة TEM القياسية أو الكربون اللاسي كبديل. في كلتا الحالتين، فإن الثقوب بين الكربون توفر منطقة تصوير من الجليد الزجاجي النقي وعينة وليس الفيلم.
- ضع جانب الكربون الشبكي في جهاز تفريغ توهج على شريحة زجاجية نظيفة. التفاف الشريحة في فيلم المختبر يمكن أن تساعد في التعامل مع الشبكة. تجنب لمس وسط الشبكة مع ملاقط وقرصة دائما بالقرب من حافة الشبكة.
- كشف الشبكة لمدة 30 s.
- إعداد الروبوت التزجيج لترسب العينة.
- تعيين إلى الرطوبة 100٪ وRT وإضافة ورق النشاف. إعداد الحمامات السائلة الإيثان والنيتروجين السائل في قاعدة الروبوت. انظر الدروس عبر الإنترنت وأشرطة الفيديو للحصول على مساعدة إضافية مع إعداد الروبوت التزجيج واستخدامها.
- تمييع عينة 5x.
- باستخدام ملاقط العمل السلبية المقدمة مع الروبوت التزجيج، والتقاط الشبكة، ثم نعلق الملاقط إلى الروبوت ونقل الملاقط في الغرفة.
- أثناء وجوده في الروبوت، أضف 4 ميكرولتر من العينة إلى الجانب الكربوني من الشبكة باستخدام ماصة من خلال الثقب في جانب الجهاز.
- الاحتضان لمدة 4 دقيقة.
- باستخدام الروبوت، لطخة 3-5 ق مع ورقة تصفية.
- الروبوت التزجيج سوف يغرق الشبكة في الإيثان السائل.
- إزالة الملاقط ونقل الشبكة إلى النيتروجين السائل وإلى حاوية تخزين، والتي ينبغي أن تكون أيضا تحت النيتروجين السائل. هذه العملية بإصلاح العينة في طبقة رقيقة من الجليد الزجاجي. تقليل الوقت الذي تقضيه الشبكة من الإيثان السائل أو النيتروجين السائل خلال هذه الخطوة.
- تبريد حامل عينة التبريد باستخدام النيتروجين السائل. الحفاظ على ديوار وخزان كامل.
- عندما تكون جاهزًا للصورة، قم بتحميل الشبكة على حامل عينة التبريد. إبقاء العينة تحت النيتروجين السائل أو لفترة وجيزة في بخار النيتروجين الباردة للغاية فقط فوق سطح السائل.
- صورة الشبكة في 120 كيلوفولت بين 75kx و 150kx في الجليد رقيقة وسميكة ، وذلك لأن micelles مختلفة الحجم قد تفضل سماكة الجليد معينة.
- الحد من التعرض لشعاع لتجنب ذوبان الجليد وإتلاف العينة. لا تركز مباشرة حيث التخطيط للصورة؛ التركيز في مكان قريب. كشف منطقة الاهتمام فقط أثناء التقاط صورة.
- تأكد من التمييز بين قطرات الإيثان السائلة من العينة عند عرض الصور (انظر الشكل 5).
- TEM التقليدية باستخدام تلطيخ سلبي
- إعداد وصمة عار.
- اغلي ~ 10 مل من الماء فائق النقاء. تزن 0.1 غرام فورماتي أورانال (UFo) في أنبوب مخروطي 15 مل.
- أضف 5 مل من الماء الساخن إلى مسحوق UFo للحصول على محلول 2٪. إغلاق بإحكام والتفاف في رقائق الألومنيوم لمنع الضوء. كما يشيع استخدام بقعة خلات أورانال بنسبة 1٪.
- دوامة أو يهز بقوة لمدة 5 دقيقة. ربط الأنبوب إلى دوامة سوف تساعد. تصفية من خلال مرشح حقنة 0.2 ميكرومتر في أنبوب مخروطي نظيف.
- اسمحوا تبرد 10 دقيقة إلى RT. إضافة 25 ميكرولتر من 5M NaOH ودوامة على الفور لمدة 2 دقيقة.
- بدلا من ذلك، تجميد 200 ميكرولتر aliquots من 2٪ UFo. عندما تكون جاهزة للاستخدام، إذابة aliquot، إضافة 1 ميكرولتر من 5 M NaOH، ودوامة لمدة 2 دقيقة.
- إبقاء وصمة عار ملفوفة في احباط أو بعيدا عن الضوء.
- تمييع عينة 10x في 1x PBS (أو المخزن المؤقت المطلوب).
- حدد الشبكة. نوصي فيلم دعم الكربون على شبكات النحاس. الجانب الأكثر قتامة ولمعان من الشبكة هو الجانب المغلف بالكربون حيث سيتم إيداع العينة وتلطيخها.
- ضع جانب الكربون الشبكي في جهاز تفريغ توهج على شريحة زجاجية نظيفة. انظر الخطوة 6.1.2.
- كشف الشبكة لمدة 30 s.
- التقاط الشبكة مع الجانب الكربون لا تزال تواجه وعقد مع ملاقط العمل السلبي من حافة الشبكة لمنع تمزيق منطقة التصوير في المركز. تعيين ملاقط مع الشبكة لا تزال عقدت الجانب الكربون يلا.
- تطبيق قطرة 4 ميكرولتر من العينة إلى أعلى (الجانب الكربوني) من الشبكة مع ماصة.
- احتضان 4 دقيقة.
- مع ~ 1 دقيقة اليسار، ماصة 10 ميكرولتر و20 ميكرولتر قطرة من محلول UFo على قطعة من فيلم مختبر نظيفة.
- استخدم ورق التصفية لفتيل العينة من حافة الشبكة (الاتصال العمودي) لتجنب أي اتصال مع سطح التصوير.
- باستخدام ملاقط (لا يزال عقد الشبكة)، على الفور مكان الجانب عينة من الشبكة إلى أسفل على 10 μL UFo قطرات، ثم الفتيل على الفور قبالة السائل (خطوة غسل). من المهم عدم السماح للشبكة الجافة، لذلك لا تتوقف بين الخطوات.
- بطريقة مماثلة، وتطبيق 20 μL UFo قطرات على الشبكة. عقد الشبكة على UFo لمدة 40 s. ويك السائل قبالة والسماح للشبكة الجافة.
- صورة الشبكة الجافة في 120 كيلوفولت بين 20،000x و 100،000x.
- تأكد من التخلص بشكل صحيح من جميع المواد الملوثة بـ UFo باستخدام خدمة السلامة الخاصة بالمؤسسة للنفايات المشعة.
- عند الضرورة ، يمكن تطبيق تحسين السطوع / التباين وفلتر متوسط على صور TEM في ImageJ لتقليل ضوضاء الخلفية. وينبغي أن تتم المعالجة بعد التقديم بصورة موحدة، فقط للصور التي لا تستخدم في القياسات الكمية مثل الكثافة، وينبغي الإبلاغ عنها دائماً.
- إعداد وصمة عار.
النتائج
من أجل توضيح أساليب التوصيف المذكورة أعلاه ، نظهر نتائج نموذجية لـ PCMs تجميعها من oligonucleotides وكتلة copolymers من أطوال وكيمياء مختلفة(الشكل 1). يقدم الشكل 2 مثالاً على كيفية تنوع حجم PCM الأساسي (كما هو محدد من SAXS و TEM، الشكل 4 والشكل 5)مع...
Discussion
كما ذكر أعلاه، تتم كتابة البروتوكولات المعروضة هنا مع التركيز على oligonucleotides كعنصر البولياني وpLys-PEG كما copolymer كتلة محايدة الموجبة، ولكن لدينا اختبارلهم مع مجموعة متنوعة من البوليمرات، مثل بولي (حمض الاكريليك)، polyglutamate، وPEG-بولي (الفينيل بنزيل ثلاثي ميثيل اليوم)، ونعتقد أنها سوف تكون قابلة لل...
Disclosures
وليس لدى صاحبي البلاغ ما يكشفان عنه.
Acknowledgements
نشكر غريفين وتيرا لافوا من مرفق توصيف المادة الناعمة ومرفق المجهر الإلكتروني المتقدم، على التوالي، في جامعة شيكاغو. كما نشكر شياو بينغ زو وسوينكي سيفيرت من مصدر الفوتون المتقدم في مختبر أرغون الوطني ومركز NIST لتصميم المواد الهرمية (CHiMaD) للدعم. ونشكر جيف تينغ ومايكل لويكهايد على إسهاماتهما في هذا العمل.
Materials
| Name | Company | Catalog Number | Comments |
| 70 mm circle filter paper | Whatman | 1001-070 | Filter paper for wicking during grid prep |
| Carbon Film TEM grid | Electron Microscopy Sciences | CF200-Cu | TEM grid |
| DAWN | Wyatt Technology | DAWN | MALS instrument |
| DNA oligonucleotide | Integrated DNA Nanotechnologies Inc | Custom oligonucleotide | |
| Lacey Carbon TEM grid | Electron Microscopy Sciences | LC200-Cu | TEM grid |
| Methoxy-poly(ethylene glycol)-block-poly(l-lysine hydrochloride) PEG5k - PLKC50 | Alamanda Polymers Inc | mPEG5K-b-PLKC50 | Example block copolymer |
| Milli-Q | Millipore Sigma | Ultrapure water | |
| NanoDrop | Thermo Scientific | For measuring nucleic acid concentration | |
| negative-action tweezers | Dumont | N7 | Tweezers for grid preparation |
| Parafilm "M" | Bemis Company Inc | PM996 | Laboratory film |
| Quantifoil Holey Carbon TEM grid | Electron Microscopy Sciences | Q210CR1.3 | TEM grid |
| Research Goniometer and Laser Light Scattering System | Brookhaven Instruments | BI-200SM | DLS/MALS instrument |
| Slide-A-Lyzer G2 2K 0.5 mL | Thermo Scientific Pierce Protein Biology | 87723 | Dialysis cartridge |
| small volume cuvette | Brookhaven Instruments | BI-SVC | Cuvette for DLS/MALS |
| Solarus 950 Advanced Plasma System | Gatan | Solarus 950 | Plasma system for TEM grids |
| Talos TEM | FEI | Talos | TEM used for cryo samples |
| Tecnai Spirit TEM | FEI | Spirit | TEM used for dry samples |
| Uranyl Formate | SPI-Chem | 16984-59-1 | For negative staining samples for TEM |
| Vitrobot | FEI | Vitrobot | Vitrification robot for cryo grid preparation |
References
- Spruijt, E., Westphal, A. H., Borst, J. W., Cohen Stuart, M. A., van der Gucht, J. Binodal compositions of polyelectrolyte complexes. Macromolecules. 43 (15), 6476-6484 (2010).
- van der Gucht, J., Spruijt, E., Lemmers, M., Cohen Stuart, M. A. Polyelectrolyte complexes: bulk phases and colloidal systems. Journal of Colloid and Interface Science. 361 (2), 407-422 (2011).
- Priftis, D., Laugel, N., Tirrell, M. Thermodynamic characterization of polypeptide complex coacervation. Langmuir. 28 (45), 15947-15957 (2012).
- Fu, J., Schlenoff, J. B. Driving Forces for Oppositely Charged Polyion Association in Aqueous Solutions: Enthalpic, Entropic, but Not Electrostatic. Journal of the American Chemical Society. 138 (3), 980-990 (2016).
- Vieregg, J. R., et al. Oligonucleotide-Peptide Complexes: Phase Control by Hybridization. Journal of the American Chemical Society. 140 (5), 1632-1638 (2018).
- Voets, I. K., de Keizer, A., Cohen Stuart, M. A. Complex coacervate core micelles. Advances in Colloid and Interface Science. 147-148, 300-318 (2009).
- Lueckheide, M., Vieregg, J. R., Bologna, A. J., Leon, L., Tirrell, M. V. Structure-Property Relationships of Oligonucleotide Polyelectrolyte Complex Micelles. Nano Letters. 18 (11), 7111-7117 (2018).
- De Kruif, C. G., Weinbreck, F., de Vries, R. Complex coacervation of proteins and anionic polysaccharides. Current Opinion in Colloid & Interface Science. 9 (5), 340-349 (2004).
- Vieregg, J. R., Tang, T. Y. D. Polynucleotides in cellular mimics: Coacervates and lipid vesicles. Current Opinion in Colloid & Interface Science. 26, 50-57 (2016).
- Marciel, A. B., Chung, E. J., Brettmann, B. K., Leon, L. Bulk and nanoscale polypeptide based polyelectrolyte complexes. Advances in Colloid and Interface Science. 239, 187-198 (2017).
- Cabral, H., Miyata, K., Osada, K., Kataoka, K. Block Copolymer Micelles in Nanomedicine Applications. Chemical Reviews. 118 (14), 6844-6892 (2018).
- Tan, Z., et al. Block Polymer Micelles Enable CRISPR/Cas9 Ribonucleoprotein Delivery: Physicochemical Properties Affect Packaging Mechanisms and Gene Editing Efficiency. Macromolecules. 52 (21), 8197-8206 (2019).
- Horn, J. M., Kapelner, R. A., Obermeyer, A. C. Macro- and Microphase Separated Protein-Polyelectrolyte Complexes: Design Parameters and Current Progress. Polymers. 11 (4), 578 (2019).
- Juliano, R. L. The delivery of therapeutic oligonucleotides. Nucleic Acids Research. 44 (14), 6518-6548 (2016).
- Kanasty, R., Dorkin, J. R., Vegas, A., Anderson, D. Delivery materials for siRNA therapeutics. Nature Materials. 12 (11), 967-977 (2013).
- Lorenzer, C., Dirin, M., Winkler, A. M., Baumann, V., Winkler, J. Going beyond the liver: progress and challenges of targeted delivery of siRNA therapeutics. Journal of Controlled Release. 203, 1-15 (2015).
- Allen, T. M., Cullis, P. R. Liposomal drug delivery systems: from concept to clinical applications. Advanced Drug Delivery Reviews. 65 (1), 36-48 (2013).
- Li, W., Szoka, F. C. Lipid-based nanoparticles for nucleic acid delivery. Pharmaceutical Research. 24 (3), 438-449 (2007).
- Miyata, K., Nishiyama, N., Kataoka, K. Rational design of smart supramolecular assemblies for gene delivery: chemical challenges in the creation of artificial viruses. Chemical Society Reviews. 41 (7), 2562-2574 (2012).
- Oishi, M., Nagasaki, Y., Itaka, K., Nishiyama, N., Kataoka, K. Lactosylated poly(ethylene glycol)-siRNA conjugate through acid-labile ss-thiopropionate linkage to construct pH-sensitive polyion complex micelles achieving enhanced gene silencing in hepatoma cells. Journal of the American Chemical Society. 127 (6), 1624-1625 (2005).
- Christie, R. J., et al. Targeted polymeric micelles for siRNA treatment of experimental cancer by intravenous injection. ACS Nano. 6 (6), 5174-5189 (2012).
- Kuo, C. H., et al. Inhibition of atherosclerosis-promoting microRNAs via targeted polyelectrolyte complex micelles. Journal of Materials Chemistry B. 2 (46), 8142-8153 (2014).
- Ge, Z., et al. Targeted gene delivery by polyplex micelles with crowded PEG palisade and cRGD moiety for systemic treatment of pancreatic tumors. Biomaterials. 35 (10), 3416-3426 (2014).
- Van Bruggen, C., Hexum, J. K., Tan, Z., Dalai, R. J., Reineke, T. M. Nonviral Gene Delivery with Cationic Glycopolymers. Accounts of Chemical Research. 52 (5), 1347-1358 (2019).
- Hayashi, K., et al. Influence of RNA Strand Rigidity on Polyion Complex Formation with Block Catiomers. Macromolecular Rapid Communications. 37 (6), 486-493 (2016).
- Marras, A. E., Vieregg, J. R., Ting, J. M., Rubien, J. D., Tirrell, M. V. Polyelectrolyte Complexation of Oligonucleotides by Charged Hydrophobic-Neutral Hydrophilic Block Copolymers. Polymers. 11 (1), 83 (2019).
- Phillips, H. R., et al. Glycopolycation-DNA Polyplex Formulation N/P Ratio Affects Stability, Hemocompatibility, and in Vivo Biodistribution. Biomacromolecules. 20 (4), 1530-1544 (2019).
- Ting, J. M., Wu, H., Herzog-Arbeitman, A., Srivastava, S., Tirrell, M. V. Synthesis and Assembly of Designer Styrenic Diblock Polyelectrolytes. ACS Macro Letters. 7 (6), 726-733 (2018).
- Zadeh, J. N., et al. NUPACK: Analysis and design of nucleic acid systems. Journal of Computational Chemistry. 32 (1), 170-173 (2011).
- Santa Lucia, J. A unified view of polymer, dumbbell, and oligonucleotide DNA nearest-neighbor thermodynamics. Proceedings of the National Academy of Sciences of the United States of America. 95 (4), 1460-1465 (1998).
- Xia, T., et al. Thermodynamic parameters for an expanded nearest-neighbor model for formation of RNA duplexes with Watson-Crick base pairs. Biochemistry. 37 (42), 14719-14735 (1998).
- Orthaber, D., Bergmann, A., Glatter, O. SAXS experiments on absolute scale with Kratky systems using water as a secondary standard. Journal of Applied Crystallography. 33 (2), 218-225 (2000).
- Srivastava, S., et al. Gel phase formation in dilute triblock copolyelectrolyte complexes. Nature Communications. 8, 14131 (2017).
- Lindhoud, S., et al. Salt-induced disintegration of lysozyme-containing polyelectrolyte complex micelles. Langmuir. 25 (19), 11425-11430 (2009).
- Lindhoud, S., de Vries, R., Schweins, R., Stuart, M. A. C., Norde, W. Salt-induced release of lipase from polyelectrolyte complex micelles. Soft Matter. 5 (1), 242-250 (2009).
- Ilavsky, J., Jemian, P. R. Irena: tool suite for modeling and analysis of small-angle scattering. Journal of Applied Crystallography. 42 (2), 347-353 (2009).
- Sambrook, J., Fritsch, E. F., Maniatis, T. . Molecular Cloning: a Laboratory Manual. , (1989).
- Jakeš, J. Regularized positive exponential sum (REPES) program-A way of inverting laplace transform data obtained by dynamic light scattering. Collection of Czechoslovak Chemical Communications. 60 (11), 1781-1797 (1995).
- Schillen, K., Brown, W., Johnsen, R. M. Micellar Sphere-to-Rod Transition in an Aqueous Triblock Copolymer System - a Dynamic Light-Scattering Study of Translational and Rotational Diffusion. Macromolecules. 27 (17), 4825-4832 (1994).
- Provencher, S. W. Contin - a General-Purpose Constrained Regularization Program for Inverting Noisy Linear Algebraic and Integral-Equations. Computer Physics Communications. 27 (3), 229-242 (1982).
- Provencher, S. W. A Constrained Regularization Method for Inverting Data Represented by Linear Algebraic or Integral-Equations. Computer Physics Communications. 27 (3), 213-227 (1982).
- Sarachan, K. L., Curtis, J. E., Krueger, S. Small-angle scattering contrast calculator for protein and nucleic acid complexes in solution. Journal of Applied Crystallography. 46 (6), 1889-1893 (2013).
- Beaucage, G. Approximations leading to a unified exponential power-law approach to small-angle scattering. Journal of Applied Crystallography. 28 (6), 717-728 (1995).
- Marras, A. E., Vieregg, J. R., Ting, J. M., Rubien, J. D., Tirrell, M. V. . Materials Data Facility. , (2018).
- Modena, M. M., Rühle, B., Burg, T. P., Wuttke, S. Nanoparticle Characterization: What to Measure. Advanced Materials. , (2019).
- Mourdikoudis, S., Pallares, R. M., Thanh, N. T. K. Characterization techniques for nanoparticles: comparison and complementarity upon studying nanoparticle properties. Nanoscale. 10 (27), 12871-12934 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved