Method Article
شرائح فرس النهر الأفقية من دماغ الفأر
* These authors contributed equally
In This Article
Summary
تهدف هذه المقالة إلى وصف بروتوكول منهجي للحصول على شرائح الدماغ قرن آمون الأفقي في الفئران. والهدف من هذه المنهجية هو الحفاظ على سلامة مسارات ألياف فرس النهر، مثل المسار المثقب والمسالك الألياف الطحبية لتقييم العمليات العصبية ذات الصلة بالجيروز.
Abstract
الحصين هو بنية منظمة للغاية في الدماغ الذي هو جزء من الجهاز الحوفي وتشارك في تكوين الذاكرة والدمج وكذلك مظهر من اضطرابات الدماغ الحادة، بما في ذلك مرض الزهايمر والصرع. يتلقى قرن آمون درجة عالية من الاتصال الداخلي و البيني، مما يضمن التواصل الصحيح مع هياكل الدماغ الداخلية والخارجية. ويتم إنجاز هذا الاتصال من خلال تدفقات إعلامية مختلفة في شكل مسارات الألياف. شرائح الدماغ هي منهجية تستخدم بشكل متكرر عند استكشاف الوظائف العصبية الفسيولوجية من قرن آمون. يمكن استخدام شرائح الدماغ فرس النهر لعدة تطبيقات مختلفة، بما في ذلك التسجيلات الكهربائية الفيزيولوجية، والقياسات المجهرية الخفيفة، فضلا عن العديد من التقنيات البيولوجية الجزيئية والهستوكيميائية. لذلك ، تمثل شرائح الدماغ نظامًا نموذجيًا مثاليًا لتقييم وظائف البروتين ، والتحقيق في العمليات الفسيولوجية المرضية التي تنطوي عليها الاضطرابات العصبية وكذلك لأغراض اكتشاف الأدوية.
هناك عدة طرق مختلفة من التحضيرات شريحة. الاستعدادات شريحة الدماغ مع هزاز تسمح للحفاظ على نحو أفضل من بنية الأنسجة وضمان إمدادات كافية من الأوكسجين أثناء تشريح, التي تقدم مزايا على الاستخدام التقليدي للمروحيات الأنسجة. وعلاوة على ذلك، يمكن تطبيق طائرات قطع مختلفة للاستعدادات شريحة الدماغ هزاز. هنا، يتم توفير بروتوكول مفصل لإعداد ناجح لشرائح قرن آمون أفقية قطع اهتزازي من أدمغة الماوس. على النقيض من مستحضرات شريحة أخرى، تشريح الأفقي يسمح للحفاظ على ألياف مسار مدخل قرن آمون (مسار مثقب) في حالة سليمة تماما داخل شريحة، مما يسهل التحقيق في التفاعلات entorhinal-فرس النهر. هنا، ونحن نقدم بروتوكول شامل لتشريح، استخراج، وشرائح أفقية حادة من الدماغ مورين، ومناقشة التحديات والمزالق المحتملة لهذه التقنية. وأخيراً، سوف نعرض بعض الأمثلة لاستخدام شرائح الدماغ في تطبيقات أخرى.
Introduction
بدأت الاستكشافات الواسعة لمقنا الحصين عندما أبلغ سكوفل وميلنر عن عدم قدرة المريض (H.M.) على تشكيل ذاكرة جديدة إعلانية بعد الإزالة الجراحية لمقنا الحصين وهياكل الفص الصدغي القريب كعلاج للصرع الشديد1. من تلك اللحظة، وقد درس الحصين على نطاق واسع بدءا من خصائص الخلايا العصبية العامة والوظائف حتى تطور اضطرابات الدماغ الحادة، مثل الصرع ومرض الزهايمر2،3،4،5. الحصين هو جزء من نظام الحوفي، ويتكون من مجموعة من هياكل الدماغ ذات الصلة المشاركة في تكوين العاطفة والذاكرة6،7. شبكة كثيفة من عدة مسارات الألياف يحقق اتصال فرس النهر ضيق إلى هياكل الدماغ الداخلية والخارجية. وتشمل هذه المسارات مسار متوسط وثقب جانبي (القشرة إينتورفينال لدنت gyrus, CA3 – CA1 و subiculum)8, مسار الألياف الطحلب (gyrus dentate إلى CA3)9 وChaffer الضمانات / مسار commiss associational (CA3 إلى CA1)10 (الشكل 1). الحصين يقدم واحدة من مناطق الدماغ الأكثر استكشافا على نطاق واسع حتى الآن بسبب تنظيمها المفارني المحافظة للغاية من تشكيل طبقة الخلايا العصبية, وإمكانية الحصول على الثقافات العصبية الحيوية وشرائح الدماغ مع سهولة نسبية5.
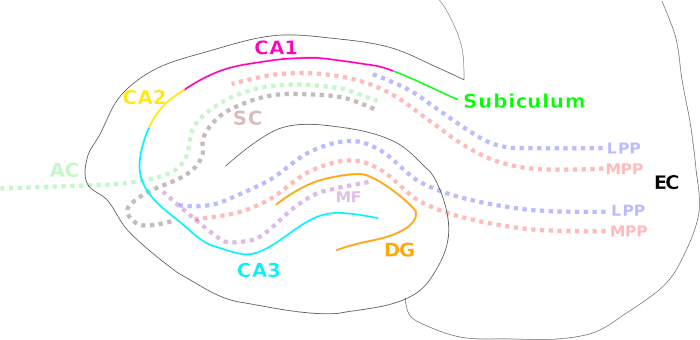
الشكل 1: الرسوم المتحركة التي توضح مناطق فرس النهر المختلفة ومسارات الألياف الرئيسية. يشار إلى مناطق فرس النهر المختلفة بخطوط ملونة صلبة: قشرة الأنف (EC؛ أسود)، الجيروسكوبات (DG؛ البرتقال)، كورنو أمونيس (كاليفورنيا) 3 (سماوي)، 2 (أصفر)، و 1 (أرجواني)، و subiculum (الأخضر). تظهر مسارات الألياف مع خط منقط الملونة: الوسيط (MPP، أحمر) والمسار الفرforant الجانبي (LPP، الأزرق) (من القشرة entorhinal إلى gyrus دنت، CA3، CA1، و subiculum)، ومسار الألياف الطحلب (MF، البنفسجي) (من جيروز دنت إلى CA3) وضمانات شيفر (SC، البني) (ipilateral من CA3 إلى CA1) / المسارات commissural الرابطة (AC، الضوء الأخضر الفاتح) (contraral من CA3 إلى CA1). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
غالبًا ما تؤدي بروتوكولات شريحة الدماغ إلى فقدان الاتصالات من مناطق الدماغ البعيدة إلى منطقة الاهتمام5. وعلاوة على ذلك، لم تعد الشعيرات الدموية وظيفية5 وحرمان الدورة الدموية11. على الرغم من هذه القيود، لا تزال تستخدم شرائح الدماغ في المقام الأول للتحقيق في الوظائف الفسيولوجية العصبية من قرن آمون بسبب عدد من المزايا. أولاً، استخراج الحصين هو سريع12 ولا يتطلب الكثير من المواد. وتشمل الأدوات الأساسية الوحيدة مجموعة تشريح، حمام المياه المختبرية، والوصول إلى كاربوجين وmicrotome تهتز (هزاز)13. الأصول الأخرى لتقنية شريحة الدماغ هي التحايل على حاجز الدم الدماغ (BBB) وغسل الجزيئات الصادرة من داخلها قبل بدء التجربة5، مما يجعل من الممكن دراسة تأثير المخدرات مع التحكم في الجرعة الدقيقة نسبيا14. وعلاوة على ذلك، شرائح الدماغ الحفاظ على cyto-العمارة والدوائر متشابك داخل الحصين15،16، حيث يتم الحفاظ على العصبية والبيئة المحلية مع اتصال الخلايا العصبية والتفاعلات المعقدة العصبية-غليا4,11,17. بالإضافة إلى ذلك، اتصالات ألياف فرس النهر هي في الغالب أحادي الاتجاه والخلايا العصبية فرس النهر لديها اللدونة متشابك عالية، مما يبسط بشكل كبير جمع وتفسير التسجيلات الكهربائية الفيزيولوجية عالية الجودة من أجل فهم العمليات العصبية18،19. الأهم من ذلك ، شرائح الدماغ تقديم الأصول القيمة المطبقة في مجموعة واسعة من التقنيات العلمية المختلفة ، وتمتد من التقنيات البيولوجية الجزيئية على تسجيلات التصوير تصل إلى القياسات الكهربائيةالفيزيولوجية 12،20،21،22،23،24،25،26.
كما هو موضح أعلاه، تقدم شرائح الدماغ فرس النهر أداة تجريبية قوية لدراسة السمات الهيكلية والوظيفية للاتصال المتشابك. وهذا يوفر الفرصة لتقييم آثار المواد الكيميائية أو الطفرات على الإثارة العصبية واللدونية16.
الاستعدادات شريحة الدماغ الحادة تقدم تقنية حساسة نسبيا ونوعية الشريحة المثلى تعتمد اعتمادا كبيرا على الظروف التجريبية المثالية، بما في ذلك عمر الحيوان، وطريقة القتل الرحيم، وسرعة تشريح وتشريح، والحلول والمعلمات تشريح (على سبيل المثال، تشريح السرعة) فضلا عن شروط الانتعاش شريحة4. ولذلك، فإن البروتوكول المصمم تصميماً جيداً له أهمية قصوى ويضمن إمكانية التكاثر عبر وحدات البحث المختلفة13.
هنا، ونحن نقدم بروتوكول مفصل للتحضيرات شريحة قرن آمون الأفقي الحاد، بهدف الحفاظ على سلامة مسار فرس النهر الجانبي ووسيمي مثقب ومسار الألياف الطحلب، مما يسمح للتحقيق في عمليات gyrus dentate ذات الصلة9. سوف نصف بالتفصيل الخطوات الرئيسية لتشريح واستخراج وشريحة أفقيا الدماغ مورين، تليها نتائج تمثيلية للتسجيلات الكالسيوم microfluorimetric والتسجيلات المحتملة ما بعد الإثارة الميدانية (fEPSPs) تحت شروط خط الأساس وخلال بروتوكولات التعريفي LTP في شرائح الدماغ من النوع البري C57BL/6J الفئران.
Protocol
وقد وافقت لجنة المراجعة الأخلاقية في جامعة كوي لوفين (بلجيكا) (P021/2012) على جميع التجارب الحيوانية لهذه الدراسة.
1. إعداد محلول شريحة السكروز العالية والسائل النخاعي الاصطناعي (ACSF)
- قبل اليوم التجريبي
- إعداد 1 لتر من 10x شريحة ما قبل الحل مع مختبر الصف نوع 1 المياه التي تحتوي على (في mM): 25 KCl، 20 CaCl2،10 MgSO4،12.5 KH2PO4 (الجدول 1). من أجل منع هطول الفوسفات الكالسيوم، وخلط المواد الكيميائية ببطء في منقار مملوءة مسبقا مع 800 مل H2O بينما التحريك باستمرار مع مُحرك مغناطيسي. تخزين الحل عند 4 درجة مئوية أو درجة حرارة الغرفة (RT).
- في اليوم التجريبي
- إعداد 1 لتر من 1X ACSF مع نوع الصف مختبر 1 المياه التي تحتوي على (في mM): 125 NaCl، 2.5 KCl، 2 CaCl2،1 MgSO4،1.25 NaH2PO4،26 NaHCO3،25 الجلوكوز (الجدول 2). استخدم تناوُل ضغط البخار للتحقق من صحة التناضح بين 305-315 mOsm (درجة الحرارة 7.55-7.6).
ملاحظة: من أجل منع هطول الفوسفات الكالسيوم، خلط ببطء جميع المواد الكيميائية الصلبة في منقار معبأة مسبقا مع 800 مل من H2O في حين اثارة باستمرار مع مُحرّك مغناطيسي. إضافة MgSO4 وCaCl2 في نهاية جدا، يقطر ببطء في المبلغ اللازم من حلول الأسهم 1 M. - باستمرار فقاعة 1x ACSF الحل في RT مع كاربوجين لتعيين رقم هيدروجيني بين 7.3-7.4.
ملاحظة: إذا كان درجة الـ (PH) مرتفعة جداً أو منخفضة جداً، فإن التعديلات الصغيرة في قوة الكاربونوجينيشن ستكون كافية. إذا كان درجة الـ PH أعلى من 7.45 مع carbogenation، قم بضبطه بإضافة بضع قطرات من 1 M NaH2PO4 حل. - إعداد 250 مل (لكل دماغ) من 1x عالية السكروز حل شريحة في منبر يحتوي على 25 مل من 10x شريحة قبل الحل و (في mM): 252 السكروز، 26 NaHCO3،و 10 الجلوكوز (الجدول 3). تحقق من أن التناضح يتراوح بين 320-325 mOsm (7.55-7.6).
- فقاعة حل شريحة السكروز عالية لمدة 10-15 دقيقة مع كاربوجين للسيطرة على درجة اله PH بين 7.3-7.4.
ملاحظة: إذا كان درجة الـ PH أعلى من 7.45 مع carbogenation، قم بضبطه بإضافة بضع قطرات من 1 M KH2PO4 حل. - تخزين محلول شريحة السكروز عالية لمدة 20-30 دقيقة في الفريزر فائقة (-80 درجة مئوية) حتى يتم تجميد جزئيا.
- إعداد 1 لتر من 1X ACSF مع نوع الصف مختبر 1 المياه التي تحتوي على (في mM): 125 NaCl، 2.5 KCl، 2 CaCl2،1 MgSO4،1.25 NaH2PO4،26 NaHCO3،25 الجلوكوز (الجدول 2). استخدم تناوُل ضغط البخار للتحقق من صحة التناضح بين 305-315 mOsm (درجة الحرارة 7.55-7.6).
2. إعداد مساحة العمل لتشريح الدماغ
- أثناء تهدئة حل شريحة السكروز عالية، وإعداد ما يلي.
- الاحماء حمام الماء إلى 32 درجة مئوية.
- ملء غرفة الانتعاش (الشكل 2A) مع حل ACSF carbogenated ووضع الغرفة في حمام الماء. تطبيق بشكل مستمر كاربوجين إلى زجاجة ACSF الرئيسية و ACSF في غرفة الانتعاش.
- أدخل الحيوان إلى الغرفة التجريبية.
ملاحظة: يجب تحديد عمر الحيوان وجنسه وسلالةه من قبل المُختبر الفردي ويعتمد على سؤال الدراسة المحدد. ومع ذلك، يجب أن تبقى معلمات الحيوان ثابتة في إطار دراسة واحدة من أجل ضمان قابلية المقارنة بين الأيام التجريبية المختلفة. تم تصميم هذا البروتوكول لاستخدام الفئران الذكور C57BL/6J في سن 2-6 أسابيع. إذا كان سيتم استخدام الحيوانات القديمة، قد يكون من الممكن تكييف حلول الشريحة والاسترداد وفقًا لذلك4،27 (على سبيل المثال ، NMDG+الحلول المستندةإلى 23،28) من أجل الحفاظ على صحة الدماغ للشرائح الحادة. - تحضير غرفة التخدير.
- وضع ورقة الأنسجة، ماصة باستور البلاستيكية مع فتحة واسعة (قطع مفتوحة)، 90 ملم طبق الثقافة مليئة بالثلج، مربع من ورقة تصفية على رأس طبق الثقافة المبردة، مقص قوي لقطع الرأس، مقص تشريح، ملقط منحني، ملعقة، 35 مم طبق الثقافة، فرشاة غرامة، شفرة، لوحة العينة (يأتي مع هزاز)، الغراء السوبر، تلميح ماصة، أربعة أشرطة من ورقة مرشح (~ 2 سم × 0.5 سم) (الشكل 2A).
- إعداد هزاز: أولا، برنامج هزاز للإعدادات الصحيحة (شفرة سرعة السفر: 0.08 مم / الثانية، وقطع السعة: 1.4 مم، وقطع التردد: 85 هرتز) وإرفاق خط كاربوجين في غرفة شريحة. المقبل، وضع غرفة شريحة في حامل، وملء حامل المحيطة غرفة شريحة مع الجليد وإرفاق كل شيء إلى هزاز. وأخيرا، ضع شفرة الحلاقة في حامل شفرة هزاز(الشكل 2B).
- بعد تجميد حل السكروز عالية تنفيذ الخطوات التالية.
- بعد 20-30 دقيقة، واتخاذ حل شريحة عالية السكروز من -80 درجة مئوية فائقة الفريزر والحفاظ على منقار على الجليد.
- وضع حل السكروز عالية بجانب هزاز على مقاعد البدلاء الخاص بك، سحق وخلط الحل المجمدة جزئيا مع ملعقة للحصول على طين لطيفة والبدء في محتدما مع كاربوجين.
- تناول بعض محلول شريحة السكروز عالية مع ماصة باستور البلاستيكية لنقع ورقة التصفية المربعة على رأس طبق الثقافة المبرد 90 ملم.
- ملء طبق ثقافة 35 ملم (أو أي حاوية صغيرة ما يعادلها التي هي مناسبة لتخزين الدماغ كله) تصل إلى 75٪ مع محلول شريحة السكروز عالية (كافية لتغطية الدماغ كله) وتبريد طبق الثقافة على الجليد التي تبقى بجوار beaker مع بقية المحلول. كاربوجينت الحل في طبق ثقافة 35 ملم.
3. تشريح وتحديد المواقع من مورين الدماغ
- تخدير الحيوان مع 5٪ isoflurane. تحديد العمق السليم للتخدير عن طريق قرص مخلب. لا ينبغي أن تحدث أي رد فعل الانسحاب مخلب.
- نقل الحيوان على ورقة الأنسجة وقطع الرأس مع مقص قوي أو مقصلة صغير.
- استخدم مقص التشريح لقطع فتح فروة الرأس.
- قطع فتح الكالفاريا على طول خياطة القوس وإزالتها بمساعدة ملقط منحنية حتى الدماغ كله، بما في ذلك المصابيح الشمية، مرئية.
ملاحظة: يجب الحرص على عدم تلف الدماغ مع حواف حادة من الكالفاريا أو ملقط. - استخدام ملعقة لغرف بعناية خارج الدماغ (المصابيح الشمية يجب أن تبقى تعلق).
- نقل الدماغ في طبق ثقافة 35 مم المبردة وإزالة جميع جزيئات الشعر أو الدم من الأنسجة عن طريق غسل الدماغ بلطف مع ماصة باستور ACSF مليئة (الدم له آثار السامة للخلايا على أنسجة الدماغ29).
- نقل الدماغ بمساعدة ملعقة على ورقة مرشح غارقة على رأس طبق الثقافة المبردة 90 مم (الشكل 2A).
- استخدام شفرة لقطع الدماغ إلى النصف، وفصل نصفي الكرة الأرضية، ووضع كلا نصفي الكرة الأرضية على الجانب مُنصف قطع حديثا.
- استخدم شفرة لإزالة الجزء الظهري (5٪-10٪) من الدماغ من كل نصف الكرة مع قطع موازية إلى أعلى الظهر(الشكل 2C)30 ووضع كلا نصفي الكرة الأرضية على الجانب قطع حديثا مع الجزء البطني من الدماغ التي تواجه صعودا.
- وضع قطرة من الغراء السوبر على لوحة العينة وانتشرت بشكل صحيح مع طرف ماصة لاستيعاب كل من نصفي الكرة الأرضية.
- استخدام حزام ورقة مرشح لالتقاط نصف الكرة الأرضية واحد مع قوات الشعيرات الدموية عن طريق لمس الجانب البطني مع حزام ورقة مرشح، وبالتالي لا إتلاف الأنسجة.
- استخدام حزام ورق مرشح آخر بعناية شبه الجافة الجانب الظهري من الدماغ قبل وضع نصف الكرة الأرضية مع الجانب الظهري إلى أسفل على رأس الغراء على لوحة العينة. كرر نفس الإجراء مع نصف الكرة الثاني.
ملاحظة: يجب وضع نصفي الكرة الأرضية في محاذاة أفقية بطريقة معكوسة على لوحة الاهتزاز، مع توجيه الجانبين الرسترالية نحو الخارج والجانبين السدالين التي تواجه (ولكن لا تلمس) بعضها البعض في الوسط. يجب أن تشير الجوانب الوسيطة لكلا نصفي الكرة الأرضية نحو شفرة الاهتزاز والجانبين الجانبي نحو المجرب(الشكل 2D). - وضع لوحة العينة في غرفة تشريح وبسرعة، ولكن بعناية، وتغطية مع الجليد الباردة عالية السكروز حل شريحة طين. بمجرد أن يلامس الحل الغراء ، فإنه سيتم ترسيخ ولصق صحيح في نصفي الكرة الأرضية إلى لوحة العينة.
- تأكد من أن نصفي الكرة الأرضية مغطى بشكل صحيح بمحلول شريحة السكروز العالي وتأكد من أن الحل مُزَمّع بالكاربونجن.
ملاحظة: يجب إجراء إجراء التشريح بأكمله بأسرع وقت ممكن. يرجى التأكد من أن الدماغ لا يبقى دون إمدادات الأوكسجين لفترة طويلة جدا. وينبغي أن يستغرق فقط حوالي 1-1.5 دقيقة من قطع الرأس لغمر الدماغ في حل شريحة السكروز عالية طين. هذا هو الشرط الأكثر أهمية للمستحضرات شريحة الدماغ الحادة من أجل ضمان جودة عالية من شريحة.
4. التقطيع الأفقي للدماغ
- ضع النصل الهزاز أمام الجانب الوسيط من نصفي الكرة الأرضية واخفضه إلى نفس الارتفاع مثل الجوانب البطنية لنصفي الكرة الأرضية التي تواجه الآن لأعلى. خفض شفرة مع مساعدة من التحكم هزاز إلى 600 μm كذلك في الاتجاه الظهري والبدء في تشريح. يجب أن تصل شفرة الأنسجة (إن لم يكن، عكس شفرة وخفضه أكثر قليلا). شريحة حتى يتم فصل شريحتين الأولى تماما من نصفي الكرة الأرضية.
- عكس شفرة وخفض آخر 300 ميكرومتر وشريحة مرة أخرى.
- عندما يصبح قرن آمون مرئية (استخدامماوس 31 أطلس الدماغ للحصول على مساعدة، إذا لزم الأمر) (الشكل 2E) جمع شرائح مع ماصات باستور البلاستيك الموسعة. جمع شرائح حتى 150000 1000 يصبح مرئيا بجوار قرن آمون. عادة، يمكن جمع ما بين 8-12 شرائح من 300 ميكرومتر (4-6 لكل نصف الكرة الأرضية) لدماغ الماوس.
- استخدام ماصة باستور البلاستيكية لجمع شرائح ونقلها إلى غرفة الانتعاش في حمام الماء (الشكل 2F) (جمع شرائح بعد كل جولة من التقطيع لمنعهم من العائمة في غرفة شريحة).
ملاحظة: العمل في أسرع وقت ممكن وضمان أن حل شريحة عالية السكروز هو الجليد الباردة وcarogenated خلال الإجراء بأكمله. إذا لزم الأمر، قم بإعادة ملء الجليد المحيط بقطعة الشريحة.
5. استعادة شرائح الدماغ للتسجيلات الكهربائية الفيزيولوجية
- اترك الشرائح في غرفة الاسترداد المملوءة بـ ACSF في حمام الماء 32 درجة مئوية لمدة ساعة واحدة.
ملاحظة: تتوفر أيضاً غرف الاسترداد تجارياً. - خذ غرفة الإنعاش من حمام الماء.
- ضع الشرائح في RT لمدة 30 دقيقة أخرى على الأقل للتعافي قبل البدء في أي تطبيق آخر.
6. تسجيلات fepSP في مسار مثقبة الوسيطة (MPP) من قرن آمون
- سحب ماصات تسجيل من الشعيرات الدموية الزجاج borosilicate مع سحب ماصة أفقية لتلقي ماصات من حجم ~ 2 MΩ عندما امتلأت بحل ACSF وغمرها في غرفة تسجيل ACSF مليئة.
- ملء محلول حمام ACSF وحل ACSF الذي يحتوي على المواد الكيميائية المناسبة (مثل Bicuculline) في نظام ضخ متعدد البراميل يتم التحكم فيه بالجاذبية متصل بغرفة التسجيل. بشكل مستمر كربوجينت جميع الحلول.
- قم بتشغيل مضخة طرّقة أو فراغية متصلة بمواد أنابيب شفط تنتهي عكس خط القذف في غرفة التسجيل. افتح البرميل المليء بـ ACSF وابدأ في إنشاء تدفق مستمر (1-2 قطرات في الثانية). تحقق من أن القطب المرجعي مغمور في حل ACSF.
- قم بتشغيل جهاز الكمبيوتر الإعداد، مكبر الصوت، micromanipulator، ومحفز، ضوء المجهر (ق)، والكاميرا، والشاشة (إن وجدت).
- فتح البرامج المناسبة للتسجيلات الكهربائية الفيزيولوجية (توجد عدة أجهزة مختلفة ومقدمي البرمجيات للمعدات الكهربائية الفيزيولوجية).
- نقل نصف الكرة الأرضية شريحة الدماغ واحد من غرفة الانتعاش إلى غرفة تسجيل الإعداد شريحة ووضعها في الاتجاه الصحيح مع طبقة الخلايا الحبيبية gyrus دنت وطبقة الجزيئية في مجال الرؤية. تأكد من أن القطب التحفيز يمكن أن تصل إلى MPP في شريحة من اتجاه القشرة entorhinal وأن القطب تسجيل لديه الوصول إلى MPP من الجانب المعاكس تماما من اتجاه CA3.
- تحقيق الاستقرار في شريحة في غرفة تسجيل مع مشبك ورق (الشكل 3A) أو شبكة شريحة الدماغ المتاحة تجاريا.
ملاحظة: قد يكون من المفيد إيقاف تشغيل الضخ أثناء نقل الشريحة وتحديد موضعها. ومع ذلك، لا ينبغي أن يستغرق ذلك وقتا طويلا من أجل ضمان جودة شريحة الدماغ. - انخفاض ووضع أقطاب التسجيل والتحفيز في MPP في الثلث السفلي من الطبقة الجزيئية قريبة من طبقة الخلايا الحبيبية(الشكل 3B) ، تواجه بعضها البعض على مسافة 100-150 ميكرومتر تقريبا. وينبغي أن القطب التحفيز الاتصال الحد الأدنى السطح، في حين أن القطب تسجيل يجب التسلل قليلا طبقة الشريحة العليا.
- تطبيق التحفيز كثافة منخفضة (30-50 μA ل0.1 مللي ثانية) لشريحة الدماغ من أجل الحصول على إشارة fEPSP. تطويع موضع الأقطاب الكهربائية إذا لزم الأمر (على سبيل المثال، إشارة fEPSP ذات شكل منخفض أو غير نمطي).
- بدء تسجيل منحنيات الإدخال والمخرجات: تطبيق زيادة كثافة التحفيز على شريحة الدماغ في فترات من 30 s.
- تعيين كثافة التحفيز إلى 50٪ من استجابة fEPSP القصوى وبدء تسجيلات fEPSP الأساسية تطبيق كثافة التحفيز 50٪ لمدة 20-40 دقيقة في 30 فترات s إلى شريحة الدماغ.
- وإذا بدا أن خط الأساس ثابت، فشرع في التسجيلات الإضافية (مثل بروتوكولات LTP/LTD و/أو تطبيقات المخدرات). (للحصول على إدخال LTP في MPP، هنا تم استخدام بروتوكول يتكون من أربع مرات 1 s 100 هرتز نبضات تطبيقها في فاصل زمني من 5 دقائق. تم تطبيق Bicuculline 10 دقيقة قبل وأثناء مرحلة تكييف.)
ملاحظة: يجب إجراء كافة التسجيلات في وضع المشبك الحالي مع التصفية المناسبة بتمريرات منخفضة (<5 كيلو هرتز) ومعدلات أخذ العينات (> 10 كيلو هرتز). - استخراج البيانات في تنسيق ملف مناسب وتحليل معلمات fEPSP، مثل الليفي الطائرة، السعة fEPSP، و slope fEPSP.
7. تسجيلات تصوير الكالسيوم لشرائح الدماغ
- نقل نصف الكرة الأرضية شريحة الدماغ واحد في غرفة 12-جيدا وتحميلها لمدة 30 دقيقة إلى 1 ساعة مع صبغة الكالسيوم المناسبة. بشكل مستمر carbogenate حل التحميل عن طريق إدخال أنبوب carbogenation من خلال ثقب عصامي (مع إبرة 18G الساخنة) في غطاء لوحة 12-جيدا.
ملاحظة: هذه الخطوة ليست ضرورية في حالة الاستعدادات شريحة الدماغ من الحيوانات المعدلة وراثيا التي تعبر عن مراسل الفلورسنت بشكل خاص مثل GCaMP. - إعداد إعداد التسجيل كما هو موضح في الخطوات 6.2-6.5.
ملاحظة: لا يوجد مكبر للصوت أو ميكرومانيبولاتور ضرورية لتجارب التصوير الدقيقة الفلورية. استخدام محفز هو تجربة تعتمد. من الضروري استخدام برامج محددة لتجارب التصوير الفلوري. - ضبط البرنامج إلى إعدادات التصوير الصحيحة: يتضمن هذا مكبر صوت الكاميرا وإعداد الضم، وإعداد الطول الموجي، ووقت التعرض، وبروتوكول التوقيت. يمكن أن تختلف الإعدادات وفقًا للتجارب الدقيقة. (على سبيل المثال آثار، 1 × 1 binning، 2.4x مكاسب ما قبل مكبر للصوت، 300 م كسب الكاميرا، والتعرض من 50 مللي ثانية في 488 نانومتر المتكررة كل 500 مللي ثانية لمدة التجربة.
- بعد التحميل مع صبغة الكالسيوم، نقل نصف الكرة الغربي شريحة الدماغ من 12-جيدا إلى غرفة تسجيل ووضعها على مرحلة المجهر.
- تحقيق الاستقرار في شريحة في غرفة تسجيل مع مشبك ورقة (الشكل 3A) أو شبكة شريحة الدماغ المتاحة تجاريا مماثلة لتلك الموصوفة في الخطوة 6.7.
- تأكد من أن مجال الاهتمام هو في المجال المجهري الصحيح والتركيز.
- استخدم برنامج التصوير المفلور لتحديد عدة مناطق ذات أهمية (ROIs) على الشريحة.
ملاحظة: قد يكون من المفيد تحديد مجال الرؤية بالكامل لمتابعة التقلبات العامة في السطوع، وذلك بسبب السطوع الضوئي. - بدء التسجيل وتطبيق التجارب المخدرات في الوقت المحدد.
ملاحظة: من المستحسن تطبيق حل K+ عالي في نهاية كل تجربة للتحقق من الطابع العصبي للخلايا وجودة الشريحة. - استخراج البيانات في تنسيق ملف مناسب وتحليل التغيرات إشارة fluorescence التي تحدث في ROIs على القياس بأكمله. يمكن أيضاً تكييف الـ ROIs أثناء التحليل خارج الخط.
ملاحظة: البروتوكولات الأخرى التي تصف تسجيلات fEPSP وقياس المغذيات الدقيقة الكالسيوم في شرائح الدماغ متوفرة في الأدب24،32،33،34،35.
النتائج
نظرة عامة على الأدوات والخطوات الهامة اللازمة للبروتوكول
ويعرض الشكل 2 جميع الأدوات الضرورية والخطوات الحاسمة لإعداد شرائح الدماغ الحادة الأفقية في منطقة آمون كما هو موضح في هذا البروتوكول. عموما، مطلوب عدد محدود من الأدوات الرئيسية، بما في ذلك عدد قليل من أدوات التشريح وغرفة استرداد شريحة (الشكل 2A)،حمام مائي مختبري، وهزاز (الشكل 2B). الشكل 2C-E تصور الخطوات الهامة والتوجهات من الدماغ ونصف الكرة الأرضية خلال بروتوكول إعداد شريحة. الشكل 2F هو مثال على النتيجة المتوقعة من شرائح الدماغ الأفقي.
تسجيلات fEPSP في المسار الforforant الوسيط
بعد فترة النقاهة، يمكن استخدام شرائح الدماغ للتسجيلات الكهربائية الفيزيولوجية من fEPSPs. هنا، استخدمنا مجهر تستقيم مجهزة متعددة القنوات الجاذبية التي تسيطر عليها نظام الضخ(الشكل 3A والشكل 3B). تم تعبئة ميكروسيبيت زجاجي (~ 2 MΩ) مع محلول ACSF وتعلق على رأس قطب فضي مغلف بالكلوريد يتم تركيبه على مكبر للصوت التشغيلي في الدائرة مع قطب حمام مكلور. تم تسجيل fEPSPs وتصورها مع مكبر للصوت وبرامج التسجيل المناسبة عن طريق إدراج micropipette الزجاج في MPP من قرن آم في الطبقة العليا من شريحة الدماغ. تم تحفيز fEPSPs عن طريق التحفيز مع ميكروكيلترورود الكتلة 2 الاتصال ، وتطبيق كثافة الحالية المختلفة على المنبع MPP من القطب تسجيل. لاحظ أن هذا البروتوكول لا يهدف إلى شرح كيفية الحصول على تسجيلات MPP، ولكن ببساطة يستخدم تسجيلات في MPP كمثال لإظهار نجاح بروتوكول إعداد شريحة الموصوفة هنا. إذا حاول شخص ما إجراء تسجيلات MPP ، قد يكون من الضروري بعض الضوابط (مثل تسجيلات النبضات المقترنة) من أجل ضمان موقع التسجيل المناسب وتمييز MPP عن LPP8و36و37.
الشكل 3C يوضح سلبية (لوحة اليسار، شريحة ذات جودة منخفضة) وإيجابية (لوحة اليمنى، شريحة ذات جودة عالية) مثال على تسجيل fEPSP. يُظهر التتبع السلبي للكرة الليفية (FV) السعة الكبيرة التي تكون أعلى حتى من السعة الفعلية fEPSP (≈0.5 mV). في المقابل، يظهر مثال شريحة عالية الجودة (اللوحة اليمنى) نسبة FV إلى fEPSP عالية السعة fEPSP (> 0.5 mV). كرة الألياف هو إشارة التي تحدث عند إزالة القطب من ألياف الخلايا العصبية حفز وبالتالي يسبق التقوية بعد تينابتيك (fEPSP). توفر علاقة FV بخصائص fEPSP معلومات هامة حول الحفاظ على خصائص محور عصبي ومشابك. شرائح عالية الجودة مع الألياف العصبية سليمة يجب أن تظهر سعة fEPSP عالية إلى FV نسبة. على العكس من ذلك، فإن شرائح ذات جودة منخفضة مع خصائص اضعف في عملية القذف يكون لها انخفاض fEPSP إلى FV نسبة. وبالمثل، يمكن تحليل قابلية شريحة الدماغ للحياة عن طريق رسم منحدرات fEPSP مقابل السعات الليفية الطائرة (الشكل 3D).
وعلاوة على ذلك، يتم استخدام منحنيات المدخلات والمخرجات (منحدر fEPSP و سعة FV على كثافة التحفيز) بشكل قياسي من أجل تحديد جودة الشريحة. ويتم الحصول على هذه المنحنيات عن طريق تطبيق زيادة المحفزات الحالية على شريحة الدماغ وعن طريق رصد استجابات fEPSP اللاحقة. تظهر شرائح الدماغ منخفضة الجودة منحنى المدخلات والمخرجات المنخفضة بسبب خصائص موصل دون المستوى الأمثل لأنسجة الدماغ المحفوظة بشكل سيئ(الشكل 3E, F). وعلاوة على ذلك، مدخلات-الإخراج منحنيات ضرورية لتحديد نطاق كثافة التحفيز المثالي للتحقيق في العمليات متشابك. ومن الناحية المثالية، ينبغي تعيين كثافة التحفيز حول 50٪ من كثافة لاستجابات قصوى. في هذه الكثافة التحفيزية المختارة ، تكون استجابات fEPSP حساسة للغاية لأي تغييرات في اللدونة المتشابكة ، والتي توفر الفرصة للتحقيق في كل من التقوية طويلة الأجل (LTP) والاكتئاب على المدى الطويل (LTD).
من أجل دراسة اللدونة متشابك، يتم رصد انتقال متشابك من شريحة الدماغ (fEPSP المنحدر) في 50٪ من كثافة التحفيز المختار لفترة زمنية أطول (عادة بين 20-40 دقيقة) قبل مرحلة تكييف. شرائح الدماغ قابلة للحياة سيكون لها خطوط أساس مستقرة، في حين أن شرائح الدماغ مع خط أساس غير مستقر لا يمكن استخدامها لبروتوكولات تكييف إضافية من أجل دراسة اللدونة متشابك من دوائر الدماغ(الشكل 3G،اللوحة العليا). يمكن أن تكون تسجيلات خط الأساس fEPSP مفيدة أيضًا من أجل مراقبة آثار المخدرات على انتقال التشابك نفسه(الشكل 3G، اللوحة السفلية). وعادة ما يستخدم متوسط إشارات خط الأساس fEPSP المسجلة لتطبيع دورة زمنية fEPSP ويتم تعيينها بشكل قياسي في 100٪.
يمكن دراسة اللدونة متشابك من خلال تطبيق بروتوكولات تكييف محددة لشرائح الدماغ. وتعتمد هذه البروتوكولات على دائرة الدماغ التي تم التحقيق فيها وعلى آلية الاهتمام (مثل LTP أو LTD). من أجل حث LTP في MPP من gyrus دنت، بروتوكول تكييف قوي ضروري بسبب تثبيط GABAergic قوية التي هي موجودة في نقاط الاشتباك العصبي MPP38. وتفيد التقارير أن تثبيط GABAergic هو أكثر وضوحا في شرائح الدماغ أعدت مع حلول تشريح السكروز عالية39. هنا, نحن نستخدم بروتوكول يتكون من أربعة التحفيزات من 1 s طويلة 100 هرتز البقول المطبقة في فاصل زمني 5 دقائق في حين يجري التعامل مع GABAA مستقبلات خصم Bicuculline (الشكل 3H). إن الإضافة المشتركة لـ NMDA و Bicuculline خلال فترة التكييف تؤدي إلى زيادة LTP (الشكل 3H). ويمكن أن يؤدي انخفاض نوعية الشريحة والإرسال المتشابك غير المستقر (خط الأساس fEPSP) إلى إدخال تحريضي غير مُغير أو غير ناجح وLT. ولذلك، من الأهمية بمكان العمل مع تحضيرات شريحة عالية الجودة واستخدام معايير استبعاد صارمة (السعة المنخفضة fEPSP إلى نسبة الألياف الطائرة (<3)، ومنحدر fEPSP صغير (<0.5 mV/ms) أو السعة (<0.5 mV) وخط الأساس fEPSP غير المستقر (تغيير أكثر من 5٪) لشرائح غير قابلة للحياة عند التحقيق في عمليات متشابك.
قياسات الفلوروريمترات الدقيقة الكالسيوم في طبقة الخلايا الحبيبية من الجيروسكوبات
بعد الانتعاش، تم احتضان شريحة الدماغ في درجة حرارة الغرفة مع 2 μM من صبغة حساسة للكالسيوم لمدة 1 ساعة في ASCF carbogenated، محمية من الضوء. تم نقل الشريحة إلى غرفة تسجيل (الشكل 3A) على مجهر فلورانس مستقيم مجهز بنظام ضخ متعدد القنوات يتم التحكم فيه بالجاذبية. تم الحصول على صور انبعاث الفلوريسنس كل 500 مللي ثانية بعد الإضاءة في 488 نانومتر (الشكل 4A, B). تم الإثارة مع مصباح زينون وماسح ضوئي مركب على مونوككرواتونتور الصريف وتم تنفيذ عملية الحصول على الصور بكاميرا CCD التي يتم التحكم فيها بالكمبيوتر. خلال القياسات، تم التعامل مع شريحة مع خصم مستقبلات NMDA APV، مما أدى إلى انخفاض في تركيز الكالسيوم داخل الخلايا. أدى تحفيز الشريحة مع محلول خارج الخلية يحتوي على تركيز البوتاسيوم العالي (50 mM) إلى تدفق هائل من الكالسيوم خارج الخلية بسبب إزالة قطبة الخلايا العصبية وفتح قنوات أيونات الجهد(الشكل 4C).
| مركب | تركيز (mM) | الوزن الجزيئي (ز / مول) | المبلغ (ز) |
| KCl | 25 | 74.55 | 1.86 |
| CaCl2 * 2H2O | 20 | 147.01 | 2.94 |
| MgSO4 * 7H2O | 10 | 246.48 | 2.46 |
| KH2PO4 | 12.5 | 136.08 | 1.7 |
الجدول 1: 10 × شريحة الحل المسبق (1 لتر).
| مركب | تركيز (mM) | الوزن الجزيئي (ز / مول) | المبلغ (ز) |
| NaCl | 125 | 58.44 | 7.3 |
| KCl | 2.5 | 74.55 | 0.19 |
| CaCl2 * 2H2O | 2 | من 1 M CaCl2 الحل | 2 مل |
| MgSO4 * 7H2O | 1 | من 1 M MgSO4 حل | 1 مل |
| NaH2PO4 * 2H2O | 1.25 | 156.02 | 0.2 |
| NaHCO3 | 26 | 84.01 | 2.18 |
| الجلوكوز * H2O | 25 | 198.17 | 4.95 |
الجدول 2: 1x ACSF (1 لتر) (التناضح بين 305-315 mOsm).
| مركب | تركيز (mM) | الوزن الجزيئي (ز / مول) | المبلغ (ز) |
| 10x شريحة presolution | غير مُنَدِيًا | غير مُنَدِيًا | 25 مل |
| سكروز | 252 | 342.3 | 21.57 |
| NaHCO3 | 26 | 84.01 | 0.55 |
| الجلوكوز * H2O | 10 | 198.17 | 0.49 |
الجدول 3: 1x محلول شريحة السكروز العالية (250 مل) (osmolarity بين 320-325 mOsm).
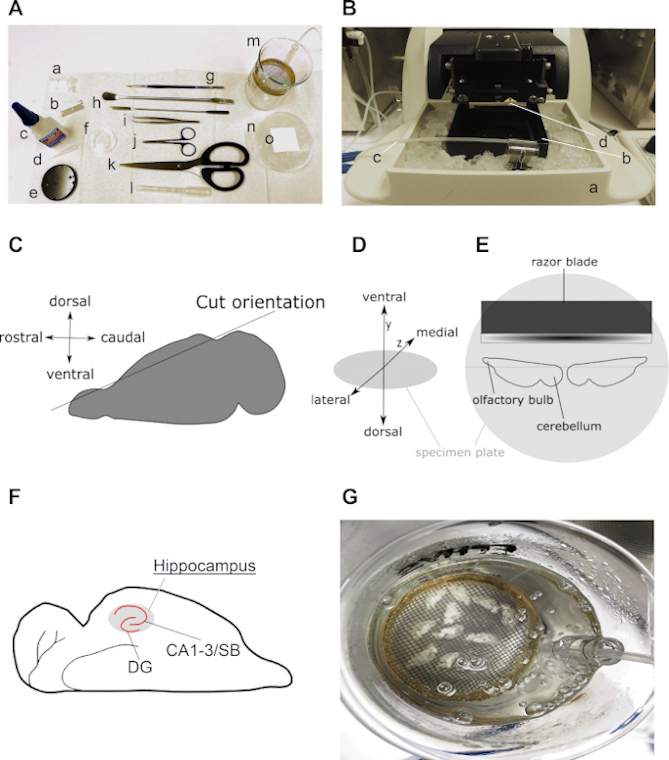
الشكل 2: معلومات مفصلة عن إعداد شرائح الدماغ قرن آمون الأفقي. (أ) صورة الأدوات اللازمة لتشريح وتقطيع دماغ القوارض: (أ) ±2 سم طولاً ± 0.5 سم من ورق الفلتر (على سبيل المثال، الصف 413)؛ (ب) شفرة؛ (ج) الغراء السوبر؛ (د) طرف الماصات؛ (ه) لوحة العينة (يأتي مع هزاز)؛ (و) طبق استزراع 35 ملم؛ (ز) فرشاة غرامة؛ (ح) ملعقة؛ '1' ملقط منحنية؛ (ي) مقص تشريح؛ (ك) مقص قوي (طول شفرة فوق 10 سم)؛ (ل) ماصة باستور البلاستيكية ذات فتحة واسعة (يتراوح قطرها بين 0.6 و 0.8 سم)؛ (م) غرفة الاسترداد (عصامي مع 250 مل من القارص، حلقة بلاستيكية، شبكة نايلون، قطعة من ماصة المصلية 10 مل)؛ (ن) طبق ثقافة 90 ملم مملوء بالثلج و(س) مربع من ورق التصفية فوق طبق الثقافة المبردة. (B) صورة هزاز مع (أ) حامل قطعة غرفة مملوءة بالثلج؛ (ب) غرفة الشرائح؛ (ج) خط كاربوجين و (د) تقطيع شفرة الحلاقة. C) الرسوم المتحركة توضح اتجاه قطع الجانب الظهري من نصف الكرة الأرضية واحد من أجل إعداد الدماغ لتشريح أفقي (انظر الخطوة 3.9). (D) الإسقاط متساوي القياس من اتجاه الدماغ على لوحة عينة من هزاز. (E) الكرتون توضح وجهة نظر أعلى من موقف نصفي الكرة الأرضية على لوحة العينة. (F) الرسوم المتحركة تظهر موقف الحصين في شريحة الدماغ الأفقي. يشار إلى مناطق الجيروسكوب (DG) و Cornu Ammonis (CA) - Subiculum (SB) من قرن آمونوس. (G) صورة لغرفة الإنعاش مع ACSF carbogenated تحتوي على عشر شرائح الدماغ الأفقي شرائح الطازجة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
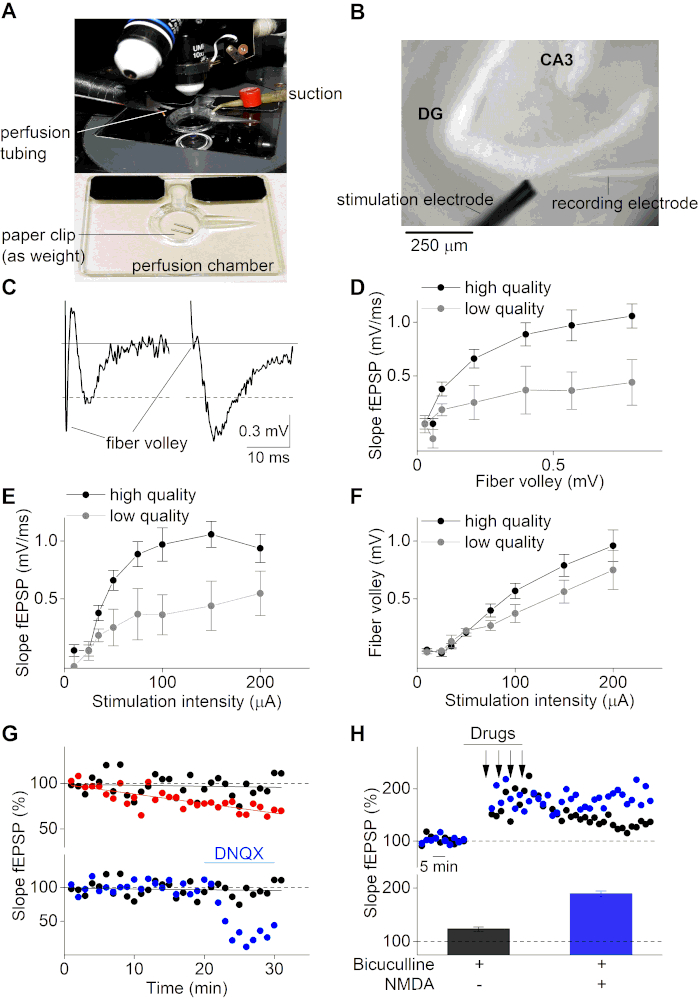
الشكل 3: التسجيلات الكهربية لشرائح الدماغ في فرس النهر. (أ) صورة لغرفة تسجيل مع التسريب والشفط ، وتستخدم تحت المجهر تستقيم. سيتم وضع شريحة الدماغ في الغرفة وشل حركتها بقطعة من مشبك ورقي قبل بدء التسجيلات. (B) صورة حقل مشرق لشريحة الدماغ فرس النهر تحت مجهر تستقيم (10x الهدف). يشار إلى الجيروسكوب (DG) ومنطقة CA3 وكذلك التحفيز (أسفل اليسار) وتسجيل (أسفل اليمين) الأقطاب الكهربائية ، التي تستهدف مسار الثقوب الوسيطة خلال تسجيلات fEPSP. (C) اليسار: تمثيل مثال شريحة منخفضة الجودة من تسجيل fEPSP مع كرة الألياف القوية والسعة الصغيرة. الحق: مثال شريحة عالية الجودة من تسجيل fEPSP. يشير الخط الرمادي إلى مستوى الأساس. تشير الخطوط المنقطّة إلى السعة الفاصلة التي تُقَدّد 0.5 ملّيفولت. (D) مؤامرة من منحدر fepSP مقابل السعة FV للجودة العالية (أسود؛ n = 10) وشرائح الدماغ منخفضة الجودة (الرمادي؛ n = 4). البيانات الممثلة في المتوسط ± SEM. (E) الرسم على المدخلات والمخرجات (منحدر fEPSP) لشدات التحفيز المختلفة (μA) لشرائح عالية الجودة (أسود؛ ن = 10) وشرائح منخفضة الجودة (الرمادي؛ ن = 4)). (F) نفس في (E) ولكن لـ FV السعات مقابل كثافة التحفيز. (G) مسار زمني من ثلاثة تسجيلات fepSP خط الأساس مختلفة (منحدر fEPSP في ٪; تطبيع إلى متوسط fEPSP المنحدر من أول 5 دقائق). يمثل اللوحة العلوية مثالًا إيجابيًا (أسود) وسلبي (أحمر) ، حيث يحتوي الأخير على خط أساس غير مستقر بسبب إغفال كاربوجين أثناء التسجيل. لوحة أقل يظهر اثنين من التسجيلات الأساسية مستقرة في المعالجة (بعد 20 دقيقة من خط الأساس مستقرة، تم حظر مستقبلات AMPA من قبل تطبيق خصم مستقبلات AMPA DNQX (10 ميكرومتر)) (الأزرق) وحالة غير المعالجة (أسود). (H) دورة زمنية تسجيلات LTP لظروف العلاج المختلفة (المشار إليها في اللوحة السفلية). لون أسود لتطبيق بيكوكولين (20 ميكرومتر) أثناء التكييف والأزرق للتطبيق المشترك من Bicuculline (20 ميكرومتر) و NMDA (10 ميكرومتر) أثناء التكييف. تشير الأسهم في اللوحة العليا إلى النقاط الزمنية التي تم فيها تطبيق تحفيز التردد العالي (4 × 1s من 100 هرتز). يمثل الرسم البياني الشريطي في اللوحة السفلية متوسط منحدرات fEPSP (٪) لمدة 50-60 دقيقة بعد إدخال LTP للتجارب الموضحة في اللوحة العلوية (تسجيل ممثل واحد لكل حالة). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
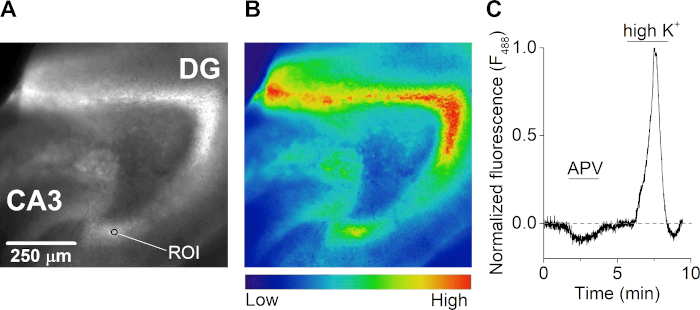
الشكل 4: قياس الفلوروميوريات الكالسيوم من شرائح الدماغ قرن آمون. (أ وباء) صورة الفلوريسنس (متحمس في 488 نانومتر) (A) والخريطة الحرارية المقابلة (B) من شريحة الدماغ فرس النهر الأفقي من الدماغ الماوس. الجيروسكوبات (DG)، CA3 المنطقة، وكمثال على منطقة الاهتمام (ROI) في اللوحة A. (C) الوقت بالطبع من استجابات الكالسيوم (F488 نانومتر) من عائد الاستثمار في gyrus dentate من شريحة الدماغ فرس النهر الحادة أثناء العلاج مع مستقبل NMDA خصم APV (50 ميكرومتر) والحل الذي يحتوي على البوتاسيوم خارج الخلية عالية (K+) (50 mM). يتم تطبيع التتبع إلى أعلى استجابة الكالسيوم أثناء ارتفاع K+ perfusion ويتم تصحيح خط الأساس لphotobleaching. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
على الرغم من أن تستخدم عادة بين المجتمع علم الأعصاب, تواجه أيضا مستحضرات شريحة الدماغ مع العديد من العيوب. على سبيل المثال، لم تعد توصيلات المدخلات والمخرجات إلى مناطق الدماغ ذات الأهمية مرتبطة في شريحة الدماغ. وعلاوة على ذلك، بمجرد عزل، الأنسجة يبدأ تتحلل ببطء مع مرور الوقت وهذه العملية يمكن أن تغير الظروف الفسيولوجية لشريحة الدماغ. هذا الموضوع على وجه الخصوص هو مقلق جدا لأن معظم تسجيلات شريحة الدماغ تستغرق عدة دقائق إلى ساعات، مما يؤدي في أيام تجريبية طويلة مع التسجيلات التي أجريت على الأنسجة التي تم عزلها تصل إلى 6-8 ساعة قبل بدء التجربة. وعلاوة على ذلك، يحصل انقطاع السائل النخاعي والدورة الدموية أثناء الاستعدادات شريحة، مما قد يؤدي إلى عدم وجود المركبات الذاتية الهامة داخل شريحة الدماغ. والأكثر وضوحا، فإن إجراء تشريح نفسها قد يسبب تلف الأنسجة الميكانيكية التي قد تعرض للخطر النتائج التي تم الحصول عليها. ومع ذلك ، فإن الفوائد الفعلية من الاستعدادات شريحة الدماغ لا تزال تفوق عيوبها ، وهذا هو السبب في أنها تقدم تقنية عالية القيمة والموظفة في أبحاث علم الأعصاب.
شرائح الدماغ فرس النهر الحادة تقديم تقنية قوية، وبالتالي تستخدم على نطاق واسع للتحقيق في العمليات العصبية من المستوى الجزيئي حتى دراسات دائرة الدماغ المعقدة. ويستند هذا على استئصال الأعصاب المثالي من قرن آمون التي يمكن الحفاظ عليها بسهولة في إعداد شريحة18. وبالتالي، يتم استخدام شرائح الدماغ فرس النهر في مجموعة واسعة من مشاريع البحث العلمي، بما في ذلك فحص المخدرات17، دراسات الخصائص العصبية وs synaptic المشاركة في الوظائف المعرفية40,41, والتحقيقات من ظروف الدماغ المرضية14,42,43. ومع ذلك، هناك مجموعة واسعة من التطبيقات المختلفة أيضاً، مما يؤدي إلى مجموعة واسعة من بروتوكولات إعداد الشرائح المتاحة التي يمكن أن تختلف في مختلف البارامترات، مثل حالات التشريح وشريحة القطع، من بين أمور أخرى. ولذلك، فإن مسألة البحث الدقيق لمشروع علمي يجب أن تحدد من أجل اختيار بروتوكول إعداد شريحة مناسبة.
المروحية الأنسجة يعرض واحدة من أقدم التقنيات المستخدمة من أجل إعداد شرائح الدماغ فرس النهر44,45. وتشمل المزايا الرئيسية لهذا الأسلوب إعداد انخفاض تكلفة المروحية وسريعة وسهلة الاستخدام46. ومع ذلك، تسبب المروحيات الأنسجة الإجهاد الميكانيكية التي تؤدي إلى التعديلات المورفولوجية وموت الخلايا47. وبالمقارنة، فإن الاهتزاز هو آلة مكلفة نوعا ما، ويزداد وقت إعداد الشريحة بشكل كبير مما قد يؤثر على جودة الشريحة. ومع ذلك، فإن الاهتزاز عادة ما يقدم طريقة أكثر لطفا لفصل شرائح من الأنسجة ويسمح للحفاظ على الدماغ تبريد لطيف وأوكسيجين على إجراء العزلة كامل، وبالتالي تحسين خصائص شريحة46. ولذلك، العديد من المجموعات تستخدم معيار هذه التقنية وجلبت بروتوكولات إلى الأمام لإعداد شرائح الدماغ قرن آمون الحاد باستخدام هزاز16،30،48. في حين أن بعض البروتوكولات توفر بعض التفاصيل فقط لشرائح نفسها ولكن بدلا من التركيز على تطبيق محدد من هذه الشريحة إعداد48، والبعض الآخر توفير بروتوكولات شريحة مفصلة التي تختلف في قطع الطائرة أو غيرها من تفاصيل البروتوكول (على سبيل المثال، agarose تضمين أو حلول شريحة / الانتعاش) نظرا في هذه المادة27،30.
البروتوكول الموصوف هنا يقدم طريقة مباشرة من أجل إعداد عالية الجودة شرائح الدماغ الماوس فرس النهر الأفقي الحاد من الحيوانات الصغيرة. البروتوكول مفيد بشكل خاص للحفاظ على مسار perforant (الوسيطة والاتية) التي تقدم مسار المدخلات قرن آمون، الذي مشاريع من القشرة entorhinal إلى الحصين8،49،50. القوس، والإكليلية، فضلا عن معزولة قرن آمون الاستعدادات شريحة عرضية لا تحافظ بشكل صحيح على مسار perforant، والتي تنبع من الطبقات الثانية والخامسة أساسا من القشرة entorhinal والمشاريع إلى عدة مناطق داخل الحصين18. نظرا لتحديد المواقع التشريحية من القشرة entorhinal فيما يتعلق قرن آمون، شرائح الدماغ الأفقي هي ضرورة من أجل الحفاظ على سليمة تماما ألياف المسار perforant داخل إعداد شريحة31. بالإضافة إلى ذلك، تشريح الأفقي يحافظ بشكل مثالي على الألياف الطحلب التي المشروع من الجيروزاز إلى الخلايا العصبية CA3 داخل الحصين9،30،50. ولذلك، فإن طريقة الإعداد هذه ذات قيمة عالية للدراسات التي تحقق مسارات مدخلات فرس النهر والعمليات ذات الصلة DG. وبالإضافة إلى ذلك، يسمح هذا البروتوكول بالتحقيق في مسار الضمان شيفر50. ومع ذلك، الاستعدادات شريحة الدماغ القوس والإنليلية هي أكثر شيوعا عند التحقيق CA3 إلى توقعات الألياف CA1، ويفترض بسبب وقت إعدادها أسرع قليلا التي يمكن أن تزيد من فرصة الحصول على شرائح عالية الجودة. ومع ذلك، الاستعدادات شريحة قرن آمون الأفقي تقديم أداة بحثية قوية لأنه يسمح الحفاظ والتحقيق في جميع مسارات الألياف فرس النهر داخل شريحة واحدة نصف الكرة الأرضية. ويمكن أن يكون هذا مفيداً بشكل خاص عند دراسة استجابات الدوائر، على سبيل المثال، في تسجيلات فحص القطب المتعدد.
مصدر قلق كبير عند إعداد شرائح الدماغ هو الحفاظ السليم على أنسجة الدماغ. ويتم ذلك من خلال عدة خطوات حاسمة في بروتوكول لدينا، بما في ذلك تشريح سريع، والأكسجين المستمر والكافي وتبريد الأنسجة، وحماية أنسجة المخ باستخدام طريقة قطع واقية مع محلول تقطيع منخفض الصوديوم، عالي السكروز39،51. على الرغم من حقيقة أن البروتوكول الموصوف هنا ينتج معدل نجاح حوالي 90٪، قد تكون هناك حاجة إلى خطوات وقائية إضافية محتملة عند العمل مع الأنسجة المشتقة من الحيوانات القديمة أو المتنوعة وراثيا أو عند محاولة الحفاظ على مجموعة خلايا محددة. وقد تم بالفعل الإبلاغ عن عدة طرق لحماية الاستعدادات الحساسة للأنسجة في الدماغ. وتشمل هذه الطرق استخدام NMDG القائم على حلول تشريح للحد من تغلغل الصوديوم52، واستخدام مستويات عالية من المغنيسيوم في حل تشريح من أجل منع نشاط مستقبلات NMDA53، والاستخدام المطول للحلول الوقائية أيضا خلال فترة النقاهة23. كل هذه التدابير سوف يؤدي إلى انخفاض السمية. بالإضافة إلى ذلك، يتم استخدام التسريب عبر كاردي مع الجليد الباردة حلول واقية ACSF وضرورية عند العمل مع الحيوانات القديمة27.
تناسب شرائح الدماغ الحصين الحادة بشكل مثالي وتستخدم على نطاق واسع للدراسات الفيزيولوجية الكهربائية لأسباب مثل إشارات السعة العالية التي يمكن الحصول عليها من شريحة الدماغ الحادة (300-500 ميكرومتر) السميكة نسبيًا ، والتي تضمن إشارة عالية إلى نسبة الضوضاء11. التطبيقات الكهربائية المستخدمة في القياسات تشمل تسجيلات الحقول خارج الخلية وتسجيلات الخلية الكاملة داخل الخلية في وضع الجهد أو المشبك الحالي. من أجل الحصول على بيانات عالية الجودة الكهربائية الفيزيولوجية، وصحة شريحة هو مصدر قلق رئيسي ويمكن ضمانها من خلال اتباع صارم البروتوكول المقدم. ومع ذلك، بما أن تحضيرات الشرائح تقدم تقنية حساسة للغاية، ينبغي أن يتم تضمين فحص الجودة بشكل روتيني قبل بدء كل تجربة. يمكن استخدام العديد من المعلمات كفحص جودة الشريحة ويتم تقييمها بشكل قياسي عبر منحنيات الإدخال والمخرجات وتسجيلات fEPSP أو EPSC19. ومع ذلك، تجدر الإشارة إلى أن الخصائص الكهروفيزيولوجية دون الأمثل يمكن أن تنشأ من أخطاء تجريبية مثل تحديد المواقع الكهربائي، والتوجه أو حتى الضرر ولا تمثل فقط صحة الشريحة المعدة. ولذلك، فمن المستحسن لتنفيذ ضوابط الجودة إضافية مثل التصور بسيطة وتقييم الخلايا تحت هدف 40x أو تلطيخ نواة DAPI. ويمكن استخدام هذه الشيكات الجودة لتأكيد صحة شريحة ثابتة على مدى عدة شرائح دورات التحضير.
يمثل قياس الفلوروريوم الكالسيوم تقنية أقل شيوعًا لدراسة شرائح الدماغ في فرس النهر. ومع ذلك، هذه التقنية هي ذات قيمة إضافية لتسجيلات القطب خارج الخلية والخلايا القياسية، كما أنها تسمح لتصور وقياس تدفقات الكالسيوم داخل الخلايا، والتي هي ذات أهمية كبيرة في إشارات الخلايا العصبية والتشابك. وتشارك التغيرات في تركيزات الكالسيوم داخل الخلايا في إطلاق الخلايا العصبية, الجيل المحتمل بعد تينابتيك, تنظيم اللدونة متشابك ومحور عصبي موصلالعصب 54,55,56. وكمثال على هذه التقنية (الشكل 4) ، استخدمنا صبغة الكالسيوم المتاحة تجاريًا. لا جدال، يمكن أن يؤدي علاج شرائح الأنسجة مع أصباغ الكالسيوم إلى صعوبات مثل زيادة الإطار الزمني التجريبي وكذلك التحميل غير الفعال للخلايا العصبية الأقل تحديدًا. ومع ذلك، يمكن استخدام الاختلافات على هذه التقنية للتحايل على هذه التحديات التقنية. على سبيل المثال، من الممكن الجمع بين قياسات الكالسيوم وتسجيلات المشبك في شرائح فرس النهر. وبهذه الطريقة، يمكن تحميل صبغة فلورية الكالسيوم في خلية محددة من خلال ماصة التصحيح، مما يسمح بقياسات ديناميات الكالسيوم في خلية واحدة محددة من الفائدة57. وبدلاً من ذلك، يمكن استخدام الحيوانات المهندسة وراثياً التي تعبر عن مؤشر الكالسيوم، GCaMP58،إما في الدماغ كله، أو التي يقودها مروج خاص بالخلايا. ومن المثير للاهتمام، أنسجة الدماغ من الحيوانات GCaMP مع رابط مباشر إلى البروتين من الفائدة يمكن أن توفر فرصا لتحديد نمط التعبير العصبي أو التحقيق في المشاركة في شرارات الكالسيوم وموجات.
وإجمالا، فإننا نقدم المبادئ التوجيهية لإعداد ناجح لشرائح الدماغ الدماغ فرس النهر الأفقية صحية وقابلة للتطبيق من الفئران للتسجيلات الكهربائية والفيزيائية والتصوير. هذه المنهجية مفيدة جدا للوصول إلى التغيرات العصبية التي تحدث في أمراض الدماغ التي يتم وصفها في الجيروز.
Disclosures
ليس لدى أصحاب البلاغ ما يكشفون عنه.
Acknowledgements
نشكر وحدة الفيزيولوجيا الكهربائية في مركز VIB-KU Leuven لأبحاث الدماغ والأمراض تحت إشراف الدكتور كيمبي ويردا والبروفسور الدكتور جوريس دي ويت لاستخدام مرافق أبحاثهم. وعلاوة على ذلك، نشكر جميع أعضاء مختبر أبحاث قناة أيون ومختبر بطانة الرحم، بطانة الرحم والطب التناسلي في جامعة كو لوفين على مناقشاتهم وتعليقاتهم المفيدة.
وقد تلقى هذا المشروع تمويلا من مؤسسة البحوث الفلاندرز (G.084515N وG.0B1819N إلى J.V.) ومجلس البحوث في جامعة لوفين (C1-funding C14/18/106 إلى J.V.). K.P. هو FWO [PEGASUS]2 ماري Skłodowska-كوري زميل وتلقى التمويل من الاتحاد الأوروبي أفق 2020 برنامج البحوث والابتكار بموجب اتفاق منحة ماري Skłodowska كوري (665501) مع مؤسسة البحوث فلاندرز (FWO) (12T0317N). ك. ه. هو زميل ما بعد الدكتوراه في مؤسسة البحوث فلاندرز، بلجيكا (12U7918N).
Materials
| Name | Company | Catalog Number | Comments |
| Anesthesia chamber | home made - Generic | N/A | plexiglas |
| Anesthesia vaporizer | Dräger & MSS International Ltd | Isoflurane Vapor 19.3 & MSS Isoflurane | to vaporize isoflurane for rodent anesthetization |
| Barrels for the perfusion system | TERUMO | Hypodermic syringes without needle | https://www.terumotmp.com/products/hypodermics/terumo-hypodermic-syringes-without-needle.html |
| Bicuculline methiodide | hellobio | HB0893 | https://www.hellobio.com/bicuculline-methiodide.html |
| Borosilcate glass capillaries | Science Products | GB150F-8P | https://science-products.com/en/shop/micropipette-fabrication-1/capillary-glass-for-micropipette-pullers/borosilicate-glass-capillaries/borosilicate-filament-polished |
| Calcium chlorid dihydrate | Merck | 102382 | https://www.merckmillipore.com/BE/en/product/Calcium-chloride-dihydrate,MDA_CHEM-102382?ReferrerURL=https%3A%2F%2Fwww.google.com%2F |
| Calcium Imaging software | Till Photonics | LiveAcquisition v2.3.0.18 | |
| Carbogen tank | Air Liquide | Alphagaz mix B50 | Gasmixture CO2/O2: 5/95, purity 5 |
| Cluster microelectrode | FHC | CE2C55 | https://www.fh-co.com/product/cluster-microelectrodes/ |
| Culture dish (35 mm) | Corning Life Sciences | 353001 | https://ecatalog.corning.com/life-sciences/b2c/US/en/Cell-Culture/Cell-Culture-Vessels/Dishes%2C-Culture/Falcon®-Cell-Culture-Dishes/p/353001 |
| Culture dish (90 mm) | Thermo Fisher Scientific | 101VR20 | https://www.thermofisher.com/order/catalog/product/101R20#/101R20 |
| Curved forceps | Fine Science tools | 11270-20 | https://www.finescience.de/de-DE/Products/Forceps-Hemostats/Dumont-Forceps/Dumont-7b-Forceps/11270-20 |
| D-AP5 | hellobio | HB0225 | https://www.hellobio.com/dap5.html |
| D-(+)-Glucose monohydrate | Sigma Aldrich | 16301 | https://www.sigmaaldrich.com/catalog/product/sial/16301?lang=en®ion=BE |
| Digital CMOS camera | HAMAMATSU | ORCA-spark C11440-36U | https://www.hamamatsu.com/eu/en/product/type/C11440-36U/index.html |
| Dissection scissors | Fine Science tools | 14058-09 | https://www.finescience.de/de-DE/Products/Scissors/Standard-Scissors/Fine-Scissors-ToughCut®/14058-09 |
| DNQX | hellobio | HB0262 | https://www.hellobio.com/dnqx-disodium-salt.html |
| EMCCD camera | Andor | iXon TM + DU-897E-CSO-#BV | https://andor.oxinst.com/products/ixon-emccd-cameras?gclid=CjwKCAjw97P5BRBQEiwAGflV6ULsKjXfhN2YZxtvsWAmF4QghyXZKuqYHVMa6KU9JyS80ATQkSKeBBoCIM0QAvD_BwE |
| EPC10 USB Double Patch Clamp Amplifier | HEKA Elektronik | 895278 | https://www.heka.com/sales/brochures_down/bro_epc10usb.pdf |
| Filter paper | VWR | 516-0818 | grade 413 |
| Fine brush | Raphael Kaerell | 8204 | Size #1 |
| 18G needle | Henke Sass Wolf Fine-Ject | 18G X 1 1/2" 4710012040 | https://www.henkesasswolf.de/cms/de/veterinaer_produkte/produkte_vet/einmalkanuelen/hsw_henke_ject_einmalkanuelen/ |
| Isoflurane | Dechra Veterinary Products | Iso-Vet 1000mg/g | 250 ml bottle |
| Loctite 406 | Henkel Adhesive technologies | Loctite 406 | Super glue |
| Magnesium sulfate heptahydrate | Merck | 105886 | https://www.merckmillipore.com/BE/en/product/Magnesium-sulfate-heptahydrate,MDA_CHEM-105886?ReferrerURL=https%3A%2F%2Fwww.google.com%2F |
| Micromanipulator | Luigs & Neumann | SM-10 with SM-7 remote control system | https://www.luigs-neumann.org |
| Microscope (for calcium imaging) | Olympus | BX51WI | https://www.olympus-lifescience.com/de/microscopes/upright/bx61wi/ |
| Microscope (for ephys recordings) | Zeiss | Axio Examiner.A1 | https://www.micro-shop.zeiss.com/de/de/system/axio+examiner-axio+examiner.a1-aufrechte+mikroskope/10185/ |
| Microscope light source | CAIRN Research | dual OptoLed power supply | https://www.cairn-research.co.uk/product/optoled/ |
| Monochromator | Till Photonics | Polychrome V | |
| N-Methyl-D-aspartic acid (NMDA) | Sigma Aldrich | M3262 | https://www.sigmaaldrich.com/catalog/product/sigma/m3262?lang=en®ion=BE |
| Oregon Green® 488 BAPTA-1 | Invitrogen Molecular Probes | #06807 | 10x50ug |
| Osmometer | Wescor | 5500 vapor pressure osmometer | to verify osmolarity of salt solutions |
| Peristaltic pump | Thermo Fisher Scientific | Masterflex C/L 77120-62 | https://www.fishersci.be/shop/products/masterflex-peristaltic-c-l-dual-channel-pump-2/p-8004229 |
| pH meter | WTW | inoLab series pH 720 | https://www.geminibv.nl/wp-content/uploads/manuals/wtw-720-ph-meter/wtw-inolab-ph-720-manual-eng.pdf |
| Pipette puller | Sutter Instrument | P-1000 | https://www.sutter.com/MICROPIPETTE/p-1000.html |
| Potassium chlorid | Chem-lab | CL00.1133 | https://www.chem-lab.be/#/en-gb/prod/1393528 |
| Potassium dihydrogen phosphate | Merck | 104873 | https://www.merckmillipore.com/BE/en/product/Potassium-dihydrogen-phosphate,MDA_CHEM-104873?ReferrerURL=https%3A%2F%2Fwww.google.com%2F |
| Razor blade to prepare hemispheres | SPI supplies | Safety Cartridge Dispenser - Pkg/10 | GEM Scientific Single Edge Razor Blades |
| Razor blade for vibratome | Ted Pella Inc | 121-6 | double edge breakable style razor blades (PTFE-coated stainless steel) |
| Recovery chamber | home made - Generic | N/A | to collect and store brain slices in (see details in manuscript) |
| Scissors | Any company | N/A | Blade should be well sharpened and at least 15 cm long for easy decapitation |
| Silver electrode wire | Any company | for recording and reference electrodes | |
| Sodium dihydrogen phosphate dihydrate | Merck | 106342 | https://www.merckmillipore.com/BE/en/product/Sodium-dihydrogen-phosphate-dihydrate,MDA_CHEM-106342?ReferrerURL=https%3A%2F%2Fwww.google.com%2F |
| Sodium hydrogen carbonate | Alfa Aesar | 14707 | https://www.alfa.com/en/catalog/014707/ |
| Sodium chlorid | Fisher Scientific | S/3160/60 | https://www.fishersci.co.uk/shop/products/sodium-chloride-certified-ar-analysis-meets-analytical-specification-ph-eur/10428420 |
| Software for field recordings | HEKA Elektronik | PatchMaster | https://www.heka.com/downloads/software/manual/m_patchmaster.pdf |
| Spatula | Sigma Aldrich | S9147-12EA | https://www.sigmaaldrich.com/catalog/product/sigma/s9147?lang=en®ion=BE |
| Stimulator | A.M.P.I | ISO-FLEX | http://www.ampi.co.il/isoflex.html |
| Sucrose | VWR International Ltd. | 102745C | https://es.vwr-cmd.com/ex/downloads/magazine/lupc_userguide_uk.pdf |
| Tubing for carbogen, perfusion and suction lines 1 | Warner Instruments | 64-0167 | Tygon tubing (TY-50) for standard valve systems |
| Tubing for carbogen, perfusion and suction lines 2 | Fisher Scientific | 800/100/200 & 800/100/280 | Smiths Medical Portex Fine Bore LDPE Tubing |
| Vacuum pump | home made - Generic | N/A | |
| 8 valve multi-barrel perfusion system | home made | N/A | consists of barrels, tubing and a self-made automated valve control (specifications of all purchased parts can be found in this Table) |
| Magnetic valves (to control the perfusion lines) | NResearch Inc. | p/n 161P011 | https://nresearch.com/ |
| Vibratome | Leica | 14912000001 | Semi-automatic vibrating blade microomei VT1200 |
| Water bath | Memmert | WNB 7 | https://www.memmert.be/wp-content/uploads/2019/09/Memmert-Waterbath-WNB-7.en_.pdf |
| Water purification system | Merck | Synergy millipore | to obtain highly purified water |
| 12-well plates | Greiner Bio-One | CELLSTAR, 665180 | http://www.greinerbioone.com/UserFiles/File/Catalogue%202010_11/UK/3680_005-Kapitel1_UK.pdf |
References
- Scoville, W. B., Milner, B. Loss of recent memory after bilateral hippocampal lesions. Journal of Neurology, Neurosurgery, and Psychiatry. 20 (1), 11-21 (1957).
- Cavarsan, C. F., Malheiros, J., Hamani, C., Najm, I., Covolan, L. Is mossy fiber sprouting a potential therapeutic target for epilepsy. Frontiers in Neurology. 9, 1023 (2018).
- Nadler, J. V. The recurrent mossy fiber pathway of the epileptic brain. Neurochemical Research. 28 (11), 1649-1658 (2003).
- Raimondo, J. V., et al. Methodological standards for in vitro models of epilepsy and epileptic seizures. A TASK1-WG4 report of the AES/ILAE translational task force of the ILAE. Epilepsia. 58, 40-52 (2017).
- Humpel, C. Organotypic brain slice cultures: A review. Neuroscience. , 86-98 (2015).
- Tohno, Y., et al. Relationships among the hippocampus, dentate gyrus, mammillary body, fornix, and anterior commissure from a viewpoint of elements. Biological Trace Element Research. 140 (1), 35-52 (2011).
- Maclean, P. D. The limbic system and its hippocampal formation; studies in animals and their possible application to man. Journal of Neurosurgery. 11 (1), 29-44 (1954).
- Petersen, R. P., et al. Electrophysiological identification of medial and lateral perforant path inputs to the dentate gyrus. Neuroscience. 252, 154-168 (2013).
- Amaral, D. G., Scharfman, H. E., Lavenex, P. The dentate gyrus: fundamental neuroanatomical organization (dentate gyrus for dummies). Progress in Brain Research. 163, 3-22 (2007).
- Szirmai, I., Buzsaki, G., Kamondi, A. 120 years of hippocampal schaffer collaterals. Hippocampus. 22 (7), 1508-1516 (2012).
- Cho, S., Wood, A., Bowlby, M. R. Brain slices as models for neurodegenerative disease and screening platforms to identify novel therapeutics. Current Neuropharmacology. 5 (1), 19-33 (2007).
- Mathis, D. M., Furman, J. L., Norris, C. M. Preparation of acute hippocampal slices from rats and transgenic mice for the study of synaptic alterations during aging and amyloid pathology. Journal of Visualized Experiments. (49), e2330 (2011).
- Papouin, T., Haydon, P. G. Obtaining Acute Brain Slices. Bio-protocol. 8 (2), 2699 (2018).
- Li, Q., Han, X., Wang, J. Organotypic hippocampal slices as models for stroke and traumatic brain injury. Molecular Neurobiology. 53 (6), 4226-4237 (2016).
- Lo, D. C., McAllister, A. K., Katz, L. C. Neuronal transfection in brain slices using particle-mediated gene transfer. Neuron. 13 (6), 1263-1268 (1994).
- Lein, P. J., Barnhart, C. D., Pessah, I. N. Acute hippocampal slice preparation and hippocampal slice cultures. Methods in Molecular Biology. 758, 115-134 (2011).
- Magalhaes, D. M., et al. Ex vivo model of epilepsy in organotypic slices-a new tool for drug screening. Journal of Neuroinflammation. 15 (1), 203 (2018).
- Bliss, T., Andersen, P., Morris, R., Amaral, D., O'Keefe, J. . The hippocampus book. , 37-114 (2007).
- Bortolotto, Z. A., Amici, M., Anderson, W. W., Isaac, J. T. R., Collingridge, G. L. Synaptic plasticity in the hippocampal slice preparation. Current Protocols in Neuroscience. 54 (1), 11-26 (2011).
- Al-Osta, I., et al. Imaging calcium in hippocampal presynaptic terminals with a ratiometric calcium sensor in a novel transgenic mouse. Frontiers in Cellular Neuroscience. 12, 209 (2018).
- McLeod, F., Marzo, A., Podpolny, M., Galli, S., Salinas, P. Evaluation of synapse density in hippocampal rodent brain slices. Journal of Visualized Experiments. (128), e56153 (2017).
- Segev, A., Garcia-Oscos, F., Kourrich, S. Whole-cell patch-clamp recordings in brain slices. Journal of Visualized Experiments. (112), e54024 (2016).
- Ting, J. T., Daigle, T. L., Chen, Q., Feng, G. Acute brain slice methods for adult and aging animals: application of targeted patch clamp analysis and optogenetics. Methods in Molecular Biology. 1183, 221-242 (2014).
- Weng, W., Li, D., Peng, C., Behnisch, T. Recording synaptic plasticity in acute hippocampal slices maintained in a small-volume recycling-, perfusion-, and submersion-type chamber system. Journal of Visualized Experiments. (131), e55936 (2018).
- Zhou, Q., Abe, H., Nowak, T. S. Immunocytochemical and in situ hybridization approaches to the optimization of brain slice preparations. Journal of Neuroscience Methods. 59 (1), 85-92 (1995).
- Koike-Tani, M., Tominaga, T., Oldenbourg, R., Tani, T. Birefringence changes of dendrites in mouse hippocampal slices revealed with polarizing microscopy. Biophysical Journal. 110 (10), 2366-2384 (2020).
- Ting, J. T., et al. Preparation of acute brain slices using an optimized N-Methyl-D-glucamine protective recovery method. Journal of Visualized Experiments. (132), e53825 (2018).
- Zhao, S., et al. Cell type-specific channelrhodopsin-2 transgenic mice for optogenetic dissection of neural circuitry function. Nature Methods. 8 (9), 745-752 (2011).
- Hua, Y., Keep, R. F., Hoff, J. T., Xi, G. Brain injury after intracerebral hemorrhage: the role of thrombin and iron. Stroke. 38, 759-762 (2007).
- Bischofberger, J., Engel, D., Li, L., Geiger, J. R., Jonas, P. Patch-clamp recording from mossy fiber terminals in hippocampal slices. Nature Protocols. 1 (4), 2075-2081 (2006).
- Paxinos, G., Franklin, K. . The Mouse Brain In Stereotaxic Coordinates. 3 edn. , 256 (2008).
- Lacar, B., Young, S. Z., Platel, J. C., Bordey, A. Preparation of acute subventricular zone slices for calcium imaging. Journal of Visualized Experiments. (67), e4071 (2012).
- Schauer, C., Leinders-Zufall, T. Imaging calcium responses in GFP-tagged neurons of hypothalamic mouse brain slices. Journal of Visualized Experiments. (66), e4213 (2012).
- Tetteh, H., Lee, J., Lee, J., Kim, J. G., Yang, S. Investigating Long-term Synaptic Plasticity in Interlamellar Hippocampus CA1 by Electrophysiological Field Recording. Journal of Visualized Experiments. (150), e59879 (2019).
- Smith, C. J., et al. Investigations on alterations of hippocampal circuit function following mild traumatic brain injury. Journal of Visualized Experiments. (69), e4411 (2012).
- McNaughton, B. L. Evidence for two physiologically distinct perforant pathways to the fascia dentata. Brain Research. 199 (1), 1-19 (1980).
- Colino, A., Malenka, R. C. Mechanisms underlying induction of long-term potentiation in rat medial and lateral perforant paths in vitro. Journal of Neurophysiology. 69 (4), 1150-1159 (1993).
- Coulter, D. A., Carlson, G. C. Functional regulation of the dentate gyrus by GABA-mediated inhibition. Progress in Brain Research. 163, 235-243 (2007).
- Kuenzi, F. M., Fitzjohn, S. M., Morton, R. A., Collingridge, G. L., Seabrook, G. R. Reduced long-term potentiation in hippocampal slices prepared using sucrose-based artificial cerebrospinal fluid. Journal of Neuroscience Methods. 100 (1-2), 117-122 (2000).
- Connor, S. A., et al. Loss of synapse repressor MDGA1 enhances perisomatic inhibition, confers resistance to network excitation, and impairs cognitive function. Cell Reports. 21 (13), 3637-3645 (2017).
- Lisman, J., et al. Viewpoints: how the hippocampus contributes to memory, navigation and cognition. Nature Neuroscience. 20 (11), 1434-1447 (2017).
- Moodley, K. K., Chan, D. The hippocampus in neurodegenerative disease. Frontiers of Neurology and Neuroscience. 34, 95-108 (2014).
- Kong, H., et al. Inhibition of miR-181a-5p reduces astrocyte and microglia activation and oxidative stress by activating SIRT1 in immature rats with epilepsy. Laboratory Investigation; A Journal of Technical Methods and Pathology. , (2020).
- Skrede, K. K., Westgaard, R. H. The transverse hippocampal slice: a well-defined cortical structure maintained in vitro. Brain Research. 35 (2), 589-593 (1971).
- Schwartzkroin, P. A. Characteristics of CA1 neurons recorded intracellularly in the hippocampal in vitro slice preparation. Brain Research. 85 (3), 423-436 (1975).
- Wang, T., Kass, I. S. Preparation of brain slices. Methods in Molecular Biology. 72, 1-14 (1997).
- Garthwaite, J., Woodhams, P. L., Collins, M. J., Balazs, R. On the preparation of brain slices: morphology and cyclic nucleotides. Brain Research. 173 (2), 373-377 (1979).
- Booker, S. A., Song, J., Vida, I. Whole-cell patch-clamp recordings from morphologically- and neurochemically-identified hippocampal interneurons. Journal of Visualized Experiments: JoVE. (91), e51706 (2014).
- Aydin-Abidin, S., Abidin, &. #. 3. 0. 4. ;. 7,8-Dihydroxyflavone potentiates ongoing epileptiform activity in mice brain slices. Neuroscience Letters. 703, 25-31 (2019).
- Xiong, G., Metheny, H., Johnson, B. N., Cohen, A. S. A comparison of different slicing planes in preservation of major hippocampal pathway fibers in the mouse. Frontiers in Neuroanatomy. 11, 107 (2017).
- Aghajanian, G. K., Rasmussen, K. Intracellular studies in the facial nucleus illustrating a simple new method for obtaining viable motoneurons in adult rat brain slices. Synapse. 3 (4), 331-338 (1989).
- Tanaka, Y., Tanaka, Y., Furuta, T., Yanagawa, Y., Kaneko, T. The effects of cutting solutions on the viability of GABAergic interneurons in cerebral cortical slices of adult mice. Journal of Neuroscience Methods. 171 (1), 118-125 (2008).
- Reid, K. H., Edmonds, H. L., Schurr, A., Tseng, M. T., West, C. A. Pitfalls in the use of brain slices. Progress in Neurobiology. 31 (1), 1-18 (1988).
- Brini, M., Calì, T., Ottolini, D., Carafoli, E. Neuronal calcium signaling: function and dysfunction. Cellular and Molecular Life Sciences: CMLS. 71 (15), 2787-2814 (2014).
- Gleichmann, M., Mattson, M. P. Neuronal calcium homeostasis and dysregulation. Antioxidants & Redox Signaling. 14 (7), 1261-1273 (2011).
- Padamsey, Z., Foster, W. J., Emptage, N. J. Intracellular Ca(2+) release and synaptic plasticity: a tale of many stores. The Neuroscientist: A Review Journal Bringing Neurobiology, Neurology and Psychiatry. 25 (3), 208-226 (2019).
- Chen-Engerer, H. J., et al. Two types of functionally distinct Ca2+ stores in hippocampal neurons. Nature Communications. 10 (1), 3223 (2019).
- Akerboom, J., et al. Optimization of a GCaMP calcium indicator for neural activity imaging. The Journal of Neuroscience: The Official Journal of the Society for Neuroscience. 32 (40), 13819-13840 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved