Method Article
نموذج تجريبي لتقييم حل الالتهاب الرئوي
In This Article
Erratum Notice
Summary
تصف هذه المخطوطة إنشاء نموذج معدي للالتهاب الرئوي في الفئران وتوصيف حل الإصابة جنبا إلى جنب مع طرق نمو البكتيريا والتقطير داخل القصبة الهوائية. كما تم وصف نهج جديد باستخدام قياس التدفق الخلوي عالي الأبعاد لتقييم المشهد المناعي.
Abstract
تسبب متلازمة الضائقة التنفسية الحادة (ARDS) إصابة الرئة الحادة ، والتي تتميز بتلف سنخي سريع ونقص تأكسج الدم الشديد. وهذا بدوره يؤدي إلى ارتفاع معدلات المراضة والوفيات. حاليا ، لا توجد نماذج ما قبل السريرية تلخص تعقيد متلازمة الضائقة التنفسية الحادة البشرية. ومع ذلك ، يمكن للنماذج المعدية للالتهاب الرئوي (PNA) تكرار السمات الفيزيولوجية المرضية الرئيسية لمتلازمة الضائقة التنفسية الحادة. هنا ، نصف نموذجا ل PNA الناجم عن التقطير داخل القصبة الهوائية للمكورات العقدية الرئوية الحية و Klebsiella pneumoniae في الفئران C57BL6. من أجل تقييم وتوصيف النموذج ، بعد إحداث الإصابة ، أجرينا قياسات تسلسلية لوزن الجسم وغسل القصبات الهوائية (BAL) لقياس علامات إصابة الرئة. بالإضافة إلى ذلك ، قمنا بحصاد الرئتين من أجل عدد الخلايا والتفاضلات ، وقياس كمية بروتين BAL ، و cytospin ، وعدد وحدات تشكيل المستعمرات البكتيرية ، وعلم الأنسجة. أخيرا ، تم إجراء قياس التدفق الخلوي عالي الأبعاد. نقترح هذا النموذج كأداة لفهم المشهد المناعي خلال مراحل الحل المبكرة والمتأخرة لإصابة الرئة.
Introduction
لا تزال متلازمة الضائقة التنفسية الحادة (ARDS) متلازمة مميتة ومعطلة شائعة تصيب حوالي 10٪ من مرضى وحدة العناية المركزة (ICU) وما يصل إلى 23٪ من الأفراد الخاضعين للتهوية الميكانيكية ، مما يؤدي إلى معدل وفيات في المستشفى يتراوح بين 35٪ و 46٪ 1. علاوة على ذلك ، أعادت جائحة COVID-19 الأخيرة التأكيد على أهمية دراسة متلازمة الضائقة التنفسية الحادة. شكلت الحالات الإيجابية ل COVID-19 زيادة في وفيات متلازمة الضائقة التنفسية الحادة ، مما يسلط الضوء على محدودية العلاجات الدوائية2.
في البشر ، تتميز متلازمة الضائقة التنفسية الحادة بالظهور السريع لنقص الأكسجة في الدم (PaO2 / FiO2 < 300) ودليل على الوذمة الرئوية الثنائية غير الهيدروستاتيكية بسبب النفاذية السنخية الشعرية المفرطة والتهاب الأسناخ3. على الرغم من أن متلازمة الضائقة التنفسية الحادة توصف تقليديا بأنها نمط من إصابات الرئة الحادة (ALI) الثانوية لمجموعة متنوعة من الإهانات ، إلا أن الالتهاب الرئوي الجرثومي والفيروسي (PNA) لا يزال من بين الأسباب الأكثر شيوعا. تم وصف ثلاث مراحل فيزيولوجية مرضية رئيسية ، وهي المراحل النضحية والتكاثرية والتليفية ، في حين أن السمتين الأساسيتين الرئيسيتين لمتلازمة الضائقة التنفسية الحادة هما الالتهاب غير المنظم والاضطراب السنخيالشعري 4. خلال هذه العمليات ، يتم إنتاج الإصابة السنخية عن طريق إطلاق السيتوكينات الالتهابية (على سبيل المثال ، عامل نخر الورم [TNF-α] ، إنترلوكين [IL-1β ، IL-6 ، IL-8 ، إلخ]) ، تدفق العدلات والبلاعم الالتهابية ، وفيضان السوائل الغنية بالبروتين. في النهاية ، تؤدي هذه الأحداث إلى تلف سنخي غير مكتمل وثنائي5،6،7،8.
على الرغم من إحراز تقدم كبير في فهم إصابات الرئة المبكرة والتهابها ، إلا أن الآليات الكامنة وراء حل PNA أقل شهرة ويجب أن تكون محور التحقيقات الآلية المستقبلية. الهدف الرئيسي من ورقة الطريقة هذه هو تزويد الباحثين بنموذج لحل الإصابات للالتهاب الرئوي المعدي يمكنه تكرار السمات الفيزيولوجية المرضية الرئيسية لمتلازمة الضائقة التنفسية الحادة. نقترح أن يساعد هذا النموذج على فهم أفضل للآليات البيولوجية الكامنة وراء حل التهاب الرئة وإصلاحه ، وبالتالي يكون بمثابة منصة لعلاجات الإنقاذ.
يمكن تكرار مراحل علم الأمراض الفسيولوجية الرئيسية التي تحدث خلال متلازمة الضائقة التنفسية الحادة في النماذج الحيوانية قبل السريرية ل ALI ، والتي يجب أن تتضمن دليلا نسيجيا على الاستجابة الالتهابية ، وإصابة الأنسجة ، والخلل الفسيولوجي ، والتهاب الأسناخ ، وتغيير الحاجز السنخيالشعري 9. يعد نموذج الفأر الذي يحفز PNA و ALI مفيدا نظرا لقابليته العالية للتكاثر ، والتكاثر السريع ، وتوافر أدوات متعددة لإجراء الدراسات الميكانيكية والجزيئية. لا يوجد نموذج واحد يلخص بالكامل جميع ميزات متلازمة الضائقة التنفسية الحادة9 البشرية.
تسمح نماذج PNA في الفئران بتكرار الآليات الفيزيولوجية المرضية الرئيسية التي تنتجها متلازمة الضائقة التنفسية الحادة في البشر ، مثل البداية السريعة ، ودليل إصابة الأنسجة في الأنسجة ، وضعف الحاجز السنخي الشعري ، ودليل على الاستجابة الالتهابية ، والخلل الفسيولوجي مع إنتاج وفيات متواضعة10. يمكن إحداث النماذج المعدية عن طريق التوصيل الموضعي أو الجهازي للممرض ، مع كون الإعطاء داخل الأنف والقصبة الهوائية والوريد أكثر طرق الإعطاء شيوعا. يسمح الطريق داخل القصبة الهوائية بالتلقيح المباشر للعامل المعدي في الرئتين ، مما يقلل من الهباء الجوي ويحسن التسليم11,12.
يتم وصف منهجية نموذج الفئران قبل السريرية ل PNA عن طريق التقطير داخل القصبة الهوائية إما للمكورات العقدية الرئوية الحية (Spn) أو الكلبسيلة الرئوية (Kp). تمثل هذه النماذج بديلا جيدا لمتلازمة الضائقة التنفسية الحادة التي تنتجها بكتيريا PNA ، وتمتلك العديد من المزايا ، بما في ذلك: الأسباب السائدة ل PNA-ARDS البشرية (المكتسبة من المجتمع والمستشفيات) ؛ استنساخ عالية يمكن معايرة الوفيات والإصابات بسهولة (نمذجة درجات مختلفة من الالتهاب الرئوي) لإظهار استجابة التهابية قوية ، مما يؤدي إلى التهاب الأسناخ واختلال وظيفي في الشعيرات الدموية السنخية. تقييم المراحل المبكرة والمتأخرة من إصابة الرئة وحلها ؛ وتقييم الاستراتيجيات العلاجية في مراحل مختلفة من متلازمة الضائقة التنفسية الحادة.
Protocol
تمت الموافقة على جميع بروتوكولات الموصوفة في هذه الدراسة من قبل اللجنة المؤسسية لرعاية واستخدام (ACUC) في كلية الطب بجامعة جونز هوبكنز لبروتوكول MO21M160. بالإضافة إلى ذلك ، تم إجراء التجارب وفقا للوائح المؤسسية والولائية والفيدرالية للبحوث الحيوانية.
تنبيه: يتطلب تكرار جميع البروتوكولات الموصوفة أدناه أن يتم في خزانة مستوى السلامة الأحيائية 2 (BSL-2) ، باتباع جميع المبادئ التوجيهية المؤسسية BSL-2 بموجب خزانة السلامة الأحيائية.
1. طلاء المخزونات البكتيرية من الحلقات التجارية
ملاحظة: يمكن استخدام هذا البروتوكول لزراعة المخزونات البكتيرية ل Spn (ATCC 49619) و Kpn (ATCC 43816) ، بدءا من حلقات culti-loops التي تم الحصول عليها من المزود (انظر جدول المواد للحصول على التفاصيل).
- سخني طبق أجار دم الأغنام بنسبة 5٪ لمدة 15 دقيقة عند 37 درجة مئوية في حاضنة. يمكن استخدام حاضنة الخلايا لهذا الغرض.
- تحت الغطاء ، قم بإزالة الغمد من حلقة التلقيح البكتيرية وانشره بعناية ، مع وضعه في صفيحة أجار ، باتباع نمط متعرج. كرر هذه الخطوة باستخدام لوحة منفصلة كنسخة مكررة. يمكن رسم ما يصل إلى خمس لوحات بنفس الحلقة.
- احتضان الألواح طوال الليل عند 37 درجة مئوية لنمو البكتيريا الأمثل. مرور البكتيريا يوميا لمدة 3 أيام. قم بتسخين ألواح أجار الدم لمدة 15 دقيقة عند 37 درجة مئوية ، وخذ ما بين 15 إلى 20 مستعمرة من صفيحة الآجار الأولى باستخدام حلقة تلقيح يمكن التخلص منها ، وانشرها في صفيحة أجار جديدة مسخنة مسبقا. قم بتسمية اللوحة بشكل مناسب.
2. نمو البكتيريا وتخزينها للاستخدام في المستقبل
- بعد 3 أيام ، التقط ما يصل إلى 30 مستعمرة من صفيحة أجار الدم بحلقة خط ، وضعها مباشرة في قارورة سعة 250 مل تحتوي على مرق تود هيويت (مرق TH). احتضان عند 37 درجة مئوية ، ويهز عند 250 دورة في الدقيقة ، مع 5٪ CO2 لمدة 4 ساعات تقريبا.
- خذ القسمة كل 15 دقيقة لقياس OD620nm حتى تصل إلى 0.3 ، وهو ما يعادل حوالي 3 × 108 وحدات تشكيل مستعمرة (CFU) لكل مل.
- قم بقسمة 1 مل من مخزون البكتيريا الجديد على الفور في قوارير مبردة سعة 2 مل. قم بتجميد القوارير الطازجة في النيتروجين السائل لمدة 5 دقائق. قم بتخزين حصص البكتيريا في ثلاجة -80 درجة مئوية (يمكن استخدام القوارير لمدة تصل إلى 6-8 أشهر قبل أن تفقد فعاليتها).
- بعد 7 أيام من التجميد ، يمكن استخدام القسمة للدراسات على. لذلك ، حدد التركيز الجديد للبكتيريا.
3. ذوبان البكتيريا لتقطير القصبة الهوائية
- قم بتسخين طبق أجار الدم لمدة 10 دقائق عند 37 درجة مئوية في شاكر. خذ إحدى قوارير المرق الجديدة من الفريزر وقم بإذابتها عن طريق التقليب اللطيف في حمام مائي 37 درجة مئوية لمدة 2 دقيقة تقريبا. تجنب لمس الحلقة O أو الغطاء بالماء الدافئ.
- لوحة على صفيحة أجار الدم لحساب المستعمرات البكتيرية يدويا. قم بإجراء تخفيف 1 × 10-6 ، ولوحة 200 ميكرولتر من التخفيف الأخير في صفيحة أجار الدم المسخنة مسبقا. افعل ذلك في التكرارات.
- احتضان الألواح طوال الليل عند 37 درجة مئوية للنمو الأمثل للبكتيريا. في اليوم التالي ، قم بتطبيق الصيغة التالية لتحديد تركيز البكتيريا الجديد: CFU / mL = (عدد المستعمرات × عامل التخفيف) / حجم المخزون المطلي
4. تقطير القصبة الهوائية للبكتيريا الحية
ملاحظة: تم تحسين هذا البروتوكول لغرس حجم 50 ميكرولتر داخل القصبة الهوائية. يمكن تخزين المخزونات البكتيرية لمدة تصل إلى 6-9 أشهر. لضمان CFU البكتيري في كل قارورة ، تأكد من وضعه قبل كل تجربة ، وحساب المخزون البكتيري CFU كما هو موضح أعلاه ، واستخدام مرق TH للتخفيفات اللاحقة.
تنبيه: تحت خزانة السلامة الحيوية ، قم بإجراء بقاء القوارض باستخدام أدوات جراحية معقمة.
- تخدير الفأر عن طريق حقن 100 ملغم/كغم من الكيتامين و2.5 ملغم/كغ من الأسيتيل برومازين داخل الصفاق. كرر لعدد الفئران التي يتم حقنها في وقت واحد.
ملاحظة: يمكن أن تتعرض الفئران للأيزوفلوران لتسهيل التعامل مع. ومع ذلك ، يمكن للمعالج المتمرس القادر على حقن التخدير داخل الصفاق دون التسبب في ضائقة حيوانية كبيرة تجنب التعرض للأيزوفلوران. يعتمد عدد الفئران المراد حقنها على خبرة الجراح. - بعد أن تخضع جميع الفئران للتخدير المناسب ، تأكد من التخدير عن طريق قرصة الذيل. ضع الماوس المخدر على سطح نظيف ومعقم ، وقم بتعليق من القواطع ، وقم بلصق الأطراف الأمامية برفق (الشكل 1 أ).
ملاحظة: لضمان صحة ، قم بتوفير تزييت القرنية في جميع المخدرة. يمكن استخدام قطرات العين كربوكسي ميثيل سلولوز ، وتطبيق قطرة واحدة لكل عين. - حلق منطقة الرقبة وتطهير المنطقة بالكلورهيكسيدين والكحول بنسبة 70٪. باستخدام المقص الجراحي ، قم بعمل شق سطحي في خط الوسط للرقبة بطول 1 سم لتصور القصبة الهوائية (الشكل 1 ب). يجب أن يكون شق صغير واحد كافيا ، ولكن إذا شوهدت وفرة من الأنسجة الدهنية ، فقم بتشريح الأنسجة الدهنية عموديا بعناية لتصور القصبة الهوائية.
ملاحظة: استخدم القفازات المعقمة والأدوات المعقمة عبر تقنية النصائح فقط. خطر العدوى هو الحد الأدنى إذا تم تنفيذ الإجراء في ظل ظروف معقمة. - باستخدام ملقط ، تنبيب كل ماوس. اسحب اللسان للخارج برفق وأدخل قسطرة وعائية 20 جم عبر الفم ، مع دفع القسطرة إلى القصبة الهوائية. ضع ضغطا لطيفا على القصبة الهوائية لتسهيل التنبيب.
ملاحظة: نظرا لأن القصبة الهوائية أمامية لجسم الفأر ، قم بثني طرف القسطرة قليلا ، حيث سيساعد ذلك في الحصول على زاوية لتنبيب الماوس بنجاح. يتم إجراء شق الرقبة بشكل رئيسي لأغراض التصور. بدلا من ذلك ، يمكن للمشغل تنبيب القصبة الهوائية بشكل أعمى. - بعد التنبيب ، قم بتوصيل الماوس بجهاز تنفس لتأكيد التنبيب. معلمات جهاز التنفس الصناعي العادية المستخدمة في هذا الإجراء هي 200 ميكرولتر من حجم السكتة الدماغية و 200 ضربة في الدقيقة. ارفع معدل جهاز التنفس الصناعي لأعلى و / أو لأسفل لفترة وجيزة للتأكيد السريع والسهل.
- بعد التأكد من التنبيب ، افصل الماوس عن جهاز التنفس الصناعي وغرس بعناية 50 ميكرولتر من العامل البكتيري من خلال قسطرة الأوعية الدموية باستخدام طرف تحميل جل ماصة 200 ميكرولتر. للتحكم في الفئران ، قم بحقن 50 ميكرولتر من مرق TH المعقم.
- بعد غرس العامل البكتيري ، قم بتوصيل الماوس بجهاز التنفس الصناعي مرة أخرى للمساعدة في إعادة تشغيل التنفس. اترك الماوس على جهاز التنفس الصناعي لمدة 30-60 ثانية. بعد حقن جميع الفئران ، راقب تنفسهم. إذا كان هناك نمط تنفس بطيء ، فقم بتوصيل الفئران بجهاز التنفس مرة أخرى.
- أغلق الشق بإضافة قطرة صغيرة من الغراء على الجلد. اجمع طيات الجلد معا واضغط برفق حتى يجف الغراء.
- ضع الفئران على وسادة تدفئة للتعافي وراقبها عن كثب حتى تستعيد وعيها الكافي. نقل الفئران مرة أخرى في القفص بمجرد تعافيها بالكامل. لإدارة الألم / الضيق بعد الجراحة ، يمكن علاج الفئران بالبوبرينورفين ، بجرعة 0.05-0.1 مجم / كجم تحت الجلد (SC).
ملاحظة: يجب القتل الرحيم للحيوانات التي تعاني من فقدان الوزن بنسبة تزيد عن 20٪ أو تعاني من ضائقة كبيرة بعد العملية مثل الخمول أو عدم القدرة على الوصول إلى الماء أو الطعام أو صعوبة التنفس أو ضعف الاستجابة للمنبهات الخارجية أو انخفاض اليقظة العقلية.
5. غسل القصبات الهوائية وحصاد الرئة
- القتل الرحيم للماوس عن طريق وضعه في حاوية مغلقة تحتوي على 5 ٪ إيزوفلوران. استمر في التعرض للإيزوفلوران لمدة 1 دقيقة بعد توقف الماوس عن التنفس. إجراء بضع الصدر لتأكيد القتل الرحيم.
ملاحظة: تأكيد القتل الرحيم عن طريق الفحص البصري والبدني. يجب أن يكون القلب قد توقف عن النبض والفئران لا تتنفس. يجب أن تكون الأغشية المخاطية بيضاء أو شاحبة. - ضع الماوس في وضع ضعيف على لوح جراحي نظيف وعلقه بواسطة القواطع. رش جلد الفأر بنسبة 70 ٪ من الإيثانول. باستخدام المقص الجراحي ، قم بعمل شق سطحي صغير في خط الوسط للرقبة لتصور القصبة الهوائية للفأر.
- قنية القصبة الهوائية مع قسطرة 20 غرام. بعناية ، أضف 1 مل من محلول ملحي خال من الكالسيوم (PBS) داخل القصبة الهوائية ، باستخدام حقنة 1 مل. اسمح بتوسيع الرئة بالكامل ، ثم استنشاق السائل باستخدام نفس المحقنة. كرر هذه الخطوة ليصبح المجموع 2 مل.
- نقل BAL إلى 2 مل قسامة. نفذ هذه الخطوة مرتين للحصول على حجم نهائي قدره 2 مل. لا تغسل الرئتين بأكثر من 1 مل في المرة الواحدة ، بسبب ارتفاع خطر اضطراب الفضاء السنخي.
- افتح التجويف الصدري واكشف الرئة والقلب والقصبة الهوائية باستخدام المقص والملقط. تشريح بعناية الحجاب الحاجز وإزالة القفص الصدري. تأكد من عدم قرصة أنسجة الرئة.
- عبر الشريان الأورطي البطني للسماح بالاستنزاف. قم بتغذية أنسجة الرئة عن طريق إجراء شق صغير يبلغ حوالي 2 مم في البطين الأيمن باستخدام المقص وحقن 5 مل من برنامج تلفزيوني بارد باستخدام قسطرة 20 جرام. يجب أن يتخلل برنامج تلفزيوني الرئة. إذا تم إجراء نضح كاف ، فإن أنسجة الرئة ستتحول إلى لون أبيض شاحب وسيترك برنامج تلفزيوني المقصورة داخل الأوعية الدموية عبر الشريان الأورطي البطني.
- بعناية ، استخرج الرئتين وتشريحهما من القصبة الهوائية لأداء الأنسجة أو المعالجة الإضافية لتعليق خلية واحدة.
- في حالة المعالجة للأنسجة ، أدخل بعناية قسطرة 20 G لتضخيم الرئتين حتى 25 سم H2O بمحلول الفورمالين (محايد مخزن 10٪). بمجرد نفخ الرئتين ، مرر خيطا بطول 3.0 سم تحت القصبة الهوائية ، واربطه بإحكام مرتين لضمان بقاء الفورمالين في أنسجة الرئة. برفق ، قم بتشريح الرئة من بقية الأنسجة وضعها في أنبوب مخروطي سعة 15 مل يحتوي على 10 مل من محلول الفورمالين.
6. معالجة غسل القصبات الهوائية
- أجهزة الطرد المركزي BAL عند 500 × جم عند 4 درجات مئوية لمدة 5 دقائق. قم بإزالة المادة الطافية الخالية من الخلايا في أنبوب منفصل واحفظها في درجة حرارة -80 درجة مئوية.
ملاحظة: يمكن إجراء مزيد من التحليل في طاف BAL ، بما في ذلك القياس الكمي للبروتين (على سبيل المثال ، مقايسة BCA13) أو قياس مؤشرات حيوية أو سيتوكينات محددة (مقايسات ELISA ومقايسات متعددة مع منصات مثل MSD و Luminex). - تحلل خلايا الدم الحمراء عن طريق إضافة 100 ميكرولتر من محلول التحلل لمدة 1 دقيقة. تحييد تفاعل lysing بإضافة 1 مل من PBS. أجهزة الطرد المركزي BAL عند 500 × جم عند 4 درجات مئوية لمدة 5 دقائق وإزالة المادة الطافية.
- أعد تعليق الخلايا في PBS (100-300 ميكرولتر ؛ بناء على حجم حبيبات الخلية). قم بإجراء عدد الخلايا باستخدام 0.4٪ من صبغة تريبان الزرقاء عن طريق عد الخلايا يدويا أو آليا. استخدم الحبيبات المتبقية لتلطيخ قياس التدفق الخلوي و / أو الحفظ بالتبريد (عن طريق التعليق في محلول الحفظ بالتبريد) في النيتروجين السائل لمزيد من الاختبارات.
7. معالجة الرئة لتعليق خلية واحدة
- تشريح الرئة بلطف من بقية الأنسجة ووضعها في أنبوب مخروطي 15 مل يحتوي على 5 مل من برنامج تلفزيوني بارد. أخرج الرئة من برنامج تلفزيوني وجففها باستخدام منشفة ورقية.
- قم بإعداد كوكتيل هضم بإضافة 1 ملغ من DNase و 5 ملغ من كولاجيناز إلى 1 مل من وسط النسر المعدل منخفض الجلوكوز من Dulbecco (DMEM). نقل الرئة إلى أنبوب C يحتوي على 1 مل من كوكتيل الهضم.
- انقل الأنبوب C إلى مفكك الأنسجة واتبع البروتوكول القياسي لمعالجة أنسجة الرئة14.
- أضف 10 مل من برنامج تلفزيوني بارد في الأنبوب C واخلطه بشكل صحيح. قم بتصفية التعليق أحادي الخلية باستخدام مصفاة خلية 70 ميكرومتر أعلى أنبوب مخروطي سعة 50 مل. قم بإجراء الترشيح مرتين.
- جهاز طرد مركزي التعليق عند 500 × جم عند 4 درجات مئوية لمدة 5 دقائق. صب بعناية المادة الطافية وأضف 1 مل من محلول التحلل لمدة دقيقة واحدة في درجة حرارة الغرفة. أضف 10 مل من برنامج تلفزيوني بارد لإيقاف تفاعل التحلل وإزالة المادة الطافية.
- جهاز طرد مركزي التعليق عند 500 × جم عند 4 درجات مئوية لمدة 5 دقائق. صب بعناية طاف وإضافة 10 مل من برنامج تلفزيوني بارد.
- قم بإجراء عدد الخلايا باستخدام صبغة التريبان الزرقاء عن طريق عد الخلايا يدويا أو آليا. استخدم حبيبات الخلية لتلطيخ قياس التدفق الخلوي و / أو الحفظ بالتبريد في النيتروجين السائل لمزيد من الاختبارات.
النتائج
سمحت الإجراءات الموصوفة أعلاه بنمذجة الآليات الفيزيولوجية المرضية الكامنة وراء إصابة الرئة الناجمة عن الالتهاب الرئوي الجرثومي في الفئران. للبدء في النمذجة ، تم الحصول على الفئران من النوع البري C57BL / 6 (WT) من مختبر جاكسون وتم تربيتها في منشأة بالمعهد. خضع ذكور الفئران WT C57BL / 6 ، البالغة من العمر 8 أسابيع ، للتلقيح داخل القصبة الهوائية إما لمرق TH (التحكم) ، أو 3 × 106 CFU من Spn الحي ، أو 200 CFU من Kpn الحي. بعد الإصابة ، تمت مراقبة الفئران لمدة 6 و 10 أيام ل Spn و Kpn ، على التوالي. على الرغم من أن المجموعات المصابة أظهرت وزنا أقل للجسم مقارنة بالمجموعة الضابطة غير المصابة ، إلا أن مجموعة Spn استعادت وزن جسمها نحو خط الأساس ، بينما أظهرت الفئران المصابة ب Kpn تعافيا بطيئا بعد 6 أيام من الإصابة (الشكل 2 أ). خلال مدة الدراسة ، لم تتطلب أي فئران الخضوع للقتل الرحيم بسبب وزن الجسم الذي يزيد عن 20٪ ، ولم يكن هناك دليل على الألم والضيق.
قمنا بقياس إصابة الرئة على فترات مختلفة. كان تركيز بروتين BAL وعدد الخلايا الكلي لكل من BAL والرئتين أعلى بشكل ملحوظ في المجموعات المصابة (الشكل 2). تم الحصول على أقسام نسيجية تمثيلية تعرض العملية الالتهابية في كلا النموذجين في اليوم 2 و 4 و 6 بعد التلقيح (الشكل 3) ، مما يدل على استمرار الالتهاب السنخي في الفئران المصابة ب Kpn (الشكل 4) ، حتى في اليوم 10. واصلت الفئران المصابة ب Kpn الإصابة بحلول اليوم 10 (الشكل 2 والشكل 4) ، بينما حلت الفئران المصابة ب Spn التهاب الرئة بحلول اليوم 6 (الشكل 2 والشكل 3).
تم استخدام معلقات الرئة أحادية الخلية لتمييز المشهد المناعي عن طريق قياس التدفق الخلوي عالي الأبعاد في اليوم 6 بعد الإصابة في نموذج Spn ، باستخدام لوحة ذات 18 لونا في فرز الخلايا المنشطة الفلورية (FACS). باستخدام تضمين الجار العشوائي الموزع على t (t-SNE) ، يمكن تصور الاختلافات الكلية في تكوين الخلايا المناعية ، كونها ملحوظة لعدد متزايد من الخلايا المحببة (CD45 + ، CD11b + ، CD24 + ، MHC-II-) ، الضامة الخلالية (CD45 + ، CD11b + ، MHC-II- ، CD24-) ، وحيدات (CD45 + ، CD11b + ، MHC-II- ، CD24- ، CD64-) ، الخلايا البائية (CD45 + ، CD19 +) ، والخلايا التائية (CD45 + ، CD3 +) ، بما في ذلك الخلايا القاتلة الطبيعية (CD45 + ، CD3 + ، NK1.1 +) ، كما هو موضح في الشكل 5. استراتيجيات البوابات موضحة في الشكل 6.
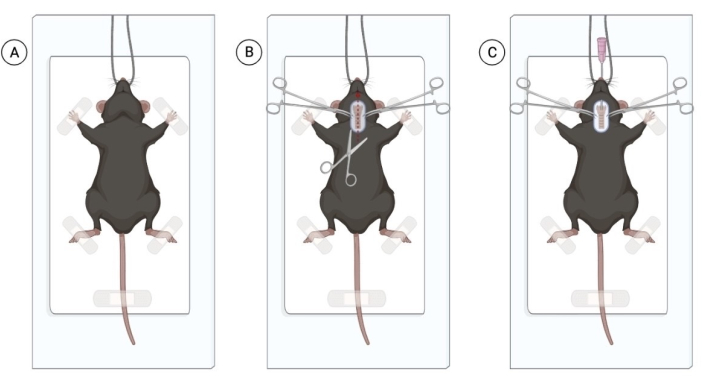
الشكل 1: إجراء جراحي لتقطير البكتيريا الحية داخل القصبة الهوائية. أ: موضع الفأر في المنطقة الجراحية المعقمة، معلقا بالقواطع. (ب) منطقة الشق والتعرض للقصبة الهوائية. (ج) عملية التنبيب بإدخال قسطرة 20 جرام. تم إنشاء الشكل باستخدام Biorender.com. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
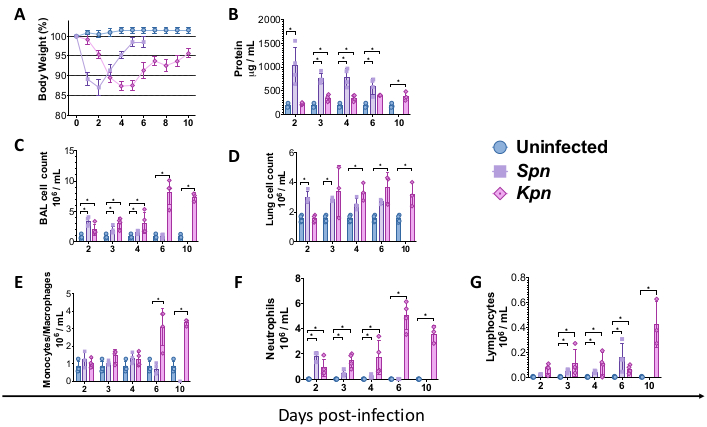
الشكل 2: ملامح إصابة الرئة الحادة (ALI) بعد نماذج الالتهاب الرئوي. (أ) وزن الجسم بمرور الوقت بالنسبة إلى خط الأساس ، والتحكم مقابل Kpn و Spn (n = 4 ، لكل مجموعة). (ب) القياس الكمي الكلي للبروتين BAL بواسطة مقايسة BCA (n = 4 ، لكل مجموعة). (C) إجمالي عدد خلايا BAL في التحكم (n = 3) و Kpn (n = 4) و Spn (n = 3). (د) إجمالي عدد خلايا الرئة في السيطرة (ن = 3) ، Kpn (ن = 4) ، و Spn (ن = 3). (E-G) تفاضل خلايا BAL عن طريق عدد الأنسجة اليدوي ل BAL cytospin في السيطرة (n = 3) ، Kpn (n = 4) ، و Spn (n = 3). تم إجراء الاختبارات الإحصائية عن طريق اختبار t الفردي ، ومقارنة المجموعة الضابطة غير المصابة مقابل المجموعات المصابة. * ص < 0.05. يتم عرض البيانات باستخدام الخطأ القياسي (SE) لكل مخطط. المحور ص هو أيام بعد الإصابة لجميع اللوحات. الاختصارات: BAL = غسل القصبات الهوائية. Spn = العقدية الرئوية. Kpn = الكلبسيلة الرئوية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
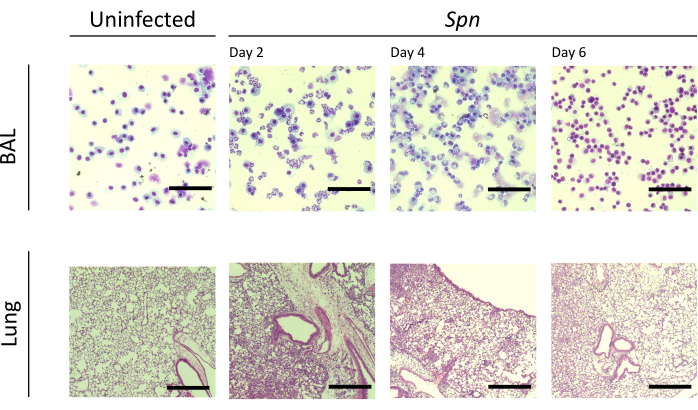
الشكل 3: النتائج النسيجية المرضية للرئة أثناء عدوى Spn . تلطيخ الهيماتوكسيلين ويوزين (H&E & E) للأقسام النسيجية لقسم BAL والرئة التمثيلي بعد العدوى داخل القصبة الهوائية ل Spn وفي الأيام 2 و 4 و 6. تكبير BAL = 100x ؛ تكبير الرئة = 10x. الاختصارات: BAL = غسل القصبات الهوائية. Spn = العقدية الرئوية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
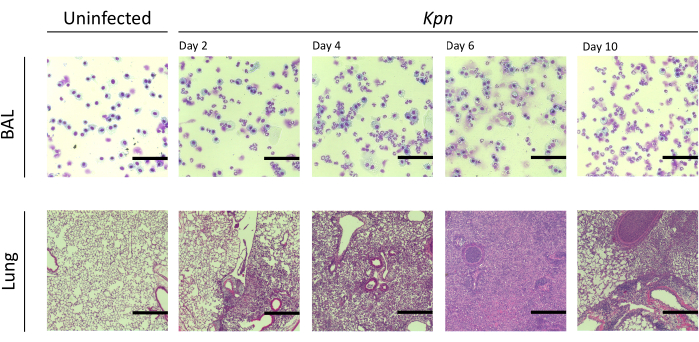
الشكل 4: النتائج النسيجية المرضية للرئة أثناء عدوى Kpn . تلطيخ الهيماتوكسيلين ويوزين (H&E & E) للأقسام النسيجية ل BAL التمثيلي وقسم الرئة بعد العدوى داخل القصبة الهوائية ل Kpn في الأيام 2 و 4 و 6 و 10. تظهر الصور تكبيرا عالي الطاقة (شريط المقياس = 50 ميكرومتر). الاختصارات: BAL = غسل القصبات الهوائية. Kpn = الكلبسيلة الرئوية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
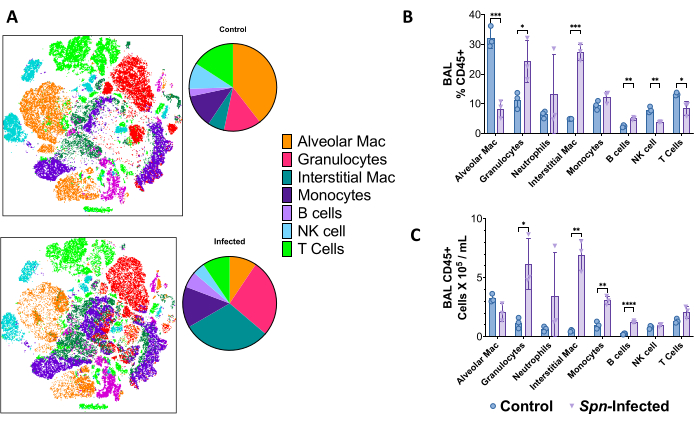
الشكل 5: مشهد الخلايا المناعية عن طريق قياس التدفق الخلوي متعدد الألوان بعد 6 أيام من الإصابة ب Spn . (أ) تم استخدام تضمين الجار العشوائي الموزع على شكل حرف T (t-SNE) لتصور مجموعات الخلايا المناعية (CD45 +) للرئة مقارنة المجموعة الضابطة غير المصابة مقابل المجموعة المصابة. ب: ملخص ترددات الخلايا المناعية من إجمالي خلايا CD45+ في الرئة. ج: إجمالي عدد الخلايا لكل مجتمع إحصائي على حدة. تم إجراء مقارنات إحصائية عن طريق اختبارات t بين السيطرة والمصابين. * p < 0.05 ، ** p < 0.01 ، ***p < 0,001. يتم عرض البيانات باستخدام الخطأ القياسي (SE) لكل مخطط. الاختصارات: BAL = غسل القصبات الهوائية. Spn = العقدية الرئوية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 6: استراتيجيات البوابات لتحديد المجموعات الفرعية للخلايا المناعية في الرئتين عند خط الأساس وبعد الالتهاب الرئوي. خضع BAL وتعليق خلايا الرئة لتلطيخ لقياس التدفق الخلوي متعدد الألوان. تم إزالة الحطام أولا باستخدام SSC-A و FSC-A ، وتم إغلاق الخلايا المفردة بواسطة استراتيجيتين (SSC-W مقابل SSC-H و FSC-W مقابل FSC-H). تم تحديد الخلايا الحية باستخدام مميز حي / ميت مقابل SSC-A. تم تحديد مجموعات الخلايا اللاحقة بواسطة علامات محددة مسبقا 15. اختصار: BAL = غسل القصبات الهوائية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
توفر نماذج الفئران التجريبية ل PNA منصة لتقييم الآليات الخلوية والجزيئية الكامنة وراء الإصابة وحل متلازمة الضائقة التنفسية الحادة. تشمل المكونات الفيزيولوجية المرضية التي يمكن تقييمها المسارات الالتهابية المبكرة ، والإزالة البكتيرية ، وتغيرات المشهد المناعي الديناميكي ، وحل الالتهاب ، والانتشار الليفي ، وإصلاح الظهارة والأوعية الدموية16. ومع ذلك ، يجب مراعاة العديد من الجوانب عند التخطيط لتكرار هذا النموذج من إصابة الرئة الناجمة عن الالتهاب الرئوي ، بما في ذلك العمر والجنس وسلالة الفئران وعوامل المضيف الجوهرية (على سبيل المثال ، حالة نقص المناعة) ، والعامل الممرض المحدد والحمل البكتيري المستخدم ، وخبرة الموظفين الذين يقومون بالإجراء.
السلطة الوطنية الفلسطينية هي من بين الأسباب الرئيسية لمتلازمة الضائقة التنفسية الحادة. اخترنا استخدام Spn و Kpn الحية ، وهما السببان السائدان ل PNA المكتسب من المجتمع والمستشفى في البشر ،على التوالي 17. نقترح تحسين النماذج البكتيرية ل PNA عن طريق معايرة جرعات البكتيريا الحية لتحقيق ملف الوفيات والإصابات المطلوب الذي يناسب فرضية الباحث على أفضل وجه. لقد قمنا بتحسين تلقيح البكتيريا داخل القصبة الهوائية من 3 × 106 CFU ل Spn و 200 CFU ل Kpn في الفئران ، مما تسبب في التهاب السنخية ، وتعطيل الحاجز السنخي الشعري ، واختلال وظيفي في الأعضاء (الشكل 2). ومع ذلك ، يمكن أن تظهر الدفعات البكتيرية من مصادر مختلفة أو حتى داخل حلقات مكررة درجات مختلفة من الالتهاب والإصابة ، حتى عند استخدام نفس السلالة و CFU.
لذلك ، لتكرار النتائج المقدمة في هذه المخطوطة ، يجب على الباحثين البدء بتركيز البكتيريا الموصوف هنا. ومع ذلك ، قد يحتاجون إلى زيادة أو تقليل الجرعة للحصول على ملف تعريف نموذج مماثل. وبالتالي ، يجب تحسين كل دفعة جديدة من البكتيريا المستخدمة لتأثيرها المحتمل على حل الإصابة. نقدم نموذجا قويا ل PNA مع نتيجتين مختلفتين للقرار ، واحدة ذاتية الحل (Spn) والأخرى بطيئة / غير قابلة للحل (Kpn) والتي يمكن أن تكون بمثابة منصات للمحققين لتقييم الآليات المناعية واختبار التدخلات العلاجية ، خاصة في أو بعد ذروة العدوى (على سبيل المثال ، 2 أيام بعد الإصابة).
يؤثر العمر والجنس والإجهاد والعوامل الوراثية على حركية أنماط حل الإصابة16. على سبيل المثال ، يجعل الجنس الحل المعجل في الإناث مقارنة بالذكور18 ؛ لذلك ، تؤدي الزيادة في الحمل البكتيري إلى زيادة معدل الوفيات وتأخر الحل لدى الذكور مقارنة بالإناث. الشيخوخة هي عامل آخر يجب مراعاته عند معايرة CFU للبكتيريا المستخدمة. أظهرت الفئران المسنة معدل وفيات بنسبة 100٪ عندما استخدمنا جرعة Spn المحددة (غير الموضحة هنا). تستخدم الفئران الشابة بشكل متكرر في نماذج PNA للمكورات الرئوية (تتراوح من 6 إلى 14 أسبوعا) ، بينما تظهر الفئران المسنة (19-26 شهرا) استجابة مناعية متغيرة وتستخدم للتحقيق في دور الشيخوخة في PNA11. كان علينا تقليل CFU إلى 300٪ لتحقيق البقاء على قيد الحياة في المسنة (غير موضح هنا). تم استخدام ذكور الفئران C57BL / 6 (8-12 أسبوعا) في هذه الدراسة وتمت متابعتها خلال 6 إلى 10 أيام بعد الإصابة. يمكن أيضا العثور على اختلافات كبيرة في الحساسية بين السلالات. السلالات الفطرية مثل BALB / C و C57BL6 / J لها استجابات مختلفة للعدوى11,19.
يسمح التلقيح المباشر للبكتيريا داخل القصبة الهوائية بتوصيل أكثر دقة لللقاح (حتى 99٪) إلى الرئتين12 ، مما يمثل بديلا للأنماط المصلية الأقل ضراوة ويقلل من رذاذ البكتيريا11. ومع ذلك ، يمكن القول أنه إجراء جراحي. يمكن أن يكون التنبيب صعبا ، ويتطلب تخديرا جهازيا ، ويمكن أن يؤدي إلى صدمة القصبة الهوائية مع وذمة مجرى الهواء اللاحقة والصرير. يمكن للفئران تطوير منعكس وعائي مبهمي يؤدي إلى انقطاع النفس ، والذي يلزم أن يكون لديه جهاز تهوية صغير للفأر لتوفير دعم إضافي لجهاز التنفس الصناعي عند الحاجة. تعد خبرة الجراح الذي يقوم بإجراء العملية مكونا حاسما لضمان نجاح التنبيب11. في دراستنا ، لم تكن هناك حاجة إلى القتل الرحيم للفئران بسبب إدارة الألم المناسبة وعدم فقدان وزن الجسم بنسبة تزيد عن 20٪. لم تظهر أي علامات على الألم والضيق مثل الخمول أو عدم القدرة على الوصول إلى الماء أو الطعام أو صعوبة التنفس أو انخفاض اليقظة العقلية. الطرق البديلة للتوصيل البكتيري المباشر إلى الرئتين هي الشفط الفموي البلعومي ، على الرغم من أن حل إصابة الرئة يبدو أنه يحدث بشكل أسرع ، ويمكن أن تنتهي بعض البكتيريا في المعدة والجهاز الهضمي20.
تمكن النماذج قبل السريرية ل PNA الباحثين من تقييم المشهد المناعي. يمكن تقييم المقصورات القصبية والخلالية للتغيرات الديناميكية في الخلايا المناعية16. علاوة على ذلك ، يمكن زراعة الخلايا وتحفيزها خارج الجسم الحي لتحديد إنتاجها المحدد من السيتوكينات والكيموكينات. هنا ، نركز على استكشاف مشهد الخلايا المناعية في الرئة و BAL باستخدام قياس التدفق الخلوي متعدد الألوان. يمكن أيضا إجراء تسلسل الحمض النووي الريبي أحادي الخلية لفهم التوقيعات النسخية الخاصة بالخلية في مراحل مختلفة من حل الإصابة.
تولد نماذج PNA-ARDS تأثيرات نظامية يمكن اكتشافها مبكرا عن طريق قياس وزن الجسم أثناء المرض10. على الرغم من أننا لا نقيس بشكل مباشر التأثيرات الجهازية لمتلازمة الضائقة التنفسية الحادة ، إلا أنه يمكن أيضا تقييم خلل الأعضاء عن طريق قياس الدم لملفات الكيمياء ، وعن طريق حصاد الأنسجة المختلفة مثل الطحال والكلى والكبد من أجل الأنسجة. تم وصف التأثيرات الجهازية للمكورات الرئوية PNA-ARDS سابقا من قبل مجموعات أخرى باستخدام نفس سلالة البكتيريا21.
هنا ، يتم وصف نموذج ل PNA التجريبي يشبه بعض النتائج الفيزيولوجية المرضية الرئيسية الكامنة وراء متلازمة الضائقة التنفسية الحادة البشرية. على الرغم من عدم وجود نماذج مثالية تلخص تماما تعقيد وعدم تجانس متلازمة الضائقة التنفسية الحادةالبشرية 9 ، إلا أن هذه النماذج ذات صلة وقابلة للتكرار لدراسة آليات إصابة الرئة وإصلاحها ، كما أنها تعمل كمنصة لتحديد الأهداف الدوائية المحتملة الجديدة التي تركز على تسريع حل التهاب الرئة وتعزيز إصلاح الرئة.
Disclosures
ليس لدى المؤلفين ما يكشفون عنه.
Acknowledgements
تم دعم هذه الدراسة من خلال منحة المعاهد الوطنية للصحة R01 HL131812 و R01HL163881.
Materials
| Name | Company | Catalog Number | Comments |
| 1-200 µL Round 0.5 mm Thick Gel-Loading Pipet Tips | Corning | 4853 | |
| 2 mL Cryogenic vials | Corning Incorporated | 431420 | 2 mL self standing, round bottom, red cap, polypropylene |
| 2 mL Eppendorf Snap-Cap Microcentrifuge Biopur Safe-Lock Tubes | Fisherscientific | 05-402-24C | Shape: Round, Length (Metric): 38mm, Diameter (Metric) Outer: 10mm, Capacity (Metric): 2mL |
| 70 µm Cell Strainer | Falcon | 352350 | White, Sterile, Individually Packaged |
| 96-well Clear Round Bottom | Falcon | 353077 | TC-treated Cell Culture Microplate, with Lid, Individually Wrapped, Sterile |
| Acepromizine Maleate Injection, USP 500 mg/50 mL (10mg/mL) | Phoenix | NDC 57319-604-04 | EACH mL CONTAINS: acepromazine maleate 10 mg, sodium citrate 0.36%, Citric acid 0.075%, benzyl alcohol 1% and water for injection. |
| Ammonium-Chloride-Potassium (ACK) Lysing Buffer | Quality Biological | 118-156-721 | 4 x 100mL |
| Anti-mouse I-A/I-E | Biolegend | 107628 | APC/Cyanine7 anti-mouse I-A/I-E [M5/114.15.2]; Isotype: Rat IgG2b |
| BCA Protein Assay Kit | Thermo Scientific | 23225 | |
| BD Trypticase Soy Agar | BD-Biosciences | 90001-276 | 5% Sheep Blood Prepared Media Stacker Plates, BD Diagnostics |
| Biotix Disposable Reagent Reservoirs | Biotix | 89511-194 | |
| Bovine Serum Albumin | Sigma-Aldrih | A4503 | |
| CD103 | Invitrogen | 509723 | Integrin alpha E) Armenian Hamster anti-Mouse, FITC, Clone: 2E7 |
| CD11b | Invitrogen | RM2817 | PE-Texas Red, Clone: M1/70.15, Invitrogen |
| CD11c | BD Biosciences | 565872 | Hamster anti-Mouse, APC-R700, Clone: N418, BD Horizon |
| CD19 | Biolegend | 152410 | APC anti-mouse CD19 [1D3/CD19]; Isotype: Rat IgG2a, κ |
| CD24 | BD Biosciences | 563450 | Rat anti-Mouse, Brilliant Violet 711, Clone: M1/69 |
| CD4 | BD Biosciences | 563790 | BUV395; Clone: GK1.5 |
| CD45 | Biolegend | 103157 | Brilliant Violet 750 anti-mouse CD45 [30-F11]; Isotype: Rat IgG2b, κ; |
| CD8a | BD Biosciences | 612759 | Rat anti-Murine, Brilliant Ultraviolet 737, Clone: 53-6.7 |
| Cell Counting Slides | Bio-rad | 1450017 | For TC20 Cell Counter |
| Cell strainer 70 µL Nylon | Falcon | 198718 | REF 352350 |
| Collagenase Type1 | Worthington Biochemical Corporation | LS004197 | |
| Culti-Loop Streptococcus pneumoniae | Thermo Scientific | R4609015 | ATCC 4961 |
| Deoxyribonuclease I from bovine pancreas | Sigma-Aldrih | DN25 | |
| Disposable inoculation loops/needles | Fisherbrand | 22-363-603 | Color blue; Volume 1 µL |
| DMEM (Dulbecco’s Modified Eagle’s Medium) | Corning | 10-014-CV | |
| Fc Block | BD Biosciences | 553142 | CD16/CD32 Rat anti-Mouse, Unlabeled, Clone: 2.4G2 |
| Formalin solution | Sigma-Aldrih | HT501640 | Formalin solution, neutral buffered, 10% |
| Gauze Sponges, Covidien | Curity | 2146- | |
| gentleMACS C Tubes | MACS Miltenyi Biotec | 130-093-237 | |
| gentleMACS Dissociator | MACS Miltenyi Biotec | 130-093-235 | SN: 4715 |
| Hema 3 Manual Staining System and Stat Pack | Thermo Scientific | 23123869 | |
| Isoflurane Liquid Inhalation | Henry Schein | 1182097 | |
| IV CATHETER JELCO 20GX1.25" | Hanna Pharmaceutical Supply Co., Inc | 405611 | |
| Ketamine HCl Injection | Henry Schein | 1049007 | Ketamine HCl Injection MDV 100mg/mL 10mL 10/Box |
| Klebsiella pneumoniae | ATCC | 43816 | subsp. pneumoniae (Schroeter) Trevisan |
| Loctite 409 | Electron Microscopy Sciences | 7257009 | |
| Ly-6C | Biolegend | 128036 | Brilliant Violet 605 anti-mouse Ly-6C [HK1.4]; Isotype: Rat IgG2c |
| Ly-6G | BD Biosciences | 740157 | Rat anti-Mouse, Brilliant Violet 510, Clone: 1A8, BD Optibuild |
| MiniVent Type 845 | Hugo Sachs Elektronik- Harvard Apparatus | 4694 | D-79232 March (Germany) |
| NK-1.1 | BD Biosciences | 553165 | Mouse anti-Mouse, PE, Clone: PK136, BD |
| Phase Hemacytometer | Hausser Scientific | 1475 | |
| Phosphate-Buffered Saline | Corning | 21-040-CV | 1X without calcium and magnesium, |
| Round Bottom | Sarstedt | 55.476.305 | |
| Round-Bottom Polystyrene Test Tubes | Falcon | 352235 | With Cell Strainer Snap Cap, 5mL |
| SealRite 1.5 mL Natural Microcentrifuge Tube | USA Scientific | 1615-5500 | Free of detectable Rnase, DNase, DNA and pyrogens. |
| Shandon EZ Single Cytofunnel | Epredia | A78710003 | |
| Siglec-F | BD Biosciences | 562681 | Anti-Mouse, Brilliant Violet 421, Clone: E50-2440 |
| Silk Black Braided 30"(75 cm) Sterile, nonabsorbable surgical suture U.S.P. | Ethicon | K-834 | 0 (3.5 metric) |
| Stainless-Steel Slide Clip | Epredia | 59910052 | |
| Sterile Single Use Vacuum Filter Units | Thermo Scientific | 1660045 | |
| Syringe sterile, single use, 1 mL | BD-Biosciences | 309628 | |
| TC20 Automatic Cell Counter | Bio-Rad | 508BR05740 | |
| TipOne 200 ul yellow pipet tip refill | USA Scientific | 1111-0706 | |
| TODD HEWITT BROTH | RPI | T47500 | |
| TPX Sample Chamber | Epredia | A78710018 | |
| TPX Single Sample Chamber, Caps and Filter Cards | Epredia | 5991022 | |
| Trypan Blue | Bio-rad | 1450022 | |
| U-100 Insulin Syringes | BD-Biosciences | 329461 | |
| Wet-Proof Multi-Heat Electric Heat Pad | Cullus | Model PR7791AB | 120 volst AC; 45 watts; Listed 562B/E26869 |
References
- Bellani, G., et al. Epidemiology, patterns of care, and mortality for patients with acute respiratory distress syndrome in intensive care units in 50 countries. JAMA. 315 (8), 788-800 (2016).
- Hariri, L., Hardin, C. C. Covid-19, angiogenesis, and ARDS endotypes. The New England Journal of Medicine. 383 (2), 182-183 (2020).
- Ferguson, N. D., et al. The Berlin definition of ARDS: an expanded rationale, justification, and supplementary material. Intensive Care Medicine. 38 (10), 1573-1582 (2012).
- Tomashefski Jr, J. F. Pulmonary pathology of the adult respiratory distress syndrome. Clinics in Chest Medicine. 11 (4), 593-619 (1990).
- Martin, T. R. Lung cytokines and ARDS: Roger S. Mitchell lecture. Chest. 116 (1 Suppl), 2S-8S (1999).
- Colletti, L. M., et al. Role of tumor necrosis factor-alpha in the pathophysiologic alterations after hepatic ischemia/reperfusion injury in the rat. The Journal of Clinical Investigation. 85 (6), 1936-1943 (1990).
- Donnelly, S. C., et al. The association between mortality rates and decreased concentrations of interleukin-10 and interleukin-1 receptor antagonist in the lung fluids of patients with the adult respiratory distress syndrome. Annals of Internal Medicine. 125 (3), 191-196 (1996).
- Miller, E. J., Cohen, A. B., Matthay, M. A. Increased interleukin-8 concentrations in the pulmonary edema fluid of patients with acute respiratory distress syndrome from sepsis. Critical Care Medicine. 24 (9), 1448-1454 (1996).
- Matute-Bello, G., et al. An official American Thoracic Society workshop report: features and measurements of experimental acute lung injury in animals. American Journal of Respiratory Cell and Molecular Biology. 44 (5), 725-738 (2011).
- Kulkarni, H. S., et al. Update on the features and measurements of experimental acute lung injury in animals: an official American Thoracic Society Workshop report. American Journal of Respiratory Cell and Molecular Biology. 66 (2), e1-e14 (2022).
- Borsa, N., Pasquale, M. D., Restrepo, M. I. Animal models of pneumococcal pneumonia. International Journal of Molecular Sciences. 20 (17), 4220(2019).
- Rubins, J. B., et al. Dual function of pneumolysin in the early pathogenesis of murine pneumococcal pneumonia. The Journal of Clinical Investigation. 95 (1), 142-150 (1995).
- Thermo Scientific, Pierce BCA Protein Assay Kit. , https://www.thermofisher.com/order/catalog/product/23225 Forthcoming.
- Jungblut, M., Oeltze, K., Zehnter, I., Hasselmann, D., Bosio, A. Standardized preparation of single-cell suspensions from mouse lung tissue using the gentleMACS Dissociator. Journal of Visualized Experiments. (29), e1266(2009).
- Tighe, R. M., et al. Improving the quality and reproducibility of flow cytometry in the lung. an official American Thoracic Society Workshop report. American Journal of Respiratory Cell and Molecular Biology. 61 (2), 150-161 (2019).
- Aeffner, F., Bolon, B., Davis, I. C. Mouse models of acute respiratory distress syndrome: a review of analytical approaches, pathologic features, and common measurements. Toxicologic Pathology. 43 (8), 1074-1092 (2015).
- Torres, A., et al. Pneumonia. Nature Reviews Disease Primers. 7 (1), 25(2021).
- Xiong, Y., et al. Estradiol resolves pneumonia via ERβ in regulatory T cells. JCI Insight. 6 (3), e133251(2021).
- D'Alessio, F. R., et al. Enhanced resolution of experimental ARDS through IL-4-mediated lung macrophage reprogramming. American Journal of Physiology. Lung Cellular and Molecular Physiology. 310 (8), L733-L746 (2016).
- D'Alessio, F. R. Mouse models of acute lung injury and ARDS. Methods in Molecular Biology. 1809, 341-350 (2018).
- Gotts, J. E., et al. Clinically relevant model of pneumococcal pneumonia, ARDS, and nonpulmonary organ dysfunction in mice. American Journal of Physiology. Lung Cellular and Molecular Physiology. 317 (5), L717-L736 (2019).
Erratum
Formal Correction: Erratum: Experimental Model to Evaluate Resolution of Pneumonia
Posted by JoVE Editors on 6/13/2023. Citeable Link.
An erratum was issued for: Experimental Model to Evaluate Resolution of Pneumonia. A figure was updated.
Figure 2 was updated from:

to:

Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved