Method Article
تصوير خلايا CD19 + B في نموذج فأر تجريبي لالتهاب الدماغ والنخاع المناعي الذاتي باستخدام التصوير المقطعي بالإصدار البوزيتروني
In This Article
Summary
تفصل هذه الورقة منهجية وضع العلامات الإشعاعية على جسم مضاد أحادي النسيلة مضاد ل CD19 خاص بالإنسان وكيفية استخدامه لتحديد كمية الخلايا البائية في الجهاز العصبي المركزي والأنسجة المحيطية لنموذج فأر من التصلب المتعدد باستخدام التصوير المقطعي بالإصدار البوزيتروني في الجسم الحي ، وعد جاما خارج الجسم الحي ، ونهج التصوير الشعاعي الذاتي.
Abstract
التصلب المتعدد (MS) هو أكثر أمراض الجهاز العصبي المركزي المزيلة للميالين شيوعا التي تصيب الشباب ، وغالبا ما يؤدي إلى عجز عصبي وإعاقة مع تقدم المرض. تلعب الخلايا الليمفاوية البائية دورا معقدا وحاسما في أمراض التصلب العصبي المتعدد وهي هدف للعديد من العلاجات في التجارب السريرية. في الوقت الحالي ، لا توجد طريقة لاختيار المرضى بدقة لعلاجات محددة مضادة للخلايا البائية أو لتحديد آثار هذه العلاجات بشكل غير جراحي على حمل الخلايا البائية في الجهاز العصبي المركزي والأعضاء الطرفية. التصوير المقطعي بالإصدار البوزيتروني (PET) لديه إمكانات هائلة لتوفير معلومات كمية محددة للغاية فيما يتعلق بالتوزيع الزماني المكاني في الجسم الحي وعبء الخلايا البائية في الكائنات الحية.
تقدم هذه الورقة طرقا لتجميع واستخدام متتبع PET خاص بخلايا CD19 + B البشرية في نموذج فأر راسخ يحركه الخلايا البائية لمرض التصلب العصبي المتعدد ، التهاب الدماغ والنخاع المناعي الذاتي التجريبي (EAE) ، والذي يسببه البروتين السكري قليل التغصن قليل التغصن البشري المؤتلف 1-125. الموصوفة هنا هي تقنيات محسنة لاكتشاف وقياس خلايا CD19 + B في الدماغ والحبل الشوكي باستخدام التصوير المقطعي بالإصدار البوزيتروني في الجسم الحي . بالإضافة إلى ذلك ، تشير هذه الورقة إلى طرق مبسطة لحساب غاما خارج الجسم الحي للأعضاء ذات الصلة بالمرض ، بما في ذلك نخاع العظام والحبل الشوكي والطحال ، جنبا إلى جنب مع التصوير الشعاعي الذاتي عالي الدقة لربط تتبع CD19 في أنسجة الجهاز العصبي المركزي.
Introduction
مرض التصلب العصبي المتعدد هو اضطراب عصبي بوساطة المناعة. يمكن أن يجعل العرض الفريد في كل مريض الإدارة صعبة لكل من المرضى والأطباء1. يتميز المرض نفسه بوجود آفات مزيل للميالين وتسلل الخلايا المناعية في الدماغ والحبل الشوكي ، مما يؤدي إلى ضعف جسدي وإدراكي2. تم تحدي النموذج التقليدي القائل بأن مرض التصلب العصبي المتعدد هو مرض بوساطة الخلايا التائية لأول مرة في المرحلة الثانية من التجارب السريرية التاريخية لريتوكسيماب3 ، وهو علاج يستهدف مجموعة فرعية CD20 + من الخلايا البائية. ومنذ ذلك الحين ، تم تطوير علاجات إضافية للخلايا البائية تستهدف CD194 ، وهي علامة حيوية للخلايا البائية يتم التعبير عنها على نطاق أوسع من الخلايا البائية ، والتي يمكن أن تكون مفيدة تشخيصيا وعلاجيا. علاوة على ذلك ، فإن الطرق الحالية لتقييم فعالية العلاج (أي مراقبة عدد الانتكاسات ونشاط التصوير بالرنين المغناطيسي [MRI]) لا توفر تدابير مبكرة للاستجابة - مما يعرض المرضى لخطر كبير من تلف الجهاز العصبي المركزي بسبب اختيار العلاج دون المستوى الأمثل وتحسينه. وبالتالي ، هناك حاجة ماسة لاستراتيجيات لمراقبة خلايا مناعية معينة ، مثل خلايا CD19 + B ، في الوقت الفعلي في الجهاز العصبي المركزي ومحيط مرضى التصلب العصبي المتعدد.
التصوير المقطعي بالإصدار البوزيتروني هو تقنية تصوير قوية تسمح في الجسم الحي بتصور كامل الجسم لهدف معين من الاهتمام ، مثل CD19. في حين أن سحب الدم وسجلات معدلات الانتكاس ومراقبة الآفات عبر التصوير بالرنين المغناطيسي توفر لقطات في فعالية العلاج ، يمكن أن يسمح التصوير المقطعي بالإصدار البوزيتروني للباحثين والأطباء بمراقبة فعالية العلاج في جميع أنحاء الجسم. يسمح هذا النهج الاستباقي للمراقبة العلاجية للأطباء بتقييم فعالية الدواء في الوقت الفعلي ، مما يتيح إجراء تعديلات سريعة حسب الحاجة. تسمح مراقبة موقع وكثافة مجموعات الخلايا المرتبطة بالمرض أيضا بالتقييم الطولي للشدة باستخدام المعلومات التشريحية الخاصة بالمريض. وبالتالي ، من الضروري إنشاء طرق تحليلية قابلة للتكرار للاستفادة بشكل موثوق من الإمكانات الكاملة لتصوير التصوير المقطعي بالإصدار البوزيتروني في البيئات السريرية وما قبل السريرية.
تصف هذه الورقة طرقا (الشكل 1) لإجراء التصوير المقطعي بالإصدار البوزيتروني ، وعد جاما خارج الجسم الحي ، والتصوير الشعاعي الذاتي (ARG) لخلايا CD19 + B مع 64 جسما مضادا أحادي النسيلة CD19 (mAb) يحمل علامة Cu ، والمعروف باسم 16C4-TM (64Cu-hCD19-mAb) ، في نموذج الفأر التجريبي لالتهاب الدماغ والنخاع المناعي الذاتي (EAE) لمرض التصلب العصبي المتعدد الناجم في الفئران المعدلة وراثيا التي تعبر عن CD19 البشري (hCD19) باستخدام البروتين السكري قليل التغصن قليل التغصن البشري المؤتلف 1-125 (MOG1-125). كما نقدم طرقا لتقييم ارتباط المقتفي الإشعاعي بدقة وقابلية للتكرار في الدماغ والحبل الشوكي ، وكلاهما من المواقع الحرجة للتسبب في المرض غالبا ما تتأثر بشدة في هذا النموذج وغيره من النماذج التنكسية العصبية. تسمح هذه التقنيات بالتحقيق غير الجراحي لدور الخلايا البائية في أمراض المرض ولديها القدرة على ترجمتها سريريا لتقييم فعالية العلاجات المضادة للخلايا البائية في مرض التصلب العصبي المتعدد.
Protocol
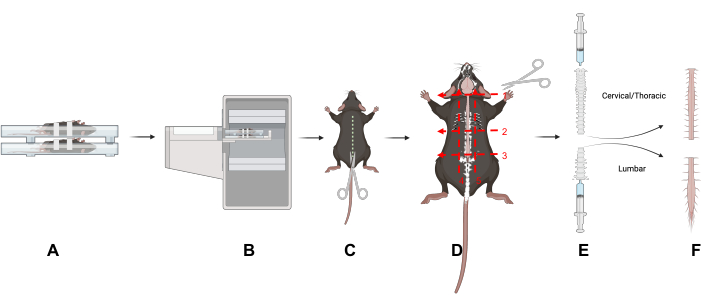
الشكل 1: تصميم الدراسة. نظرة عامة على التقنيات الرئيسية في هذه المقالة. (أ) وضع الفئران في سرير المسح على ظهورها يقلل من الحركة في العمود الفقري. (ب) التصوير المقطعي بالإصدار البوزيتروني/التصوير المقطعي المحوسب للفئران. ج: قم بعمل شق أسفل الجانب الظهري للحيوان لكشف العمود الفقري. (د) قسم العمود الفقري إلى أجزاء عنق الرحم / الصدر وأسفل الظهر وإزالة الأجزاء بعد الجروح الخمسة المشار إليها. ه: استخدم محقنة لإزالة الحبل الشوكي من العمود الفقري عن طريق عمل ختم بالمحقنة والعمود الشوكي والاحمرار من النهايات القحفية والذيلية للعمود الشوكي كما هو موضح. (و) أجزاء معزولة من الحبل الشوكي العنقي / الصدري والقطني. اختصار: PET / CT = التصوير المقطعي بالإصدار البوزيتروني / التصوير المقطعي المحوسب. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
تم إجراء جميع الدراسات على الحيوانات وفقا للهيئة الإدارية لرعاية المختبر (APLAC) في جامعة ستانفورد ، وهو برنامج معتمد من قبل جمعية تقييم واعتماد رعاية المختبر (AAALAC International). تأقلمت الفئران مع حظيرة الحيوان لمدة 7 أيام على الأقل قبل بدء الدراسة لتقليل الضغط على الفئران ، حيث يمكن أن يؤثر الإجهاد على تحريض EAE.
1. تحريض EAE في إناث الفئران CD19 المتوافقة مع البشر
- حث إناث الفئران CD19 C57BL / 6J المتوافقة مع البشر الذين تتراوح أعمارهم بين 9-13 أسبوعا مع EAE كما هو موضح سابقا5 باستخدام MOG1-125.
2. رعاية الحيوان والتسجيل في نموذج الماوس EAE
- سجل تطور المرض ورعاية الفئران كما هو موضح سابقا5. باختصار ، سجل هذا النموذج على مقياس من 1-5 على النحو التالي: 1 هو ضعف الذيل / العرج ، 2 هو ضعف الأطراف الخلفية ، 3 هو شلل الأطراف الخلفية ، 4 هو شلل الأطراف الخلفية مع ضعف الأطراف الأمامية ، 5 هو احتضار.
3. اقتران mAb ، ووضع العلامات الإشعاعية ، والتوصيف
- اقترن المخلب ثنائي الوظيفة 1،4،7،10-رباعي أزاسيكلودوديكان-1،4،7،10-رباعي الأسيتيك حمض أحادي-N-هيدروكسي سكسينيميد استر (DOTA-NHS-ester) إلى hCD19-mAb إلى التسمية الإشعاعية مع 64Cu.
- باستخدام عمود تحلية ، استبدل المخزن المؤقت لتخزين hCD19-mAb بمخزن HEPES المؤقت (درجة الحموضة 8.5-9): قم بتكييف عمود (أعمدة) التحلية باستخدام HEPES. احسب عدد الأعمدة المطلوبة بناء على سعة حجم عينة عمود التحلية وحجم mAb المطلوب: أنابيب 0.5 مل: 30-130 ميكرولتر من حجم العينة ، 300 ميكرولتر من الغسيل ؛ أنابيب 2 مل: حجم عينة 200-700 ميكرولتر ، 1 مل غسيل.
- قم بتبريد جهاز الطرد المركزي إلى 4 درجات مئوية للتبادل العازل عبر عمود التحلية.
- استرجع عمود التحلية من الثلاجة. قم بإزالة الجزء السفلي من عمود التحلية ، وقم بفك الغطاء ، وضع العمود في أنبوب تجميع.
- أجهزة الطرد المركزي في 1500 × غرام لمدة 2 دقيقة لإزالة حل التخزين ؛ تخلص من التدفق الذي يحتوي على محلول التخزين وأعد استخدام أنبوب التجميع. ضع علامة على خط على العمود حيث تكون أعلى نقطة في الراتنج المضغوط المتحلل مائلة لأعلى.
- أضف المخزن المؤقت HEPES إلى الجانب السفلي من عمود التحلية. ضع عمود التحلية في جهاز الطرد المركزي بحيث يكون الخط متجها للخارج ؛ تدور عند 1500 × جم لمدة 2 دقيقة. تخلص من التدفق وأعد استخدام أنبوب التجميع.
- كرر الخطوتين 3.1.4 و 3.1.5 2x باستخدام نفس أنبوب التجميع وتجاهل التدفق بين الخطوات.
- ضع عمود التحلية المشروط في أنبوب تجميع جديد وملصق ؛ سيحتوي هذا الأنبوب على hCD19-mAb.
- أضف hCD19-mAb إلى الجزء العلوي من عمود (أعمدة) التحلية المشروطة واستخدم المخزن المؤقت HEPES لشطف قارورة mAb الفارغة ؛ أضف هذا إلى أعلى عمود التحلية (الحجم الإجمالي وفقا لتوصية الشركة المصنعة). تدور عند 1500 × جم لمدة 2 دقيقة لإزالة hCD19-mAb. حافظ على التدفق الذي يحتوي على hCD19-mAb.
- قم بقياس تركيز hCD19-mAb باستخدام مقياس الطيف الضوئي للأشعة المرئية وفوق البنفسجية واضبط على 0.5 ميكروغرام / ميكرولتر باستخدام المخزن المؤقت HEPES إذا لزم الأمر.
- إلى محلول hCD19-mAb ، أضف 1/50th حجم محلول mAb البالغ 0.5 M EDTA لجعل التركيز النهائي ل EDTA 0.01 M في محلول hCD19-mAb. دع محلول hCD19-mAb-EDTA يقف في درجة حرارة الغرفة لمدة 15 دقيقة.
- أخرج DOTA-NHS-ester من الفريزر واتركه يصل إلى درجة حرارة الغرفة (10-15 دقيقة). احسب حجم DMSO لإضافته إلى DOTA-NHS-ester لعمل تركيز DOTA يسمح بإضافة النسبة المولية DOTA / mAb المطلوبة (والتي عادة ما تكون في ترتيب 1-2 DOTA / mAb).
ملاحظة: يجب ألا يتجاوز حجم DMSO-DOTA-NHS-ESTER المضاف إلى hCD19-mAb 10٪ من حجم mAb. يجب أن يتم ذلك باستخدام جدول بيانات حتى يمكن القيام به بسرعة وبشكل متكرر. - بناء على النسبة المطلوبة من DOTA إلى hCD19-mAb ، احسب كمية DOTA-NHS-ester لإضافتها إلى hCD19-mAb.
نانومول mAb × 10 DOTA / mAb → نانومول DOTA → مجم من DOTA → مجم / مل DOTA / DMSO → مل من DMSO عامل تخفيف → لمحلول DOTA / DMSO - وزن 1-2 ملغ من DOTA-NHS-استر ، وإضافة بعناية الحجم الصحيح (المحسوب في الخطوة 3.1.11) من DMSO إلى DOTA-NHS-استر ؛ مزيج وتدور لأسفل.
- ماصة الحجم المحسوب لمحلول DOTA-NHS-ester (الخطوة 3.1.12) في محلول hCD19-mAb ؛ امسح الجزء الخارجي من طرف الماصة قبل الإضافة لضمان عدم إضافة DOTA-NHS-ester إضافي (دون تغيير الكمية الموجودة في الماصة). مزيج بلطف وتدور.
- ضعه في الثلاجة (4 درجات مئوية) للتفاعل طوال الليل (12-16 ساعة).
- تنقية وتركيز
- تبريد أجهزة الطرد المركزي إلى 4 °C لخطوات تبادل المخزن المؤقت لمكثف الطرد المركزي ؛ ضع كتلة أنبوب PCR معدنية على الثلج الجاف لتجميد المترافق المفاجئ.
- قم بإزالة تفاعل DOTA-hCD19-mAb من الثلاجة وإخماده عن طريق إضافة مخزن مؤقت TRIS من الدرجة البيولوجية: 10٪ من إجمالي حجم التفاعل. قم بإزالة 10-20 ميكروغرام من العينة لتحليل قياس الطيف الكتلي.
- قم بتكييف عمود (أعمدة) التحلية كما هو موضح أعلاه (الخطوات 3.1.1-3.1.5) ، باستخدام 0.1 M من محلول أسيتات الأمونيوم ، الرقم الهيدروجيني 5.5.
- استبدل المخزن المؤقت محلول DOTA-hCD19-mAb بأسيتات الأمونيوم (الخطوات 3.1.1-3.1.8).
- ركز حل DOTA-hCD19-mAb: أضف المحلول إلى مكثف طرد مركزي لقطع الوزن الجزيئي 50 كيلو دالتون باتباع توصيات الشركة المصنعة بشأن الحجم. أجهزة الطرد المركزي عند 4000 × جم لمدة 10 دقائق (أو حتى يتم تقليل الحجم بنسبة 80٪ -90٪) ؛ تجاهل التدفق.
- كرر تسع مرات أخرى (إجمالي 10): أضف ما يكفي من أسيتات الأمونيوم لإعادة مستوى الصوت إلى الحد الأقصى الموصى به للحجم.
ملاحظة: يجب أن يكون الإجمالي هو ما تمت إضافته في البداية ، بما في ذلك ما تبقى في العمود ، عادة 400-450 ميكرولتر لمكثف طرد مركزي بسعة 500 ميكرولتر.- شطف قارورة التفاعل مع العازلة خلات الأمونيوم لاسترداد أي DOTA-hCD19-mAb المتبقية ؛ أضف الغسيل إلى مكثف الطرد المركزي.
- جهاز طرد مركزي عند 4000 × جم لمدة 10 دقائق.
ملاحظة: قد يتم تقليل وقت الدوران في الدورات اللاحقة إذا تم تقليل مستوى الصوت إلى 80٪ -90٪ في وقت أقل.
- قم بإزالة محلول البروتين من مكثف الطرد المركزي. لاحظ الحجم الإجمالي ل DOTA-hCD19-mAb.
- في مكثف الطرد المركزي 2 ، أضف ما يكفي من محلول أسيتات الأمونيوم لحجم إجمالي يبلغ 100 ميكرولتر وماصة للخلط. قم بتغطية عمود مكثف الطرد المركزي وعكسه. تدور في 4000 × غرام لمدة 2 دقيقة لجمع الحل. نقل إلى أنبوب جديد.
- في مكثف الطرد المركزي 500 ، استخدم ماصة لجمع محلول mAb من مكثف الطرد المركزي ؛ أضف إلى أنبوب جديد.
- قم بقياس التركيز باستخدام مقياس الطيف الضوئي للأشعة المرئية وفوق البنفسجية. إذا كان التركيز أكثر من 2 ملغ / مل ، خفف مع أسيتات الأمونيوم إلى 2 ملغ / مل.
- القسمة 100 ميكروغرام لكل أنبوب PCR (حوالي 50 ميكرولتر) ؛ قم بتسمية الأنابيب ب DOTA-hCD19-mAb والتاريخ والكتلة والتركيز. تدور أسفل القوارير.
- قم بتجميد DOTA-hCD19-mAb على كتلة تفاعل البوليميراز المتسلسل المبردة على الثلج الجاف (أو قم بتجميده على الثلج الجاف). بمجرد تجميد جميع العينات ، ضعها في فريزر -80 درجة مئوية.
- قم بقياس عدد DOTA لكل hCD19-mAb بواسطة قياس الطيف الكتلي. احتفظ بعينة من الأجسام المضادة غير المقترنة (النقية) من كل اقتران لحساب النسبة. استخدم المعادلة (1) الواردة أدناه ؛ يتم اختصار الوزن الجزيئي MW.
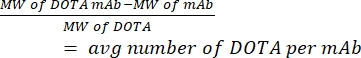 (1)
(1)
- وضع العلامات الإشعاعية
ملاحظة: ارتد معدات الحماية الشخصية المناسبة (PPE) للتعامل مع النشاط الإشعاعي ، بما في ذلك معطف المختبر والقفازات ومقاييس الجرعات الشخصية للجسم والحلقة ، وفقا للوائح المؤسسية. مسح وتغيير القفازات بانتظام لمنع التلوث الإشعاعي. استخدم التدريع الواقي من الرصاص وقم بزيادة المسافة من المصدر المشع عن طريق التعامل مع الملقط عندما يكون ذلك ممكنا.- انقل النشاط الإشعاعي من قارورة الشحن إلى قارورة جديدة باستخدام ماصة. قياس النشاط الإشعاعي.
- قم بإزالة السمة لتفاعل الوسم الإشعاعي الأول. أضف 50 ميكرولتر من أسيتات الأمونيوم (درجة الحموضة 5.5) لكل 1 mCi من 64Cu-CuCl3. قم بقياس الأس الهيدروجيني عن طريق سحب 1 ميكرولتر على شريط الأس الهيدروجيني بنطاق يلتقط 5.5 بدقة كافية للتمييز بين 5 و 6.
- إذا لم يكن الرقم الهيدروجيني 4-5.5 ، فقم بتغييره باستخدام 1 M NaOH أو 0.1 M HCl. أضف كميات صغيرة ، 1-5 ميكرولتر ، من 1 M NaOH إذا كان الرقم الهيدروجيني أقل من 4 أو 0.1 M HCl إذا كان الرقم الهيدروجيني أكبر من 5.5 حتى يتم الوصول إلى الرقم الهيدروجيني الصحيح. مع كل إضافة ، امزج جيدا ، وقم بتدويرها لأسفل ، وقم بقياس درجة الحموضة كما هو موضح أعلاه. لاحظ كل إضافة وإزالة لأي محلول (بما في ذلك التحقق من الأس الهيدروجيني) حتى يمكن حساب الحجم النهائي.
- بمجرد تحقيق الرقم الهيدروجيني الأمثل ، أضف 10 ميكروغرام من DOTA-hCD19-mAb لكل 1 mCi من 64Cu-CuCl3. تخلط بلطف وتدور لفترة وجيزة.
- ضع قارورة التفاعل على خلاط حراري مضبوط على 37 درجة مئوية و 400 دورة في الدقيقة (دورة في الدقيقة).
- بعد 30 دقيقة ، قم بإخماد التفاعل: قسم حجم التفاعل الكلي على 50 ، وأضف هذا الحجم البالغ 0.5 M EDTA إلى خليط التفاعل.
- حدد كفاءة وضع العلامات باستخدام كروماتوغرافيا الطبقة الرقيقة الفورية (ITLC) لقياس النسبة المئوية للنحاس المرتبط والحر في المحلول.
- قص شرائح بعرض 1 سم من ورق TLC. ضع علامة على 1 سم من أعلى وأسفل الشريط وقم بإعداد أنبوب (قارورة مخروطية سعة 50 مل) بطور متحرك أقل من 1 سم من حمض الستريك 0.1 متر (يجب أن يكون مستوى الطور المتحرك أقل من علامة 1 سم على الشريط عند وضعه في الأنبوب).
- ماصة 1 ميكرولتر من محلول التفاعل على الشريط في أسفل علامة 1 سم (جبهة المذيب) ووضع الشريط في الأنبوب. راقب حتى تصل مقدمة المذيب إلى أعلى علامة 1 سم ، وقم بإزالة الشريط ولفه بقطعة من الغلاف البلاستيكي.
- ضع الشريط على المنصة وقم بتشغيله من خلال ماسح ضوئي للتصوير اللاسلكي TLC. ابحث عن mAb المسمى إشعاعيا في الأصل و 64Cu الحر الذي ينتقل مع مقدمة الطور المتحرك (الشكل 2). إذا كانت نسبة النحاس الحر أقل من 5٪ (95٪ كفاءة وضع العلامات) ، فتابع الحقن في الحيوانات. إذا كانت نسبة النحاس الحر أكبر من 5٪ ، فتابع التنقية.
ملاحظة: تعتمد النسبة المئوية للنحاس الحر بشكل عام على نسبة DOTA-mAb إلى 64Cu ، ووقت التفاعل ، ودرجة الحموضة ، ودرجة الحرارة. يجب تحسين ظروف التفاعل من قبل كل مستخدم لكل mAb جديد لضمان نتائج متسقة.
- تنقية عن طريق عمود الجاذبية درجة الحمض النووي القابل للتصرف
- قم بتكييف عمود تدفق الجاذبية بدرجة الحمض النووي القابل للتصرف (عمود تبادل التحلية / المخزن المؤقت) وفقا لتوجيهات الشركة المصنعة. ضع عمود الجاذبية بدرجة الحمض النووي القابل للتصرف على حامل حلقي أو أداة أخرى خلف درع الرصاص الكافي ؛ تأكد من أن الجهاز مستقر ويمكن نقله بسهولة. ضع الأنبوب أسفل العمود.
- ماصة خليط التفاعل الخام على راتنج عمود تدفق الجاذبية. انتظر حتى يتدفق كل السائل إلى الراتنج. ماصة كافية PBS لجلب الحجم الكامل (المنتج الخام بالإضافة إلى PBS) إلى 500 ميكرولتر. تخلص من التدفق.
- ضع العمود فوق أنابيب طرد مركزي سعة 1.5 مل تحمل علامة 1-10. أضف 1 مل من PBS إلى العمود. اجمع خمس قطرات في كل أنبوب حتى يتوقف التدفق.
ملاحظة: قد تكون هناك حاجة إلى أقل من 10 أنابيب. - قم بتغطية الجزء السفلي من العمود وقياس النشاط الإشعاعي المتبقي. قياس كل قارورة مع التدفق. لكل قارورة تحتوي على أكثر من 50 μCi ، قم بإعداد ITLC لكل خطوة 3.3.7 لقياس النسبة المئوية للنحاس المرتبط في كل كسر.
ملاحظة: سيحتوي أول كسر أو كسرين على الطور المتحرك فقط ؛ سوف يذوب mAb المسمى إشعاعيا أولا (عادة الكسور 2 أو 3 إلى 5 أو 6) و 64Cu الحر سوف يذوب أخيرا (سيلتزم البعض بالعمود). قد تختلف النسبة المئوية المرتبطة ب 64Cu بين الكسور. - الجمع بين الكسور مع أكبر من 95 ٪ ملزمة (أقل من 5 ٪ النحاس الحر) ؛ استخدم الحل للحقن. إذا رغبت في ذلك ، قم بإجراء HPLC لاستبعاد الحجم لتأكيد وضع العلامات الإشعاعية5 وحساب النشاط المولي. احتفظ بقسمة لقياس التركيز على مقياس الطيف الضوئي للأشعة المرئية وفوق البنفسجية بعد اضمحلاله 10 فترات نصف عمر (127 ساعة أو 5.3 أيام).
4. إعداد الجرعة
ملاحظة: قبل التعامل مع الجرعة ، ارتد معدات الوقاية الشخصية المناسبة ، بما في ذلك معطف المختبر ومقاييس جرعات الجسم والأصابع والقفازات.
- حقن 64Cu-DOTA-hCD19-mAb 18-24 ساعة قبل التصوير المقطعي بالإصدار البوزيتروني ، للسماح بالدورة الدموية الكافية للمقتفي الإشعاعي في الجسم.
- ضع حاوية الرصاص على الفور مع 64Cu-DOTA-hCD19-mAb خلف التدريع من الرصاص. قم بتشغيل عداد جيجر لمراقبة التلوث المحتمل.
ملاحظة: قم بتغيير القفازات بشكل متكرر عند التعامل مع المواد المشعة. يوصى باستخدام القفازات المزدوجة أثناء سحب الجرعات لتسهيل التغييرات السريعة للقفازات. ضع دائما الأدوات الحادة والقمامة الملوثة في منطقة القمامة المحمية المخصصة. - قم بتخفيف 64Cu-DOTA-hCD19-mAb إلى تركيز مناسب في أنبوب طرد مركزي بلاستيكي منخفض الارتباط سعة 1.5 مل.
ملاحظة: سوف يرتبط 64Cu-DOTA-hCD19-mAb بالبلاستيك إذا لم يكن مرتبطا منخفضا ؛ 64سوف Cu ربط الزجاج.- قم بتخفيف المقتفي الإشعاعي في محلول ملحي لمنع التحلل الإشعاعي وتبسيط رسم جرعات متسقة.
- تحضير جرعات لإدارة ما بين 75 و 150 μCi في 100 ميكرولتر ، إن أمكن. تأكد من أن الحد الأقصى لحجم الحقن الكلي لا يتجاوز 10٪ من وزن جسم الماوس.
- استخدم حقنة أنسولين سعة 500 ميكرولتر (50 سم مكعب) لسحب الجرعة من الأنبوب البلاستيكي منخفض الربط. تأكد من عدم وجود فقاعات في المحقنة حيث سيتم حقنها عن طريق الوريد.
- قم بتسمية المحاقن بأرقام الحيوانات المقابلة.
- سجل نشاط الجرعة والوقت في دفتر ملاحظات معمل لتحليل البيانات.
- اجعل الجرعات جاهزة للحقن بمجرد قسطرة الحيوانات لتقليل الوقت تحت التخدير.
- بعد تحضير الجرعات، قم بإعداد معيار (وهمي) للمسح الضوئي لتوليد عامل معايرة.
- املأ أنبوبا مخروطيا سعة 15 مل ب 50-75 μCi من النشاط المخفف في الماء (أو PBS).
ملاحظة: تأكد من الخلط الشامل للمحلول. يمكن أن يكون المعيار مجانيا 64Cu متبقيا من وضع العلامات.- قياس مقدار النشاط في المعيار وتسجيل الوقت.
- املأ أنبوبا مخروطيا سعة 15 مل ب 50-75 μCi من النشاط المخفف في الماء (أو PBS).
5. القنية والحقن
ملاحظة: انظر الطرق الموصوفة سابقا 6 للقنية الوريدية للفئران لحقن المقتفي الإشعاعي6.
- قم بوزن الفئران وتسجيلها لشدة المرض كما هو موضح في القسم 2.1 قبل تخدير الفئران في صندوق ضربة قاضية مملوء ب 1.5-3٪ إيزوفلوران استعدادا لإدارة المقتفي الإشعاعي.
ملاحظة: سيتم حقن هذه الفئران على سطح الطاولة ، وليس على ماسح PET كما هو موضح سابقا. ليست هناك حاجة للصق القسطرة في مكانها للحقن ، حيث لن يتم نقل الفئران بين القنية والحقن. - بمجرد قنية الفأر ، أدخل الإبرة في نهاية القسطرة واحقنها ببطء. بعد الحقن ، اتبع ذلك بتدفق ملحي صغير عبر القسطرة لضمان حقن الجرعة بأكملها.
ملاحظة: يجب أن يساوي الحجم تقريبا الحجم الميت للقسطرة ، وهو 50 ميكرولتر للقسطرة التي يستخدمها المؤلفون.- حقن فوق قطعة من مسح المختبر لجمع أي قطرات من المقتفي الإشعاعي. قم بتضمين هذا عند قياس الجرعة المتبقية.
- سجل وقت الحقن في دفتر ملاحظات معملي.
- قم بإزالة القنية مباشرة بعد الحقن. قم بقياس القنية وحقنة الجرعة والأنسجة باستخدام معاير الجرعة لتحديد الجرعة المتبقية التي لم يتم حقنها في الفأر.
- سجل النشاط والوقت في دفتر ملاحظات معملي.
- بعد حقن الفئران ، قم بتسمية أقفاصها ببطاقة قفص تشير إلى أن الفئران مشعة. تسجيل وتسجيل الأقفاص وفقا للمبادئ التوجيهية المؤسسية. ثم ضع الفئران في منطقة احتجاز مشعة محددة.
6. التصوير المقطعي بالإصدار البوزيتروني / التصوير المقطعي المحوسب
- إجراء التصوير المقطعي بالإصدار البوزيتروني 18-24 ساعة بعد حقن 64Cu-DOTA-hCD19-mAb. قم بوزن الفئران وتسجيلها قبل المسح.
ملاحظة: تعتمد تعليمات تشغيل الماسحة الضوئية على الماسحة الضوئية المستخدمة.- تأكد من تسخين مكون الأشعة السينية في ماسح التصوير المقطعي بالإصدار البوزيتروني / التصوير المقطعي المحوسب وجاهزيته للاقتناء.
- افتح برنامج الحصول على الماسح الضوئي PET على الكمبيوتر.
- من القائمة المنسدلة تسجيل دخول الباحث ، انقر فوق معلومات المختبر المناسبة.
- في صفحة المشروع ، إما أن تنشئ مشروعا جديدا أو تحدد مشروعا موجودا من القائمة المنسدلة.
- عندما تظهر مطالبة التهيئة تلقائيا على الشاشة ، انقر فوق Home Bed وانتظر السرير إلى المنزل. ثم ، انقر فوق إحماء CT.
- تأكد من إغلاق باب الحماية من التصوير المقطعي المحوسب للسماح للتصوير المقطعي المحوسب بالإحماء.
- أثناء تسخين الماسح الضوئي ، قم بتسجيل الفئران EAE وحقنها تحت الجلد بمحلول ملحي دافئ 0.2-0.4 مل في الجناح للترطيب.
- بعد تسخين الماسحة الضوئية ، ارجع إلى الكمبيوتر لإعداد فحوصات التصوير المقطعي بالإصدار البوزيتروني للدراسة.
ملاحظة: يمكن إعدادها قبل يوم الفحص.- تحت عنوان الدراسات الحديثة ، انقر فوق إنشاء دراسة جديدة. املأ اسم الدراسة والبروتوكول والمركب ومعلومات الموضوع.
- في حالة إجراء PET/CT، حدد بروتوكول PET أولا، ثم حدد بروتوكول التصوير المقطعي المحوسب.
ملاحظة: عادة ما يكون التصوير المقطعي المحوسب القياسي كافيا لمسح طراز الماوس EAE. يبلغ طول التصوير المقطعي المحوسب 1 دقيقة ويتم الحصول عليه باستخدام binning عند 2 × 2 بجهد 80 كيلو فولت ، تيار 150 μA ، و 720 إسقاطات. يتم إعادة بناء صور التصوير المقطعي المحوسب باستخدام خوارزمية فيلدكامب المعدلة. - بالنسبة لبروتوكول PET ، اختر مسحا ثابتا من 64 نحاسيا لمدة 10-15 دقيقة. إذا لم يكن هذا الفحص مدرجا بالفعل في قائمة البروتوكولات المتاحة ، فقم بإضافته بالنقر فوق علامة التبويب البروتوكولات في القائمة القياسية ، إنشاء بروتوكول جديد | القائمة المنسدلة النظائر . إذا لم يكن النظير المطلوب مدرجا ، فانقر فوق المزيد | أضف من المكتبة وأضف النظير المطلوب. حدد مدة الفحص ، وانقر فوق زر الاختيار الخاص بالفحص الثابت ، وقم بتسمية البروتوكول وانقر فوق حفظ.
- ارجع إلى علامة التبويب "دراسات " واستمر في تسمية وإعداد جميع عمليات الفحص المطلوبة لهذا اليوم.
ملاحظة: يوصى أيضا بإعداد فحص "CT Test" واحد باستخدام التصوير المقطعي المحوسب القياسي فقط للتحقق من وضع السرير للفحص الأول لضمان الموضع الأمثل. يجب أن يكون هذا هو الفحص الأول الذي يتم تشغيله للدراسة.
- في حالة إجراء PET/CT، حدد بروتوكول PET أولا، ثم حدد بروتوكول التصوير المقطعي المحوسب.
- تحت عنوان الدراسات الحديثة ، انقر فوق إنشاء دراسة جديدة. املأ اسم الدراسة والبروتوكول والمركب ومعلومات الموضوع.
- بمجرد أن يصبح الماسح الضوئي جاهزا ، قم بتخدير الفئران في صندوق ضربة قاضية لإعدادهم للفحص.
ملاحظة: في هذه المرحلة ، من المحتمل أن تكون الفئران مريضة جدا. من أفضل الممارسات تقليل الوقت تحت التخدير.- تطبيق هلام العين.
- تأكد من أن سرير المسح المكون من أربعة فأرة مزود بعناصر تسخين ، مثل وسادات التدفئة أو الهواء الساخن ، مع ضبط الأيزوفلوران على 1.5٪ -2٪ وتشغيل وسادة التدفئة (الشكل 3). ضع الفئران في وضع ضعيف على سرير المسح.
- مع تقدم مرض EAE ، يصبح العمود الفقري للفأر منحنيا بشدة. مسح الفئران أثناء وجودها على ظهورها لتقويم العمود الفقري قدر الإمكان ، وتحسين التحليل في اتجاه مجرى النهر. اسحب ذيل الماوس برفق للمساعدة في تقويم العمود الفقري.
- بمجرد الوصول إلى وضع الاستلقاء ، قم بلصق كل ماوس بإحكام في مكانه بشريط مجهر ناعم. استخدم شريطا واحدا من الشريط اللاصق فوق الرأس وآخر برفق على البطن لتقليل الحركة بسبب التنفس.
- سجل في دفتر ملاحظات المختبر الماوس الموجود في موضع المسح الضوئي.
- بمجرد تأمين الفئران ، ارجع إلى كمبيوتر المسح الضوئي لتشغيل الماسح الضوئي.
- افتح قائمة وحدة التحكم في الحركة . انقر فوق PET Center FOV لنقل الفئران الموجودة على سرير المسح إلى حلقة PET. للحصول على الفحص الأول لليوم ، انقر فوق CT Center FOV. بمجرد الوصول إلى الموضع ، قم بتشغيل فحص CT Test للتأكد من صحة الموضع ؛ كرر حتى يصبح وضع السرير مرضيا.
- ضع قطعة صغيرة من الشريط الأبيض على سرير المسح لتحديد موضع السرير الصحيح لبقية الدراسة.
- بمجرد وضع السرير في مكانه لإجراء فحص التصوير المقطعي بالإصدار البوزيتروني ، ابدأ تسلسل المسح بالنقر فوق تشغيل.
- انتظر حتى ينتقل الماسح الضوئي تلقائيا من حلقة التصوير المقطعي بالإصدار البوزيتروني إلى التصوير المقطعي المحوسب.
- تحقق دائما بصريا مما إذا كانت الحيوانات قد انتقلت إلى الموضع المناسب لكل من PET و CT.
- سجل وقت بدء الفحص في دفتر ملاحظات معمل لتصحيح تسوس الجرعة المحقونة أثناء تحليل البيانات.
- بعد اكتمال الفحص ، اسمح بإعادة بناء الصورة. تحقق من البيانات قبل إزالة الحيوانات.
ملاحظة: ستستغرق إعادة بناء المجموعات الفرعية المطلوبة 3D (OSEM) حوالي 5 دقائق لإجراء فحص ثابت. - تحقق بصريا من البيانات ووافق عليها ، باستخدام الطحال كعنصر تحكم إيجابي لأن هذا النسيج يحتوي على عدد كبير من الخلايا البائية. أخرج الحيوانات من سرير المسح وضعها في صندوق ضربة قاضية مملوء بالإيزوفلوران استعدادا للتروية والتشريح اللاحق.
- كرر الخطوات 6.5-6.12 للفئران المتبقية في الدراسة.
- عندما يتم فحص جميع الفئران أو عند مسح مجموعة بها مكان مفتوح في سرير المسح ، قم بمسح المعيار المعد في الخطوة 4.6.
7. تشريح لعد غاما خارج الجسم الحي والتصوير الشعاعي الذاتي
- قبل التشريح ، تأكد من أن جميع أنابيب عد جاما وأجهزة الطرد المركزي قد تم وزنها مسبقا.
- إجراء القتل الرحيم عن طريق التروية ، كما هو موضح سابقا6 ، مع PBS وبضع الصدر بينما يتم تخدير الفئران بعمق (الاستنشاق المستمر ل 4٪ إيزوفلوران ، 2 لتر / دقيقة 100٪ O2).
- لإزالة نخاع العظم ، قم بقطع عظم الفخذ عند الركبة والحوض. تأكد من إزالة كلا الرأسين من عظم الفخذ.
- ضع كلا عظم الفخذ في أنبوب طرد مركزي سعة 0.5 مل به ثقب في الأسفل (باستخدام إبرة 20 جرام) وقطع الغطاء.
- ضع أنبوب 0.5 مل الذي يحتوي على عظم الفخذ داخل أنبوب طرد مركزي سعة 1.5 مل مع قطع الغطاء.
- ضع إعداد الأنبوب بالكامل في جهاز طرد مركزي صغير. تدور لمدة 4 دقائق عند 4500 × جم.
ملاحظة: يجب إزاحة نخاع العظم من خلال الفتحة الموجودة في أنبوب الطرد المركزي سعة 0.5 مل والاستقرار في قاع أنبوب الطرد المركزي سعة 1.5 مل.- افصل الأنابيب. وزن عظم الفخذ الفارغ في أنبوب الطرد المركزي 0.5 مل. وزن نخاع العظم في أنبوب الطرد المركزي 1.5 مل. ضع كل أنبوب طرد مركزي في أنابيب عد جاما.
- قم بإزالة الدماغ باستخدام الملقط والمقص ، مع الحرص على الحفاظ على جذع الدماغ سليما. ضع الدماغ في أنبوب عد جاما. سجل الوزن الجاف ، واغسله باستخدام برنامج تلفزيوني ، واحتفظ بالثلج حتى يصبح جاهزا للعد.
- لإزالة الحبل الشوكي ، قم بتنفيذ الخطوات التالية.
- قم بإزالة الجلد والفراء عن طريق إجراء شق أسفل الجانب الظهري للحيوان لكشف العمود الفقري (الشكل 1).
- افصل أسفل الظهر (L) عن مناطق عنق الرحم (C) والصدر عن طريق قطع ثلاث طائرات عرضية حول العمود الفقري وعبره: عند قاعدة الرقبة (فقرة C1) (الشكل 1D ، رقم 1) ؛ في قاعدة القفص الصدري (فقرة L1) (الشكل 1D ، رقم 2) ؛ في قاعدة الحوض (L5 فقرة) (الشكل 1D ، رقم 3).
- قطع تحت القفص الصدري (الشكل 1 د ، رقم 2).
- قطع مباشرة فوق العجز لفصل منطقة العمود الفقري القطني. قم بقص العمود الفقري بعناية من نهاية الحوض حتى يصبح الحبل الشوكي القطني مرئيا (الشكل 1 د ، الرقم 3). تقليم الأنسجة المحيطة لعزل المناطق القطنية وعنق الرحم / الصدر من العمود الفقري (الشكل 1D ، الرقمان 4 و 5).
- لطرد الحبل الشوكي ، استخدم حقنة ذات طرف منزلق (3-10 مل) مملوءة ب PBS. قم بإنشاء ختم بين المحقنة والعمود الفقري باستخدام الإبهام والسبابة.
- ادفع PBS برفق من خلال المحقنة لطرد الحبل الشوكي على وسادة ماصة (الشكل 1E) ؛ كرر لكلا منطقتي العمود الفقري. ضع أنسجة الحبل الشوكي في أنبوب عد جاما.
- سجل الوزن الجاف ، وأضف برنامج تلفزيوني للتأكد من أن الأنسجة في أسفل الأنبوب لتجنب الجفاف. ضع الأنبوب على الثلج حتى يصبح جاهزا للعد.
- طرد الحبل الشوكي العنقي / الصدري من نهاية الجمجمة والحبل الشوكي القطني من النهاية الذيلية للعمود الفقري (الشكل 1E).
8. عد غاما خارج الجسم الحي
- افتح برنامج عداد جاما. انتقل إلى قائمة العمل وحدد البروتوكول المطلوب ، مثل بروتوكول عد 30 ثانية ل 64نحاس.
- إعداد ثلاثة معايير على الأقل في أنابيب منفصلة. قم بتشغيلها الآن لاستخدامها في التحليل (الخطوة 10.2). تهدف إلى جعل ثلاثة أحجام النسخ المتماثلة وكميات النشاط في ثلاثة أنابيب منفصلة.
ملاحظة: حجم 500 ميكرولتر يعطي نتائج جيدة. بينما سيتم تحديد النشاط بواسطة الآلة المستخدمة ، فإن 10 μCi تعمل بشكل جيد بشكل عام. - ضع المعايير في رف مكتوب عليه الرمز الشريطي المقابل للبروتوكول المطلوب تشغيله. ضع الرف على عداد جاما.
- بعد تسجيل أوزان الأعضاء ، ضع الأنابيب التي تحتوي على الأعضاء على رف عد جاما بعد الأنابيب التي تحتوي على المعايير.
ملاحظة: يمكن أن تشمل الأجهزة ذات الأهمية لهذا النموذج الغدد الليمفاوية المحورية والدم ونخاع العظام والدماغ والغدد الليمفاوية العنقية وعظم الفخذ والقلب والكبد والحبل الشوكي القطني والعضلات والطحال والذيل والحبل الشوكي العنقي / الصدري. - ضع رفا مع رمز شريطي للتوقف في الجزء الخلفي من عداد جاما.
- اضغط على زر التشغيل على الكمبيوتر. إذا أمكن ، لا تضغط على تشغيل حتى يكون هناك العديد من الحوامل أو الأجهزة التي سيتم تشغيلها للسماح بحساب جميع الأنابيب باستمرار في ملف واحد. تأكد من وجود رف به رمز شريطي للإيقاف في الجزء الخلفي من عداد جاما لكل تشغيل.
- قم بتشغيل حتى يتم عد جميع العينات. احفظ الملف وقم بتصديره.
9. التصوير الشعاعي الذاتي خارج الجسم الحي (ARG) لأنسجة الجهاز العصبي المركزي
- اتبع الخطوات المنشورة مسبقا لكل من الدماغ والحبل الشوكي ARG (مع استبعاد الخطوات 2-6 التي وصفها Chaney et al. ، حيث يتم حقن الفئران بالفعل بالمقتفي الإشعاعي من فحص التصوير المقطعي بالإصدار البوزيتروني)6.
ملاحظة: تعليمات محددة لإعداد شريط ARG للحبل الشوكي مذكورة هنا6. - بعد اكتمال عد جاما للحبال الشوكية القطنية وعنق الرحم / الصدر ، ضع الأنابيب على الفور على الثلج حتى يتم عد جميع أنسجة الجهاز العصبي المركزي.
ملاحظة: راجع الطريقة المنشورة مسبقا ل ARG للدماغ6. - اقلب الأنابيب برفق للسماح للحبال الشوكية بالسقوط على وسادة ماصة. إذا التصق الحبل الشوكي بجانب الأنبوب ، اغسله برفق باستخدام برنامج تلفزيوني بارد وقم بقلب الأنبوب مرة أخرى. جفف كل الحبل الشوكي بعناية عن طريق النشاف برفق بمنديل مختبري. ضع الحبل الشوكي المجفف بطريقة منظمة على قطعة سوداء سميكة من الورق.
- ضع ملصقا بجانب الحبل الشوكي بقلم أبيض لسهولة التعرف عليه.
- اترك مساحة في الزوايا وفي منتصف الورقة السوداء لوضع أكوام من ثلاث شرائح مجهرية لتكون بمثابة فواصل لمنع ضغط الحبل الشوكي عند إغلاق شريط ARG. استخدم 5-7 مداخن.
- بمجرد وضع جميع الحبال الشوكية القطنية وعنق الرحم / الصدر على الورق الأسود ووضع العلامات عليها ، ضع قطعة الورق بعناية في شريط ARG. ضع الكاسيت المفتوح على صينية من الثلج الجاف لتجميد الحبل الشوكي.
- بمجرد التجميد ، ضع غلافا بلاستيكيا برفق بين شاشة تخزين الفوسفور الرقمية والحبل الشوكي وضع الشاشة فوق العينات. أغلق الكاسيت على الفور وضعه في الفريزر -20 درجة مئوية لمدة 10 أنصاف عمر تقريبا (~ 127 ساعة).
- عند اكتمال وقت التعرض ، امسح الفيلم ضوئيا باستخدام جهاز تصوير الفوسفور. تحليل الصورة الرقمية الناتجة (انظر القسم 12 للحصول على التعليمات).
10. تحليل بيانات التوزيع الحيوي
- قم بإعداد جدول بيانات "تصحيح الجرعة" لتحديد تصحيح الوقت رياضيا للاضمحلال الإشعاعي ، وبالتالي تطبيع جرعات الإشعاع والسماح بإجراء مقارنات بين الأشخاص.
- قم بتصحيح جميع الجرعات إلى وقت الحقن ، مع مراعاة النشاط المتبقي المتبقي في المحقنة والقسطرة بعد الحقن.
- باستخدام المعايير المعدة في الخطوة 8.2 ، متوسط مقدار النشاط (μCi) والأعداد الطبيعية في الدقيقة (CPM). اقسم متوسط التكلفة لكل ألف ظهور على متوسط مقدار النشاط القياسي للحصول على التكلفة لكل ألف ظهور/ميكروسي.
ملاحظة: تأكد من تصحيح مقدار النشاط لكل معيار إلى الوقت الذي يحسب فيه عداد جاما التكلفة لكل ألف ظهور للمعايير. يجب أن يقوم عداد جاما بتطبيع جميع قيم التكلفة لكل ألف ظهور إلى وقت بدء البروتوكول.
- قم بإعداد جدول بيانات "النتائج" لحساب النسبة المئوية النهائية للجرعة المحقونة لكل جرام من الأنسجة (٪ ID / g) لكل عينة.
- قم بتصحيح الاضمحلال CPM الطبيعي من عداد جاما لكل عينة يتم حسابها إلى وقت حقن الحيوان.
ملاحظة: يمكن أن يكون تصحيح الاضمحلال في أي نقطة زمنية ؛ تأكد من تصحيح جميع الجرعات وقيم التكلفة لكل ألف ظهور إلى نفس النقطة الزمنية. - تطبيع التكلفة لكل ألف ظهور المصححة بالاضمحلال إلى كتلة كل عينة لتحديد التكلفة لكل ألف ظهور لكل عينة. احسب إجمالي التكلفة لكل ألف ظهور المحقونة عن طريق طرح التكلفة لكل ألف ظهور في الذيل من التكلفة لكل ألف ظهور المحقونة المحسوبة.
ملاحظة: لا يحتاج الذيل إلى تصحيح الكتلة حيث سيتم ببساطة طرح قيمة التكلفة لكل ألف ظهور هذه من إجمالي التكلفة لكل ألف ظهور المحقونة لحساب أي مقتفي خارج الوريد من الحقن. - اقسم التكلفة لكل ألف ظهور لكل كتلة على إجمالي التكلفة لكل ألف ظهور المحقونة لحساب ٪ID/g.
- قم بتصحيح الاضمحلال CPM الطبيعي من عداد جاما لكل عينة يتم حسابها إلى وقت حقن الحيوان.
- قم بإعداد جدول بيانات "ملخص" لعرض النتائج النهائية لإدخالها في برنامج الرسوم البيانية وتصور البيانات اللاحق والتحليل الإحصائي.
11. تحليل صورة PET
- افتح برنامج تحليل التصوير المقطعي بالإصدار البوزيتروني. لعق على ملف |البيانات المحلية المفتوحة | ديكوم. حدد موقع الملف المطلوب (تنسيق DICOM). افتح كل من التصوير المقطعي بالإصدار البوزيتروني والتصوير المقطعي المحوسب.
- في مدير البيانات ، اضبط تباين PET و CT على المستويات المطلوبة.
- تسجيل واقتصاص الفئران الفردية.
- في قائمة التنقل ، حدد علامة التبويب إعادة التوجيه/التسجيل .
- انتقل إلى القائمة جامدة ضمن علامة التبويب هذه. قم بتعيين الفحص بالأشعة المقطعية (0 ) كفحص ثابت وفحص التصوير المقطعي بالإصدار البوزيتروني (1) كفحص متحرك .
- حدد التحويل الصارم والجودة السريعة . انقر فوق تسجيل.
- بعد اكتمال التسجيل (5-10 دقائق) ، انقر فوق علامة الاختيار لحفظ التسجيل.
- فحص البيانات بصريا للتأكد من نجاح التسجيل. تصدير الجلسة بالضغط على ملف | الجلسة | تصدير.
- بعد ذلك ، قم بقص كل ماوس في اقتصاص كامل للجسم: انتقل إلى قائمة التنقل وانقر على اقتصاص. اسحب جوانب كل مقطع عرضي من الحافة الخارجية إلى الداخل.
- بمجرد اقتصاص الماوس المطلوب بإحكام ، انقر فوق علامة الاختيار ، وقم بتصدير الجلسة لحفظها.
- بعد ذلك ، قم بقص وتصويب رؤوس كل ماوس لتحليل الدماغ باستخدام دليل الترجمة والتناوب والتقلب في قائمة التسجيل / إعادة التوجيه . تصدير للحفظ.
- تحليل الحبل الشوكي.
- لبدء تحليل مناطق الاهتمام (ROIs) في الحبل الشوكي ، افتح أداة 3D ROI من قائمة التنقل .
- ضمن رأس عائد الاستثمار ، استخدم علامة الجمع في أسفل القائمة لإنشاء ستة عائد استثمار: عائد الاستثمار القطني ، عائد الاستثمار العنقي / الصدري ، الهيكل العظمي القطني ، الهيكل العظمي الصدري ، الحبل الشوكي القطني ، الحبل الشوكي الصدري.
ملاحظة: عائد الاستثمار القطني والعنقي / الصدري هو عائد استثمار كبير معمم سيتم استخدامه لإنشاء عائد استثمار الهيكل العظمي (الشكل 4). - لتجنب التداخل البصري من إشارة PET بهذه الخطوة ، انقر فوق F3 لإيقاف تشغيل PET.
- انتقل إلى الجزء العلوي من مشغل أداة 3D ROI. انقر على النقطة الصلبة على يمين رمز المؤشر لفتح وضع الطلاء 3D وقائمة تآكل / تمدد .
- حدد Sphere وقم بتغيير الحجم إلى 20 بكسل. اضبط التمدد على +5.
- قبل المتابعة ، انتقل إلى أسفل القائمة. تأكد من تحديد عائد الاستثمار القطني ، لأن هذا هو أول عائد استثمار يتم سحبه.
- على التصوير المقطعي المحوسب ، ابحث عن الفقرة L6 من العمود الفقري (حيث يلتقي العمود الفقري بالوركين). بدءا من فقرة واحدة فوق L6 ، ارسم عائد استثمار قطني تقريبي على الفقرات الخمس فوق الوركين (الفقرات L1-L5). بعد ذلك ، قم بالتبديل إلى عائد الاستثمار العنقي / الصدري وتتبع ما تبقى من العمود الفقري إلى قاعدة الجمجمة.
ملاحظة: لا يجب أن يكون هذا دقيقا ، حيث يتم استخدامه للإشارة إلى المكان الذي يجب أن يحدث فيه عتبة Otsu في الخطوة 11.4.8. - بعد رسم عائد الاستثمار المعمم ، انتقل إلى الجزء العلوي من المشغل. حدد قائمة خوارزميات التجزئة .
- من القائمة المنسدلة ، حدد عتبة Otsu. بالنسبة إلى الإدخال، حدد عائد الاستثمار القطني. في الجزء السفلي من القائمة ، تأكد من تحديد الهيكل العظمي القطني . في القائمة المنسدلة بجوار الصورة ، تأكد من تحديد التصوير المقطعي المحوسب وانقر فوق تطبيق. كرر لعائد الاستثمار العنقي / الصدري والهيكل العظمي الصدري.
- إذا لم تبرز عتبة Otsu العمود الفقري بشكل كاف ، فاستخدم Global Thresholding وقم بتغيير قيمة الحد الأدنى إلى 350 والحد الأقصى إلى 3500 للعتبة اليدوية واضبطها حسب الضرورة لعزل الفقرات.
- بعد استخدام Otsu Thresholding لإنشاء عائد استثمار الهيكل العظمي ، ارجع إلى قائمة التنقل (رمز المؤشر). إما أن تحذف أو تحدد العمود H (إخفاء) لكل من عائد الاستثمار القطني والعنقي / الصدري الخام لإخفائها. حدد العمود I (غير قابل للتغيير) لكل من عائد الاستثمار للهيكل العظمي بحيث لا يمكن تحريرهما.
- أخيرا ، ارجع إلى الجزء العلوي من مشغل أداة عائد الاستثمار ثلاثي الأبعاد وانتقل إلى قائمة 3D Paint لرسم عائد استثمار الحبل الشوكي.
- حدد أداة Sphere مرة أخرى وتتبع الحبل الشوكي داخل الهيكل العظمي لكل من الفقرات القطنية والصدرية ، مما يضمن تحديد عائد الاستثمار الصحيح في أسفل القائمة.
- لمسح أي عائد استثمار ، انقر فوق القيادة / التحكم وارسم فوق الجزء المراد مسحه.
- تحقق من عائد الاستثمار للحبل الشوكي من جميع المستويات الثلاث للتأكد من عدم وجود عائد استثمار خارج العمود الفقري.
- تصدير نتائج تحليل الحبل الشوكي.
- إذا تم إيقاف تشغيل إشارة PET في الخطوة 11.4.3 ، فاضغط على F3 بعد رسم عائد استثمار الحبل الشوكي لإعادة تشغيل PET ، أو حدد وحدة التحكم المرئية (VC) وانقر فوق شريط PET.
- ارجع إلى قائمة التنقل (رمز المؤشر). انقر على أيقونة الشبكة لإظهار الجدول. انسخ الجدول إلى برنامج جداول البيانات واحفظه.
- أخيرا ، قم بتصدير الملف في برنامج تحليل PET ، كما هو موضح أعلاه ، لحفظ عائد الاستثمار المرسوم.
- تحليل الدماغ باستخدام أطلس 3D شبه الآلي.
- افتح ملف اقتصاص الرأس. قم باستيراد أطلس دماغ الماوس بالانتقال إلى قائمة الوحدات المتقدمة وتحديد أداة 3D Brain Atlas. تأكد من تعيين المرجع إلى CT وأن خيار الاقتصاص غير محدد. قم بتعيين مسار لدليل الإخراج.
- في الإعداد المتقدم ، قم بتغيير التحويل إلى Versor-Affine. احتفظ بجميع الإعدادات الافتراضية الأخرى. انقر فوق تشغيل.
- اضبط الأطلس يدويا في قائمة إعادة التوجيه / التسجيل واستخدم التصوير المقطعي المحوسب للجمجمة كمبدأ توجيهي لتركيب الأطلس.
- توخ الحذر الشديد إذا كان التحجيم ضروريا ، لأن هذا يمكن أن يؤثر بشكل كبير على أحجام بنية الدماغ. انقر فوق علامة الاختيار عند اكتمال التعديل.
- أعد تشغيل الأطلس مع تحديد استيراد عائد استثمار 3D .
- قم بتصدير الملف لحفظ الأطلس الذي تم تركيبه على الرأس الذي تم اقتصاصه.
- بعد رسم وتصدير جميع عائد الاستثمار من الأعضاء المطلوبة ، احسب قيمة تصحيح الربط القياسية. اضمحلال وتصحيح جميع البيانات وتحويلها إلى٪ ID / g كما هو موضح سابقا6. تطبيع للعضو الذي يناسب النموذج الحيواني ، مثل القلب لتطبيع إلى المقتفي الإشعاعي الموجود في تجمع الدم.
12. تحليل التصوير الشعاعي الذاتي خارج الجسم الحي
- افتح ملف الصورة الرقمية (.gel) باستخدام برنامج تحليل الصور. اضبط السطوع والتباين على الحد المطلوب. قم بتطبيق جدول بحث ألوان مناسب إذا رغبت في ذلك.
ملاحظة: يوصى باستخدام Royal أو Grays لسهولة التصور.
النتائج
كان hCD19-mAb مقترنا ب DOTA وتم تمييزه إشعاعيا ب 64نحاس كما هو موضح في الشكل 2. خضعت EAE والفئران الساذجة لفحص PET / CT (الشكل 3) 18-24 ساعة بعد الحقن ب 64Cu-DOTA-hCD19-mAb. تم تسجيل صور PET / CT بشكل مشترك باستخدام برنامج تحليل PET ، وتم تحليل أنسجة الجهاز العصبي المركزي باستخدام عائد الاستثمار اليدوي أو أطلس الدماغ 3D شبه الآلي. كان ارتباط المقتفي الإشعاعي في عائد الاستثمار (الشكل 4) أعلى في الفئران EAE منه في الفئران الساذجة. أظهر عد غاما خارج الجسم الحي و ARG زيادة الارتباط في الحبل الشوكي (كل من الأجزاء القطنية والصدرية العنقية) والدماغ (ARG فقط) لفئران EAE مقارنة بالسذاجة (الشكل 5 والشكل 6). أظهر عد غاما خارج الجسم الحي للفئران المثقوبة أيضا انخفاضا في ارتباط المقتفي الإشعاعي في الأعضاء الطرفية ، بما في ذلك الطحال وعظم الفخذ ونخاع العظم (الشكل 5) ، بما يتفق مع الخلايا البائية التي تغادر المحيط وتتسلل إلى الجهاز العصبي المركزي في نموذج EAE هذا.
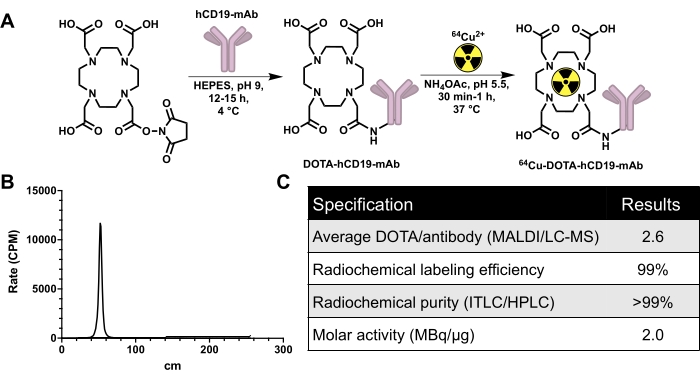
الشكل 2: مخطط الاقتران ووضع العلامات الإشعاعية لتوليد 64 جسما مضادا أحادي النسيلة CD19 خاص بالإنسان يحمل علامة Cu ، 16C4-TM mAb (64Cu-DOTA-hCD19-mAb) ، بالإضافة إلى بيانات مراقبة الجودة. (أ) تفاعل DOTA-NHS-ester مع الجسم المضاد أحادي النسيلة hCD19 لإنتاج اقتران hCD19-DOTA (وليس على نطاق واسع) ووضع العلامات الإشعاعية مع 64 Cu-CuCl3 لإنتاج 64Cu-DOTA-hCD19-mAb. (ب) كروماتوجراف ممثل ITLC. الذروة عند 40-60 سم هي الجسم المضاد المشع ؛ يسافر 64Cu-CuCl3 غير المنضم مع المرحلة المتنقلة وسيكون موجودا من 200 إلى 240 سم. لا يوجد 64Cu-CuCl 3 مجاني يمكن اكتشافهفي هذا الكروماتوجراف. (ج) مواصفات مراقبة جودة الجسم المضاد الموسوم إشعاعيا. الاختصارات: DOTA-NHS استر = 1،4،7،10-تترازاسيكلودوديكان-1،4،7،10-رباعي الخليك حمض أحادي-N-هيدروكسي سكسينيميد استر. ITLC / HPLC = كروماتوغرافيا طبقة رقيقة فورية / كروماتوغرافيا سائلة عالية الأداء ؛ MALDI/LC-MS = الامتزاز/التأين/الكروماتوغرافيا السائلة - قياس الطيف الكتلي بالليزر بمساعدة المصفوفة؛ CPM = التهم في الدقيقة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: صور فوتوغرافية توضح كيفية تأمين الفئران في سرير مطبوع ثلاثي الأبعاد داخل ماسح التصوير المقطعي بالإصدار البوزيتروني لتمكين تصوير عالي الجودة للحبل الشوكي والدماغ مع تقليل الحركة . (أ) سرير ماسح ضوئي ثلاثي الأبعاد مطبوع بأربعة فأرة (يعرف أيضا باسم "فندق الفأر") مزود بعناصر تسخين وأنابيب تخدير. (ب) الفئران المخدرة في وضع الاستلقاء لتحقيق أقصى قدر من استقامة العمود الفقري ؛ يتم تسجيل موضع السرير لكل ماوس. (ج) يتم لصق الفئران بإحكام على رأسها لتقليل الحركة في الدماغ وعبر البطن لتقليل الحركة الناتجة عن التنفس، دون التأثير على التنفس. ( د) وضع سرير الماوس داخل الماسح الضوئي وربطه بقاعدة المسح الضوئي. تم توصيل أنابيب التخدير من الماسح الضوئي إلى السرير وضبط الأيزوفلوران على 2٪. تمت مراقبة تنفس الماوس لضمان مستوى الأيزوفلوران المناسب قبل إغلاق باب الماسح الضوئي. اختصار: PET = التصوير المقطعي بالإصدار البوزيتروني. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
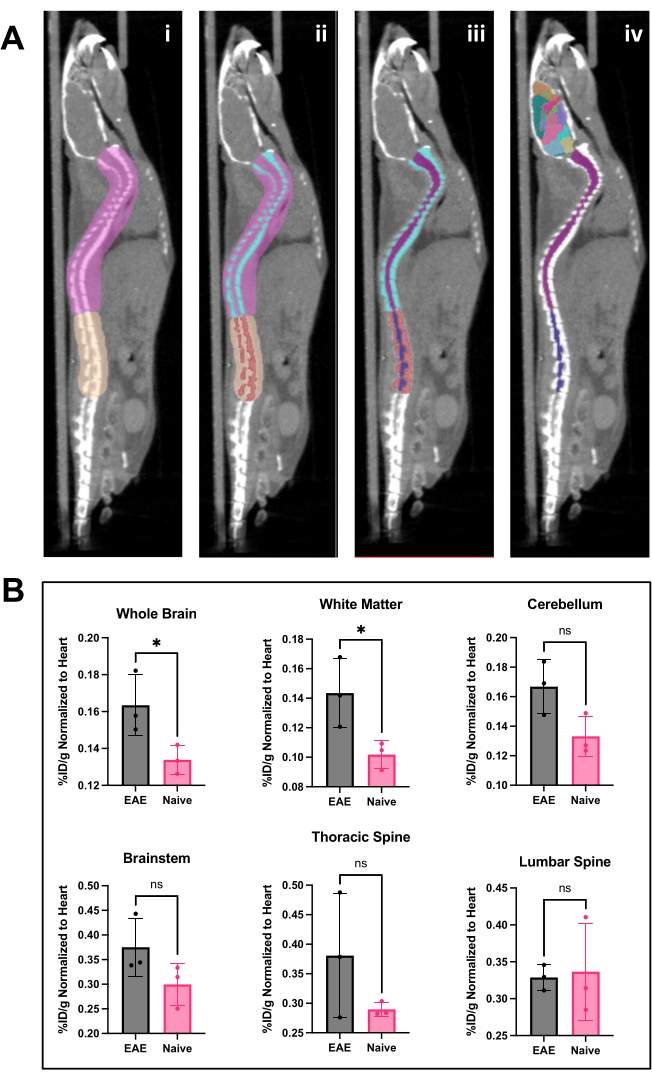
الشكل 4: صورة الحبل الشوكي وتحليل الدماغ والنتائج باستخدام برنامج تحليل التصوير المقطعي بالإصدار البوزيتروني . (أ) ط) عائد الاستثمار (الوردي والتان ) المرسوم على العمود الفقري لفصل الفقرات القطنية عن الفقرات الصدرية والعنقية وإعداد الصورة لعتبة أوتسو. ب ) تم تقسيم الفقرات الشوكية (الفيروزية والحمراء) باستخدام عتبة أوتسو. ج) ثم تم جعل الفقرات غير قابلة للتغيير في قائمة 3D ROI ، والحبل الشوكي مقسم إلى عائد استثمار عنق الرحم / الصدر (أرجواني ) وأسفل الظهر (البحرية). د) تمت إزالة عائد الاستثمار الفقري ، مع ترك عائد الاستثمار للحبل الشوكي وأطلس الدماغ التمثيلي مطبقا. (ب) تحليل تمثيلي لنتائج التصوير المقطعي بالإصدار البوزيتروني من مناطق مختلفة للجهاز العصبي المركزي ممثلة بالرقم ٪ ID / g الطبيعي لعائد الاستثمار للقلب داخل كل. كان الحصول على PET عبارة عن مسح ثابت لمدة 10 دقائق عبر التصوير المقطعي بالإصدار البوزيتروني / التصوير المقطعي المحوسب. تم قياس مناطق الدماغ كميا باستخدام نهج أطلس الدماغ شبه الآلي ، كما هو موضح في اللوحة أ. د) تظهر النتائج التمثيلية إما أهمية أو تتجه نحو زيادة كبيرة في ارتباط المقتفي في الدماغ والحبل الشوكي الصدري. الإحصائيات التي تم إجراؤها باستخدام اختبار t للطالب (*: p < 0.0332). الاختصارات: PET = التصوير المقطعي بالإصدار البوزيتروني. عائد الاستثمار = مناطق الاهتمام ؛ الجهاز العصبي المركزي = الجهاز العصبي المركزي. CT = التصوير المقطعي. ٪ ID / g = النسبة المئوية للجرعة المحقونة لكل جرام من الأنسجة ؛ EAE = التهاب الدماغ والنخاع المناعي الذاتي التجريبي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
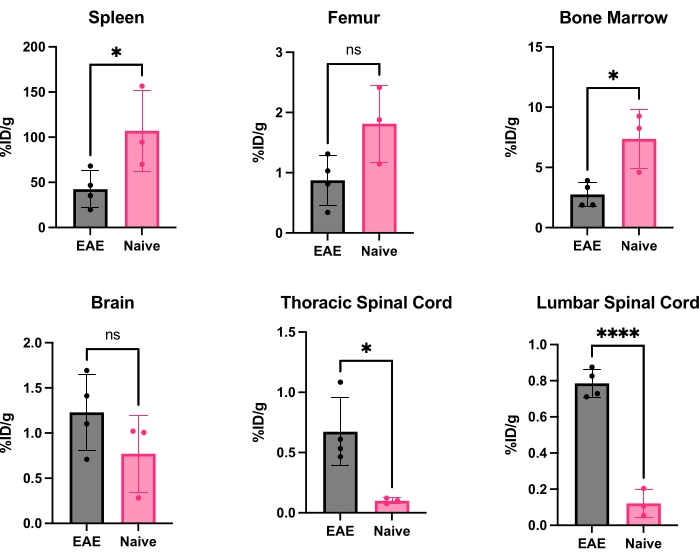
الشكل 5: التقدير الكمي التمثيلي لحساب غاما خارج الجسم الحي في أعضاء مختلفة في EAE والفئران الساذجة معبرا عنها بالرمز ٪ID/g. بعد فحص التصوير المقطعي بالإصدار البوزيتروني ، تم حقن الفئران ب PBS لإزالة المقتفي الإشعاعي الموجود في الدم ، إما حرا أو مرتبطا بخلايا CD19 + B المقيمة في الدم ، وسرعان ما تم تشريح الأعضاء ووزنها للحصول على وزن دقيق لكل عضو. ينخفض ارتباط التتبع بشكل كبير في الطحال ونخاع العظام في الفئران EAE مقارنة بالفئران الساذجة. لوحظ زيادة ارتباط المقتفي الإشعاعي في كل من أجزاء الحبل الشوكي القطني وعنق الرحم / الصدر لفئران EAE. لا يظهر الدماغ زيادة كبيرة في إشارة المقتفي الإشعاعي ، على الرغم من أنه يتجه نحو زيادة كبيرة. الإحصائيات التي تم إجراؤها باستخدام اختبار t للطالب (*: p < 0.0332 ؛ ****: p < 0.0001). الاختصارات: PET = التصوير المقطعي بالإصدار البوزيتروني. ٪ ID / g = النسبة المئوية للجرعة المحقونة لكل جرام من الأنسجة ؛ EAE = التهاب الدماغ والنخاع المناعي الذاتي التجريبي. PBS = محلول ملحي مخزن بالفوسفات. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
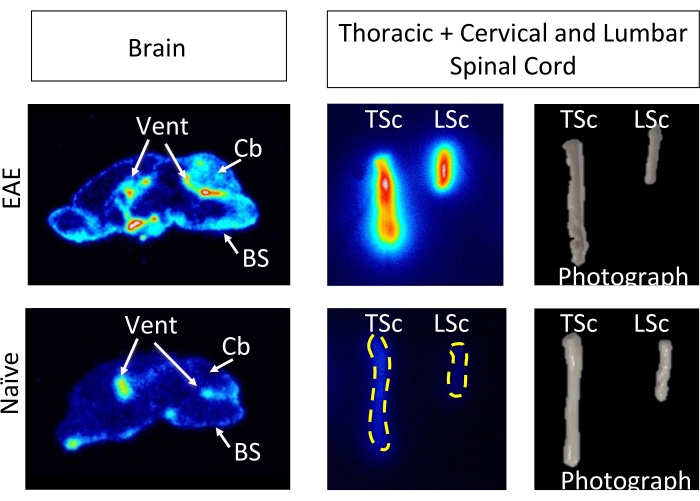
الشكل 6: صور ARG خارج الجسم الحي تصور 64Cu-DOTA-hCD19-mAb ملزمة في أقسام الدماغ السهمي والحبل الشوكي كله من EAE مقارنة بالفئران الساذجة. تم مسح أفلام تخزين الفوسفور الرقمية باستخدام جهاز تصوير الفوسفور بعد تعرضها لعينات الأنسجة المشعة لمدة 10 أنصاف عمر تقريبا (127 ساعة أو 5 أيام). تكشف الصور الناتجة عن إشارة أعلى بصريا في دماغ الفئران EAE مقارنة بأقسام الدماغ من الفئران الساذجة ، وهو أمر متوقع بسبب المناطق المعروفة باحتوائها على الخلايا البائية في هذا النموذج5. على وجه التحديد ، هناك زيادة في إشارة التتبع في جذع الدماغ والمخيخ والبطينين في أقسام دماغ الفأر EAE. تعكس هذه الزيادة في الإشارة لأقسام دماغ فأر EAE ما تم العثور عليه في القياس الكمي PET للدماغ بالكامل المفصل أعلاه. وبالمثل ، هناك زيادة في ارتباط المقتفي الإشعاعي في كل من قطاعات الحبل الشوكي العنقي / الصدري والقطني مقارنة بالحبال الشوكية الساذجة ، مما يعكس ما تم العثور عليه باستخدام حساب جاما خارج الجسم الحي. الاختصارات: PET = التصوير المقطعي بالإصدار البوزيتروني. EAE = التهاب الدماغ والنخاع المناعي الذاتي التجريبي. تنفيس = البطينين. Cb = المخيخ. BS = جذع الدماغ. TSc = الحبل الشوكي الصدري والعنقي مجتمعة ؛ LSc = الحبل الشوكي القطني. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الشكل التكميلي S1: تلطيخ أنسجة الجهاز العصبي المركزي لأنسجة دماغ الفأر الساذجة و EAE باستخدام CD45R / B220. لوحظت الخلايا البائية في جذع الدماغ والسحايا والمادة البيضاء لفئران EAE (n = 7 EAE ، n = 5 فئران ساذجة ، متوسط أربع شرائح لكل). هذا الرقم من 5. أشرطة المقياس = 5 مم (تكبير منخفض [1x]) في صور الدماغ السهمي ، 100 ميكرومتر (تكبير عالي [20x]) في جذع الدماغ والسحايا والمادة البيضاء المخيخية. الرجاء الضغط هنا لتنزيل هذا الملف.
Discussion
توضح هذه المقالة طريقة مبسطة لتصوير خلايا CD19+ B البشرية في نموذج ماوس من مرض التصلب العصبي المتعدد باستخدام CD19-PET. نظرا للعرض غير المتجانس لمرض التصلب العصبي المتعدد والاستجابات المختلفة للعلاجات ، يمكن أن تكون إدارته في العيادة صعبة وهناك حاجة ماسة إلى أساليب جديدة لاختيار العلاج ومراقبته. يمكن أن يكون التصوير المقطعي بالإصدار البوزيتروني بمثابة أداة قوية لمراقبة تطور المرض والاستجابة الفردية للعلاج المستنفد للخلايا البائية. بالإضافة إلى مرض التصلب العصبي المتعدد ، يمكن استخدام تصوير CD19-PET لمراقبة استنفاد الخلايا البائية بعد العلاج في أنواع فرعية من الأورام اللمفاوية وسرطان الدم أو غيرها من الأمراض بوساطة الخلايا البائية. يوضح هذا البروتوكول والبيانات التمثيلية فائدة تصوير الخلايا البائية في الأمراض العصبية.
لدراسة خلايا CD19 + B البشرية في سياق مرض التصلب العصبي المتعدد ، اخترنا نموذج MOG1-125 EAE المعتمد على الخلايا البائية7. على غرار نماذج EAE الأخرى ، يظهر هذا النموذج مع أعراض الشلل التدريجي وتسلل الخلايا المناعية إلى الجهاز العصبي المركزي. ومع ذلك ، فإن نموذج MOG1-125 فريد من نوعه من حيث أنه نموذج يحركه الخلايا البائية: تحتوي الفئران على أعداد متفاوتة من الخلايا البائية في الفضاء تحت العنكبوتية في السحايا وجذع الدماغ والحمة والبطينين. يمكن أن تنتشر هذه الخلايا الليمفاوية بشكل ضئيل في جميع أنحاء هذه المناطق و / أو تشكل هياكل تشبه الجريب ، والتي لوحظت أيضا في البشر المصابين بمرض التصلب العصبي المتعدد 8,9. بالإضافة إلى استخدام الفئران الساذجة كعناصر تحكم ، يمكن استخدام مجموعة تحريض فرويند المساعدة الكاملة (CFA) فقط (أي مستحلب تحريضي مطابق لما يعطى لفئران EAE بدون بروتين MOG). في نموذج الماوس EAE ، يكون حاجز الدم في الدماغ (BBB) مختلا ويسمح للكيانات الأكبر ، مثل الأجسام المضادة ، بالعبور. لن يرتبط المقتفي الإشعاعي CD19-mAb ويبقى في الجهاز العصبي المركزي إلا إذا كانت الخلايا البائية موجودة. سوف يعود المقتفي إلى حوض الدم إذا لم تكن الخلايا البائية موجودة. لقد أثبتنا ذلك باستخدام عد جاما والتصوير الشعاعي الذاتي خارج الجسم الحي لأنسجة الجهاز العصبي المركزي عن طريق التعطير قبل قياس مستويات النشاط الإشعاعي في الأنسجة. لقد أثبتنا ذلك أيضا في منشورات سابقة أبلغت عن استخدام المقتفيات الإشعاعية القائمة على mAb (أي مناهج التصوير المناعي PET) للكشف عن الخلايا البائية في الجهاز العصبي المركزي 1,2.
تم استخدام جهاز إزالة مخلب DOTA منذ استخدامه في التصوير السريري بالإصدار البوزيتروني مع الببتيدات والأجسام المضادة الموسومة بالنحاس 64 ، ونهدف إلى ترجمة hCD19-mAb للتصوير السريري لمرضى التصلب المتعدد. DOTA لديها تقارب ربط كاف للنحاس 64 في الجسم الحي. الاستقرار في الجسم الحي مهم جدا لأن 64Cu الحر يذهب إلى الكبد ويمكن أن يحجب إشارة المقتفي الإشعاعي المرتبط. وبالتالي ، من المهم قياس الإشارة في الكبد لحساب الإشارة النسبية مقارنة بالأعضاء الأخرى. عادة ما تؤخذ العضلات كنسيج تحكم ، ولكن في حالة EAE ، يمكن أن يكون هناك التهاب موجود في العضلات. عمر النصف البالغ 64نحاس هو 12.7 ساعة ، مما يوفر متسعا من الوقت ل DOTA-hCD19-mAb للارتباط بهدفه مع ضمان إمكانية قياس الإشارة بواسطة PET. عند تحضير الاقتران ، يجب إجراء تفاعلات اختبار صغيرة الحجم (75-125 ميكروغرام) لتحديد كمية DOTA المراد إضافتها إلى mAb لإنتاج نسبة DOTA / mAb المطلوبة (على سبيل المثال ، قد يؤدي تفاعل 6-10 أضعاف DOTA-NHS-ester الزائد لكل مول mAb إلى توفير مرافق 1-2 DOTA / mAb). يؤثر وقت التفاعل ودرجة الحرارة (على سبيل المثال ، 2-4 ساعات أو بين عشية وضحاها عند 4 درجات مئوية أو درجة حرارة الغرفة) أيضا على نسبة DOTA / mAb ويجب تحسينها. يمكن إجراء معايرة بالنحاس غير المشع لحساب عدد DOTAs لكل mAb ؛ ومع ذلك ، نوصي بإجراء MALDI-MS و / أو LC-MS للحصول على نتائج أكثر موثوقية ودقة.
نسبة DOTA / mAb المحسوبة هي متوسط قيمة لعينة معينة ومن المتوقع حدوث بعض الاختلاف. بالنسبة ل MALDI ، يتم أخذ عدة طلقات لكل عينة من أجل mAbs المترافق وغير المقترن. ثم نحسب نسبة الاقتران إلى غير المقترن لتحديد متوسط عدد DOTA / mAb. تعد نسبة DOTA / mAb مهمة لأن الكثير من المخلبات ستعطل ارتباط الأجسام المضادة وسيؤدي القليل جدا منها إلى وضع علامات إشعاعية غير متسقة وإشارة منخفضة. يجب أن تكون النسبة قريبة جدا بين دفعات المرافق للحفاظ على كثافة إشارة متسقة وحركية ملزمة ؛ من الناحية المثالية ، يجب استخدام نفس الدفعة من المرافق لجميع التجارب في دراسة معينة. من التقنيات الواعدة لتقليل التأثيرات المحتملة على النشاط المناعي بسبب الاقتران المفرط المحتمل استخدام الاقتران الخاص بالموقع10 حيث يكون اقتران المخلب انتقائيا للموقع على جليكان السلسلة الثقيلة للجسم المضاد ، مما يضمن إضافة 1 مخلب لكل mAb.
يجب تحسين ظروف تفاعل وضع العلامات الإشعاعية لضمان أعلى كفاءة وإنتاجية لوضع العلامات لأن الاختلافات في الأجسام المضادة ونسبة DOTA / mAb والنشاط المولي 64Cu ، من بين حالات أخرى ، ستؤثر على وضع العلامات الراديوية. قد يسمح استخدام النسبة المثلى 64Cu إلى mAb باستخدام المقتفي الإشعاعي دون تنقية ، مما يقلل من الوقت اللازم لوضع العلامات الإشعاعية وفقدانها بسبب عمود تدفق الجاذبية والاضمحلال الإشعاعي. يمكن أيضا تحقيق نشاط مولي ثابت وموثوق عند استخدام نفس النسبة المترافقة 64Cu إلى mAb ، وهو أمر مهم بشكل خاص عند مقارنة النتائج عبر مجموعات متعددة من الفئران أو دراسات التصوير. ويمكن أيضا تعديل شروط مركز القانون الدولي ليناسب كل مستخدم. إذا كان التنقية ضروريا ، فيجب حفظ القسمة إما لقياس الطيف الضوئي HPLC و / أو الأشعة المرئية / فوق البنفسجية بحيث يمكن حساب النشاط المولي.
من المهم ملاحظة أن استخدام الأجسام المضادة ذات العلامات الإشعاعية للتصوير قد يكون أمرا صعبا. من الضروري أن يكون الجسم المضاد المستخدم في المقتفي الإشعاعي خاملا بيولوجيا حتى لا يكون له تأثير فسيولوجي. علاوة على ذلك ، نظرا لأن الأجسام المضادة لها إقامة دم طويلة ، يجب على المرء الانتظار لفترة كافية للدوران والربط والخلوص ل mAb معين لضمان إشارة مناسبة إلى الخلفية دون المساس بجودة الصورة. عادة ما يكون الانتظار لمدة 20-48 ساعة للحصول على 64mAb المسمى بالنحاس كافيا ولكن يجب على المرء أن يصور في 2 ، 4 ، 6 ، 12 ، 24 ، 48 ساعة بعد الحقن عند تقييم متتبع mAb PET جديد لتحديد أفضل نقطة زمنية للتصوير في نموذج قوارض معين. وينطبق الشيء نفسه على الحصول على صور ARG بأعلى نسبة إشارة إلى الخلفية. تم التقاط الصور التمثيلية في هذا البروتوكول في 18-20 ساعة بعد الحقن ، على الرغم من أنه يمكن استخدام نقاط زمنية أخرى اعتمادا على النظير المشع المستخدم. ستؤدي الأجسام المضادة المختلفة المرتبطة بحواتم مختلفة من CD19 إلى نتائج متفاوتة ويجب توصيفها بدقة.
عند تحليل إشارة الحبل الشوكي ، من المهم وضع الفئران على ظهورها في سرير المسح لتقليل الحركة الناتجة عن التنفس. بالإضافة إلى ذلك ، يمكن أن يساعد وضع الاستلقاء في تقويم العمود الفقري في الفئران التي زادت من انحناء العمود الفقري بسبب تطور مرض EAE. هناك جانب مهم آخر يجب مراعاته عند استهداف اكتشاف الإشارة في العمود الفقري والحبل الشوكي وهو تجنب حقن MOG1-125 على الجناح لأن مواقع الحقن يمكن أن تربط المقتفي بسبب الاستجابة المناعية المرتبطة في تلك المناطق. يمكن أن يتداخل القرب من موقع الحقن مع تحليل الحبل الشوكي. وبالتالي ، فإن الحقن في الصدر هي الأفضل للتطبيق الموصوف هنا.
تقنيات تحليل الصور المستخدمة خاصة بتصوير الجهاز العصبي المركزي. توفر أداة أطلس الدماغ داخل برنامج تحليل الصور نتائج قابلة للتكرار وموثوقة طالما أن تسجيل التصوير المقطعي بالإصدار البوزيتروني والتصوير المقطعي المحوسب دقيق. إن استخدام أطلس الدماغ 3D شبه الآلي وتعديله ليناسب جمجمة كل فأر يسمح بعائد استثمار ثابت بين الحيوانات. نظرا لعدم وجود نهج آلي أو شبه آلي حاليا لتحليل الإشارة في الحبل الشوكي ، يجب رسم عائد الاستثمار اليدوي. والجدير بالذكر أنه عند قياس خلايا CD19 + B (أو أي نوع من الخلايا موجود في كل من نخاع العظم والحبل الشوكي) ، من الأهمية بمكان القضاء على الإشارة الناشئة عن العمود الفقري ونخاع العظم قدر الإمكان. والسبب في ذلك هو أنه من المعروف أن الفئران الساذجة تحتوي على المزيد من خلايا CD19 + B في نخاع العظام أكثر من الفئران EAE ، حيث تغادر الخلايا البائية المحيط للتسلل إلى الجهاز العصبي المركزي 5,11. يمكن لإشارة نخاع العظم هذه أن تحجب الإشارة الحقيقية في الحبل الشوكي.
لتحديد إشارة الحبل الشوكي الحقيقية مع تقليل مساهمة الإشارة من العمود الفقري ونخاع العظم ، يمكن استخدام عتبة Otsu لصورة التصوير المقطعي المحوسب لتحقيق عائد استثمار غير قابل للتغيير للعمود الفقري. يمكن بعد ذلك رسم عائد استثمار منفصل للحبل الشوكي بسهولة داخل العمود الفقري. يمكن أيضا تطبيق نفس التقنية لقياس نخاع العظم في عظم الفخذ. هذه طريقة مفيدة للغاية لاكتساب نظرة ثاقبة حول ارتباط المقتفي في الحبل الشوكي. ومع ذلك ، نظرا للدقة المكانية المنخفضة نسبيا للتصوير المقطعي بالإصدار البوزيتروني والقضايا المتعلقة بتأثير الحجم الجزئي عند مسح المناطق التشريحية الصغيرة للفئران ، فإن استخدام تقنيات تأكيدية إضافية خارج الجسم الحي (على سبيل المثال ، عد جاما ، ARG) يتيح التحقق من صحة ارتباط المقتفي الإشعاعي في الحبل الشوكي دون وجود دم أو سائل نخاعي أو إشارة غير مباشرة من العمود الفقري.
تميل الإشارة في الحبل الشوكي العنقي / الصدري إلى الاختلاف في فئران EAE اعتمادا على شدة المرض وعدد الخلايا البائية التي تتسلل أثناء الاستجابة المناعية التكيفية. هذا الاختلاف في عدد الخلايا البائية التي تتسلل ، وكذلك الكمية الصغيرة من الخلايا البائية في الجهاز العصبي المركزي مقارنة بتلك الموجودة في نخاع عظم الحوض / العمود الفقري للفئران الساذجة ، يمكن أن يجعل القياس الكمي لأنسجة الحبل الشوكي في الجسم الحي أمرا صعبا في الفئران. بالنظر إلى الدقة المكانية للتصوير المقطعي بالإصدار البوزيتروني في تصوير الحيوانات الصغيرة ، يمكن أن تمتد الإشارة من نخاع العظم إلى إشارة الحبل الشوكي. يساعد التوزيع الحيوي خارج الجسم الحي والتصوير الشعاعي الذاتي المنجز هنا في التحقق من صحة إشارة PET للفقرات مقابل أنسجة الحبل الشوكي. يتم تسطير الفئران قبل التشريح لإزالة أي مقتفي غير مقيد في تجمع الدم بحيث تعكس نتائج حساب جاما والتصوير الشعاعي الذاتي المقتفي المرتبط بالفعل في كل عضو بدلا من المقتفي الموجود في تجمع الدم في هذا العضو.
تنتشر المقتفيات الإشعاعية عبر الدم ، ومع مقتفيات الأجسام المضادة ، على وجه التحديد ، غالبا ما يكون هناك مقتفي إشعاعي غير مرتبط موجود في الدم لأسابيع بعد الحقن الأولي. نظرا لأننا نقوم بتصوير الدماغ والحبل الشوكي ، اللذين يحتويان على العديد من الأوعية الدموية ، فمن المهم أن نفهم أي جزء من الإشارة يرجع حقا إلى ارتباط التتبع في الدماغ / الأنسجة ذات الأهمية مقابل ذلك الموجود في تجمع الدم. لذلك من الضروري تقسيم إشارة الدماغ عن طريق الإشارة في تجمع القلب / الدم. في الإعداد السريري ، يمكن استخدام نفس تقنيات تحليل الصور الخاصة بعتبة Otsu للفقرات وعائد الاستثمار لأنسجة الحبل الشوكي للقياس الكمي. بالنظر إلى أحجام الأنسجة الأكبر في البشر مقارنة بالفئران ، يجب أن يكون هناك تأثير أقل بكثير من تأثيرات الحجم الجزئي ، مما يؤدي إلى تحسين الدقة وإلغاء الحاجة إلى تقنيات خارج الجسم الحي لتأكيد النتائج في الجسم الحي . سيسمح استخدام التصوير المقطعي بالإصدار البوزيتروني في العيادة للأطباء بتخصيص العلاج لكل مريض اعتمادا على عبء الخلايا البائية الفردية.
ARG مفيد بشكل خاص للحصول على صور عالية الدقة لتمكين تحديد أكثر دقة للموقع المكاني لربط التتبع في مناطق صغيرة مثل جذع الدماغ والمخيخ. يمكن حفظ نفس الأقسام و / أو الأقسام المجاورة للبقع المناعية الكيميائية لتأكيد وجود الخلايا البائية. لقد قمنا سابقا بتلوين أنسجة الجهاز العصبي المركزي ب CD45R / B220 (الشكل التكميلي S1) لربط عدد الخلايا البائية بإشارة PET و ARG 5,9. يمكن بعد ذلك مقارنة التلوين مكانيا بنتائج ARG للتحقق من أن إشارة المقتفي الإشعاعي تتطابق مع نمط التلطيخ. يمكن أن تكون الخلايا البائية موجودة في مجموعات أو منتشرة في جميع أنحاء جذع الدماغ. حساسية التصوير المقطعي بالإصدار البوزيتروني عالية بما يكفي لقياس الإشارة ، وهو أمر مشجع للترجمة السريرية. بالنسبة للحبل الشوكي ARG ، تضمن إزالة الحبل الشوكي من الفقرات أن الإشارة المقاسة ناتجة عن ارتباط التتبع في أنسجة الحبل الشوكي بدلا من نخاع العظم و / أو الدم ، والذي يمكن أن يحجب صور PET بسبب تأثيرات الحجم الجزئي.
على غرار ARG ، يتيح عد جاما خارج الجسم الحي تحديد كمية الإشارة المشعة في الأعضاء الفردية. بالنسبة لهذه التقنية الخاصة ، من المهم قياس الوزن الرطب للأنسجة والتأكد من أنها في الجزء السفلي من الأنابيب الخاصة بها قبل وضع الأنابيب في عداد جاما. يجب تسمية الأنابيب برقم الماوس والأنسجة ، بحيث يتم استخدام الأنبوب الصحيح ؛ ثم يتم وزن الأنبوب على ميزان معاير ويتم إدخال الأعضاء إلى أقرب عشر ميكروغرام (0.0001 ملغ). بعض الأنسجة صغيرة للغاية والفرق في كتلة الأنبوب قبل وبعد سيكون في حدود 0.0001 ملغ. يجب وزن الأنسجة مباشرة بعد التشريح لمنع فقدان الرطوبة ، مما يؤدي إلى انخفاض الكتلة. بعد الوزن ، يجب ملء أنابيب الدماغ والحبل الشوكي ب PBS لمنع الجفاف قبل تجميد هذه الأنسجة ل ARG.
Disclosures
تم توفير الجسم المضاد CD19 بواسطة Horizon Therapeutics.
Acknowledgements
نحن ممتنون للدعم المقدم من مرفق تصوير الحيوانات الصغيرة SCi3 في ستانفورد والدكتور فريزغي هابتي لمساعدته الفنية في التصوير المقطعي بالإصدار البوزيتروني / التصوير المقطعي المحوسب. يتم تنفيذ LC-MS من قبل الموظفين الأساسيين في المرفق الأساسي لقياس الطيف الكتلي بجامعة ستانفورد (SUMS) ونحن نقدر الموظفين لتقديم هذه الخدمة. نشكر Horizon Therapeutics على التفضل بتقديم hCD19-mAb وجودي كارنيل على وجه الخصوص على توجيهها الفني ودعمها. تم تمويل هذا العمل من قبل NINDS NINDS (1 R01 NS114220-01A1).
Materials
| Name | Company | Catalog Number | Comments |
| 0.5 mL 50 kDa MWCO Centrifugal filter | MiliporeSigma | UFC505008 | centrifugal filter |
| 64Cu-CuCl3 | Washington University in St. Louis; University of Wisonsin, Madison; or another vendor | ||
| AR-2000 Radio-TLC Imaging Scanner | Eckert & Ziegler | AR-2000 | |
| Autoradiography cassette | Cole Palmer | EW-21700-34 | Aluminum, 8" x 10" |
| Autoradiography film | GE Life Sciences | 28-9564-78 | Storage Phosphor Screen BAS-IP SR 2025 E Super Resolution, 20 x 25 cm, screen only |
| Butterfly Needle Catheter | SAI Infusion Technologies | BLF-24 | |
| DOTA-NHS-ester | Macrocyclics | B-280 | |
| EAE Induction Kit | Hooke Laboratories | EK-2160 | |
| Geiger Counter | Ludlum | 14C | |
| GNEXT PET/CT Scanner | Sofie | GNEXT | |
| Hidex Automatic Gamma Counter | Hidex | AMG | |
| HPLC Column | Phenomenex | 00H-2146-K0 | 5 μm SEC-s3000 400 Å, 300 x 7.8 mm |
| Illustra NAP-5 column | Cytiva | 17085301 | DNA gravity column |
| Image J | NIH | ARG analysis software | |
| Low Protein Binding Collection Tubes (1.5 mL) | Thermo Scientific | PI90410 | |
| NanoDrop Lite Spectrophotometer | Thermo Scientific | 840281400 | UV-Vis micro/nano-spectrophotometer |
| PCR tubes 0.2 mL, for DNA grade | Eppendorf | 30124707 | |
| Typhoon phosphor imager 9410 | GE Healthcare | 8149-30-9410 | |
| VivoQuant | Invicro | Version 4 Patch 3 | PET Analysis Software; must purchase brain atlas add-on |
| Zeba Spin Desalting Columns, 7K MWCO, 0.5 mL | Thermo Scientific | PI89882 | Desalting column |
References
- Dobson, R., Giovannoni, G. Multiple sclerosis - a review. European Journal of Neurology. 26 (1), 27-40 (2019).
- Karussis, D. The diagnosis of multiple sclerosis and the various related demyelinating syndromes: A critical review. Journal of Autoimmunity. 48-49, 134-142 (2014).
- Hauser, S. L., et al. B-cell depletion with Rituximab in relapsing-remitting multiple sclerosis. The New England Journal of Medicine. 358 (7), 676-688 (2008).
- Chen, D., Gallagher, S., Monson, N. L., Herbst, R., Wang, Y. Inebilizumab, a B cell-depleting anti-CD19 antibody for the treatment of autoimmune neurological diseases: Insights from preclinical studies. Journal of Clinical Medicine. 5 (12), 107(2016).
- Stevens, M. Y., et al. Development of a CD19 PET tracer for detecting B cells in a mouse model of multiple sclerosis. Journal of Neuroinflammation. 17 (1), 275(2020).
- Chaney, A. M., Johnson, E. M., Cropper, H. C., James, M. L. PET imaging of neuroinflammation using [11C]DPA-713 in a mouse model of ischemic stroke. Journal of Visualized Experiments. (136), e57243(2018).
- Lyons, J. -A., Ramsbottom, M. J., Cross, A. H. Critical role of antigen-specific antibody in experimental autoimmune encephalomyelitis induced by recombinant myelin oligodendrocyte glycoprotein. European Journal of Immunology. 32 (7), 1905-1913 (2002).
- Haugen, M., Frederiksen, J. L., Degn, M. B. cell follicle-like structures in multiple sclerosis-With focus on the role of B cell activating factor. Journal of Neuroimmunology. 273 (1-2), 1-7 (2014).
- James, M. L., et al. Imaging B cells in a mouse model of multiple sclerosis using 64Cu-Rituximab PET. Journal of Nuclear Medicine. 58 (11), 1845-1851 (2017).
- Zeglis, B. M., et al. An enzyme-mediated methodology for the site-specific radiolabeling of antibodies based on catalyst-free click chemistry. Bioconjugate Chemistry. 24 (6), 1057-1067 (2013).
- Lyons, J. -A., et al. B cells are critical to induction of experimental allergic encephalomyelitis by protein but not by a short encephalitogenic peptide. European Journal of Immunology. 29 (11), 3432-3439 (1999).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved