Method Article
استخدام طرق طفيفة التوغل لتقييم استخدام الوقود وإيقاعات الساعة البيولوجية لدى كبار السن
In This Article
Summary
يتم تقديم بروتوكول جديد طفيف التوغل لتقييم التأثير التآزري لاستخدام الوقود وإيقاعات الساعة البيولوجية على الأفراد المسنين ، باستخدام خلايا الدم المحيطية أحادية النواة.
Abstract
ترتبط الشيخوخة بتغيرات فسيولوجية متعددة تساهم بشكل تآزري ومستقل في الإعاقة الجسدية وخطر الإصابة بالأمراض المزمنة. على الرغم من أن مسببات الإعاقة الجسدية المرتبطة بالعمر معقدة ومتعددة العوامل ، يبدو أن الانخفاض في وظيفة الميتوكوندريا يتزامن مع تطور التدهور الوظيفي لدى العديد من كبار السن. لا يزال سبب انخفاض وظيفة الميتوكوندريا مع الشيخوخة بعيد المنال ، لكن العلم الناشئ يشير إلى أن كلا من استقلاب الوقود وإيقاعات الساعة البيولوجية يمكن أن تؤثر على وظيفة الميتوكوندريا.
أثبتت الدراسات الحديثة أن إيقاعات الساعة البيولوجية تصبح مضطربة مع الشيخوخة ، وأن إيقاعات الساعة البيولوجية المعطلة لها عواقب مرضية تؤثر على وظيفة الميتوكوندريا وتتداخل مع العديد من الأمراض المزمنة المرتبطة بالعمر. الطرق الكمية الحالية للتقييم المباشر لوظيفة الميتوكوندريا غازية وتتطلب عادة خزعة عضلية ، والتي يمكن أن تشكل صعوبات في تجنيد المشاركين والالتزام بالدراسة ، بالنظر إلى المستويات المتصورة للألم والمخاطر المحتملة. وبالتالي ، تم تكييف بروتوكول مبتكر وغير جراحي نسبيا لتقييم التغيرات في وظيفة الميتوكوندريا على المستوى الخلوي وأنماط الساعة البيولوجية لدى كبار السن. على وجه التحديد ، يتم استخدام محلل التدفق الأيضي في الوقت الفعلي لتقييم وظيفة الطاقة الحيوية للميتوكوندريا لخلايا الدم البيضاء في ظل توافر الركيزة التفاضلية.
يتم أيضا تحليل التعبير عن جينات الساعة البيولوجية في خلايا الدم البيضاء للارتباط المتبادل مع الطاقة الحيوية للميتوكوندريا ونتائج إيقاع الساعة البيولوجية. يعتقد أن هذه الأساليب المنهجية المبتكرة ستساعد التجارب السريرية المستقبلية من خلال توفير طرق طفيفة التوغل لدراسة تفضيل ركيزة الميتوكوندريا وإيقاعات الساعة البيولوجية لدى كبار السن.
Introduction
أدت التطورات في القرن الماضي إلى زيادة متوسط العمر المتوقع وعدد السكان المسنين. بالنظر إلى المستقبل ، من المتوقع أن تزيد النسبة المئوية للبالغين الذين تبلغ أعمارهم 65 عاما فما فوق بنسبة 5٪ من عام 2020 إلى عام 2050 في الولايات المتحدة1. هذه الزيادة في متوسط العمر المتوقع لا تعني زيادة في الفترة الصحية - فترة الحياة المرتبطة بالأداء المستقل. الحقيقة هي أن الشيخوخة مصحوبة بتغيرات بيولوجية لا حصر لها تؤثر على التمثيل الغذائي الخلوي وعلم وظائف الأعضاء ، مما ينتج عنه انخفاض تدريجي في الأداء المعرفي والجسدي2،3. مع استمرار زيادة متوسط العمر المتوقع للإنسان ، هناك حاجة أكبر للحفاظ على القدرة الوظيفية والاستقلالية مع سن4 سنوات.
من المعروف منذ فترة طويلة أن التدهور في الوظيفة البدنية والاستقلال مع تقدم العمر متعدد العوامل ، على الرغم من أنه يرتبط في كثير من الأحيان بظهور الأمراض المزمنة والأحداث التحريضية الحادة5. على العكس من ذلك ، فقد ثبت أن هذا الانخفاضات في الأداء البدني وخصائص العضلات مرتبطة بتطور الإعاقة مع تقدم العمر مع عدم وجود صلة واضحة بمرض واحد6. مع الصعوبات في معرفة المسببات الدقيقة للأمراض المزمنة والإعاقة الجسدية ، يعتقد أن ضعف وظيفة الميتوكوندريا يتزامن مع ظهور وتطور المرض المزمن وفقدان الوظيفة البدنية لدى البالغين المسنين7،8.
توفر الميتوكوندريا غالبية الأدينوسين ثلاثي الفوسفات (ATP) ، وهو ضروري للعديد من العملياتالخلوية 9. تعتمد الأنسجة شديدة الأكسدة على الميتوكوندريا لإنتاج الطاقة الكافية. مع الشيخوخة والقدرة التأكسدية وانخفاض تخليق ATP في الميتوكوندريا. يرجع هذا الانخفاض جزئيا إلى الضرر التأكسدي للحمض النووي للميتوكوندريا (mtDNA) ، مما يؤدي إلى تراكم تدريجي لطفرات mtDNA وحذفها10. يتسبب تراكم طفرات mtDNA وحذفها في انخفاض تكوين بروتينات سلسلة نقل الإلكترون الوظيفية ، مما يتسبب في انخفاض قدرة الخلايا على إنتاج ATP. يكون الانخفاض المرتبط بالعمر في وظيفة الميتوكوندريا أكثر وضوحا في الأنسجة عالية الأكسدة ، مثل القلب والعضلات الهيكلية11. أظهرت الدراسات أن الميتوكوندريا العضلية المعدة في عينات الفئران الأكبر سنا تظهر انخفاضا بنسبة 50٪ تقريبا في إنتاج ATP ومحتواه مقارنة بالعينات الأصغرسنا 12. علاوة على ذلك ، فقد ثبت أن قدرة إنتاج ATP للميتوكوندريا في العضلات الهيكلية البشرية تنخفض بحوالي 8٪ لكل عقد من الحياة13. تشير هذه النتائج إلى أن الانخفاضات المرتبطة بالعمر في وظيفة الميتوكوندريا قد تساهم في انخفاض إنتاج الطاقة في الكائنات الحية.
يعتقد أن المنظم الرئيسي لنشاط الميتوكوندريا هو المنشط المشترك لمستقبلات التكاثر البيروكسيسوم γ(PPARγ) -1 (PGC-1α) 14. يؤدي تدهور نشاط PGC-1α أو انخفاض وفرته إلى انخفاض النشاط التأكسدي للميتوكوندريا ، وبالتالي ضعف إنتاج الطاقة. علاوة على ذلك ، قد يؤثر انخفاض جودة الميتوكوندريا على جودة عضلات الهيكل العظمي وبالتالي يؤدي إلى تطور أو تفاقم ساركوبينيا ، ودينامبيني ، وانخفاض القدرة الوظيفية15،16. تشير الأدلة على الانخفاض المتزامن المرتبط بالعمر في وظيفة الميتوكوندريا وجودة العضلات الهيكلية إلى وجود صلة بين ضعف الميتوكوندريا والتسبب في التدهور الوظيفي17. في الآونة الأخيرة ، تم تأكيد ذلك في كبار السن الذين يعيشون في المجتمع الوظيفي ، مما يدل على أن الانخفاضات في استقلاب الميتوكوندريا في عضلات الهيكل العظمي تتنبأ بانخفاض الحركة لدى هذه الفئة من السكان18. على الرغم من أن الآلية الدقيقة التي تؤدي إلى تدهور الميتوكوندريا مع تقدم العمر غير واضحة ، إلا أن الأدلة الحديثة سلطت الضوء على التفاعل المتبادل بين الساعة البيولوجية ووظيفة الميتوكوندريا ، مع عواقب على استخدام وقود الميتوكوندريا والتكوين الحيوي19.
استخدام الوقود
يبدو أن وظيفة الميتوكوندريا تتأثر بعملية التمثيل الغذائي للوقود ونوع الوقود المستخدم على المستوى الخلوي في أنسجة العضلات الهيكلية11. خلال فترات استنفاد الوقود ، وتحديدا استنفاد الكربوهيدرات لدى البشر ، يتغير تفضيل الوقود لإنتاج الطاقة (الميتوكوندريا). عند مستويات الجلوكوز المنخفضة ، يتحول تفضيل الوقود بعيدا عن الجلوكوز إلى الأحماض الدهنية وأجسام الكيتون المشتقة من الحمض. يتميز هذا التبديل الأيضي بتنظيم عملية التمثيل الغذائي للدهون في الخلايا الشحمية متبوعا بزيادة إطلاق الكيتونات في الدم4. يبدو أن التحول في استخدام الوقود من الجلوكوز إلى الكيتونات مع نظام غذائي الكيتون له تأثير مفيد على إنتاج أنواع الأكسجين التفاعلية للميتوكوندريا ، والدفاع المضاد للأكسدة ، وتخليق ATP ، والتكوينالحيوي 20.
يحدث التحول الأيضي من الكربوهيدرات إلى التمثيل الغذائي للدهون في فترات انخفاض توافر المغذيات البيئية وعندما يتم استنفاد مخازن الجليكوجين. عند بدء هذا التبديل ، يتم تقسيم الدهون الثلاثية المخزنة إلى جلسرين ، وهي ركيزة لاستحداث السكر ، والأحماض الدهنية الحرة ، والتي يتم نقلها إلى الكبد لتتأكسد عن طريق أكسدة β إلى أنزيم الأسيتيل أ (أسيتيل CoA). يتم تصنيع أجسام الكيتون ، بشكل رئيسي في الكبد ، عن طريق تكثيف من خطوتين لثلاثة جزيئات أسيتيل CoA إلى β-hydroxy-β-methylglutaryl-CoA ، والتي تتم معالجتها بعد ذلك في أجسام الكيتون ، بما في ذلك أسيتو أسيتات و 3-βeta hydroxybutyrate21. يتم توزيع أجسام الكيتون هذه على الأنسجة في جميع أنحاء الجسم ، مع حدوث أعلى استهلاك في القلب والدماغ والعضلات الهيكلية21. مع تقدم العمر ، تضعف أكسدة الأحماض الدهنية في الميتوكوندريا ، مما يؤثر على مفتاح التمثيل الغذائي22. وقد اقترح أن الضعف في استخدام وقود الميتوكوندريا يؤدي إلى مزيد من الخلل الوظيفي في الميتوكوندريا ، والذي بدوره يساهم في الأمراض المرتبطة بالعمر والتدهور الوظيفي23.
تمت دراسة التغييرات في استهلاك الأكسجين في الميتوكوندريا لخلايا الدم المحيطية أحادية النواة (PBMCs) لتقييم الأنماط المرتبطة بالخلل الوظيفي والأوعية الدموية. أجرى هارتمان وآخرون دراسة تهدف إلى تحديد العلاقة بين استهلاك الأكسجين والتمدد بوساطة متنوعة ، والتي وجد أنها تشير إلى وجود صلة بين الخلل الوظيفي في الميتوكوندريا وخلل خلايا العضلات الملساء الوعائية24. فيما يتعلق بالأعضاء الأخرى ، تم ربط PBMCs بالأداء المعرفي والدماغي الأعلى ، على النحو الذي يحدده قياس التنفس25. وبالتالي ، يمكن أن تكون الطاقة الحيوية PBMC وقدرة التنفس بمثابة مؤشرات حيوية محتملة لتقييم القدرة الوظيفية للأعضاء أو الأنسجة في جميع أنحاء الجسم.
إيقاع الساعة البيولوجية
عامل مهم آخر يؤثر على صحة الميتوكوندريا هو إيقاع الساعة البيولوجية. إيقاعات الساعة البيولوجية هي ~ 24 ساعة تذبذبات في السلوك وعلم وظائف الأعضاء تحدث في غياب الإشارات البيئية26. تعمل هذه الإيقاعات بطريقة تنبؤية لدعم توازن النظام والأنسجة. الآلية التي تكمن وراء إيقاعات الساعة البيولوجية هي حلقة تغذية مرتدة للنسخ والترجمة تسمى الساعة البيولوجية27. لقد ثبت على مدى السنوات ال 15 الماضية أن آلية الساعة البيولوجية موجودة في جميع الخلايا تقريبا في جميع أنحاء الجسم28. بالإضافة إلى الحفاظ على الوقت ، تساهم آلية الساعة الجزيئية أيضا في برنامج يومي للتعبير الجيني ، يشار إليه باسم إخراج الساعة البيولوجية29. جينات إخراج الساعة فريدة لكل نوع من أنواع الأنسجة وترتبط وظيفيا بالمسارات المهمة لعملية التمثيل الغذائي للخلايا ، والالتهام الذاتي ، والإصلاح ، والتوازن. أظهرت الأدلة الحديثة أن صحة الميتوكوندريا تعتمد على وظيفة الساعة البيولوجية وتؤثر على وظيفة الميتوكوندريا ، بما في ذلك التكوين الحيوي للميتوكوندريا ، واستخدام الوقود ، والميتوفاجي30.
أظهرت الأدلة الناشئة في كل من الدراسات قبل السريرية والسريرية أنه طوال الشيخوخة ، هناك اضطرابات في إيقاعات الساعةالبيولوجية 31. وتشمل هذه الاضطرابات في دورات النوم والاستيقاظ الطبيعية ، وانخفاض السعة في إيقاعات درجة حرارة الجسم الأساسية ، وتأخر القدرة على التكيف مع التحولات في المرحلة31. إحدى الدراسات ، على سبيل المثال ، تحدت نظام الساعة البيولوجية للفئران البالغة والكبيرة (20+ شهرا) عن طريق تغيير جدول الضوء بمقدار 6 ساعات. وجد أن الفئران القديمة استغرقت وقتا أطول لإعادة تدريب أنماط نشاطها على جدول الضوءالجديد 32. تمشيا مع التغيرات في سلوك الساعة البيولوجية ، وجد تحليل ساعات الأنسجة أن ساعات الأنسجة المركزية والمحيطية كانت ضعيفة في مجموعة الشيخوخة.
في الآونة الأخيرة ، أجرت عدة مجموعات تحليلا نسخيا للساعة البيولوجية وإخراج الساعة البيولوجية عبر أنسجة مختلفة مع سن33. تسلط نتائج هذه الدراسات الضوء على أن هناك إعادة برمجة واسعة النطاق لإخراج الساعة البيولوجية مع تقدم العمر. هذا يعني أنه على الرغم من أن الساعة الأساسية تحافظ على وظيفة التوقيت ، إلا أن الجينات المستهدفة للتعبير اليومي مختلفة إلى حد كبير. على سبيل المثال ، جمعت دراستان خزعات عضلية من البشر كل 4 ساعات لمدة 24 ساعة ، وحددت النتائج أن ذروة وقع التعبير الجيني على مدار الساعة يتم عكسها بين القوارض الليلية والبشر النهاريين34،35،36. يشير هذا إلى أنه عند مقارنة التعبير الجيني على مدار الساعة بناء على مرحلة النشاط مقابل الراحة فقط (وليس الضوء مقابل الظلام) ، فإن أنماط التعبير الجيني للساعة في العضلات هي نفسها تقريبا بين الأنواع. يقترح أن يؤدي هذا التغيير المرتبط بالعمر في ناتج الساعة إلى ضعف في تنظيم المسارات التي تشمل السمات المميزة المعروفة للشيخوخة ، مثل وظيفة الميتوكوندريا ، وتلف الحمض النووي وإصلاحه ، والالتهام الذاتي37.
الأساس المنطقي للدراسة
العلاقة بين وظيفة الميتوكوندريا وتدهور الوظيفة البدنية راسخة. ومع ذلك ، فإن السبب الكامن وراء الخلل الوظيفي في الميتوكوندريا لا يزال موضوعا للنقاش. تشير الأبحاث الحديثة إلى أن استخدام الوقود الخلوي وإيقاعات الساعة البيولوجية قد تلعب دورا في هذه العملية. غالبا ما ينظر إلى الطرق التقليدية لتقييم وظيفة الميتوكوندريا ، مثل قياس استهلاك الأكسجين في الميتوكوندريا في عينة خزعة العضلات ، على أنها مؤلمة وغازية ، مما قد يثبط المشاركة ، خاصة في المجموعات السكانية ذات الكتلة العضلية المنخفضة ، مثل البالغين الضعفاء والساركوبين38.
بالنظر إلى هذه القيود ، هناك حاجة إلى طريقة أقل توغلا لتقييم التغيرات في استخدام الوقود الخلوي وإيقاع الساعة البيولوجية لدى كبار السن. تهدف هذه الدراسة إلى تقييم بروتوكول جديد طفيف التوغل يمكن استخدامه لتقييم استقلاب الوقود وإيقاع الساعة البيولوجية في هذه الفئة من السكان. ستساهم نتائج هذه الدراسة في فهم أفضل للتغيرات المرتبطة بالعمر والاستجابة للتدخلات الطبية أو السلوكية ، وستكون بمثابة نموذج للدراسات المستقبلية في هذا المجال.
Protocol
تمت الموافقة على الإجراءات التي تشمل المشاركين البشريين من قبل لجنة أخلاقيات البحث (سياسة أخلاقيات فلوريدا 1.0104) ومجلس المراجعة المؤسسية بجامعة فلوريدا.
1. وظيفة الميتوكوندريا
- عزل خلايا الدم المحيطية أحادية النواة (PBMCs)
- اجمع PBMCs باستخدام أنابيب خاصة لجمع الدم سعة 8 مل (16 مم × 125 مم ؛ تحتوي إما على 0.1 M من مضادات التخثر من سترات الصوديوم أو مضاد للتخثر هيبارين الصوديوم) (انظر جدول المواد).
ملاحظة: تحتوي أنابيب جمع الدم على وسائط فصل الدم المكونة من هلام بوليستر متغير الانسيابية ووسط متدرج (انظر جدول المواد) لتعزيز فصل خلايا الدم البيضاء. - قم بمعالجة أنابيب تحضير الخلايا سعة 8 مل في غضون ساعتين بعد التجميع للحصول على نتائج قابلة للتطبيق.
- امزج أنابيب جمع الدم بعد ملئها بالدم (إما عن طريق الانعكاس اللطيف أو على الخلاط) واحتفظ بها في درجة حرارة الغرفة (RT) لمدة 2 ساعة كحد أقصى.
- قم بالطرد المركزي لأنابيب جمع الدم في دوار متأرجح مناسب للخارج عند 2,000 × جم لمدة 15 دقيقة (أو ما يعادل 30,000 جم في الدقيقة ؛ لا تتجاوز 2,000 × جم) في RT.
ملاحظة: هذه الأنابيب أطول من أنبوب الطرد المركزي العادي سعة 15 مل ؛ لذلك ، يجب إيلاء اهتمام إضافي لاستخدام الدوار الصحيح. - قم بالشفط والتخلص منه في حاوية نفايات خطرة بيولوجيا ~ 80٪ من طبقة البلازما ، واجمع طبقة الخلية من أنبوب جمع الدم (باستخدام ماصة نقل) في أنبوب طرد مركزي سعة 15 مل.
ملاحظة: عند استخدام أنبوب سعة 15 مل ، أضف 7 مل من طبقة الخلية واملأ حتى 14 مل بمحلول ملحي معقم مخزن بالفوسفات (PBS). يجب أن تكون نسبة الخلايا إلى PBS 1: 1. استخدم أنابيب متعددة إذا لزم الأمر. تخلط بلطف عن طريق قلبها. - جهاز طرد مركزي في دوار متأرجح للخارج عند 900 × جم لمدة 5 دقائق (أو ما يعادل 4,500 جم دقيقة) عند RT.
- دون إزعاج حبيبات الخلية ، قم بشفط محلول PBS وتخلص منه في حاوية نفايات خطرة بيولوجيا.
- أعد تعليق حبيبات الخلية في 1 مل من الوسط القاعدي (BM ؛ انظر جدول المواد) عن طريق الترتيبات برفق. أضف BM إلى إجمالي 10 مل ، واخلطه برفق عن طريق قلبه. إجراء تعداد الخلايا.
- قم بالطرد المركزي لتعليق الخلية في دوار متأرجح للخارج عند 900 × جم لمدة 5 دقائق في RT.
ملاحظة: عند استخدام الخلايا في نفس اليوم لتقييم الطاقة الحيوية ، انتقل إلى الخطوة 1.1.10 ؛ إذا تم تجميد الخلايا للتخزين، فانتقل إلى الخطوة 1.1.13. - احسب حجم وسيط الفحص (AM ؛ انظر جدول المواد) لإعادة تعليق حبيبات الخلية التالية لتحقيق تركيز الخلية المطلوب.
ملاحظة: على سبيل المثال ، بالنسبة لكثافة البذر البالغة 150.000 خلية / بئر في 50 ميكرولتر ، فإن التركيز المطلوب لتعليق الخلية هو 3 ملايين خلية / مل. - دون إزعاج حبيبات الخلية ، قم بشفط المادة الطافية وتخلص منها في حاوية نفايات خطرة بيولوجيا.
- أعد تعليق حبيبات الخلية برفق في 1 مل أو أقل من صباحا. أضف AM إلى الحجم الإجمالي المحسوب لتركيز الخلية المطلوب. الخلايا جاهزة الآن للزرع في صفيحة زراعة الخلايا المطلية (انظر جدول المواد).
ملاحظة: الخطوات التالية هي لتجميد الخلايا للتخزين (1.1.13-1.1.16) ولا تنطبق على الإجراء في نفس اليوم. - لتجميد الخلايا ، قم بشفط المادة الطافية دون إزعاج حبيبات الخلية وتخلص منها في حاوية نفايات خطرة بيولوجيا.
- أعد تعليق الخلايا برفق في وسائط التجميد (انظر جدول المواد) بالتركيز المطلوب (5-10 ملايين خلية / مل). Aliquot الأحجام المطلوبة في cryovials المسماة.
- قم بتجميد تعليق الخلية ببطء باستخدام حاوية تجميد (انظر جدول المواد) لمدة لا تقل عن 4 ساعات أو طوال الليل عند -80 درجة مئوية.
- بعد 4 ساعات ، أو في صباح اليوم التالي ، انقل المبردات إلى تخزين النيتروجين السائل ، حيث يجب أن تكون موجودة في مرحلة البخار.
- في اليوم السابق للقياس ، قم بتغطية قيعان الآبار لصفيحة مجهرية لزراعة الخلايا (انظر جدول المواد) بمادة لاصقة للخلية (انظر جدول المواد). قم بإعداد المادة اللاصقة وفقا لتعليمات الشركة المصنعة ، بتركيز موصى به يبلغ 22.4 ميكروغرام / ميكرولتر ، عن طريق تخفيف الحجم المناسب من محلول المخزون اللاصق في بيكربونات الصوديوم 0.1 متر (درجة الحموضة 8.0). ضع 25 ميكرولتر من المادة اللاصقة على كل بئر من الصفيحة الدقيقة لزراعة الخلايا.
- بعد 20 دقيقة ، قم بسحب السائل المتبقي من كل بئر وغسل الآبار مرتين ب 200 ميكرولتر من الماء المعقم النقي. دع اللوحة تجف في خزانة السلامة الحيوية (لمدة ~ 2 ساعة).
- لف الطبق بورق الألمنيوم أو ضعه في وعاء ثانوي مغلق ، واحفظه في الثلاجة على حرارة 4 درجات مئوية.
- اجمع PBMCs باستخدام أنابيب خاصة لجمع الدم سعة 8 مل (16 مم × 125 مم ؛ تحتوي إما على 0.1 M من مضادات التخثر من سترات الصوديوم أو مضاد للتخثر هيبارين الصوديوم) (انظر جدول المواد).
- تقييم الطاقة الحيوية ل PBMCs باستخدام محلل التدفق الأيضي في الوقت اللازم
ملاحظة: استخدام محلل التدفق والقارئ متعدد الأوضاع (راجع جدول المواد)، وكثافة بذر مثالية تبلغ 000 150 من ثنائي الفينيل ثنائي الفينيل لكل بئر، وتركيز نهائي للفك الاقتران كربونيل سيانيد -4 (ثلاثي فلورو الميثوكسي) فينيل هيدرازون (FCCP) يبلغ 2 ميكرومتر، وتركيز نهائي من Hoechst 33342 قدره 4 ميكرومتر (مع وقت حضانة لا يقل عن 20 دقيقة بعد الحقن).- لترطيب خراطيش المستشعر باستخدام الداعم المائي ، قم بإزالة خرطوشة المستشعر مع لوحة المرافق من الصندوق وضع "المستشعر" للخرطوشة على المقعد. Pipet 200 μL من العيار (انظر جدول المواد) في كل بئر من لوحة المرافق وضع المعزز المائي بإحكام على لوحة المرافق ، متبوعا بخرطوشة المستشعر. افحص وقم بإزالة أي فقاعات هواء محاصرة ، وضعها في حاضنة 37 درجة مئوية غيرCO-2 طوال الليل.
- قم بتشغيل محلل التدفق ثم افتح برنامج تحليل الفحص (انظر جدول المواد). اضبط درجة الحرارة على 37 درجة مئوية. اترك الجهاز طوال الليل للسماح بتثبيت درجة الحرارة المحددة.
ملاحظة: يمكن تنفيذ خطوات البرمجة التالية (1.2.4-1.2.10) في اليوم السابق أو في يوم التجربة - لبرمجة ملف برنامج تحليل الفحص (انظر جدول المواد) ، افتح قالب اختبار إجهاد أكسدة الركيزة. انتقل إلى تعريفات المجموعة ، وافتح علامة التبويب استراتيجيات الحقن ، وقم بتحرير اختبار إجهاد المثبط + الثور الفرعي إلى اختبار إجهاد الثور الفرعي + الإتوموكسير ، وأضف استراتيجيتين أخريين للحقن: UK5099 + اختبار إجهاد الثور الفرعي و BTPES + اختبار إجهاد الثور الفرعي. ضمن كل استراتيجية حقن ، داخل نافذة حالة الحقن ، انقر فوق A للمنفذ A وأدخل التركيز النهائي للمثبط المعني (Etomoxir: 4 μM ؛ UK5099: 2 ميكرومتر؛ BTPES: 3 ميكرومتر).
- انقر فوق المنافذ B و C و D ، وأدخل التركيزات النهائية ذات الصلة (المنفذ B: تركيز oligomycin [1.50 μM] ، المنفذ C: FCCP [2.0 μM] ؛ المنفذ D: Rotenone + Antimycin A [0.5 ميكرومتر]). أضف Hoechst 33342 ، 4 ميكرومتر إلى نافذة المركبات للمنفذ D.
- افتح علامة التبويب المعالجة المسبقة واختر العلاجات المسبقة ، إن أمكن. على سبيل المثال: التحكم أو التجريبي أو المعتاد (على سبيل المثال، خط الأساس والمتابعة). أضف أوصافا في النافذة الموجودة أسفل النافذة إذا لزم الأمر.
- افتح علامة التبويب Assay Media ومن القائمة المنسدلة للوسائط ، اختر RPMI Medium ، ودرجة الحموضة 7.4 ، وأدخل رقم المجموعة ، والموظفين الذين يعدون الوسائط ، ووقت التحضير ، والمكملات الغذائية المضافة إلى الوسائط (10 ملي مولار جلوكوز ، 2 ملي جلوتامين ، 1 ملي بيروفات ؛ انظر جدول المواد).
- افتح علامة التبويب نوع الخلية وأدخل معرف موضوع PBMC كاسم ، و PBMC كنوع الخلية ، و 150000 ككثافة البذر ، و معرف الموضوع كمصدر ، و الموظفين الذين أعدوا الخلايا ، وتاريخ التحضير ، ويوم ذوبان الخلية ، إن أمكن.
- انقر فوق إنشاء مجموعات ، وانتقل إلى خريطة اللوحة ، وقم بتعيين آبار اللوحة المكونة من 96 بئرا للمجموعات المعنية. احتفظ بالآبار A1 و A12 و H1 و H12 المخصصة كآبار خلفية.
- انتقل إلى البروتوكول ، وحدد مربع التوازن (الإعداد الافتراضي) ، وأدخل المعلومات التالية: خط الأساس: خمس دورات قياس: 3 دقائق من المزيج ، و 0 دقيقة انتظار ، و 3 دقائق قياس ؛ الوسائط أو المثبط (المنفذ A): ست دورات قياس: 3 دقائق من المزج ، و 0 دقيقة انتظار ، و 3 دقائق قياس ؛ أوليغومايسين (المنفذ B): ثلاث دورات قياس: مزيج 3 دقائق ، انتظار 0 دقيقة ، و 3 دقائق قياس ؛ FCCP (المنفذ C): ثلاث دورات قياس: 3 دقائق من المزيج ، 0 دقيقة انتظار ، و 3 دقائق قياس ؛ Rotenone + Antimycin A + Hoechst 33342 (المنفذ D): ثلاث دورات قياس: 3 دقائق من المزيج ، و 0 دقيقة انتظار ، و 3 دقائق قياس.
- في يوم تقييم الطاقة الحيوية ، خذ الصفيحة الدقيقة لزراعة الخلايا المطلية من الثلاجة واتركها تسخن إلى RT في خزانة السلامة الحيوية.
- تحضير وسط الفحص (AM) عن طريق خلط 97 مل من BM المسخن مسبقا والمكملات الغذائية: 1 مل من البيروفات (التركيز النهائي: 1 ملليمتر) ، 1 مل من الجلوكوز (التركيز النهائي 10 ملم) ، و 1 مل من الجلوتامين (التركيز النهائي: 2 ملليمتر). ضع AM عند 37 درجة مئوية في حاضنة غير CO2 حتى الاستخدام.
- لزرع الخلايا ، أضف 50 ميكرولتر من تعليق الخلية (من 1.1.12) يحتوي على 150.000 PBMCs لكل بئر ، باستثناء A1 و H1 و A12 و H12 (المخصصة كآبار خلفية).
حرج: تم تحديد كثافة البذر المثلى مسبقا. - قم بتغطية لوحة الخلية بغطاءها واترك 60 دقيقة من الراحة الخلوية في RT في خزانة السلامة الحيوية لتسهيل التوزيع المتساوي للخلايا.
حرج: عرض الخلايا تحت المجهر لضمان توزيع الخلايا المتجانسة المطلوبة عبر البئر. - لتصوير الخلية ، قم بتشغيل القارئ متعدد الأوضاع (انظر جدول المواد) قبل ساعات قليلة من حضانة الخلية الأولى. انتظر حتى يكتمل بروتوكول بدء القارئ قبل فتح برنامج التصوير (انظر جدول المواد). افتح برنامج التصوير واضبط درجة حرارة التسخين المسبق على 37 درجة مئوية.
- لتحضير كواشف الفحص ، اتبع تعليمات مجموعة الفحص لإعادة تكوين الكواشف ، مع تعديلات طفيفة كما هو موضح في الجدول 1.
حرج: تم تحديد تركيزات FCCP و Hoechst33342 النهائية المثلى مسبقا. - بعد راحة الخلية لمدة 60 دقيقة ، افحص الآبار بمجهر زراعة الخلايا وقم بتدوين أي تشوهات بصرية ، مثل تراكم الخلايا.
- الطرد المركزي للوحة زراعة الخلية في RT في جهاز طرد مركزي مع دوار متأرجح للألواح الدقيقة عند 60 × جم لمدة 1 دقيقة ، مع الحد الأدنى من التسارع والحد الأدنى من الكسر ؛ اقلب اللوحة وجهاز الطرد المركزي مرة أخرى عند 40 × جم لمدة 1 دقيقة. اضبط التسارع والكسر إلى الحد الأدنى. احتضان الخلايا لمدة 25-30 دقيقة عند 37 درجة مئوية في حاضنة غير CO2 .
ملاحظة: عند إجراء تصوير الخلية ، يتم تحضين لوحة الخلية في القارئ متعدد الأوضاع المسخن مسبقا بدلا من ذلك (انظر جدول المواد) ، ويتم التقاط صورة المجال الساطع لكل بئر خلال فترة الحضانة هذه (حضانة الخلية الأولى). - امسح الرمز الشريطي للوحة زراعة الخلية ضوئيا باستخدام ماسح الباركود (انظر جدول المواد)، وحدد بدء مسح Brightfield، ضع لوحة زراعة الخلية على درج اللوحة، وابدأ سحب الدرج. حدد الآبار التي تحتوي على خلايا للمسح الضوئي وابدأ الفحص.
- أثناء حضانة الخلية الأولى ، قم بتحميل منافذ خرطوشة المستشعر بالكواشف ، كما هو موضح في الجدول 1: المنفذ (أ): 20 ميكرولتر من AM (الضوابط) ، إيتوموكسير (مثبط لنقل الأحماض الدهنية طويلة السلسلة إلى الميتوكوندريا) ، المملكة المتحدة 5099 (2-Cyano-3- (1-phenyl-1H-indol-3-yl) -2-propenoic acid ؛ مثبط حامل البيروفات الميتوكوندريا) ، أو BPTES (Bis-2- (5-phenylacetamido-1 ، 3،4-ثياديازول-2-يل) كبريتيد الإيثيل ؛ مثبط تحويل الجلوتامين إلى الغلوتامات) ؛ المنفذ (ب): 22 ميكرولتر من oligomycin (مثبط سينسيز ATP) ؛ المنفذ (C): 25 ميكرولتر من FCCP (فك اقتران الكربونيل سيانيد -4 (ثلاثي فلوروميثوكسي) فينيل هيدرازون ؛ المنفذ (D): 27 ميكرولتر من الروتينون / مضادات المايسين A / Hoechst 33342 (مثبطات مركب الميتوكوندريا الأول والثالث ، على التوالي ، والصبغة النووية). أعد خرطوشة المستشعر إلى حاضنة 37 درجة مئوية غيرCO-2 لمدة 5 دقائق أخرى.
ملاحظة: اتبع تعليمات الشركة المصنعة لتحميل المنفذ. - أخرج لوحة زراعة الخلية من الحاضنة أو قارئ اللوحة بعد حضانة الخلية الأولى وبعد اكتمال تصوير الخلية (إن أمكن) ، وأضف AM دافئا إلى كل بئر إلى الحجم النهائي البالغ 180 ميكرولتر لكل بئر. ضع لوحة الخلية عند 37 درجة مئوية في حاضنة غير ثاني أكسيد الكربون2 لمدة 15-25 دقيقة أخرى (حضانة الخلية الثانية).
- ابدأ الفحص الأيضي عن طريق بدء معايرة المستشعر أثناء حضانة الخلية الثانية. انقر فوق تشغيل الفحص عندما يكون الاختبار جاهزا للبدء بمعايرة خرطوشة المستشعر. عند المطالبة، انقل خرطوشة المستشعر من حاضنة 37 درجة مئوية غير CO2 إلى درج محلل التدفق وابدأ المعايرة. اتبع موجه برنامج تحليل الفحص واستبدل لوحة المرافق للوحة الخلية بعد اكتمال المعايرة.
ملاحظة: تستغرق المعايرة حوالي 20 دقيقة. - بعد فحص التمثيل الغذائي ، اتبع موجه البرنامج وقم بإزالة خرطوشة المستشعر ولوحة الخلية من الجهاز. قم بإزالة خرطوشة المستشعر من لوحة الخلية وقم بتغطية لوحة الخلية بغطاءها.
- بعد تحديد وقت حضانة صبغة Hoechst في التجارب الأولية ، امسح الرمز الشريطي للوحة واتبع مطالبات البرنامج للحصول على صورة فلورية لكل خلية تحتوي على بئر باستخدام القارئ متعدد الأوضاع.
ملاحظة: برنامج تحليل التصوير والفحص متصل ، مما يسمح باستيراد بيانات عدد الخلايا إلى ملف بيانات تحليل الفحص لتطبيع البيانات إلى عدد الخلايا.
2. التعبير الجيني على مدار الساعة البيولوجية
ملاحظة: ستتم مراجعة تعبير المشاركين عن جينات الساعة من PBMCs عن طريق عزل الحمض النووي الريبي باستخدام مجموعة دم الحمض النووي الريبي (انظر جدول المواد).
- اسحب 3 مل من دم المشارك مباشرة في أنبوب الحمض النووي الريبي (انظر جدول المواد) مع 6 مل من الكواشف المستقرة. دوامة لمدة 10 ثوان لخلطها بالكامل.
ملاحظة: إذا لم يتم خلط الكواشف المستقرة جيدا مع عينة دم المشارك ، فهناك خطر متزايد لخطأ الدراسة. - نقل 1.0 مل من عينة الدم المستقرة إلى أنبوب سعة 15 مل ، مع 5 مل من محلول تحلل كريات الدم الحمراء. احتضن على الثلج لمدة 10-15 دقيقة. دوامة الأنبوب 2x أثناء الحضانة. جهاز الطرد المركزي للأنبوب عند 4 درجات مئوية عند 400 × جم لمدة 10 دقائق.
- حدد الحبيبات واسكب بعناية المادة الطافية التي تحتوي على خلايا الدم الحمراء المحللة. أضف 2 مل من محلول تحلل كريات الدم الحمراء (انظر جدول المواد) ، وأعد تعليق الخلايا ، والدوامة لفترة وجيزة ، وجهاز الطرد المركزي عند 400 × جم لمدة 10 دقائق عند 4 درجات مئوية.
- اسكب المادة الطافية واترك الأنبوب مقلوبا على ورق ماص لمدة 1-2 دقيقة. امسح أي سائل حول حافة الأنبوب بورق نظيف قبل الخطوة التالية.
- أضف بعناية 600 ميكرولتر من المخزن المؤقت لتحلل الحمض النووي الريبي (انظر جدول المواد). باتباع بروتوكول الشركة المصنعة ، أضف β-mercaptoethanol وأعد تعليق الحبيبات.
- Pipet المحللة مباشرة في عمود الدوران الذي يمكن التخلص منه (انظر جدول المواد) ، يتم وضعه في أنبوب تجميع سعة 2 مل وجهاز طرد مركزي لمدة دقيقتين بأقصى سرعة للتجانس. تخلص من عمود دوران الخالط المحلل الخلوي القابل للتصرف واحفظ المحللة المتجانسة.
- أضف 1 حجم (600 ميكرولتر) من 70٪ من الإيثانول إلى المحللة المتجانسة واخلطها عن طريق سحب العينات. قم بسحب العينة بعناية ، بما في ذلك أي راسب قد يكون قد تشكل ، في عمود دوران جديد في أنبوب تجميع سعة 2 مل ، ولكن لا ترطب الحافة. جهاز طرد مركزي لمدة 15 ثانية عند > 8,000 × جم.
- انقل عمود الدوران (انظر جدول المواد) إلى أنبوب تجميع جديد سعة 2 مل. ضع 700 ميكرولتر من عازلة الغسيل الصارمة (انظر جدول المواد) على عمود الدوران وجهاز الطرد المركزي لمدة 15 ثانية عند >000 8,000 × جم للغسيل. تجاهل التدفق.
- افتح عمود الدوران بعناية وأضف 500 ميكرولتر من مخزن الغسيل المعتدل (انظر جدول المواد). أغلق الغطاء وجهاز الطرد المركزي بأقصى سرعة (20,000 × جم) لمدة 3 دقائق.
- انقل عمود الدوران إلى أنبوب طرد مركزي دقيق سعة 1.5 مل وقم بسحب 30-50 ميكرولتر من الماء الخالي من RNase مباشرة على غشاء السيليكا. جهاز طرد مركزي لمدة 1 دقيقة عند >8,000 × جم لتصفية الحمض النووي الريبي. كرر مرة أخرى.
ملاحظة: يمكن تخزين الحمض النووي الريبي عند -80 درجة مئوية. - قم بإجراء معالجة DNase على عمود باستخدام مجموعة DNase الخالية من RNase (انظر جدول المواد) ، وفقا لبروتوكول الشركة المصنعة.
- قم بإنشاء (كدنا) باستخدام 500 نانوغرام من إجمالي الحمض النووي الريبي ونظام تفاعل البوليميراز المتسلسل في الوقت الفعلي (PCR) (انظر جدول المواد) ، وفقا لبروتوكول الشركة المصنعة. قم بتخفيف جميع عينات (كدنا) 1:25 في ماء خال من RNase واستخدم 4 مل لإجراء النسخ العكسي الكمي PCR (qRT-PCR).
- استخدم طريقة إضافة التمهيدي (انظر جدول المواد) لإكمال qRT-PCR ب 10 ملي مولار من كل من البادئات الموضحة في الجدول 2. أكمل qRT-PCR باستخدام نظام الوقت الفعلي (انظر جدول المواد).
- تطبيع مستويات mRNA للجينات المختارة باستخدام مستويات Rpl26 mRNA. استخدم طريقة 2-DDCt لحساب القياس الكمي النسبي.
- لتحديد ما إذا كان التعبير عن mRNA معين أظهر تذبذبا يوميا ، استخدم اختبارا قائما على احتمالية LR_rhythmicity39 (باستخدام p≤ 0.01) للكشف عن إيقاع الساعة البيولوجية في حالة تجريبيةواحدة 40.
3. خطة تحليل البيانات
ملاحظة: سيتم استخدام جرد طبي لتصنيف المشاركين بناء على استخدام الدواء43.
- استخدم نموذجا خطيا مختلط التأثيرات ، حيث يجب تضمين العمر والجنس والوزن والطول وضغط الدم ومعدل ضربات القلب وعوامل الخطر الأخرى كمتغيرات مشتركة.
- يجب تضمين مصطلح الأثر العشوائي لشرح ارتباط البيانات داخل الموضوع.
- لتركيب النموذج ، يجب تنفيذ اختيار متغير عكسي مع المبدأ الهرمي.
- من النموذج المجهز، قم بقياس التغييرات من النقطة الزمنية 1 إلى النقطة الزمنية 2، بالنظر إلى جميع المتغيرات المشتركة في النموذج المجهز.
النتائج
يتضمن البروتوكول المقترح بيانات أولية تعمل كتحقق من صحة المنهجية. يشتمل البروتوكول على محلل التدفق الأيضي في الوقت الفعلي لفحص وظيفة الميتوكوندريا واستخدام الوقود الخلوي ، واستخراج الحمض النووي الريبي و qRT-PCR لتحليل جينات إيقاع الساعة البيولوجية (على سبيل المثال ، BMAL1 و CLOCK و Nfil2 و Nr1d1 و Dbp و Cry1 و Per2).
يتم عرض معدل استهلاك الأكسجين (OCR) ل PBMCs البشرية المعزولة من خمسة مشاركين في المراقبة ، بعد 10 أيام من التحليل الأولي ، في الشكل 1. تستخدم البيانات لمقارنة القيم السابقة واللاحقة وتظهر متوسط قيم التنفس القاعدي ، والاستجابة الحادة ، والتنفس الأقصى ، والقدرة الاحتياطية بعد حقن التحكم ، إيتوموكسير ، UK5099 ، و BPTES. والجدير بالذكر أن الشكل 1 ج يظهر استجابة حادة سلبية كبيرة بعد حقن الإيتوموكسير ، ولكن لم يتم ملاحظة أي آثار كبيرة على التنفس القاعدي أو التنفس الأقصى أو القدرة الاحتياطية.
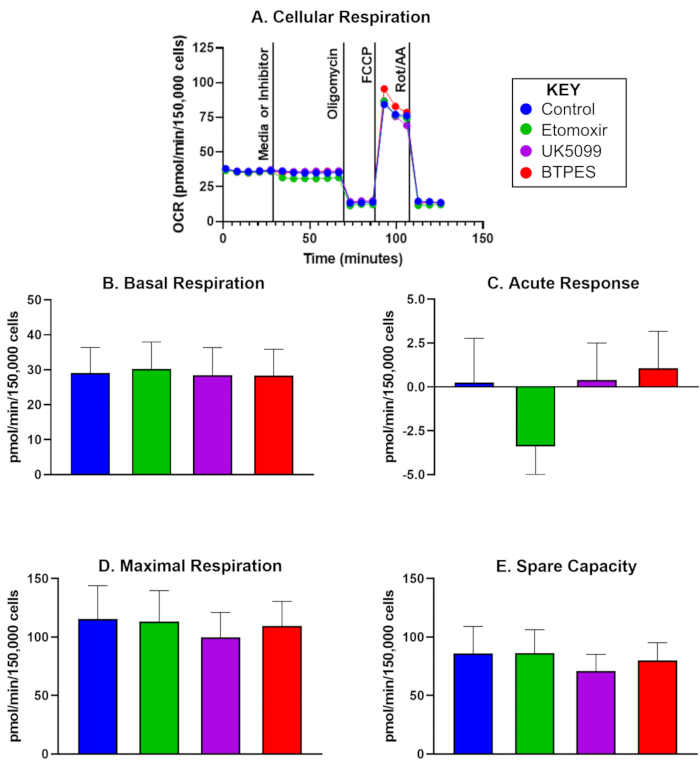
الشكل 1: استهلاك الأكسجين لخلايا الدم المحيطية البشرية أحادية النواة المعزولة (PBMCs). (أ) معدل استهلاك الأكسجين في الوقت الفعلي (OCR ؛ pmol / (min∙ 150,000 خلية) من PBMCs المعزولة من موضوع التحكم ، تم قياسه باستخدام محلل التدفق وتقييمه باستخدام مقايسة أكسدة الركيزة. تم زرع الخلايا بكثافة 150.000 خلية / بئر. كان الحقن الأول إما وسيطا (تحكم) أو مثبطا (إيتوموكسير ، UK5099 ، أو BPTES ؛ انظر النص للحصول على التفاصيل) وحدث بعد قياس معدل التنفس الخلوي الأساسي. تم تحديد الاستجابة الحادة لقيود الركيزة الميتوكوندريا على أنها اختلاف التعرف الضوئي على الحروف القاعدي قبل وبعد حقن المثبطات. يمنع أوليغومايسين ، مثبط سينسيز ATP ، التنفس المقترن بإنتاج ATP وينتج تنفس تسرب البروتون. FCCP ، الفصل ، يحفز أقصى قدر من التنفس غير المقترن. يمنع الروتينون ومضادات المايسين أ (مثبطات المركب الأول والثالث ، على التوالي) كل شيء باستثناء التنفس غير الميتوكوندريا (انظر النص للحصول على التفاصيل). (ب - ه) القياس الكمي للتنفس الخلوي (ن = 5 ؛ يتم تمثيل البيانات كمتوسط ± SD). (ب) التعرف الضوئي على الحروف القاعدي قبل الحقن المثبط ، (ج) الاستجابة الحادة للمثبط (التغيير في التعرف الضوئي على الحروف بالنسبة إلى المعدل القاعدي قبل حقن المثبط) ، (د) الحد الأقصى للالتعرف الضوئي على الحروف ، و (ه) السعة الاحتياطية (الفرق بين الحد الأقصى للالتعرف الضوئي على الحروف والتعرف الضوئي على الحروف القاعدي بعد الحقن الأول). قد تشير الاستجابة الحادة (C) لحقن الإيتوموكسير إلى اعتماد أعلى ل OCR على الأحماض الدهنية كركيزة للطاقة في ظل الظروف القاعدية مقارنة بمجموعات الركيزة الأخرى ، دون تأثير ملحوظ على التعرف الضوئي على الحروف أثناء ارتفاع الطلب على الطاقة (D). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
| مركب | تمت إضافة AM (ميكرولتر) إلى المركب | مخزون (ميكرومتر) | مخزون (ميكرولتر) لمخزون العمل | AM (ميكرولتر) لمخزون العمل | مخزون العمل (ميكرومتر) | مخزون العمل (ميكرولتر) [ميناء] | العنصر النهائي (ميكرومتر) |
| إيتوموكسير | 700 | 160 | 500 | 1500 | 40 | 20 [أ] | 4 |
| المملكة المتحدة5099 | 700 | 80 | 500 | 1500 | 20 | 20 [أ] | 2 |
| BPTES | 700 | 120 | 500 | 1500 | 30 | 20 [أ] | 3 |
| أوليغو | 420 | 150 | 300 | 2700 | 15 | 22 [ب] | 1.5 |
| FCCP | 720 | 100 | 600 | 2400 | 20 | 25 [ج] | 2 |
| تعفن / AA / H | 540 | 50 | 300 | 2700 | 5 | 27 [د] | 0.5 |
الجدول 1: تحضير الكواشف لاختبار أكسدة الركيزة وتركيزات المخزون والعمل والمحاليل النهائية. جميع الكواشف هي جزء من اختبار إجهاد الخلية أو مجموعات اختبار إجهاد أكسدة الركيزة. الاختصارات: oligo = oligomycin. FCCP = فك اقتران الكربونيل سيانيد -4 (ثلاثي فلوروميثوكسي) فينيل هيدرازون ؛ Rot / AA / H = روتينون / أنتيمايسين A / Hoechst 33342. إيتوموكسير ، UK5099 ، BTPES: مثبطات الأحماض الدهنية والجلوكوز وأكسدة الجلوتامين ، على التوالي.
| بمال 1 | إلى الأمام - GCACGACGTTCTTTCTTCTGT |
| عكس - GCAGAAGCTTTCGATCTGCTTTTTTTT | |
| ساعة | إلى الأمام - CGTCTCAGACCCTTCCTCAAC |
| عكس - GTAAATGCTGCCTGGGTGGA | |
| البكاء 1 | إلى الأمام - ACTGCTATTGCCCTGTTGGT |
| عكس - GACAGGCAAATAACGCCTGA | |
| في 1 | مهاجم - ATTCGGGTTACGAAGCTCCC |
| عكس - GGCAGCCCTTTCATCCACAT | |
| بير2 | إلى الأمام - CATGTGCAGTGGAGCAGATTC |
| عكس - GGGGTGGTAGCGGATTTCAT | |
| Rev-erb α | إلى الأمام - ACAGATGTCAGCAATGTCGC |
| عكس - CGACCAAACCGAACAGCATC |
الجدول 2: بادئات جينات الساعة البيولوجية.
Discussion
ينظر إلى التدهور في وظيفة الميتوكوندريا وتنظيم إيقاع الساعة البيولوجية مع تقدم العمر بشكل متزايد على أنهما عاملان مساهمان في الأمراض المرتبطة بالعمر. يمثل تغيير إيقاعات الساعة البيولوجية من خلال تعديلات نمط الحياة ، مثل النظام الغذائي والنشاط البدني ، استراتيجية محتملة لتعزيز الشيخوخة الصحية وتقليل انخفاض الحركة المرتبط بالشيخوخة. ومع ذلك ، فإن الطرق الحالية لتقييم وظيفة الميتوكوندريا مباشرة غازية وغالبا ما تتطلب خزعة عضلية ، والتي يمكن أن تشكل تحديات في تجنيد المشاركين والاحتفاظ بهم بسبب الألم والمخاطر المتصورة.
إن تقييم علامات الساعة البيولوجية والصحة الأيضية من خلال طرق أقل توغلا ، مثل جمع الدم ، من شأنه أن يوفر نتائج قيمة لاستكشاف واختبار الأهداف العلاجية في الدراسات المستقبلية. هذه الأساليب طفيفة التوغل لديها القدرة على تطوير المجال بشكل كبير من خلال توفير رؤى جديدة حول التفاعل المعقد بين إيقاع الساعة البيولوجية وصحة التمثيل الغذائي وتأثيرهما على الوظيفة. الهدف من هذه الدراسة هو تقييم العلاقة بين استقلاب الطاقة الخلوية وإيقاع الساعة البيولوجية. على وجه الخصوص ، يتم استخدام تحليل تدفق الطاقة الحيوية لتقييم وظيفة الميتوكوندريا في ظل ظروف توافر الركيزة المختلفة ، جنبا إلى جنب مع مراقبة التعبير الجيني لمجموعة من الجينات اليومية في خلايا الدم البيضاء للمشاركين. من خلال استخدام ذراعي التحليل ، الطاقة الحيوية والتعبير الجيني ، يمكن تحقيق فهم شامل للعلاقة بين هاتين العمليتين الأساسيتين.
يقدم التحليل الإحصائي لبيانات هذه السلسلة الزمنية من منظور الساعة البيولوجية نظرة ثاقبة لقوة ونطاق وتوقيت إيقاعات الساعة البيولوجية. في الختام ، يشكل تكامل تحليل التعبير الجيني ، والطاقة الحيوية الخلوية ، ومقاييس التمثيل الغذائي على مستوى الكائن الحي نهجا جديدا ومبتكرا من شأنه أن يلقي الضوء على التفاعل بين استقلاب الطاقة وإيقاعات الساعة البيولوجية لدى البشر.
في دراسة تجريبية ، اكتشفنا استجابة حادة في التعرف الضوئي على الحروف ل PBMCs للحد من استخدام الأحماض الدهنية (بعد حقن إيتوموكسير ، وهو مثبط للكارنيتين بالميتويل ترانسفيراز 1 أ). تشير هذه النتيجة إلى أنه في PBMCs من هذه المجموعة المعينة من المشاركين ، قد يكون هناك اعتماد على الأحماض الدهنية كركيزة للطاقة أثناء التنفس الأساسي. ومع ذلك ، لم يتأثر التنفس الأقصى ، مما يشير إلى أن مصادر الطاقة البديلة ، مثل الجلوكوز والجلوتامين ، قد تعوض عن انخفاض استخدام الأحماض الدهنية أثناء ارتفاع الطلب على الطاقة. يجب أن تبحث الدراسات المستقبلية فيما إذا كانت أ) الطاقة الحيوية ل PBMCs تعكس طاقة الجسم بالكامل و ب) ما إذا كانت التدخلات مثل الأكل المقيد بالوقت يمكن أن تؤثر على تفضيلات ركيزة الطاقة.
هناك العديد من الخطوات الحاسمة فيما يتعلق بتحليل تدفق PBMCs. أولا ، قبل تقييم العينات التجريبية ، يجب تحسين كثافة تلقيح الخلايا (الخلايا لكل بئر) عن طريق التأكد من وجود توزيع موحد مستمر للخلايا داخل كل بئر وعبر كل لوحة ، يجب تحسين تركيز FCCP النهائي عن طريق تشغيل اختبارات التركيزات باستخدام التركيزات 0 و 0.125 و 0.25 و 0.5 و 1.0 و 2.0 ميكرومتر ، وإذا كان ذلك ممكنا ، يجب تحسين تلطيخ Hoechst 33342 باتباع تعليمات الشركة المصنعة. ثانيا ، يعد تطبيع البيانات الأيضية للمعلمات الخلوية أمرا بالغ الأهمية لمقارنة البيانات بين التجارب. في البروتوكول الحالي ، يتم وصف عدد الخلايا بعد الانتهاء من فحص محلل التدفق باستخدام خلايا Hoechst 33342 الملطخة وجهاز تصوير الخلايا. في حالة عدم توفر جهاز مناسب ، يمكن تطبيق طرق التطبيع البديلة ، مثل البروتين الخلوي الكلي أو محتوى الحمض النووي النووي لكل بئر. هناك تعديل ملحوظ يمكن استخدامه في البروتوكول ، مقارنة بتلك المقترحة. على وجه التحديد ، يمكن إكمال البروتوكول باستخدام مجموعة فحص فردية لكل من المثبطات الثلاثة ، مقارنة بالمجموعتين المقترحتين هنا فقط (انظر جدول المواد).
إن استخدام PBMCs كبديل لدراسة التفاعل بين استقلاب الطاقة وإيقاعات الساعة البيولوجية لدى كبار السن محدود بافتراض أن استجابتهم للعلاج يمكن أن تعكس بدقة الاستجابة في الأنسجة والأعضاء الأخرى. على الرغم من أن هذا النهج جديد وبسيط التوغل ، فمن المهم الاعتراف بأن الأنسجة والأعضاء المختلفة ، مثل الدماغ والكبد والعضلات الهيكلية ، قد تتفاعل بشكل مختلف في ظل ظروف مختلفة. أظهرت دراسة قبل السريرية أن التعبير الجيني على مدار الساعة قد تغير في الفئران التي تتغذى والصائمة ، مما أدى إلى التنظيم الجزئي للجينات المستهدفة BMAL1 في أنسجة الكبد والعضلات ، ولكن تقليل تنظيم الآخرين41. تمثل هذه الأنسجة والأعضاء المحيطية بشكل كبير عمليات التمثيل الغذائي ويمكن أن تتأثر بالإشارات البيئية التي تؤثر على آليات التعبير الجيني على مدار الساعة42. هناك حاجة إلى مزيد من البحث لفهم العلاقة بين الأنسجة المحيطية والأعضاء والساعة البيولوجية المركزية بشكل كامل.
قيد آخر هو أن المشاركين ليسوا غير مؤهلين لأخذ أي وصفة طبية ، مما قد يشكل قيودا على التحليل الإحصائي. لمواجهة هذا القيد ، في البحث المستقبلي ، سيتم استخدام جرد طبي ، والذي تم التحقق من صحته في مجموعات كبار السن الذين يتناولون الأدوية43. سيتم تصنيف المشاركين بناء على الأدوية الموصى بها المسجلة في قسم مراجعة بيانات البروتوكول. هناك ما مجموعه ثلاث فئات ، من حيث الأدوية التي ثبت أنها 1) تسريع التدهور الوظيفي ، 2) التدهور الوظيفي البطيء ، و 3) التأثير على وظيفة العضلات والهيكل العظمي.
أخيرا ، تظهر القدرة التأكسدية للميتوكوندريا في عضلات الهيكل العظمي البشري إيقاعا ليلا ونهارا ، حيث تبلغ ذروتها بين الساعة 06:00 مساء و 11:00 مساء وتنخفض بين الساعة 08:00 صباحا و 11:00 صباحا44. لم يتضح بعد ما إذا كان هذا ينطبق على القدرة التأكسدية للميتوكوندريا ل PBMCs. ومع ذلك ، تشير البيانات الأولية إلى أن PBMCs واستقلاب الميتوكوندريا مرتبطان45. بالنظر إلى أن المعلومات المتعلقة بخزعات العضلات والتعديلات في PBMCs ليست واضحة ، يجب توخي الحذر عند تحليل النتائج. بالنظر إلى هذا القيد ، من المهم وضع هذه المعلومات في الاعتبار عند تقييم البروتوكول وتطويره ، لأنها قد توفر سياقا ورؤية قيمة يمكن أن تساعد في ضمان صحة البروتوكول وفعاليته.
على حد علمنا ، لم تقم أي دراسات سابقة بتقييم أنماط استخدام الوقود أو إيقاعات الساعة البيولوجية من خلال الأساليب المقترحة في هذا المشروع. هدفنا هو فحص استجابة علامات استخدام وقود الميتوكوندريا وصحة الساعة البيولوجية للتغييرات. تقدم هذه الدراسة طريقة طفيفة التوغل لقياس مؤشر حيوي شديد الحساسية ، والذي يمكن أن يكون بديلا في الدراسات التدخلية المستقبلية حيث لا تكون خزعة العضلات ممكنة.
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للإفصاح عنه.
Acknowledgements
تم تمويل هذه الدراسة من قبل مركز الاستقلال الأمريكي الأكبر سنا (NIH / NIA P30AG028740) ، بمساعدة معهد العلوم السريرية والانتقالية (NIH / NCRR UL1TR000064).
Materials
| Name | Company | Catalog Number | Comments |
| Agilent Technologies Cell Imaging | Agilent Technologies | Cell image software | |
| Agilent/Seahorse Wave desktop program | Agilent Technologies | 5994-0039EN | Software used to analyse data from the celluar analyser and stress test assay |
| Agilent/Seahorse XFe96 Flux Analyzer | Agilent Technologies | S7800B | Real-time cellular flux analyzer; flux analyser |
| Bar Code Reader | Agilent Technologies | G2615-90007 | |
| Seahorse Wave Desktop Software | Agilent technologies | Data acquisition software; assay analysis; wave program | |
| Seahorse XF 1.0 M Glucose solution | Agilent Technologies | 103577-100 | Supplement to basal medium to make assay medium |
| Seahorse XF 100 mM Pyruvate solution | Agilent Technologies | 103578-100 | Supplement to basal medium to make assay medium |
| Seahorse XF 200 mM Glutamine solution | Agilent Technologies | 103579-100 | Supplement to basal medium to make assay medium |
| Seahorse XF Cell Mito Stress Test | Agilent Technologies | 103015-100 | Mitochondrial bioenergetic function assay |
| Seahorse XF Mito Fuel Flex Test | Agilent Technologies | 103260-100 | Mitochondrial bioenergetic function assay |
| Seahorse XF RPMI Medium | Agilent Technologies | 103576-100 | Basal medium for PBMCs |
| Seahorse XFe96 FluxPak mini | Agilent Technologies | 102601-100 | Sensor cartridges and cell culture microplates |
| Cytation 1 Cell Imaging Multi-Mode Reader | Agilent/BioTek | Multimode reader to image cells | |
| CPT Sodium Heparin Tube, 16 x 125 mm x 8.0 mL | Becton Dickinson | 362753 | Blood collection tubes for isolation of peripheral blood mononuclear cells |
| CellTak Cell and Tissue Adhesive | Corning | 354240 | Cell adherent to coat cell culture microplate |
| Phosphate Buffered Saline | Corning | 21-040-CV | Buffer to wash blood cells |
| Ficoll Paque Plus | Cytiva | GE17-1440-02 | Gradient medium |
| Lunar Prodigy DXA scanner | General Electric | EN 60601-2-7 5.1 | Whole body lean mass and fat/lean tissue mass ratio |
| Freezing container, Nalgene Mr. Frosty | MilliporeSigma | C1562 | Freezing container used to slow-freeze cell suspension |
| Buffer EL. | Qiagen | 79217 | Erythrocyte lysis buffer |
| Buffer RLT | Qiagen | 79216 | RNA lysis buffer |
| Buffer RPE | Qiagen | 1018013 | Mild washing buffer |
| Buffer RW1 | Qiagen | 1053394 | Stringent washing buffer |
| QIAamp DNA Micro Kit | Qiagen | 56304 | DNA preps: QIAamp MinElute Columns, Proteinase K, Carrier RNA, Buffers, Collection Tubes (2 ml) |
| QIAamp RNA Blood Mini Kit | Qiagen | 52304 | RNA blood kit; Used to isolate RNA |
| QIAshredder | Qiagen | 79656 | disposable cell-lysate homogenizers |
| RNase-Free DNase Set | Qiagen | 79254 | Used to perform DNA digest |
| 2-Mercaptoethanol (Reagent) | Thermo Fisher Scientific | MFCD00004890 | |
| 2-mL collection tubes, 100 count | Thermo Fisher Scientific | AM12480 | |
| Fast SYBR Green Master Mix | Thermo Fisher Scientific | 4385612 | Primers are added to this and used to carry out qRT-PCR |
| Microcentrifuge Tubes, 1.5 mL | Thermo Fisher Scientific | 69715 | Used to hold RNA purification filter during RNA purification |
| Narrow p1000 pipette tips | Thermo Fisher Scientific | 02-707-402 | |
| QuantStudio 3 Real-Time PCR System, MiniAmp Plus Thermal Cycler, and 96-Well Plates Package | Thermo Fisher Scientific | A40393 | |
| Tempus Blood RNA Tube | Thermo Fisher Scientific | 4342792 | RNA Tube |
| Tempus Spin RNA Isolation kit | Thermo Fisher Scientific | 4380204 | RNA extraction and isolation |
References
- UN Department of Economic and Social Affairs. Population Division 2019, World Population Prospects. UN Department of Economic and Social Affairs. , (2019).
- Anton, S., Leeuwenburgh, C. Fasting or caloric restriction for healthy aging. Experimental Gerontology. 48 (10), 1003-1005 (2013).
- Dziechciaż, M., Filip, R. Biological psychological and social determinants of old age: Bio-psycho-social aspects of human aging. Annals of Agricultural and Environmental Medicine. 21 (4), 835-838 (2014).
- Anton, S. D., et al. Flipping the metabolic switch: understanding and applying the health benefits of fasting. Obesity. 26 (2), 254-268 (2018).
- Fried, L. P., Guralnik, J. M. Disability in older adults: evidence regarding significance, etiology, and risk. Journal of the American Geriatrics Society. 45 (1), 92-100 (1997).
- Manini, T. Development of physical disability in older adults. Current Aging Science. 4 (3), 184-191 (2011).
- Chung, H. Y., et al. Molecular inflammation: underpinnings of aging and age-related diseases. Ageing Research Reviews. 8 (1), 18-30 (2009).
- Sun, N., Youle, R. J., Finkel, T. The mitochondrial basis of aging. Molecular Cell. 61 (5), 654-666 (2016).
- Tarasov, A. I., Griffiths, E. J., Rutter, G. A. Regulation of ATP production by mitochondrial Ca2. Cell Calcium. 52 (1), 28-35 (2012).
- Chistiakov, D. A., Sobenin, I. A., Revin, V. V., Orekhov, A. N., Bobryshev, Y. V. Mitochondrial aging and age-related dysfunction of mitochondria. Biomed Research International. 2014, 238463 (2014).
- Boengler, K., Kosiol, M., Mayr, M., Schulz, R., Rohrbach, S. Mitochondria and ageing: role in heart, skeletal muscle and adipose tissue. Journal of Cachexia, Sarcopenia, and Muscle. 8 (3), 349-369 (2017).
- Drew, B., et al. Effects of aging and caloric restriction on mitochondrial energy production in gastrocnemius muscle and heart. American Journal of Physiology Regulatory, Integrative and Comparative Physiology. 284 (2), R474-R480 (2003).
- Short, K. R., et al. Decline in skeletal muscle mitochondrial function with aging in humans. Proceedings of the National Academy of Sciences. 102 (15), 5618-5623 (2005).
- Musci, R. V., Hamilton, K. L., Miller, B. F. Targeting mitochondrial function and proteostasis to mitigate dynapenia. European Journal of Applied Physiology. 118 (1), 1-9 (2018).
- Picca, A., et al. Targeting mitochondrial quality control for treating sarcopenia: lessons from physical exercise. Expert Opinion on Therapeutic Targets. 23 (2), 153-160 (2019).
- Fernandez-Marcos, P. J., Auwerx, J. Regulation of PGC-1α, a nodal regulator of mitochondrial biogenesis. The American Journal of Clinical Nutrition. 93 (4), 884-890 (2011).
- Kim, Y., Triolo, M., Hood, D. A. Impact of aging and exercise on mitochondrial quality control in skeletal muscle. Oxidative Medicine and Cellular Longevity. 2017, 3165396 (2017).
- Wang, H., Hiatt, W. R., Barstow, T. J., Brass, E. P. Relationships between muscle mitochondrial DNA content, mitochondrial enzyme activity and oxidative capacity in man: alterations with disease. European Journal of Applied Physiology and Occupational Physiology. 80 (1), 22-27 (1999).
- Tian, Q., et al. Muscle mitochondrial energetics predicts mobility decline in well-functioning older adults: The baltimore longitudinal study of aging. Aging Cell. 21 (2), e13552 (2022).
- Sardon Puig, L., Valera-Alberni, M., Cantó, C., Pillon, N. J. Circadian rhythms and mitochondria: connecting the dots. Frontiers in Genetics. 9, 452 (2018).
- Gano, L. B., Patel, M., Rho, J. M. Ketogenic diets, mitochondria, and neurological diseases. Journal of Lipid Research. 55 (11), 2211-2228 (2014).
- Liesa, M., Shirihai, O. S. Mitochondrial dynamics in the regulation of nutrient utilization and energy expenditure. Cell Metabolism. 17 (4), 491-506 (2013).
- Lesnefsky, E. J., Chen, Q., Hoppel, C. L. Mitochondrial metabolism in aging heart. Circulation Research. 118 (10), 1593-1611 (2016).
- Hartman, M. L., et al. Relation of mitochondrial oxygen consumption in peripheral blood mononuclear cells to vascular function in type 2 diabetes mellitus. Vascular Medicine. 19 (1), 67-74 (2014).
- Mahapatra, G., et al. Blood-based bioenergetic profiling is related to differences in brain morphology in African Americans with Type 2 diabetes. Clinical Science. 132 (23), 2509-2518 (2018).
- Moore-Ede, M. C. Physiology of the circadian timing system: predictive versus reactive homeostasis. The American Journal of Physiology. 250 (5), R737-R752 (1986).
- Young, M. W. Life's 24-hour clock: molecular control of circadian rhythms in animal cells. Trends in Biochemical Sciences. 25 (12), 601-606 (2000).
- Yoo, S. H., et al. PERIOD2::LUCIFERASE real-time reporting of circadian dynamics reveals persistent circadian oscillations in mouse peripheral tissues. Proceedings of the National Academy of Sciences. 101 (15), 5339-5346 (2004).
- Zhang, R., Lahens, N. F., Ballance, H. I., Hughes, M. E., Hogenesch, J. B. A circadian gene expression atlas in mammals: implications for biology and medicine. Proceedings of the National Academy of Sciences. 111 (45), 16219-16224 (2014).
- de Goede, P., Wefers, J., Brombacher, E. C., Schrauwen, P., Kalsbeek, A. Circadian rhythms in mitochondrial respiration. Journal of Molecular Endocrinology. 60 (3), R115-R130 (2018).
- Hood, S., Amir, S. The aging clock: circadian rhythms and later life. The Journal of Clinical Investigation. 127 (2), 437-446 (2017).
- Sellix, M. T., et al. Aging differentially affects the re-entrainment response of central and peripheral circadian oscillators. The Journal of Neuroscience. 32 (46), 16193-16202 (2012).
- Sato, S., et al. Circadian reprogramming in the liver identifies metabolic pathways of aging. Cell. 170 (4), 664-677 (2017).
- Lundell, L. S., et al. et al. feeding alters lipid and amino acid metabolite rhythmicity without perturbing clock gene expression. Nature Communications. 11 (1), 4643 (2020).
- Perrin, L., et al. Transcriptomic analyses reveal rhythmic and CLOCK-driven pathways in human skeletal muscle. eLife. 7, e34114 (2018).
- Gutierrez-Monreal, M. A., Harmsen, J. -. F., Schrauwen, P., Esser, K. A. Ticking for metabolic health: the skeletal-muscle clocks. Obesity. 28, S46-S54 (2020).
- Wolff, C. A., et al. Defining the age-dependent and tissue-specific circadian transcriptome in male mice. bioRxiv. 42 (1), 111982 (2023).
- Wilson, D., Breen, L., Lord, J. M., Sapey, E. The challenges of muscle biopsy in a community based geriatric population. BMC Research Notes. 11 (1), 830 (2018).
- Ding, H., et al. Likelihood-based tests for detecting circadian rhythmicity and differential circadian patterns in transcriptomic applications. Briefings in Bioinformatics. 22 (6), 224 (2021).
- Ding, Z., Lamb, T. M., Boukhris, A., Porter, R., Bell-Pedersen, D. Circadian clock control of translation initiation factor eIF2α activity requires eIF2γ-dependent recruitment of rhythmic PPP-1 phosphatase in Neurospora crassa. mBio. 12 (3), e00871 (2021).
- Di Francesco, A., Di Germanio, C., Bernier, M., de Cabo, R. A time to fast. Science. 362 (6416), 770-775 (2018).
- Kalfalah, F., et al. Crosstalk of clock gene expression and autophagy in aging. Aging. 8 (9), 1876-1895 (2016).
- Psaty, B. M., et al. Assessing the use of medications in the elderly: methods and initial experience in the cardiovascular health study. Journal of Clinical Epidemiology. 45 (6), 683-692 (1992).
- van Moorsel, D., et al. Demonstration of a day-night rhythm in human skeletal muscle oxidative capacity. Molecular Metabolism. 5 (8), 635-645 (2016).
- Janssen, J. J. E., et al. Extracellular flux analyses reveal differences in mitochondrial PBMC metabolism between high-fit and low-fit females. American Journal of Physiology. Endocrinology and Metabolism. 322 (2), E141-E153 (2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved