Method Article
تجميعات الأوتار الهندسية للتحقيق في الحديث الخلوي في المرض والإصلاح
In This Article
Summary
هنا ، نقدم نظاما نموذجيا تجميعيا لتقليد الحديث الخلوي للوتر بين الأنسجة الأساسية للوتر الحامل وحجرة خارجية تحتوي على مجموعات الخلايا التي يتم تنشيطها بسبب المرض والإصابة. كحالة استخدام مهمة ، نوضح كيف يمكن نشر النظام لاستكشاف التنشيط المرتبط بالمرض للخلايا البطانية الخارجية.
Abstract
تمكن الأوتار من الحركة عن طريق نقل قوى العضلات إلى العظام. يعتمدون على نواة وترية صلبة تتكون من ألياف الكولاجين ومجموعات الخلايا اللحمية. يتم تضمين هذا القلب الحامل وتغذيته وإصلاحه بواسطة طبقة نسيجية تشبه الزليلي تتكون من حجرة الأوتار الخارجية. على الرغم من هذا التصميم المتطور ، فإن إصابات الأوتار شائعة ، ولا يزال العلاج السريري يعتمد على العلاج الطبيعي والجراحة. أدت القيود المفروضة على أنظمة النماذج التجريبية المتاحة إلى إبطاء تطوير علاجات جديدة معدلة للأمراض وأنظمة سريرية لمنع الانتكاس.
تقتصر الدراسات البشرية في الجسم الحي على مقارنة الأوتار السليمة بالأنسجة المريضة أو الممزقة في المرحلة النهائية التي تم أخذ عينات منها أثناء جراحة الإصلاح ولا تسمح بالدراسة الطولية لمرض الأوتار الأساسي. تقدم النماذج الحيوانية في الجسم الحي أيضا حدودا مهمة فيما يتعلق بالتعقيد الفسيولوجي غير الشفاف ، والعبء الأخلاقي على ، والتكاليف الاقتصادية الكبيرة المرتبطة باستخدامها. علاوة على ذلك ، فإن النماذج الحيوانية في الجسم الحي غير مناسبة بشكل جيد للفحص المنهجي للأدوية ومسارات التفاعل متعددة الخلايا والأنسجة المتعددة. كما أن أنظمة النماذج الأبسط في المختبر قد قصرت. أحد الأسباب الرئيسية هو الفشل في تكرار التحميل الميكانيكي ثلاثي الأبعاد بشكل كاف لدراسة خلايا الأوتار ووظيفتها بشكل هادف.
نظام نموذج 3D الجديد المعروض هنا يخفف من بعض هذه المشكلات من خلال استغلال النباتات الأساسية لوتر ذيل الفئران. الأهم من ذلك ، يمكن الوصول بسهولة إلى هذه النباتات بأعداد كبيرة من فأر واحد ، وتحتفظ بأنماط تحميل 3D في الموقع على المستوى الخلوي ، وتتميز بمصفوفة خارج الخلية تشبه الجسم الحي. في هذا البروتوكول ، يتم إعطاء تعليمات خطوة بخطوة حول كيفية زيادة زراعة الأوتار الأساسية باستخدام الهلاميات المائية الكولاجين المحملة بالخلايا البطانية المشتقة من العضلات ، والخلايا الليفية المشتقة من الأوتار ، والبلاعم المشتقة من نخاع العظام لتحل محل مجموعات الخلايا المنشطة للمرض والإصابة داخل حجرة الأوتار الخارجية. يوضح كيف يمكن تحدي تجمعات الأوتار الناتجة ميكانيكيا أو من خلال محفزات بيئية دقيقة محددة للتحقيق في الحديث المتبادل متعدد الخلايا الناشئ أثناء المرض والإصابة.
Introduction
في وظيفتها المتمثلة في نقل قوى العضلات إلى العظام لتمكين الحركة ، تواجه الأوتار بعضا من أشد الضغوط الميكانيكية التي تحدث في جسم الإنسان1،2،3. بسبب شيخوخة المجتمعات ، وزيادة انتشار السمنة ، وتزايد شعبية الأنشطة الرياضية التي تتطلب ميكانيكيا ، من المتوقع أن يرتفع انتشار أمراض الأوتار والإصابات في البلدان المتقدمة4،5،6. وقد أعاق تطوير نظم علاجية جديدة قائمة على الأدلة ومعدلة للأمراض لمكافحة هذه الزيادة بسبب القيود المفروضة على النظم النموذجيةالمتاحة حاليا 1،7،8.
من الناحية المثالية ، ستسمح نماذج إصلاح الأمراض والإصابات بدراسة كيفية معالجة العضو المستهدف لمجموعة محددة من معلمات الإدخال (تقليد محفزات المرض ، الجدول 1) في معلمات مخرجات قابلة للقياس (تمثل السمات المميزة للمرض ، الجدول 2) مع التحكم في العوامل المربكة. ومن شأن الدراسات التي تستخدم مثل هذه الأنظمة النموذجية أن تكون قادرة على تحديد العمليات الفسيولوجية (المرضية) الكامنة وراء إصلاح الأمراض والإصابات واكتساب المعرفة التي يمكن استغلالها لمنع أو تقليل السمات المميزة للأمراض والإصابات في العيادات. بتطبيق هذا المبدأ على الأوتار ، يجب أن يلخص نظام نموذجي مفيد الأجزاء المركزية من استجابة الأوتار في الجسم الحي للمرض والإصابة ، والتي تشمل السمات المميزة التالية: الضرر الدقيق ، الالتهاب ، الأوعية الدموية الجديدة ، فرط الخلايا الخلوية ، دوران المصفوفة المتسارع ، وإلغاء التقسيم9،10،11،12،13،14،15. باستخدام هذه السمات المميزة كأساس ، يمكن استنتاج المتطلبات التالية لنظام نموذج إصلاح مرض الأوتار والإصابات الناجح.
يفترض أن يكون التحميل الزائد الميكانيكي عاملا مركزيا في إصابة الأوتار والتسبب في المرض ، وبالتالي فهو نهج تجريبي شائع الاستخدام لإنشاء تلف دقيق16. وبالتالي ، فإن قابلية التحميل الميكانيكية التي يمكن التحكم فيها هي شرط أساسي لنماذج إصلاح أمراض الأوتار والإصابات. من الناحية المثالية ، يتيح نظام الطراز ثلاثة أوضاع رئيسية: التحميل الفردي للتمدد إلى التلف ، وتحميل التعب ، والتفريغ8،17،18. عند التشوه الميكانيكي ، تواجه الخلايا المقيمة في الأنسجة مزيجا معقدا من قوى الشد وقوى القص (بسبب انزلاق ألياف الكولاجين المحيطة بالخلايا) وقوى الضغط التي تحدث أثناء التفريغ أو بالقرب من التفريغ19,20. يجب أن تعيد الأنظمة النموذجية إنشاء أنماط التحميل المعقدة هذه قدر الإمكان.
هناك طريقة بديلة لإدخال الضرر الدقيق للمصفوفة وهي الاستفادة من الضغوطات الكيميائية الحيوية التي تحاكي الاستعدادات الجهازية لأمراض الأوتار والإصابات ، مثل السيتوكينات الالتهابية (المؤيدة) ، أو الإجهاد التأكسدي ، أو تركيزات الجلوكوزالعالية 21،22،23. وبالتالي ، فإن البيئة المكروية المتخصصة التي يمكن التحكم فيها مفيدة لنظام نموذج إصلاح أمراض الأوتار والإصابات.
الشرط الأساسي الشائع للأنظمة النموذجية لتكون قادرة على تلخيص الالتهاب والأوعية الدموية الجديدة وفرط الخلية هو الوجود الانتقائي لمجموعات الخلايا التي تقود هذه العمليات24. بالنسبة للعمليات الالتهابية ، تشمل هذه المجموعات العدلات والخلايا التائية والبلاعم ، بينما ستكون هناك حاجة إلى الخلايا البطانية والخلايا المحيطة لدراسة الأوعية الدموية الجديدة25،26،27،28،29. الخلايا الليفية الأوتارية ليست حيوية فقط لإصلاح الأوتار ، ولكن ، كخلايا تكاثرية ومهاجرة ، مسؤولة جزئيا أيضا عن فرط الخلية المحلي الذي لوحظ في مرض الأوتار30،31،32،33،34،35،36.
إلى جانب التغيرات في مجموعات الخلايا المقيمة ، يتم تغيير تكوين مصفوفة الأوتار في أمراض الأوتار والإصابة أيضا7،37،38،39،40. لتقديم الإشارات البيئية الدقيقة الصحيحة ذات الصلة بالمرض ، يجب أن تكون الأنظمة النموذجية قادرة على دمج تركيبة مصفوفة خارج الخلية تتوافق مع مرحلة المرض أو الإصابة المستهدفة ، على سبيل المثال ، من خلال تمكين التوليفات النسبية ذات الصلة من الكولاجين -1 والكولاجين -3 والفبرونيكتينالخلوي 41.
يعد تقسيم الأوتار السليمة إلى قلب الأوتار والمقصورات الخارجية (أي الإندوتينون والإبيتينون والباراتينون) أمرا أساسيا لوظيفتها وغالبا ما ينزعج في الأوتار المريضة أو المصابة1،42،43،44،45،46،47. وبالتالي ، فإن دمج تجزئة الأوتار ثلاثية الأبعاد في أنظمة نموذج الأوتار ليس مطلوبا فقط لمحاكاة العمليات الكامنة وراء إزالة وإعادة التقسيم عن كثب ، بل يساعد أيضا في إنشاء التدرجات الزمانية المكانية الصحيحة للسيتوكينات والمواد المغذية48,49.
أخيرا ، تعد النمطية أحد الأصول المركزية الأخرى لأنظمة النماذج ، مما يسمح للباحثين بالجمع بين المساهمة النسبية الصحيحة والتفاعل بين الضغوطات الموصوفة سابقا أثناء العمليات التي تم التحقيق فيها 8,17.
إلى جانب اختيار طرائق الإدخال المثلى ، تتمثل إحدى الخطوات المهمة في القدرة على قياس ومراقبة وتتبع التغييرات في المخرجات الناتجة. تعتبر الخواص الميكانيكية للنظام النموذجي (أي طول منطقة إصبع القدم ، ومعامل المرونة الخطي ، والحد الأقصى لإجهاد الشد ، والحد الأقصى لإجهاد الشد ، وقوة التعب ، واسترخاء الإجهاد) أساسية هنا ، لأنها تميز الوظيفة الرئيسية للوتر50،51،52. لربط هذه التغييرات الوظيفية بالتغيرات على مستوى الأنسجة ، من المهم تمكين طرق الكشف عن تلف المصفوفة الهيكلية (الكولاجين) وتتبع انتشار وتجنيد مجموعات الخلايا ذات الصلة بالمرض والإصلاح30،53،54،55،56،57،58،59،60.
لدراسة الحديث المتبادل بين الخلايا الخلوية ومصفوفة الخلايا الناشئة ، يجب أن يكون المرء قادرا على عزل أو تمييز البروتينات بكميات كافية للقياس الكمي (على سبيل المثال ، ELISA ، البروتينات ، الكيمياء الهيستولوجية المناعية ، قياس التدفق الخلوي)14،21،61،62. يجب أن يكون تحليل التعبير الجيني الخاص بالسكان أو على الأقل المقصورة ممكنا أيضا (أي فرز الخلايا المنشطة بالفلورة [FACS] ، وتسلسل الحمض النووي الريبي أحادي الخلية / السائبة ، وتفاعل البلمرة المتسلسل الكمي في الوقت الفعلي (RT-qPCR))21،24،27،63. يجب أن يسمح النظام النموذجي بقياس أكبر عدد ممكن من معلمات الإخراج المذكورة أعلاه على نفس العينة وعلى عينات متعددة بطريقة سريعة بما يكفي لفتح دراسات عالية الإنتاجية.
من بين الأنظمة النموذجية المتاحة حاليا لدراسة أمراض الأوتار البشرية وإصلاح الإصابات ، فإن جسم الإنسان نفسه هو ، بالطبع ، الأكثر تمثيلا. كما أنه الأقل توافقا مع التدخل التجريبي. في حين أن المرضى الذين يعانون من إصابات الأوتار الحادة متاحون بكثرة للدراسات السريرية ، فإن المرضى الذين يعانون من اعتلال الأوتار المبكر (مرض الأوتار الأكثر شيوعا) لا يعانون من أعراض إلى حد كبير وغالبا ما لا يتم اكتشافهم سريريا حتى تظهر تغييرات أكثر حدة14،64،65. هذا يجعل من الصعب تحديد اللحظة الحرجة عندما يخرج توازن الأوتار عن مساره والآليات الكامنة وراء هذا الانحراف16،66،67،68،69. بالإضافة إلى ذلك ، فإن استخراج الخزعات من الأوتار السليمة يمثل تحديا أخلاقيا ، لأنه قد يؤدي إلى ضرر مستمر. غالبا ما تستخدم بقايا أوتار أوتار الركبة من جراحة إعادة بناء الرباط الصليبي الأمامي كعناصر تحكم صحية ولكن يمكن القول إنها تختلف في الوظيفة والخصائص الميكانيكية ومجموعات الخلايا وتكوين المصفوفة مقارنة بالكفة المدورة والعرقوب والأوتار الرضفية التي تتأثر عادة بمرض الأوتار والإصابة70،71،72،73.
يمكن الوصول إلى النماذج الحيوانية في الجسم الحي وسهولة الوصول إليها ، لكن استخدامها يفرض عبئا أخلاقيا كبيرا على وتكلفة اقتصادية على الباحثين. بالإضافة إلى ذلك ، فإن معظم النموذجية الشائعة إما لا تصاب بآفات الأوتار تلقائيا (أي الجرذان والفئران والأرانب) أو تفتقر إلى البادئات والسلالات المعدلة وراثيا اللازمة لتتبع مسارات الاتصال متعددة الخلايا المشاركة فيها (مثل الخيول والأرانب).
تقع أنظمة النماذج 2D البسيطة في المختبر على الجانب الآخر من طيف التعقيد / قابلية السحب وتسمح بشكل أفضل بدراسة محكومة وفعالة من حيث الوقت لمسارات اتصال محددة بين الخلايا استجابة لمجموعة أكثر قابلية للتحكم من المشغلات 8,74. ومع ذلك ، فإن هذه الأنظمة المبسطة تفشل عادة في تلخيص الحمل الميكانيكي متعدد الأبعاد (أي الشد والضغط والقص) الذي يعد أمرا أساسيا لوظيفة الأوتار. بالإضافة إلى ذلك ، تميل الصلابة العالية (أيضا) لبلاستيك زراعة الأنسجة إلى تجاوز أي إشارات مصفوفة توفرها الطلاءات التي تهدف إلى تقليد حالة المرض محل الاهتمام75,76.
للتغلب على هذا العيب ، تم تطوير أنظمة نموذج 3D متطورة بشكل متزايد لتوفير مصفوفة قابلة للتحميل يمكن على الأقل مطابقة تكوينها جزئيا لحالة المرض المطلوبة77،78،79. ومع ذلك ، فإن هذه الأنظمة لا تكافح فقط لتكرار تركيبات المصفوفة خارج الخلية المعقدة في الجسم الحي وأنماط التحميل الخلوي بدقة ولكنها تفتقر عموما إلى قابلية التحميل على المدى الطويل والواجهات المجزأة المطلوبة لدراسة مسارات الاتصال عبر الأجزاء التي تنسق إصلاح أمراض الأوتاروالإصابات 48،49،80.
تتمتع أنظمة نموذج زراعة الأوتار خارج الجسم الحي بميزة واضحة تتمثل في تكوين مصفوفة مدمجة تشبه الجسم الحي والتي تضم منافذ حول الخلية ، وحواجز متقاطعة ، بالإضافة إلى تدرجات السيتوكين / المغذيات الزمانية المكانية وتلخص أنماط التحميل المعقدة عند التمدد8. نتيجة لحدود انتشار المغذيات المعتمدة على الحجم ، يصعب الحفاظ على النباتات من النماذج الحيوانية الأكبر (أي الخيول) على قيد الحياة للدراسة طويلة الأجل لأمراض الأوتار وإصلاح الإصابات81،82،83. وفي الوقت نفسه ، فإن النباتات الصغيرة من أنواع الفئران (مثل وتر العرقوب والوتر الرضفي) تمثل تحديا للتثبيت بشكل متكرر والتحميل الميكانيكي. يحد حجمها أيضا من كمية المواد التي يمكن جمعها للقراءات على مستوى الخلية والبروتين والجينات دون تجميع العينات وتقليل الإنتاجية. وبهذا المعنى ، توفر كراسات وتر ذيل الفئران إمكانية فتح دراسة عالية الإنتاجية لأمراض الأوتار وإصلاح الإصابات لأنها متوفرة بسهولة بكميات كبيرة من فأر واحد ، والحفاظ على تكوين المصفوفة المحيطة بالخلية المعقدة في الجسم الحي ، وتلخيص أنماط التحميل الخلوي. ومع ذلك ، أثناء عملية الاستخراج ، يفقدون معظم مقصورتهم الخارجية ويحتوي على مجموعات من الأوعية الدموية والمناعة والخلايا الليفية التي تعتبر الآن أنها تؤدي إلى مرض الأوتار وإصلاح 8,18.
لسد هذه الفجوة ، تم تطوير نظام نموذجي يجمع بين مزايا النباتات الأساسية المشتقة من وتر ذيل الفئران مع مزايا أنظمة النماذج القائمة على هيدروجيل 3D. يتكون هذا النظام النموذجي من هيدروجيل محمل بالخلايا (الكولاجين -1) مصبوب حول وتر الذيل يزرع84,85. في هذه الورقة ، يتم توفير خطوات التصنيع اللازمة بالتفصيل جنبا إلى جنب مع القراءات المفيدة التي يمكن الحصول عليها عن طريق الزراعة المشتركة للنباتات الأساسية (المقصورة الداخلية) داخل هيدروجيل الكولاجين من النوع 1 المحمل بالخلايا البطانية (المقصورة الخارجية).
Protocol
تمت الموافقة على جميع الطرق الموضحة هنا من قبل السلطات المسؤولة (أرقام ترخيص كانتون زيورخ ZH104-18 و ZH058-21). يتم تقديم نظرة عامة في الشكل 1.
1. عزل مكونات تجميع الأوتار من الفئران البالغة من العمر 12-15 أسبوعا (أي B6 / J-Rj)
- القتل الرحيم للفئران من خلال الاختناق الناجم عن غاز CO2 . لتحقيق أقصى قدر من الغلة ، لا تقم بمعالجة أكثر من 3 فئران في وقت واحد والمضي قدما في عزل الخلية مباشرة بعد القتل الرحيم.
- ضمان الوفاة عن طريق الحث الثنائي لاسترواح الصدر.
- تعقيم جلد الفأر بنسبة 80 ٪ من الإيثانول ونقل الماوس إلى غطاء السلامة البيولوجية المعقمة.
- عزل النباتات الأساسية لوتر الذيل.
- استخدم مشرطا (رقم 21) لفصل الذيل عن الفأر عن طريق قصه عند قاعدته.
- بدءا من طرف الذيل ، امسكه بالملاقط وتذبذبه لكسر الجلد. ثم اسحب الملقط برفق بعيدا عن الذيل لفضح نباتات قلب الأوتار.
- ضع نباتات قلب الوتر في وسط الاستزراع القياسي (DMEM / F12 + 10٪ FBS + 1٪ بنسلين / ستربتومايسين + 1٪ أمفوتريسين + 1٪ أحماض أمينية غير أساسية) وافصلها عن جزء الذيل المسحوب باستخدام شفرة مشرط جديدة (رقم 21).
- كرر الخطوات 1.4.2. و 1.4.3. حتى تتم معالجة الذيل بالكامل وتصبح نباتات الأوتار أقصر من 25 مم.
- قطع النوى المعزولة إلى قطع بطول 25 مم باستخدام شفرة مشرط جديدة (رقم 21).
- قم بقياس متوسط قطر النباتات الأساسية باستخدام مجهر ضوئي متصل ببرنامج تحليل الصور عبر كاميرا C-mount رقمية قابلة للتوصيل.
- استخدم النقطة وانقر لتحديد أداة قياس الخط على الجانب الأيمن.
- قم بقياس قطر الزرع في ثلاثة مواقع مختلفة واحسب متوسط قطرها.
- لتسهيل التثبيت والاختبار الميكانيكي لاحقا ، تابع فقط مع النباتات الأساسية التي يبلغ متوسط قطرها أكبر من 100 ميكرومتر.
- التفريغ جنبا إلى جنب مع العرض لظروف الاستزراع القياسية (37 درجة مئوية ، 20٪ O2 ، مكملات المصل) يغير التعبير الجيني في غضون 6 ساعات بعد العزل ويؤدي إلى التدهور في غضون 7 أيام21. لتبدأ بحالة شبه استتبابية ، قم بإنتاج مجموعات الأوتار وابدأ التجارب مباشرة بعد عزل قلب الوتر.
- اعتمادا على الإعداد التجريبي ، يلزم وجود نباتات أساسية للوتر غير الحيوية كمجموعة تحكم. لتنشيط نباتات الأوتار الأساسية ، قم بتجميدها في وعاء صغير مملوء بالنيتروجين السائل لمدة 5 ثوان باستخدام ملاقط ثم قم بإذابتها لمدة 5 ثوان في درجة حرارة الغرفة (RT). كرر دورة التجميد والذوبان هذه 3 مرات وتابع الخطوة 4 ("تثبيت النباتات الأساسية").
تنبيه: يمكن أن يسبب النيتروجين السائل حروقا باردة واختناقا وتقصفا للعديد من المواد العادية. استخدم فقط الحاويات المصممة للسوائل ذات درجات الحرارة المنخفضة وارتد ملابس واقية (مثل واقي الوجه والقفازات المناسبة والأحذية المغلقة).
- عزل الخلايا الليفية الوترية.
- استخدم مشرطا (رقم 21) لعمل شق عرضي في منتصف قدم الفأر. قم بعمل قطعتين عموديتين على القدم على طول جانبي الساقين الخلفيتين وحتى الوركين من كل طرف من طرفي هذا الشق.
- استخدم الملقط لتثبيت رفرف الجلد المقطوع عند القدم وتقشير الجلد الذي يغطي عضلات ربلة الساق. عند عزل الخلايا البطانية من نفس الفأر ، قم بإزالة كل الجلد بدلا من ذلك.
- افصل وتر العرقوب عن عظم العقبي بشفرة مشرط جديدة (رقم 21). ثبت الطرف الفضفاض لوتر العرقوب بالملاقط وافصل الطرف الآخر عن عضلة الساق.
- اغسل وتر العرقوب مرة واحدة في برنامج تلفزيوني واستخدم المشرط (رقم 21) لإزالة جميع الأنسجة العضلية المتبقية حتى يبقى نسيج الوتر الأبيض فقط. إذا تم عزل الخلايا البطانية من نفس الماوس ، اترك وتر العرقوب في PBS واستمر في الخطوة 1.6. أولا.
- تجمع أوتار العرقوب من واحد في أنبوب بلاستيكي سعة 15 مل يحتوي على 10 مل من وسط هضم الأوتار (DMEM / F12 + 1٪ بنسلين / ستربتومايسين + 1٪ أمفوتريسين + 2 مجم / مل كولاجيناز 1) وهضمها لمدة 6-8 ساعات عند 37 درجة مئوية تحت التحريك البطيء والمستمر باستخدام شاكر مداري منخفض السرعة عند 15 دورة في الدقيقة.
- قم بالطرد المركزي لمحلول الأوتار المهضومة عند 500 × جم لمدة 5 دقائق في RT ، واستنشق المادة الطافية ، وأعد تعليقها في 8 مل من وسط الاستزراع القياسي (DMEM / F12 + 10٪ FBS + 1٪ بنسلين / ستربتومايسين + 1٪ أمفوتريسين + 1٪ أحماض أمينية غير أساسية) ، وزرع في دورق ثقافة T25 في ظل ظروف الثقافة القياسية (37 درجة مئوية ، 20٪ O2) لمدة 7 أيام دون تغيير الوسائط. بعد ذلك ، قم بتغيير الوسائط مرة واحدة في الأسبوع.
- قسم الخلايا عند التقاء 80٪ إلى دورق ثقافة T150 (1: 6). قم بتجميد الخلايا عند مرور 2 في 2 مل من وسط التجميد المصفى المعقم (70٪ DMEM / F12 + 20٪ FBS + 10٪ DMSO) موزعة على أنبوبين باردين سعة 1.5 مل واحتفظ بهما عند -80 درجة مئوية حتى استخدام آخر. استخدم التربسين لإزالة الخلايا من بلاستيك زراعة الأنسجة.
- عزل الخلايا البطانية المشتقة من العضلات.
- إذا لم يتم عزل الخلايا الليفية الوترية من نفس الفأر ، فابدأ بالخطوتين 1.5.1 و 1.5.2.
- استخدم المقص لفصل الساقين الخلفيتين عن الجسم عن طريق قطع مفصل الورك.
- اغسل الأرجل الخلفية مرة واحدة في برنامج تلفزيوني بارد (~ 4 درجة مئوية) ، وأزل العضلات (عضلات الفخذ الرباعية ، والباسطة ديجيتوروم لونجوس ، ونعل ، و gastrocnemius) بمشرط (رقم 21) ، وضع العضلات في طبق بتري على الثلج.
- استخدم شفرة مشرط جديدة (رقم 21) لفرم الأنسجة العضلية إلى قطع أصغر من 1 مم3 مع الاحتفاظ بطبق بتري على الجليد.
- اجمع الأنسجة العضلية المفرومة من كلا الساقين الخلفيتين في أنبوب بلاستيكي سعة 50 مل يحتوي على 12.5 مل من وسط هضم العضلات (PBS + 2 مجم / مل كولاجيناز IV + 2 مجم / مل ديسباز II + 2 مللي مول CaCl2).
- ضع الأنبوب البلاستيكي في حمام مائي على حرارة 37 درجة مئوية لمدة 10 دقائق. هز المحلول بقوة وضعه مرة أخرى لمدة 10 دقائق أخرى. كرر حتى يبدو المحلول متجانسا وتبقى فقط قطع (بيضاء) من الأوتار واللفافة (حوالي 4 × 10 دقائق). في هذه الأثناء ، استمر في عزل الخلايا الليفية الوترية أو عزل البلاعم.
- أضف 12.5 مل من برنامج تلفزيوني بارد + 10٪ FBS إلى الأنبوب البلاستيكي لإيقاف عملية الهضم.
- استخدم حامل ماصة يعمل بالبطارية ومجهز بماصة سعة 50 مل لشفط التعليق من الأنبوب البلاستيكي. جهز الأنبوب البلاستيكي بمصفاة خلية 400 ميكرومتر وقم بتصفية التعليق لإزالة الحطام. كرر العملية باستخدام مصفاة خلية 100 ميكرومتر.
- أجهزة الطرد المركزي التعليق المصفى عند 400 × جم لمدة 5 دقائق في RT. أعد التعليق في 10 مل من PBS البارد + 10٪ FBS وأجهزة الطرد المركزي مرة أخرى.
- يعاد التعليق في 8 مل من وسط الاستزراع البطاني (خليط 1: 1 من DMEM / F12 ومجموعة endopan 3 + 10 وحدة / مل من الهيبارين + 20٪ FBS + 1٪ بنسلين / ستربتومايسين + 1٪ أمفوتريسين + 30 مجم / مل مكمل النمو البطاني) المكمل بالبوروميسين (4 مجم / مل) لاختيار السكان.
- قم بزرع الخلايا من فأر واحد في دورق مزرعة T25 واحد تم تغطيته مسبقا ب 2 مل من محلول جيلاتيني معقم بنسبة 0.2٪ لمدة ساعتين عند 37 درجة مئوية ثم جفف طوال الليل في RT بعد إزالة المحلول الزائد. تحضير القوارير في اليوم السابق للعزلة.
- بعد 24 ساعة في ظروف الاستزراع القياسية (37 درجة مئوية ، 20٪ O2) ، قم بإزالة وسط مكمل البوروميسين ، واغسل الخلايا المرفقة مرة واحدة باستخدام برنامج تلفزيوني ، واستزرعها في 8 مل من وسط الثقافة البطانية.
- قم بتمرير الخلايا بنسبة 1: 5 عند التقاء 80٪ في قوارير مغلفة بالجيلاتين واستخدمها في التجارب حتى P2. استخدم محلول انفصال الخلايا بخلاف التربسين (جدول المواد) لإزالة الخلايا من بلاستيك زراعة الأنسجة وعدم تجميدها.
- عزل البلاعم المشتقة من نخاع العظم.
- إذا لم يتم عزل الخلايا الليفية الوترية أو الخلايا البطانية من نفس الفأر ، فقم بتنفيذ الخطوات 1.5.1 و 1.5.2 و 1.6.2 و 1.6.3 أولا.
- بعد إزالة الجلد والوتر والأنسجة العضلية ، اغسل العظام المتبقية (عظم الفخذ والساق) مرة واحدة في برنامج تلفزيوني بارد (~ 4 درجة مئوية).
- ضع العظام في برنامج تلفزيوني بارد طازج (~ 4 درجة مئوية) واستخدم مشرطا (رقم 21) لقطع المشاش تدريجيا حتى ينكشف نخاع العظم. يظهر كنقطة حمراء على جانبي العظم.
- جهز حقنة بإبرة حقن 0.4 مم × 25 مم (G27) واملأها ب 10 مل من وسط زراعة البلاعم (DMEM / F12 + 10٪ FBS + 1٪ بنسلين / ستربتومايسين + 1٪ أمفوتريسين + 1٪ أحماض أمينية غير أساسية).
- أمسك عظمة تلو الأخرى فوق أنبوب بلاستيكي سعة 50 مل ، وأدخل إبرة الحقن بعمق حوالي 1 مم في نخاع العظم المكشوف في الأعلى ، واطرد نخاع العظم عن طريق إفراغ المحقنة. يظهر نخاع العظم المتدفق كهيكل يشبه الأنبوب المحمر عند تعليقه في الوسط.
- قم بإذابة نخاع العظم عن طريق سحبه برفق لأعلى ولأسفل بشكل متكرر باستخدام طرف ماصة سعة 1 مل. استخدم حامل ماصة يعمل بالبطارية ومجهز بماصة سعة 50 مل لتصفية تعليق الخلية من خلال مصفاة خلية 100 ميكرومتر مرة أخرى في الأنبوب البلاستيكي سعة 50 مل وجهاز طرد مركزي عند 350 × جم لمدة 5 دقائق في RT.
- قم بإزالة المادة الطافية ، وأعد تعليق الحبيبات في محلول تحلل خلايا الدم الحمراء (RBC) سعة 10 مل ، وأجهزة الطرد المركزي مرة أخرى عند 350 × جم لمدة 10 دقائق في درجة حرارة الغرفة.
- أعد تعليق الحبيبات في 5 مل من وسط زراعة البلاعم (DMEM / F12 + 10٪ FBS + 1٪ بنسلين / ستربتومايسين + 1٪ أمفوتريسين + 1٪ أحماض أمينية غير أساسية) وزرعها في أطباق بتري غير معالجة بقطر 100 مم (5-8 × 106 خلايا لكل طبق).
- بعد 4 ساعات ، أضف 5 مل من وسط زراعة البلاعم المكمل بعامل تحفيز مستعمرة البلاعم 40 نانوغرام / مل (m-CSF) إلى وسط زراعة الخلايا بدون m-CSF (خليط 1: 1) للوصول إلى تركيز نهائي قدره 20 نانوغرام / مل m-CSF.
- بعد 6 أيام ، استخدم الخلايا في التجارب أو قم بتجميدها حتى الاستخدام مرة أخرى. استخدم محلول انفصال الخلايا بخلاف التربسين (جدول المواد) لإزالة الخلايا من بلاستيك زراعة الأنسجة.
ملاحظة: بمجرد عزلها ، لم تعد الخلايا تتوسع. تعمل طرق عزل الخلايا الموصوفة هنا أيضا مع الفئران والجرذان خارج النطاق العمري المشار إليه.
- للتحقق من النمط الظاهري لمجموعات الخلايا المعزولة باستخدام قياس التدفق الخلوي ، تابع الخطوة 6.3.4.
2. عزل الكولاجين من فئران Wistar أو Sprague-Dawley
- اتبع بروتوكول العزل الموصوف بالتفصيل في مكان آخر86. كما أنه يعمل مع الفئران ، وإن كان مع عائد أقل بكثير.
- تحديد تركيز المحلول الناتج باستخدام مقايسة هيدروكسي برولين ، وتقييم النقاء باستخدام SDS-page ، وتخزين المحلول عند 4 درجات مئوية حتى الاستخدام في التجارب.
3. إنتاج مكونات نظام الاستزراع
- 3D-طباعة حاملي المشبك ، ومحطة التركيب ، وقوالب الغرفة.
- قم بتحميل ملف .stl المرفق (الملف التكميلي 1) لحوامل المشابك ومحطة التركيب وقوالب الحجرة في برنامج التقطيع. لتكييف أرقام الكائنات كما هو مطلوب ، استخدم النقطة وانقر لتحديد الكائنات والنسخ واللصق لضربها.
- اضغط على تصدير رمز G (Ctrl-R) لإنشاء رمز G ثم تصديره (Ctrl-G).
- قم بتحميل رمز G في طابعة 3D.
- استخدم خيوطا غير ملونة ومتوافقة حيويا لعملية الطباعة (أي حمض اللبنيك).
- قم بقطع خيوط 3 مم في فتحات حامل المشبك الذي سيحمل البراغي باستخدام قاطع الخيط (الملف التكميلي 2 والملف التكميلي 3 ، الثقوب 1 و 3).
- ضع دبابيس وتد من الفولاذ المقاوم للصدأ في الفتحة الموجودة في الجزء الخلفي من حامل المشبك (الملف التكميلي 2 والملف التكميلي 3 ، الفتحة 4).
- تعقيم حوامل المشبك ومحطة التركيب بضوء الأشعة فوق البنفسجية لمدة 1 ساعة على الأقل قبل الاستخدام. لا تعيد استخدام حوامل المشابك المطبوعة 3D.
- بدلا من ذلك ، قم بإنتاج حوامل المشابك ومحطة التركيب باستخدام البولي إيثريميد باستخدام الخطط المرفقة (الملف التكميلي 2 ، الملف التكميلي 3 ، والملف التكميلي 4) ، وهو أغلى ثمنا ولكنه يتيح طرق تعقيم أفضل (أي التعقيم) والاستخدام المتكرر.
- صب الغرف باستخدام قوالب 3D المطبوعة.
- املأ قوالب الغرفة بالسيليكون.
- قم بإزالة السيليكون في غرفة مفرغة (90 ملي بار) لمدة 30 دقيقة.
- دع المحلول يتبلمر عند RT طوال الليل أو على لوح تسخين عند 70 درجة مئوية لمدة 1 ساعة ، اعتمادا على مقاومة الحرارة للخيوط المستخدمة في القوالب.
- قم بإزالة الغرف المبلمرة بعناية من القوالب وقطع السيليكون الزائد بمشرط (رقم 21).
- اختياري: إذا تم تحميل التجميعات ، وبالتالي الغرف المحيطة بها ميكانيكيا ، فقم بتعزيز الثقوب الموجودة في غرف السيليكون بأنابيب مجوفة مصنوعة من الفولاذ المقاوم للصدأ.
- قم بتصنيع المشابك المعدنية من الفولاذ المقاوم للصدأ باستخدام المخطط المرفق (الملف التكميلي 5).
- قبل كل استخدام ، اغسل المشابك المصنوعة من الفولاذ المقاوم للصدأ ، وحوامل مشبك البولي إيثريميد ، والبراغي ، وغرفة السيليكون.
- Sonicate لمدة 10 دقائق في 80٪ إيثانول (EtOH) و 20٪ ماء تناضح عكسي (ROW).
- سونيكات لمدة 10 دقائق في 50٪ EtOH و 50٪ إيزوبروبانول.
- شطف 3x مع ROW.
- Sonicate لمدة 10 دقائق في تركيز التنظيف القلوي 0.5٪ (أي 3 مل في 600 مل من ROW).
- Sonicate لمدة 10 دقائق في تركيز التنظيف القلوي 0.5٪.
- اتركيه في مركز تنظيف قلوي 0.5٪ أثناء رجه لمدة 1 ساعة و 50 دقيقة.
- شطف 3x مع ROW.
- سونيكات لمدة 10 دقائق في ROW.
- قم بتجفيف المكونات في الهواء وتعقيمها.
4. لقط النباتات الأساسية
- ضع حوامل المشابك المطابقة مع مشبك معدني واحد في محطة التثبيت.
- ضع قطعا ورقية معقمة مبللة (4 مم × 25 مم) فوق المشابك المعدنية ثم اقطع الورق على طول الحدود الداخلية للمشابك بمشرط (رقم 21). اقطع قطعتين ورقيتين إضافيتين أصغر (4 مم × 1.5 مم) من قطعة ورقية أخرى واحتفظ بها رطبة.
- باستخدام ملاقط مدببة ، ضع 8 نباتات أساسية على الورق بين المشابك المعدنية مع نقاط نهايتها على المشابك المعدنية.
- قم بتغطية نقاط نهاية النباتات الأساسية بقطع الورق الأصغر الجاهزة (4 مم × 1.5 مم) ثم ضع المشابك المعدنية فوقها. استخدم مفك البراغي والبراغي الصغيرة (M3 x 6 مم) لتثبيت التركيبات الأساسية بين المشابك المعدنية وحامل المشبك.
- انقل بعناية النباتات الأساسية المثبتة إلى غرف زراعة السيليكون واملأ هذه الغرف ب 2 مل من وسط زراعة الخلايا القياسي (DMEM / F12 + 10٪ FBS + 1٪ بنسلين / ستربتومايسين + 1٪ أمفوتريسين + 1٪ أحماض أمينية غير أساسية).
- اختياري: إذا كان سيتم تحميل التجميعات / الغرف المحيطة ميكانيكيا ، فقم بتثبيتها بمسامير إضافية (M3 × 16 مم) في الفتحة 3 (الملف التكميلي 2 والملف التكميلي 3 ، الفتحة 3).
5. إعداد هيدروجيل الكولاجين والصب
- قم بإزالة الخلايا المستهدفة من بلاستيك زراعة الأنسجة بمحلول انفصال الخلايا ، وقم بطردها مركزيا عند 400 × جم لمدة 5 دقائق في RT ، وأعد تعليقها في 1 مل من وسط الاستزراع القياسي.
- بالنسبة لتجميع واحد ، يلزم 10 ميكرولتر PBS (20x) ، 1.28 ميكرولتر من 1 M NaOH (125x) ، 8.72 ميكرولتر من الماء المقطر المزدوج (ddH2O ، 23x) ، 80 ميكرولتر من الكولاجين -1 (2.5x أو 1.6 مجم / مل نهائي) ، و 100 ميكرولتر (2x) من وسائط الاستزراع القياسية (للتجمعات الأساسية // الخالية من الخلايا) أو تعليق الخلية. تحضير هذه المكونات في حلين منفصلين ومزجها مباشرة قبل الصب.
- حل التشابك: قم بتجميع PBS و NaOH و ddH20 وتعليق الخلية لما يصل إلى 12 مجموعة (+ 10٪ هامش أمان) في محلول متشابك واحتفظ به في أنبوب بلاستيكي سعة 15 مل على الجليد. اضبط تركيز معلق الخلية لتحقيق التركيزات النهائية التالية بعد خلط المحلولين: 250000 خلية / مللي لتر من الخلايا الليفية الوترية ، أو 500000 خلية / مل من الخلايا البطانية المشتقة من العضلات ، أو 370000 خلية / مل من الضامة المشتقة من نخاع العظام.
- محلول الكولاجين -1: قم بتجميع محلول الكولاجين -1 المطلوب لما يصل إلى 12 مجموعة (+ 10٪ هامش أمان) في أنبوب بلاستيكي آخر سعة 15 مل واحتفظ به على الجليد.
- بمجرد أن يصبح محلول التشابك ومحلول الكولاجين -1 جاهزين على الجليد ، قم باستنشاق وسط زراعة الخلايا من غرف الاستزراع التي تحتوي على النباتات الأساسية المثبتة.
- أضف محلول الكولاجين -1 إلى محلول التشابك باستخدام ماصة سعة 1000 ميكرولتر وامزج المحلولين عن طريق السحب لأعلى ولأسفل بسرعة دون إنشاء فقاعات. قم بتغطية نباتات قلب الأوتار الفردية ب 200 ميكرولتر من المحلول المختلط عن طريق سحبه في البساتين التي توفرها غرف السيليكون.
- دع الهلاميات المائية تتبلمر لمدة 50 دقيقة عند 37 درجة مئوية.
- املأ غرف زراعة السيليكون بعناية ب 1.5 مل من وسط الاستزراع المشترك المعني عن طريق سحبه في زوايا الغرف.
- للاستزراع المشترك للخلايا الليفية الأساسية // ، املأ DMEM / F12 ، 10٪ FBS ، 1٪ أحماض أمينية غير أساسية ، 1٪ بنسلين / ستربتومايسين ، 1٪ أمفوتريسين ، 200 ميكرومتر حمض الأسكوربيك ، 20 نانوغرام / مل عامل تحفيز مستعمرة البلاعم.
- للاستزراع المشترك للبلاعم الأساسية // ، املأ DMEM / F12 ، 10٪ FBS ، 1٪ أحماض أمينية غير أساسية ، 1٪ بنسلين / ستربتومايسين ، 1٪ أمفوتريسين ، 200 ميكرومتر حمض الأسكوربيك ، 20 نانوغرام / مل عامل تحفيز مستعمرة البلاعم.
- للاستزراع المشترك للخلايا البطانية الأساسية // ، املأ خليط 1: 1 من DMEM / F12 ومجموعة endopan 3 + 10 U / mL من الهيبارين + 20٪ FBS + 1٪ من البنسلين / الستربتومايسين + 1٪ أمفوتريسين + 30 مجم / مل مكمل النمو البطاني.
- استزراع التجمعات في ظروف الثقافة المناسبة للفرضية. لتقليد بيئة متخصصة تشبه الآفات ، على سبيل المثال ، قم بزراعتها عند 37 درجة مئوية و 20٪ O2. تغيير وسط الثقافة مرتين في 1 أسبوع. لمنع العدوى ، ضع الغرف في طبق بتري كبير أو صندوق معقم قبل وضعها في حاضنة.
ملاحظة: يعتمد وقت الاستزراع على الفرضية وإعداد الثقافة المشتركة. على سبيل المثال ، تصبح تجمعات الخلايا الليفية الأساسية // في بيئة متخصصة تشبه الآفة غير مستقرة ميكانيكيا بعد حوالي 3 أسابيع.
6. طرق القراءة المتاحة
- إجراء الفحص المجهري الفلوري ، بما في ذلك فحوصات الجدوى والمورفولوجيا.
- بشكل عام ، يمكن تصوير التجميعات على أنها حوامل كاملة. للقيام بذلك ، قم بإزالة التجميعات من المشابك عن طريق قصها بمقص قريب من المشابك ونقلها إلى لوحة 12 بئرا.
- اغسل التجميعات مرة واحدة باستخدام برنامج تلفزيوني.
- إذا تم إجراء تحليل الجدوى ، قم بتلطيخ كل مجموعة ب 100 ميكرولتر من 4 × 10−6 M إيثيديوم هوموديمر في PBS (EthD-1) لمدة 20 دقيقة عند 37 درجة مئوية في الظلام.
- اغسل التجميعات 3x باستخدام PBS ، ثم ثبتها ب 500 ميكرولتر من 4٪ فورمالديهايد لكل منها لمدة 20 دقيقة في RT.
تنبيه: 4٪ فورمالديهايد له تأثيرات مسببة للحساسية ومسرطنة ومطفرة ، وهو سام للتكاثر ، ويمكن أن يسبب سمية تنموية (سمية) أو تلف الأعضاء. ارتد ملابس وقفازات واقية ، وحماية العين ، وقناع أو حماية أخرى للتنفس. - اغسل التجميعات 3x باستخدام PBS واستمر في بروتوكول التلوين الذي تختاره. تم وصف مجموعة مختارة من البقع سابقا84,85.
ملاحظة: تجنب البقع التي تستخدم الفلوروفورات ذات الطول الموجي للانبعاث القريب من التألق الذاتي للكولاجين (حوالي 480 نانومتر).
- وفقا لتعليمات الشركة المصنعة ، قم بإجراء عزل الحمض النووي الريبي الخاص بالمقصورة ل RT-qPCR أو تسلسل الحمض النووي الريبي على مستوى الجينوم.
- إزالة التجميعات من المشابك بالمقص.
- اختياري: استخدم الملقط لفصل النباتات الأساسية عن حجرة الهيدروجيل الخارجية.
- تجمع 20-24 20 مم من النباتات الأساسية أو 2 من الهلاميات المائية المحملة بالخلايا لعزل كميات كافية من الحمض النووي الريبي.
- استخدم 1 مل من التريزول البارد والاضطراب الميكانيكي (أي الخرز المعدني أو الطحن المبرد) لتدمير المصفوفة خارج الخلية للنباتات الأساسية المجمعة أو الهلاميات المائية الكولاجين المجمعة.
تنبيه: سمية الفم والجلد والاستنشاق. يسبب تهيج الجلد والعين. تعامل فقط مع القفازات وفي خزانة السلامة الكيميائية. - استمر في عزل الحمض النووي الريبي من الخلية المحللة باستخدام مجموعات استخراج الحمض النووي الريبي القياسية كما هو موضح سابقا أو كما هو موضح في تعليمات الشركة المصنعة 84,85.
- قياس التدفق الخلوي الخاص بالمقصورة.
- إزالة التجميعات من المشابك بالمقص.
- اختياري: استخدم الملقط لفصل النباتات الأساسية عن حجرة الهيدروجيل الخارجية.
- هضم المقصورات في 1 مل من PBS مع كولاجيناز I (3 ملغ / مل) وديسباز II (4 ملغ / مل) لمدة 4 ساعات عند 37 درجة مئوية تحت التحريك المستمر.
- جهاز طرد مركزي المحلول المهضوم عند 500 × جم لمدة 5 دقائق في RT ونضح المادة الطافية.
- أعد تعليق الحبيبات في 100 ميكرولتر من المخزن المؤقت FACS (1٪ FBS في PBS) الذي يحتوي على الأجسام المضادة المقترنة بالفلوروفور التي تختارها. تم وصف مجموعة مختارة من الأجسام المضادة المقترنة بالفلوروفور سابقا84,85.
- احتضان محلول التلوين لمدة 30 دقيقة في RT.
- قم بتخفيف محلول التلوين ب 1.4 مل من المخزن المؤقت FACS وجهاز طرد مركزي لمدة 5 دقائق عند 500 × جم في RT.
- أعد تعليق الحبيبات في 350 ميكرولتر من المخزن المؤقت FACS وقم بتصفية المحلول من خلال غطاء مصفاة شبكي من النايلون 100 ميكرومتر قبل تحليله باستخدام مقياس التدفق الخلوي المفضل وفقا لتعليمات الشركة المصنعة.
- تحليل طاف.
- استبدل وسط الاستزراع المشترك بوسط الاستزراع المشترك الخالي من المصل قبل 3 أيام من مجموعة المواد الطافية.
- قم بإجراء تحليل فوري ومتأخر للطافية المخصبة وغير المخففة باستخدام مقايسة الممتز المناعي المرتبط بالإنزيم (ELISA) ومجموعات مقايسة اكتشاف مقياس المتوسط (MSD). للتحليل المتأخر ، قم بتخزين المادة الطافية في أنابيب بلاستيكية سعة 1.5 مل عند -80 درجة مئوية.
- تقييم الخواص الميكانيكية التجميعية.
- استخدم جهاز تمدد مخصص لتطبيق القوى الميكانيكية وقياس الخواص الميكانيكية22. دبابيس وتد الفولاذ المقاوم للصدأ ومسامير الفولاذ المقاوم للصدأ تجعل المشابك قابلة للربط بأجهزة التمدد الأخرى أيضا.
- نظرا لأن الخواص الميكانيكية للتجميع يتم تحديدها إلى حد كبير من خلال تلك الخاصة ب explant الأساسي المضمن 18 ، قم بقياس الخواص الميكانيكية للزرع الأساسي قبل تضمينه في هيدروجيل لتقليل خطر تدمير الهيدروجيل المصبوب حديثا في عملية القياس.
النتائج
عزل المكونات (الشكل 1 والشكل 2)
قبل استخدام النباتات الأساسية ومجموعات الخلايا في الاستزراع المشترك التجميعي ، يجب فحص هذه المكونات تحت المجهر (الشكل 1). يجب أن يكون للنباتات الأساسية قطر موحد (100-200 ميكرومتر) ولا توجد مكامن الخلل أو التجاعيد المرئية. يجب أن تقدم الخلايا البطانية شكلا ممدودا عند ملامسته للخلايا الأخرى ، وهو ما لا يحدث عند بذرها بكثافة منخفضة للغاية بسبب انخفاض العائد الأولي من العزلة. في هذه الحالة ، تفترض الخلايا البطانية شكلا أكثر استدارة مع امتدادات هيكلية خلوية وتتكاثر بشكل أبطأ بشكل ملحوظ. قسمها 1: 5 بعد 7-10 أيام. تفترض الخلايا الليفية الوترية المعزولة من أوتار العرقوب مورفولوجيا أكثر استدارة مقارنة بنظيراتها البشرية في غضون 1-2 ممر (10-14 يوما لكل منهما) عندما تم تقسيمها بنسبة 1: 6. البلاعم أصغر بكثير من الخلايا الليفية أو الخلايا البطانية ولا تتكاثر بعد العزلة. اعتمادا على الدفعة ، يمكن أن يختلف شكلها من هرمي إلى دائري.
تم التحقق من الأنماط الظاهرية للمكونات الخلوية باستخدام قياس التدفق الخلوي. تم استخدام جسم مضاد CD31 مترافق كعلامة للخلايا البطانية (الشكل 2 أ). عند تحديد عتبة التألق بناء على عينة تحكم غير ملوثة (رمادية) ، تم تحديد 90.1٪ من الممر 1 (P1) و 48.7٪ من الخلايا البطانية للمرور 2 (P2) على أنها إيجابية CD31. تم استخدام خط فأر معدل وراثيا يشارك في التعبير عن علامة الخلايا الليفية الوترية Scleraxis جنبا إلى جنب مع بروتين الفلورسنت الأخضر (ScxGFP) وجسم مضاد CD146 مترافق لتوصيف الخلايا الليفية الأوتارية (الشكل 2B)35,60. بعد مرور واحد (P1) ، كانت 37.3٪ من الخلايا الليفية ScxGFP + CD146- ، و 0.2٪ كانت ScxGFP + CD146 + ، و 4.3٪ كانت ScxGFP-CD146 + ، و 58٪ كانت ScxGFP-CD146-. بعد مقطعين (P2) ، انخفضت النسبة المئوية لخلايا ScxGFP + CD146 إلى 27.6٪ ، وزادت النسبة المئوية لخلايا ScxGFP + CD146 + إلى 6.9٪ ، وزادت النسبة المئوية لخلايا ScxGFP-CD146 + إلى 10.6٪ ، وانخفضت النسبة المئوية لخلايا ScxGFP-CD146 إلى 54.9٪. لتحديد وتوصيف البلاعم ، تم استخدام جسم مضاد F4 / 80 مع CD86 وجسم مضاد CD206 (الشكل 2C). بعد العزلة والثقافة ، كانت 96.4٪ من الخلايا المشتقة من نخاع العظم إيجابية F4 / 80. من بين هذه الخلايا الإيجابية F4 / 80 ، كانت 8.6٪ CD206 + CD86- ، و 23.6٪ CD206 + CD86 + ، و 28.3٪ CD206-CD86 + ، و 39.4٪ كانت CD206-CD86-. قد تختلف سرعة تشابك الكولاجين من دفعة إلى أخرى ويجب اختبارها قبل بدء التجارب.
مظهر التجميع (الشكل 3)
في ظروف الاستزراع الشبيهة بالآفة (36 درجة مئوية ، 20٪ O2) ، ظل الزرع الأساسي قابلا للتمدد ميكانيكيا ، ولم يتغير في المظهر ، واستمر في تمييزه بصريا وفصله جسديا عن الهيدروجيل المحيط على مدار 21 يوما على الأقل (الشكل 3 أ ، ب). تم ضغط الهيدروجيل المحيط بمرور الوقت ، مع سرعة الضغط اعتمادا على عدد الخلايا البذر فيه. تقلصت الخلايا الليفية المشتقة من وتر العرقوب هيدروجيل محيطها بشكل أسرع وفعلت ذلك شعاعيا عندما تكون في هيدروجيل يلقي حول نبات أساسي وفي جميع الاتجاهات عندما لا يكون كذلك (الشكل 3B ، C). في البداية ، تم ضغط الهلاميات المائية الخالية من الخلايا الموضوعة حول نبات أساسي أيضا. من المحتمل أن يكون هذا الانكماش ناتجا عن هجرة الخلايا من الزرع الأساسي ، مما يشير إلى وجود واجهة ديناميكية عبر المقصورات. نظرا لأن الهلاميات المائية الخالية من الخلايا بدون زرع أساسي مدمج لم تضغط بشكل يمكن اكتشافه ، فإن مساهمة الانكماش الناجم عن فقدان الماء تبدو ضئيلة (الشكل 3B والملف التكميلي 6).
لذلك ، يمكن استخدام نقص ضغط الهيدروجيل لاكتشاف الأخطاء في تجميع التجميع (أي تركيزات الخلايا المنخفضة) ويجب التحقق منه قبل الاستمرار في طرق القراءة الأكثر تكلفة. أثناء إنشاء هذه الطريقة ، تضمنت الأخطاء الشائعة التي تقلل من تركيز الخلايا الخلايا الميتة في الهيدروجيل الخارجي لأنها تركت لفترة طويلة جدا في محلول التشابك القاسي نسبيا (درجة حموضة عالية ، درجة حرارة منخفضة) وتجفيف النباتات الأساسية لأن الوقت بين الشفط المتوسط وحقن الهيدروجيل كان طويلا جدا ، أو لأن الزرع الأساسي كان مثبتا بدرجة عالية جدا بحيث لا يمكن تضمينه في الكولاجين.
الفحص المجهري الفلوري متحد البؤر: تحليل الجدوى والتشكل (الشكل 3)
بمجرد إزالتها من المشابك بالمقص (الشكل 3 ب) ، يمكن تثبيت التجميعات وتلوينها وتصويرها باستخدام مجهر متحد البؤر ككل دون تقسيم. هنا ، تم تلطيخ الخلايا البطانية الأساسية // ، والبلاعم الأساسية // وتجمعات الخلايا الليفية الأساسية // ب DAPI (NucBlue) و Ethidium Homodimer (EthD-1) لتحليل الجدوى و DAPI و F-actin لتحليل التشكل وانتشار الخلايا في هيدروجيل الكولاجين ثلاثي الأبعاد (الشكل 3D). تم تحديد صلاحية تجمعات الخلايا البطانية الأساسية // (الشكل 3E) ووجد أنها أقل بشكل عام بعد تجميع التجميع مما تم الإبلاغ عنه سابقا لتجمعات الخلايا الأساسية // البلاعم واللب // الخلايا الليفية84. ومع ذلك ، ظلت الصلاحية مستقرة خلال ثقافة التجميع حتى اليوم 7 على الأقل.
التلف الدقيق المستحث ميكانيكيا وقياس الخواص الميكانيكية (الشكل 4)
تسمح البراغي والدبابيس المتصلة بحوامل المشابك بتثبيت التجميعات المثبتة على أجهزة التمدد أحادية المحور. تم تجهيز جهاز التمدد المخصص المستخدم هنا بخلية تحميل 10 نيوتن وقد تم وصفها في المنشورات السابقة (الشكل 4 أ)22. تم تكييف جميع العينات مسبقا بخمس دورات تمدد إلى إجهاد 1٪ قبل القياسات.
سيسمح تسجيل منحنى الإجهاد والانفعال الكامل للنباتات الأساسية أو التجمعات (الشكل 4 ب) بالقياس الكمي لمعامل المرونة الخطي (α) ، والحد الأقصى للإجهاد (β) ، والحد الأقصى للإجهاد (у). ومع ذلك ، فإنه يضر أيضا بشكل لا رجعة فيه بالزرع الأساسي أو التجميع ، مما يجعل من المستحيل تقييم التطور الطولي للإجهاد الأقصى (β) والحد الأقصى للإجهاد (у) لنفس العينات (الشكل 4 ب). هنا ، تم استخدام معامل المرونة الخطي كمقياس لقدرة العينة على تحمل القوى ، حيث يتطلب هذا القياس تمديد العينة إلى إجهاد 2٪ فقط ، والذي ثبت سابقا أنه لا يسبب انخفاضات دائمة في معامل المرونة الخطي18. على وجه الخصوص ، تعرضت مجموعات الخلايا البطانية الأساسية // لإجراء التثبيت إلى سلالة 2 ٪ (تقريبا نهاية المنطقة المرنة الخطية) أو سلالة 6 ٪ (تقريبا الحد الأقصى للإجهاد). تم تقييم الضرر الدقيق الناتج عن طريق قياس معامل المرونة الخطي قبل الإجراء وبعده (الشكل 4C).
تماشيا مع التجارب التي أجريت سابقا والتي تستغل النباتات الأساسية أحادية الاستزراع ، احتفظت تجمعات الخلايا البطانية الأساسية // بمعامل المرونة الخطي لمدة 14 يوما على الأقل عند استزراعها في ظروف متخصصة شبه متجانسة (29 درجة مئوية ، 3٪ O2) وتعرضها لسلالات لا تزيد عن 2٪ 18,21. فيما يتعلق بالتحفيز الأساسي الميكانيكي ، يبدو أن التمدد الثابت المطبق من خلال المشابك يحاكي بشكل كاف مستويات الإجهاد الأصلية التي تعاني منها وحدات الأوتار الأساسية في الجسم الحي لمنع عمليات الهدم المرتبطة عموما بتفريغ المصفوفة87. في الواقع ، يمكن أن يعزى الانخفاض التدريجي وذو الدلالة الإحصائية لمعامل المرونة الخطي الذي لوحظ في مجموعات الخلايا البطانية الأساسية المعرضة لإجهاد 6٪ إلى تفريغ المصفوفة الناجم عن التلف الدقيق للمصفوفة المستحثة ميكانيكيا.
عند إجراء هذه التجارب ، من المهم منع تجفيف التجميع. هنا ، تم تغليفها بورق معقم ومبلل ، ولكن يمكن أيضا أن تكون الطرق الأخرى قابلة للتطبيق اعتمادا على توافقها مع جهاز التمدد المستخدم. نظرا لأن الاحتكاك بين المشابك المعدنية و explant الأساسية محدود ، أضف قطعا صغيرة من الورق بين المعدن والزرع الأساسي أثناء التثبيت لمنع الانزلاق ومراقبة عملية التمدد عن كثب لاكتشاف واستبعاد الزرع الأساسي المنزلق والتجمعات.
تحليل الإفراز الخاص بالمقصورة والإفراز الخاص بالتجميع (الشكل 5 والشكل 6)
في المجموعة الأولى من تجارب الثقافة الأحادية الأساسية المعروضة هنا ، تم تقييم استقرار التعبير الجيني الأساسي بعد عزل الزرع لفصل العزلة عن التأثيرات التجريبية (الشكل 5 أ). على الرغم من أن أعداد التكرار الأعلى ضرورية للاستنتاجات الدقيقة ، إلا أن التعبير عن Vegfa و Mmps زاد بقوة في النباتات الأساسية المعزولة حديثا في غضون ساعات بعد عزل الزرع عند استزراعه في ظروف متخصصة تشبه الآفات (37 درجة مئوية ، 20٪ O2).
التوعي الجديد هو السمة المميزة المركزية لمرض الأوتار وإصلاحه والتي يمكن ، جزئيا ، أن تكون مدفوعة بالخلايا البطانية التي تنشطها عوامل مؤيدة لتولد الأوعية (أي عامل نمو بطانة الأوعية الدموية ، Vegfa) التي يفرزها قلب الوتر تحت نقص الأكسجة88. بفحص الخطوة الأولى من هذا الحديث المتبادل المحتمل (الشكل 5B) ، وجد أن التعبير عن كل من Vegfa وعلامة نقص الأكسجة الكربونية anhydrase 9 (Ca9) يزداد دلالة إحصائية في النباتات أحادية المستزرعة تحت توتر الأكسجين المنخفض (3٪ O2) على عكس تلك أحادية الاستزراع تحت ضغط الأكسجين العالي (20٪ O2). وفي الوقت نفسه ، لا يبدو أن توتر الأكسجين المنخفض يسبب تغيرات في التعبير عن علامات الخلايا الليفية الأوتارية مثل Scleraxis (Scx) و Colagen-1 (Col1a1). معا ، تحدد هذه النتائج الخلايا المقيمة الأساسية كمساهمين معقولين في الإشارات المؤيدة لتولد الأوعية في مكانة نقص الأكسجين.
بعد ذلك ، تم تقييم تنشيط الخلايا البطانية عن طريق الإشارات الأساسية المؤيدة لتولد الأوعية في الثقافة المشتركة لتجميع الخلايا البطانية تحت توتر الأكسجين المرتفع (20٪ O2) والمنخفض (3٪ O2). لحسن الحظ ، يسمح التركيب المعياري للتجمعات بتحليل النسخ الخاص بالمقصورة بعد الثقافة عن طريق الفصل المادي للزرع الأساسي عن هيدروجيل الكولاجين الخارجي (الشكل 6 أ). في الزرع الأساسي (الشكل 6D) ، تم التأكيد مرة أخرى على زيادة تعبير Vegfa تحت ضغط الأكسجين المنخفض ، على الرغم من أن التأثير على علامات نقص الأكسجين الأخرى مثل Fgf2 كان أقل وضوحا ويتطلب أرقاما تكرارية أعلى للحصول على استنتاجات دقيقة. بالإضافة إلى ذلك ، انخفض التعبير عن العلامات المؤيدة للالتهابات مثل Tnf-α وعلامات تدهور المصفوفة خارج الخلية مثل Mmp3 في القلب تحت ضغط الأكسجين المنخفض. في الهيدروجيل الخارجي المصنف في البداية بالخلايا البطانية (الشكل 6E) ، أدى وجود نبات أساسي حي (aC) إلى تقليل تعبير Vegfa تحت ضغط الأكسجين المنخفض ، ولكن ليس تحت توتر الأكسجين العالي. بالإضافة إلى ذلك ، فإن وجود نبات أساسي غير حيوي (dC) تحت ضغط الأكسجين المنخفض لم يقلل من تعبير Vegfa أيضا. تحت توتر الأكسجين المنخفض ، كان تعبير Tnf-α في الهيدروجيل الخارجي مشابها حول aC / dC ولكنه زاد تحت توتر الأكسجين العالي حول النباتات الأساسية الحية. انخفض تعبير Fgf2 في جميع الظروف مقارنة بالهيدروجيل المحمل بالخلايا البطانية الخارجية المستزرع حول نبات أساسي غير حيوي تحت ضغط أكسجين مرتفع ولكن معظمها تحت توتر أكسجين منخفض. كان تعبير Mmp3 أعلى حول النباتات الأساسية الحية تحت ضغط الأكسجين العالي وأدنى حول النباتات الأساسية غير الحيوية تحت توتر الأكسجين المنخفض. بشكل عام ، يبدو أن الخلايا البطانية المستزرعة بشكل مشترك تستجيب لكل من الزرع الأساسي النشط ، القادر على بدء الحديث المتبادل والاختلافات في مستويات الأكسجين. ومن شأن إجراء تحليل أكثر شمولا للنسخ أن ييسر توضيح مساهمات كل منهما.
تسمح نمطية نظام التجميع بدمج الخلايا المعدلة وراثيا التي تحتوي على جينات مراسل الفلورسنت. هنا ، تم زرع الخلايا البطانية المعزولة من الفئران Pdgfb-iCreER mG89 في حجرة الهيدروجيل. تشارك هذه الخلايا في التعبير عن الوحدة الفرعية b لعامل النمو المشتق من الصفائح الدموية (Pdgfb) جنبا إلى جنب مع البروتين الفلوري الأخضر المعزز (EGFP) ، مما يجعل الخلايا البطانية المعبرة عن Pdgfb تظهر باللون الأخضر تحت المجهر (الشكل 6C). باستخدام هذه الطريقة ، تم تأكيد وجود الخلايا البطانية المعبرة عن Pdgfb على مدى 7 أيام في الثقافة (37 درجة مئوية) ويبدو أنها مستقلة عن توتر الأكسجين (20٪ O2 مقارنة ب 3٪ O2).
لتحليل إفراز التجمعات ، تم استبدال وسط المزرعة المستخدم على التوالي للنواة // الخالية من الخلايا واللب // الخلايا الليفية أو النواة // البلاعم أو الثقافة المشتركة للخلايا البطانية // الأساسية بنظيرتها الخالية من المصل قبل ثلاثة أيام من استنشاق وتجميد المادة الطافية المخصبة الآن بالإفراز (الشكل 6 أ). كان وقت التخصيب هذا كافيا للكشف عن السيتوكينات مثل عامل نمو بطانة الأوعية الدموية (VEGF) مع مقايسة MSD ، كما هو موضح هنا للنباتات الأساسية وتجمعات الخلايا الليفية الأساسية // المزروعة في ظروف متخصصة تشبه الآفات (الشكل 6B).
تتعلق الاعتبارات المهمة عند تحليل الإفرازات والنسخ الخاصة بالنباتات الأساسية والتجمعات باستخدام الضوابط المناسبة. النباتات الأساسية المعزولة حديثا لها قيمة محدودة ، حيث يزداد تعبيرها عن Vegfa و Mmps بقوة في غضون ساعات بعد العزلة (الشكل 5 أ). تعتبر النباتات المتطابقة زمنيا المحاطة بهيدروجيل خال من الخلايا في البداية أكثر ملاءمة كعناصر تحكم للتعبير الجيني للمقصورة الأساسية. بالنسبة للهيدروجيل الخارجي ، فإن الهلاميات المائية المحملة بالخلايا المستزرعة بدون زرع أساسي هي عناصر تحكم أدنى مقارنة بالهلاميات المائية المحملة بالخلايا المستزرعة حول النباتات الأساسية غير الحيوية (الملف التكميلي 7) ، ويرجع ذلك أساسا إلى أنها تضغط في أشكال مستديرة بدلا من الهلاميات المائية الممدودة التي تغير بشكل كبير مورفولوجيا الخلية (الشكل 3 أ).
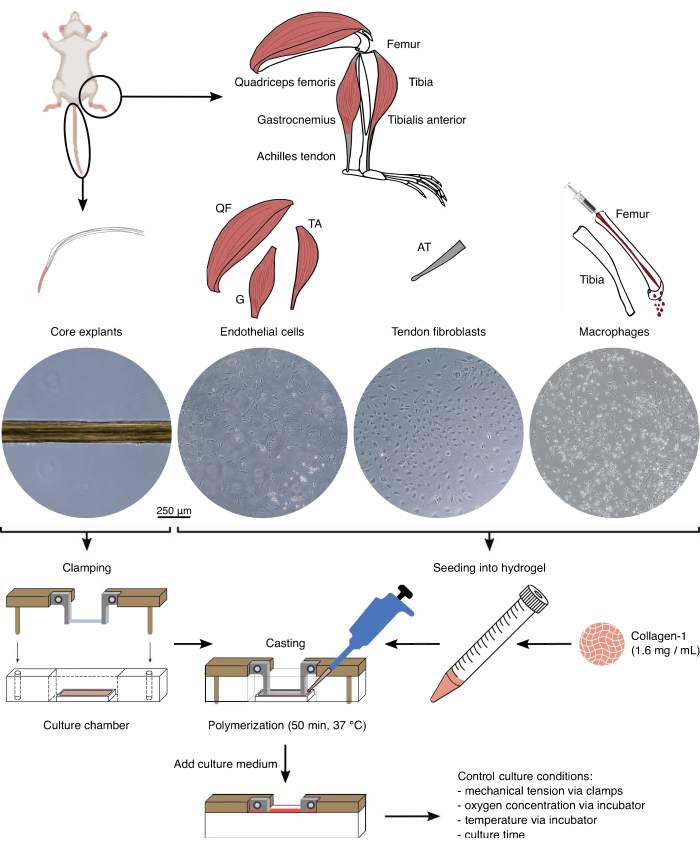
الشكل 1: عزل مكون التجميع وتجميعه لنمذجة الحديث المتبادل في الجسم الحي . تم استخراج نباتات الأوتار الأساسية من ذيول الفأر وقطعها وتثبيتها. تم هضم عضلات ساق الفأر (أي عضلات الفخذ الفخذية (QF) ، والساق (G) ، والظنبوب الأمامي (TA)) لعزل الخلايا البطانية التي تم استزراعها بعد ذلك على بلاستيك زراعة الأنسجة. تم هضم أوتار العرقوب (AT) أيضا لعزل الخلايا الليفية الأوتارية ، والتي تم استزراعها بعد ذلك على بلاستيك زراعة الأنسجة. تم طرد نخاع العظم من الساق وعظم الفخذ من العظام. بعد ذلك ، تم استزراع الخلايا الوحيدة المعزولة على بلاستيك زراعة الأنسجة وتمييزها إلى بلاعم ساذجة. تصور الصور المجهرية الضوئية (10x) مظهر النباتات الأساسية والخلايا البطانية والخلايا الليفية الأوتارية والبلاعم مباشرة قبل دمجها في التجمعات. أثناء التجميع ، تم تعليق الخلايا المزروعة على البلاستيك ثم زرعها في محلول كولاجين -1 (1.6 مجم / مل). بعد ذلك ، تم صب خليط الخلية والهيدروجيل حول الزرع الأساسي المثبت وبلمرته لمدة 50 دقيقة عند 37 درجة مئوية قبل إضافة وسط الاستزراع. تم التحكم في ظروف الاستزراع عن طريق المشابك (التوتر الميكانيكي) وإعدادات الحاضنة (تركيز الأكسجين ودرجة الحرارة). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
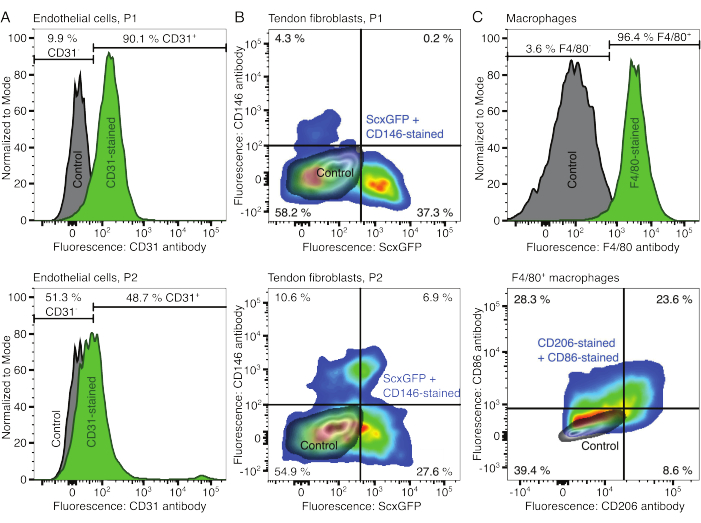
الشكل 2: توصيف مكونات التجمع الخلوي. (أ) تحليل التدفق الخلوي التمثيلي للخلايا البطانية المشتقة من العضلات بعد مرور واحد (P1 ، الصف العلوي) وممرين (P2 ، الصف السفلي). تم تطبيع أعداد الخلايا غير الملوثة (الرمادية) والملطخة ب CD31 (الخضراء) إلى مشروط. النسب المئوية معطاة للمجموعة الملطخة ب CD31. (ب) تحليل التدفق الخلوي التمثيلي للخلايا الليفية المشتقة من وتر العرقوب بعد مرور واحد (P1 ، الصف العلوي) وممرين (P2 ، الصف السفلي). تشير المحاور إلى شدة مضان للخلايا غير الملوثة (الرمادية) والخلايا التي تعبر عن ScxGFP وملطخة بالأجسام المضادة CD146 (ألوان قوس قزح). (ج) التحليل الخلوي للتدفق التمثيلي للبلاعم المشتقة من نخاع العظم بعد الزرع. في الصف العلوي ، تم تطبيع أعداد الخلايا غير الملوثة (الرمادية) و F4 / 80 (الخضراء) إلى مشروط. يتم إعطاء النسب المئوية للمجموعة الملطخة F4 / 80. يشير الرسم البياني في الصف السفلي إلى شدة التألق للخلايا غير الملوثة (رمادية) ومجموعة فرعية F4 / 80 + من الخلايا الملطخة بالأجسام المضادة CD206 والأجسام المضادة CD86 (ألوان قوس قزح). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
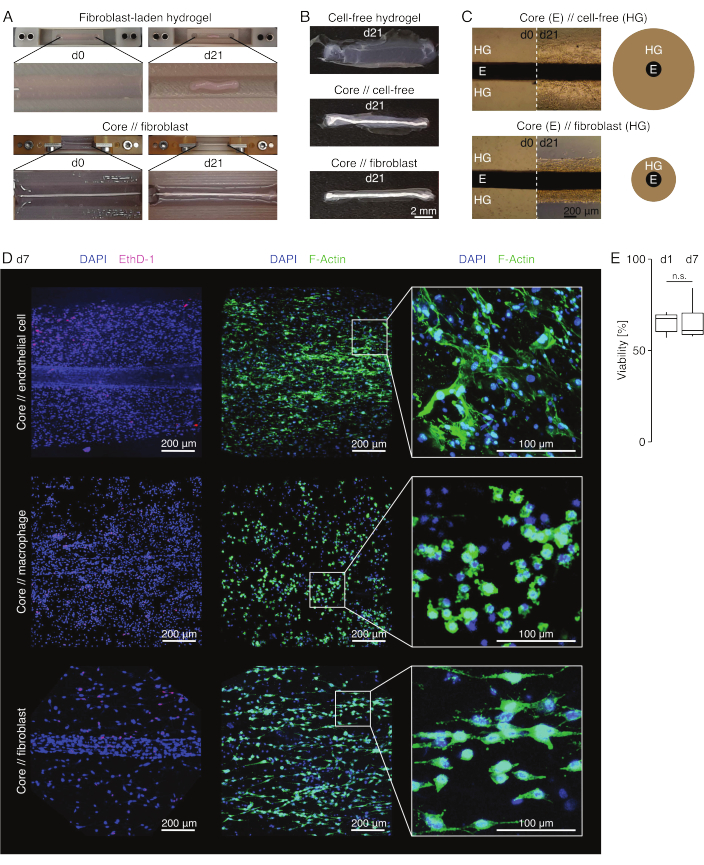
الشكل 3: التصوير التجميعي والمظهر. (أ) تظهر الصور التمثيلية التي تم التقاطها في اليوم 0 (d0) واليوم 21 (d21) من الثقافة (37 درجة مئوية ، 20٪ O2) تقلصا متعدد الأبعاد لهيدروجيل يحتوي على خلايا ليفية خارجية بدون زرع أساسي مدمج وضغط شعاعي قوي لهيدروجيل يحتوي على خلايا ليفية خارجية حول نبات أساسي. (ب) تظهر الصور التمثيلية التي تم التقاطها في اليوم 21 (d21) من الثقافة (37 درجة مئوية ، 20٪ O2) الاختلافات في سرعة الضغط بين الهلاميات المائية الخالية من الخلايا ، والهلاميات المائية الخالية من الخلايا المصبوبة حول نبات أساسي ، والهلاميات المائية المحملة بالوتر الليفي المصبوبة حول نبات أساسي. (C) تشير الصور المجهرية الضوئية التمثيلية (10x) الملتقطة في اليوم 0 (d0) واليوم 21 (d21) من الثقافة (37 درجة مئوية ، 20٪ O2) إلى تغيرات طولية في وجود مجموعات الخلايا وسرعة ضغط هيدروجيل الكولاجين (HG) حول الزرع الأساسي (E) في الثقافة المشتركة لتجميع الخلايا الأساسية // الخالية من الخلايا واللب // الخلايا الليفية. يصور التمثيل التخطيطي الاختلافات في ضغط الهيدروجيل بين التجميع الأساسي // الخالي من الخلايا و التجميع المشترك // الخلايا الليفية. (د) صور مجهرية متحدة البؤر تمثيلية تم التقاطها في اليوم 7 (d7) للخلية الأساسية // البطانية ، الأساسية // البلاعم ، والاستزراع المشترك لتجميع الخلايا الليفية الأساسية // (37 درجة مئوية ، 20٪ O2). تصور الصور الموجودة في الصف الأيسر تجمعات ذات نوى خلوية ملطخة باللون الأزرق (DAPI) وخلايا ميتة ملطخة باللون الوردي (Ethidium homodimer-1). يصور الصفان الآخران تجمعات ذات نوى خلية ملطخة باللون الأزرق (DAPI) وخيوط الأكتين باللون الأخضر (F-actin). (ه) مخططات صندوقية تصور الصلاحية الكمية لتجمعات الخلايا البطانية الأساسية // في اليوم 1 (d1) واليوم 7 (d7) من الاستزراع المشترك. ن = 5. تتوافق المفصلات العلوية والسفلية مع الربعين الأول والثالث (25و 75في المائة ) والمفصلات الوسطى مع الوسيط. تمتد الشعيرات من المفصلة العلوية / السفلية إلى أكبر / أصغر قيمة لا تزيد عن 1.5 ضعف النطاق الربيعي. قيم P : n.s.p > 0.05. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
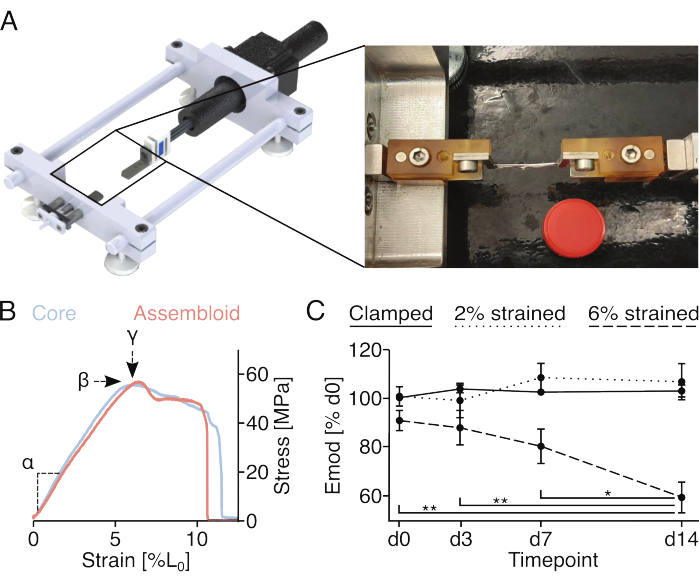
الشكل 4: التحفيز الميكانيكي للتجمعات وقياس الخواص الميكانيكية التجميعية. (أ) تصوير رسومي لجهاز التمدد المصنوع خصيصا والذي يتألف من منصات حامل المشبك ومستشعر القوة ومحرك السائر. تظهر الصورة الفوتوغرافية تجميعا مثبتا على جهاز التمدد بمشابك. غطاء أنبوب بلاستيكي سعة 15 مل (Ø: 17 مم) يستخدم للقياس. (ب) رسم بياني يصور منحنيات الإجهاد / الانفعال التمثيلية للنباتات الأساسية (أزرق فاتح) والتجمعات (أحمر فاتح). يمكن استخراج معامل المرونة الخطي (α) ، والحد الأقصى للإجهاد (β) ، والإجهاد الأقصى (у) من البيانات لتوصيف الزرع الأساسي أو التجميع ميكانيكيا. (C) رسم بياني يوضح معامل المرونة الخطي (Emod) لتجمعات الخلايا البطانية الأساسية // المزروعة بشكل مشترك (29 درجة مئوية ، 3٪ O2) على مدار دورة زمنية مدتها 14 يوما بعد تثبيتها (خط صلب) ، أو تثبيتها وتمديدها إلى سلالة 2٪ L0 (خط منقط) ، أو تثبيتها وتمديدها إلى 6٪ L0 سلالة (خط متقطع) في بداية التجربة. ن = 5. تمت تسوية نقاط البيانات إلى معامل المرونة الخطي الأولي قبل التمدد وتم عرضها جميعا كمتوسط (±sem). قيم P: * p < 0.05 ، ** p < 0.01. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
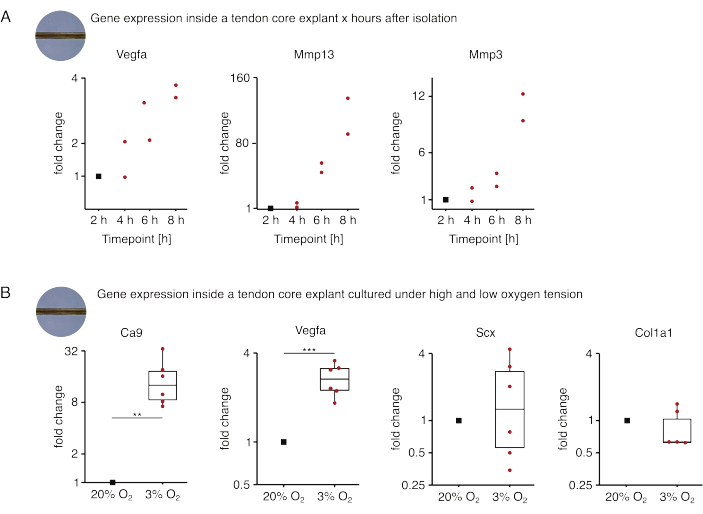
الشكل 5: التغيرات في النسخ الأساسية بعد العزلة والثقافة في ظل ظروف متخصصة مختلفة. (أ) مخطط مبعثر يصور تغيرات الطيات في التعبير الجيني Vegfa و Mmp13 و Mmp3 في أحادي المستزرع (37 درجة مئوية ، 20٪ O2) يزرع لب الفئران 2 h و 4 h و 6 h و 8 h بعد عزلها عن الذيل. تم تطبيع التغييرات في أضعاف في النقاط الزمنية المعنية إلى التعبير الجيني 2 ساعة بعد العزلة. ن = 2. (ب) تم تطبيع المخططات الصندوقية التي تصور تغيرات الطيات في التعبير الجيني Ca9 و Vegfa و Scx و Col1a1 في النباتات الأساسية أحادية الزراعة تحت توتر الأكسجين المنخفض (3٪ O2) ومقارنتها بتلك أحادية الزراعة تحت توتر الأكسجين العالي (20٪ O2). ن = 5-6. تتوافق المفصلات العلوية والسفلية للمربعات مع الربعين الأول والثالث (25و 75في المائة ) والوسط مع الوسيط. تمتد الشعيرات من المفصلة العلوية / السفلية إلى أكبر / أصغر قيمة لا تزيد عن 1.5 ضعف النطاق الربيعي. يتم تصوير نقاط البيانات المستخدمة للتطبيع كنقاط سوداء ونقاط البيانات الفردية كنقاط حمراء. قيم P: ** p < 0.01 ، ***p < 0.001. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
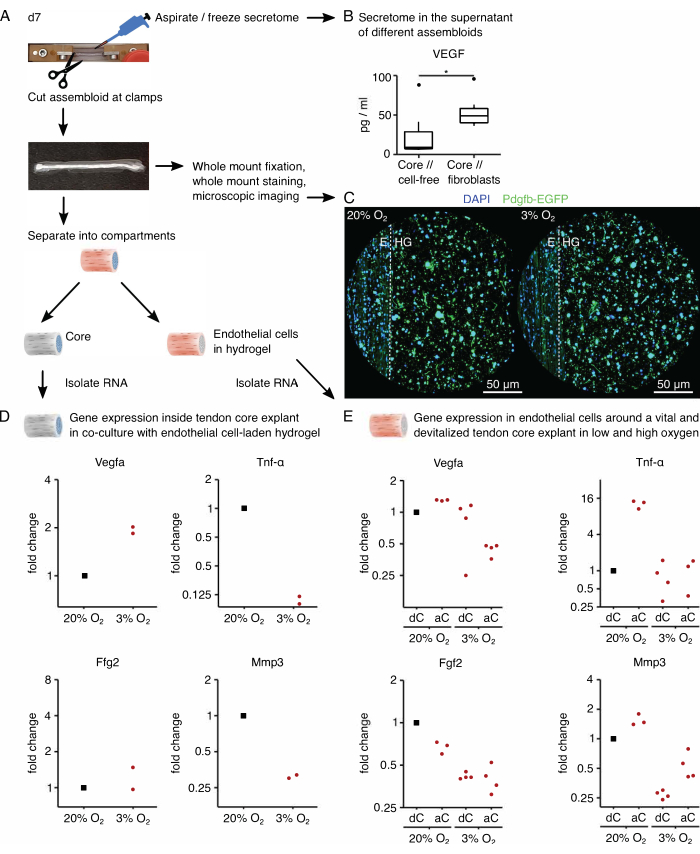
الشكل 6: تحليل الإفراز الخاص بالتجميع وتحليل النسخ الخاص بالحجرة. (أ) صورة تمثيلية تظهر التجميع في اليوم 7 (d7) ، عندما تم أخذ عينات من الإفراز والنسخ ، وتصوير سير العمل الأساسي. (ب) تركيز VEGF (pg / mL) في طاف النوى // الخالية من الخلايا واللب // تجمعات الخلايا الليفية بعد 7 أيام من الاستزراع المشترك (37 درجة مئوية ، 20٪ O2) مصورة على أنها مربعات. ن = 6. (C) صور مجهرية متحدة البؤر تمثيلية لتجمعات الخلايا البطانية الأساسية // بعد 7 أيام من الزراعة المشتركة (37 درجة مئوية) تحت ضغط الأكسجين العالي (20٪ O2) وتوتر الأكسجين المنخفض (3٪ O2). يتم تلوين نوى الخلايا باللون الأزرق (DAPI) ، وتشارك الخلايا البطانية المدمجة في التعبير عن البروتين الفلوري الأخضر المعزز (EGFP) جنبا إلى جنب مع الوحدة الفرعية b لعامل النمو المشتق من الصفائح الدموية لعلامة الخلايا البطانية (Pdgfb). يشير الخط المنقط إلى الواجهة المجزأة بين الزرع الأساسي (E) وهيدروجيل الخلايا البطانية (HG). (د) مخطط مبعثر يصور تغيرات الطيات في التعبير الجيني Vegfa و Tnf-α و Fgf2 و Mmp3 في المقصورة الأساسية من تجمعات الخلايا البطانية الأساسية // المزروعة بشكل مشترك تحت ضغط الأكسجين المنخفض (3٪ O2) تمت تسويتها ومقارنتها بتلك المزروعة تحت توتر الأكسجين العالي (20٪ O2). ن = 2. (ه) مخطط مبعثر يصور تغيرات الطيات في التعبير الجيني Vegfa و Tnf-α و Fgf2 و Mmp3 في المقصورة الخارجية للنواة // تجمعات الخلايا البطانية ذات النواة الحية (aC) أو النواة غير الحيوية (dC) المزروعة بشكل مشترك تحت توتر الأكسجين العالي (20٪ O2) وتوتر الأكسجين المنخفض (3٪ O2). تم تطبيع تغييرات الطيات في الظروف المعنية إلى المقصورة الخارجية لتجميع الخلايا البطانية الأساسية // مع نواة غير حيوية (dC) تمت زراعتها بشكل مشترك تحت ضغط أكسجين مرتفع (20٪ O2). ن = 3-4. في B ، تتوافق المفصلات العلوية والسفلية للمربعات مع الربعين الأول والثالث (25و 75في المائة ) والوسط مع الوسيط. تمتد الشعيرات من المفصلة العلوية / السفلية إلى أكبر / أصغر قيمة لا تزيد عن 1.5 ضعف النطاق الربيعي. يتم تصوير القيم المتطرفة كنقاط سوداء. قيم P: * p < 0.05. في D و E ، يتم تصوير نقاط البيانات المستخدمة للتطبيع كنقاط سوداء ، ويتم تصوير نقاط البيانات الفردية كنقاط حمراء. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الجدول 1: متطلبات المدخلات لأنظمة نموذج أمراض الأوتار والإصابة. قائمة بمحفزات مرض الأوتار الأولية والدوافع الثانوية المتطابقة مع مجموعة مختارة من معلمات الإدخال التي تعتبر قابليتها للسحب أساسية لنمذجة أمراض الأوتار وإصابتها. الرجاء الضغط هنا لتنزيل هذا الجدول.
الجدول 2: متطلبات المخرجات لأنظمة نموذج أمراض الأوتار والإصابة. مجموعة مختارة من السمات المميزة لمرض الأوتار تتطابق مع مجموعة مختارة من معلمات المخرجات التي تعتبر قابليتها للقياس الكمي أساسية لتفسير سلوك نموذج مرض الأوتار والإصابة. الرجاء الضغط هنا لتنزيل هذا الجدول.
الملف التكميلي 1: ملف .stl لحوامل المشابك ومحطة التركيب وقوالب الغرفة. الرجاء الضغط هنا لتنزيل هذا الملف.
الملف التكميلي 2: مخطط حامل المشبك الأيمن. الرجاء الضغط هنا لتنزيل هذا الملف.
الملف التكميلي 3: مخطط حامل المشبك الأيسر. الرجاء الضغط هنا لتنزيل هذا الملف.
الملف التكميلي 4: مخطط منصة التركيب الرجاء النقر هنا لتنزيل هذا الملف.
الملف التكميلي 5: مخطط المشابك المعدنية. الرجاء الضغط هنا لتنزيل هذا الملف.
الملف التكميلي 6: صورة تظهر انكماش هيدروجيل خال من الخلايا. الرجاء الضغط هنا لتنزيل هذا الملف.
الملف التكميلي 7: صورة تظهر نبتة أساسية غير حيوية. الرجاء الضغط هنا لتنزيل هذا الملف.
Discussion
بشكل عام ، يحتوي نظام نموذج التجميع المعروض هنا على العديد من الخطوات الحاسمة التي يجب تسليط الضوء عليها. أولا ، النظام النموذجي جيد فقط مثل جودة مكوناته. من الضروري التحقق من الزرع الأساسي ومجموعات الخلايا التي سيتم زرعها تحت المجهر قبل بدء عملية التجميع. من المهم بالمثل التحقق من النمط الظاهري لمجموعات الخلايا المعزولة مرة واحدة على الأقل باستخدام قياس التدفق الخلوي. خاصة عند استخدام دفعة جديدة من الكولاجين -1 لأول مرة ، فمن المفيد التحقق من سرعة التشابك في التشغيل التجريبي قبل تضمين الخلايا فيه. يتطلب تجميع التجميع الكثير من المناولة اليدوية ، مما يزيد من خطر الإصابة بالعدوى. لتقليل مخاطر العدوى ، اعمل في غطاء معقم للسلامة الحيوية مع تدفق الهواء الصفحي ، وتبادل القفازات كثيرا ، وقم بإزالة التلوث من القفازات وكذلك مساحة العمل بنسبة 80٪ من الإيثانول. لأسباب مماثلة ، لا تستخدم حوامل المشبك المطبوعة 3D أكثر من مرة. قبل عملية التضمين نفسها ، من المهم الاحتفاظ بجميع مكونات الهيدروجيل (محلول التشابك ، محلول الكولاجين -1) على الجليد لمنع التشابك المبكر. وبالتالي ، يجب على المرء أن يعمل بسرعة بمجرد إضافة الخلايا إلى محلول التشابك للحد من موت الخلايا بسبب ارتفاع درجة الحموضة وانخفاض درجة حرارة محلول التشابك. لمنع موت الخلايا المرتبط بالجفاف في الزرع الأساسي ، قم باستنشاق الوسط الذي يغطي النباتات الأساسية المثبتة مباشرة قبل خلط محلول التشابك مع محلول الكولاجين -1. لضمان الموضع المركزي للزرع الأساسي داخل الهيدروجيل ، من المثالي صب الهيدروجيل حول نبات أساسي مثبت مشدود قليلا. للقيام بذلك ، استخدم دبوس وتد وبرغي الترباس M3 × 16 مم لتثبيت حوامل المشبك على لوحة (مطبوعة ثلاثية الأبعاد) مزودة بفتحات بالأطوال المناسبة. بعد وقت البلمرة لمدة 50 دقيقة ، يمكن فك حدة الزرع الأساسي المدمج مرة أخرى اعتمادا على ظروف الاستزراع المطلوبة. إن مقدار التوتر الذي يختبره التجمع أثناء الاستزراع له تأثير عميق على النتائج التجريبية ويجب أن يظل موحدا عبر العينات والظروف21.
ومع ذلك ، فإن التأثير الكبير للتحميل الميكانيكي (غير الميكانيكي) على النتائج التجريبية هو ميزة رئيسية لنموذج التجميع على معظم البدائل المهندسة بالأنسجة ، خاصة وأن تكوين المصفوفة المحفوظ للزرع الأساسي يجب أن يعيد أيضا إنشاء أنماط التحميل المعقدة في الجسم الحي على المستوى الخلوي90. بينما في الممارسة العملية ، تم فقط قياس معامل المرونة الخطي ، والحد الأقصى لإجهاد الشد ، والحد الأقصى لإجهاد الشد للتجمعات حتى الآن ، تم وصف بروتوكولات قياسات قوة التعب واسترخاء الإجهاد لنباتات الأوتار الأساسية في مكان آخر ويجب أن تكون قابلة للتطبيق على التجميعات91,92. بالإضافة إلى أنماط التحميل الشبيهة بالجسم الحي ، من المحتمل أن تكون النمطية متعددة المستويات للتجميع هي أكبر ميزة لها. بفضل غرف الاستزراع الفردية ، يمكن ضبط مجموعة من الظروف المتخصصة التي يمكن التحكم فيها لكل عينة على حدة (مثل درجة الحرارة ، وتوتر الأكسجين ، وتركيز الجلوكوز ، والمكملات ، والمحفزات ، والمثبطات ، والتمدد الثابت مع لوحة). بعد ذلك ، يمكن تخصيص صلابة المصفوفة وتكوين المصفوفة للمقصورة الخارجية من خلال تركيبة الهيدروجيل وسيسمح ، على سبيل المثال ، بدراسة تأثير البيئة الدقيقة للأنسجة المريضة بشكل متزايد من خلال دمج المزيد من الكولاجين -3 والفبرونيكتين الخلوي93،94،95. يمكن بسهولة التكيف مع مجموعات الخلايا التي تم تقييمها في المقصورة الخارجية عن طريق اختيار الخلايا التي يجب زرعها ولكن يمكن أيضا تعديلها في زرع قلب الأوتار من خلال الاستفادة من خطوط الخلايا المعدلة وراثيا وخطوط الفأر (أي استنفاد خلايا ScxLin)96. توفر المصفوفة المختلفة وتكوين الخلية للمقصورتين بنية ثلاثية الأبعاد مجزأة فريدة من نوعها وهي سمة مميزة أخرى للوترالمركزي 1،30،46.
عند استخدام هذا النظام ، من المهم مراعاة عواقب نمطية النظام على دقة معلمات النتائج. بينما يمكن تقييم تكاثر الخلايا وتجنيدها لكل حجرة على حدة ، فإن الخواص الميكانيكية ومكونات الإفراز ومنتجات التحلل قابلة للقياس حاليا فقط للتجميع الكامل. فيما يتعلق بالإنتاجية ، يمكن لشخص واحد مدرب بشكل صحيح إعداد ما يصل إلى 50 مجموعة في يوم عمل عادي ، مع كون عنق الزجاجة الرئيسي هو إجراء التثبيت. في حين أن بعض طرق القراءة يستبعد بعضها البعض ، فمن الممكن تقييم الخواص الميكانيكية ومكونات الإفراز بشكل متكرر على نفس العينة وكذلك إما تكوين عدد الخلايا (قياس التدفق الخلوي) ، أو نسخ الخلية (RT-qPCR ، تسلسل الحمض النووي الريبي) ، أو توزيع المصفوفة والخلايا (الكيمياء المناعية / المجهر الفلوري) في نقاط النهاية. في المنشورات السابقة ، تم نشر هذه الطرق لتوصيف التفاعلات بين الخلايا وعبر الأجزاء على نطاق واسع في النواة // الخلايا الليفية وتجمعات البلاعم الأساسية // المعرضة لمكانة تشبه الآفة84,85. في هذا العمل ، تم استكشاف قدرة نظام نموذج التجميع على استكشاف التفاعل عبر الأجزاء بين الخلايا البطانية الأساسية والخارجية تحت محفزات بيئية دقيقة مختلفة.
تسمح نمطية النظام النموذجي بتحسين الطريقة في المستقبل ، وهو أمر ضروري للتغلب على القيود التالية لتكرار التصميم الحالي. كشف تحليل التدفق الخلوي المقدم في هذا العمل وبيانات تسلسل الحمض النووي الريبي أحادية الخلية المنشورة مؤخرا أن الخلايا الوترية المقيمة في قلب الأوتار والمجموعات المشتقة من وتر العرقوب أكثر تجانسا مما كان يفترض سابقا24،34،59،84،97. بالإضافة إلى ذلك ، فإن السلوك المهاجر لمجموعات الخلايا الأساسية أو المقيمة في هيدروجيل في البداية يطمس تجزئة التجميع أثناء الثقافة. كلا العاملين معا يجعلان من الصعب عزو الاختلافات النسخية إلى أنواع معينة من الخلايا وفصل الانتشار - عن العمليات القائمة على الهجرة. يمكن التغلب على هذا القيد عن طريق تحسين مجتمع المدخلات باستخدام فرز الخلايا المنشطة بالفلورة (FACS) بناء على التركيب الخلوي للأوتار السليمة أو المريضة التي تم وصفها في الدراسات الحديثة في الجسم الحي ، وتحسين القراءة من خلال تنفيذ تسلسل الحمض النووي الريبي أحادي الخلية ، ودمج علامات الانتشار مثل تلطيخ EdU (5-ethynyl-2'-deoxyuridine) أثناء الفحص المجهري.
تشترك التجميعات المعروضة هنا أيضا في ضعف مع معظم الأنظمة المختبرية المتوفرة حاليا والتي تحاكي الأعضاء المريضة المنفصلة عن بقية الجسم98,99. ومع ذلك ، فإن المنصة القائمة على غرفة الاستزراع المستخدمة هنا تضع النظام النموذجي جيدا للاندماج في منصة متعددة الأعضاء حيث يتم توصيل التجمعات التي تحاكي الأعضاء المختلفة ويمكن دراسة التفاعلات بين الأعضاء.
يعتمد النظام النموذجي في جوهره على أوتار القوارض الموضعية ، مما يؤدي إلى مجموعة فريدة من العيوب الخاصة به. أولا ، تعوق قابلية ترجمة النتائج الفئران البرية التي لا تتطور أو تعاني من أمراض الأوتار 8,100,101. إن دمج الأنسجة والخلايا من البشر أو سلالات الفئران المطورة حديثا والتي تظهر جوانب من مرض الأوتار يمكن أن يخفف من هذه المشكلة102. إن التحول نحو التجميع القائم على الإنسان مثير للاهتمام بشكل خاص ، لأنه سيمكن من إجراء دراسات على الأنسجة المشتقة من المريض من الأوتار المريضة بشكل مختلف (مثل التهاب الأوتار أو الأوتار أو التهاب الحضاق) وحتى المتبرعين المقاومين للعلاج الذين يمكنهم فتح برامج علاج أكثر تخصيصا. ثانيا ، لا تتعامل نباتات وتر ذيل الفئران مع الأضرار الدقيقة الناجمة عن الحمل الزائد بشكل جيد بشكل خاص ، مما يحد من قابلية تطبيق النظام النموذجي لدراسة تلف الأوتار الحاد.
لكل هذه الأسباب ، فإن تجمعات explant // hydrogel في وضع رئيسي لدراسة بيولوجيا الأوتار الأساسية ، وتفاعلات بنية المصفوفة والوظيفة ، والتفاعلات المتقاطعة بين مجموعات خلايا معينة استجابة للتلف الدقيق الناجم عن المتخصصة. يمكن للرؤى التي تم جمعها من هذه الدراسات عالية الإنتاجية إلى حد ما أن تعطي توجيها للبحث والتطوير العلاجي في الجسم الحي .
Disclosures
ليس لدى المؤلفين ما يكشفون عنه.
Acknowledgements
تم تمويل هذا العمل من قبل منحة ETH 1-005733
Materials
| Name | Company | Catalog Number | Comments |
| 0.4 mm x 25 mm injection needle (G27) | Sterican | 9186174 | |
| 3D printing filament: Clear polylactic acid prusament | Prusa | NA | |
| 4% formaldehyde | Roti-Histofix | P087.4 | |
| Accutase cell detachment solution | Sigma-Aldrich | A6964-100ML | |
| Amphotericin | VWR | L0009-100 | |
| Attachable digital C-mount camera: Moticam 2 | Motic | NA | |
| Bolt screw M3 x 16 mm, stainless steel | RS PRO | 1871235 | |
| Bolt screw M3 x 6 mm, stainless steel | RS PRO | 1871207 | |
| CaCl2 | Sigma-Aldrich | C5670 | |
| CD146 antibody: PE anti-mouse | BioLegend | 134703 | |
| CD206 antibody: Alexa Fluor 488 anti-mouse | BioLegend | 141709 | |
| CD31 antibody: Alexa Fluor 488 anti-mouse | BioLegend | 102413 | |
| CD86 antibody: PE anti-mouse | BioLegend | 105007 | |
| Collagenase I | Thermo Fisher Scientific | 17100017 | |
| Collagenase IV | Gibco | 17104-019 | |
| Dialyzed Fetal Bovine Serum (FBS) | Sigma-Aldrich | F0392-100ML | |
| Dimethyl sulfoxide (DMSO) | Sigma-Aldrich | 7000183 | |
| Dispase II | Sigma-Aldrich | D4693-1G | |
| DMEM/F12 | Sigma | 7002211 | |
| Dowel Pin, 3 mm x 16 mm, stainless steel | Accu | HDP-3-16-A1 | |
| Dragon Skin 10 Slow/1 silicone | KauPO | 09301-004-000001 | |
| Endopan 3 Kit | Pan-Biotech | P04-0010K | |
| Endothelial cell growth supplement | Lonza | CC-3162 | |
| Eppendorf safe-lock plastic tubes (1.5 mL) | Eppendorf | 30121023 | |
| Ethidium homodimer, EthD-1, 2 mM stock in DMSO | Sigma-Aldrich | 46043-1MG-F | |
| F4/80 antibody: Apc/fire 750 anti-mouse | BioLegend | 123151 | |
| Falcon plastic tube (15 mL) | Corning | 352096 | |
| Falcon plastic tube (50 mL) | Corning | 352070 | |
| Flow cytometer: LSR II Fortessa | BD Bioscience | 23-11617-02 | |
| Gelatin | Invitrogen | D12054 | |
| Hellmanex III alkaline cleaning concentrate | Sigma | Z805939-1EA | |
| Heparin | Sigma-Aldrich | H3149-10KU | |
| Hydroxyproline assay | Sigma-Aldrich | MAK008 | |
| Image analysis software: Motic Images Plus 3.0 ML | Motic | NA | |
| L-Ascorbic Acid Phosphate Magnesium Salt n-Hydrate | Wako Chemicals | 013-19641 | |
| LSE Low Speed Orbital Shaker | Corning | 6780-FP | |
| MEM non-essential amino acids | Sigma | 7002231 | |
| Mouse macrophage-stimulating factor (m-CSF) | PeproTech | 315-02-50ug | |
| MSD assay | Mesoscale Discovery | various | |
| NucBlue | Thermo Fisher Scientific | R37605 | |
| Nylon mesh strainer cap, 100 µm | Corning | 734-2761 | |
| Original Prusa i3 MK3S 3D printer | Prusa | i3 MK3S | |
| Penicillin-Streptomycin | Sigma-Aldrich | P4333 | |
| Phosphate-buffered saline (PBS), ph 7.4, sterile, 10 L | Gibco | 10010001 | |
| Puromycin | Gibco | A1113803 | |
| RBC lysis buffer | VWR | 786-650 | |
| recombinant m-CSF | PeproTech | 315-02 | |
| RNA extraction kit: Rneasy plus Micro | Qiagen | 74034 | |
| Slicing software: PrusaSlicer | Prusa | NA | Version 2.6.0 or higher |
| Sterile Cell Strainer 100 µm | Fisherbrand | 22363549 | |
| Surgical scalpel blade No. 21 | Swann-Morton | 307 | |
| Trizol reagent | Thermo Fisher Scientific | 15596018 | |
| Trypsin-EDTA (0.5 %) | Gibco | 15400054 |
References
- Snedeker, J. G., Foolen, J. Tendon injury and repair - A perspective on the basic mechanisms of tendon disease and future clinical therapy. Acta Biomaterialia. 63, 18-36 (2017).
- Wang, J. H. C. Mechanobiology of tendon. Journal of Biomechanics. 39 (9), 1563-1582 (2006).
- Kirkendall, D. T., Garrett, W. E. Function and biomechanics of tendons. Scandinavian Journal of Medicine and Science in Sports. 7 (2), 62-66 (1997).
- Götmark, F., Cafaro, P., O'Sullivan, J. Aging human populations: Good for us, good for the earth. Trends in Ecology and Evolution. 33 (11), 851-862 (2018).
- Maffulli, N., Wong, J., Almekinders, L. C. Types and epidemiology of tendinopathy. Clinics in Sports Medicine. 22 (4), 675-692 (2003).
- Renström, P. A. F. H., Woo, S. L. -. Y. Tendinopathy: A major medical problem in sport. Tendinopathy in Athletes. , (2007).
- Screen, H. R. C., Birk, D. E., Kadler, K. E., Ramirez, F., Young, M. Tendon functional extracellular matrix. Journal of Orthopaedic Research. 33 (6), 793-799 (2016).
- Wunderli, S. L., Blache, U., Snedeker, J. G., Wunderli, S. L., Blache, U., Tendon, J. G. S. Tendon explant models for physiologically relevant in vitro study of tissue biology - a perspective. Connective Tissue Research. 61 (3-4), 262-277 (2020).
- Magnusson, S. P., Langberg, H., Kjaer, M. The pathogenesis of tendinopathy: balancing the response to loading. Nature Reviews Rheumatology. 6 (5), 262-268 (2010).
- Heinemeier, K. M., Schjerling, P., Øhlenschlæger, T. F., Eismark, C., Olsen, J., Kjær, M. Carbon-14 bomb pulse dating shows that tendinopathy is preceded by years of abnormally high collagen turnover. FASEB Journal. 32 (9), 4763-4775 (2018).
- Andersson, G., Backman, L. J., Scott, A., Lorentzon, R., Forsgren, S., Danielson, P. Substance P accelerates hypercellularity and angiogenesis in tendon tissue and enhances paratendinitis in response to Achilles tendon overuse in a tendinopathy model. British Journal of Sports Medicine. 45 (13), 1017-1022 (2011).
- Rolf, C. G., Fu, B. S. C., Pau, A., Wang, W., Chan, B. Increased cell proliferation and associated expression of PDGFRβ causing hypercellularity in patellar tendinosis. Rheumatology. 40 (3), 256-261 (2001).
- Riley, G. The pathogenesis of tendinopathy. A molecular perspective. Rheumatology. 43 (2), 131-142 (2004).
- Jarvinen, M., Jozsa, L., Kannus, P., Järvinen, T. L., Kvist, M., Leadbetter, W. Histopathological findings in chronic tendon disorders. Scandinavian Journal of Medicine & Science in Sports. 7 (2), 86-95 (1997).
- Soslowsky, L. J., et al. Overuse activity injures the supraspinatus tendon in an animal model: A histologic and biomechanical study. Journal of Shoulder and Elbow Surgery. 9 (2), 79-84 (2000).
- Tran, P. H. T., et al. Early development of tendinopathy in humans: Sequence of pathological changes in structure and tissue turnover signaling. FASEB Journal. 34 (1), 776-788 (2020).
- Theodossiou, S. K., Schiele, N. R. Models of tendon development and injury. BMC Biomedical Engineering. 1 (1), 1-24 (2019).
- Stauber, T., Blache, U., Snedeker, J. G. Tendon tissue microdamage and the limits of intrinsic repair. Matrix Biology. 85-86, 68-79 (2020).
- Wang, T., et al. In vitro loading models for tendon mechanobiology. Journal of Orthopaedic Research. 36 (2), 566-575 (2018).
- Fang, F., Sawhney, A. S., Lake, S. P. Different regions of bovine deep digital flexor tendon exhibit distinct elastic, but not viscous, mechanical properties under both compression and shear loading. Journal of Biomechanics. 47 (12), 2869-2877 (2014).
- Wunderli, S. L., et al. Tendon response to matrix unloading is determined by the patho-physiological niche. Matrix Biology. 89, 11-26 (2020).
- Wunderli, S. L., et al. Minimal mechanical load and tissue culture conditions preserve native cell phenotype and morphology in tendon - A novel ex vivo mouse explant model. Journal of Orthopaedic Research. 36 (5), 1383-1390 (2017).
- Arnoczky, S. P., Lavagnino, M., Egerbacher, M., Caballero, O., Gardner, K. Matrix metalloproteinase inhibitors prevent a decrease in the mechanical properties of stress-deprived tendons. The American Journal of Sports Medicine. 35 (5), 763-769 (2007).
- de Micheli, A. J., et al. Single-cell transcriptomic analysis identifies extensive heterogeneity in the cellular composition of mouse Achilles tendons. American Journal of Physiology - Cell Physiology. 319 (5), C885-C894 (2020).
- Arvind, V., Huang, A. H. Reparative and maladaptive inflammation in tendon healing. Frontiers in Bioengineering and Biotechnology. 9 (July), 1-16 (2021).
- Marsolais, D., Côté, C. H., Frenette, J. Neutrophils and macrophages accumulate sequentially following Achilles tendon injury. Journal of Orthopaedic Research. 19 (6), 1203-1209 (2001).
- Garcia-Melchor, E., et al. Novel self-amplificatory loop between T cells and tenocytes as a driver of chronicity in tendon disease. Annals of the Rheumatic Diseases. 80 (8), 1075-1085 (2021).
- Stolk, M., Klatte-Schulz, F., Schmock, A., Minkwitz, S., Wildemann, B., Seifert, M. New insights into tenocyte-immune cell interplay in an in vitro model of inflammation. Scientific Reports. 7 (1), 9801 (2017).
- Tempfer, H., Traweger, A. Tendon vasculature in health and disease. Frontiers in Physiology. 6, 330 (2015).
- Mienaltowski, M. J., Adams, S. M., Birk, D. E. Regional differences in stem cell/progenitor cell populations from the mouse achilles tendon. Tissue Engineering - Part A. 19 (1-2), 199-210 (2013).
- Sakabe, T., et al. Transcription factor scleraxis vitally contributes to progenitor lineage direction in wound healing of adult tendon in mice. Journal of Biological Chemistry. 293, (2018).
- Dyment, N. A., Hagiwara, Y., Matthews, B. G., Li, Y., Kalajzic, I., Rowe, D. W. Lineage tracing of resident tendon progenitor cells during growth and natural healing. PLoS One. 9 (4), e96113 (2014).
- Harvey, T., Flamenco, S., Fan, C. M. A Tppp3 + Pdgfra + tendon stem cell population contributes to regeneration and reveals a shared role for PDGF signalling in regeneration and fibrosis. Nature Cell Biology. 21 (12), 1490-1503 (2019).
- Zhang, J., et al. Characterization of the structure, vascularity, and stem/progenitor cell populations in porcine Achilles tendon (PAT). Cell and Tissue Research. 384 (2), 367-387 (2021).
- Tarafder, S., et al. Tendon stem/progenitor cells regulate inflammation in tendon healing via JNK and STAT3 signaling. FASEB Journal. 31 (9), 3991-3998 (2017).
- Lee, C. H., et al. Harnessing endogenous stem/progenitor cells for tendon regeneration Find the latest version Harnessing endogenous stem/progenitor cells for tendon regeneration. J Clin Invest. 125 (7), 2690-2701 (2015).
- Lui, P. P. Y., Chan, L. S., Cheuk, Y. C., Lee, Y. W., Chan, K. M. Expression of bone morphogenetic protein-2 in the chondrogenic and ossifying sites of calcific tendinopathy and traumatic tendon injury rat models. Journal of Orthopaedic Surgery and Research. 4, 27 (2009).
- Takeuchi, E., et al. Localization and expression of osteopontin in the rotator cuff tendons in patients with calcifying tendinitis. Virchows Archiv. 438 (6), 612-617 (2001).
- Kadler, K. E., Hill, A., Canty-Laird, E. G. Collagen fibrillogenesis: fibronectin, integrins, and minor collagens as organizers and nucleators. Current Opinion in Cell Biology. 20 (5), 495-501 (2008).
- Millar, N. L., et al. MicroRNA29a regulates IL-33-mediated tissue remodelling in tendon disease. Nature Communications. 6, 6774 (2015).
- Riley, G. P., Harrall, R. L., Constant, C. R., Chard, M. D., Cawston, T. E., Hazleman, B. L. Tendon degeneration and chronic shoulder pain: changes in the collagen composition of the human rotator cuff tendons in rotator cuff tendinitis. Annals of the Rheumatic Diseases. 53 (6), 359-366 (1994).
- Thorpe, C. T., Peffers, M. J., Simpson, D., Halliwell, E., Screen, H. R. C., Clegg, P. D. Anatomical heterogeneity of tendon: Fascicular and interfascicular tendon compartments have distinct proteomic composition. Scientific Reports. 6, 20455 (2016).
- Thorpe, C. T., et al. Distribution of proteins within different compartments of tendon varies according to tendon type. Journal of Anatomy. 229 (3), 450-458 (2016).
- Choi, H., et al. Heterogeneity of proteome dynamics between connective tissue phases of adult Tendon. eLife. 9, e55262 (2020).
- Spiesz, E. M., et al. Tendon extracellular matrix damage, degradation and inflammation in response to in vitro overload exercise. Journal of Orthopaedic Research. 33 (6), 889-897 (2015).
- Dyment, N. A., et al. The paratenon contributes to scleraxis-expressing cells during patellar tendon healing. PLoS One. 8 (3), e59944 (2013).
- Cadby, J. A., Buehler, E., Godbout, C., Van Weeren, P. R., Snedeker, J. G. Differences between the cell populations from the peritenon and the tendon core with regard to their potential implication in tendon repair. PLoS One. 9 (3), e92474 (2014).
- Huh, D., Hamilton, G. A., Ingber, D. E. From three-dimensional cell culture to organs-on-chips. Trends in Cell Biology. 21 (12), 745-754 (2011).
- Duval, K., et al. Modeling physiological events in 2D vs. 3D cell culture. Physiology. 32 (4), 266 (2017).
- Wang, J. H. C. Mechanobiology of tendon. Journal of Biomechanics. 39 (9), 1563-1582 (2006).
- Derwin, K. A., Soslowsky, L. J. A quantitative investigation of structure-function relationships in a tendon fascicle model. Journal of Biomechanical Engineering. 121 (6), 598-604 (1999).
- Herod, T. W., Veres, S. P. Development of overuse tendinopathy: A new descriptive model for the initiation of tendon damage during cyclic loading. Journal of Orthopaedic Research. 36 (1), 467-476 (2017).
- Andersen, M. B., Pingel, J., Kjær, M., Langberg, H. Interleukin-6: A growth factor stimulating collagen synthesis in human tendon. Journal of Applied Physiology. 110 (6), 1549-1554 (2011).
- Langberg, H., Rosendal, L., Kjær, M. Training-induced changes in peritendinous type I collagen turnover determined by microdialysis in humans. Journal of Physiology. 534 (1), 297-302 (2001).
- Zitnay, J. L., et al. Molecular level detection and localization of mechanical damage in collagen enabled by collagen hybridizing peptides. Nature Communications. 8, 14913 (2017).
- Hwang, J., et al. Molecular assessment of collagen denaturation in decellularized tissues using a collagen hybridizing peptide. Acta Biomaterialia. 53, 268-278 (2016).
- Lin, A. H., Zitnay, J. L., Li, Y., Yu, S. M., Weiss, J. A. Microplate assay for denatured collagen using collagen hybridizing peptides. Journal of Orthopaedic Research. 37 (2), 431-438 (2019).
- Blomgran, P., Blomgran, R., Ernerudh, J., Aspenberg, P. A possible link between loading, inflammation and healing: Immune cell populations during tendon healing in the rat. Scientific Reports. 6, 29824 (2016).
- Harvey, T., Flamenco, S., Fan, C. -. M. A Tppp3+Pdgfra+ tendon stem cell population contributes to regeneration and reveals a shared role for PDGF signalling in regeneration and fibrosis. Nature Cell Biology. 21 (12), 1490-1503 (2019).
- Pryce, B. A., Brent, A. E., Murchison, N. D., Tabin, C. J., Schweitzer, R. Generation of transgenic tendon reporters, ScxGFP and ScxAP, using regulatory elements of the scleraxis gene. Developmental Dynamics. 236 (6), 1677-1682 (2007).
- Godinho, M. S. C., Thorpe, C. T., Greenwald, S. E., Screen, H. R. C. Elastin is localised to the interfascicular matrix of energy storing tendons and becomes increasingly disorganised with ageing. Scientific Reports. 7 (1), 9713 (2017).
- Smith, M. M., et al. Modulation of aggrecan and ADAMTS expression in ovine tendinopathy induced by altered strain. Arthritis and Rheumatism. 58 (4), 1055-1066 (2008).
- Asundi, K. R., Rempel, D. M. MMP-1, IL-1β, and COX-2 mRNA expression is modulated by static load in rabbit flexor tendons. Annals of Biomedical Engineering. 36 (2), 237-243 (2008).
- Millar, N. L., et al. Inflammation is present in early human tendinopathy. American Journal of Sports Medicine. 38 (10), 2085-2091 (2010).
- Dakin, S. G., et al. Inflammation activation and resolution in human tendon disease. Science Translational Medicine. 7 (311), 311ra173 (2015).
- Jelinsky, S. A., Rodeo, S. A., Li, J., Gulotta, L. V., Archambault, J. M., Seeherman, H. J. Regulation of gene expression in human tendinopathy. BMC Musculoskeletal Disorders. 12, 86 (2011).
- Kannus, P., Józsa, L. Histopathological changes preceding spontaneous rupture of a tendon. A controlled study of 891 patients. The Journal of Bone and Joint Surgery. American. 73 (10), 1507-1525 (1991).
- Comin, J., et al. The prevalence and clinical significance of sonographic tendon abnormalities in asymptomatic ballet dancers: A 24-month longitudinal study. British Journal of Sports Medicine. 47 (2), 89-92 (2013).
- Schubert, T. E. O., Weidler, C., Lerch, K., Hofstädter, F., Straub, R. H. Achilles tendinosis is associated with sprouting of substance P positive nerve fibres. Annals of the Rheumatic Diseases. 64 (7), 1083-1086 (2005).
- Quigley, A. S., Bancelin, S., Deska-Gauthier, D., Légaré, F., Kreplak, L., Veres, S. P. In tendons, differing physiological requirements lead to functionally distinct nanostructures. Scientific Reports. 8 (1), 4409 (2018).
- Herod, T. W., Chambers, N. C., Veres, S. P. Collagen fibrils in functionally distinct tendons have differing structural responses to tendon rupture and fatigue loading. Acta Biomaterialia. 42, 296-307 (2016).
- Shepherd, J. H., Riley, G. P., Screen, H. R. C. Early stage fatigue damage occurs in bovine tendon fascicles in the absence of changes in mechanics at either the gross or micro-structural level. Journal of the Mechanical Behavior of Biomedical Materials. 38, 163-172 (2014).
- Birch, H. L. Tendon matrix composition and turnover in relation to functional requirements. International Journal of Experimental Pathology. 88 (4), 241-248 (2007).
- Kapałczyńska, M., et al. 2D and 3D cell cultures - a comparison of different types of cancer cell cultures. Archives of Medical Science. 14 (4), 910-919 (2018).
- Hussien, A. A., Niederoest, B., Bollhalder, M., Goedecke, N., Snedeker, J. G. The stiffness-sensitive transcriptome of human tendon stromal cells. Advanced Healthcare Materials. 12 (7), 2101216 (2023).
- Heo, S. J., et al. Aberrant chromatin reorganization in cells from diseased fibrous connective tissue in response to altered chemomechanical cues. Nature Biomedical Engineering. 7 (2), 177-191 (2023).
- Liu, C. -. F., Aschbacher-Smith, L., Barthelery, N. J., Dyment, N., Butler, D., Wylie, C. What we should know before using tissue engineering techniques to repair injured tendons: A developmental biology perspective. Tissue Engineering Part B: Reviews. 17 (3), 165-176 (2011).
- Ruiz-Alonso, S., Lafuente-Merchan, M., Ciriza, J., Saenz-del-Burgo, L., Pedraz, J. L. Tendon tissue engineering: Cells, growth factors, scaffolds and production techniques. Journal of Controlled Release. 333, 448-486 (2021).
- Rinoldi, C., et al. Tendon tissue engineering: Effects of mechanical and biochemical stimulation on stem cell alignment on cell-laden hydrogel yarns. Advanced Healthcare Materials. 8 (7), e1801218 (2019).
- Walia, B., Huang, A. H. Tendon stem progenitor cells: Understanding the biology to inform therapeutic strategies for tendon repair. Journal of Orthopaedic Research. 37 (6), 1270-1280 (2018).
- Thorpe, C. T., Riley, G. P., Birch, H. L., Clegg, P. D., Screen, H. R. C. Fascicles from energy-storing tendons show an age-specific response to cyclic fatigue loading. Journal of The Royal Society Interface. 11 (92), 20131058-20131058 (2014).
- Thorpe, C. T., Riley, G. P., Birch, H. L., Clegg, P. D., Screen, H. R. C. Fascicles and the interfascicular matrix show decreased fatigue life with ageing in energy storing tendons. Acta Biomaterialia. 56, 58-64 (2017).
- Youngstrom, D. W., Rajpar, I., Kaplan, D. L., Barrett, J. G. A bioreactor system for in vitro tendon differentiation and tendon tissue engineering. Journal of Orthopaedic Research. 33 (6), 911-918 (2015).
- Stauber, T., et al. Extrinsic macrophages protect while tendon progenitors degrade: Insights from a tissue engineered model of tendon compartmental crosstalk. Advanced Healthcare Materials. 10 (20), e2100741 (2021).
- Stauber, T., Moschini, G., Hussien, A. A., Jaeger, P. K., De Bock, K., Snedeker, J. G. IL-6 signaling exacerbates hallmarks of chronic tendon disease by stimulating progenitor proliferation & migration to damage. eLife. 12, RP87092 (2023).
- Doillon, C. J., Mantovani, D., Rajan, N., Habermehl, J., Cote, M. Preparation of ready-to-use storable and reconstituted type I collagen from rat tail tendon for tissue engineering applications. Nature Protocols. 1 (6), 2753-2758 (2007).
- Blache, U., et al. Inhibition of ERK 1/2 kinases prevents tendon matrix breakdown. Scientific Reports. 11 (1), 6838 (2021).
- Liu, X., et al. The role of vascular endothelial growth factor in tendon healing. Frontiers in Physiology. 12, 766080 (2021).
- Claxton, S., Kostourou, V., Jadeja, S., Chambon, P., Hodivala-dilke, K., Fruttiger, M. Efficient, inducible Cre-recombinase activation in vascular endothelium. Genesis. 46 (2), 74-80 (2008).
- Passini, F. S., et al. Shear-stress sensing by PIEZO1 regulates tendon stiffness in rodents and influences jumping performance in humans. Nature Biomedical Engineering. 5 (12), 1457-1471 (2021).
- Lee, A. H., Szczesny, S. E., Santare, M. H., Elliott, D. M. Investigating mechanisms of tendon damage by measuring multi-scale recovery following tensile loading. Acta Biomaterialia. 57, 363-372 (2017).
- Lee, A. H., Elliott, D. M. Multi-scale loading and damage mechanisms of plantaris and rat tail tendons. Journal of Orthopaedic Research. 37 (8), 1827-1837 (2019).
- Williams, I. F., Heaton, A., McCullagh, K. G. Cell morphology and collagen types in equine tendon scar. Research in Veterinary Science. 28 (3), 302-310 (1980).
- Maffulli, N., Ewen, S. W. B., Waterston, S. W., Reaper, J., Barrass, V. Tenocytes from ruptured and tendinopathic achilles tendons produce greater quantities of type III collagen than tenocytes from normal achilles tendons: An in vitro model of human tendon healing. American Journal of Sports Medicine. 28 (4), 499-505 (2000).
- Pajala, A., Melkko, J., Leppilahti, J., Ohtonen, P., Soini, Y., Risteli, J. Tenascin-C and type I and III collagen expression in total Achilles tendon rupture. An immunohistochemical study. Histology and Histopathology. 24 (10), 1207-1211 (2009).
- Best, K. T., et al. Scleraxis-lineage cell depletion improves tendon healing and disrupts adult tendon homeostasis. eLife. 10, e62203 (2021).
- Lehner, C., et al. Tenophages: A novel macrophage-like tendon cell population expressing CX3CL1 and CX3CR1. DMM Disease Models and Mechanisms. 12 (12), dmm041384 (2019).
- Ajalik, R. E., et al. Human organ-on-a-chip microphysiological systems to model musculoskeletal pathologies and accelerate therapeutic discovery. Frontiers in Bioengineering and Biotechnology. 10, 846230 (2022).
- Ingber, D. E. Human organs-on-chips for disease modelling, drug development and personalized medicine. Nature Reviews Genetics. 23 (8), 467-491 (2022).
- Brehm, M. A., Shultz, L. D., Luban, J., Greiner, D. L. Overcoming current limitations in humanized mouse research. The Journal of Infectious Diseases. 208 Suppl (Suppl 2), 125-130 (2013).
- Nunan, R., Harding, K. G., Martin, P. Clinical challenges of chronic wounds: searching for an optimal animal model to recapitulate their complexity. Disease Models & Mechanisms. 7 (11), 1205-1213 (2014).
- Costa-Almeida, R., Calejo, I., Reis, R. L., Gomes, M. E. Crosstalk between adipose stem cells and tendon cells reveals a temporal regulation of tenogenesis by matrix deposition and remodeling. Journal of Cellular Physiology. 233 (7), 5383-5395 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved