热力学第一定律表明,反应的内能变化(Δ E )是热量( q )和功( w )。
在气态反应中,所完成的工作是压力-体积类型,因此会导致反应体积发生变化。
炸弹量热仪设计为在恒定体积下运行,因此不允许改变反应体积(Δ V = 0)。
因此,完成的功为零,使用炸弹量热仪测量的热量( q v )等于反应内部能量的变化。< / p>
由于量热仪是绝热的,没有热量散失到环境中,因此量热仪获得的热量等于反应释放的热量。
由于体积条件恒定,反应中放出的热量与内部能量的变化相对应。
这是经历燃烧的特定量反应物的内部能量变化。通过将值除以实际反应的摩尔数,可以得到每摩尔特定反应物的ΔErxn。
炸弹量热仪需要校准以确定量热仪的热容量并确保准确的结果。校准使用已知q值的反应完成,例如在反应前后称重的镍熔丝产生的火花点燃的苯甲酸的测定量。由已知反应产生的温度变化用于确定量热仪的热容量。通常每次使用量热仪收集研究数据之前都要进行校准。
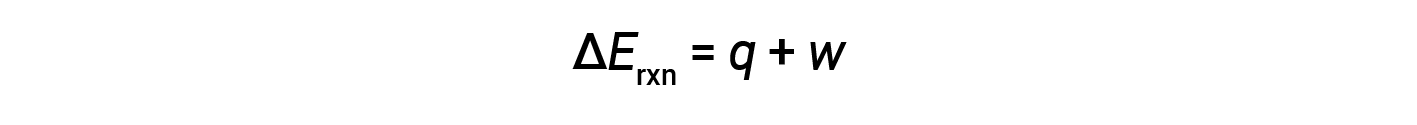
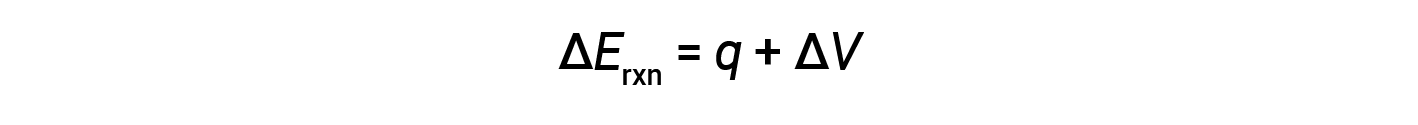
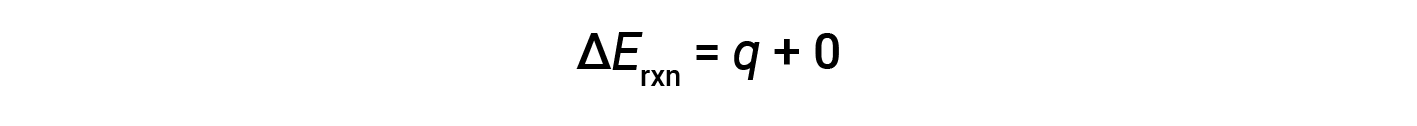
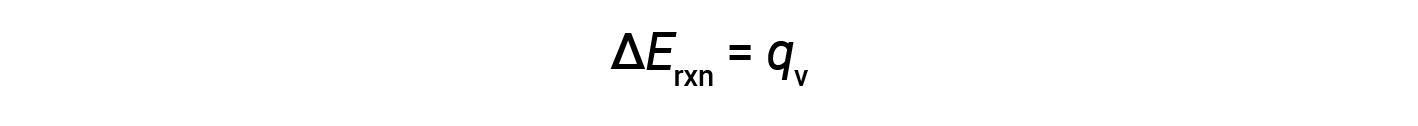
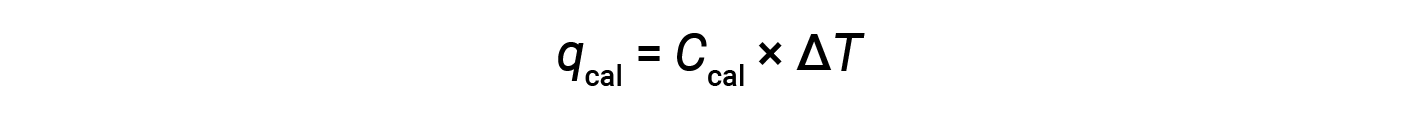
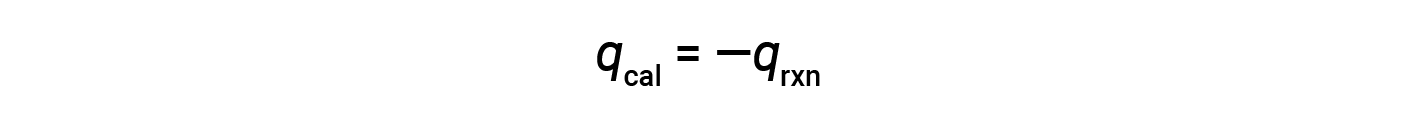
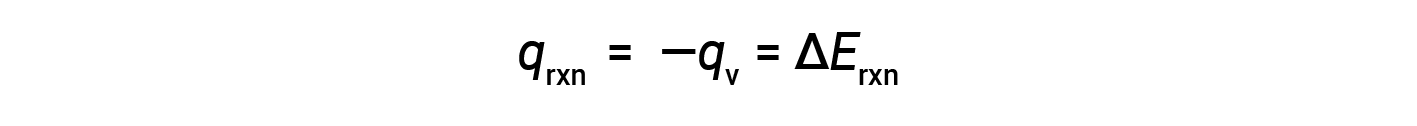
来自章节 6:

Now Playing
6.9 : 定容量热法
热化学
26.6K Views

6.1 : 能源基础
热化学
36.2K Views

6.2 : 热力学第一定律
热化学
30.3K Views

6.3 : 内能
热化学
28.2K Views

6.4 : 量化热量
热化学
52.7K Views

6.5 : 量化做功
热化学
18.7K Views

6.6 : 焓值
热化学
34.3K Views

6.7 : 热化学方程
热化学
27.8K Views

6.8 : 恒压量热法
热化学
83.3K Views

6.10 : 赫斯定律
热化学
43.7K Views

6.11 : 标准生成焓
热化学
40.4K Views

6.12 : 反应焓
热化学
31.2K Views
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。