6.11 : 标准生成焓
通常将反应物和产物处于相同条件下的反应的焓变制成表格。标准状态是一组普遍接受的条件,用作确定其他不同条件下的特性的参考点。对于化学家,IUPAC标准状态是指材料在1 bar的压力下和1 M的溶液,并且未指定温度。许多热化学表格列出了标准状态为1 atm的值。因为在如此小的压力变化(1 bar = 0.987 atm)下,反应的Δ H 变化很小,所以Δ H 值(最精确测量的除外)值)在两组标准条件下基本相同。上标" o"焓变符号中的表示标准状态。由于通常的(但不是技术标准)温度是298.15 K,因此,除非指定其他温度,否则将假定该温度。因此,符号(ΔH°)用于指示在这些条件下发生的过程的焓变。 (符号ΔH用于表示在非标准条件下发生的反应的焓变。)
许多类型的化学和物理过程的焓变可在参考文献中找到,包括燃烧反应,相变和形成反应的焓变。由于给定反应的焓变与所涉及物质的量成正比,因此可以在此基础上进行报告(即,特定反应物的量为ΔH)。但是,我们经常发现,将一个广泛的属性(ΔH)除以另一个(物质的数量),并报告每个数量的密集值ΔH,通常是"归一化"到每摩尔的基础上。
标准形成焓ΔHf°是反应的焓变,在该反应中,在标准状态下,由最稳定状态的自由元素精确地形成1摩尔纯物质。这些值对于计算或预测不切实际或危险的化学反应或难以进行测量的过程的焓变特别有用。使用已知的标准形成焓值,可以确定任何反应的焓变。
CO 2 ( g )的形成标准焓为-393.5 kJ / mol。这是放热反应的焓变:
以1个大气压和25摄氏度的压力开始反应(碳以石墨形式存在,这是在这些条件下最稳定的碳形式),最后以一摩尔CO 2 ,也处于1 atm和25℃。对于二氧化氮,NO 2 ( g ),Δ H f °为33.2 kJ / mol。这是吸热反应的焓变:
具有 1 / 2 摩尔N 2 和1摩尔O 2 的反应方程是正确的在这种情况下,因为标准的形成焓总是指1摩尔的产物:NO 2 ( g )。
根据定义,最稳定形式的元素形成的标准焓在标准条件下等于零。例如,在标准条件下,碳(石墨烯),双原子氧气,双原子氮气,钠金属和液态汞的形成标准焓为零。
标准形成焓
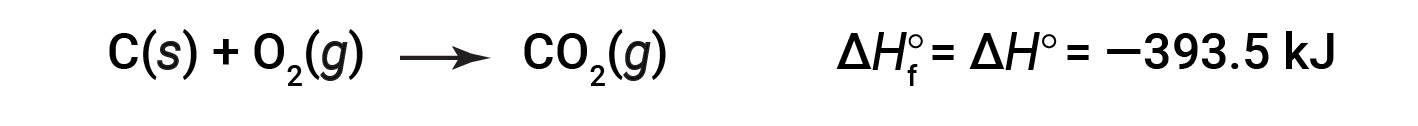
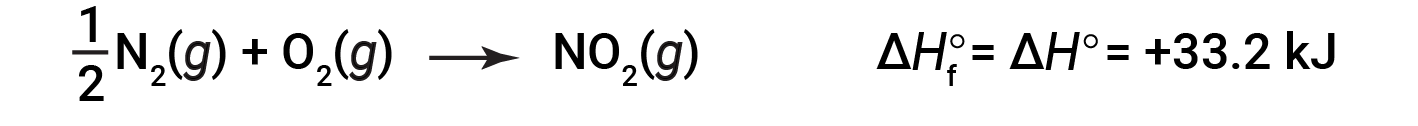
来自章节 6:

Now Playing
6.11 : 标准生成焓
热化学
40.9K Views

6.1 : 能源基础
热化学
36.8K Views

6.2 : 热力学第一定律
热化学
31.4K Views

6.3 : 内能
热化学
28.7K Views

6.4 : 量化热量
热化学
53.8K Views

6.5 : 量化做功
热化学
19.0K Views

6.6 : 焓值
热化学
34.7K Views

6.7 : 热化学方程
热化学
28.1K Views

6.8 : 恒压量热法
热化学
84.5K Views

6.9 : 定容量热法
热化学
26.8K Views

6.10 : 赫斯定律
热化学
44.3K Views

6.12 : 反应焓
热化学
31.4K Views
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。