12.10 : 凝固点降低和沸点升高
沸点升高
液体的沸点是其蒸汽压等于环境大气压力的温度。 由于存在非挥发性溶质,溶液的蒸汽压会降低,因此解决方案的沸点会随之增加。 蒸汽压随温度升高而升高,因此溶液需要比纯溶剂更高的温度才能实现任何给定的蒸汽压,包括与周围环境相同的。 当非易失性溶质溶解在溶剂 ΔTb 中时,观察到的沸点增加称为沸点升高,与溶质物种的摩尔浓度成正比:
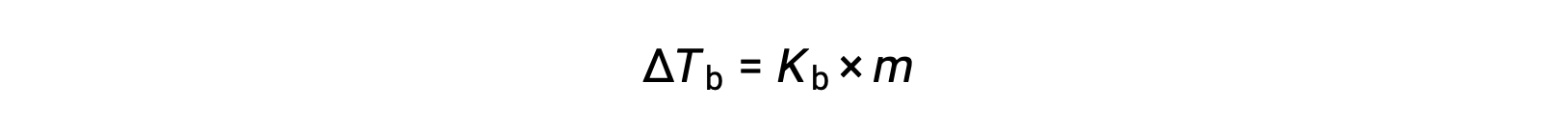
其中 KB 是沸点升高常数,或 沸点升高常数(Ebullioscopic constant) 和 m 是所有溶质物种的摩尔浓度 (质量摩尔浓度)。 沸点升高常量是取决于溶剂标识的特征性质。
凝固点降低
溶液在低于纯液体的温度下冷冻。 这种现象在使用盐,氯化钙或尿素在道路和人行道上融化冰的"除冰"方案中以及在汽车散热器中使用乙二醇作为"防冻剂"中被利用。 海水在低于淡水的温度下结冰,因此北极和南极海洋即使在低于 0 °C 的温度下也保持解冻状态 (生活在这些海洋中的鱼类和其它冷水动物的体液也是如此)。
与纯溶剂 (ΔTf) 相比,稀释溶液的凝固点减少,称为凝固点降低,与溶质的摩尔浓度直接成正比
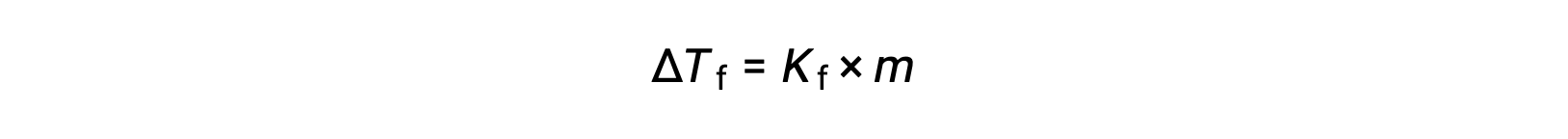
其中 m 是溶质的摩尔浓度, Kf 称为凝固点降低常数 (或 凝固点降低常数(Cryoscopic constant))。 就像沸点升高常量一样,这些常量是特征性质,其值取决于溶剂的化学特性。
摩尔质量的确定
渗透压和凝固点,沸点和蒸汽压中的变化与给定溶液数量中存在的溶质物种数量成正比。 因此,为使用已知溶质质量的溶液测量其中一个性质可以确定溶解物的摩尔质量。
例如,在 55.0 克苯中溶解的 4.00 克非电解质溶液在 2.32 °C 时被冻结 假设理想溶液行为,该化合物的摩尔质量是什么?
为了解决这个问题,首先,计算出凝固点与观察到的凝固点和纯苯凝固点的变化:
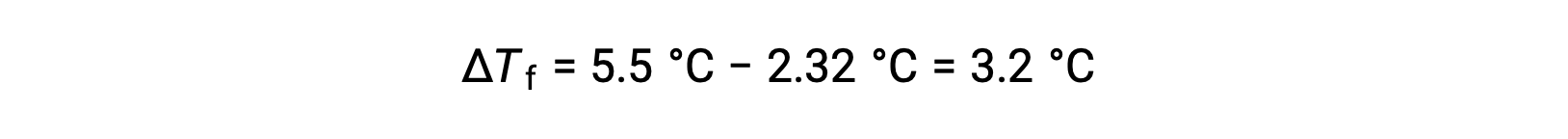
然后,由Kf苯的凝固点降低常数和 ΔTf确定摩尔浓度:
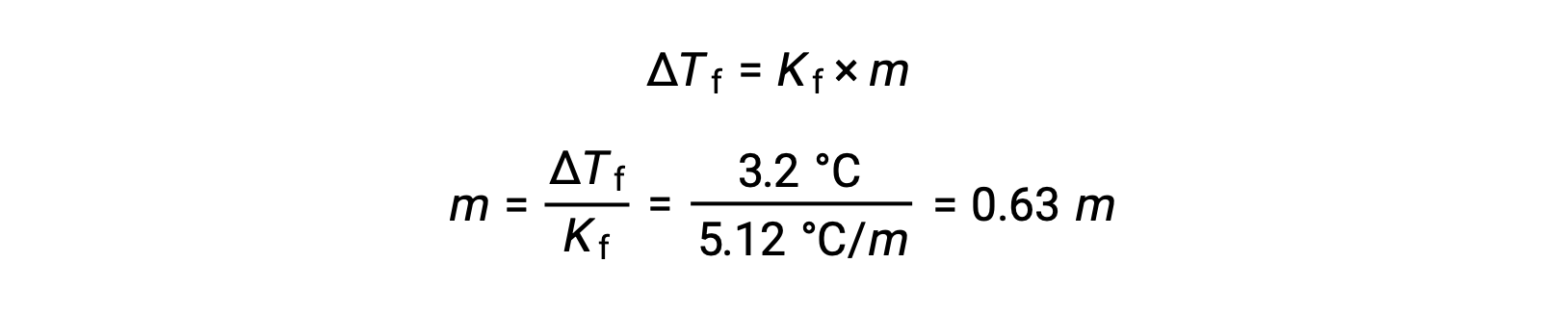
接下来,溶液中化合物的摩尔数是从用于制造溶液的摩尔浓度和溶剂质量中找到的。
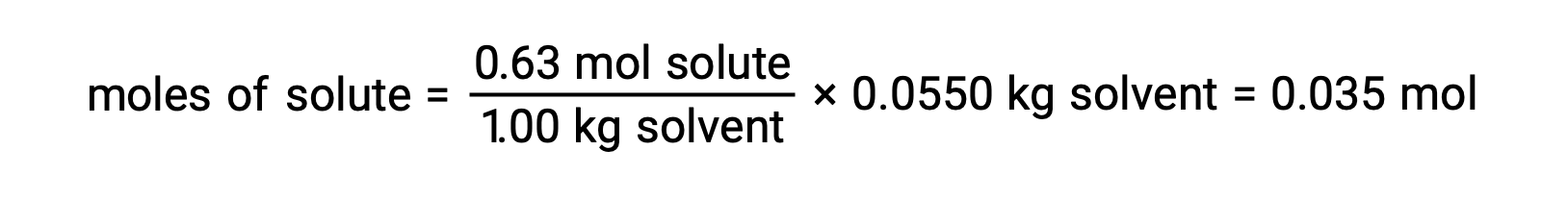
最后,确定溶质质量的摩尔质量和该质量中的模块数量。
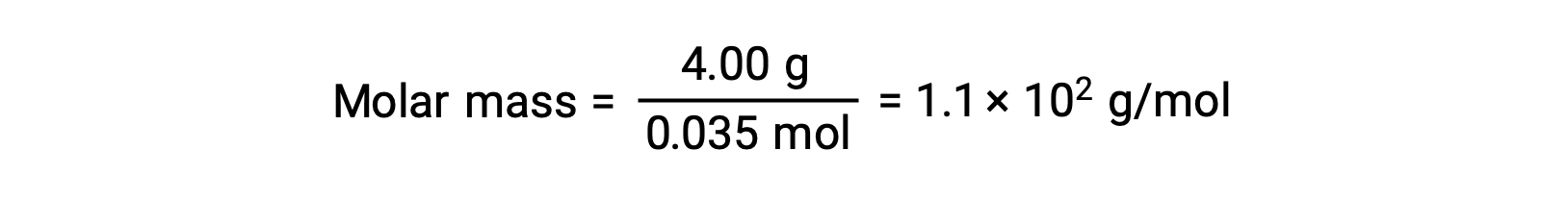
来自章节 12:

Now Playing
12.10 : 凝固点降低和沸点升高
溶液和胶体
34.1K Views

12.1 : 溶液生成
溶液和胶体
31.2K Views

12.2 : 溶液中的分子间力
溶液和胶体
33.0K Views

12.3 : 溶解焓
溶液和胶体
24.6K Views

12.4 : 水溶液与水合热
溶液和胶体
14.3K Views

12.5 : 溶液平衡与饱和
溶液和胶体
18.4K Views

12.6 : 影响溶解度的物理性质
溶液和胶体
22.4K Views

12.7 : 表达溶液浓度
溶液和胶体
58.2K Views

12.8 : 蒸汽压降低
溶液和胶体
26.0K Views

12.9 : 理想溶液
溶液和胶体
19.1K Views

12.11 : 溶液的渗透和渗透压
溶液和胶体
38.9K Views

12.12 : 电解质: 范特霍夫因子(van't Hoff Factor)
溶液和胶体
32.8K Views

12.13 : 胶体
溶液和胶体
17.3K Views
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。