当溶解在水中时,酸或碱的相对强度是其电离的程度。 如果电离反应基本上是完整的,则该酸或碱被称为强;如果电离相对较少,则该酸或碱弱。 相比强的来说,有更多的弱酸和碱。 下面列出了最常见的强酸和碱:
| 强酸 | 强碱 |
| HClO4 | LiOH |
| HCl | NaOH |
| HBr | KOH |
| Ca(OH) 2 | |
| HNO3 | SR (OH) 2 |
| H2SO4. | BA (OH) 2 |
酸的相对强度可以通过在水溶液中测量其平衡常数来量化。 在同一浓度的溶液中,酸离子的电离强度越强,因此产率的水合氢离子浓度比弱酸高。 一种酸的平衡常数称为酸离子常数 Ka。 对于酸 HA 的反应:

酸离子常数的写为
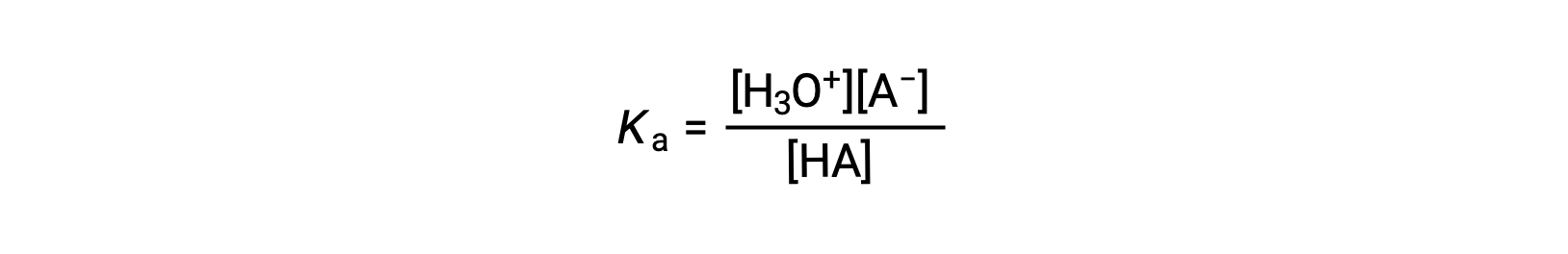
其中浓度是均衡的。 虽然水是反应中的反应物,但也是溶剂,因此我们不在方程中包括 [H2O]。 酸的Ka越大,H3O+ 和 A−的浓度相对于平衡混合物中的非电离酸浓度越大,酸越强。 当≈∞完全电离时,一种酸被分类为"强",在这种情况下, HA 的浓度为零,酸电离常数为不可测量的大 (Ka )。 部分电离的酸被称为"弱",其酸性电离常数可以通过实验测定。
为了说明这一想法,下面显示了三个酸电离方程和kA值。 电离常数从所列方程式的第一个增加到最后一个,表示相对酸强按 CH3CO2H < HNO2 < HSO4− 的顺序增加。
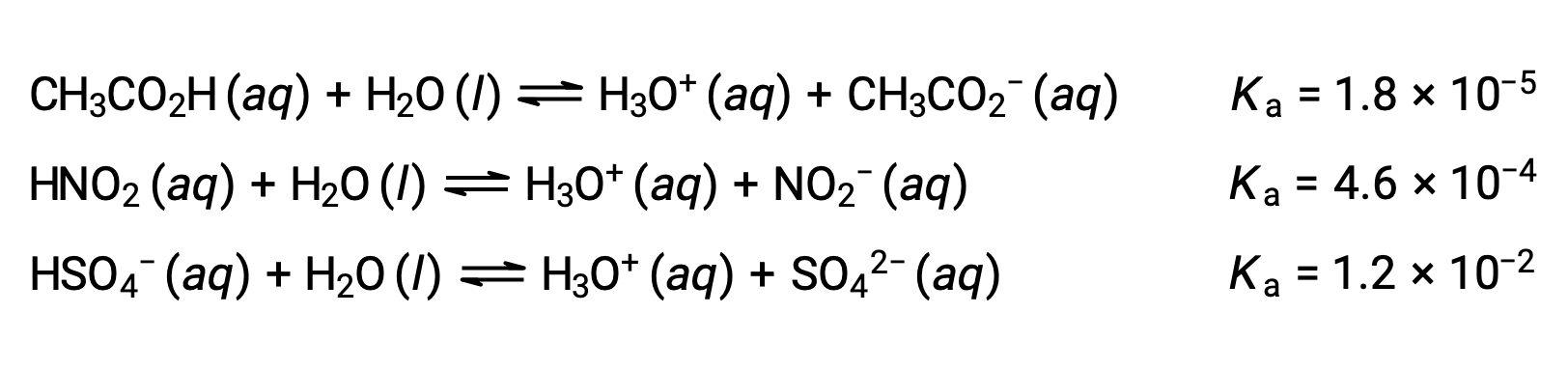
另一种衡量酸强度的方法是其电离百分比。 弱酸的电离百分比是根据平衡混合物的成分定义的:
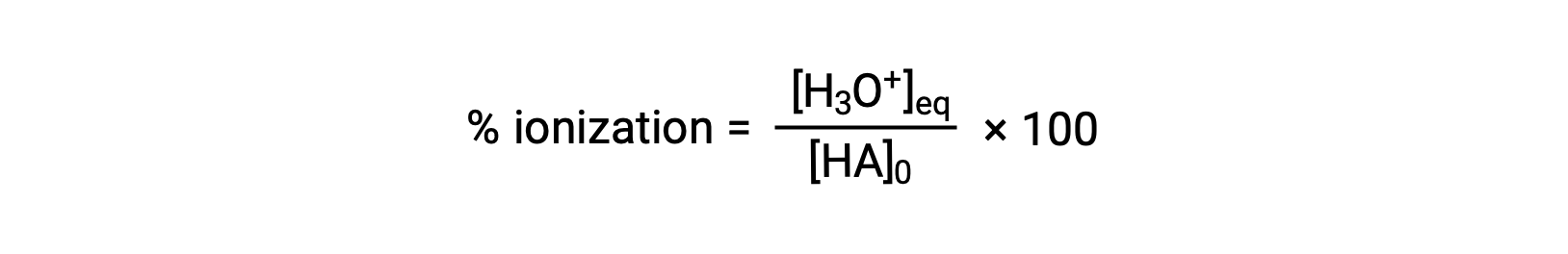
其中分子相当于酸偶联物碱的浓度 (根据化学计量法, [a− ] = [H3O+])。 与 Ka 值不同,弱酸的电离百分比随酸的初始浓度而变化,通常随着浓度的增加而下降。
就像酸一样,碱的相对强度反映在水溶液中其基电离常数 (KB) 的幅度中。 在同一浓度的溶液中,碱离子化程度越高,因此产率比弱碱的氢氧化物离子浓度更高。 强度较高的碱的电离常数大于强度较低的碱。 对于碱, B 的反应:
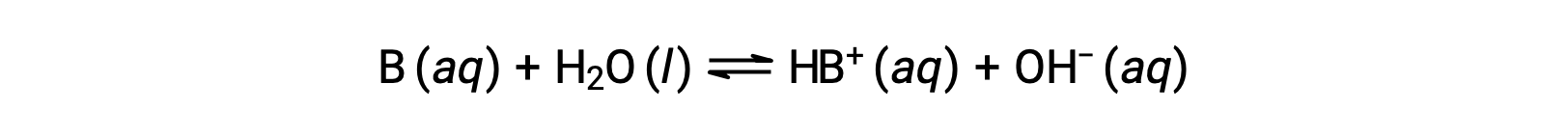
电离常数被写入为
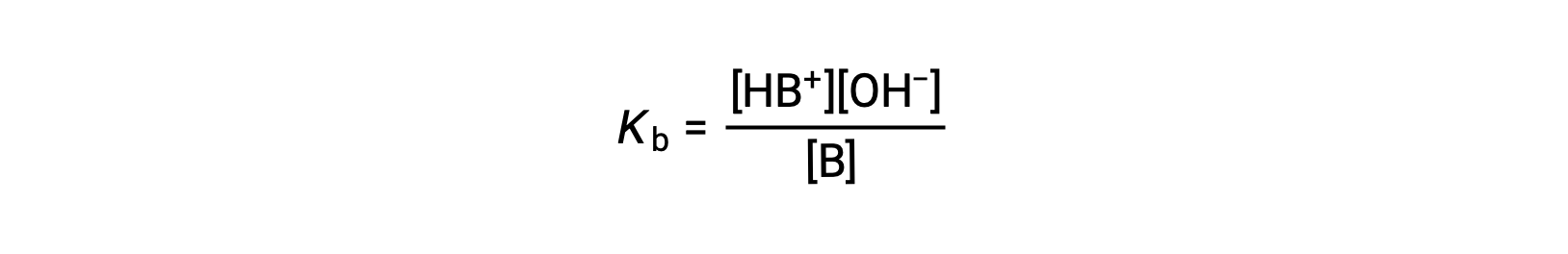
下面对三种弱碱的数据进行的检查显示,碱强度的增加顺序为 NO2− < CH2 CO2− < NH3。
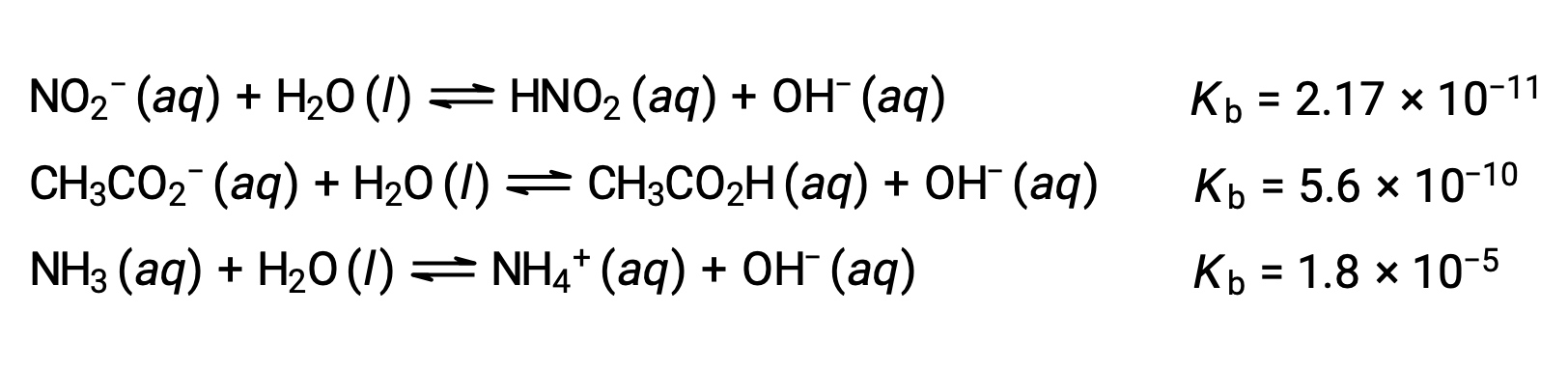
对于酸,碱的相对强度也反映在其百分比电离中,计算为
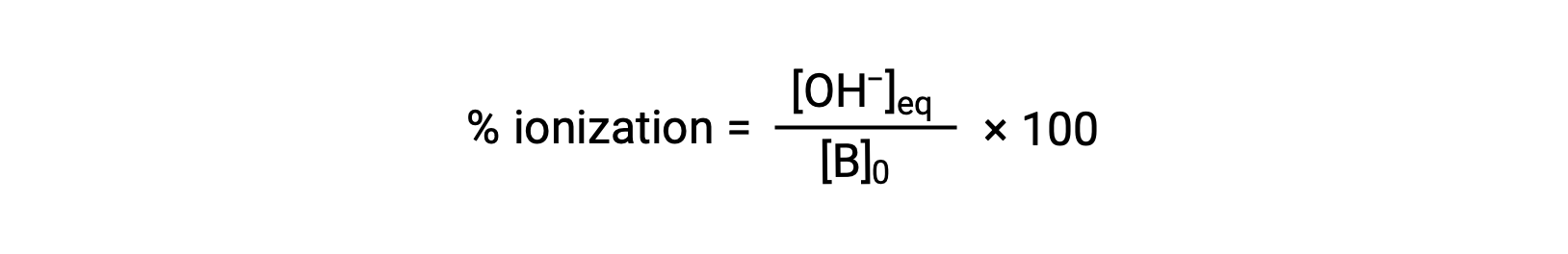
但会因碱电离常数和溶液的初始浓度而异。
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。