与纯水相比,含有普通离子的水溶液 (离子化合物的溶解也产生的离子) 离子化合物的溶解度较低。 这是一个称为同离子效应的现象的示例,这是质量作用定律的结果,可以使用 勒夏特列原理(Le Chatelier's Principle) 来解释。 考虑碘化银的溶解:
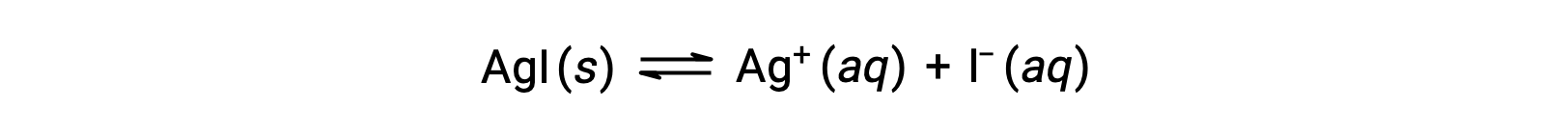
这种溶解平衡可能会因添加银 (I) 或碘化离子而改变,从而导致 AGI 的沉淀和溶解 AA+ 和 I –的浓度降低。 在已经含有这两种离子之一的溶液中,没有这些离子的 AGI 可能比溶液中的溶解更少。
这种影响也可以用溶度积表达式中表示的质量操作来解释:
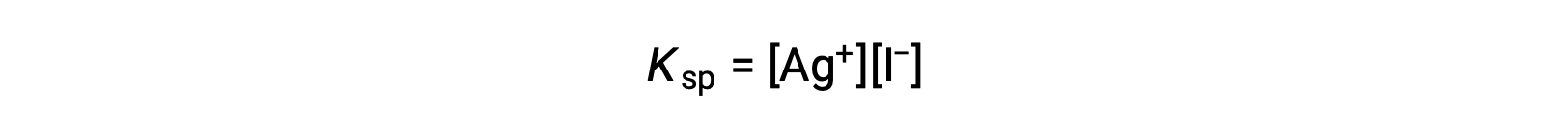
无论离子源如何,银 (i) 和碘化离子极性的数学生成物在平衡混合物中都是恒定的,因此一个离子的浓度的增加必须通过另一个离子的比例减小来平衡。
关于溶解度的同离子效应
常见离子会影响化合物在溶液中的溶解度。 例如,固体 mg/OH)2 解离 Mg2+ 和 OH− 离子,如下所示;
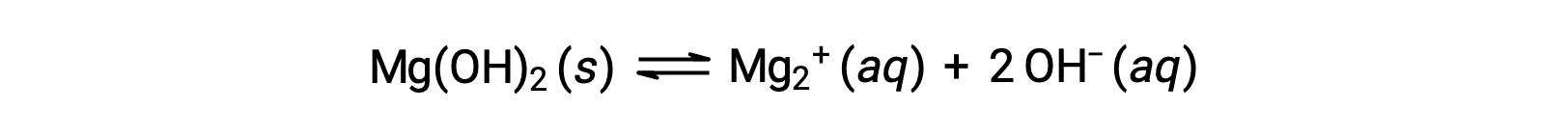
如果将 MgCl2 添加到饱和溶液 (mg/Oh) 2 中,则反应将向左移,以根据 Le Châtelier 的原理释放附加 Mg2+ 离子产生的应力。 在定量的术语中,添加的 Mg2+ 会导致反应商大于溶度积 (Q > KSP) ,而 MG (OH) 2 表单会一直到反应商再次等于 KSP 为止。 在新的平衡状态下, [mg-] OH 小于 [Mg2+] ,且 [Mg2+] 大于纯水中的 mg/OH)2 溶液。
如果 Koh 被添加到饱和溶液 (毫克 (OH) 2 中,反应将向左移以释放额外 OH 离子的应力。 MG (OH) 2 形成,直到反应商再次等于 KSP。 在新的平衡状态下, [mg-2+] OH 大于 [Mg2+] ,小于纯水中的 mg/OH)2 的溶液。
来自章节 16:

Now Playing
16.1 : 同离子效应
酸碱和溶解度平衡
38.6K Views

16.2 : 缓冲液
酸碱和溶解度平衡
158.6K Views

16.3 : 亨德森-哈塞尔巴尔赫方程(Henderson-Hasselbalch Equation)
酸碱和溶解度平衡
64.3K Views

16.4 : 计算缓冲溶液中的 pH 值变化
酸碱和溶解度平衡
49.6K Views

16.5 : 缓冲液效力
酸碱和溶解度平衡
45.7K Views

16.6 : 滴定计算:强酸 - 强碱
酸碱和溶解度平衡
27.1K Views

16.7 : 滴定计算:弱酸 - 弱碱
酸碱和溶解度平衡
40.1K Views

16.8 : 指标
酸碱和溶解度平衡
45.6K Views

16.9 : 多质子酸的滴定
酸碱和溶解度平衡
90.7K Views

16.10 : 溶解度平衡
酸碱和溶解度平衡
46.4K Views

16.11 : 影响溶解度的因素
酸碱和溶解度平衡
31.3K Views

16.12 : 错合离子的形成
酸碱和溶解度平衡
21.5K Views

16.13 : 离子沉淀
酸碱和溶解度平衡
25.9K Views

16.14 : 定性分析
酸碱和溶解度平衡
14.9K Views

16.15 : 酸-碱 滴定曲线
酸碱和溶解度平衡
120.2K Views
关于 JoVE
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。