计算滴定溶液的 pH 值:强酸 / 强碱
对 25.00 mL 0.100 M HCL (强酸) 和 0.100 M 的强碱 NaOH 进行滴定。 添加碱溶液的不同体积的 pH 值可按以下公式计算:
(A) 滴液体积 = 0 mL。 溶液 pH 值是由 HCl 的酸电离引起的。 因为这是一个强酸,电离是完整的,水合氢离子体积摩尔浓度是 0.100 M。 溶液的 pH 值是:

(B) 滴液体积 = 12.50 mL。 由于酸样品和碱滴定剂都是一丙酮并均匀浓缩,因此这种滴定添加剂包括小于 A 化学化学数量 of 碱,因此通过与样品中过量酸的反应将其完全消耗。 剩余酸的浓度通过从初始数量中减去消耗的数量然后除以溶液体积来计算:
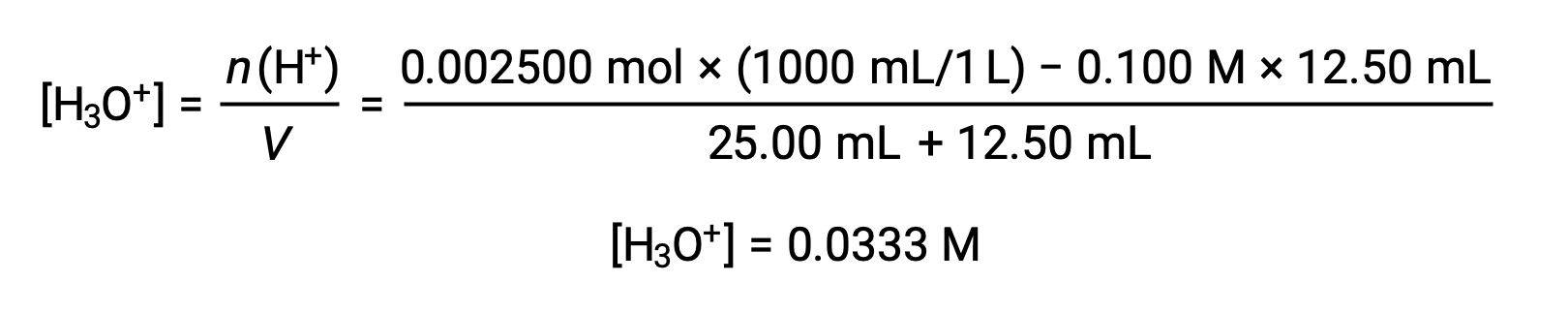
(C) 滴液体积 = 25.00 mL。 这种滴定添加剂涉及碱的化学化学当量数量 (等效点) ,因此只有中和反应的生成物在溶液 (水和 NaCl) 中。 该盐的阳离子和阴离子均不会发生 酸-碱 电离;生成水合氢离子的唯一过程是水的自质解。 溶液为中性, pH 值 =7.00。
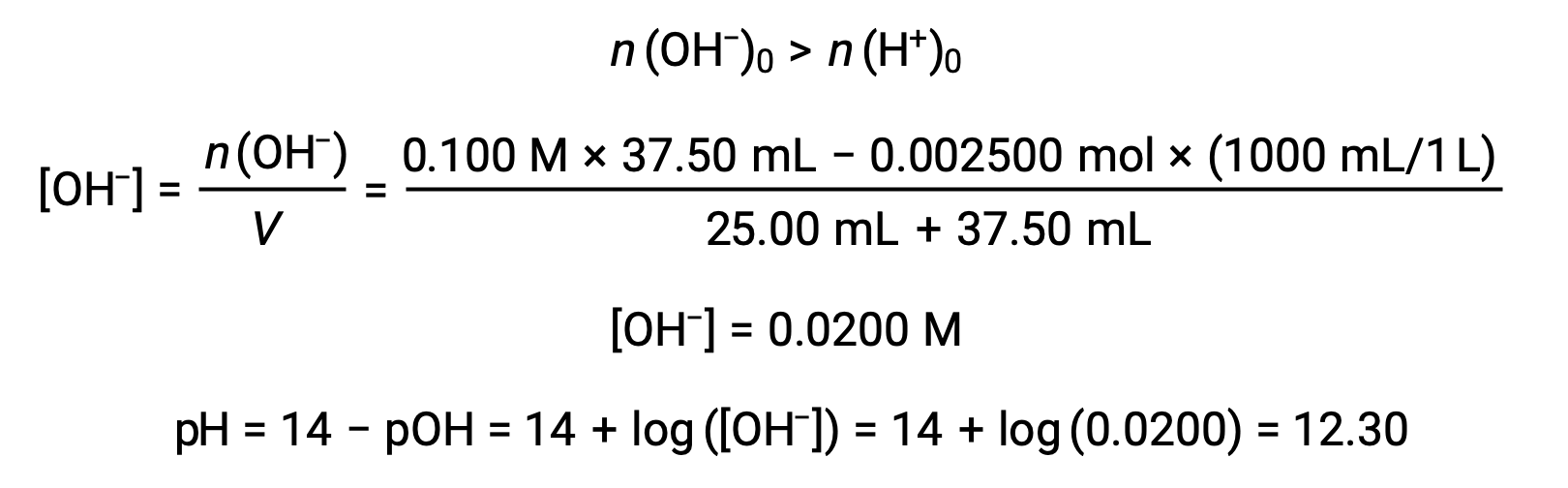
(d) 滴液体积 = 37.50 mL。 这涉及添加超过等效点的滴定。 然后使用氢氧化物离子的浓度计算溶液 pH 值:
来自章节 16:

Now Playing
16.6 : 滴定计算:强酸 - 强碱
酸碱和溶解度平衡
27.3K Views

16.1 : 同离子效应
酸碱和溶解度平衡
39.1K Views

16.2 : 缓冲液
酸碱和溶解度平衡
160.3K Views

16.3 : 亨德森-哈塞尔巴尔赫方程(Henderson-Hasselbalch Equation)
酸碱和溶解度平衡
65.8K Views

16.4 : 计算缓冲溶液中的 pH 值变化
酸碱和溶解度平衡
50.3K Views

16.5 : 缓冲液效力
酸碱和溶解度平衡
46.7K Views

16.7 : 滴定计算:弱酸 - 弱碱
酸碱和溶解度平衡
41.2K Views

16.8 : 指标
酸碱和溶解度平衡
45.7K Views

16.9 : 多质子酸的滴定
酸碱和溶解度平衡
91.3K Views

16.10 : 溶解度平衡
酸碱和溶解度平衡
47.2K Views

16.11 : 影响溶解度的因素
酸碱和溶解度平衡
31.3K Views

16.12 : 错合离子的形成
酸碱和溶解度平衡
21.9K Views

16.13 : 离子沉淀
酸碱和溶解度平衡
26.4K Views

16.14 : 定性分析
酸碱和溶解度平衡
15.6K Views

16.15 : 酸-碱 滴定曲线
酸碱和溶解度平衡
121.3K Views
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。