需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
实时成像果蝇胚胎血细胞迁移
摘要
果蝇血细胞分散在整个胚胎发育。此协议演示如何安装和图像这些用荧光标记的血细胞的胚胎的迁移。
摘要
许多研究解决细胞迁移
研究方案
制备
- 包含一个血细胞的特定Gal4的驱动程序( 如SRP - Gal4 的 2)和无人机控制( 如UAS - GFP)基因编码的下荧光记者获得适当的果蝇线。苍蝇SRP - GAL4 UAS - GMA 3或crq - GAL4 UAS - GFP 4,5纯合子是特别有用的成像目的(NB GMA的是绿色荧光蛋白融合moesin肌动蛋白结合结构域),参见下面的讨论Gal4的司机和UAS的范围内构造(布卢明顿联合中心包含多种)。
- 通常遗传杂交进行这样突变的等位基因与Gal4的驱动程序和替代同源染色体进行的UAS构造,使用荧光平衡器 CTG 或 TTG 6平衡。这使得它可以选择无CTG / TTG相关的绿色荧光(这是在现阶段2.11)的基础上的纯合突变体。
- 在与苹果汁琼脂平板7铺设笼放大的股票和地方苍蝇。苍蝇至少需要两天,使其恢复到之前铺设笼有足够多的胚胎开始被辞退。 20每个性别的苍蝇一般应足以产生足够的成像胚胎的,但应该指出的是,不同的线路有不同程度的生育。我们使用55毫米培养皿适合到塑料烧杯底部,在其基础刺破,让空气流通。胚胎收集的确切手段是不重要的,但时序是至关重要的,以便正确地收集,上演胚胎。
- 收集胚胎从一个通宵的苹果汁琼脂板保持在25 ° C或从计时板。对于后者,我们通常让苍蝇打下一个预热板删除板,并放置15-16小时,在18 ° C,在安装胚胎前,前4小时,这提供了通过胚胎后期12发展阶段15。过夜板包含了更加多样化的阶段,但提供了更高水平的血细胞的荧光记者表达由于在较长的时间在25期的优势GAL4 - UAS系统° C的温度敏感。
程序
- 打跑胚胎从苹果汁琼脂板使用了少量的水和软尖的画笔。用肉眼很容易脱落的胚胎可以看出。
- 胚胎转移到一个细胞过滤器(费雪)或自制浇到,在一个烧杯中举行收集废水篮子从苹果汁琼脂平板的水篮7。
- 重复步骤2.2,直到你满意为止你有足够的胚胎从苹果汁琼脂平板上转移。
- 洗净胚胎细胞过滤器/水篮。
- 广场细胞过滤器/苹果汁琼脂平板培养皿盖的篮子,并补充足够的整齐漂白暂停胚胎细胞过滤器/篮。
- 按照下明解剖镜下的胚胎dechorionation:dechorionation完成时背的附属物已解散,这应该发生在两分钟之内。
- 从漂白细胞过滤器/篮含有胚胎取出,洗掉残留的漂白剂使用水。继续到步骤2.8前应清除所有漂白剂的痕迹。一招,以评估是否所有的漂白剂已被删除印迹关闭蓝色实验室组织的残余水 - 如果有残留的漂白剂漂白蓝色白色/粉红色。
- 吸干关闭剩余的水用实验室组织/细胞过滤器/篮底部的mediwipes。
- 广场的水液滴在培养皿盖子。用细的画笔,从胚胎篮收集的所有的dechorionated胚胎和重新悬浮液滴。下一步胚胎干吸水使用微量或认真吸收实验室组织/ mediwipes。
- 一旦胚胎已经干涸,添加voltalef油下降到涵盖所有的胚胎。将相邻液滴含有胚胎的石油第二小的下降。注:我们一直无法找到一个voltalef石油的总部设在英国的供应商;卤烃油700(Sigma公司)可以用来代替。
- 在一个荧光解剖镜下选择适当上演胚胎所需的油滴的制表大师钳的一双(5号)的基因型。这些镊子应以舀起他们的卵黄膜穿刺胚胎弯曲向内(图1)。选定的胚胎转移到第二油滴。重要的是,你能够看到荧光血细胞,在解剖显微镜,以便能收集到的良好形象,共聚焦显微镜(图2)。我们通常安装阶段13/14胚胎形象腹侧中线或15阶段的胚胎血细胞的横向迁移以下散布在胚胎的血细胞的活力形象。
- 坚持一个Petriperm / Lumox的菜(Sarstedt)底面的两个盖玻片(18x18mm,厚度为1),使用2 voltalef石油小滴,留下约之间(图3)1厘米;,这些将被用来支持放置在盖玻片胚胎,所以不粉碎他们。 Petriperm菜(直径50mm),包含一个疏水性,透气膜。我们发现的菜肴变得更容易使用,一旦被多次使用(菜,可消灭70%的乙醇和重用)。
- 在解剖镜下明,拿起选定胚胎弯曲钳和行腹侧逐一平行于盖玻片边缘(图3)。这是可能的对齐,以这种方式在15胚胎,这取决于你的灵巧和耐心。重要的是轻轻地操纵胚胎,胚胎和Petriperm盘膜是脆弱的,可以很容易破裂。
- 一旦胚胎是一致的添加油小滴,让它蔓延,形成了两者之间的盖玻片的同质层。油后已蔓延(这可能需要几分钟)检查胚胎腹侧起来。如果胚胎已经稍微卷起,再次重新定位他们与镊子。
- 最后,使用镊子(3号)通过胚胎盖玻片(18x18mm,厚度为1),休息后,先前坚持的两个盖玻片。胶盖玻片盖玻片支持使用指甲油(图3)。
- 安装胚胎共聚焦或宽视场显微镜Petriperm盘和安装在使用适当的适配器阶段Petriperm菜。直立或倒置显微镜可用于通过盖玻片(而不是通过膜)与客观对焦镜头。
代表性的结果:
本协议描述了如何安装果蝇胚胎血细胞的胚胎的腹侧实时成像。如果做得正确,这将是容易产生血细胞或者剧照或电影。的主要因素是用于图像的血细胞(尤其是物镜)显微镜,但获得的图像的性质也将取决于所处的发展阶段,温度胚胎提出了在使用和GAL4和UAS线。
荧光蛋白的表达水平较高,使血细胞成像更容易,因此重要的是能够看到的血细胞在胚胎阶段的协议(图2包含的例子清晰的血细胞在胚胎内,采取2.11相机装上一个解剖镜下)。 GAL4和UAS的构造,因此人数的增加,使一个更大的信号信噪比。此外,这减少了需要高的激光强度或增加曝光时间的成像,这反过来又使血细胞的行为时,时间较长。
GFP的表达非常高的水平,将显示血细胞形态的细节,特别是薄片状片状,环绕圆形胞体(图4A - B)。不包括GFP圆形区域代表吞噬体(图4A - C的)。片状(图4B)中出现的丝状伪足,手指也可以看出。两个Gal4的司机仍然足以看到这些进程(图4C),尤其是当一个或多个SRP - Gal4的 (见讨论),但扫描速度较慢或更大的激光功率的激光共聚焦显微镜可能是必需的。随着表达水平的降低,它变得更加难以形象的血细胞的突起;尽管如此,它仍然是可以跟踪这些条件下的血细胞迁移,细胞体内仍然明显,即使突起不太清楚(图4D)。
在发展的早期阶段(高达阶段13)血细胞迁移到另一个密切联系,它往往是很难区分单个细胞。 13血细胞的阶段结束,已经形成了一个下来的腹侧中线(图5A)的单行,然后,变得更加运动型,迁移横向腹神经索(图5B)的边缘。血细胞内的动态突起的肌动蛋白细胞骨架,可以直接观察到通过GMA(图5C)或樱桃moesin表达。
安装在这样的胚胎,使气体交换,防止脱水和胚胎以下成像仍然可行。如果胚胎是在安装时一般是明显的,因为胚胎的内容将通过其卵黄膜泄漏的损坏。如果一个胚胎开始脱水,则往往被视为在卵黄膜的变形。偶尔胚胎期间将推出一个timelapse电影的过程中,然而,这往往是更长的时间尺度电影的问题。 LastlY,一次安装的胚胎,使实验者的完美的方向在他们的实验中获得胚胎的最好机会。

图1。钳dechorionated胚胎操纵 。
制表大师钳(大小5)提示应弯曲向内,以时尚的一个工具舀如下所示的胚胎。外表面的弯曲区域也是有用的操纵胚胎Petriperm膜定位时,因为他们拥有没有锋利的边缘,可以穿刺胚胎。
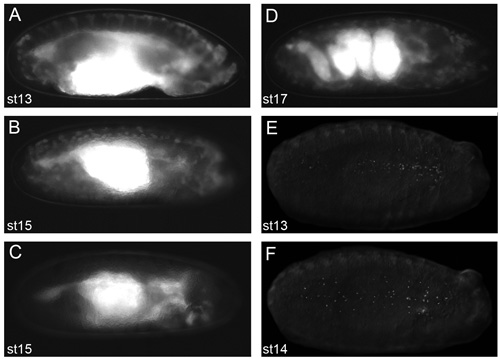
图2。代表图像的胚胎,将产生良好的生活成像效果。
voltalef石油dechorionated胚胎(2.11协议的阶段)上的荧光解剖显微镜拍摄的图像。 crq GAL4,UAS - GFP的胚胎 ;阶段13(A)和阶段15(二)SRP - GAL4 UAS - GFP横向意见。 (三)在其中的一个阶段15 SRP - GAL4 UAS - GFP /侧视图; crq Gal4的,uas-GFP/uas-N17Rac胚胎血细胞有没有迁移的头,这表明什么时血细胞的胚胎像沿着其迁徙路线并不明显。侧视图一个阶段17 SRP - GAL4,UAS - GFP; crq - GAL4 UAS - GFP发展(d)在这个阶段的胚胎肠道令人费解的结构,肌肉收缩的发病防止超出了这个胚胎的实时成像发展阶段。腹阶段,13(E)和14期的意见(F) 的SRP - GAL4 UAS红毒刺胚胎散布血细胞,用荧光标记的核。观察荧光血细胞在2.11的协议阶段是一个先决条件,以获得优异的图像;前是为所有图像的权利。

图3。胚胎上安装一个Petriperm / Lumox的菜 。
18x18mm盖玻片(厚度1)坚持底面Petriperm使用的油的小水滴,约1cm分隔的菜。胚胎,然后列队腹侧长(前后轴)平行的盖玻片的边缘,并覆盖着石油的一个小水滴。一旦石油已蔓延至填补第三的盖玻片(18x18mm厚度1)使用以前坚持的两个盖玻片作为一个桥梁,以防止被压扁了的胚胎油覆盖的胚胎上轻轻放在两个盖玻片之间的差距。这盖玻片,然后粘到两个盖玻片桥梁使用两个小滴指甲油。设置后,胚胎可以直立或倒置显微镜盖玻片(而不是通过Petriperm膜),重点是通过与客观镜头成像。
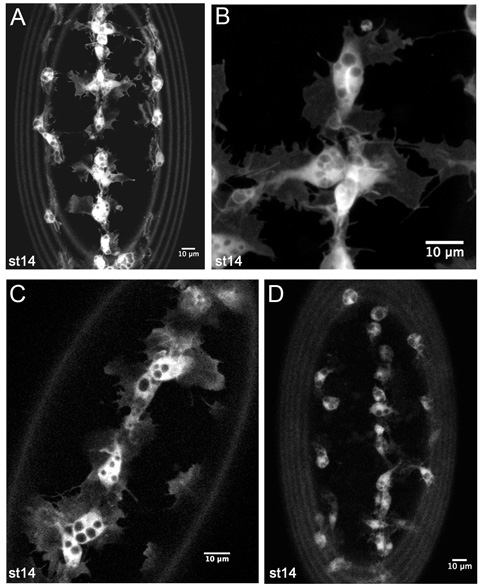
图4。代表从绿色荧光蛋白标记的血细胞实时成像结果。
Z型血细胞上的一个阶段14 SRP - GAL4 UAS - GFP的腹侧方; crq GAL4 UAS - GFP胚胎(AB),预测。 (一)是一个较低的放大倍率的形象,如用于监测timelapse电影中的血细胞的发育迁移。 (B)是一个更高的放大倍率腹侧中线血细胞,显示其形态精致的细节。 (C)是一个1米的血细胞,在一个阶段SRP - GAL4 UAS - GFP / 14的腹侧中线片; crq - Gal4的,UAS - GFP / +胚胎,揭示Gal4的司机和UAS的拷贝数较低结构也足以产生的良好形象。 (四)显示在一个阶段14 crq GAL4 UAS - GFP胚胎的血细胞ž投影。血细胞突起不太明显,由于GFP表达较低,但它仍然是可能使电影和跟踪这个Gal4的驱动程序和UAS的组合构建的血细胞迁移。徕卡LSM510共聚焦显微镜图像;前是在所有图像;引起卵黄膜的自体荧光图像的边缘的环。

图5。代表的GMA表达血细胞实时成像结果 。
阶段13 腹侧中线(A)和14期的血细胞的Z -预测(二)SRP - GAL4,UAS - GMA的胚胎,取自timelapse电影,显示血细胞的发育迁移。肌动蛋白动力学的详细信息,可以得到更高的GMA表达血细胞(三)放大成像。 GMA组成的GFP融合moesin和标签微丝肌动蛋白结合域。前路是在所有的图像,图像共聚焦显微镜。
讨论
此过程中最重要的因素是健康的胚胎有明确标记的血细胞的选择和安装不小心损坏。一旦胚胎中的卤烃油,脱水和抗一旦安装了好几个小时可以成像。在我们的手中,我们可以形象的血细胞,三个小时,胚胎或明显的照片损害可以忽略不计的脱水,采取每三分钟我们蔡司LSM510共聚焦显微镜图像与40X目标的Z - Stack。由于血细胞是高度动态的,可能有一个空间和时间分辨率之间的权衡:如果需要一个?...
致谢
该协议已经通过我们的工作与保罗马丁和安东尼圣哈辛托实验室内和合作。我们感谢布卢明顿联合中心,以其优良的服务和继续分享飞线果蝇社会。 BS目前由BBSRC项目赠款资助。第一次世界大战是由威康信托职业发展奖学金。
材料
| Name | Company | Catalog Number | Comments |
| Cell strainer | BD Biosciences | 352350 | 70μm pores |
| Halcarbon oil 700 | Sigma-Aldrich | H8898 | |
| Lumox/Petriperm dish | Sarstedt Ltd | 96077305 |
参考文献
- Brand, A. H., Perrimon, N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes. Development. 118, 401-415 (1993).
- Bruckner, K. The PDGF/VEGF receptor controls blood cell survival in Drosophila. Dev Cell. 7, 73-84 (2004).
- Dutta, D., Bloor, J. W., Ruiz-Gomez, M., VijayRaghavan, K., Kiehart, D. P. Real-time imaging of morphogenetic movements in Drosophila using Gal4-UAS-driven expression of GFP fused to the actin-binding domain of moesin. Genesis. 34, 146-151 (2002).
- Stramer, B. Live imaging of wound inflammation in Drosophila embryos reveals key roles for small GTPases during in vivo cell migration. J Cell Biol. 168, 567-573 (2005).
- Wood, W., Jacinto, A. Drosophila melanogaster embryonic haemocytes: masters of multitasking. Nat Rev Mol Cell Biol. 8, 542-551 (2007).
- Halfon, M. S. New fluorescent protein reporters for use with the Drosophila Gal4 expression system and for vital detection of balancer chromosomes. Genesis. 34, 135-138 (2002).
- Sullivan, W., Ashburner, M., Hawley, R. S. . Drosophila protocols. , (2000).
- Tepass, U., Fessler, L. I., Aziz, A., Hartenstein, V. Embryonic origin of hemocytes and their relationship to cell death in Drosophila. Development. 120, 1829-1837 (1994).
- Millard, T. H., Martin, P. Dynamic analysis of filopodial interactions during the zippering phase of Drosophila dorsal closure. Development. 135, 621-626 (2008).
- Doerflinger, H., Benton, R., Shulman, J. M., St Johnston, D. The role of PAR-1 in regulating the polarised microtubule cytoskeleton in the Drosophila follicular epithelium. Development. 130, 3965-3975 (2003).
- Olofsson, B., Page, D. T. Condensation of the central nervous system in embryonic Drosophila is inhibited by blocking hemocyte migration or neural activity. Dev Biol. 279, 233-243 (2005).
- Paladi, M., Tepass, U. Function of Rho GTPases in embryonic blood cell migration in Drosophila. J Cell Sci. 117, 6313-6326 (2004).
- Vlisidou, I. Drosophila embryos as model systems for monitoring bacterial infection in real time. PLoS Pathog. 5, e1000518-e1000518 (2009).
- Jacinto, A. Dynamic actin-based epithelial adhesion and cell matching during Drosophila dorsal closure. Curr Biol. 10, 1420-1426 (2000).
- Wood, W., Jacinto, A. Imaging cell movement during dorsal closure in Drosophila embryos. Methods Mol Biol. 294, 203-210 (2005).
- Kunwar, P. S. Tre1 GPCR initiates germ cell transepithelial migration by regulating Drosophila melanogaster E-cadherin. J Cell Biol. 183, 157-168 (2008).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。