Method Article
Vibrodissociation从啮齿动物脑切片的神经元,研究突触传递和图像突触前的码头
摘要
这份报告表明保留个别可行的神经元连接的突触前boutons的机械隔离技术。 Vibrodissociated的神经元具有快速生产的优势,卓越的药理控制和改进的空间不影响邻近的细胞钳。这种方法可用于突触元素的成像和膜片钳记录。
摘要
机械解离的中枢神经系统的神经元的优势,保持连接到孤立的利益神经元突触前boutons。这使得可以很好地控制细胞和突触后细胞内环境条件下的突触传递的考试。一个没有使用蛋白酶的振动技术,作为vibrodissociation,是最流行的机械隔离技术。一个微量,用刀尖火抛光的一个小球的形状,是从P1 - P21的啮齿类动物的大脑切片放入。微管是振动片表面平行,并通过降低切片厚度中分离出神经元的解放。分离出神经元的研究vibrodissociation几分钟内准备好。这种技术已在使用的初级神经元文化,脑片和酶分离出神经元,其中包括的优点:快速生产可行的,相对成熟的神经元电生理和影像学检查;外环境优越的控制,从邻近的细胞的影响;适用性控制药理实验,使用快速药物的应用和总细胞灌流;改进的空间相对切片或细胞培养的筹备工作中的神经元的全细胞记录钳。该制剂可用于检查突触生理学,药理学,调制和可塑性。实时成像在活细胞和boutons前和突触后的元素也可以使用vibrodissociated神经元。前和突触后成分的分子组成的表征,也可以实现与免疫学和成像为基础的方法。
研究方案
1。准备阻燃密封玻璃微管
- 使用微电极的玻璃,拉一个标准的膜片钳微管燃烧的棕色或相当于微量拉马(尖端直径1〜2微米)。提示放置微量的火焰从本生〜2秒,直到与融合球直径200-300微米形式刻录机。
- 到持有人将火焰密封修补吸管上一个可以迅速振捣一侧到另一侧(旅行距离为100-200微米),利用压电双晶片,继电器,或等价的有效设备的显微操纵器。
2。准备从P1 - P21的大鼠或小鼠的大脑切片
- 准备与人工脑脊液(ACSF)的组成如下(单位:mm):124氯化钠,氯化钾4.5,1.2的NaH 2 PO 4,26碳酸氢钠3,和10个D -葡萄糖。泡,95%〜15分钟的氧气/ 5%的CO 2气体溶液,再加入2毫米氯化钙和氯化镁2 1毫米。
- 切割脑切片:
- 与氟烷或异氟醚麻醉的动物。杀头动物 - 删除大脑 - 块大脑所需的方向(冠状,矢状窦,横等),包括感兴趣区域。
- 加盖阻塞的脑淹没在学联振动脑切片阶段 - 部分脑厚度在250-400微米 - 在学联片冒泡carbogen在“预孵育”液体/气体接触的所有表面上允许扣除室 - 让切片至少一个小时,在这个中型平衡。
3。 Vibrodissociation
- 填写一个35毫米直径的HEPES -缓冲的组成如下(MM)的盐溶液的培养皿:150氯化钠,氯化钾,10 HEPES,1个2.5 氯化镁2,氯化钙,10 D -葡萄糖与pH设置为7.4,用NaOH和〜300 mOsM使用蔗糖的渗透压调整。培养皿可悬挂菜,标准的细胞培养皿,培养皿玻璃盖玻片插入,或涂用,如多聚- L -赖氨酸,根据需要更强的细胞黏附盘底部的菜肴。
- 放置在培养皿中的切片和解剖立体可视化在250 X.握住片的底部使用一个弯曲的铂丝(直径0.5毫米),顶面片放在作为一个重量。
- 阻燃密封微管片表面所需的大脑区域位置的提示。激活显微10-30赫兹横向漂移距离〜100微米,震动提示。使用的显微操纵器,移动针尖深入到切片组织等,它是通过整个切片〜30秒内传递。重复此步骤,需要最大限度地从一个特定的大脑区域索取分离出神经元的数量。
- 取出切片提示 - 拿起片用镊子轻轻摇晃,而仍然在解决方案 - 然后取出切片完全和丢弃。
- 允许游离的细胞来解决,坚持至少10分钟的菜底部。
4。电生理记录
- 将含有倒置显微镜舞台上的神经元的菜,和可视化的目标为10 × 63 ×。看看顺利专利膜,没有出泡,可检测,但没有超大核神经元。如果相衬光学使用,外观为淡黄色的色调相明亮的神经元,而不是太蓝。 Superfuse细胞外解决方案,包含所需的盐类,养分,受体拮抗剂等(我们的标准是上述的HEPES缓冲液(3.1节)),往往辅以5微米2,3 - 二氧-6 - 硝基- 1, 2,3,4 - 四氢[F]喹喔啉- 7 -磺二钠(NBQX),和25-100μM的D - 2 -氨基- 5 - phosphonopentanoic酸(AP5)块离子型谷氨酸受体,允许快速GABA的隔离A受体介导的iPSCs的1,2。
- 将一个标准的补丁微量使用燃烧的棕色或相当于拉马。枪头阻力应该是2-4MΩ(靶细胞的大小而定)时,与CL填补- -基础的解决方案。
- 建立从可视化的神经元使用标准的电生理技术的全细胞记录。
- 记录自发突触后电流(sPSCs),使用一个无间隙的数据采集协议。应用0.2-1μM河豚毒素和/或低的Ca 2 + -含有细胞外液记录微型突触后电流(mPSCs)。
- 解决方案和药理剂,可直接应用于细胞。我们使用从本地解决方案,交流融合的方尖玻璃涉及油管的横向运动管灌流安装在步进电机驱动的显微。这种分配在10毫秒100S解决方案交换实现的快速变化,在细胞外分子的含量,受体激动剂的应用,等等。
- 赤池和他的同事们已经开发出的技术,以刺激单突触前boutons 3,4。一个微管是放在附近的一个可视化的布顿和刺激(5-10μA的不良刺激电流,持续时间为0.1-0.2 MS)。酉iPSCs的记录,故障的方法,如方法可用于检查前和突触后功能的变化。
5。突触前的码头成像
- 突触后神经元可以充满各种染料通过补丁吸管。神经元也可以从表达荧光蛋白(FPS),如选定的细胞群中的绿色荧光蛋白(GFP)的小鼠。
- 可以从小鼠表达,特别是中间神经种群FPS vibrodissociated神经元突触前终端可视化。例如,表达的GFP的小鼠谷氨酸脱羧酶65(GAD65)发起人显示绿色somata的海马篮子细胞的过程和其他interneurons驱动。 Vibrodissociated从海马CA1区锥体神经元有GFP阳性的轴突apposed somata和近端树突(图1A)的终端。锥体神经元从小鼠vibrodissociated表达synaptopHlourin(pH值敏感的GFP突变体融合的突触囊泡相关VAMP2蛋白)Thy1启动子的控制之下,也有FP阳性附加boutons表明pH敏感的荧光(图1B)。
- 突触前boutons可以载入与钙染料和其他荧光分子使用AM酯化化合物5。图2显示了使用的钙指示剂Fluo4 - AM加载的例子。第一,1-2μMAM酯化染料应用于神经元在37 ° 10分钟。染料可以渗透到细胞内环境,酯酶切割分子,产生自由,细胞impermeant和淬灭染料。这种方法加载前和突触后的细胞成分。装载之后,细胞HEPES缓冲盐溶液冲洗,并保持在37 °为一个额外的10分钟。一个GΩ的密封玻璃吸管电极之前,细胞与外部缓冲溶液冲洗3次。
- 使用染料内游离的解决方案,然后建立一个全细胞记录。录制2-5分钟后,染料主要是从突触后神经元,使可视化氟- 4 -加载突触boutons。这项技术是由叶等5。
- 染料加载boutons然后可以可视化使用相机或基于多光子显微镜高倍率,高数值孔径的目标。使用如图3所示的设置,可以实现同步的全细胞记录和钙成像。图2C中的神经元和boutons图像电子倍增电荷耦合器件(EMCCD)相机被抓获。为激发光源的功率衰减至1.2%,与中性密度1.0过滤器和虹膜过滤器调整到12%输出。可观察到,从绿色突触前boutons的钙瞬变和实时记录和测量脱机。
6。代表性的成果:
自发的和电流注入的诱发发射Vibrodissociated神经元
如图4A所示从一个典型的vibrodissociated海马CA1区锥体神经元的录音。可以观察到大鼠基底外侧杏仁核,海马,腹侧被盖区1,5分离锥体神经元自发的过度动作电位。在电流钳记录CA1区锥体神经元,极化电流注入产生的典型电压响应,而足够数量的去极化电流引起典型的中等电流水平和非容纳动作电位延迟发射更强的电流注入模式的过度反应动作电位(图4B)。
自发和微型Vibrodissociated神经元的GABA能抑制性突触后电流
在细胞内的解决方案基于一个铯电压钳记录,自发突触电流(图5A)。这些事件被淘汰低含钙的解决方案2,6中,在大多数神经类型是完全由γ- 氨基丁酸 A受体拮抗剂荷包牡丹碱或gabazine(图5B,C),如,这表明这些是由GABA释放和激活介导的sIPSCs受阻这个离子型受体亚型。然而,在主要神经元的大脑区域,如基底外侧杏仁核和腹侧被盖区5,7, 氨基丁酸 A受体的封锁揭示谷氨酸激活型的AMPA受体介导的EPSCs持续时间较短。有趣的是,TTX的应用程序在特定毒素最敏感的电压门控钠离子通道的封锁的的浓度降低vibrodissociated神经元观察到几个大脑区域(图6a)2,4,7 sIPSCs的频率和振幅。因此,钠离子通道的活动参与的捏过的突触boutons GABA释放。它目前尚不清楚,如果全面爆发钠动作电位发生在这些终端。值得注意的是,良好的密封直径1微米的轴突终端的输入电阻是可能要到GΩ的范围。因此,即使少量的钠离子通道的开放可能就足够了,以去极化激活调解激发分泌耦合的钙离子通道的终端。这些钙离子通道的问题,有证据表明,N和P / Q型通道在释放GABA能终端在海马CA1区和其他地方的8 vibrodissociated准备参加。
调制传输的可塑性和神经递质和受体的数量已经研究使用vibrodissociated 神经元3,4,9。显示,有这样的调节行动的神经递质腺苷,氨酪酸,羟色胺,内源性大麻素等 2,6,10,11,12 。此外,短期突触可塑性,如大麻依赖的去极化诱导的抑制(DSI)的抑制,也被描述在这个准备2,11。这些结果表明,许多形式的受体介导的内源性神经调的跨突触的信号是在vibrodissociated准备完好。
在Vibrodissociated准备的钙瞬变和轴突终末囊泡释放
使用的EMCCD配备倒置显微镜上面描述的,我们已经研究钙瞬变,在突触前终端vibrodissociated神经布顿准备。图2显示了细胞加载上午酯化氟- 4和随后在海马CA1区锥体神经元突触后的染料稀释。观察到一些利益(投资回报)区域图6B所示染料填充boutons自发性钙瞬变。 1微米河豚毒素(TTX)的应用程序消除这些自发的瞬变,这表明,他们是介导的激活电压门控钠,都自发地在boutons激活电流,导致随后的钙升高。快速的解决方案交换至40毫米增加10毫米外氯化钾生产增加的荧光,如投资回报率,对应于突触前终端(图7a)来衡量。从突触后神经元的同步记录是用来监视sIPSCs,并确定是否发生频率增加是由高 K +去极化(图7B )。
要直观囊泡在突触前boutons我们用小鼠表达Thy1子(标记的spH21小鼠)的控制下synaptopHlourin构建的融合。 SynaptopHluorin在分子构造在黄道pHlourin(pH敏感性增强的绿色荧光蛋白突变体)12与囊泡相关膜蛋白(VAMP2)13 。这样的安排,地处pHlourin囊泡腔相对酸性的环境淬灭荧光图案。当囊泡融合这个主题是暴露在荧光puncta因而增加对应囊泡/突触前终端较为中性的外环境。 spH21小鼠海马神经元Vibrodissociation允许荧光puncta预计GABA能终端(图8A)的大小和位置的可视化。应用高K + -包含外部的解决方案,增加在这些终端的荧光,这种影响是在存在外部的解决方案,在细胞外钙减少到0.2毫米(图8B)封锁。因此,在荧光去极化诱发的增加,这似乎反映GABA能突触在神经元布顿准备的兴奋 - 分泌耦合。
的能力来衡量突触前的钙瞬变和囊泡在神经布顿准备轴突终端的融合,让我们来研究神经调质,药物的滥用和对参与激发分泌耦合和胞吐/内吞作用的突触前机制突触可塑性的影响。这些技术也可以结合其他分子工具和遗传工程小鼠,研究特定蛋白质在突触前功能和调制/可塑性的角色。
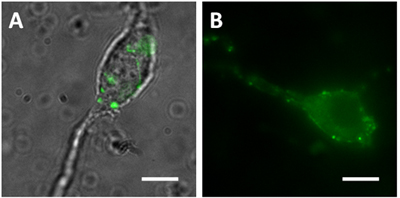
图1。Vibrodissociated从海马CA1区神经元(一)合并DIC的形象ND绿色荧光图像从GAD65鼠标。合并DIC的图像清楚地显示绿色终端的位置,从synaptophluorin(spH21)鼠标(二)荧光图像。比例尺= 10微米

图2钙指标的加载过程:(一)全细胞装入AM酯化染料;(二)全细胞记录稀释染料;(三)为感兴趣区域(箭头)显示终端。

图3。vibrodissociated神经元突触前终端同时全细胞记录和钙成像实验装置示意图。 EMCCD =电子倍增电荷耦合器件。

图4。有代表性的波形显示(一)自发从vibrodissociated CA1区神经元动作电位和(B)膜电压响应电流钳从CA1区神经元极化和去极化电流注射。
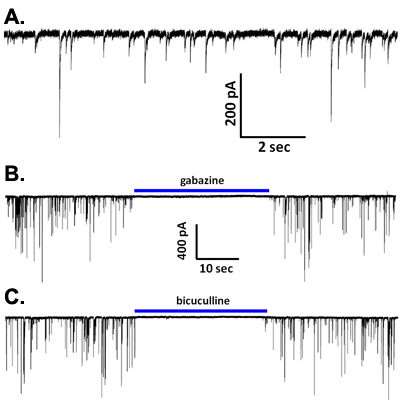
图5(一)代表从CA1区锥体神经元自发iPSCs的波形。 (BC)的iPS细胞,阻止gabazine(10微米,B)或荷包牡丹碱(20微米,C)。
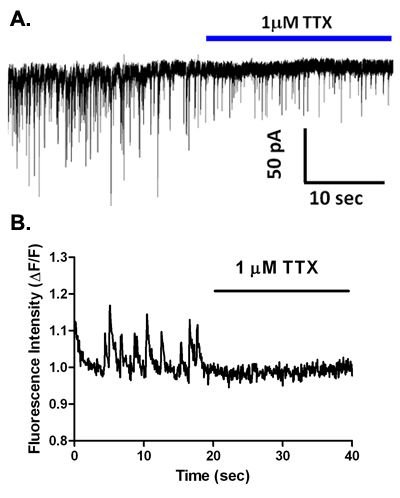
图6。TTX的抑制自发性GABA能突触传递,并消除vibrodissociated海马准备在突触前钙瞬变。 (a)记录由前一个vibrodissociated神经元,并在TTX的应用程序。请注意在频率下降sIPSCs的幅度。 (二)观察钙瞬变在一个荧光4装上vibrodissociated神经元突触前终端前,在TTX的应用程序。注意瞬变的完全丧失。
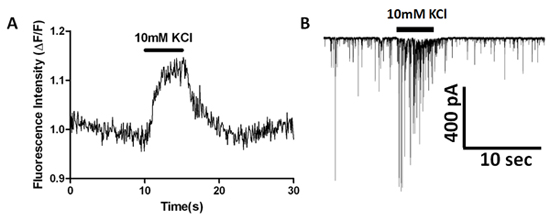
图7同时钙成像和sIPSC全细胞记录显示高K +刺激的影响。 (一)荧光测量,超过装载荧光上午04时染料突触前布顿的时间。 (二)sIPSC频率和振幅在高K +应用程序的同步增长。

图8中的Ca 2 +依赖的高K + spH21从海马CA1区锥体神经元突触前boutons的响应。 (一)一个vibrodissociated神经元的荧光图像。 (二)高K +应用程序(由黑条表示),在我们正常的细胞外 Ca 2 +含解决方案(2毫米的Ca2 +)的存在持续增加,在荧光。观察无荧光的增加是在低细胞外 Ca 2 +(0.2毫米的Ca 2 +) 。图中的数据进行标准化前高K +荧光水平,并从3 boutons显示平均响应。
讨论
成功的vibrodissociation需要,片含有健康的神经细胞和组织间隙有足够的弹性,使神经细胞无毒性损害退出切片。因此,该技术在早期发育期(P1 - 21)最佳健康切片时,可以用比是在成人的大脑切片中发现的少胶质/ interstiatial材料。然而,在我们的经验,优化切片片vibrodissociation技术本身可能是适得其反的神经元的存活准备。虽然我们经常准备切片原位录音使用冷修改学联蔗糖,其中已取代许多细胞外钠离子和钙2,为vibrodissociation饮片可以在我们的正常录制学联准备(如切) 。我们还准备从单个神经元片记录片本身放置在正常ACSF片在35 ° C后切片,在此温度30-60分钟,然后把他们送回室温离开他们。然而,为vibrodissociation饮片立即移动到室温后切片。这些程序提供一个健康的神经元后vibrodissociation,或许是由于缺乏坚定的间质组织,让神经细胞更容易被动摇切片本身的松散的更高的产量。我们还没有详尽的检查切片制备条件,如我们经常获得足够的神经元在某一天,我们的记录和成像实验。这可能是额外的修改,如层厚或preincubaton程序的变化,可以增加健康的神经元的收益。曾经尝试过在努力提高细胞产量和技术工作在老年动物非常温和的蛋白酶治疗。但是,即使是轻微的蛋白酶治疗似乎总是破坏突触功能。因此,虽然蛋白酶和机械分离仍可能发现它并未证明可靠的日期前脑神经元的组合。
还应该注意健康的神经元的相对低的收益率后vibrodissociation意味着,该技术主要是研究丰富的神经元亚型,主要是投射神经元的有用。的可用性GFP的表达增加小鼠小神经元亚群可以很容易地确定研究这些罕见的神经元的机会。然而,除非神经产量可大大提高这些神经元的数据积累,可能会相对缓慢。
几个步骤已被证明是成功加载与钙敏感染料的神经元的关键。接触AM酯化染料是在37 ° C,和我们一直在试图在较低温度下的染料负载不成功。染料的浓度应优化考虑加载时间和温度,因为它出现较高的浓度,染料加载boutons突触前钙离子浓度降低。我们观察到,装载较高浓度降低的频率和振幅的sIPSCs。当装载钙感应到vibrodissociated神经元突触前终端的染料,护理必须采取的,因为缓冲能力小的突触前boutons可能比在SOMA boutons的大小并不一致。 HEPES缓冲的外部解决方案,染料加载含有神经元的菜都洗,洗涤后的恢复时间是至关重要的。此外,为全细胞记录良好的密封,细胞必须彻底清洗,以消除非内在的染料分子的外层细胞膜。
除了 使用vibrodissociated神经元电生理和活细胞成像,免疫细胞化学技术还可以应用到这些细胞11,12。细胞可以很容易地固定和多种抗体,和其他细胞标记染色。这些细胞的使用提供了一个可视化蛋白表达GABA能突触前终端的清洁准备。使用GABA能神经元的促销员具体的控制下表达荧光蛋白的小鼠,使调查,以确定个人的vibrodissociated准备在突触终端(图1)。这种类型的成像的荧光标记物,可允许使用基于激光显微镜和新技术一样的受激发射损耗(刺激发射损耗显微镜)的终端形态测量。染料报告突触囊泡循环的可视化也有可能与这种准备。赤池和他的同事与苯乙烯基染料FM1 - 43标记GABA能在活细胞中4可视化终端的终端。
还应当执行vibrodissociated单细胞逆转录PCR轮廓表达神经元。这种技术是常规应用在细胞培养中生长的酶分离的神经元和神经元。
披露声明
致谢
我们要感谢博士。平朱骏和他们协助进小山在最初设立的技术,和维罗妮卡阿尔瓦雷斯博士格式化的书面稿件的援助。这项研究是由NIAAA院内临床和生物医学研究部。
材料
| Name | Company | Catalog Number | Comments |
| 项目 | 公司 | 目录# | 评论 |
| 振动组织切片机 | 莱卡微系统公司 | VT1200S | |
| 细胞培养皿(35毫米) | 屋宇署猎鹰 | 353001 | |
| 玻璃底菜 | Willco碟 | GWSB - 5040或GWSB - 3522 | 玻璃的厚度0.16-0.19毫米成像 |
| 压电式机械手 | EXFO - 伯利 | LSS - 3000 | 也可以使用继电器等 |
| SD9广场脉冲刺激 | 草技术 | SD9K | 触发压电操盘 |
| 解剖立体 | 野生Heerbrugg | 典型值374590 | 也可以使用任何立体 |
| 火焰山/布朗微量拉马 | 萨特仪器 | P - 97 | |
| 薄壁玻璃毛细管 | 世界精密仪器 | TW - 150F - 4 | 对于阻燃密封玻璃微吸管和微量补丁 |
| 六通道灌注阀控制系统 | 华纳仪器 | VC - 6或VC - 6M | |
| 灌注快速步 | 华纳仪器 | SF - 77B | |
| 倒置显微镜20 - 63X的目标 | 尼康 | TS200 Diaphot | |
| EMCCD相机 | ANDOR技术 | IXON 的EM + DU - 888 | |
| 激发荧光照明光源 | EXFO光子解决方案公司 | 的X - Cite 120PC | |
| 荧光4,钙指标 | 分子探针 | F14201 |
参考文献
- Zhu, P. J., Lovinger, D. M. Ethanol potentiates gabaergic synaptic transmission in a postsynaptic neuron/synaptic bouton preparation from basolateral amygdala. J Neurophysiol. 96, 433-441 (2006).
- Zhu, P. J., Lovinger, D. M. Retrograde endocannabinoid signaling in a postsynaptic neuron/synaptic bouton preparation from basolateral amygdala. J Neurosci. 25, 6199-6207 (2005).
- Akaike, N., Moorhouse, A. J. Techniques: Applications of the nerve-bouton preparation in neuropharmacology. Trends Pharmacol Sci. 24, 44-47 (2003).
- Akaike, N., Murakami, N., Katsurabayashi, S., Jin, Y. H., Imazawa, T. Focal stimulation of single gabaergic presynaptic boutons on the rat hippocampal neuron. Neurosci Res. 42, 187-195 (2002).
- Ye, J. H., Wang, F., Krnjevic, K., Wang, W., Xiong, Z. G., Zhang, J. Presynaptic glycine receptors on gabaergic terminals facilitate discharge of dopaminergic neurons in ventral tegmental area. J Neurosci. 24, 8961-8974 (2004).
- Koyama, S., Matsumoto, N., Kubo, C., Akaike, N. Presynaptic 5-ht3 receptor-mediated modulation of synaptic gaba release in the mechanically dissociated rat amygdala neurons. J Physiol. 529, 373-383 (2000).
- Deng, C., Li, K. Y., Zhou, C., Ye, J. H. Ethanol enhances glutamate transmission by retrograde dopamine signaling in a postsynaptic neuron/synaptic bouton preparation from the ventral tegmental area. Neuropsychopharmacology. 34, 1233-1244 (2009).
- Murakami, N., Ishibashi, H., Katsurabayashi, S., Akaike, N. Calcium channel subtypes on single gabaergic presynaptic terminal projecting to rat hippocampal neurons. Brain Res. 951, 121-129 (2002).
- Zhu, P. J., Lovinger, D. M. Persistent synaptic activity produces long-lasting enhancement of endocannabinoid modulation and alters long-term synaptic plasticity. J Neurophysiol. 97, 4386-4389 (2007).
- Inada, H., Maejima, T., Nakahata, Y., Yamaguchi, J., Nabekura, J., Ishibashi, H. Endocannabinoids contribute to metabotropic glutamate receptor-mediated inhibition of gaba release onto hippocampal ca3 pyramidal neurons in an isolated neuron/bouton preparation. Neuroscience. 165, 1377-1389 (2010).
- Miesenbock, G., De Angelis, D. A., Rothman, J. E. Visualizing secretion and synaptic transmission with ph-sensitive green fluorescent proteins. Nature. 394, 192-195 (1998).
- Li, Z., Burrone, J., Tyler, W. J., Hartman, K. N., Albeanu, D. F., Murthy, V. N. Synaptic vesicle recycling studied in transgenic mice expressing synaptophluorin. Proc Natl Acad Sci U S A. 102, 6131-6136 (2005).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。