需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
躯干神经嵴细胞迁移使用一个修改过的Zigmond室法分析
摘要
取出的细胞迁移(躯干神经嵴细胞)的方法来分析。这种方法是廉价的,温柔的,和能够区分趋化学增活现象和其他因素的影响,如在主躯干神经嵴细胞培养的细胞 - 细胞相互作用所产生的迁徙极性的。
摘要
神经嵴细胞(NCCS)是一个流动人口的细胞存在于脊椎动物的发展,移民从背神经管(NT)后发生上皮-间质转化1,2。在EMT,NCC的长距离迁移,沿刻板的途径,直到他们达到他们的目标。 NCC的区分成为一个巨大的数组类型的细胞,包括神经元,神经胶质细胞,黑素细胞和嗜铬细胞1-3。 NCC的接触和认识到自己的正确的目标位置的能力是基本适当的主干NCC-源性成分结构的形成。因此,阐明机制的指导主干NCC迁移的问题具有十分重要的意义。大量的分子已被证明来指导NCC迁移4。例如,躯干NCC的Semaphorin,和ephrin和缝配体的5-8负指导线索,如被击退。然而,并非直到最近,已确定9的任何趋化因子的主干NCC的。
常规的体外方法研究的贴壁细胞的趋化行为的工作最好与永生化的,均匀分布的细胞,但更具挑战性的适用于某些初级最初缺乏均匀的分布和迅速分化(如NCC的)的干细胞培养。均匀化分布的主干NCC的趋化研究的一种方法是从小学NT植文化的主干NCC的隔离,然后抬起replate他们几乎100%汇合。然而,这种电镀的方法需要大量的时间和精力,到取出足够的细胞,是残酷的,分布躯干的NCC的在一个不同的方式,发现在体内条件。
在这里,我们报道了在体外的方法,是可以评估的趋化和其他迁徙的主干NCC的回应没有requirin嘎同质细胞分布。此技术利用延时成像伯,泰然自若改性Zigmond室(一个标准Zigmond室其他地方描述10)内的中继线净捐助国。通过暴露在培养的周边的中继线净捐助国到趋化梯度是垂直于他们的预测的自然方向性,由所施加的趋化梯度诱导洄游极性的改变可以被检测。这种技术是廉价的,需要只有两个NT外植体每重复处理的培养,避免恶劣的细胞起重(如胰蛋白酶消化),叶中继线NCC的在一个更相似的分布,在体内条件下,外植和实验之间的时间量减少(这可能会降低分化的风险),并允许时间的推移众多的候鸟特性的评价。
研究方案
1。第1天:过夜培养于盖玻片上的躯干神经管分离
- 56小时的孵育小鸡的鸡蛋在38℃中取出的鸡蛋孵化,轻度喷用70%的乙醇,然后让他们干。将鸡蛋打碎成紫外线消毒的玻璃盘。
- 从每个胚胎中提取蛋黄,将其放置在小鸡林格氏。通过第一弯剪刀切割周围血岛,然后,用生硬的镊子,挑胚胎的胚外膜,并将其放置在无菌塑料培养皿中含有小鸡林格氏液。
- 隔离每个胚胎的树干修剪多余的胚外膜以及颅,迷走神经,骶轴向水平,使用钨针(图1)。首先,选择约9胚胎阶段之间HH15-17 11。对于阶段HH15和,前脑和后脑轴形成一个锐角,因此出现的头部倾斜尾端。在阶段HH17,尾芽和倾斜腹部,但不包含体节。有了一个钨针,修剪掉至约2毫米的胚外膜从胚胎和切断前的体节10任何胚胎组织。同时删除所有的尾部的胚胎组织从周围的第五个新形成的体节。
- 将孤立胚胎中继线在中性蛋白酶(0.24 U / ml的DMEM培养基)孵育1小时15分钟,在37℃和5%CO 2的 。树干一旦开始孵化,开始准备6的盖玻片(CS)培养NT植(步骤1.5-1.8)。
- 冲洗6在70%乙醇中的CS(在无菌水,超纯水稀释),然后允许它们干燥。使用实验室的标记,画一个圆圈,在每个CS的中心是直径在1厘米左右(这个圈子以后可以帮助您确定已应用于纤维连接蛋白涂层)。在同一个面上的每一个CS,写的字“是”(或其他一些非对称的字或形状)绘制的圆外(这将有助于ŸOU识别是否正面临着显着的CS向上或向下)。
- 每个CS放置在一个单独的40×10毫米的无菌培养皿与标记的表面朝下,并允许菜坐杀菌10分钟的UV灯的下方开放。
- 应用60微升纤连蛋白(FN,10微克/毫升的DMEM)的CS未标记的表面涂覆,同时确保在整个区域内的1厘米的圆。将菜在37°C孵育30分钟,然后小心吸纤维连接蛋白,每一个CS。
- 加入250微升“文化”培养基[含L-谷氨酰胺(2毫摩尔),青霉素(100U/ml),链霉素(100微克/毫升),和8%胎牛血清(FBS)的] FN涂覆面积CS。将含有每个CS的菜肴,在37℃和5%CO 2中 ,直到已被隔离的NT。
- 把所有的孵化胚胎干一个5公分的玻璃培养皿中L15介质,并开始解剖每个NT,用细镊子和钨针(图1)。 Çarefully片沿边境NT和体节用锋利的钨针,同时注意不要损坏NT。它往往是更容易,开始隔离每个NT的尾部,最末端的主干。
- 选择直最长的NTS培养过夜(NTS大约8和15体节间长,建议)6。引培养基用微尖,转让的6 NTS自己事先准备好的CS(从1.5到1.8)。要确保NT不保持浮在表面。如果NT是浮动的,滴介质上,直到它下沉用微。
- 将每道菜在37°C,5%CO 2晚 。要小心,以确保每一个NT是在其各自的CS FN-涂布面积紧接的菜放置在孵化器中(通过使用作为参考绘制圆的步骤1.5)。更好地调整每个NT的位置,如果需要的话,可用于微量。
- 地点在至少2 毫升培养基(无血清)到一个无菌的15毫升离心管中,并在37℃和5%CO 2中孵育过夜。发布帽稍微拧松,以允许介质的pH调整过夜。预孵化介质有助于防止泡沫的形成,在你的房间,这可能干扰的分子梯度的建立是非常重要的。这样的“预孵育”中,应采用未来所有的步骤。在没有使用时,此媒体应孵育在37℃下
2。第2天:载入的改性Zigmond室和延时分析细胞迁移
- 出的6 NTS培养,选择最适合分析3文化。一般来说,NCC文化,应选择有至少一个长的,直边(图2A)。最好的文化将被用于加载和电影3的改性Zigmond室在一天,每一个不同的治疗。在3文化,选择一个为LOADIN克的第一腔室和返回他人培养箱购买使用。
- 用棉签,适用于薄,甚至一层凡士林周围的水库,桥梁,一个被修改的Zigmond室。
- 有了一个钨针,轻轻地移除NT从CS,而离开周边连接到的CS表面的净捐助国。 ,用钢笔记住的方向直的边缘的NCC文化的标记的菜。
- 将几滴预孵育介质上桥。拿起CS用细镊子,轻拍边缘的CS反对一个的Kimwipe以去除大部分的旧培养基 ,然后立即将CS修改后的Zigmond室,使被拍摄下来的文化中心,直边的长度的桥梁和大致垂直的桥型储层边界(图2A,B)。
- 使用倒置显微镜,直NCC边界移动到上侧的最近的第桥Ë水库将包含可疑的趋化(图2B的控件,这将对应的水库加载第二)。此外,更精细地对齐的文化的直边是垂直的桥型储层边界。
- 仔细,但牢固地按CS到凡士林本上Zigmond室,确保完全密封的腔室,然后放置额外的凡士林,沿边缘的CS,以进一步确保这将是气密。精细调整角度的NCC边界再次校正在密封过程中的任何移动。
- 装入的水库,将不包含疑似趋化第一(图2B)。这样做的装载1毫升注射器(25 G连接的针x 1.5英寸),约300微升的预孵育介质和注入介质,额满为止(入水库同时小心不产生任何气泡在水库)。将水库两侧与SUFFicient量的凡士林之前加载下一个水库。
- 重复步骤2.7,使用预培养的培养基中的候选人趋化只是这一次。这是关键的时候产生的分子梯度的文化,始终加载水库进行测试后加载水库缺乏测试分子的分子。
- 将加载的Zigmond厅在37°C孵育1小时,拍摄前。图片直边界的的NCC文化,在90秒的时间间隔3小时,而培养在大约37°C(图2A,B)。创建任何电影之前,一定要调整,使相机获得的图像边缘对准并接触边缘的桥梁接壤的最后一个水库加载(图2B,上面板;虚线框表示理想成像位置)。这将有利于以后的软件通过规范的分子梯度和日的方向性的分析生产Ë距离水库拍摄的每部电影。
- 对于控件,重复步骤2.2-2.9为每个其他两个NCC文化选择(在步骤2.1),但用适当的培养基中,填充每个水库。对于一种类型的控制与预培养介质不含有要测试的分子填补两个水库。对于第二个控制治疗,首要的桥梁与预培养的培养基中可疑的趋化之前安装的CS几滴。然后,加载都用相同的培养基中怀疑趋化水库。
- 使用ImageJ的(NIH) 手动跟踪 (rsb.info.nih.gov / IJ /插件/曲目/ track.html)的和趋化和迁移工具V1.01 (www.ibidi.de /应用/ ap_chemo.html的)插件来追踪周边NCC的迁移沿直线边界的文化Ĵ乌斯季成像和分析各种参数的迁徙轨迹(图2B-C)。
3。代表性的成果:
示出的轨迹从电影许多中继线NCC的响应于使用上述技术的候选趋化的细胞的样品(图2D)。在这个例子中的大部分细胞的积极响应,显示了趋化因子梯度净迁移人数(显示为红色)。轨迹数据可用于分析细胞迁移以及其他属性。
为了在视觉上评价在改性Zigmond室,IgM抗体共轭的Alexa Fluor 488(分子量〜900 kDa的)施加的梯度被加载到所述第二储改性Zigmond室(在大约40μg/ ml的H 2 O)。渐变1小时和26小时后还是有点,但大大减少了50小时(图3)。如果分子进行测试,然后应用梯度无线会降低速度比显示。

图1。外植干线新界南总纤连蛋白包被盖玻片上培养过夜 。由于主干NCC的残缺不全的背NT位于相邻的体节8月28日,该段的NT显微切割分离和培养过夜,纤维连接蛋白涂层CS允许的NCC的从NT植的移民。 8-15体节间长,比较直的隔离NTS最适合过夜培养,因为他们往往会产生NCC文化与较长的直边界。神经管的引起其他神经嵴轴向水平的地区在一个较小的字体显示。 ,体节。

图2迁移取出的主干NCC的评估方法。使用一个的改性Zigmond室。 (A)准备拉长躯干NCC文化至少有一个长而直的边界过夜培养的NTS和由此产生的NCC文化的选择实验。选定文化的最长的直边界,然后垂直于定位的桥型储层边界,因此,平行于未来应用梯度矢量。(B)的经过精细调整的位置上Zigmond室和密封的NCC文化盖玻片室,该室被加载。当测试趋化,水库,将不包含可疑的趋化( - )第一个被加载和密封。然后,其他的水库被加载与怀疑趋化(+)和密封。周边NCC的沿着先前选定的边界进行成像和跟踪使用手动跟踪插件ImageJ的(下图)。(C)许多候鸟的响应特性与所施加的梯度可以评估的基础上跟踪数据。比如,一个趋化指数可以衍生除以细胞的位移沿x轴的总距离它已迁移,(D)的一个有吸引力的响应的一个例子被示出由一个细胞轨迹情节最初产生的趋化性和迁移为ImageJ的工具插件。每条轨迹的开始点被设置为原点(0,0)。注意要多细胞转向的的趋化source.The中心的所有单元格的质量在最后的位置(蓝十字相同的权重,所有的细胞)也接近单核细胞趋化源。 NCC的,神经嵴细胞;红色轨道,细胞迁移向容器装有一个怀疑的单核细胞趋化黑色轨道,细胞迁移距离(+),更高的趋化浓度( - ),低级的趋化浓度。

图3。 强度跨桥公司的Alexa Fluor 488 IgM抗体共轭物的添加后,在不同的时间改性Zigmond室室中装入在协议中所描述的类似的方法,与主要的例外,预培养水(而不是预培养介质)被用来抗体稀释至40微克/毫升,在桥的端部(远离片采取上述强度分布)和小的空气袋本。最初,没有梯度是目前大部分的桥梁。按1公顷梯度成立,并维持到26小时。 50小时的梯度的存在,是在不同地区的桥梁不一致,存在时,陡峭的梯度大大减少。穿过大桥(一桥水库边界),使用相同的片AxioVision 4.6软件产生的所有配置文件。请注意,即使在空气口袋里目前,梯度不中断。高,高强度,低,强度低; x轴,整个桥(2毫米)的宽度的距离(+),储层装有的Alexa Fluor 488 IgM抗体共轭( - ),储集层的共轭不加载。
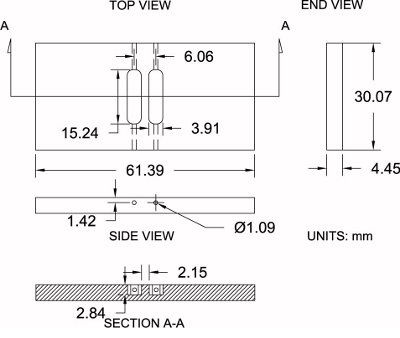
图4。改性Zigmond室规格所示是示这里使用随着其尺寸规格(±0.2毫米)的改性Zigmond室。测量可以适度调整,以配合个人喜好。
补充协议:制作改进的Zigmond厅
请参阅图4作为参考下面的协议:
- 购买一张3/16“厚的抛光亚克力(4.45 mm实际厚度)。
- 使用一台锯,切割室空白过大的粗糙的尺寸33.25毫米x64.57毫米的。这允许3.175毫米的额外的用于加工的材料。
- 将用老虎钳室空白。有了一个铣床和6.35毫米(1/4“)的端铣刀位,精加工的腔室的侧面到其精确的尺寸:30.07毫米x61.39毫米。
- 腔室定位空白的铣床上并定位沿x和y轴与一个边器的中心的坯件,然后零的中心位置。
- 采集腔室高度(z轴)的顶表面接触的端铣刀位和零的高度。
- 使用3.91毫米(0.154“)的端铣刀位,偏移位3.03毫米沿x轴(正方向)为第一储。开始加工成2.84毫米的深度的腔室移动的同时沿y-轴(正方向)至7.62毫米(0.300“),然后遍历到7.62毫米(0.300”)在相反的方向(负)的一个完整的水库长度为15.24毫米(0.600“)。抵销位至3.03毫米(0.119“)沿x轴的(负方向),并重复相同的过程的第二水库。
- 室的位置在它的边缘,钻一个孔,用1.09毫米(0.043英寸)钻头(共4个),每个水库的水库在实验过程中加载介质腔侧连接端。
- 在温暖的肥皂水中浸泡室,以帮助消除任何化学污染物。
- 浸泡和冲洗腔室,以及在双蒸水中,以消除任何肥皂。该商会是现在已经准备好使用上述。
讨论
在主干NCC的趋化研究已经证明了具有挑战性的一系列原因。主干的NCC的构成一个异构干细胞的人口将分化,如果培养长期的,因此,躯干NCC的,必须从主外植的中继级NT。传统的方法来研究均匀分布在体外的细胞群的趋化反应是难以在主干NCC的测试,因为他们首先需要的细胞是孤立的均匀再接种的趋室(例如,Boyden小室12)。为外植几十个NTS可能会被要求创建一个均匀分布的主干NCC?...
披露声明
没有利益冲突的声明。
致谢
我们特别感谢利诺金,史蒂夫古兹曼和Ujit的Satyarthi的,这种方法在开发过程中的技术援助。迈伦·霍桑,理查德·Spengel,罗伯托·罗哈斯加工室使用,提供了必要的技术援助。值得一提的是,罗伯托·罗哈斯图4。我们也感谢斯科特·弗雷泽发展的趋化试验前的宝贵意见。这项工作得到部分支持,NIH-MBRS分数5S06GM048680-13 MEDB和加州州立大学北岭分校研究生论文支持计划奖CW。
材料
| Name | Company | Catalog Number | Comments |
| 的试剂的名称 | 公司 | 目录编号 | 评论(可选) |
| DMEM | 欧米茄科学 | DM-22 | |
| 青霉素链霉素解决方案中 | 欧米茄科学 | PS-20 | 100X股权集中度 |
| L-谷氨酰胺 | 欧米茄科学 | GS-60 | 100X股权集中度 |
| 胎牛血清 | 欧米茄科学 | FB-11 | 地段#105247(或其他相媲美) |
| 修改Zigmond室 | 自制 | N / A | 水库容积:160微升EA;其他规格,请参阅图。 4,补充制造协议 |
| 细胞培养皿 | 丹维尔 | T6040 | 40×10毫米 |
| 纤维连接蛋白 | BD | 354008 | 10倍的股票准备在1毫升H 2 O和9毫升DMEM稀释1毫克FN |
| 盖玻片 | 费舍尔 | 12-548-B | 预清洗; 22 x 22毫米 |
| L15介质 | Thermo Scientific的 | SH30525.02 | |
| 凡士林 | 舒适 | 011110794642 | 100% |
| 离心管 | Biologix | 10-9152 | 15毫升 |
| 中性蛋白酶 | 电池系统 | 4Z0-850 | 10X股权集中度 |
| 注射器 | BD | 309602 | 1毫升 |
| 针 | BD | 305127 | 25 G x 1.5英寸 |
| 的Alexa Fluor 488-IgM阳性 | 我nvitrogen | A21042 | 股票是2毫克/毫升; 7摩尔的染料/摩尔IgM抗体 |
| 解剖镊 | FST | 杂项。 | 杜蒙特#5或55;直嘴;不锈钢或钛 |
| 钨针 | N / A | N / A | 首页放置在针座 |
| 钝钳 | 蒂曼 | 160-18 | 用于转移胚胎林格从蛋黄中的 |
补充协议:制作改进的Zigmond厅
请参阅图4作为参考下面的协议:
- 购买一张3/16“厚的抛光亚克力(4.45 mm实际厚度)。
- 使用一台锯,切割室,以粗糙的尺寸33.25毫米x64.57毫米中的空白过大的。这允许3.175毫米的额外的用于加工的材料。
- 在六室设置空白本身。有了一个铣床和6.35毫米(1/4“)的端铣刀位,精加工的腔室的侧面到其精确的尺寸:30.07毫米x61.39毫米。
- 腔室定位空白的铣床上并定位沿x和y轴与一个边器的中心的坯件,然后零的中心位置。
- 采集腔室高度(z轴)的顶表面接触的端铣刀位和零的高度。
- 使用3.91毫米(0.154“)的端铣刀位,偏移位3.03毫米沿x轴(正方向)为第一储室开始加工成2.84毫米的深度,同时沿y轴移动(正方向)至7.62毫米(0.300“),然后遍历至7.62毫米(0.300”),在相反的方向(负)的长度为15.24毫米(0.600“)的一个完整的水库。偏移比特沿x轴方向(负方向)至3.03毫米(0.119“),并重复同样的过程,所述第二储。
- 在它的边缘放置室钻一个孔,用1.09毫米(0.043英寸)钻头(共4个),每个水库的水库在实验过程中加载介质腔侧连接端。
- 在温暖的肥皂水中浸泡室,以帮助消除任何化学污染物。
- 浸泡和冲洗腔室,以及在双蒸水中,以消除任何肥皂。该商会是现在已经准备好使用上述。
参考文献
- Le Douarin, N. M. The avian embryo as a model to study the development of the neural crest: a long and still ongoing story. Mechanisms of Development. 121, 1089-1102 (2004).
- Baker, C. V. . Neural Crest and Cranial Ectodermal Placodes. , (2005).
- Gammill, L. S., Roffers-Agarwal, J. Division of labor during trunk neural crest development. Dev. Biol. 344, 555-565 (2010).
- Kulesa, P. M., Gammill, L. S. Neural crest migration: patterns, phases and signals. Dev. Biol. 344, 566-568 (2010).
- Wang, H. U., Anderson, D. J. Eph family transmembrane ligands can mediate repulsive guidance of trunk neural crest migration and motor axon outgrowth. Neuron. 18, 383-396 (1997).
- Krull, C. E. Interactions of Eph-related receptors and ligands confer rostrocaudal pattern to trunk neural crest migration. Curr. Biol. 7, 571-580 (1997).
- Gammill, L. S., Gonzalez, C., Gu, C., Bronner-Fraser, M. Guidance of trunk neural crest migration requires neuropilin 2/semaphorin 3F signaling. Development, Cambridge, England. , 133-199 (2006).
- De Bellard, M. E., Rao, Y., Bronner-Fraser, M. Dual function of Slit2 in repulsion and enhanced migration of trunk, but not vagal, neural crest cells. The Journal of cell biology. 162, 269-279 (2003).
- Kasemeier-Kulesa, J. C., McLennan, R., Romine, M. H., Kulesa, P. M., Lefcort, F. CXCR4 controls ventral migration of sympathetic precursor cells. J. Neurosci. 30, 13078-13088 (2010).
- Zigmond, S. H. Ability of polymorphonuclear leukocytes to orient in gradients of chemotactic factors. The Journal of Cell Biology. 75, 606-616 (1977).
- Hamburger, V., Hamilton, H. L. A series of normal stages in the development of the chicken embryo. J. Morph. 88, 49-52 (1951).
- Boyden, S. The chemotactic effect of mixtures of antibody and antigen on polymorphonuclear leucocytes. The Journal of Experimental Medicine. 115, 453-466 (1962).
- Davis, E. M., Trinkaus, J. P. Significance of cell-to cell contacts for the directional movement of neural crest cells within a hydrated collagen lattice. Journal of Embryology and Experimental Morphology. 63, 29-51 (1981).
- Zicha, D., Dunn, G. A., Brown, A. F. A new direct-viewing chemotaxis chamber. Journal of Cell Science. 99, 769-775 (1991).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。