需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
在复杂的临床和环境样本使用寡核苷酸加上荧光微多元检测细菌
摘要
我们描述了一个复用的微生物样本内使用寡核苷酸耦合的荧光珠的检测方法。从样本内的所有生物体的扩增杂交的探针耦合珠小组。一个Luminex公司或生物复杂的仪器是用于查询每个珠珠型和杂交信号。
摘要
细菌性阴道病(BV)是一个经常性的多种微生物综合征的特点是在“正常” 菌群改变乳酸菌占主导地位, 其中包括阴道加德纳菌,Atopobium阴道的细菌种类占主导地位的菌群, 及其他1-3。这种情况是关联与对健康的负面结果,包括艾滋病毒收购4范围内,它可能难以管理临床 5 。此外,BV的诊断依赖于使用的各6,7数值标准取得的阴道拭子涂片革兰氏污渍。虽然这个诊断是简单,价格低廉,适合资源有限的环境,它可以受到相关的主观解释,并没有给出一个详细的个人资料的阴道菌群8的组成问题。最近的深度测序工作已经透露了一个丰富,形式多样的阴道菌群明确诊断相比,那些被认为正常9,10个人,这导致在11,12 BV的分子诊断的潜在目标识别与BV的个人采取的样本之间的差异。这些研究提供了丰富的有用信息,但深度测序尚未实际在临床上的诊断方法。最近,我们描述的方法,迅速 分析多重格式的阴道菌群,使用寡核苷酸耦合的荧光珠检测在 Luminex公司平台13。像目前的革兰氏染色的方法,这种方法是快速和简单,但增加了额外的优势,利用分子测序探针设计研究产生的知识。因此,这种方法提供了一种方法来配置文件的阴道拭子,可用于诊断BV具有较高的特异性和灵敏度比赛中的主要微生物ared革兰氏染色同时提供更多的信息物种的存在和丰富的半定量和快速的方式。这种复用的方法是,远远超出了目前定量PCR分析,特别是生物,目前仅限于5或6个不同的检测单个样品14范围扩展。更重要的是,该方法不仅限于细菌在阴道拭子检测,可以很容易地适应快速分析几乎所有的微生物群落的兴趣。例如,我们最近开始申请污水处理厂使用这种方法的诊断工具的发展。
研究方案
这种方法被用于Dumonceaux 等的研究。J。临床。微生物 47,4067-4077,DOI:10.1128/jcm.00112-09(2009年)。
图1描绘了整个过程的示意图。
1。珠耦合
这说明了耦合聚苯乙烯Luminex公司珠的寡核苷酸探针(见表2)使用方法。卷稍微适应新的捕获探针的评价试行;括号中表示这些卷。
- 取出-20℃dessicator 1 - 乙基-3 - (3 - dimethylamiopropyl)碳二亚胺盐酸(EDC)的粉末和温暖到室温。
- 重悬在20秒水浴sonicator sonciation微球,然后震荡约20秒。
- 400μL(100微升)微球转移到Eppendorf管(与此相对应5X10 6或1.2510 月 6微球) 。 Luminex公司建议使用低蛋白结合离心管(如的Eppendorf蛋白LoBind管,目录编号为0030 108.094),以防止粘管和干扰珠恢复耦合珠。我们没有发现这是一个问题,使用标准的聚丙烯离心管中,我们通常使用的(如VWR目录号87003-298)。
- 佩莱在1分钟XG 14000。取下并丢弃上清液。
- 重悬在50μL室温2 0.1 M的微球(12.5μL) - (N -吗啉)乙磺酸(MES),pH值4.5。
- 准备在10毫克/毫升的水,在新鲜的EDC解决方案。
- 重分析规模的EDC 5-10毫克,小于1毫升这种解决方案的准备,然后加水至10毫克/毫升。
- 加入1 nmol 5' -氨基C12修饰的捕获寡核苷酸(见表2)微球,并通过震荡混合。 1 nmol 5μL200微米寡核苷酸。
- 振荡5秒的微球和混合添加2.5μL新鲜的EDC解决方案。
- 在室温下孵育30分钟,在黑暗中。
- 丢弃的EDC解决方案(步骤1.6),并准备在水上面(步骤1.6)的10毫克/毫升的EDC的新鲜样品。
- 添加另一种新鲜的EDC解决方案2.5μL到5秒的微球和涡。
- 在室温下孵育30分钟,在黑暗中。
- 洗净加入1毫升0.02%吐温20的珠子。涡(超声以及可选20秒)重悬珠。
- 离心14000 XG 1分钟。取下并丢弃上清液。
- 再加入1毫升0.1%十二烷基硫酸钠(SDS),洗珠。涡(超声以及可选20秒)重悬珠。
- 离心14000 XG 1分钟。取下并丢弃上清液。
- 重悬在100μL(25μL)的Tris - EDTA(TE)的缓冲区[10米的珠中号的Tris - Cl的pH值8.0,1 mM的EDTA,pH值8.0。
- 枚举在血球或库尔特计数器的珠子来确定股票的浓度。
- 每个珠子稀释到终浓度为100珠/μLTE缓冲准备微法师组合。池加上珠相应的检测所需的复杂的(如10复杂的检测,混合在每个珠子的100/μl终浓度为10种不同的耦合珠)。
- 微预混存放在4 ° C黑暗环境中。混合物可以保存几个月,如果这些条件下保存。
2。分子伴侣60通用目标(cpn60 UT)的单链扩增生产和代。
- 生成聚合酶链反应每个样本(PCR)产品。包括硫代和生物素修饰的5'引物(表1)。卷组合和浓度,请参阅表3。
- 后立即PCR是完整的,加2μL(20个单位的T7前)onuclease到每个PCR管(PCR缓冲液,将足以为T7反应)。孵育反应在室温(22-25 ° C)为40分钟。
- 在此潜伏期年底,加入12.5μL0.5 M的乙烯二胺四乙酸(EDTA)pH值8.0和组合。这给出了一个共〜64.5μl的单链PCR产物。
3。 PCR产物单链寡核苷酸耦合聚苯乙烯珠杂交。
- Prewarm仪器至60 ° C至杂交温度保持在分析过程中。使用该仪器的软件平台上的加热器打开,一定要使用适合包含杂交珠混合式PCR板的黄铜加热块。
- 悬浮微硕士混合用移液器(步长1.20),免除到Eppendorf管适量,管帽,和超声水浴sonicator在2分钟。另外,绝对的一致性,以确保在珠resuspe微预混nsion,可悬浮振荡和吹打,然后超声以上,然后配药聚丙烯Eppendorf管中所需的金额。
- 免除低调96井套管PCR板(见表2)适当的水井,单链PCR产物17μL(2.2步)。添加33μL悬浮,sonciated珠的混合物,以每口井。盖硅胶套(见表2),和自来水轻轻。
- 放入热循环的方案板块:95℃5分钟,10分钟,60℃60℃保持60 ° C为5分钟,结束。启动该程序。
- 做出新的链亲和素 - 藻红蛋白(SA - PE)的解决方案,您将需要每孔25μL(额外的几口井)。稀释股票的SA - PE(1毫克/毫升)1:50至20微克/毫升1X四甲基氯化铵(TMAC)缓冲区(3中号TMAC SA - PE解决方案; 0.1%Sarkosyl; 50毫米的Tris - HCl,pH值8.0 4毫米EDTA,pH值8.0)。
- 当热循环到达60 ° C的保持步,打开盖子,取出硅胶盖,直接添加SA - PE解决方案,以每口井(不利用的热循环板)。更换硅胶套,关闭热循环盖和恢复程序。
- 当程序完成后,走板,并迅速转移到BioPlex机读。板必须在10分钟内读取。阅读在60 ° C;确保BioPlex已被预热到这个温度。可以肯定,已调整,以适应板使用,用户手册描述了使用的仪器探头高度。
- 准确珠和信号检测,BioPlex门设置必须设置根据正在使用的微型。 BioRad公司聚苯乙烯珠需要4,335-10,000门设置,而磁性微球的需要设置的5,000-25,000。也有选项板采用高的光电倍增管的设置,增加了记者增益值运行。这我可以ncrease降低信号的强度,但它是很重要的,包括适当的阴性对照,作为背景的信号也将增加。
4。代表性的成果:
我们在制定和实施这个实验的目标之一是使尽可能简单和简化。因此,我们优化了放大后的关键步骤,包括T7核酸外切酶治疗时间和杂交时间,以发展一个可以在合理的时间内完成检测。如图2a所示的扩增T7治疗是对信号的产生至关重要,因为大多数探头短或没有T7治疗很少或根本没有信号。信号呈线性增加,直到大约40分钟,此时的信号增幅放缓。 T7治疗时间2小时观察,即使在无信号的退化,这表明,硫代修饰引物的高度有效地防止轻盾吨钢绞线退化描述15。我们选择T7治疗时间为40分钟,以减低整体的协议时间,但它是从图2A的T7治疗可以去更长的时间。我们还确定了杂交时间对信号产生的影响(图2B),并发现,10分钟足够的最大信号,没有信号的进一步增加,即使后4个小时的杂交观察。因此,选择了一个10分钟的杂交步骤,再次降低整体检测时间。记住,这些结果如InstaGene(BIO - RAD)快速DNA提取技术,整体的检测,包括DNA提取,PCR和Luminex分析,在4-5个小时就可以完成。
Luminex公司或BioPlex运行期间的聚苯乙烯微球的聚合水平的一个警示说明,可以检测效率有重大影响。 BioPlex软件将显示珠聚集的水平,即当不止一个珠是在激光的路径和结果中排除从总量上的杂交信号检测。视珠聚集也可以被任何微粒物质引起的,不是单一珠的适当大小,甚至可以造成气泡。在这些事件中的任何,从珠聚合,气泡,或粒子的信号被丢弃。在大多数情况下,我们发现,珠聚合最小(图3A)和100票对每个珠子事件的目标水平是很容易实现。然而,有时珠表明一个聚集温和(图3B)或严重(图3C)的水平。在这种情况下,因为大多数的数据将被丢弃,仪器可能无法达到100事件每珠型,结果可能有问题。超声步骤(步骤3.2),是为了尽量减少珠聚集。此外,存储为一个稀微的master mix(步长1.20)珠可能有帮助。我们注意到,排除TMAC的hybridization缓冲区 - 将它添加到的SA - PE稀释剂(步骤3.5) - 有助于减少珠聚集。此外,虽然我们没有测试这个新的Luminex公司或BioRad公司提供的磁珠被认为是显示的倾向聚合。
针对G. 5 plex的Luminex公司阵列的应用结果阴道毛滴虫,A。阴道,L。 iners,L. crispatus,和L。 gasseri连同相应的革兰氏染色阴道拭子涂片如图4所示。这些样本来自在多个时间点的单个人。时间为0,个人与BV诊断的基础上革兰氏染色(图4A),并从同一样品的Luminex公司的结果(图4B)显示阵列,G.代表的生物阴道毛滴虫是最普遍的,而A。阴道和L. iners也是积极的。 9天之后,个人仍然是BV的阳性和Signal为G。阴道有大幅增加,而A。阴道和L. iners仍为阳性。更重要的是,经过这段时间的个人开始过渡到一个正常的菌群,革兰氏阳性杆菌涂片检测(图4A), 而 G的信号阴道减弱和信号为L。 iners增加(图4B)。我们用这种方法(G.阴道和/或A.阴道样本呈阳性反应,被认为是BV 的积极)13 BV的原始定义,这个人是积极BV在所有时间点, 虽然未能检测G.革兰氏染色阴道在后两个时间点。随着Luminex公司这里介绍的方法,趋 势可以很容易地相比,基于测序的方法,和Luminex公司检测结果证实革渍 13,同时提供对生物体的身份和丰富的附加 信息。
图1。Luminex公司的协议确定一个复杂的临床或环境样品的菌群轮廓示意图。该协议开始已经从样本中提取的利息的DNA模板。 (1)生成模板DNA的PCR产物链特定的生物素化, 硫代修饰cpn60 UT斯达康PCR引物, 再加上未修改cpn60 UT PCR引物(表1),(2),这将产生一个PCR产物池中的微生物与生物素硫代一个链上的修改;(3)精华的T7核酸外切酶,它可以不降低硫代修饰的分支和因此产生的单链DNA的,是在5'端用生物素修饰的双链PCR技术产品;(4)夫妇聚苯乙烯珠特定物种cpn60 UT斯达康探头-每个珠子具有独特光谱地址(由珠表示),我小号有迹可寻Luminex公司或生物复杂的仪器;(5)杂交的单链PCR产物产生利益的样本种特异性寡核苷酸,加上珠套件;(6)添加绑定到的链亲和素 - 藻红蛋白共轭生物素标记的单链PCR产物和杂交指标的行为;(7)确定光谱地址(珠身份)和杂交信号的强度,使用Luminex公司或生物复杂的仪器。至少有100珠计算每个珠子的身份和中位数的荧光强度(MFI)的藻红蛋白信号输出报告。多达100个不同的珠类型可以同时进行评估,但检测显示三珠类型的歧视说明。 (8)当在PCR的小额信贷机构重复相同的样本产生是明显大于在一个给定珠负面控制(之一,尾学生的吨的测试,p <0.05),样本是认为,有机体阳性。
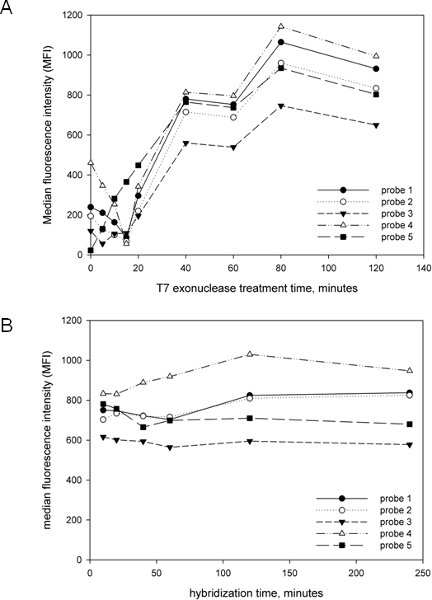
图2。Luminex公司检测参数优化。针对链球菌anaerobius五种不同的探针,用混合模板产生的扩增子包括质粒的克隆 cpn60 20已知与阴道的细菌,UT 斯达康 ,包括体育anaerobius。 (一)。 T7核酸外切酶治疗时间的影响。其次上面所描述的协议,但不同杂交和中位数的荧光强度(MFI)的所有探测器测定前用T7核酸外切酶的治疗时间。 (二)。杂交时间的影响。上面所描述的协议之后,各种杂交倍。同一组的探针被用于从同一模板生成A和中位数的荧光强度(MFI)在确定所有探头的扩增。
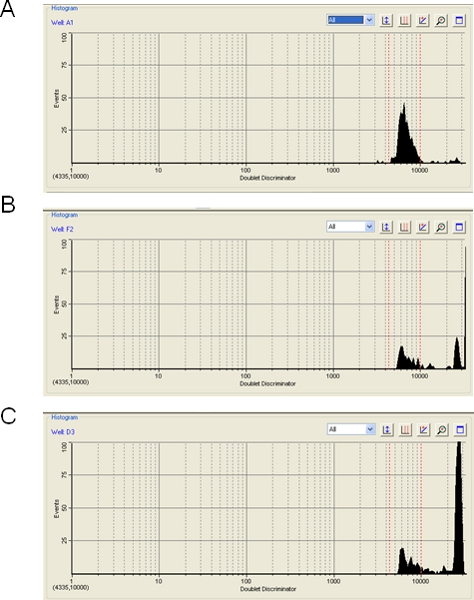
图3。测定BioPlex软件珠聚集。三个例子BioPlex运行在珠聚集水平(一)接受(5%);(二)边缘(50%);及(C)不可接受的(80%)。
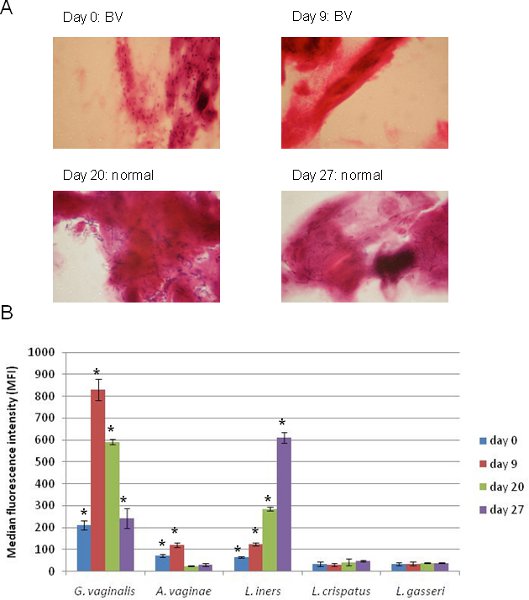
图4 5 plex的Luminex公司数组BV采取连续样品来自同一个体诊断中的应用。 (一)。革兰氏染色的幻灯片显示了传统的诊断用于评估BV每个样品。 (二)。 5 plex的Luminex公司数组的应用在本协议中所述相同的四个样品(a)所示的准备和执行。细菌的MFI信号的目标是通过我们的定义(单尾学生 t检验,P <0.05)是由星号(*)表示显著积极。
讨论
特异性的信号的产生是至关重要的,你必须有信心,信号观察真实地反映了从该生物体产生的扩增检测。如PrimerPlex(总理Biosoft)的软件可以帮助设计探针,将有效地杂交,但他们可能会或可能不会跨非目标物种杂交。如在本议定书中所述,当使用通用引物进行PCR,重要的是要牢记,代表所有的生物样品中扩增产生。它是重要的,因此,分析潜在的探针交叉杂交的可能性比较探针设计软件建议c...
披露声明
没有利益冲突的声明。
致谢
我们感谢这个手稿与实验发展和批评性意见帮助阿尔贝托Severini和Vanessa Goleski。这项工作是由加拿大公共卫生署和工业研究援助计划(加拿大国家研究理事会)。从萨斯喀彻温大学出版基金获得额外的支持。
材料
| Name | Company | Catalog Number | Comments |
| 寡核苷酸名称 | 公司 | 序列1 | |
| H279BP | Invitrogen公司,内幕交易审裁处,或其他 | 生物素OEFO GAIIIIGCIGGIGAYGGIACIACIAC | |
| H280 | YKIYKITCICCRAAICCIGGIGCYTT | ||
| H1612BP | 生物素OEFO GAIIIIGCIGGYGACGGYACSACSAC | ||
| H1613 | CGRCGRTCRCCGAAGCCSGGIGCCTT | ||
| 1O,硫代- C,E,硫代- G;楼硫代一个;我,肌苷,Y,C或T,R,A或G,K,T或G,S,C或G 。 | |||
见表1。修改后的通用cpn60 PCR寡核苷酸序列。
| 试剂名称 | 公司 | 目录编号 | 评论 |
| 1 - 乙基-3 - (3 - dimethylamiopropyl)碳二亚胺盐酸(EDC) | 刺穿 | 22980 | |
| 荧光聚苯乙烯珠:MicroPlex微球(Luminex公司),或生物复杂的羧基珠(BIO - RAD) | Luminex公司或Bio - Rad公司 | Bio - Rad公司:171 - 506xxx其中xxx对应珠标识符 | 磁珠成为寡核苷酸耦合,并可能提供一定的优势。没有尝试过这些作者。 |
| 捕获寡核苷酸(5'氨基C12修饰) | Invitrogen公司,内幕交易审裁处,或其他 | 各种 | 脱盐的纯度水平是可以接受的的。用来描述阴道拭子的捕获探针的序列是在这协议是基于 13的手稿。 |
| T7核酸外切酶 | New England Biolabs公司 | M0263S | |
| 链霉亲和R -藻红蛋白(SA - PE) | Invitrogen公司 | S - 866 | 要小心,以获得高纯度的SA - PE;这个目录建议 |
| 套管96孔PCR板 | 费舍尔 | CS006509 | 融入96孔的热循环和BioPlex机 |
| 套管密封垫 | 费舍尔 | CS006555 | 可重新使用,用肥皂水洗,冲洗干净,干燥 |
| 5M TMAC | 西格玛 | T3411 | |
| 生物复杂或Luminex公司仪器 | Bio - Rad公司或Luminex公司 | Bio - Rad公司:171-000201 | |
| PrimerPlex探针设计软件 | 总理Biosoft | www.premierbiosoft.com | 建议对Luminex公司探头DE的迹象,虽然可以使用其他软件平台 |
表2特定的试剂和设备。
| 组件 | μL/检测 | μl/100分析 | 终浓度 |
| 10x PCR缓冲液(Invitrogen公司) | 5 | 500 | 1X |
| 50毫米MgCl 2的 (Invitrogen公司) | 2.5 | 250 | 2.5毫米 |
| 10 mM的dNTP的 | 1 | 100 | 每次0.2毫米 |
| H279BP,25μM | 0.25 | 25 | 375牛米 |
| H1612BP,25μM | 0.75 | 75 | 125纳米 |
| H280,25微米 | 0.25 | 25 | 375牛米 |
| H1613,25微米 | 0.75 | 75 | 125纳米 |
| 水 | 34 | 3400 | --- |
| 总计 | 44.5 | 4450 |
表3。推荐的PCR引物(表1)与修改cpn60 UT混合物。该试剂盒被设置为5μL模板DNA和0.5μLTaq DNA聚合酶(Invitrogen公司)(2.5U)。通常情况下,大量的准备(如100检测足够),并储存在-20 ° C
参考文献
- Hale, L. P., Swidsinski, A., Mendling, W. Bacteria associated with bacterial vaginosis. N. Engl. J. Med. 354, 202-203 (2006).
- Hay, P. Life in the littoral zone: lactobacilli losing the plot. Sex. Transm. Infect. 81, 100-102 (2005).
- Morris, M., Nicoll, A., Simms, I., Wilson, J., Catchpole, M. Bacterial vaginosis: a public health review. Brit. J. Obstet. Gynecol. 108, 439-450 (2001).
- Myer, L., Kuhn, L., Stein, Z. A., Wright, T. C., Denny, L. Intravaginal practices, bacterial vaginosis, and women's susceptibility to HIV infection: epidemiological evidence and biological mechanisms. Lancet. Infect. Dis. 5, 786-794 (2005).
- Wilson, J. Managing recurrent bacterial vaginosis. Sex. Transm. Infect. 80, 8-11 (2004).
- Nugent, R. P., Krohn, M. A., Hillier, S. L. Reliability of diagnosing bacterial vaginosis is improved by a standardized method of gram stain interpretation. J. Clin. Microbiol. 29, 297-301 (1991).
- Ison, C. A., Hay, P. E. Validation of a simplified grading of Gram stained vaginal smears for use in genitourinary medicine clinics. Sex. Transm. Infect. 78, 413-415 (2002).
- Money, D. The laboratory diagnosis of bacterial vaginosis. Can. J. Infect. Dis. Med. Microbiol. 16, 77-79 (2005).
- Schellenberg, J. Pyrosequencing of the chaperonin-60 universal target as a tool for determining microbial community composition. Appl. Environ. Microbiol. 75, 2889-2898 (2009).
- Spear, G. T. Comparison of the diversity of the vaginal microbiota in HIV-infected and HIV-uninfected women with or without bacterial vaginosis. J. Infect. Dis. 198, 1131-1140 (2008).
- Brotman, R. M., Ravel, J. Ready or not: the molecular diagnosis of bacterial vaginosis. Clin. Infect. Dis. 47, 44-46 (2008).
- Fredricks, D. N., Fiedler, T. L., Marrazzo, J. M. Molecular identification of bacteria associated with bacterial vaginosis. N. Engl. J. Med. 353, 1899-1911 (2005).
- Dumonceaux, T. J. Multiplex detection of bacteria associated with normal microbiota and with bacterial vaginosis in vaginal swabs by use of oligonucleotide-coupled fluorescent microspheres. J. Clin. Microbiol. 47, 4067-4077 (2009).
- Molenkamp, R., van der Ham, A., Schinkel, J., Beld, M. Simultaneous detection of five different DNA targets by real-time Taqman PCR using the Roche LightCycler480: Application in viral molecular diagnostics. J. Virol. Meth. 141, 205-211 (2007).
- Nikiforov, T. T., Rendle, R. B., Kotewicz, M. L., Rogers, Y. H. The use of phosphorothioate primers and exonuclease hydrolysis for the preparation of single-stranded PCR products and their detection by solid-phase hybridization. PCR. Methods. Appl. 3, 285-291 (1994).
- Hill, J. E., Penny, S. L., Crowell, K. G., Goh, S. H., Hemmingsen, S. M. cpnDB: A Chaperonin Sequence Database. Genome. Res. 14, 1669-1675 (2004).
- Bradshaw, C. S. The association of Atopobium vaginae and Gardnerella vaginalis with bacterial vaginosis and recurrence after oral metronidazole therapy. J. Infect. Dis. 194, 828-836 (2006).
- Dumonceaux, T. J. Enumeration of specific bacterial populations in complex intestinal communities using quantitative PCR based on the chaperonin-60 target. J. Microbiol. Meth. 64, 46-62 (2006).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。