需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
使用油脂全线Bicelle方法的膜蛋白的高通量结晶
摘要
Bicelles脂质/两亲分子的混合物保持在脂质双层膜蛋白(MPS),但有独特的相行为,有利于高通量筛选的结晶机器人。这项技术已成功地生产从原核和真核来源的高分辨率结构。本视频介绍了生成油脂全线Bicelle混合物,纳入全线Bicelle混合物的国会议员,成立从中长期的结晶试验(手动以及作为机器人)和收割晶体的协议。
摘要
在许多生理过程,如抽水整个否则周围所有的细胞和细胞器的防渗膜双层的具体分子膜蛋白(MPS)发挥了关键作用。 MPS导致许多人类的疾病和失调的功能发生变化,因此,其结构复杂的认识,仍然是生物学研究的重要目标。然而,国会议员的决心结构仍然是一个重大的挑战往往来自其疏水性所引起的。
国会议员的双层内嵌入大量的疏水区域。经常使用的洗涤剂这些蛋白质溶解产生一种蛋白质,然后可以在一个类似的方式为可溶性蛋白操纵洗涤剂胶束双层。传统上,进行结晶试验使用一种蛋白质清洁剂的混合物,但他们往往抵制结晶或生产质量较差的晶体。出现这些问题,因洗涤剂无法充分模仿双层导致稳定性差和异质性。此外,洗涤剂盾牌疏水表面的MP减少晶体接触的表面积。来规避这些弊端国会议员可结晶油脂的媒体,更加紧密地模拟其内源性环境,并在最近成为了MP的结晶新技术。
油脂立方米阶段(LCP)是一个立体的脂质双层渗透 1水通道的互联系统。虽然monoolein是选择脂质,如monopalmitolein和monovaccenin相关的血脂也被用来做LCP 的 2 。国会议员被纳入LCP的,他们在三个层面和饲料晶核弥漫。 LCP的一个巨大优势是,该蛋白在更自然的环境中仍然存在,但该方法具有技术的弊端,包括高VISCosity(需要专门的仪器),并在晶体中的可视化和操纵3,4的困难。由于这些技术上的困难,我们利用另一个结晶bicelles 5,6( 图1)油脂中。 Bicelles是与两亲(CHAPSO)或短链的脂质(DHPC)一个混合的磷脂酰胆碱脂质(DMPC)所形成的脂质/两亲分子的混合物。在每个全线Bicelle光盘,脂质分子生成双层而行两亲分子的非极性边缘的双层和洗涤剂提供有益的特性。重要的是,其转变温度以下,蛋白全线Bicelle混合物粘度降低和控制在一个类似的方式溶解洗涤剂,国会议员,bicelles兼容结晶机器人。
Bicelles已成功地用于结晶几个膜蛋白5,7-11(见表1)。这种增长的集合蛋白质演示的bicelles结晶从原核和真核来源的α-螺旋和β表国会议员的多功能性。由于这些成功和高通量实施简单,bicelles应该是每一个膜蛋白晶体学的武器库中的一部分。在这个视频中,我们描述全线Bicelle方法,并提供一个一步一步的协议,使用标准的机器人纯化国会议员成立的高通量结晶试验。
研究方案
全线Bicelle基础的结晶,是由四个基本步骤(图2):我)准备一个全线Bicelle形成脂质:两亲分子的混合物;二)进入全线Bicelle介质的纯化蛋白质的结合;三)结晶试验(手动或自动机械);及iv)可视化,晶体的提取和冻结。下面详细介绍这些步骤
1。准备的Bicelles
Bicelles可以形成:两亲组合在各种脂质的浓度范围。因此,基于以往的成功条件,初步构成建议( 见表1) 。最成功的混合物DMPC:CHAPSO全线Bicelle制定,可以购买商业作为预混使用现成的制定(见下面试剂表)或所描述的那样在实验室准备。在本练习中我们将准备在2.8:1的摩尔比1毫升35%DMPC:CHAPSO混合物。
- 称取0.26克DMPC(先生677.9克/摩尔),0.09克CHAPSO(先生630.9克/摩尔),并添加去离子水至终体积为1.0 ml。
- 全线Bicelle的比例在10%-40%之间,可以改变一个DMPC:CHAPSO摩尔比从2.6-3.0:1不等(表1)。
- 注意:全线Bicelle浓度越难以溶解脂质,导致在一个较高的的溶液粘度越高。然而,一个集中的全线Bicelle制定有利的蛋白质浓度低时。
- 溶解脂质获得一个同质的解决方案,需要相当大的努力,使这一步的大部分时间消耗在全线Bicelle方法。完全混合通过以下步骤,直到DMPC与周期:
- 温暖的混合物〜40℃水浴或培养箱〜1分钟的旋涡。
- 注:由于开展更多的周期,气候变暖的混合物将导致在凝胶样CONsistency使得很难以涡。
- 酷冰几分钟的旋涡混合物。冷却有助于液化的解决方案,使其更容易,以涡。
- 注:随着越来越多的循环执行,混合物冷却后可能成为阴天。
- 重复上面列出(1.2.1和1.2.2),直到完全溶解脂质的步骤。
- 注意:此过程可能需要几个小时。全线Bicelle形成表明DMPC与相行为的变化:CHAPSO制定。建成后,将混合物在室温或以上的透明凝胶上冰的粘稠液体。
- 温暖的混合物〜40℃水浴或培养箱〜1分钟的旋涡。
- 全线Bicelle的混合物,现在可以使用,并保持长期存储(长达5年的),可在-20 ° C。由于水解磷脂头组的风险,这是不可取的,储存在室温下长时间bicelles。
2。蛋白质团到bicelles
从bicelles获得大多数的MP结构结晶DMPC:CHAPSO全线Bicelle浓度从2%至8%不等的8至12毫克/毫升( 见表1)的蛋白浓度。如果可能的话,初始屏幕应使用这些准则和额外的浓度可在优化阶段筛选。 LCP的方法相比,蛋白与bicelles法团是一个简单的过程( 图3),它应该做的结晶试验的同一天。
- 解冻DMPC:CHAPSO全线Bicelle相位的变化,以明确的凝胶在室温下混合,直到。
- 注:多个冷冻解冻不会影响全线Bicelle行为。
- 放在冰的混合物,液化和简要涡重新建立一个同质全线Bicelle阶段。当置于冰上的混合物可能变得浑浊。
- 神父OM这一点上,保持全线Bicelle混合物和纯净冰蛋白。这将保持在液体中的相适合吹打全线Bicelle。
- 全线Bicelle混合物添加洗涤剂溶解在1:4(V / V)的比例纯化蛋白。
- 例如:100μL蛋白全线Bicelle混合获得混合与20μL全线Bicelle 80μL蛋白。如果蛋白浓度为15毫克/毫升,全线Bicelle浓度为35%,这会给一个全线Bicelle注册的蛋白质混合物的蛋白浓度12毫克/毫升和7%的全线Bicelle浓度。
- 轻轻吹打的内容向上和向下,直到溶液变得清晰和均匀混合。
- 注:如果气泡出现,快速自旋与台式离心机(30-60秒,13000 RPM,4℃),可以帮助将其删除。
- 在冰上孵育至少30分钟的混合物,以促进蛋白质的INT的完整纳入Ø bicelles。现在的蛋白质全线Bicelle混合结晶试验的准备。
3。设置结晶试验
其他脂质像LCP的结晶技术需要专门的设备,由于介质的高粘度;,但bicelles独特的相行为允许在执行几乎任何标准的结晶格式,包括机器人(图3)。悬挂或坐滴格式,使用标准的市售屏幕可以进行结晶试验。
- 无论是设立托盘手动或使用结晶机器人,保持在冰上的蛋白质,全线Bicelle混合物。这将保持全线Bicelle的蛋白质混合物冷,确保溶液的粘度是最小的。
- 手册结晶试验 - 使用标准的吸管,蛋白质全线Bicelle混合物可以以同样的方式与水库解决方案混合作为正常执行教育署可溶性或洗衣粉溶解膜蛋白。
- 注:在审判全线Bicelle蛋白混合物置于冰上。
- 机器人结晶试验 -我们有专门适合蚊子的结晶机器人这些试验,但原则(以下相同的预防措施)的技术应与所有的结晶机器人兼容。以下提示将确保全线Bicelle蛋白混合保持冷静和准确地由机器人吸管:
- 预冷板,放在冰的蛋白质,全线Bicelle混合物。
- 移液器进入板块全线Bicelle蛋白混合,并继续保持在冰板。这个板块应该开始运行之前的最后一个项目上的机器人。
- 设置水库托盘和结晶盖平台3和5分别蚊子机器人,。
- 将含有蛋白全线Bicelle混合平台4板蚊子的机器人。这可以保证蛋白质,全线Bicelle混合物最后被拾起机器人,并立即释放。
- 为了防止加热和粘度增加,不混合蛋白全线Bicelle混合水库。
- 执行多个屏幕上时,立即返回全线Bicelle蛋白质板冰的冷却尽快完成运行。
- 可以选择滴体积比(蛋白质:水库)作为传统的结晶试验。例如,可以成立的初步水晶试验,用蚊子机器人,使用0.25μL蛋白:全线Bicelle混合加0.25μL水库。
- 孵育晶体试验室,在20 ° C。因为bicelles阶段行为是取决于温度,温度是一个很好的筛选和优化参数。
- 较高的温度,诱发层状第12期( 图1),其中已预先组织的优势层中的蛋白质。温度低于20 ° C可以进行筛选,但你不应该低于4 ° C可能,因为这导致脂质过长时间的沉淀。
- 在相同的方式作为传统的结晶试验,全线Bicelle试验应在晶体的外观和增长的定期监测。我们建议检查托盘上的第1和第3天安装后每周检查。
- 水晶可以进行优化,使用洗涤剂,包括网格筛选,添加剂筛选,温度变化等。此外,全线Bicelle百分比和蛋白质晶体的基础经常使用的方法:全线Bicelle的比例可以是多种多样的。此外,bicelles可以掺杂特定血脂,可能是蛋白质稳定性或功能所必需的。
4。可视化,晶体的提取和冻结
由于与蛋白质,全线Bicelle混合物的晶体试验粘度类似蛋白洗涤剂滴,可视化和晶体提取是家常便饭,像传统的设置进行。
- 可视化:在LCP的媒体,通常需要高品质的照明下正常和极化晶体检测,可视化是不bicelles阻碍。有色以及无色蛋白晶莹的水珠,可以很容易地使用标准的显微镜,无需特殊设备需要进行分析。
- Bicelles,其他油脂媒体一样,往往会产生高比例的误报。一个UV镜,大大有助于区分盐晶体蛋白(图4)。
- 提取和冷冻:水晶提取和冷冻是相对简单,并且不需要解散周围全线Bicelle媒体。此外,全线Bicelle阶段本身提供了一些温和的冷冻保护。
5。代表性的成果:
NT“一般需要2-3天晶体出现,大约一周或更长时间为他们成长到他们的最大尺寸,这是细菌视紫红质和鼠标的电压依赖性阴离子通道1(mVDAC1) 晶体 4,8对于其他的膜蛋白,它可以需要几个星期,晶体生长,所以重要的是继续监测,远远超出了第一周的晶体试验。油脂与其他媒体中,bicelles往往以形成形状可能出现结晶。它也被观察到,他们带领到更高比例的盐和洗涤剂晶体。紫外线-色氨酸荧光显微镜检测可以显着帮助消除这类非蛋白质的误报。图4显示了脂质形状,盐和蛋白质晶体在可见光和紫外线光的效果,以帮助区分不同的结果可观察到的。
83fig1.jpg“/>
图1。全线Bicelle示意图 。 DMPC(蓝色)和CHAPSO(绿色),保护双层的疏水边缘,如两亲如形成一个双层脂质分子组成Bicelles。随着温度的增加,圆盘状bicelles经历了一个相变成穿孔层状表12。
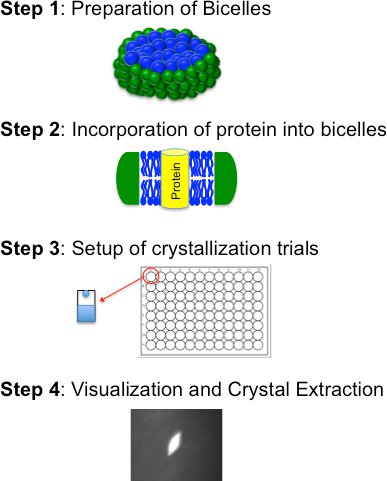
图2。全线Bicelle结晶的方法,概述了四个基本步骤的流程图。

图3。晶体试验设置示意图。纯化洗涤剂溶解膜蛋白可以直接混入的内容由简单的移液一起上冰bicelles。冰〜30分钟,结晶试验后孵化的蛋白质/全线Bicelle混合物可以设置使用任何标准格式,包括机器人。

图4。晶体试验的可视化。可见光图像( 顶部面板 )和紫外线图像( 底部面板 )( 一 )针形观察到晶体中盐的唯一条件。可以检测无荧光的晶体,假阳性的迹象。 (二)在MPD条件杆状结晶形成。晶体荧光弱,但被发现使用X射线衍射的非蛋白质。 (三)水晶观察到约四个星期后,设立审判。紫外光下的强荧光,证实它是一种蛋白质晶体。
| 号 | 蛋白质 | 来源 | 全线Bicelle配方 | 蛋白质Concentrati上 | 洗涤剂1 | 决议案(a) | 参考 |
| 1 | 细菌视紫红质2 | Halobacterium salinarum | 8%DMPC:CHAPSO(2.8:1) | 8毫克/毫升 | 2.0 | Faham和鲍伊,2002年 | |
| 8%DTPC:CHAPSO(3:1) | 8毫克/毫升 | 1.8 | Faham 等,2005年 | ||||
| 2 | β2-肾上腺素受体/晶圆厂复杂 | 智人 | 8.3%DMPC:CHAPSO(3:1) | 10毫克/毫升 | DDM | 3.4/3.7 | Rasmussen 等人,2007年 |
| 3 | 电压依赖性阴离子通道1 | 小家鼠 | 7%DMPC:CHAPSO(2.8:1) | 12毫克/毫升。 | LDAO | 2.3 | Ujwal 等,2008 |
| 4 | Xanthorhodopsin | Salinibacter曲霉 | 4.2%DMPC,新墨西哥州5% | 4毫克/毫升。 | DDM | 1.9 | Luecke 等。 |
| 5 | 菱形蛋白酶 | 大肠杆菌 | 2%DMPC:CHAPSO(2.6:1) | 9毫克/毫升 | 壬基酚葡萄糖苷 | 1.7 | 2011年Vinothkumar, |
1用于膜蛋白的纯化的洗涤剂
2从紫膜的母语血脂可能在纯化过程中同时进行
表1。膜蛋白结构的结晶条件总结解决使用 bicelles 。
Access restricted. Please log in or start a trial to view this content.
讨论
Bicelles是一个独特的,提供原生双层式的环境,而表现犹如洗涤剂溶解油脂媒体。此属性,给出了bicelles一个明显的优势超过其他脂质体的结晶方法,因为没有学习曲线,这种技术所需的专用设备。一旦bicelles,无论是商业或准备在实验室中,他们可以直接与纯化的蛋白质,从这个角度混合结晶试验几乎完全与标准洗衣粉的协议进行的。此外,bicelles提供了包括与其他技术相比,延长贮存期,蛋白?...
Access restricted. Please log in or start a trial to view this content.
披露声明
没有利益冲突的声明。
致谢
我们要感谢博士。詹姆斯Bowie和萨利姆Faham全线Bicelle方法和有益的讨论特拉维夫拉巴斯博士提供的技术专长和指导。我们承认实验支持乐杜。 Rachna Ujwal MemX生物科技有限责任公司,但是,不支持这项工作的财务利益。这项工作是支持部分由美国国立卫生研究院(RO1 GM078844)资助。
Access restricted. Please log in or start a trial to view this content.
材料

参考文献
- Landau, E. M., Rosenbusch, J. P. Lipidic cubic phases: A novel concept for the crystallization of membrane proteins. Proceedings of the National Academy of Sciences. 93, 14532-14535 (1996).
- Caffrey, M., Lyons, J., Smyth, T., Hart, D. J. Chapter 4 Monoacylglycerols: The Workhorse Lipids for Crystallizing Membrane Proteins in Mesophases. Current Topics in Membranes. 63, 83-108 (2009).
- Nollert, P., Landau, E. M. Enzymic release of crystals from lipidic cubic phases. Biochem. Soc. Trans. 26, 709-713 (1998).
- Cheng, A., Hummel, B., Qiu, H., Caffrey, M. A simple mechanical mixer for small viscous lipid-containing samples. Chem. Phys. Lipids. 95, 11-21 (1998).
- Faham, S., Bowie, J. U. Bicelle crystallization: a new method for crystallizing membrane proteins yields a monomeric bacteriorhodopsin structure. J. Mol. Biol. 316, 1-6 (2002).
- Faham, S., Ujwal, R., Abramson, J., Bowie, J. U. Chapter 5 Practical Aspects of Membrane Proteins Crystallization in Bicelles. Current Topics in Membranes. 63, 109-125 (2009).
- Faham, S. Crystallization of bacteriorhodopsin from bicelle formulations at room temperature. Protein Science. 14, 836-840 (2005).
- Luecke, H. Crystallographic structure of xanthorhodopsin, the light-driven proton pump with a dual chromophore. Proceedings of the National Academy of Sciences. 105, 16561-16565 (2008).
- Ujwal, R. The crystal structure of mouse VDAC1 at 2.3 Å resolution reveals mechanistic insights into metabolite gating. Proceedings of the National Academy of Sciences. 105, 17742-17747 (2008).
- Vinothkumar, K. R. Structure of rhomboid protease in a lipid environment. J. Mol. Biol. 407, 232-247 (2011).
- Rasmussen, S. G. F. Crystal structure of the human [bgr]2 adrenergic G-protein-coupled receptor. Nature. 450, 383-387 (2007).
- Prosser, R. S., Hwang, J. S., Vold, R. R. Magnetically aligned phospholipid bilayers with positive ordering: a new model membrane system. Biophys. J. 74, 2405-2418 (1998).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。