需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
RNAi介导的基因敲除和
摘要
在这个协议中,我们结合RNAi介导的基因沉默在体内利尿法研究感兴趣的基因的影响击倒蚊虫液的排泄。
摘要
这个视频协议演示了一个有效的技术击倒在昆虫特定基因,并进行一种新的生物活性来衡量排泄率。这种方法可以用于获取更好地了解昆虫的利尿过程,是在利尿吸血节肢动物,能够占用大量的液体,在一个单一的血粉的研究,特别是有用的。
这RNAi介导的基因敲除结合在体内利尿法是由汉森实验室研究RNAi介导水通道蛋白基因埃及伊蚊利尿1击倒的影响。
该协议是在设置两部分:第一个示范说明如何构建一个简单的蚊子喷射装置及如何准备和注入的蚊子胸部RNAi介导的基因敲除的dsRNA。第二个示范说明如何确定在使用延命蚊子的排泄率。
研究方案
第一部分- RNAi介导的基因敲除成年埃及伊蚊蚊。实验概述, 见图1。
1。双链RNA的合成
- 对利益和控制的dsRNA基因合成的双链RNA。注:我们建议发展中国家引物的PCR片段范围在300至500个碱基对位于特定基因2月底3'和T7引物序列在5'端(5'-TAA TAC GAC中TCA的CTA重视。豪GG-3')。片段的唯一性,应确认BLASTN程序分析3。
- 使用的Ambion公司的T7 Megascript高产转录试剂盒(Ambion公司,试剂表),利用T7 RNA聚合酶转录反应合成双链RNA。注:类似的试剂和试剂盒可在别处。
- 净化双链RNA,沉淀氯化锂遵循的Megascript套件指示。
- 后purificat离子,在无菌水溶解的双链RNA沉淀。用于显微注射,以确保足够的粘度,dsRNA的浓度不得超过2微克/微升。
2。注射液的制备
- 可以构造一个简单的微注射器用管,剪刀,金属针,1 ml注射器,1毫升的塑料枪头( 见图2)。应切断油管〜40厘米长。另外,自动化微注射器可用于如德拉蒙德Nanojet二4。
- 2毫升的刻度切尖的注射器(针轮毂),并从橡胶柱塞头柱塞。
- 打孔使用金属针在橡胶柱塞头和橡胶柱塞的后脑勺针枢纽。
- 油管的一端放置在针枢纽,并将其放置在另一端1毫升的塑料枪头,将口片(另外,10毫升SYringe可用于生产注射所需的空气压力)。
- 孔中的橡胶柱塞头放置在一个玻璃毛细管针,并打破针尖所以宽度是足够大的液体流经。注:针尖的最优规模待定经验 - 如果针的宽度太大,这将导致创伤和高蚊子死亡率,如果针的宽度太小,这将是不可能的渗透蚊子的外骨骼。
- 淹没在准备双链RNA样品注射针,并绘制成的注射针吸口片(或注射器)的液体,液体样品。注意:这一步是相同的所有液体试剂注入蚊子,包括PBS缓冲液,这是用来在体内利尿检测协议(见下文)。
3。收集和麻醉蚊子
- 收集用电池供电到一个收集瓶吸气ţ蚊子。放置在收集瓶的瓶盖和瓶放在一个干净的CO 2垫麻醉蚊子。注:另外,蚊子可以在冰麻醉。
4。蚊子注射液
- 打开收集瓶的CO 2垫直接放在蚊子,等到蚊子是麻醉。
- 丢弃所有男性。
- 排队上侧的蚊子,以便更容易地访问注射。
- 抢蚊子的腿或翅膀,以避免受伤。你也可以用细的画笔或羽毛来操纵蚊子。
- 当准备注入第一的蚊 子,轻轻的支持与钳胸部一侧针尖插入对方胸部( 图2)。这是更好地注入的角质层薄的部分,避免推针O连接到胸部深。
- 一旦针到位,吹入蚊子的液体。所需的金额可以由监察针液体半月板。必要毫米为一个特定的卷的数目可以由玻璃毛细管针(πr2小时 )的汽缸容积计算。通常用于注射用双链RNA的有效金额为1微克。
- 一旦液体被注入到蚊子,仔细地缩回针头。如果胸部外大型液体液滴形式,蚊子应该被丢弃。然后,重复这个过程中,未来的蚊子。
5。蚊子的恢复和存储
- 注射后,放置在储存容器中的蚊子。例如,一品脱蜡内衬纸板杯(汤杯)网覆盖纸板盖保护。盖有网的覆盖暴露了削减部分。一旦所有的钼squitoes放置在容器中,容器放置在孵化室环境控制和提供食物来源,如20%蔗糖浸泡的棉花球放在网覆盖顶部的蚊子。 在体内利尿检测的,然后再执行,剥夺水源的双链RNA注射蚊子为12小时,以规范每个蚊子的水化状态。
- 双链RNA介导的基因敲除效率可以是可变的。基因沉默可以开始注射后1天,它可能会持续注射后4至6天。确定的最佳时机,以实现最大的基因敲除每一个基因的经验。一般来说,我们等待双链RNA注射后的前3天进行。
第二部分- 在成人埃及伊蚊的蚊子体内利尿法
注:此协议已被发达国家和作者用于黄热病的蚊子的水通道蛋白介导的RNA干扰击倒的埃及伊蚊 。为了避免个别蚊子之间的变异,蚊子应分析组。由于技术上的原因,我们建议5%治疗蚊虫群体 - 有一个有限的时间内进行第一次测量体重,蚊子开始前,注射后尿排泄。
6。收集和麻醉蚊子
- 之前收集的蚊子,记录与使用分析精密天平盖一个空的收集瓶的重量。这瓶将被用于所有后续测量。
- 权衡收集瓶与抽气收集到5个雌性蚊子。将在收集瓶帽,让它坐几秒钟的CO 2垫麻醉蚊子。
7。初始重量测量
- 采取ţ他的5个蚊子初始体重测量,将收集瓶含有精密天平上的帽蚊子。
- 计算组5蚊子的重量,通过蚊子的重量和收集瓶与盖和帽空收集瓶的重量减去。
- 打开收集瓶和录制的蚊子的重量后,直接放置在CO 2垫蚊子。如果蚊子都开始醒来时体重测量,为几秒钟,然后打开它,并放在垫蚊子小瓶上的CO 2垫。
8。注射液的制备
- 设立微注射器RNAi介导的基因敲除协议中的指示。
- 放置一个玻璃毛细管在微注射器针头和打破针尖宽度足够大的液体uid来流经。
- 淹没的针在PBS缓冲液和注射针吸引到缓冲区,使用此协议所需的金额是1.25每个蚊子的PBS液。注:此金额模仿,采取雌蚊5血浆的平均金额。
9。蚊子注射液
- 排队的蚊子,以便更容易与微注射器的访问。
- 一旦针到位,吹PBS缓冲液,把蚊子。
- 一旦液体被注入到蚊子,可能形成液滴在胸部外侧。这液滴下一步前要认真清除。
- 重复注射过程中,与未来的蚊子。随着经验的积累,蚊子的存活率会是注射后几乎100%。
10。称重蚊子
- 注射后,轻轻将蚊子在收集瓶和帽子。 5蚊子将收集瓶含有精密天平上的帽蚊子,以第一次测量体重。
- 蚊子和收集瓶与盖的重量计算组5蚊子的重量减去空收集瓶与盖的重量。注:蚊子会开始分泌尿液中的CO 2麻醉垫取出后2分钟内,所以重要的是要测量体重才开始排泄。
- 放置在一个小容器中的蚊子,他们将在那里开始排泄尿液。
11。第二个和随后的体重测量
注:在30分钟的时间间隔应采取的蚊子的重量测量,但可以调整或长或短的时间间隔取决于排泄率。
- 30分钟后,收集石斑鱼页5抽吸到相同的收集瓶与盖蚊子。采取将收集瓶含有精密天平上的帽蚊子蚊子的下一个体重测量。
- 测量后,将在接下来的30分钟在同一控股容器的蚊子。
- 重复这个过程所需的时间量。
12。确定蚊子排泄率
- 可以计算出被注入到5蚊子的液体总量减去初始体重的重量后,立即注射蚊子。
- 可以计算出在一个特定的时间点是由蚊子组排出的尿液量减去初始体重从重量在特定时间点的蚊子蚊子。
- 在一个特定时间点的排泄率,可以计算出航空维修丁在这个时间点尿排出的液体注入( 见表1)的总金额的数额。
13。代表结果
RNAi介导的基因敲除和体内利尿法已用于汉森实验室研究水通道蛋白在埃及伊蚊利尿的效果。三是水通道蛋白表达在埃及伊蚊马氏管被撞倒图4显示了代表利尿法已被用来排泄率比较埃及伊蚊和致倦库蚊实验结果相比,控制蚊子1排泄率显着效果。在不同的温度。
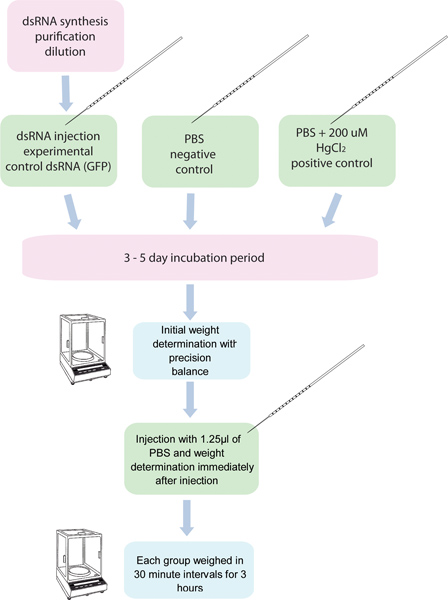
图1。 RNA干扰/利尿法流程图 5组,每组10蚊子EA。CH注射dsRNA的一个特定的基因,十蚊五组与对照双链RNA注入。另一组200μM2 HgCl在PBS注射蚊子被用来作为阳性对照。这些蚊子注射前和注射3小时30分钟的时间间隔后称重。
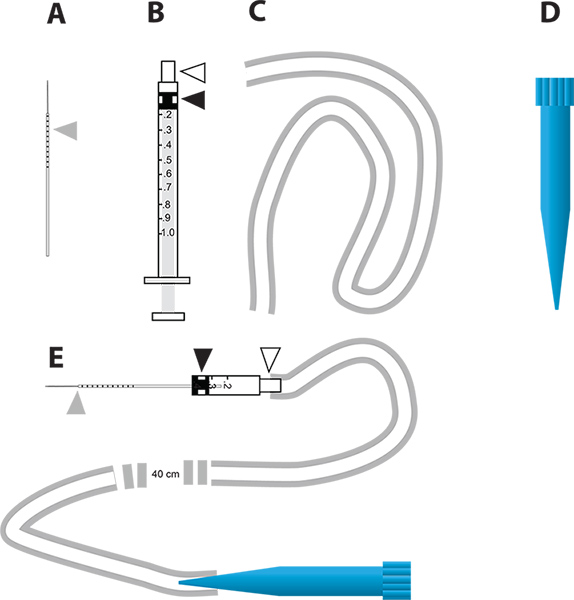
图2。 RNAi介导的基因敲除和在体内利尿法的一个简单的微注射装置。A。用于注射的玻璃毛细管针。灰色的三角形代表毫米针提请表明液体注射到蚊子的数量递增。乙1毫升注射器用于兴建微注射器。白色三角形代表针枢纽和黑色三角形代表的橡胶柱塞头连接在注射器的柱塞。 C.油管用来连接的喉舌喷油器。 D. 1毫升一次性吸管头(蓝色提示)的显微注射设备的喉舌。 E.显微注射设备,采用公元部分。 点击这里查看大图 。
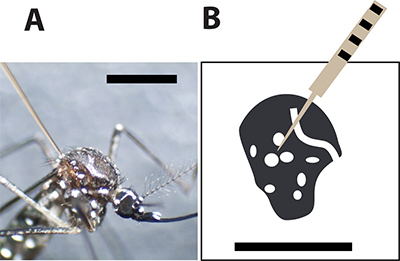
图3。最佳蚊子注射部位。答与胸部之间的大尺度的玻璃毛细管针注射雌性埃及伊蚊 。黑条表示1毫米大小的比较。 B.绘图的雌蚊胸部和白色斑点代表在蚊子外骨骼的白色鳞屑。注射针应刺破景点之间的蚊子,以尽量减少注射时的死亡率。
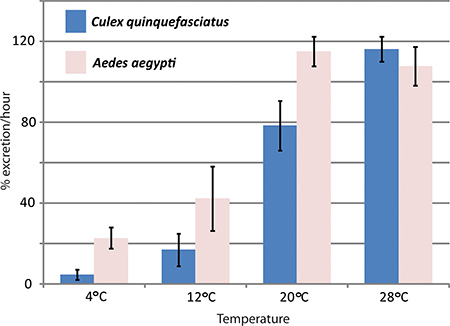
图4。对温度的影响致倦库蚊和埃及伊蚊利尿TURE。利尿法两蚊, 埃及伊蚊和致倦库蚊种,在不同温度下进行。在注射后的第一个小时的排泄率(%)。
| 组 | 塔拉 (七) | 不注射 (七) | 注射后 (七) | 后1h进样 (七) | 平均体重(毫克) | 量注射 (μL) | 金额排出 (μL) | %排泄 |
| 1 | 7.5938 | 7.6057 | 7.6104 | 7.6096 | 2.38 | 0.94 | 0.16 | 17.0 |
| 2 | 7.8252 | 7.8349 | 7.8415 | 7.8403 | 1.94 | 1.32 | 0.24 | 18.2 |
| 3 | 7.8896 | 7.9026 | 7.9077 | 7.906 | 2.6 | 1.02 | 0.34 | 33.3 |
表1。 埃及伊蚊在执行与埃及伊蚊雌蚊在体内利尿法在4°C的原始数据体内利尿检测结果。
讨论
RNAi的协议,用于已开发在Raikhel亚历山大实验室在加州河滨大学6,7和类似由加弗和Dimopoulos 4发表了一份协议。这个视频协议中的实验方法可以用来研究有关的基因在昆虫体内设置利尿。作为一个简单的“利尿模型系统,吸引昆虫,马氏管,排泄器官几代科研人员的利益。这个器官是涉及通关8和果蝇的工作已确定在马氏管生理9,10,现在可以在其他昆虫...
披露声明
我们什么都没有透露。
致谢
作者感谢她的这个协议的批评维多利亚木匠。
材料
| Name | Company | Catalog Number | Comments |
| 试剂或设备名称 | 公司 | 目录编号 | 评论 |
| MEGAscript的T7高产套件 | Ambion公司,公司 | AM1334 | |
| PBS缓冲液 | Sigma-Aldrich公司 | P4417 | |
| 塑料管材 | 本地供应商 | 聚氯乙烯 | |
| 1毫升胶枪头 | 厂商VWR | 83007-376 | 蓝尖 |
| 1毫升注射器 | 流式细胞,Dickinson公司 | 309602 | |
| 剪刀 | 本地供应商 | ||
| 金属针 | 卡罗来纳州生物 | 654307 | 大小5 |
| 飞垫 | 杰纳西科学 | 789060 | |
| 电池供电的吸气/收集瓶 | UPMA实验室 | IPMM 2000 | |
| 细尖镊子 | 世界精密仪器 | 14095 | |
| 玻璃毛细管针 | 世界精密仪器 | 1B200-6 | |
| 立体解剖显微镜 | 徕卡公司 | S6D | |
| 分析精密天平 | 梅特勒 - 托利多 | AB54S | |
| 蔗糖 | Sigma-Aldrich公司 | 84097 | |
| 一品脱打蜡内衬纸板杯 | 本地供应商 | 制造汤杯 | |
| 网状网 | 本地供应商 | 塑料飞纱布的 |
参考文献
- Drake, L. L., et al. The Aquaporin gene family of the yellow fever mosquito, Aedes aegypti. PloS one. 5, e15578 (2010).
- Shepard, A. R., Jacobson, N., Clark, A. F. Importance of quantitative PCR primer location for short interfering RNA efficacy determination. Analytical biochemistry. 344, 287-288 (2005).
- Altschul, S. F., et al. Gapped BLAST and PSI-BLAST: a new generation of protein database search programs. Nucleic acids research. 25, 3389-3402 (1997).
- Garver, L., Dimopoulos, G. Protocol for RNAi Assays in Adult Mosquitoes (A. gambiae). J. Vis. Exp. (5), e230 (2007).
- Clements, A. N. Volume 1 Development, Nutrition, and Reproduction. The Biology of Mosquitoes. 2, (1992).
- Hansen, I. A., Attardo, G. M., Park, J. H., Peng, Q., Raikhel, A. S. Target of rapamycin-mediated amino acid signaling in mosquito anautogeny. Proceedings of the National Academy of Sciences of the United States of America. 101, 10626-10631 (2004).
- Hansen, I. A., Attardo, G. M., Roy, S. G., Raikhel, A. S. Target of rapamycin-dependent activation of S6 kinase is a central step in the transduction of nutritional signals during egg development in a mosquito. The Journal of biological chemistry. 280, 20565-20572 (2005).
- Pannabecker, T. Physiology of the Malpighian Tubule. Annual review of entomology. 40, 493-510 (1995).
- Dow, J. New insights into Malpighian tubule function from functional genomics. Comp Biochem Phys A. 150, S135 (2008).
- Dow, J. A. T. Insights into the Malpighian tubule from functional genomics. Journal of Experimental Biology. 212, 435-445 (2009).
- Lawson, D., et al. VectorBase: a data resource for invertebrate vector genomics. Nucleic acids research. 37, 583-587 (2009).
- Beyenbach, K. W. Transport mechanisms of diuresis in Malpighian tubules of insects. J. Exp. Biol. 206 (Pt 21), 3845-3856 (2003).
- Coast, G. M. Continuous recording of excretory water loss from Musca domestica using a flow-through humidity meter: hormonal control of diuresis. Journal of insect physiology. 50, 455-468 (2004).
- Kersch, C. N., Pietrantonio, P. V. Mosquito Aedes aegypti (L.) leucokinin receptor is critical for in vivo fluid excretion post blood feeding. FEBS letters. 585, 3507-3512 (2011).
- Hays, A. R., Raikhel, A. S. A novel protein produced by the vitellogenic fat body and accumulated in mosquito oocytes. Development Genes and Evolution. 199, 114-121 (1990).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。