需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
过敏性气道炎症在肺树突状细胞的成熟和迁移分析
摘要
我们描述了一个战略,以监测肺部树突状细胞的成熟和迁移的卵在卵蛋白引起的过敏性气道炎症的设置。这种策略可以进行修改,以评估肺部树突状细胞的迁移,在感染的设置。
摘要
树突状细胞(DC)的启动适应性免疫应答的抗原特异性T细胞激活的关键球员。区议会是目前在稳定状态下的外围组织,区议会,然而,在抗原刺激的反应,采取抗原,并迅速转移到淋巴结,他们开始对T细胞反应的抗原1,2。此外,区议会也起到了关键作用,在启动自身免疫性以及过敏免疫反应3。
区议会发挥了至关重要的作用,同时启动免疫反应和诱导耐受性肺环境设置4。肺癌环境主要是耐受性,由于置身于广大环境抗原5阵列。然而,在一些人有一个宽容的突破,从而导致过敏和哮喘的感应。在这项研究中,我们描述了一个战略,它可以用来监测气道DC成熟和米格在抗原致敏使用的口粮。气道DC成熟和迁移的测量,允许在气道过敏性炎症免疫反应动力学的评估,并协助随后沿与免疫反应的基本机制的了解程度。
我们的战略是基于对卵清蛋白作为增敏剂的使用。卵清蛋白诱发过敏性哮喘是一种广泛使用的模型,以重现气道嗜酸性粒细胞浸润,肺炎和升高的IgE水平在哮喘6,7。致敏后,小鼠滴鼻交付FITC标记的卵,它允许特定的标签气区议会其中吸收卵的挑战。接下来,使用多个DC特异性标志物,我们可以评估这些区议会的成熟,并采用流式细胞仪还可以评估其迁移到淋巴结。
研究方案
1。致敏的小鼠卵白蛋白
- 准备解决的OVA(V级;西格玛,MO)在无菌PBS在1毫克/毫升的浓度(溶液可存放于-80°C)。
- 为了准备卵明矾的混合物,在管的明矾和卵清蛋白溶液中滴加的方式加入,而在1:1的比例涡旋管。混合搅拌30分钟,混合后马上使用。
- 用1毫升注射器,0.2毫升的混合物注入小鼠腹腔注射2周后再次重复。
2。 FITC标记的卵清蛋白与小鼠鼻内挑战
- 卵明矾第二次注射后7天内,老鼠是准备接受挑战OVA-FITC标记滴鼻。
- 准备的卵-FITC(Sigma公司)的解决方案,使用浓度为1毫克/毫升,分装店在无菌PBS -80°C。
- 无菌纱布放置在50毫升猎鹰管的底部,并在化学ĤOOD,添加到纱布5毫升Aerrane。为了麻醉小鼠,直接进入管约5-10秒的动物。
- 在直立位置,并使用无菌枪头,吸管100微升到老鼠的鼻孔OVA-FITC标记在下拉明智的时尚解决方案,保持麻醉的动物。
- 重复鼻内挑战与未来两天的OVA-FITC标记。
3。从肺部及引流淋巴结的单细胞悬液的制备
- 使用腹腔注射Euthanyl的牺牲小鼠。
- 为了减少巨噬细胞的污染,其中直流分析复杂,进行肺灌洗。到肺灌洗,简要地暴露小鼠气管插管导管和注射器,用5毫米EDTA冷PBS,下呼吸道冲洗3次,以去除细胞从肺泡空间。
- 灌注10毫升的PBS含10 U / ml的剖检可见肺部在通过心脏的右心室,以消除肺血管中的血细胞。执行灌注,直到肺部变白,去除大部分血细胞的指标。消除污染外周血细胞,这一点尤为重要。
- 解剖肺部和删除纵隔淋巴结(MLN),并将其放置在一个单独的盘的淋巴结。 (尽量减少照射到组织,以防止FITC荧光猝灭。)
- 放在培养皿的肺部和百果用剪刀。下一步消化肺部在37°C使用250 U / ml的胶原酶D类(罗氏公司),并添加EDTA(10毫米终浓度)为接下来的5分钟停止胶原酶活性为25分钟
- 通过消化肺细胞过滤100微米的碎片和执行低渗溶解去除红细胞。单细胞悬液,准备区议会进一步分析。
- 为了准备从单细胞悬液,肠系膜淋巴结,T缓解使用胶原酶细针和消化,如上所述,随后通过一个细胞过滤紧张MLN的。
4。直流染色标记,以评估成熟/迁移
- 为了确定在肺部的DC,染色CD11c和CD11b的表现。此外,以评估为成熟,染色CD86和CD80上调,这是作为区议会接受成熟的表现。素CD11c +细胞CD11b + OVA-FITC标记+在MLN的细胞被确认为肺区议会迁移从肺部的响应卵呼吸道挑战的MLN的。
- 暂停浓度在10×10 6细胞/毫升,在流式细胞仪缓冲(PBS 1%FBS和1mM EDTA)和流式细胞仪染色的细胞悬液/管分装150微升的细胞。肺区议会的识别,需要以下的污渍:不染控制(不暴露于OVA-FITC标记的小鼠肺细胞),OVA-FITC标记的控制,CD11c的单一控制,CD11b的单一控制,CD11b的+ CD11c的+双重控制,细胞CD11b + OVA-FITC标记+双控,素CD11c + OVA-FITC标记+双控,MHC II类单一的控制,CD86的单一控制,CD80的单一控制和样品染色卵-FITC标记+素CD11c +细胞CD11b + MHCII +卵-FITC标记+ CD11c的细胞CD11b + CD86的+和卵-FITC标记+素CD11c +细胞CD11b + CD80 +。
- 为了评估DC的迁移,执行从MLN的单细胞悬液绝对细胞计数,并随后准备以下管:不染控制(MLN的细胞不暴露于OVA-FITC标记的小鼠),OVA-FITC标记的控制,素CD11c +单一的控制,细胞CD11b +双重控制,细胞CD11b + OVA-FITC标记+双控制,素CD11c + OVA-FITC标记+双控制和素CD11c +细胞CD11b + OVA-FITC标记+样本。
5。代表结果
腹腔致敏诱发呼吸道过敏性炎症的时间点很重要,应进行如图1所示。小鼠腹腔致敏和呼吸道卵的挑战后,确认诱导的气道过敏性炎症,有的可以牺牲和组织学分析,可进行肺段, 如图2所示。炎性细胞的存在可以证实苏木精和曙红染色( 图2A)和粘液生产的存在,可以通过定期酸希夫染色( 图2B)进行评估。总之,这将确认后诱导的气道过敏性炎症8 OVA致敏小鼠卵挑战。相比之下,生理盐水治疗小鼠的肺部分预计将随着没有任何粘液生产无任何炎症。此外,以下卵的挑战,肺区议会unde的RGO成熟和随后迁移到淋巴结。预计的CD11c +细胞在小鼠以OVA致敏和挑战,从纵隔淋巴结(MLN)进行分析,显示出较高的CD11c +细胞的比例相比,生理盐水治疗的老鼠( 图3A)。此外,+ OVA-FITC标记+ OVA致敏和小鼠肠系膜淋巴结细胞的CD11c + CD11b的绝对细胞计数分析,预计显示显着升高(即高出数倍)计数,生理盐水治疗小鼠(同行图3B)。
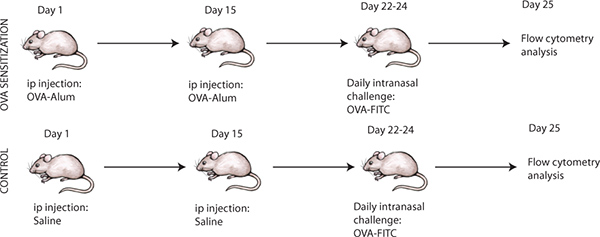
图1。诱导卵白蛋白(OVA)诱导小鼠过敏性气道炎症,随着呼吸道挑战与FITC标记的卵清蛋白(OVA-FITC标记)的实验协议。
fig2.jpg“/>
图2。致敏卵呼吸道挑战导致呼吸道过敏性炎症,苏木精和曙红染色显示肺段(一)确定感应,也导致呼吸道粘液,碘酸希夫肺的染色确定的生产(二)所示的部分。

图3。OVA-FITC标记的挑战诱导DC的迁移从肺部纵隔淋巴结(MLN)。 (一)流式细胞仪图描绘在控制或OVA致敏小鼠肠系膜淋巴结的CD11c +细胞的比例。 (二)素CD11c +细胞CD11b + OVA-FITC标记的生理盐水或OVA致敏小鼠肠系膜淋巴结+细胞绝对计数。 * P <0.05。 点击这里查看大图 。
Access restricted. Please log in or start a trial to view this content.
讨论
这里介绍的方法提供了一个流式细胞仪分析肺区议会,上呼吸道挑战OVA-FITC标记的交付为基础的基础的做法。这允许选择性的肺区议会,占用OVA-FITC标记,因此直流人口,这是监测在OVA诱发的过敏性气道炎症过程,在呼吸道的免疫反应参与的有效的监测。在对照组,在过敏性气道炎症的情况下,的洄游区议会号码(卵-FITC标记+区议会)的肠系膜淋巴结中确定的指示直流迁移,基础利率而过敏性气道...
Access restricted. Please log in or start a trial to view this content.
披露声明
没有利益冲突的声明。
致谢
这项工作是由CIHR和CF加拿大赠款博士吉姆胡锦涛和加拿大的CF拉胡尔Kushwah授予博士学位奖学金。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| 试剂名称 | 公司 | 目录编号 | |
| 卵清蛋白 | Sigma-Aldrich公司 | A5503 | |
| 明矾 | Thermo Scientific的 | 77161 | |
| OVA-FITC标记 | Sigma-Aldrich公司 | A9771 | |
| 胶原酶ð | 罗氏公司 | 11088858001 | |
| 抗体 | E-生物科学 |
参考文献
- Kushwah, R., Hu, J. Role of dendritic cells in the induction of regulatory T cells. Cell Biosci. 20, (2011).
- Kushwah, R., Hu, J. Complexity of dendritic cell subsets and their function in the host immune system. Immunology. 133, 409-419 (2011).
- Lambrecht, B. N., Hammad, H. Taking our breath away: dendritic cells in the pathogenesis of asthma. Nat Rev Immunol. 3, 994-1003 (2003).
- Hammad, H., Lambrecht, B. N. Dendritic cells and epithelial cells: linking innate and adaptive immunity in asthma. Nat. Rev. Immunol. 8, 193-204 (2008).
- Lloyd, C. M., Murdoch, J. R. Tolerizing allergic responses in the lung. Mucosal. Immunol. 3, 334-344 (2010).
- Herz, U. The relevance of murine animal models to study the development of allergic bronchial asthma. Immunol. Cell Biol. 74, 209-217 (1038).
- Herz, U., Lumpp, U., Daser, A., Gelfand, E. W., Renz, H. Murine animal models to study the central role of T cells in immediate-type hypersensitivity responses. Adv. Exp. Med. Biol. 409, 25-32 (1996).
- Nakae, S. TNF can contribute to multiple features of ovalbumin-induced allergic inflammation of the airways in mice. J. Allergy Clin. Immunol. 119, 680-686 (2007).
- Guth, A. M. Lung environment determines unique phenotype of alveolar macrophages. Am. J. Physiol. Lung Cell Mol. Physiol. 296, L936-L946 (2009).
- Kushwah, R., Cao, H., Hu, J. Characterization of pulmonary T cell response to helper-dependent adenoviral vectors following intranasal delivery. J. Immunol. 180, 4098-4108 (2008).
- Kushwah, R., Oliver, J. R., Zhang, J., Siminovitch, K. A., Hu, J. Apoptotic dendritic cells induce tolerance in mice through suppression of dendritic cell maturation and induction of antigen-specific regulatory T cells. J. Immunol. 183, 7104-7118 (2009).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。