Method Article
外用转基因大鼠通过代
摘要
基因可以在E16 在子宫内的电穿孔(IUE)的皮质或大鼠的海马通过的开发过程中进行操作,以使在神经元的连接的快速和有针对性的修改对于成年动物的行为或神经病理学的后来的研究。产后体内成像为IUE成功的控制是通过激活共转染的荧光素酶的生物发光进行的。
摘要
在子宫内的电穿孔(IUE)是一种技术,它允许细胞的遗传修饰在大脑中用于调查神经元发育。到目前为止,使用IUE的调查在成人大脑行为或神经病理学已由方法监测IUE转染成功通过在出生后的动物的非侵入性技术不足的限制。
对于本研究中,E16大鼠用于IUE。脑室注射的核酸导入胚胎后,将镊子电极的定位是用于确定目标的显影皮质或海马的关键。
心室共注射和转染细胞的荧光素酶基因允许监测产后后腹膜内注射荧光素在麻醉活P7小狗通过体内生物发光,用IVIS光谱装置与三维量化软件的电穿孔。 DISC1基因到大鼠皮质导致苯丙胺超敏反应。可以在神经元验尸荧光显微镜检测冰冻切片显示在出生后≥6个月基因表达共转染绿色荧光蛋白。
我们的结论是出生后的生物发光成像能够评估瞬时转染与IUE大鼠的成功。对局部基因操作过程中neurodevelopmen的影响调查t关于成人的大脑,其连通性都大大促进。对于许多科学问题,这种技术可以补充甚至代替了利用转基因大鼠,并提供了一种新的技术,行为神经科学。
引言
该在子宫内电(IUE)方法,它允许基因表达的调节在发育中的大脑的发展,一直是一个突破,因为它使研究神经发育相对容易。1-7变化的靶基因的表达水平在啮齿类动物胚胎和/或围产期发育过程中一个特定的大脑区域进行了论证,审慎影响神经细胞的增殖,迁移,树枝状和连接。8-10
精神分裂症是一种复杂的精神疾病与已经涉及到神经发育异常的11,12,因此,许多所确定的候选基因用于治疗精神分裂症进行了研究,以神经发育潜力的调制效果,如例如用于急性和慢性症状的破坏,在精神分裂症-1(DISC1)基因13-15。
大脑发育是品REGULAT由遗传因素及其与环境的相互作用而在产前,产期和出生后发育时期扮演的角色主编。关于各种行为障碍的一个主要遗传危险因素是DISC1 16基因。DISC1拦截导致小鼠13,17迁移缺陷,并操纵在显影皮层由IUE DISC1的表达已被证明影响成年小鼠18的行为。
通过IUE操纵大脑基因表达有几个优点超过19转基因动物纹路的产生。首先,在感兴趣的领域基因表达周内实现到几个月,而不是几代育种转基因啮齿动物系。第二,避免早期发育过程中的补偿机制,可能会屏蔽表型生殖细胞工程的动物20。第三,通过仅针对特定的细胞群,或大脑的特定区域,migrati或增殖的不同,可以直接与非突变体相比,或控制对侧如果单侧电穿孔被选择。另一方面,IUE没有表达的启动子驱动的CRE / lox位引起的定时,将细胞在一定区域内的唯一对象导致的马赛克样的基因表达模式的一个亚群的准确度。
许多实验性应用在成年啮齿类动物,细胞在大脑区域数目有限的瞬时转染可能是足够的,甚至是所希望的,这样的稳定的,种系的转基因啮齿动物的主要优点是可以忽略的。事实上,IUE是有益的探讨一些异常发达细胞是否会影响细胞或电路的整个网络。另一个优点可能是证明一个基因的非细胞自主性的影响,由于命中的镶嵌性质的能力。此外,转基因和基因敲除鼠的产生仍处于起步阶段,使用IUE该物种为研究异常的脑发育影响的是高息。
到目前为止,使用IUE调查这些动物作为成人的干预后果的一个主要障碍是缺乏监测电成功。到目前为止,在不能适当的双目荧光显微镜下或用IVIS光谱的荧光成像检测的活新生大鼠幼崽的GFP共转染的荧光神经元。
为了克服这个障碍,我们共转染的荧光素酶报告基因和由IUE大脑区域的3维(3D)的定量进行幼仔的生物发光实时成像。
作为证明本方法的适用性在稍后的功能测定法测试的神经发育的遗传操作中,共注射含有人DISC1,萤光素酶,绿色荧光蛋白和成鼠胚胎侧脑室质粒的一个例子 3,然后在电用拔毛钳电极进行。而荧光信号不能在产后阶段被检测体内 ,通过共转染的荧光素酶基因来自于萤光素代谢的固体生物发光信号中检测到出生后五个星期。三维测量大脑电穿孔面积允许的量化据此幼仔与不足或放错地方的电是从一开始就确定的,因此,使IUE动物的分配(目的基因和炒控制),以实验组与低变异的匹配电穿孔脑区。使用成人IUE大鼠行为范式被证明是本协议的有效性的一个例子。
研究方案
按照国家和欧洲的立法;所有的动物实验是由负责Landesministerium献给天然色,UMWELT UND Verbraucherschutz(87-51.05.2010.A301 LANUV北威州)的授权。
1, 在子宫内电穿孔
此方法已被详细描述的朱庇特的大鼠由Walantus 等人的 心情 ,以及Rice 等 4,并在这里总结仅简要介绍。 6-8幼崽一窝大小产生一个好的结果。应该有至少两个非电穿孔胚胎以增加整体存活率(见下文)。
- 制备DNA混合物含有1.5微克/微升的目标质粒(shRNA的:载体pENTR-U6; Invitrogen公司,俄勒冈州尤金/ DISC1表达:pCAX 21),0.5微克/微升含有质粒(pCAX),0.5微克/微升GFP的荧光素酶含在1x PBS溶液染色灯蓝光质粒(pCAGGS中22)e为快速绿色染料。
- 准备注射针头出玻璃毛细管用针吸取拔轮器。和手术器械消毒或者通过高压灭菌或孵化与含酒精的消毒剂(克坦Tinktur长处)。
- 辖手术前剂量丁丙诺啡(0.05毫克/千克)的15分钟手术前的孕鼠受精(E16)后16天。然后麻醉动物在异氟醚室。
- 麻醉后,将大鼠在与呼吸面罩连接到麻醉设备37℃温的手术台上仰卧位,用氧设定在0.4升/分钟和异氟醚1.8%。
- 妆腹部后,消毒剃区域三次克坦Tinktur复地(基于醇的消毒剂)。
- 盖上消毒布鼠,只露出剃操作字段。
- 执行在子宫内电穿孔。
- 切开腹部有一个scisso沿着白线 R(〜2个厘米)。
- 用环钳小心地暴露子宫角。
- 照顾与温暖无菌PBS保留子宫壁湿整个手术过程。
- 注入的DNA溶液用细玻璃针插入胚胎的侧脑室中的一个。
- 将7毫米电极周围胚胎的头部。打上部皮质层的细胞群,执行IUE在E16 23和上喷射的心室上面的半球正极有轻微的背/横向定位的倾向。针对海马细胞改变正极放置到相对侧比注入脑室侧稍微背方向( 图1)。
- 由五个50毫秒的脉冲进行电穿孔在55 V与950毫秒打破了方波脉冲电穿孔。
- 饶在每个子宫角的阴道端的第一胚胎以增加吨他的所有胚胎的生存机会。
- 把子宫角放回母鼠。
- 与可吸收薇乔外科缝合材料施蒂希腹壁起来。
- 关闭与薇乔缝合材料或缝合剪辑皮肤。
- 将母鼠放回原笼,并保持它温暖2-3小时。
- 单独持有大鼠在动物设施的房间自己的家笼和饲料自由采食 。他们给E22-24的诞生。
- 保持幼鼠与他们的母亲三个星期和性别之后将它们分开。
2。生物发光Live中的酶荧光素酶反应的成像
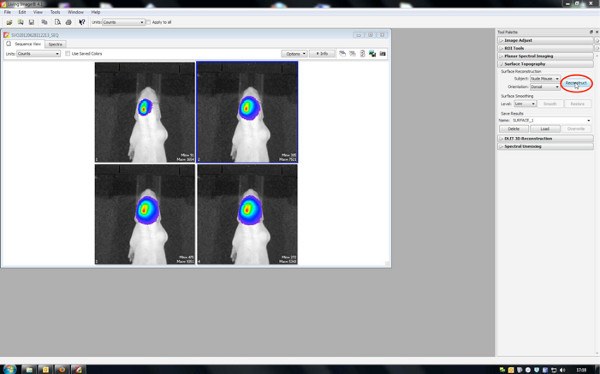
这种方法被用来分析在子宫内的转染细胞中的位置。共电穿孔的萤火虫荧光素酶的cDNA转化为活性的荧光素酶,其在代谢D-荧光素向氧化萤光素,发射一个光子( 图2中 的)。所得到的发光可以在正面电穿孔的幼鼠中的IVIS光谱多达约35天龄的脑中被检测到出生后( 图4)。
在本研究中,进行了萤光素酶测定和生物发光成像开始在P7。这个时间点被选择,让母亲和幼仔从出生应力恢复。当最初的工作与幼崽在P0,幼崽的生存受到严重影响,该幼仔被发现死亡或母亲吃掉。
最初,幼鼠与成功电穿孔是由一个二维的生物发光图像以三分钟的曝光时间。随后,正幼仔被用于以指定电穿孔区的位置产生的三维图像。
- 稀D-荧光素钠盐在PBS中的15毫克/毫升的浓度,并通过无菌注射器过滤器进行过滤杀菌。
- 称取幼崽。
- 带你的小狗,一手在顶部的腹部和伸展腹部轻微。注入10微升/克体重的荧光素溶液腹腔的。对于年龄较大的和更敏捷的人,注射荧光素之前预麻醉与异氟醚在感应室内的幼崽。
- 打开XGI-8气体麻醉系统的IVIS频谱内的异氟醚涌入与3%异氟醚。
- 把动物的口鼻部到麻醉系统的玻璃鼻锥。
- 握住动物俯卧位,直到它在深麻醉(2-3分钟)。然后降低异氟醚涌入到1.5%。
- 选择一个二维生物发光测量,选择从整个窝仔兔阳性。使用以下设置
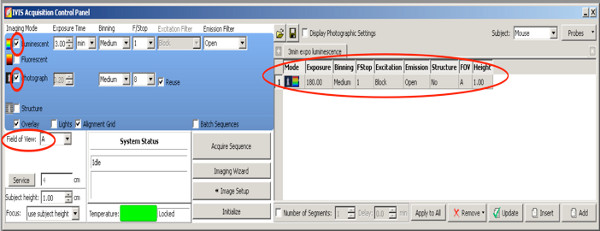
点击这里查看大图 。- 设置CHECkmark照片上中等分级和F /停止8,相机将照片从上面开始测量后。
- 设置激发滤色片:块。
- 设置发射滤光片:开路。
- 设置分级到中等。
- 设置F /停止1。
- 舞台设置水平A
- 发光设置曝光时间为180秒。
- 对于为了更好地从正面幼仔量化电穿孔区域,请使用以下DLIT设置萤火虫荧光素酶的生成3D照片。
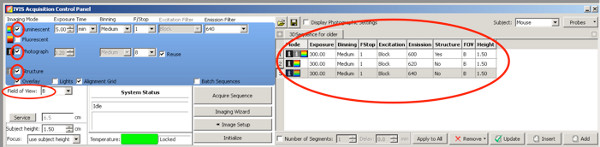
点击这里查看大图 。- 照片上设置一个复选标记;相机拍摄一张照片从上面开始测量后。
- 设置复选标记的结构,在动物的表面由IVIS现有的生物发光测量进行扫描。
- üSE以下排放过滤器和曝光时间设置,直到两个星期的年龄:
发射滤波器1:590纳米,曝光时间300秒
发射滤光片2:600纳米,曝光时间240秒
发射滤波器3:620纳米,曝光时间为180秒
发射滤光片4:640纳米,曝光时间120秒
对于年龄大于P20鼠
发射滤波器1:600纳米,照射时间300秒
发射滤波器2:620纳米,照射时间300秒
发射滤波器3:640纳米,曝光时间300秒
点击这里查看大图 。
由于在中老年动物的信号强度的降低,曝光时间被扩大为三个最佳发射滤波器。 - 设置阶段B级
- 设置分级到中等。
- 设置F /停止1
- 经过测量,擦伤由耳孔代码K老鼠来相互区分他们,并给他们匹配到IVIS实时成像图片
- 在测量过程结束,关闭异氟醚涌入,将其返回到它的笼子前,保持在温暖板老鼠了几分钟。
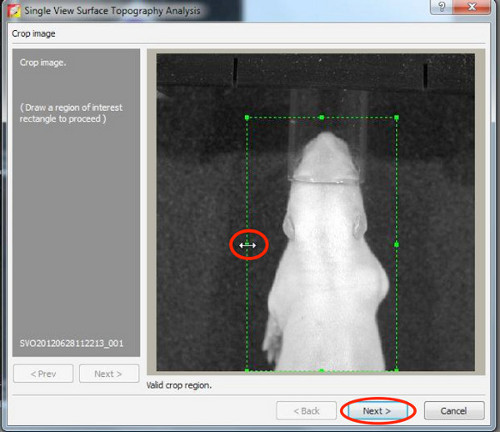
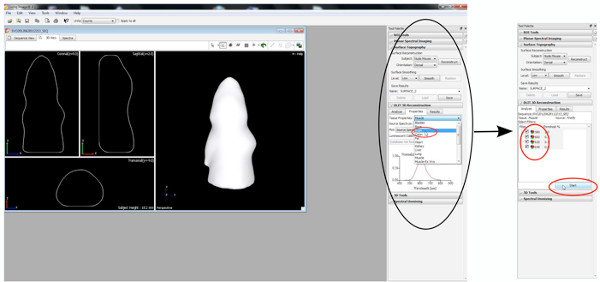
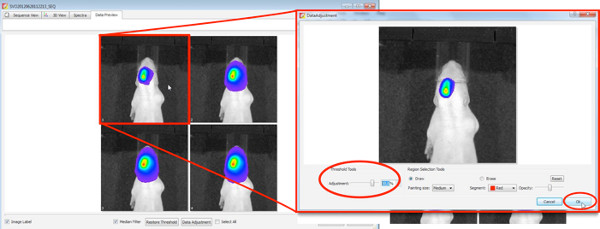
3。生物发光图像分析
3D影像,3D电影和信号源的音量的量化的产生是通过在IVIS频谱预装的生活图像软件制作。
- 3D影像生成
4。行为测试
为了确定在大鼠IUE介导的基因操作是否会发起了持续到成年期的长期影响进行行为测试。在本特定的情况下,瞬间的效果,IUE后单方面全长人DISC1皮质过度表达通过检测的运动在一个开放的字段(OF),有和没有安非他明的低剂量,对于多巴胺相关的一个特定的测试研究行为24。在通过执行类似的过程Niwa 等。在使用DISC1击倒,IUE小鼠,但不IUE小鼠控件显示过敏症安非他明18。
在实验室条件下举行了从早上7点至晚上7时12小时的光,是在子宫内电穿孔与DISC1过表达载体大鼠和自由采食 。在3个月的年龄,大鼠行行为测试。
定量运动作为读出的安非他明的影响,一个开放的场坐落在一个声音和光隔离室的超铀扫描活动系统的使用。该系统测量的持续时间和距离的动物的动作,时间和距离在开阔地的边缘或中心度过的,以及养育行为25。
- 在第一天,生理盐水注射后测试
- 称重动物。
- 腹膜内注射1微升/ g体重的生理盐水溶液(1×PBS)中。
- 正确的注射后,把动物变成开放式的现场,并启动相应TruScan系统的测量。记录15分钟的ð细分数据转换成3×5分钟的部分。
- 把动物放回笼子。
- 第二天,在测试注射安非他明
- 称重动物。
- 腹膜内注射1微升/克体重的0.5毫克/毫升的苯异丙胺溶液。
- 右后喷射将动物放入开放野和启动的TruScan系统的测量。记录15分钟,并细分数据转换成3×5分钟的部分。
- 返回动物的笼子。
- 分析运动并通过具体的Tru扫描软件生成的养育行为。用的GraphPad(棱镜)创建图表并通过SPSS统计软件计算统计。
结果
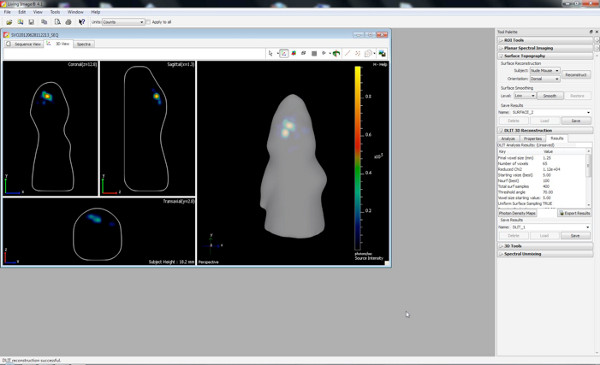
图3显示了住三幼鼠成像测量在P7注射150毫克素/公斤体重后。的信号强度的差异表示在IUE的效率的变化是可见的。强大的生物发光信号记录到P36( 图4)。在图5中 ,通过生物 发光成像来定义皮层( 图5A和5C)和海马( 图5B和5D)电穿孔的能力被描述。生物发光信号( 图7A)与颅骨切除( 图7B)和相应的GFP-电穿孔的细胞在cryosectioned脑( 图8)在P14后其荧光信号的相关性被描绘值得注意的是在图6-8中。,没有检测在活老鼠的荧光信号的任何时间点。
帐篷“> 在体内生物发光成像使不同电穿孔的大脑区域的二维近似的判别( 图5A和5B),其大大的IVIS光谱软件生成三维图像( 图5C和5D)的DLIT方案改善。在所示的例子,前额叶皮层和海马的电穿孔可以进行区分。应当指出,虽然目的是电穿孔海马,对海马皮层躺在背一些祖细胞也可以击中( 图7)。单方面大鼠子宫内电穿孔pCAX载体进入皮层,随后过表达全长人DISC1进行了调查和自发苯丙胺诱发多动症的成年人。大鼠电穿孔pCAX-DISC1是过敏的安非他明的低剂量。这些老鼠显著移动MO再后,安非他明治疗后比生理盐水注射,而对照动物没有( 图10)。
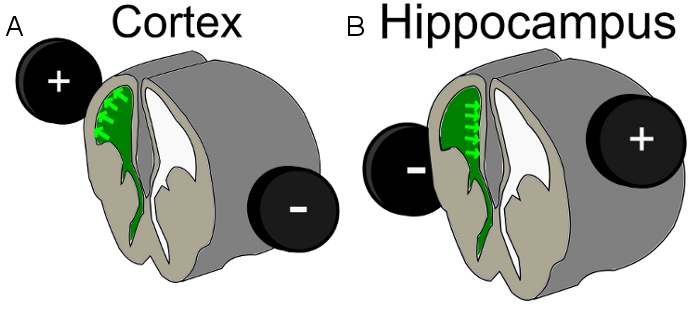
图1。计划电极位置A)皮层电和B)海马电;绿色=注入的DNA混合的心室中。
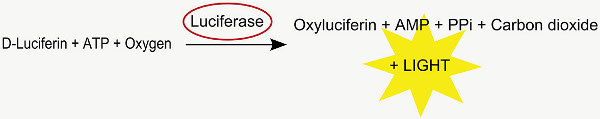
图2。荧光素酶反应。
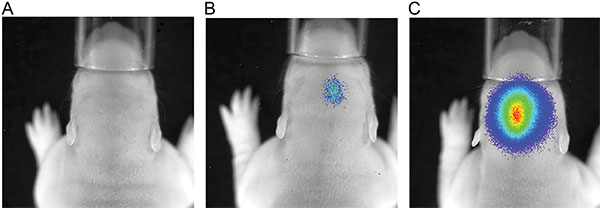
图3。 P7大鼠注射150毫克/公斤体重荧光素后的发光测量,曝光时间为180秒,A)的大鼠没有发光信号,B)鼠用生物发光微弱信号,C)的大鼠具有较强的发光信号。
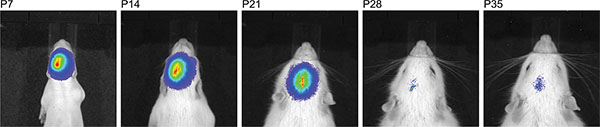
图4。时间线注射150毫克/公斤荧光素展现在那里可以检测IUE成功的一个大的时间窗口后,同一大鼠连续的生物发光测量。
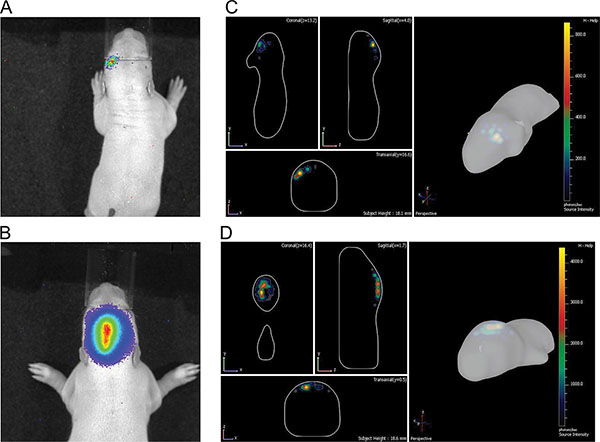
图5插图皮层和海马之间的电在P7 a)和b 2D图像的差别);。从海马B)&D),C)和D)的 3D画面,A)和C)从皮层。files/ftp_upload/50146/50146fig5highres.jpg“>点击这里查看大图。
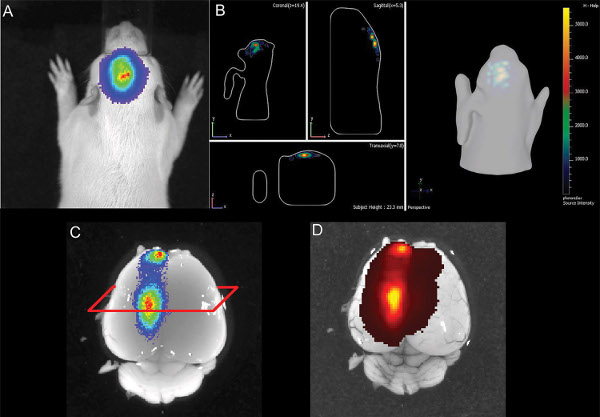
图6。插图大鼠小狗在P14 A的E16海马电)2D画面生物发光的B)三维说明这个生物发光信号C)脑解剖与生物发光信号D)的大脑与GFP落射荧光信号。 点击这里查看大图 。
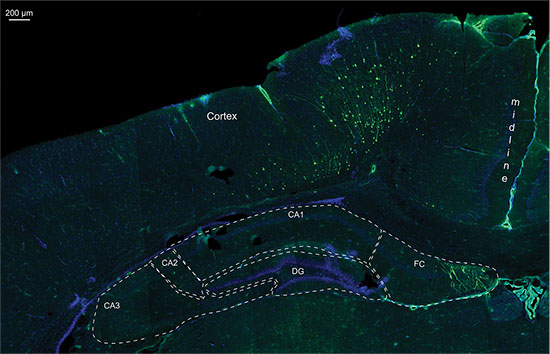
图7。细节从同一P14大鼠脑电穿孔用含有GFP的质粒和萤光素酶的20微米深冷部的荧光图像的矢量,细胞核染色用DAPI,CA1-3 =大角Ammonis 1-3; DG =齿状回; FC = Fasciolarum cinereum。
视频1。一个海马的3D动画电穿孔的大鼠在P14。
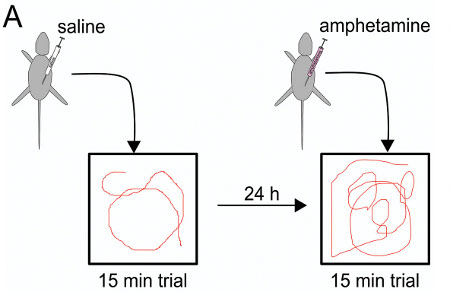
图8。安非他明测试计划:第一天注射生理盐水15分钟前试验,24小时后注射安非他明测试在田野室之前。
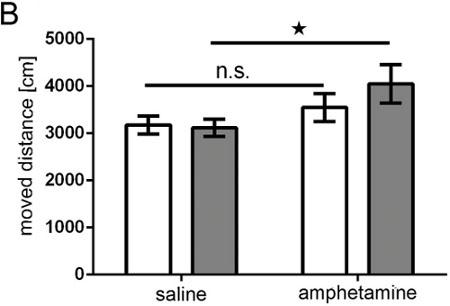
图9。安非他明测试。条形图显示记录的一个TrueScan系统超过15分钟白条=对照组动物的移动距离(厘米);。灰色条= DISC1过表达组,对照组10例; DISC1表达组N = 11;方差分析:基因型*治疗P = 0.043,t检验为总时间的盐水对安非他明ns =不显著PControl则= 0.172,pDISC1 = 0.001。
讨论
我们的研究表明,IUE适合于生成成年大鼠神经元表达的转基因在大脑中的一个选择区域,而且,由于该干预的结果,这些动物显示出指示进行操作的功能行为的改变。在这项研究中,作为一个例子,在大鼠前额叶皮层的一小部分,单方面过度DISC1表现出对安非他明超敏反应( 图9)。
选择大鼠进行电穿孔成功通过体内生物发光成像,有效地控制了IUE细胞转染的固有变异性,被用于产生基团的低个体间变异性购买调查的均匀IUE区域。
在这项研究中,我们无法通过检测新生儿动物的共电GFP诱导荧光的选择从垃圾电穿孔幼仔,甚至寿啊在同一时间和同一动物的平均共电穿孔的荧光素酶的生物发光信号可注射荧光素( 图6)后,进行检测,并表达神经元的GFP仍然存在于大脑在六个月的年龄。我们的结论是,在大鼠中,萤光素酶/萤光素反应是非常适合于区分动物的成功电穿孔的大脑( 图3)。
IUE成功的定量监测涉及的生物发光信号,这是由光子的计数测得的相同的曝光时间( 图3)内,且对应于共表达的荧光素酶的酶活性的强度。小的生物发光信号是可检测的由100-200计数的光子,并且在〜1×10 4光子/秒/ cm 2 /球面度显示1000-2000的GFP染色的细胞在6个月大的大鼠脑组织学的光泽。最高的信号DISP奠定的光辉高达〜5×10 6光子/秒/厘米2 /球面度和〜64,000计数。
中所使用的只SD大鼠品系中,我们观察到的生物发光信号的弱化纵向随着年龄的增加,信号消失超出P35的年龄( 图4)。在这一点上,我们并不知道任何瞬态,质粒载体为基础的荧光素酶的表达是否降低,或者如果生物发光信号减弱时,由于增加脑质量,或者两者都是原因消失的信号。在成年大鼠本功能测定法,基于所述信号的位置被仅仅作出行为研究的选择,而不是由生物发光信号的强度。
尽管三维定量生物发光监控允许不同地区的电穿孔( 图5)之间的差异,其准确性是为细胞位于深度毛钱限制大脑nsion, 图6示出了海马电穿孔,其中在2D和3D图象的生物发光测量所指示的电穿孔的良好定位的一个示例。在解剖验尸脑,GFP的荧光信号在检测到大约相同的位置上的生物发光信号,表明海马正确定位。但组织学表明,还细胞在海马皮层背侧被靶向( 图7)。这表明生物发光法是一种有用的工具来检测阳性,IUE幼崽,又要有电穿孔区域的想法,但最终成像不能代替验尸组织学,积极靶细胞准确地定位。
我们的演示表明承诺为IUE技术的应用产生的皮质或海马脑区的微妙针对性的操作,以模拟在C aberrancesortical迁移或其他神经发育缺陷,可能影响成年动物。而双边电穿孔26具有对行为可能更大的效果的优点,也有胚的更死亡率。单侧电被选为为了两个半球有一个作为内部控制,以及用于比较显示,在一个单边,小区域甚至IUE操纵足以改变人们的行为。 IUE引起的变化在神经元之间的连接性或体系结构可因此没有唤起的病变和所需的要被IUE操纵的区域的匹配与适当的行为测试被诱导依赖于科学问题。
故障排除
降低产仔数有关于提高IUE幼崽的生存几点建议。首先,为了尽量减少组织lesio电穿孔过程中的使用非常薄的玻璃毛细管n为推荐。第二,不要电穿孔第一胚胎在每个角子宫的阴道底:第一个出生的胚胎死亡增加了其他所有的胚胎中止的机会。三,出生后,母鼠往往杀死他们的后代的部分原因是由于围生期的压力。为了减少额外的压力,不与出生后右实时成像启动,但等待了七天。
GFP的荧光检测的幼崽
在出生后一周,荧光任何一方根据实时双目荧光显微成像和荧光成像与IVIS频谱无信号(落射荧光和transfluorescence模式; GFP的激发/发射:五百二十○分之四百六十五nm和540分之500纳米)。这是可能的,这两个,通过像皮肤的颅骨和高的自体荧光背景组织的有限传输的短波长的激发和发射光防止使用递减下荧光ribed条件的大鼠。 如图6所示,在活的动物中的荧光素酶信号也可在解剖脑(无头盖骨)检测,并在那里,也荧光信号是可检测的( 图6D)。
生物发光的间隔紧密的大脑区域分化
即使在3D图中的生物发光区的位置不能预测到100%。尤其是细胞上的或比预测的区域的上方,也可以偶然地靶向和转染。确切的位置必须由验尸(荧光)组织学进行控制( 见图7)。
披露声明
这项研究的作者没有经济利益在这项研究中,并未赞助行业研究。开放获取费用由珀金埃尔默公司出版后的贡献。
致谢
作者感谢特雷西年轻,皮尔斯和神谷笃提供质粒。
这项工作是由神经元ERANET发现为OR和CK(BMBF 01EW1003),东风集团(柯1679/3-1; GRK1033)到CK,和(DE 792/2-4)大规模
材料
| Name | Company | Catalog Number | Comments | ||||||||||||||||||||||||||||
| Reagent name | |||||||||||||||||||||||||||||||
| Dulbecco's Phosphate-Buffered Saline (PBS) | Invitrogen | 14190-250 | without calcium, without magnesium | ||||||||||||||||||||||||||||
| D-luciferin, sodium salt | SynChem OHG, Germany | BC218 | CAS number: 103404-75-7 substrate for firefly-luciferase | ||||||||||||||||||||||||||||
| Fast Green FCF | Sigma Aldrich, USA | F7258-25G | CAS: 2353-45-9 | ||||||||||||||||||||||||||||
| D-Amphetamine | Sigma Aldrich, USA | A 5880 | CAS: 51-63-8 | ||||||||||||||||||||||||||||
| kodan Tinktur forte | Schülke Mayr GmbH, Germany | 104 005 | |||||||||||||||||||||||||||||
| Material / product | |||||||||||||||||||||||||||||||
| Glass capillaries | Sutter Instrument | Novato, California, USA | borosilicate glass O.D.:1 mm, I.D.: 0.78 mm | ||||||||||||||||||||||||||||
| Needle Pipette Puller | David Kopf Instruments | Tujunga, California, USA | |||||||||||||||||||||||||||||
| Tweezer electrode | Nepa Gene CO., LTD. | Shioyaki, Ichikawa, Chiba, Japan | 7 mm in diameter platinum disc electrodes (CUY650P7) | ||||||||||||||||||||||||||||
| Surgical Scissors - sharp | Fine Science Tools | Heidelberg, Germany | Straight, 12 cm (14002-12) | ||||||||||||||||||||||||||||
| Ring Forceps | Fine Science Tools | Heidelberg, Germany | 2.2 mm ID, 3 mm OD (11021-12) | ||||||||||||||||||||||||||||
| Square wave pulse electroporator (CUY21SC) | Nepa Gene CO., LTD. | Shioyaki, Ichikawa, Chiba, Japan | (CUY21SC) | ||||||||||||||||||||||||||||
| Vicryl surgical suture material | Ethicon | Norderstedt, Germany | 3-0; 2 Ph. Eur; | ||||||||||||||||||||||||||||
| Wound Clip Applicator | Fine Science Tools | Heidelberg, Germany | Reflex 9 mm (12032-09) | ||||||||||||||||||||||||||||
| Syringe filter | VWR | Darmstadt, Germany | 0.45 μm cellulose acetate | ||||||||||||||||||||||||||||
| IVIS Spectrum | Caliper Life Science / PerkinElmer | Waltham, MassachusettsUSA | |||||||||||||||||||||||||||||
| XGI-8 Gas Anesthesia System | PerkinElmer | Waltham, Massachuset tsUSA | |||||||||||||||||||||||||||||
| Open-field | Coulbourn Instruments | Allentown, USA | (40 x 40 x 39 cm) | ||||||||||||||||||||||||||||
| Tru Scan activity system | Coulbourn Instruments | Allentown, USA | |||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
参考文献
- Saito, T., Nakatsuji, N. Efficient gene transfer into the embryonic mouse brain using in vivo electroporation. Developmental Biology. 240, 237-246 (2001).
- Fukuchi-Shimogori, T., Grove, E. A. Neocortex patterning by the secreted signaling molecule FGF8. Science. 294, 1071-1074 (2001).
- Walantus, W., Elias, L., Kriegstein, A. In Utero Intraventricular Injection and Electroporation of E16 Rat Embryos. J. Vis. Exp. (6), e236 (2007).
- Rice, H., Suth, S., Cavanaugh, W., Bai, J., Young-Pearse, T. L. In utero Electroporation followed by Primary Neuronal Culture for Studying Gene Function in Subset of Cortical Neurons. J. Vis. Exp. (44), e2103 (2010).
- Takahashi, M. Manipulating gene expressions by electroporation in the developing brain of mammalian embryos. Differentiation. 70, 155 (2002).
- Tabata, H., Nakajima, K. Efficient in utero gene transfer system to the developing mouse brain using electroporation: visualization of neuronal migration in the developing cortex. Neuroscience. 103, 865-872 (2001).
- Nakahira, E., Yuasa, S. Neuronal generation, migration, and differentiation in the mouse hippocampal primoridium as revealed by enhanced green fluorescent protein gene transfer by means of in utero electroporation. J Comp Neurol. 483, 329-340 (2005).
- Young-Pearse, T. L., et al. A critical function for beta-amyloid precursor protein in neuronal migration revealed by in utero RNA interference. The Journal of Neuroscience : the Official Journal of the Society for Neuroscience. 27, 14459-14469 (2007).
- Niwa, M., et al. Knockdown of DISC1 by in utero gene transfer disturbs postnatal dopaminergic maturation in the frontal cortex and leads to adult behavioral deficits. Neuron. 65, 480-489 (2010).
- Sapir, T., et al. Accurate balance of the polarity kinase MARK2/Par-1 is required for proper cortical neuronal migration. The Journal of Neuroscience : the Official Journal of the Society for Neuroscience. 28, 5710-5720 (2008).
- Weinberger, D. R. From neuropathology to neurodevelopment. Lancet. 346, 552-557 (1995).
- Murray, R. M., Lewis, S. W. Is schizophrenia a neurodevelopmental disorder?. British Medical Journal. 295, 681-682 (1987).
- Kamiya, A., et al. A schizophrenia-associated mutation of DISC1 perturbs cerebral cortex development. Nat Cell Biol. 7, 1167-1178 (2005).
- Miyoshi, K., et al. Disrupted-In-Schizophrenia 1, a candidate gene for schizophrenia, participates in neurite outgrowth. Mol Psychiatry. 8, 685-694 (2003).
- Mao, Y., et al. Disrupted in schizophrenia 1 regulates neuronal progenitor proliferation via modulation of GSK3beta/beta-catenin signaling. Cell. 136, 1017-1031 (2009).
- Millar, J. K., et al. Disruption of two novel genes by a translocation co-segregating with schizophrenia. Hum Mol Genet. 9, 1415-1423 (2000).
- Steinecke, A., Gampe, C., Valkova, C., Kaether, C., Bolz, J. Disrupted-in-Schizophrenia 1 (DISC1) is necessary for the correct migration of cortical interneurons. The Journal of Neuroscience : the Official Journal of the Society for Neuroscience. 32, 738-745 (2012).
- Niwa, M., et al. Knockdown of DISC1 by in utero gene transfer disturbs postnatal dopaminergic maturation in the frontal cortex and leads to adult behavioral deficits. Neuron. 65, 480-489 (2010).
- Taniguchi, Y., Young-Pearse, T., Sawa, A., Kamiya, A. In utero electroporation as a tool for genetic manipulation in vivo to study psychiatric disorders: from genes to circuits and behaviors. The Neuroscientist : a Review Journal Bringing Neurobiology, Neurology and Psychiatry 18. , 169-179 (2012).
- Bai, J., et al. RNAi reveals doublecortin is required for radial migration in rat neocortex. Nat Neurosci. 6, 1277-1283 (2003).
- Osumi, N., Inoue, T. Gene transfer into cultured mammalian embryos by electroporation. Methods. 24, 35-42 (2001).
- Momose, T., et al. Efficient targeting of gene expression in chick embryos by microelectroporation. Development, Growth & Differentiation. 41, 335-344 (1999).
- LoTurco, J., Manent, J. B., Sidiqi, F. New and improved tools for in utero electroporation studies of developing cerebral cortex. Cereb Cortex. 19, 120-125 (2009).
- Featherstone, R. E., Kapur, S., Fletcher, P. J. The amphetamine-induced sensitized state as a model of schizophrenia. Progress in Neuro-psychopharmacology & Biological Psychiatry. 31, 1556-1571 (2007).
- Pum, M., Carey, R. J., Huston, J. P., Muller, C. P. Dissociating effects of cocaine and d-amphetamine on dopamine and serotonin in the perirhinal, entorhinal, and prefrontal cortex of freely moving rats. Psychopharmacology. 193, 375-390 (2007).
- dal Maschio, M., et al. High-performance and site-directed in utero electroporation by a triple-electrode probe. Nature Communications. 3, 960 (2012).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。