Method Article
自动化芯片起实验产生上万HeLa细胞表观遗传配置文件
摘要
Methods for mapping in vivo protein-DNA interactions are becoming crucial for every aspect of genomic research but they are laborious, costly, and time consuming. Here a commercially available robotic liquid handling system that automates chromatin immunoprecipitation for mapping in vivo protein-DNA interactions with limited amounts of cells is presented.
摘要
Chromatin immunoprecipitation followed by next generation sequencing (ChIP-seq) is a technique of choice for studying protein-DNA interactions. ChIP-seq has been used for mapping protein-DNA interactions and allocating histones modifications. The procedure is tedious and time consuming, and one of the major limitations is the requirement for high amounts of starting material, usually millions of cells. Automation of chromatin immunoprecipitation assays is possible when the procedure is based on the use of magnetic beads. Successful automated protocols of chromatin immunoprecipitation and library preparation have been specifically designed on a commercially available robotic liquid handling system dedicated mainly to automate epigenetic assays. First, validation of automated ChIP-seq assays using antibodies directed against various histone modifications was shown, followed by optimization of the automated protocols to perform chromatin immunoprecipitation and library preparation starting with low cell numbers. The goal of these experiments is to provide a valuable tool for future epigenetic analysis of specific cell types, sub-populations, and biopsy samples.
引言
随着新一代测序(NGS)技术已经成为普遍和更容易获得,蛋白质-DNA相互作用现在染色质免疫沉淀之后NGS检测(芯片起),使转录因子的发现的全基因组映射的主要方法结合的组蛋白修饰位点或图案。芯片起是提供能够由富集的DNA片段的测量被用于蛋白-DNA相互作用的定量和定性分析整个基因组的高吞吐量数据是有利的。但是,也有在标准芯片起实验一些缺点,例如在获得足够的材料,以创建一个测序文库的难度。
芯片实验分为六个基本步骤包括:1)的交联蛋白质的DNA结合区2)的样品制备,其包括细胞裂解和剪切染色质通过超声处理,3)形成的免疫复合的,4)沉淀免疫复合物,5)洗涤免疫复合的,和富集的材料和分析通过qPCR和NGS 6)洗脱。
一个ChIP实验的成功取决于三个主要因素:一个好的染色质制剂,抗原的原始样品中的量,并且特异性和亲和力的抗体对其关联抗原。一个主要的限制是对高量的,以便获得足够的富集的DNA,以创建一个测序文库起始细胞数量的要求。对于谁与有限的样本数量,如活检标本或细胞亚群工作的科学家,芯片起实验是非常具有挑战性的。最近的研究已经表明,芯片起测定法能够进行与低量电池1,2的工作的时候。Diagenode开发了机器人液体处理系统与细胞数目有限的开始时,可以完全自动化芯片起实验。
自动化提供许多优势的ChIP-SEQ样品手工编制,因为它减少人为错误,降低了变异,降低实验成本。用于染色质免疫沉淀和库制备半自动化协议已被报道,但这些研究都没有一直使用低细胞数3,4,5,6时所显示的数据。
在本文中一个完整的自动化工作流描述了用于在使用磁性珠为基础的技术,并能解决在协议优化多个参数的机器人液体处理系统既染色质免疫沉淀和库制剂测定。这里,自动芯片起实验已经成功完成对细胞数目有限的具有简化,标准化,并提供了可靠的解决方案,以研究在小细胞群体的后生型材的目标。本文描述的自动化贴片协议已使用特定的组蛋白抗体和试剂B进行了优化HeLa细胞旦是工作流可以适合于其它细胞系和抗体与相应的实验优化。
研究方案
1.标准芯片实验
- 细胞收集和DNA-蛋白质交联。
- 生长的HeLa-S3细胞的80%-90%汇合。除去培养基,用10ml 1×磷酸盐缓冲盐水(PBS)的洗碟两次,并添加胰蛋白酶-EDTA(1×)的培养板上。孵育最多2分钟,从培养皿分离细胞。收集细胞,并用10ml PBS洗涤两次。
注意:较长的培育时间会导致细胞损伤。 - 离心细胞5分钟,在500×g离心和重悬细胞于20ml PBS中。继续执行计数细胞。
- 离心细胞5分钟,在500×g离心,弃上清,加入500微升PBS中。细胞的固定步骤的最佳数量是每500微升PBS千万细胞。
- 添加13.5微升新鲜37%甲醛为500微升细胞悬浮液的各等分试样。固定的细胞在室温下8分钟。
- 添加57微升1.25M的甘氨酸SOLUT离子停止固定。孵育5分钟,在RT下持续混合通过温和涡旋。从这时开始上冰工作。
- 离心细胞,在500×g离心5分钟,在4℃并弃去上清液而不扰乱细胞沉淀。
- 用1毫升的PBS洗涤细胞两次。轻轻倒掉上清,保持细胞沉淀上冰。
- 生长的HeLa-S3细胞的80%-90%汇合。除去培养基,用10ml 1×磷酸盐缓冲盐水(PBS)的洗碟两次,并添加胰蛋白酶-EDTA(1×)的培养板上。孵育最多2分钟,从培养皿分离细胞。收集细胞,并用10ml PBS洗涤两次。
- 细胞裂解和染色质剪切
- 加入10毫升冰冷的裂解缓冲液IL1至细胞沉淀(1毫升每1百万细胞裂解缓冲液是最优比)。移液器上下几次并孵育10分钟,在4℃下温和混合。
- 离心裂解物5分钟,在500×g离心并4℃。弃去上清液。
- 加入10毫升冰冷的裂解缓冲液IL2的裂解物,并通过上下吹打轻轻混匀。孵育裂解物10分钟,在4℃下。
- 离心5分钟,在500×g离心,4℃,弃上清。
- 准备相再完全剪切缓冲器添加200X蛋白酶抑制剂混合物(PIC),该IS1剪切缓冲区。保持5分钟,在冰上的缓冲和事后在冰上工作。加入1毫升的完全IS1剪切缓冲器的每10万个细胞的颗粒和通过上下吹打轻轻混匀。在超声处理之前在冰上孵育样品10分钟,以降低样品的粘度。
- 使用水浴超声波仪为2至3组,每组10个循环剪切染色质的300微升等份通过超声处理。甲周期包括30秒"开"和在高功率设定30秒"关"。另外,使用一个皮超声处理装置用的30秒"开",30秒"关"5至10个周期较短的超声处理时间。简要涡和自旋的运行之间的管子。当使用其他类型的sonicators,请按照相应的制造商的说明染色质剪切。
- 离心剪切染色质在16000×g离心10分钟,和collect要在IP步骤立即使用上清液。可替代地,存储所述染色质在-80℃下长达2个月以供将来使用。
- 分析染色质剪切效率,使用前1-1.5%TAE琼脂糖凝胶或bionalyzer免疫一步。最佳的染色质片段大小范围100-600基点之间。
2.低Cell芯片实验
- 细胞收集和DNA-蛋白质交联
- 生长的HeLa-S3细胞的80%-90%汇合。除去培养基,用10ml 1×磷酸盐缓冲盐水(PBS)的洗碟两次,并添加1×胰蛋白酶-EDTA到培养板上。孵育最多2分钟,从培养皿分离细胞。
注意:较长的培育时间会导致细胞损伤。 - 通过加入含有血清入1毫升离心管1毫升培养培养基收集细胞。计数细胞。
- 在500离心细胞5分钟×g下。使细胞数量到每毫升培养基中的固定的10,000个细胞。
- 加入27微升的36.5%新鲜准备甲醛到每个管固定。倒置该管两次或三次,并培育10分钟,在RT。
- 添加115微升1.25M的甘氨酸溶液于样品,颠倒试管两次或三次,并孵育5分钟,在室温。从这时开始上冰工作。
- 离心细胞,在300×g离心在4℃下10分钟。弃去上清液缓慢。
- 用1ml冰冷的HBSS事先知情同意(200X,终浓度1×)洗涤细胞。倒置该管两次或三次,在4℃至悬浮细胞和离心机在300×g离心10分钟。轻轻倒掉上清,保持细胞沉淀上冰。
- 生长的HeLa-S3细胞的80%-90%汇合。除去培养基,用10ml 1×磷酸盐缓冲盐水(PBS)的洗碟两次,并添加1×胰蛋白酶-EDTA到培养板上。孵育最多2分钟,从培养皿分离细胞。
- 细胞裂解和染色质剪切
- 加入25微升的完全裂解缓冲液TL1(裂解缓冲液+ TL1 PIC),每10,000个细胞,并手动搅拌该管的底部,以悬浮细胞。在冰上孵育5分钟。
- 加入75微升完整的HBSS(HBSS + PIC)缓冲到含有10,000个细胞每等分。
- 剪切10,000个细胞通过超声处理将100μl等分试样进行5组,每组5周期。甲周期包括30秒"开",并在高功率设定30秒"关"。或者,使用具有5个循环的30秒"开",30秒"关"短超声处理时使用的微微超声处理装置。最佳的染色质片段大小范围100-600基点之间。需要注意的是染色质制剂,细胞类型和不同sonicators需要单独的剪切优化实验。
- 离心机以立即使用在IP步骤的剪切染色质以14000×g离心10分钟以弃去不溶性物质,并收集上清。可替代地,存储所述染色质在-80℃下长达2个月以供将来使用。
- 使用1-1.5%TAE琼脂糖凝胶分析染色质剪切效率前免疫沉淀步骤,或该bionalyzer。用RNase现有治疗样品琼脂糖凝胶分析,以提高剪切的视觉评估。最佳的染色质片段大小范围100-600基点之间。
3.染色质免疫沉淀和图书馆准备
- 对于标准的自动化芯片实验
- 加入120微升的ChIP缓冲H(沉淀缓冲H + PIC)的100微升剪切染色质。用200微升的IP,并保持2微升至20微升作为输入样本。
- 选择在自动化仪表自动化芯片200微升协议。吞吐量的协议为每运行1至16个样品。
- 运行使用自动化的ChIP实验,染色质相当于1-2万个细胞,1-2微克抗H3K79me3的,-H3K27me3,-H3K4me3,-H3K4me2,-H3K9ac,-H3K9 / 14ac,-H3K36me3和的H3K9me3芯片起级兔多克隆抗体。最优的抗体的量取决于在组蛋白修饰和亲和力和规格ificity相应的抗体。
- 使用的非免疫兔IgG等量作为同种型对照抗体。另外,使用无涂层的珠子或特定抗体阻断随着芯片控制。加入20微升的蛋白A包被磁珠每个反应。
- 使用自动组蛋白芯片起试剂盒进行自动化的芯片实验具有抗H3K79me3和-H3K4me2多克隆抗体。使用的理想芯片起试剂盒进行芯片实验具有抗H3K27me3,-H3K4me3,-H3K9ac,-H3K9 / 14ac,-H3K36me3和-H3K9me3。
- 选择自动化贴片协议下的自动化设备实现软件的说明。设置的ChIP实验参数以4小时为抗体涂覆步骤和15小时的免疫沉淀步骤。逆交联步骤发生在自动化仪器在65℃下4小时。
- 净化的自动化系统的反向的交联的DNA。选择AUTomated协议DNA纯化,协议或工具包利用磁珠基于DNA纯化。洗脱在25微升水中的DNA。
- 通过提取免疫沉淀的DNA的10%量化免疫沉淀的DNA。免疫沉淀的DNA量取决于染色质和抗体,细胞类型和目标组蛋白修饰的质量。量化,根据制造商的说明使用试剂盒的DNA中。
- 分析免疫沉淀的DNA使用引物至少1阳性和1个阴性对照的基因组区域的质量通过定量PCR。不用于评估的ChIP富集使用总免疫沉淀的DNA的10%以上。
- 准备定量PCR反应。加入10微升2倍SyberGreen的qPCR预混,1微升引物混合物,1-5微升的免疫沉淀或输入DNA和无菌水至20微升的最终反应体积。在定量PCR方案包括在95℃下初始变性步骤5-10分钟取决于Taq聚合酶的提供者和退火温度应根据所选择的引物进行设置。
- 使用自动化库准备协议与市售的Illumina芯片起文库制备试剂来构建同时使用的ChIP的DNA,以及由相同的染色质制剂中保存输入的DNA的库相兼容。用10-20纳克免疫沉淀DNA从每个抗体库的准备。准备高达每运行16自动库。
- 序库,并根据Illumina公司制造商的说明生成簇。进行一次生物信息学分析(集群过滤,基地通话等 )按照标准Illumina的管道,过滤器和对准读取最新的人类基因组装配(当前版本是GRCh38)与ELAND对齐。使用SICER 7或8 MACS峰值呼叫并执行峰的下游分析瓦特第i荷马9,BEDTools 10或首选软件。
- 对于低格自动化数字芯片实验
- 加入120微升的完整的ChIP缓冲TC1(芯片缓冲TC1 + PIC),以100微升剪切染色质。用200微升的IP,并保持20微升作为输入。
- 选择自动化系统自动化芯片200微升协议。吞吐量的协议为每运行1至16个样品。
- 使用自动化贴片试剂和芯片级的优化抗体上班质低量运行自动芯片起实验。使用染色对应于10,000个细胞和100,000个细胞,0.5微克抗H3K27me3的,0.25微克-H3K4me3,0.1微克-H3K27ac,0.25微克-H3K9me3兔高级芯片起级兔多克隆抗体。最优的抗体的量取决于在组蛋白修饰和相应的抗体的亲和力和特异性。
- 使用非免疫RAB等量位IgG作为同种型对照抗体。另外,使用无涂层的珠子或特定抗体阻断随着芯片控制。加入10微升蛋白A包被的磁珠每个反应。
- 选择自动化贴片协议下的自动化设备实现软件的说明。设置的ChIP实验参数以4小时为抗体涂覆步骤和15小时的免疫沉淀步骤。逆交联步骤发生在自动化仪器在65℃下4小时。
- 净化用离心柱按照生产商的说明,并从6微升在卷洗脱至25微升的水反向的交联的DNA。
- 量化使用市售测定试剂盒的DNA中。分析用引物对阳性和阴性对照区域的qPCR评估芯片质量的结果。
- 使用库制备试剂盒采用优化文库制备试剂制备低DNA全库tities。使用30 PG和PG 300的ChIP的DNA(分别对应1万元以上10细胞的实验)图书馆准备。准备使用自动化协议与文库制备试剂兼容库。自动库准备吞吐量为每运行1至48库。
- 下列的双链DNA模板的末端修复,结扎包含测序引物位点的裂解茎 - 环接头。下列的DNA延伸工序中,扩增与库中的制备试剂盒的协议描述的高保真扩增法的样品。
- 文库扩增后,量化和纯化后的文库制备试剂盒的指导方针的库。需要注意的是大小选择后纯化不是必要的。
- 序库,并根据制造商的说明生成簇。进行一次生物信息学分析(集群过滤,基地通话等 )的立场如下ARD生产管线,过滤器,并对准读取到最新的人类基因组总成(目前的版本是GRCh38)与ELAND 7对准。使用SICER 8或9 MACS峰值呼叫,并以荷马执行峰的下游分析,BEDTools 10,或任何首选软件。

图1.屏幕截图,展示了如何设置自动芯片实验的IP-星紧凑的软件。该软件提供了灵活选择每次运行的样本量,以及变更的关键实验参数(抗体包,IP和洗涤)根据研究人员的需求。自动化过程允许测试并联不同条件( 即 ,不同类型和抗体的量,不同类型和细胞的量,甚至不同吨ypes并在相同的运行磁珠金额。 请点击此处查看该图的放大版本。

图2.屏幕截图显示了如何使用该库套件在自动化系统中设置自动库准备下一代测序软件。 请点击此处查看该图的放大版本。
结果
优化自动化芯片起实验,8个不同的组蛋白标记
为了成功地开发和验证的自动化贴片协议,芯片起级抗体之前在手动芯片起实验验证(数据未显示)被选中。下面的ChIP-SEQ级抗体本研究选择:抗H3K79me3,-H3K27me3,-H3K4me3,-H3K4me2,-H3K9ac,-H3K9 / 14ac,-H3K36me3和-H3K9me3。所有芯片起级抗体的特异性先前由斑点印迹,肽阵列和蛋白质印迹实验证实(数据未示出)。导频码片的qPCR实验随抗体量进行,以确定抗体( 图3)的灵敏度。 qPCR的与至少两个正和两个负控制目标进行了分析,并与正富集超过阴性靶更高型材五倍有资格进行测序EXPER iments。它来执行芯片和芯片起实验剪切染色质的高品质是很重要的。本出版物中所有的芯片实验用新鲜的染色质进行。也有可能冻结固定的细胞在-80℃下,继续进行染色质的制备和剪切在不同的一天。然而,染色质冷冻固定细胞制备行为可能不同从染色质新鲜制备的,因此,声波处理条件,可能需要对每个染色质的制备进行优化。当用不同的细胞类型的工作,可以使用剪切缓冲器具有不同的洗涤剂组合物(SDS)。细胞类型,如在悬浮液中生长初级细胞系或细胞是困难的细胞对剪切和将要求高的SDS浓度(1%),而细胞系,很容易剪切例如HeLa将需要低浓度的SDS(0.1%)中的剪切缓冲区。
res.jpg"/>
图3.验证使用自动化系统芯片级的抗体。芯片具有抗H3K79me3,-H3K27me3,-H3K4me3,-H3K4me2,-H3K9ac,H3K9 / 14ac,执行从剪切染色质-H3K36me3和-H3K9me3兔多克隆抗体百万的HeLa-S3细胞根据不同的组蛋白修饰。用200μl工作体积自动化的ChIP协议在自动化仪器抗体滴定实验中使用。抗体量的1,2,5和10微克每块芯片的实验进行了测试和2微克的IgG用作阴性对照。在每个实验。富集被定量PCR评估。结果显示为%输入(DNA免疫沉淀相比,定量PCR分析后,输入DNA的相对量)。 请点击此处查看该图的放大版本。
验证并确定最优后在自动化系统中使用的芯片级抗体的升量,自动芯片起实验以生成每个组蛋白修饰( 图4)测序型材进行。

通过自动芯片起实验产生的图4组蛋白芯片起轮廓。该图显示了在不同的基因组区域进行的H3K4me3,H3K9ac和H3K9 / 14acH3K4me2 H3K79me3和H3K36me3的芯片起轮廓。 图4A示出了沿完整的X峰分布-chromosome和4B周围的GAPDH基因的75 kb的区域分布4C显示H3K27me3,H3K36me3和H3K4me3的的轮廓周围的MYT1基因的500 kb的区域和4D显示的H3K9me3在200 kb的区域周围ZNF12的分布。large.jpg"目标="_空白">点击此处查看该图的放大版本。
生成用于与基因表达相关的六个不同的组蛋白修饰组蛋白后生型材(H3K4me3的,H3K9ac,H3K9 / 14ac,H3K4me2,H3K79me3和H3K36me3)。 图4A示出了沿X染色体的不同组蛋白标志物芯片起轮廓。在6个不同的组蛋白型材之间观察到高度的峰值相关指示自动化系统的能力,以产生准确和可靠的数据。 图4B,4C和4D示出的峰为不同的组蛋白修饰,在特定的基因组区域的分布。
自动化的染色质免疫沉淀实验下降到200个细胞
细胞可以在芯片实验中使用的最小量依赖于染色质的质量,specificity和抗体和组蛋白修饰或蛋白质研究的丰度的灵敏度。用样品的数量有限和最佳的试剂和不同载波的选择工作的改善了的DNA回收效率,并有助于芯片实验的成功时选择好的芯片起同类抗体是很重要的。为了确定细胞的自动化的ChIP协议可以处理,不同数量的染色质,抗体,和磁性小珠的使用特别优化以批量染色质的低工作的ChIP试剂IP的星自动化系统中进行测试的最小量。
首先,从10,000个细胞染色质如在协议中所述进行超声处理。芯片结果通过定量PCR( 图5A),其示出了具有H3K4me3的抗体在阳性对照区域和可忽略的信号在阴性对照区域显著富集证实。为了便于比较和一致性的证明,additiona设置有H3K27ac,得到的H3K9me3升数据,和H3K27me3抗体,使用10,000个细胞。
进行自动化的ChIP实验,然后以证明所述自动化系统的功能与数量使用相同的H3K4me3的抗体的细胞的低工作。自动化的ChIP表现良好,通过一系列的10 IP反应,重现性和手动的ChIP结果( 图5B)高度可比的证明。手动和自动进行实验和自动化协议益处被认为在还原实验实验变异性( 图5C)。
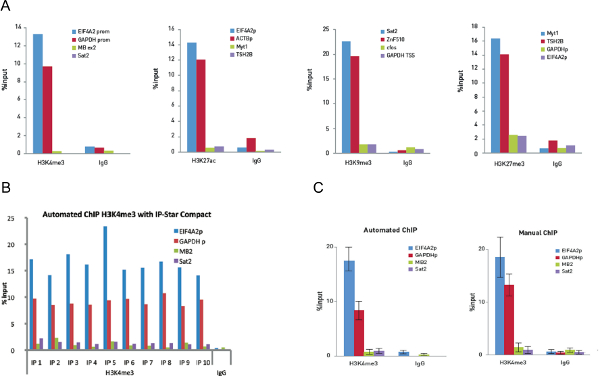
图5.优化对10000个细胞手册的ChIP实验在10,000个细胞进行芯片和汽车芯片实验 ,并用0.25微克的H3K4me3,0.1微克H3K27ac,0.5微克的H3K9me3和0.25微克H3K27me3抗体。相同数量的兔IgG被用作对照。在定量PCR用引物对两个正基因座和两个负基因座的每个ChIP实验进行的。 图5A示出了恢复,表现为输入的百分比(免疫沉淀的DNA相比的qPCR分析后输入的DNA的相对量)。 图5b示出使用0.25微克的H3K4me3多克隆抗体和0.25微克兔IgG作为阴性对照抗体的IP-星紧凑型运行10沉淀反应。然后用引物为阳性的位点EIF4A2启动子和GAPDH TSS和负位点肌红蛋白外显子2和SAT2进行定量PCR分析。该图显示了恢复,表现为输入(免疫沉淀的DNA相比的qPCR分析后的输入DNA的相对量)的百分比。 图5C示出了相比于10自动芯片实验的10手册的ChIP实验H3K4me3的芯片的数据。误差棒表示s每十个重复的TANDARD偏差。 请点击此处查看该图的放大版本。
为了理解的自动化的ChIP协议的敏感性,实验使用细胞从100000下降到200个细胞每个IP范围的量进行。抗H3K27me3抗体被用作它是一种非常普遍的组蛋白修饰。使用其它组蛋白或非蛋白抗体可能需要更多或更少的细胞,这取决于表位的丰度和抗体的质量。该实验通过定量PCR进行验证,并可以观察到通过减少珠和抗体的背景中的实验量被减小,允许成功的ChIP-qPCR的结果与少至200个细胞的抗体( 图6)。
尔斯/ ftp_upload / 52150 / 52150fig6highres.jpg"/>
图6.自动对200个细胞沉淀实验 。宫颈癌-S3细胞和抗体针对H3K27me3。染色质1万个细胞,这染色质(从10万到200细胞当量)的连续稀释每块芯片的反应中使用剪切。 1 H3K27me3微克和10μl的蛋白A包被的磁珠上使用100,000个细胞的实验中,0.5微克H3K27me3和10微升10,000和1,000个细胞珠和0.25微克H3K27me3和5μl的珠粒用500和200细胞。以100,000个细胞,并分别1,000个细胞进行实验时1微克和兔IgG微克0.5用作阴性对照抗体。 图6A示出的TSH2B和GAPDH基因%的占有率超过输入6B表示TSH2B的相对于阴性对照的GAPDH的相对占用基因组区域。
对芯片起效果上下游分析10,000个细胞
为了评估自动化芯片起实验用细胞的低起始数的全局质量,自动芯片起测定法用0.25 10,000 HeLa细胞和芯片实验的H3K4me3的抗体微克上使用了10万的HeLa-S3细胞作为阳性对照实验。自动化图书馆采用适于与DNA低量制备库MicroPlex文库制备试剂盒制备的。需要注意的是,即使它是能够进行成功的自动化芯片实验少于10,000个细胞中,拉下的DNA的量是不够的,以准备使用该试剂盒的试剂库。簇生成和测序根据制造商的说明进行。从低细胞数量芯片样品的测序显示优异成绩后,生物信息学分析。 30皮克数据集(相应的起始材料,以10,000个细胞 )含有低背景噪声和由两个300皮克数据集(对应于100,000个细胞起始材料)和由Broad研究所为将其用作外部参考ENCODE项目产生的H3K4me3的数据集确定高度可靠的富集峰。要注意的前40重叠率数据,这是指在编码11的项目中使用的标准方法,其中,所述芯片起被认为是可再现的,如果比较两个数据集有至少80%的最佳的40%的重叠是很重要的峰由重要性分值排名。相比,无论是300皮克数据集(考虑到其所有的山峰,而不仅仅是最好的40%)和Broad研究所的数据( 表1)30 PG数据集满足这些标准。 300皮克数据集显示了几乎相同的峰Broad研究所的数据有98%的前40名重合度( 图7)。
ighres.jpg"/>
图7.沉淀实验和10,000个细胞芯片起实验库代是使用H3K4me3的抗体(0.25微克/微升)万和10万的HeLa-S3细胞生成。的35 bp的标签被映射到与ELAND对准人类基因组。在随后的峰主叫SICER可以可靠地从低细胞数,以及从数百万个细胞识别的富集。数据集进行分析,并与彼此和由Broad研究所产生的基准数据进行比较。低细胞样本是一致的,并具有很高的相似性。 30 PG样品满足ENCODE标准11(最小80%的峰值的前40%应该重叠)。 请点击此处查看该图的放大版本。
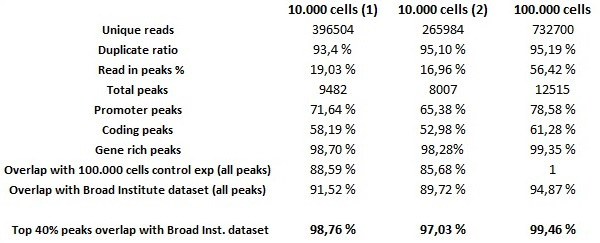
表1中。
讨论
染色质免疫沉淀,随后通过测序现在是一个标准程序。这里一个自动化芯片起协议,可以产生与起始材料的少至10,000个细胞染色质的表观遗传轮廓呈现。
自动化芯片和文库制备试验允许标准化芯片优化程序,减少实验变异。这里介绍的液体处理系统消除了许多带芯片减少了手的时间只有30分钟,相关的手工程序,减少了样品损失,并且能够进行精确的芯片起与库输入短短皮克。为了实现成功的自动化芯片起实验中,它也是重要的使用。在每个实验的系统,高品质剪切染色质制剂与芯片起同类抗体使用磁性珠为基础的技术,并提供了灵活地改变主要实验参数,如温育时间为抗体涂层荷兰国际集团和免疫步骤或洗涤条件允许研究人员进行所有必要的试验芯片,以次优化改造。自动化系统是"开放"的平台,还允许多个并行试剂比较,实验条件为每个单独的细胞系和抗体优化,使各种类型和染色质的浓度,不同的抗体,甚至不同类型的磁性的直接比较珠。
一项所述的自动化系统的局限性是在体积范围从5微升至200微升的自动化的所有协议的需要。但是,该实验的这种自动化平台的小型化也能够节省在试剂成本。
除了在本研究中所述的协议,该系统的适应性,也可以自动多种其他基于磁珠应用,如免疫沉淀一次甲基化DNA(MeDIP和MethylCap技术),hydroxylmethylated脱氧核糖核酸(hMEDIP),连续染色质免疫沉淀(ReChIP),核糖核酸免疫沉淀(RNA-IP),亚硫酸氢盐转化的免疫沉淀和DNA的纯化实验的捕获。
披露声明
The authors of this article, at the time of its writing, are employed by Diagenode S.A. and Diagenode, Inc., the manufacturer of the automated system described.
致谢
This work was supported by the BLUERPINT EU grant (BLUEPRINT – A BLUEPRINT of Haematopoietic Epigenomes). We also thank the Walloon Region (DG06) for its financial support.
材料
| Name | Company | Catalog Number | Comments |
| PBS | Life technologies | 14190-094 | |
| Trypsin-EDTA | Sigma | T3924-100ML | |
| Formaldehyde 37% | Sigma | F8775-25 | |
| 1.25 M Glycine Solution | Diagenode | C01020010 | Component of the ideal ChIP-seq kit |
| Lysis Buffer iL1 | Diagenode | C01020010 | Component of the ideal ChIP-seq kit |
| Lysis Buffer iL2 | Diagenode | C01020010 | Component of the ideal ChIP-seq kit |
| Shearing Buffer iS1 | Diagenode | C01020010 | Component of the ideal ChIP-seq kit |
| Protease Inhibitors Mix (200x) | Diagenode | C01010130 | Component of the Auto True Micro ChIP kit |
| HBSS (no calcium, no magnesium, no phenol red) | Life technologies | 14175-053 | |
| Lysis Buffer tL1 | Diagenode | C01010130 | Component of the Auto True Micro ChIP kit |
| ChIP Buffer tC1 | Diagenode | C01010130 | Component of the Auto True Micro ChIP kit |
| ideal ChIP-seq kit | Diagneode | C01010051 | |
| ChIP-Buffer H | Diagenode | C01010020 | Component of the Auto Histone ChIP-seq kit |
| Auto Histone ChIP-seq kit | Diagenode | C01010020 | |
| Auto True Micro ChIP kit | Diagenode | C01010130 | |
| H3K79me3 polyclonal antibody-Classic | Diagenode | C15310068 | |
| H3K27me3 polyclonal antibody-Classic | Diagenode | C15410069 | |
| H3K4me3 polyclonal antibody-Classic | Diagenode | C15410030 | |
| H3K4me2 polyclonal antibody-Classic | Diagenode | C15410035 | |
| H3K9ac polyclonal antibody-Premium | Diagenode | C15410004 | |
| H3K9/14ac polyclonal antibody-Premium | Diagenode | C15410200 | |
| H3K36me3 polyclonal antibody-Premium | Diagenode | C15410058 | |
| H3K9me3 polyclonal antibody-Premium | Diagenode | C15410193 | |
| Rabbit IgG | Diagenode | C15410206 | |
| Protein-A coated paramagnetic beads | Diagenode | C01010020 | |
| Auto IPure | Diagenode | C03010010 | |
| MicroChIP DiaPure columns | Diagenode | C03040001 | |
| Universal SyberGreenMaster Mix 1.25 ml | Diagenode | DMMLD2D100 | |
| Quant-IT dsDNA | Invitrogen | Q32854 | |
| Illumina Sample Preparation kit fro Genomic DNA | Illumina | FC-121-3001 | |
| Illumina True-seq kit ChIP library Prep kit | Illumina | IP-202-1012 | |
| MicroPlex Library Preparation Kit | Diagenode | C05010010 | |
| Agencourt AMPure XP beads | Beckman Coulter | A63881 | |
| Illumina Library prep Quantification kit | Kapa Biosystems | KK4844 | |
| IP-Star Compact Automated System | Diagenode | B03000002 | |
| Bioruptor Plus | Diagenode | B01020001 | |
| Bioruptor Pico | Diagenode | B01060001 | |
| Qubit system | Invitrogen | Q32857 | |
| Illumina Hiseq systems | Illumina |
参考文献
- Dahl, J. A., Collas, P. A rapid micro chromatin immunoprecipitation assay (microChIP). Nature Protocols. 3, 1032-1045 (2008).
- Adli, M., Bernstein, B. E. Whole-genome chromatin profiling from limited numbers of cells using nano-ChIP-seq. Nature Protocols. 6, 1656-1668 (2011).
- Blecher-Gonen, R., et al. High-throughput chromatin immunoprecipitation for genome-wide mapping of in vivo protein-DNA interactions and epigenomic states. Nature Protocols. 8, 539-554 (2013).
- Aldridge, S., et al. AHT-ChIP-seq: a completely automated robotic protocol for high-throughput chromatin immunoprecipitation. Genome Biology. 14, 124 (2013).
- Farias-Hesson, E., et al. Semi-automated library preparation for high-throughput DNA sequencing platforms. Journal of Biomedicin., & Biotechnology. 2010, (2010).
- Callejas, S., Alvarez, R., Benguria, A., Dopazo, A. AG-NGS: a powerful and user-friendly computing application for the semi-automated preparation of next-generation sequencing libraries using open liquid handling platforms. BioTechniques. 56, 28-35 (2014).
- Zang, C., et al. A clustering approach for identification of enriched domains from histone modification ChIP-Seq data. Bioinformatics. 25, 1952-1958 (2009).
- Zhang, Y., et al. Model-based analysis of ChIP-Seq (MACS). Genome Biology. 9, 137 (2008).
- Heinz, S., et al. Simple combinations of lineage-determining transcription factors prime cis-regulatory elements required for macrophage and B cell identities. Molecular Cell. 38, 576-589 (2010).
- Quinlan, A. R., Hall, I. M. BEDTools: a flexible suite of utilities for comparing genomic features. Bioinformatics (Oxford, England). 26, 841-842 (2010).
- Landt, S. G., et al. ChIP-seq guidelines and practices of the ENCODE and modENCODE consortia. Genome Research. 22, 1813-1831 (2012).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。