需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
使用体外生物法测定抗 tnf 单克隆抗体 (抗体) 的相对效力
摘要
本文介绍了一种利用 WEHI 164 细胞中和机制测定抗 TNFα单克隆人的相对亡活性的协议。本协议对于比较不同分子的中和强度具有相同的生物功能是有用的。
摘要
本协议显示了使用抗 TNFα单克隆抗体对小鼠成纤维细胞模型 (WEHI 164) 中 TNFα的凋亡活性中和的测量。此外, 该协议可用于评估其他抗 TNFα分子, 如融合蛋白。细胞模型在这里使用的是敏感的 TNFα介导的细胞凋亡时, 额外的应力因子诱导的单元培养条件 (例如,血清剥夺)。这一过程说明了如何执行这一分析化验, 突出的关键操作与样品制备, 细胞稀释, 诱导细胞凋亡, 和分光光度测量, 是至关重要的, 以确保成功的结果。该协议揭示了与细胞凋亡诱导和有效信号记录有关的 best-performance 条件, 导致低不确定性值。
引言
生物效力是根据与相关生物特性有关的检测产品属性而进行的生物活性的定量测量, 而数量 (以质量表示) 是蛋白质含量的物理化学量度。效力测试, 连同其他分析方法, 是作为产品一致性、稳定性和可比性研究的一部分进行的。在这个意义上, 效力测量是用来证明产品批次符合关键质量属性 (CQAs) 或验收标准在所有阶段的临床试验和经市场批准。
凋亡是程序性细胞死亡, 当细胞被病毒感染时自然发生, 或者当细胞被环境因素所胁迫时, 会危及细胞的生存能力和功能1,2。除其他以外, 凋亡抑制, 或生物中和, 是一个主要已知的治疗机制的抗体, 特别是在治疗慢性疾病, 如免疫介导的炎症性疾病。抗 TNFα分子通过阻断肿瘤坏死因子α (TNFα) 与 p55 和 p75 细胞表面受体3的相互作用而发挥其治疗特性, 从而阻止最终导致细胞凋亡的信号通路。
TNFα在一些慢性病症可能导致炎症4。TNFα是地分泌入细胞外环境由巨噬细胞, 是固有免疫系统的哨兵和主要演员在这种疾病5。作为一条共同的道路, TNFα放松管制与这些疾病的发病机制有关。不受控制, 并在恒定诱导和细胞应力, TNFα诱导细胞死亡和组织变性, 最终导致类风湿关节炎, 克罗恩病, 和其他病理概况6。
tnf 拮抗剂阻断肿瘤坏死因子及其受体之间的相互作用, 被越来越多地用来作为一种有效的治疗方法来减少症状和阻碍这些疾病的进展。目前, 抗 TNFα药物产品被广泛用于控制这种细胞因子的系统集中, 从而防止受累组织的进一步变性。在这个意义上, 提供一个重现性和健壮的生物测定来描述药物的具体能力, 以达到其生物学效应是当务之急。
在本议定书中, 着重强调了执行生物分析方法所需的技能, 这是在发展中和化验过程中确定的关键步骤, 以成功测量生物效力。这种生物分析方法提供了不同批次或抗 TNFα药物产品的有用的可比性信息, 与临床试验的参考物质进行比较。
研究方案
1. 媒体和解决方案的准备
- 准备培养基: RPMI-1640 与 10% FBS, pH 7.4.
- 制备测定培养基: RPMI-1640 无酚红, 1% FBS, pH 7.4.
- 准备细胞洗涤液: DPBS 镁和无钙溶液与 0.02% EDTA, pH 7.4.
- 准备细胞剥离液: 0.125% 胰蛋白酶与1毫米 EDTA.
- 解冻100毫升的0.25% 溶液胰蛋白酶-EDTA 和转移到无菌500毫升烧瓶.
- 混合100毫升的细胞洗涤液和配发15毫升等分到15毫升无菌管。存储在-70 到-80 和 #176; C 直到使用.
- 将这些解决方案通过 0.22-#181; m 膜进行过滤, 预热到37和 #176; C 至少30分钟, 然后使用.
- 准备凋亡诱导砧木溶液 TNF 和 #945; 3.3 和 #181 的解决方案; g/毫升.
- 溶解20和 #181; g 的 TNF 和 #945; 与500和 #181; 过滤消毒水的主要容器和混合, 直到完全溶解.
- 转移到15毫升无菌管, 并加入5.5 毫升的 DPBS 镁和无钙溶液的这个管。使用涡流混合器轻轻搅拌.
- 将解决方案分为70和 #181; L 部分。免除每分0.5 毫升管内和存储在-80 和 #176; C.
- 准备细胞凋亡诱导溶液: TNF 和 #945; 溶液在 40 ng/毫升.
- 将凋亡诱导储存液的分解冻, 在25和 #730 的水浴中孵化; C 为 10 min.
- 将凋亡诱导库存溶液稀释至 40 ng/毫升, 增加61和 #181; 3.3 和 #181; g/毫升 TNF 和 #945; 15 毫升无菌管中4.939 毫升的测定培养基的溶液.
- 混合涡旋混合器十年代; 此解决方案必须在使用前新鲜准备.
- 将解决方案预热到37和 #176; C 至少在 eneutralization 检测之前使用30分钟.
- 准备基板解决方案: 酶3/7 全球解决方案 7 8 .
- 在使用前解冻酶缓冲区解决方案 (酶3/7 全球缓冲区) 12 小时.
- 让酶缓冲液和基板 (酶3/7 全球基板) 分别位于25和 #177; 5 和 #176; C 在混合前30分钟.
- 将酶缓冲液的10毫升转移到基板瓶中, 并通过反转进行混合.
- 保持在25和 #177; 5 和 #176; C, light-protected 直到使用.
注: 溶液在室温下稳定6小时.
2。细胞培养和计数
- 单元格解冻和第一次区域性.
- 从-80 和 #730 的冰箱中取出一个带有 WEHI 164 单元格的小瓶 9 , 然后将它们转到冰浴中.
- 吸管向上和向下与1毫升的5ml 培养基, 直到冷冻细胞完全解冻.
- 将9毫升的5ml 培养基放在15毫升无菌管上.
- 将电池悬浮液转移到15毫升无菌管中, 并通过反转将其轻轻混合五次.
- 离心机悬浮在 125 x g 为 3 min. 丢弃上清和分解细胞颗粒.
- 在试管中加入5毫升培养基。混合, 直到细胞完全悬浮.
- 用于单元计数, 传输50和 #181; l 细胞悬浮到500和 #181; l 微和混合与50和 #181; l 0.4% 台盼蓝。计算单元格并调整为 0.5 x 10 6 单元格/mL。请参见下面的步骤 2.2.
- 将13毫升的5ml 培养基添加到75毫升的细胞培养瓶中.
- 从步骤2.1.6 中分配足够的单元悬浮体积以实现 0.5 x 10 6 单元格/mL 在细胞培养烧瓶中孵育, 在37和 #176; C 和 5% CO 2 过夜。
- 单元格计数.
注意: 请参见参考 10 。- 使用从步骤2.1.6 的解决方案, 将 0.05 mL 转换为例, 并使用台盼蓝排除方法在显微镜下确定细胞密度.
- 量化单元格和可行单元格的总数.
- 将单元格悬浮液调整为 0.5 x 10 6 单元格/mL.
公式 1
v 培养基 (ml) =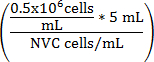
V 培养基 (ml) = (5mL-v 单元悬浮 )
V 培养基 (ml) = 调整后的卷 WEHI 164细胞悬架
NVC = 可行的 WEHI 164 细胞/毫升
V 培养基 (ml) = 检测培养基体积增加到细胞悬浮达到 0.5 x 10 6 细胞/ml
0.5 x 10 6 和 #160; = 目标单元格密度
- 单元格拆分和第二和第三亚文化.
注: 真空系统可用于从烧瓶中去除溶液。可使用一次性或玻璃无菌管。如果吸管在顶部有一个棉花堵塞, 它必须在使用前删除。- 使用1毫升无菌吸管和真空, 从细胞培养 T 瓶中取出培养基.
- 将5毫升的细胞洗涤液放入培养的 T 型烧瓶中, 轻轻混合, 并丢弃溶液。重复此步骤两次.
注意: 完全去除培养基对于有效的细胞剥离至关重要. - 在 T 形烧瓶中添加15毫升的细胞剥离液, 并在37和 #176 的恒温箱中让3分钟站立; C 和 5% CO 2 .
- 验证显微镜下烧瓶内壁上是否有附着的细胞。用20毫升无菌吸管将细胞从培养液中取出, 并将其放入一个50毫升的不育管中.
- 离心机悬浮在 125 x g 为3分钟. 丢弃上清和重颗粒与另5毫升培养基.
- 根据 公式1对单元格进行计数并添加足够的培养基以达到所需的细胞浓度 .
- 将此悬浮液添加到 72 cm 2 t-烧瓶, 并在夜间孵育37和 #176; C 和 5% CO 2 .
- 在中和检测中使用这些细胞至少要两次亚文化。在接下来的两天中重复步骤 2.3. 1-2. 3.8.
- 检测单元格挂起。
- 选择至少有三次传递的 WEHI 164 子区域性。请参见步骤 2.1.
- 根据此协议的步骤2.2 和2.3 分离和计数单元格.
- 根据 公式1将单元格悬浮液稀释为 0.5 x 10 6 单元格/mL。
- 使用此悬浮液进行中和检测。使用前旋流混合器混合所有的悬浮液.
3。抗体制备和稀释的
- 定量的抗体.
- 使用它们的质量消光系数 (1.39) 11 , 通过 280 nm 的紫外线吸收来确定参考物质、控制样品和分析样品的浓度.
注: 原始浓度可从药物产品标签中取出。然而, 这必须通过紫外线吸收来验证.
- 使用它们的质量消光系数 (1.39) 11 , 通过 280 nm 的紫外线吸收来确定参考物质、控制样品和分析样品的浓度.
- 单克隆稀释.
- 将所有样品单独稀释一式三份, 用 DPBS 镁和无钙溶液在2毫升管内中, 降低到2毫克/毫升。使用 DPBS 镁和无钙溶液作为空白, 通过紫外吸收来确认此浓度.
- 使用涡流混合器混合 5 s 的股票蛋白溶液.
- 稀释100和 #181; 每2毫克/毫升的单克隆溶液, 0.9 毫升的测定培养基.
- 用涡流混合器混合5秒.
注: 这些溶液的浓度为200和 #181;每三份必须稀释. - 稀释 10 & #181;每个200和 #181 的 L. 0.99 毫升的测定培养基中的单/毫升单克隆溶液。使用涡流混合器混合5秒。这些解决方案的浓度为2和 #181; g/毫升。在中和试验中使用前, 对每三个稀释进行串联.
- 使抗 TNF 和 #945; 单克隆稀释在三独立板。从每一个独立副本中复制一份, 并将它们放在一个微中, 如 表 1 所示。参考物质 参考物质 D2:D11 控件示例
表 1: 微示例数组. 一个完整的中和化验必须运行在三板在坐标 B2 到 G11。随机分配的参考, 分析和控制样本允许研究人员验证任何偏见的化验.板 1 板 2 板 3 韦尔斯 示例 井 示例 井 示例 B2:B11 参考物质 B2:B11 控件示例 B2:B11 分析示例 C2:C11 C2:C11 C2:C11 D2:D11 分析样例 D2:D11 E2:E11 E2:E11 E2:E11 F2:F11 控件示例 F2:F11 分析示例 F2:F11 参考物质 G2:G11 G2:G11 G2:G11 - 执行每个引用、示例或控件的单克隆稀释, 如 表 2 所示.
注: 抗肿瘤坏死因子和 #945; 在本表中描述的单克隆抗体浓度不是中和测定中的最终浓度。 >> 250 9 75 75m 行 7 11 150 75 行 10 13
能 2: 抗 TNF 和 #945; 单克隆稀释。 抗 TNF 和 #945 的序列稀释; 抗体在该表中演示。本表中所描述的最终浓度不是测定中的浓度, 其中抗 TNF 和 #945; 抗体被稀释的因子为 3 (单克隆稀释 + 培养基 + 细胞悬浮液)。粗体线表示稀释来自3、5、7、9和10行;non-bolded 线代表了3、4和6行的稀释。这些串联稀释是在执行中和化验前完成的。在配发稀释之前, 必须注意移上下三次的混合.板列 检测培养基容积 (#956; L) 参考物质体积, 分析样品或对照样品 (uL) 浓度在检测板 (ng/毫升) 2 0 230 3 150 150 从行 2 1000 4 75 75 从行 3 500 5 100 50 从行 3 333 6 75 75 线 4 7 75 75 从行 5 166 8 75 75 行 6 125 83 10 75 75 行 9 41 - 将板材保持在25和 #177; 5 和 #176; C 直到使用.
4。中和 WEHI 164 细胞的中和含量
- 通过涡流所有单元格悬浮 (0.5 x 10 6 单元/mL) 混合, 然后在该协议的任何步骤中进行分配.
注意: 在本节中, 将每个解决方案预热到37和 #176; C 在使用前为30分钟. - 传输50和 #181; L 单元悬浮到板的60口井中的每一个, 从2栏移动到11和 B 行到 G.
- 传输50和 #181; 单克隆参考、样本和控制稀释到板。按照 图 1 中描述的模式进行.
- 添加50和 #181; L 细胞凋亡诱导溶液对每一个井.
- 使用50和 #181 的蜂窝式控制; WEHI 164 细胞, 在三口井中配发。把每一个井的最后一卷150和 #181; L 与分析培养基.
- 使用50和 #181 的混合物的细胞毒性控制; WEHI 164 细胞 + 50 和 #181; 细胞凋亡诱导溶液 l。把每一个井的最后一卷150和 #181; L 与分析培养基.
- 用于 TNF 和 #945; 控制, 使用50和 #181; i. 细胞凋亡诱导溶液, 并将其带到150和 #181; 测定培养基.
- 对于空白, 请使用150和 #181; 仅适用于检测培养基的 L.
- 将剩余的井用150和 #181 填充培养基, 避免板的蒸发效果.
- 重复步骤 4.1. 1-4. 1.9 两次在其他板.
注: 微中的单克隆人最终浓度为: 0.666、0.333、0.167、0.111、0.083、0.056、0.042、0.028、0.014 和0.004 和 #181; g/毫升. - 在板中加载示例, 如 图 1 所示.
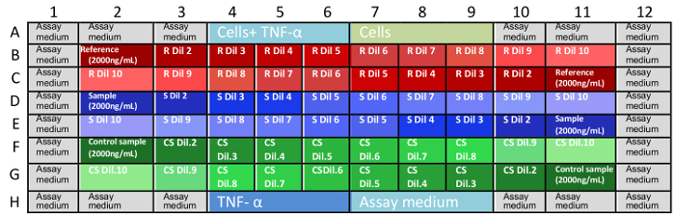
图 1: 检测板中样品的配置。B1 对 G11 的坐标在板, 并描述了样品稀释放置的位置。缺少的坐标是充满控制和测定培养基 (A1-A12 和 H1-H12) 的水井。这种随机分布的样品 (向前和反向稀释在板) 有助于消除偏差的结果, 由于蒸发的介质或其他变量。最好的做法是, 每次微都由一位分析师完成。R: 参考, S: 样品, CS: 对照样品, Dil: 稀释。 请单击此处查看此图的较大版本. - 孵育三板在37和 #176; C 和 5% CO 2 16 和 #177; 2 h.
- 让酶3/7 全球试剂站在25和 #177; 5 和 #176; C 在使用前30分钟.
- 在所有井中添加100和 #181; L 此试剂, 包括样品和控制.
- 使用微涡流混合器在25和 #177 处摇动板, 5、#176; C。
- 孵育2.5 和 #177 的板; 0.5 小时在25和 #177; 5 和 #176; C, 免受光照.
- 插入麦克风roplates 进入计, 完成下一节.
5。结果分析
- 使用用于发光检测的软件, 选择发光模式和端点函数.
- 选择96井底板及其80内部井, 不包括1和12栏.
- 选择1250毫秒和十年代的集成时间, 以便在阅读前混合微.
- 选择要放置参考物质、分析物质和控制样品的井, 并确定其相应浓度.
- 读取在板中放置的示例与计.
- 使用第四参数公式分析结果。图的剂量响应曲线, 如 图 2 所示.
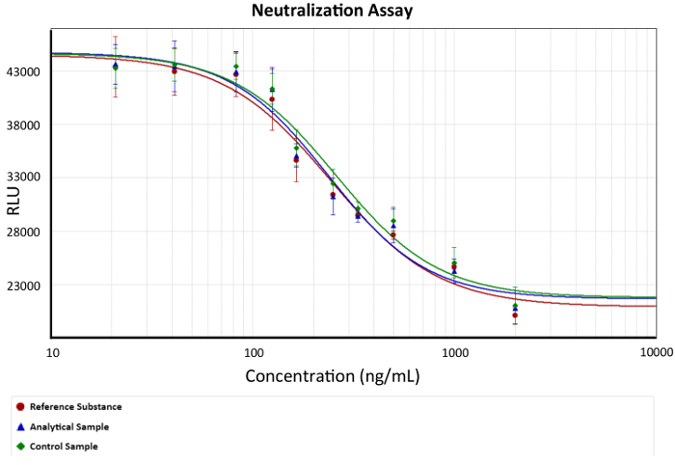
图 2: 剂量-响应曲线. 抗 TNF 和 #945; 单克隆抗体浓度与发光 (细胞活力) 的描述。描述抗 TNF 和 #945 的第四参数方程; 抗体的保护模型。EC50 是单克隆体的浓度, 可以抵消肿瘤坏死因子和 #945 的数量; 在每一个化验中导致50% 细胞死亡, 在曲线图中作为斜率变化的例证。条形图描述了每个单克隆人浓度的发光标准偏差。 x 表示抗 TNF 和 #945; Ab 浓度, 在 ng/mL 中被描述为对数函数, 而 y 表示 在任意发光单元中的发光响应。 请单击此处查看此图的较大版本.
注: 在第四参数方程中, C 是有效浓度 50 (EC50)。这个值将被用来比较的参考物质, 分析样本, 和控制样品的手段的效应函数. - 用于计算相对效, 将参考物质固定到 100%, 并据此计算样品的效和控制.
注意: 这些值在 图 3 中描述.
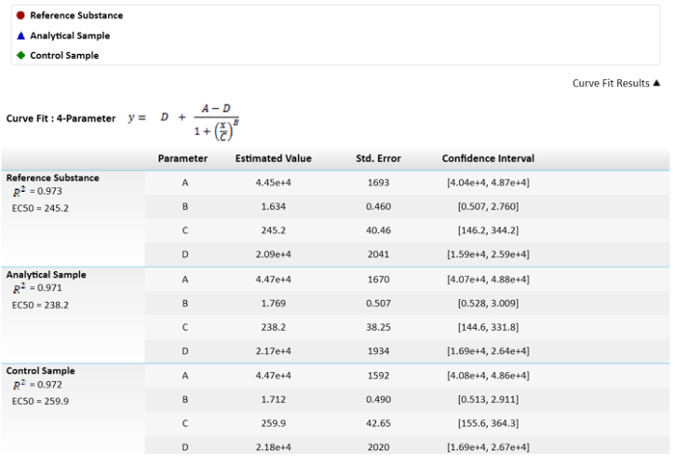
图 3: 用于计算 EC50s 及其值的数学公式. EC50 值, 或 C 参数, 其不确定性被描述为标准错误。比较了样品的 EC50s 和相对效力的参考结果。置信区间计算与 #945; = 0.05。 请单击此处查看此图的较大版本.
结果
剂量-反应图 (带控制)
图 1表示发光响应与单克隆浓度。这 sigmoidal 功能的例证酶3和7释放在分析培养基由于细胞裂解。通过血清饥饿加 TNFα信号诱导, 细胞死亡增加。因此, 抗 TNFα分子 (单克隆抗体) 与细胞因子相互作用, 抑制 (由空间位阻) 与 TNF 细胞受体的互动。这导致细胞存活在更高的单克隆浓度。
讨论
这种特性有助于在进行昂贵且耗时的临床试验之前确定一个分子在发育过程中的生物学行为. 它也有助于批次释放一个批准的药物产品。值得一提的是, 这些化验结果对于确定分子对其作用机制是否具有足够的生物学效应是有用的。本教程中提出的生物分析方法对不同抗 TNFα分子的比较至关重要。尽管常用的物理化学方法, 这种方法可以确定, 通过生物手段, 药物的效力和功效作为一个质量属...
披露声明
作者没有透露
致谢
这项工作得到了国家科学和技术委员会 (委员会) 的支持, 墨西哥授予 PEI 委员会 2015 220333, 没有参与研究的设计。
材料
| Name | Company | Catalog Number | Comments |
| WEHI 164 | ATCC | CRL-1751 | Fibrosarcoma cells from Mus musculus |
| RPMI-1640 Medium | ATCC | 30-2001 | Store medium at 2 °C to 8 °C |
| RPMI 1640 Medium, no phenol red | GIBCO | 11835-030 | Store medium at 2 °C to 8 °C |
| Trypsin-EDTA(0.25%),phenol red | GIBCO | 25200-056 | Store medium at -10 °C to -20 °C |
| DPBS, no calcium, no magnesium | GIBCO | 14190-136 | Store medium at 2 °C to 8 °C |
| Recombinant Human TNF-alpha Protein | R&D Systems | 210-TA-020 | Store at -20 °C to -70 °C |
| Fetal Bovine Serum (U.S), Super Low IgG | HyClone | SH3089803 | Store at -10 °C to -20 °C |
| Fetal Bovine Serum (U.S.), Characterized | HyClone | SH3007103 | Store at -10 °C to -20 °C |
| Caspase-Glo 3/7 Assay kit | Promega | G8093 | Store the Caspase-Glo. 3/7 Substrate and Caspase-Glo. 3/7 Buffer at –20 ºC protected fromLight |
| EDTA, Disodium Salt, Dihydrate, Crystal, A.C.S. Reagent | J.T.Baker | 8993-01 | -- |
| Sample mAb Adalimumab | Probiomed | NA | Final concentrations in the microplate are: 0.666, 0.333, 0.167, 0.111, 0.083, 0.056, 0.042, 0.028, 0.014 and 0.004 μg/mL |
| Reference and Control mAb Adalimumab | Abbvie | NA | Final concentrations in the microplate are: 0.666, 0.333, 0.167, 0.111, 0.083, 0.056, 0.042, 0.028, 0.014 and 0.004 μg/mL |
| Microplate Reader | Molecular Devices | 89429-536 | SpectraMax M3 Multi-Mode |
| Microplate reader Software | Molecular Devices | -- | SoftMax Pro 6.3 GxP |
| Incubator | Revco | 30482 | Revco RNW3000TABB Forced-Air CO2 |
| Laminar Flow Hood | The Baker Company | 200256 | Baker SG603A-HE | High Efficiency, Class II Type A2 |
参考文献
- Elmore, S. Apoptosis: A Review of programmed cell death. Toxicol Patho. 35 (4), 495-516 (2007).
- Darwish, R. S. Regulatory mechanisms of apoptosis in regularly dividing cells. Cell Health Cytoskelet. 2 (1), 59-68 (2010).
- Tracey, D., et al. Tumor necrosis factor antagonist mechanism of action: A comprehensive review. Pharmacol Ther. 117 (2), 244-279 (2008).
- Körner, H., Sedgwick, J. Tumour necrosis factor and lymphotoxin: Molecular aspects and role in tissue-specific autoimmunity. Immunol Cell Biol. 74 (5), 465-472 (1996).
- Wong, M., et al. TNFa blockade in human diseases: Mechanisms and future directions. Clin Immunol. 126 (2), 121-136 (2008).
- Furst, D. E., Wallis, R., Broder, M., Beenhouwer, D. O. Tumor necrosis factor antagonists: different kinetics and/or mechanisms of action may explain differences in the risk for developing granulomatous infection. Semin Arthritis Rheum. 36 (3), 159-167 (2006).
- Karvinen, J., et al. Homogeneous time-resolved fluorescence quenching assay (LANCE) for caspase-3. J Biomol Screen. 7 (3), 223-231 (2002).
- Ren, Y. G., et al. Differential regulation of the TRAIL death receptors DR4 and DR5 by the signal recognition particle. Mol Biol Cell. 15 (11), 5064-5074 (2004).
- Sud, D., Bigbee, C., Flynn, J. L., Kirschner, D. E. Contribution of CD8+ T cells to control of Mycobacterium tuberculosis infection. J Immunol. 176 (7), 4296-4314 (2006).
- Strober, W. Trypan blue exclusion test of cell viability. Curr Protoc Immunol. Apendix 3, 3 (2001).
- Ramasubramanyan, N., et al. . Low acidic species compositions and methods for producing and using the same. 1, (2014).
- Masters, J. R., Stacey, G. N. Changing medium and passaging cell lines. Nat Protoc. 2 (9), 2276-2284 (2007).
- Eskandari, M. K., Nguyen, D. T., Kunkel, S. L., Remick, D. G. WEHI 164 subclone 13 assay for TNF: sensitivity, specificity, and reliability. Immunol Invest. 19 (1), 69-79 (1990).
- Hora, M. S., Rana, R. K., Smith, F. W. Lyophilized formulations of recombinant tumor necrosis factor. Pharm Res. 9 (1), 33-36 (1992).
- Ponnappan, S., Ponnappan, U. Aging and immune function: molecular mechanisms to interventions. Antiox Redox Signal. 14 (8), 1551-1585 (2011).
- Matsumaru, K., Ji, C., Kaplowitz, N. Mechanisms for sensitization to TNF-induced apoptosis by acute glutathione depletion in murine hepatocytes. Hepatology. 37 (6), 1425-1434 (2003).
- Camacho-Villegas, T., Mata-Gonzalez, T., Paniagua-Solis, J., Sanchez, E., Licea, A. Human TNF cytokine neutralization with a vNAR from Heterodontus francisci shark: a potential therapeutic use. mAbs. 5 (1), 80-85 (2013).
- Männel, D. N., Falk, W. Optimal induction of tumor necrosis factor production in human monocytes requires complete S-form lipopolysaccharide. Infect Immun. 57 (7), 1953-1958 (1989).
- Lis, K., Kuzawińska, O., Bałkowiec-Iskra, E. Tumor necrosis factor inhibitors-state of knowledge. Arch Med Sci. 10 (6), 1175-1185 (2014).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。