需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
用四甲基铵进行实时离子电渗疗法,以量化体细胞分数和脑细胞外空间的变性
* 这些作者具有相同的贡献
摘要
该方案描述了实时离子电渗疗法,一种测量活体大脑细胞外空间(ECS)物理参数的方法。释放到ECS中的惰性分子的扩散用于计算ECS体积分数和曲折度。它是研究脑ECS急性可逆变化的理想选择。
摘要
该评论描述了执行实时离子电渗(RTI)方法的基本概念和方案,探索和定量活体大脑的细胞外空间(ECS)的金标准。 ECS围绕所有脑细胞并且包含间质液和细胞外基质。大脑活动所需的许多物质的运输,包括神经递质,激素和营养物质,都是通过ECS扩散发生的。这种空间的体积和几何形状的变化发生在正常的脑部过程,如睡眠和病理状况,如缺血。然而,大脑ECS的结构和调节,特别是在患病状态,仍然在很大程度上未被探索。 RTI方法测量活体大脑的两个物理参数:体积分数和曲折度。体积分数是ECS占据的组织体积的比例。柔软度是衡量物质在通过脑部扩散时遇到的相对阻碍与没有障碍物的介质相比。在RTI中,惰性分子从源微电极脉冲到脑ECS中。当分子从该源扩散时,使用离子选择性微电极定位大约100微米,离子的浓度随时间变化。从所得扩散曲线可以计算体积分数和曲折度。这种技术已被用于来自多个物种(包括人类)的脑切片和体内研究ECS的急性和慢性变化。与其他方法不同,RTI可以用于实时检测脑ECS的可逆和不可逆变化。
引言
细胞外空间(ECS)是所有脑细胞外部相互通路的网络,包含间质液和细胞外基质( 图1a和图1b )。脑细胞功能所需的许多物质(包括营养素,激素和神经递质)的分布通过ECS扩散发生。在该空间中的物理参数,包括体积,几何形状和细胞外基质,变化可以显着地通过ECS和局部离子浓度洗澡脑细胞,从而对脑细胞功能1,2产生深远的影响影响扩散。
实时离子电渗疗法(RTI)被用于确定一个大脑区域的两个结构特点:体积分数和弯曲度3,4,"xref"> 5。体积分数( α )是代表基础体积中ECS( V ECS )相对于总组织体积( V 组织 )占据的组织体积的比例;
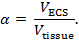
与没有障碍物的介质相比,Tortuosity( λ )是通过脑区域扩散时物质遇到的相对障碍;

其中D * (cm 2 s -1 )是物质在脑中的有效扩散系数, D (cm 2 s -1 )是物质在游离介质如稀释琼脂糖凝胶中的自由扩散系数。
今天是R最常用的探针物质TI方法是小阳离子四甲基铵(TMA)。 TMA的分子量为74g / mol,在溶液中完全解离,并具有一个正电荷。这种离子的RTI研究已经证明α  0.2和λ
0.2和λ  1.6 1,2。这意味着ECS大约是总体积的20%,并且小的惰性分子的扩散在ECS中比在没有障碍物3的介质中大约慢2.5倍。然而, α和λ随着脑年龄,区域和状态以及病理状况而变化1 。这些参数的改变与大脑发育,衰老,睡眠,癫痫以及脑中许多其他基本过程和疾病有关1, 6 。虽然其他技术测量α和λ ,RTI可以实时测量生物组织的局部区域。因此,RTI在急性和可逆性挑战中已成为调查α和λ变化的不可缺少的工具。
1.6 1,2。这意味着ECS大约是总体积的20%,并且小的惰性分子的扩散在ECS中比在没有障碍物3的介质中大约慢2.5倍。然而, α和λ随着脑年龄,区域和状态以及病理状况而变化1 。这些参数的改变与大脑发育,衰老,睡眠,癫痫以及脑中许多其他基本过程和疾病有关1, 6 。虽然其他技术测量α和λ ,RTI可以实时测量生物组织的局部区域。因此,RTI在急性和可逆性挑战中已成为调查α和λ变化的不可缺少的工具。
该理论支撑器R最初由尼克尔森和Phillips验证,并且该技术已经被自那时起4,7广泛使用。使用RTI的实验开始于通过离子电渗法从源微电极释放到脉冲TMA的稀释琼脂糖凝胶。一旦弹出,离子从点源自由扩散,从潜在的无限数量的随机路径中选择( 图1d )。使用大约定位的离子选择性微电极(ISM)随时间测量离子的变化浓度100米远( 图1c )。 TMA浓度的变化被绘制并适合于允许计算D和离子电渗微电极(在方案中讨论的参数)的输送数的曲线。利用这些值,在感兴趣的脑区域中重复该过程以获得D *并计算α和λ 。离子电渗微电极的控制,TMA浓度曲线的数据收集,绘图和拟合以及实验参数的计算都通常由专门为此目的而设计的程序Wanda和Walter完成(软件及其手册是可根据要求自由提供)。
本评论的"议定书"部分描述了在啮齿动物脑切片中设计和执行RTI所需的基本程序。该技术也被用于无杆ENT模型,包括人脑切片和体内脑制剂1,4,6,8,9。 "代表结果"部分提供理想和非理想的结果,以突出数据解释的细微差别。最后,讨论部分简要介绍了故障排除技术,RTI的限制,用于研究ECS的替代技术以及RTI的未来应用。

图1:ECS扩散图。 ( a )ECS图:在典型的脑部分显示ECS的大小和位置。黄色标记了灰色脑细胞过程之间的ECS。 ECS的体积大约是总组织体积的20%( 即,体积分数= 0。2)生理条件下。 ( b )ECS的放大图:重点介绍有助于曲折的物理参数,包括脑细胞几何(灰色)和细胞外基质(图示为多色糖胺聚糖和蛋白多糖的网格)。 ( c )从点源扩散的3D图:证明惰性分子从离子电渗源到ISM的净运动。排除扩散阻挡层和细胞摄取,分子在所有方向向外扩散,产生球形浓度前沿。 ISM量化从离子电渗源释放的惰性分子的局部浓度。 ( d )大脑ECS中扩散的计算机模拟:[左侧]蒙特卡罗模拟的设置;绿色球体代表脑细胞过程,红色十字表示点源。这个设置模拟图1a所示的脑组织。 [中图] 3和6个分子在通过大脑的细胞外空间扩散时进行随机运动,如图2所示。 [远]从点源释放的许多分子的随机游走。来自点源的所有分子的净运动是向外的, 如图1c所示 。累积随机散点概述了单元格之间的空格( 即 ECS;参见参考文献5进行进一步说明)。 请点击此处查看此图的较大版本。
Access restricted. Please log in or start a trial to view this content.
研究方案
用于获取组织样本的所有动物手术均获得SUNY Downstate医疗中心动物伦理委员会的批准。
1.准备解决方案和设备
- 为ISM的参考筒准备150 mM NaCl回填溶液。将其储存在连接到0.22μm过滤器上的10mL注射器中(以去除细菌或颗粒)。
- 为微电极制备150 mM TMA氯化物(TMA-Cl)回填溶液。将其储存在连接到0.22μm过滤器上的10mL注射器中。从5 M制造商库存解决方案准备TMA-C1溶液(在本协议中),以确保正确的浓度。
- 通过将漂白剂(次氯酸钠)中的电线浸没至少2小时,将至少四条银线氯化以制造微电极。用乙醇除去多余的漂白剂,让电线干燥。
- 在150mM NaCl和0.5mM TMA-Cl的烧杯中制备50mL的0.3%琼脂糖并覆盖它。使用粉末状和新鲜的琼脂糖,以确保良好的扩散测量。
- 加热并将琼脂糖溶液与搅拌棒混合以使其溶解。让溶液冷却至室温。将其在4°C下储存长达1周。
- 准备1 M KCl中由4%琼脂糖制成的无关(接地)电极(附录A中的方向)
- 制造一个小型多孔的杯子,可以安装在实验室中,并允许其内容物与外部环境之间的电气连续性( 图2a )。在这个杯子的底部放一个金属环,以防止它在部分淹没在水中时浮起来。
- 使用5 M TMA-Cl原料的连续稀释制备5个100 mL TMA-Cl溶液,用于校准ISM。溶液的终浓度应为0.5,1,2,4和8 mM TMA-Cl,全部为150 mM NaCl。将校准溶液储存在可密封的杯子中,以防止蒸发/ LI>
电子设置
- 根据图2b中的框图连接RTI实验装置的组件;包括具有两个输入通道的放大器(其中一个对于ISM的离子选择镜筒应具有非常高的阻抗),10Hz的低通滤波器,图表记录器,A / D + D / A转换器,离子电渗单元(或能够提供恒流脉冲的放大器)以及运行万达和瓦尔特程序的计算机(PC)。检查电子设置以确认所有连接都到位。
- 如果需要,可以在接地的外壳(如法拉第笼)中屏蔽实验设备,因为ISM具有很高的电阻,并且对附近运动产生的伪像敏感。
- 创建由双输入放大器,图表记录器,适当的ISM支架和无关的接地电极组成的专用ISM校准站。如果可能的话,屏蔽外壳。如果ISM在实验设置中进行校准,请跳过此步骤(步骤3.29)

图2:多孔实验杯和电子设置。 ( a )多孔实验杯:使用多孔网来创建一个允许琼脂糖(内部)和实验洗液(外部)之间电连续性的实验杯。金属环附着在杯子的底部,以防止杯子漂浮在洗澡液中。 ( b )RTI设置的框图(步骤2.1和2.2):ISM连接到放大器(amp。)。 ISM有两个桶。一个包含尖端的液体离子交换器(LIX),并产生与尖端的TMA浓度的对数成比例的电压与局部环境电压;日e信号路径由红线表示。 ISM的另一个桶被称为参考筒,并测量ISM顶端的环境电压;它通过蓝色信号路径连接。放大器有两个连接到ISM的所谓的头级;这些单位的增益为1(x1),并将微电极的高阻抗与放大器电路其余部分的低阻抗相匹配。连接到离子选择性筒的头级必须能够匹配大约1,000MΩ的进入电阻,而参考镜筒的电阻通常约为10MΩ。在离开头阶段之后,使用求和放大器(Σ)将来自参考镜筒的电压反转并从离子选择镜筒上的电压中减去以获得纯离子信号电压。放大器的输出传递到提供额外放大的信号调节单元和多极低通滤波器(≤10Hz;通常为贝塞尔fi滤波器),可以消除噪声并防止模数转换器(A / D)的信号混叠。过滤器的输出也显示在条形图记录仪上。 A / D转换器将信号数字化并发送到个人计算机(PC)。 PC还产生由数模转换器(D / A)转换为馈送到离子电渗单元的模拟电压脉冲的数字信号,其将电压转换成恒定幅度的电流脉冲并将其发送到离子电渗微电极。离子电渗信号路径由绿线表示。数据采集和离子电渗信号处于万达程序的控制之下,它以电压对时间记录的形式生成每个扩散记录的输出文件,以及定义实验的所有参数。第二个程序Walter读取输出文件并使用ISM校准数据将数字化电压转换为浓度。浓度然后将rsus时间曲线拟合到瓦尔特到扩散方程的适当解。如果培养基是琼脂糖,则提取D和n t ,如果培养基是脑,则提取λ和α 。模拟信号为实线;数字信号是虚线。在包含切片的浴槽中还有一个无关的接地电极(未示出)。红线=离子信号,蓝线=参考信号,绿线=离子电渗指令,实线=模拟,虚线=数字。 请点击此处查看此图的较大版本。
离子选择性微电极的制备和校准
- 在实验前一天使用协议制作ISM。批量制作ISM以确保在实验当天至少有两项工作。
注意:大多数ISM是稳定的一天或二。 ISM制造对湿度和大气条件敏感。并非每个微电极都会成功校准。 - 使用旧的一对镊子在一桶双重硼硅酸盐玻璃毛细管的末端切掉大约0.5cm的玻璃。
- 在毛细管的另一端切片一个桶( 图3a )。确保隔膜没有损坏(严重)。注意:戴防护眼镜,以防止射弹玻璃造成伤害。
- 将毛细管置于一瓶丙酮中至少1小时以除去污染物。
- 从丙酮中取出毛细管,并将其清洁干燥,压缩后的氮气或空气通过其除去任何过量的丙酮。去除毛细管中的所有丙酮,因为残留的丙酮可能会干扰硅烷化(至关重要)。
- 在垂直或水平拉拔器上制造微量移液器的尖端。调整参数以拉长长锥形的移液器尖尖,直径约1μm或更小。在该步骤结束时,将一个毛细管制成两个移液管( 图3a )。
- 在一个复合的显微镜下,可以看到一个单一的微量移液管,10X的目标是立式显微镜。使用玻璃显微镜载玻片切割尖端,使得尖端( 即两个筒)的最终直径在2至5μm之间( 图3b )。这种移液器从现在开始就被称为ISM。
- 使用安装在0.22μm过滤器上的10mL注射器和28G,97mm针头( 图3b ),通过切口侧上的开口,将具有150mM NaCl参比溶液的ISM的切碎桶填充。不要将枪管的四分之三的桶装满桶。
- 用150 mM TMA-Cl填充溶液填充ISM的无切屑桶。点击ISM轻轻敲击任何气泡从解决方案。检查麦克风下的气泡用于切削刀头的罗盘。
- 使用本生灯燃烧ISM背面,以确保在ISM背面的隔膜上不会发生回填溶液的通讯。确保ISM的顶部四分之一在燃烧后干燥。
- 将氯化银线插入ISM的参考溶液中,并弯曲从毛细管突出的线,将其标记为参考筒( 图3c )。确保电线浸没在回填溶液中,并在实验期间保留在溶液中。
- 在25 G注射器针头的尖端上滑动短长度的聚四氟乙烯管(约20厘米长)。将管的另一端放在离子选择性筒的背面。确保管道在桶中但在回填溶液之上( 图3c )。
- 用本生灯加热一道牙蜡,并密封管道和硅胶呃将它们导入各自的桶中( 图3c )。确保在离子选择性桶(关键)内的塑料管周围产生完整的空气密封。
- 在二甲苯中制备4%氯代三甲基硅烷的小透明玻璃容器(5 mL或更少)。注意:二甲苯和硅烷对健康非常危险;处理通风柜内的两种化学物质并妥善丢弃。
- 将容器放置在水平放置在通风橱中的立体解剖显微镜前面。使用显微操纵器将ISM垂直固定在容器上( 图3d )。
- 将微电极的尖端浸入氯代三甲基硅烷溶液中。
- 将空的10 mL注射器连接到通向ISM的25号针头上。从注射器中施加正空气压力直到形成TMA-Cl溶液的气泡;该步骤应通过显微镜在直观可视化下进行。
- 轻轻点击ISM支架,将气泡从尖端上敲掉。
- 在10 mL注射器上使用负压将氯代三甲基硅烷溶液拉至ISM顶端约1,500μm的高度。
- 从ISM的尖端完全排出氯代三甲基硅烷溶液,直到在尖端产生TMA-Cl溶液的气泡( 图3d )。
- 重复步骤3.19和3.20五次。确保每次均匀,不间断的液体色谱柱被吸入。如果没有溶液可以吸入尖端,检查管道是否堵塞,空气密封不完整或ISM的尖端是否被堵塞。
- 将所有氯代三甲基硅烷溶液冲洗出尖端,直到产生TMA-Cl溶液的气泡。
- 在注射器保持正压的同时,从二甲苯溶液中取出ISM。确保所有二甲苯溶液从ISM尖端排出,因为过量的二甲苯将破坏后续步骤中创建的挂钩列。
- 将ISM的尖端放置在保持TMA的液体离子交换器(LIX)的小的透明容器(换热器进入或小型比色杯)中。使用水平显微镜设置在直观可视化下执行此步骤。
- 施加少量负压以将最少量的LIX吸入尖端( 即,一旦看到LIX进入尖端,停止施加负压)。
- 断开10 mL注射器与管道的连接,并允许ISM坐5分钟。在此期间,LIX将进入硅烷化的尖端,直到达到平衡状态。
- 从LIX中删除ISM。将管道从交换器桶中拉出(尽可能少地除去蜡)。将氯化银线放在ISM后端产生的小开口。用熔化的蜡密封交换器桶的回填中的电线。
- 让ISM坐下至少30分钟。使用任何柔韧的临时粘合剂将完整的ISM连接到烧杯的内边缘。
- 通过在步骤1.8中制作的每个校准溶液中记录由ISM测量的电压来校准ISM。
注意:校准可以在校准台(参见步骤2.3)或实验设置中进行。该程序在附录B和Haack 等人 10中概述。 - 如果对于多个ISM的ISM校准成功,则暂停这里直到预期使用的那一天。如果没有,制造更多的ISM。
- 在实验当天,再次校准微电极(参见步骤3.29)。

图3:离子选择性微电极的制备。 ( a )在切断毛细管末端并拉动后(步骤3.2-3.6):ISM在两端单个筒fa玻璃毛细管被切碎。通过拉一个双管玻璃毛细管产生具有细尖端的两个微量移液管产生ISM。 ( b )回填两个桶后的ISM(步骤3.7-3.9):单个ISM的末端切成直径为2-5μm。离子选择性桶用TMA-Cl回填,参考桶用NaCl补充。 ( c )在用氯代三甲基硅烷涂覆之前的ISM(步骤3.11-3.13):将氯化银线插入参考筒中。聚四氟乙烯(PTFE)管连接到25 G针并插入离子选择性筒。使用牙蜡在两个桶的顶部上形成气密密封。 ( d )用氯代三甲基硅烷涂覆微量移液管(步骤3.15-3.26):[低放大倍率]根据水平安装的立体显微镜,悬浮在氯代三甲基硅烷中的ISM。 [高倍率]通过水平安装的立体显微镜的视图在三氯甲基硅烷溶液中的ISM尖端的操作。在通过显微镜观察尖端后,少量的TMA-Cl溶液从离子选择性管中排出(足以产生TMA-Cl溶液的小气泡)。轻击ISM支架以释放TMA-Cl溶液泡沫,然后将氯代三甲基硅烷制成尖端。这个循环重复几次。在所有氯三甲基硅烷从ISM中排出之后,将ISM放入用于TMA的液体离子交换器(LIX)中,并将LIX吸入离子选择性筒的末端。 请点击此处查看此图的较大版本。
离子电渗微电极的制备
注意:离子电渗微电极应在实验当天制造。
- 在垂直或ho上拉双管硼硅玻璃毛细管rizontal拉扯根据步骤3.6( 图4a )中拉出的微量移液管,定义拉拔移液器的参数。
- 将微量移液管放置在步骤3.7中使用的复合显微镜下,使用玻璃显微镜载玻片切割尖端,使得所得直径在2至5微米之间( 图4a )。
- 使用连接到0.22μm过滤器的10 mL注射器和28 G,97 mm针头( 图4a ),使用150 mM TMA-Cl回填溶液填充两个桶。
- 轻轻点击微量移液器,确保两个桶的溶液中没有留下气泡。
- 将氯化银线放入微量移液器的两个桶中。确保电线在回填溶液中足够深,以便在实验期间它们将与溶液保持接触。
- 使用热牙蜡将电线密封到桶中。轻轻互锁t他们通过将它们彼此缠绕( 如图4b所示的完成的微电极)进行导线。
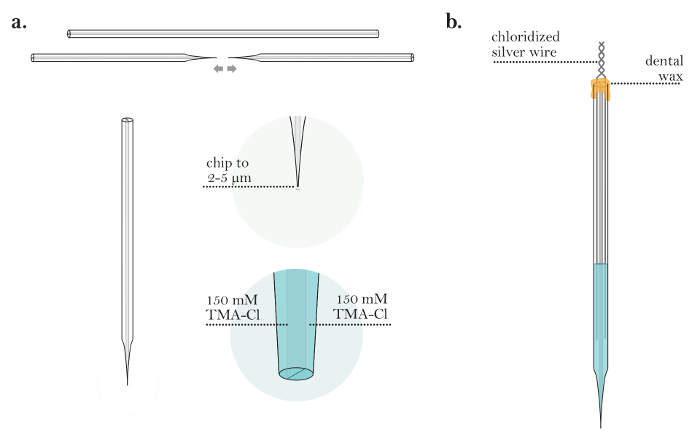
图4:离子电渗微电极的制备。 ( a )回填双筒后的离子电渗微电极(步骤4.1-4.3):离子电渗微电极从毛细管中拉出。微电极的尖端切成直径为2-5μm。离子电渗微电极的两个桶都填充有TMA-Cl溶液。 ( b )完成的离子电渗微电极(步骤4.5-4.6):将带有两个氯化银线的离子电渗微电极插入到桶中。微电极的桶用蜡密封,并且银线在微电极的背面被扭绞在一起。/files/ftp_upload/55755/55755fig4large.jpg"target ="_ blank">请点击此处查看此图的较大版本。
5.人造脑脊液和啮齿动物脑组织切片的制备
- 准备1L人造脑脊液(ACSF),其具有适合于该实验的组合物,并向其中加入0.5mM TMA-Cl。
注意:TMA-Cl在实验过程中需要建立TMA的背景浓度。 - 制备啮齿动物的脑切片用根据标准协议11,12的厚度为400微米。使用步骤5.1中准备的ACSF进行脑切片的解剖和维护。
6.琼脂糖实时离子电渗疗法
- 打开运行Walter和Wanda程序的电脑。
注意:这些程序可根据要求免费提供。虽然这个软件不是必需的,但编程类似否则将需要软件或手动执行分析。 - 以适当的速率( 例如, 2mL / min)通过浸没室运行ACSF。在实验期间,将温度控制器设置为所需温度,并将95%O 2 /5%CO 2 (或其他合适的气体混合物)气化。
- 将无关(接地)电极安装在合适的保持器中,并将尖端浸没在穿过浸没室的ACSF中。将电线连接到记录设置的地面。
- 用先前制备的0.3%琼脂糖填充多孔杯(在步骤1.7中制成)并将其放入浸没室中。确保溶液不会超过杯子的顶部。
- 将校准的ISM固定到一个显微操纵器和离子电渗微电极的移液管支架上。将支架设置为适合设置的角度( 图5a )。
- 连ISM和离子电渗微电极连接到记录放大器的各自的头级。或者,直接连接到放大器(取决于设置)。
- 确保连接线或夹子的重量/定位不会导致微电极的任何移动,因为定位的小波动会影响结果。
- 打开电子设置(从步骤2)。在不同的情况下启动沃尔特和万达。
- 在万达GUI中,单击"校准"( 图6a )。在校准框( 图6b )中,填写ISM校准期间测量的电压(步骤3.29),然后单击"适合数据"。
注意:这使得能够适应尼科尔斯基方程的以下表示(或者通过另一种方式拟合方程来获得M和K ):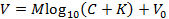
她的e, V是测量电压(mV), M是尼科尔斯基斜率(mV), C是离子浓度(mM), K是干扰(mM), V 0是偏移电压(mV) 3 。 - 单击"校准"框中的"接受",将步骤6.9中生成的斜率( M )和干扰( K )自动传送到主GUI。
注意:这里, K表示Na干扰,通常可以忽略不计。 - 在GUI的左侧,确保所有实验参数都设置在相应的条目中( 图6a )。
- 在源方法框中,将源设置为离子电渗源(默认),"记录持续时间"设置为"200 s"(默认),"脉冲开始"设置为"10 s"(默认),"脉冲结束"到"60 s"(默认),"偏置电流"为"20 nA"(默认),"主电流"为"100 nA"(默认值),"转换因子"为适当的值。
- 在测量电极盒中,将"Bath C"设定为浴液中含有的TMA浓度(以mM表示)。将"总增益","输出通道","ISM通道"和"参考通道"设置为正在使用的数据采集系统的适当值。
注意:"转换因子"必须设置为适当的值(特定于使用的离子电渗单位)。该值指定来自D / A转换器(nA / mV)的给定施加电压的电流量。
- 将温度探头置于琼脂杯中。在GUI的"测量电极"框中的"温度"条目中记录测量的温度( 图6a )。
- 打开子阶段照明器。如果需要,打开连接到麦克风的相机镜头和相机显示器。
- 将至少1000微米深的微电极放入琼脂糖并将其置于杯中( 图5b )。在显微镜下使用10X物镜(具有长工作距离的浸水物镜)可视化它们。
- 将放大器的电压偏移到参考和ISM通道的0 mV,以便将记录在琼脂糖中的电压建立为基准电压。
- 在双通道放大器上,手动将ISM通道连接器移动到电压减法输出端,以将参考和ISM通道之间的减法设置为"开"。
注意:减法确保ISM通道中的电压变化仅反映TMA浓度的变化。 - 移动ISM使其接触离子电渗微电极的尖端。将所有三个方向轴上的尖端对中。
- 将两个微电极的相对位置置零显微操纵器控制箱。确保微电极准确而准确(关键)。
- 将离子电渗微电极的离子电渗微电极120μm的ISM移动到一个轴( 图5b中的左右轴)。将此距离输入到GUI的"测量电极"框中( 图6a )。
- 在GUI中单击"获取"开始录制( 图6a );允许程序录制完整录音。
注意:离子电渗微电极接收恒定的偏置电流。点击"获取"之后,在主电流施加一段有限的时间之前,有一个很短的延迟。 - 重复步骤6.20再三次三次以上。等待TMA信号在获得新记录之前返回基准线;该程序将保存每个记录供以后分析。
- 通过将ISM移回t来检查两个微电极的间距o由控制箱指定的零位置。如果微电极不再居中,则使用与步骤6.17相同的策略再次使其居中。记录电极位置的任何变化。
注意:如果间距变化超过约2%,则步骤6.19中获取的记录不能被认为是准确的,必须采取新记录。

图5:Agar实验设置。 ( a )在稀释琼脂中进行实验设置(步骤6.1-6.5):将填充有稀释琼脂的小型多孔容器置于运行中的灌注室中。离子电渗微电极(左侧)和ISM(右侧)由微电极保持器保持;微电极支架安装在机器人显微操纵器的臂上。将温度探针放置在琼脂凝胶中,并且不加接地的电极是pl浸入浸入室内。 ( b )琼脂中微电极的放大图:离子电渗微电极(左侧)和ISM(右侧)使用10X水浸物镜(浸入150mM NaCl中的物体)在琼脂中显现。使用微操纵器将微电极定位到1000μm的深度;微电极之间的间距为120μm。 请点击此处查看此图的较大版本。

图6:万达计算机软件界面。 ( a )浏览万达图形用户界面(GUI):打开万达软件后出现的屏幕。在盒(1)中,选择适当的介质,离子电渗分子和技术。 (2)点击"校准"打开万达校准盒。在校准ISM后(参见图6b和补充B),ISM位于琼脂或脑中,如方案步骤6和8所述。在框(6)中,输入正在执行的实验的所有适当值。 (7)点击"获取"录音;电压对时间的图表显示在万达GUI的右上部分。 ( b ) 在万达校准ISM :点击(2)万达GUI中的"校准"后打开的窗口。步骤3.29的值输入框(3),选择"适合数据"(4)。校正曲线被确认为线性。 (5)点击"接受"返回万达GUI。 请点击此处查看此图的较大版本。
琼脂糖数据分析
- 打开Walter程序在电脑(PC)上。在"0.记录从:"菜单中,单击"万达/ VOLTORO"按钮,读取万达生成的记录( 图7a )。假设输出到电子表格是必需的,打开相应的软件。在"1.写Excel"中点击"Sheet 1,3"菜单( 图7b )。
- 在下一个弹出窗口中,选择要读取的记录,然后单击"打开"( 图7b );请注意,记录将自动绘制。要开始安装程序,请执行以下步骤。
- 在"2.选项"菜单中,单击"选择记录"按钮。在" 图2 "弹出窗口中,使用鼠标将十字准线移动到要处理的第一个记录上( 图7c );按鼠标左键选择记录。
- 点击on"拟合曲线"在菜单中。选择合适的迭代次数;使用至少20次拟合来获得数据的精确拟合。
- 在菜单中,选择"全部"以适应所有数据点,然后选择"继续"该程序将适合所显示的曲线。观察拟合程序,并将实验记录与获得的最佳拟合曲线进行比较。
- 通过单击"7.结果"菜单( 图7d )中的"Excel",选择将结果写入相应的电子表格程序的选项。注意(并记录)将用于确定离子电渗微电极的功能的以下关键数据:' D(E5) ',' 参考D(E5) ',' r_app ',运输数' n t ',' 表观n t '。
注意:" D(E5) ":测量的自由扩散系数tx 10 5 (cm 2 / s); " 参考D(E5) ":理论自由扩散系数×10 5 (cm 2 / s)。该值是根据离子,介质和温度输入从瓦尔特内的数据库中提取的。 " r_app ":表观微电极间距(cm),基于测量值和参考值D(E5)计算 。 " n t ":运输号码(无量纲)。该数字确定用于释放TMA 4的离子电渗电流的分数。 " 表观n t ":表观运输号(无量纲)。这是从r_app计算的运输号码。该数值应接近测量的n t 。 - 对所选择的一对微电极的每个记录重复步骤7.1-7.3。
- 通过以下步骤确定离子电渗微电极是否可用。
- 将" r_app"与实际的r ( 即 120μm)进行比较;如果所有试验的平均值在彼此的4%以内,则该标准得到满足。
- 将" D(E5)"与参考D(E5)进行比较 ;如果所有试验的平均值在8%以内,则该标准得到满足。
- 比较使用相同的微电极试验之间的"N t"的 ;如果所有试验的平均值在10%以内,则该标准得到满足。
- 如果步骤7.5中的其中一个条件未得到满足,则排除离子电渗微电极或开始测试另一个。
- 如果离子电渗微电极被认为适合于实验,则记录万达GUI中"运输编号N"字段中所有试验的平均运输编号( 图6a )。
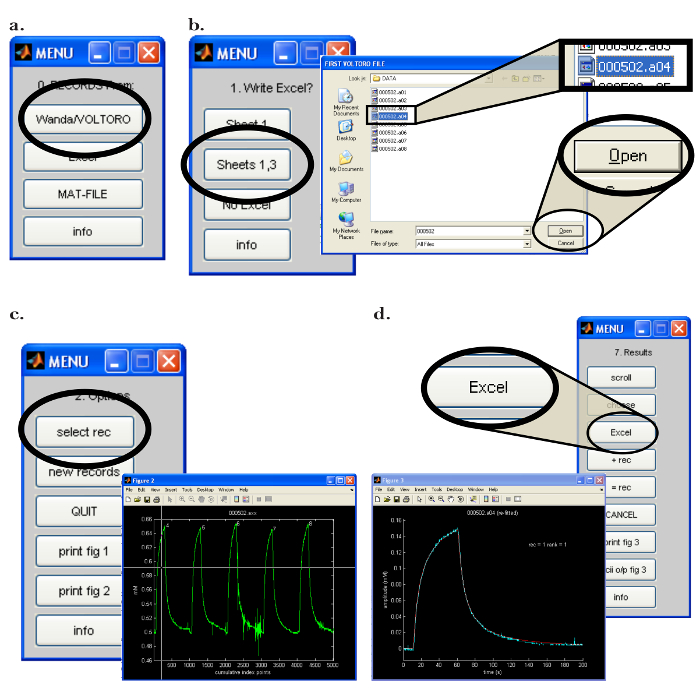
图7:沃尔特计算机软件界面。 ( a )选择Walter中的数据收集程序:启动Walter软件后,将打开"0. Records From:"菜单。通过点击"万达/沃尔托"按钮选择加载万达保存的记录的选项。 ( b )选择Walter中的数据和数据分析输出位置:[Left]打开相应的电子表格程序后,选择"Sheet 1,3"将所有Walter数据分析输出到以前打开的电子表格程序。 [右]选择数据分析输出位置后,将弹出一个弹出窗口,允许用户选择要由Walter读取的第一个和最后一个记录。 ( c )选择在Walter中进行分析的记录:[右]选择要阅读的文件后,将打开所有选定记录的弹出窗口作为图(" 图2 ")。 [左]在"2.Options"菜单中,单击"选择rec",鼠标用于移动十字准线以识别第一个记录进行分析;按鼠标按钮选择录制。 ( d ) 将数据分析从Walter导出到电子表格:拟合数据后,弹出窗口和"7.结果"菜单出现。 [左]所选录音(蓝色)与Walter(红色)生成的拟合扩散曲线的曲线图。 [右]"7.结果"菜单允许用户通过单击"Excel"按钮将分析中的数据写入电子表格程序。 请点击此处查看此图的较大版本。
8.脑切片中的实时离子电渗疗法
- 放置一个400μm厚的脑记录室中的虱子,确保它完全浸没在流动的ACSF中。使用水彩画笔定位切片,并用网格轻轻固定。
- 将离子电渗微电极和ISM置于脑切片上的感兴趣区域之上。淹没在流动的ACSF中,但在切片之上。
- 将参考和离子感应通道的电压偏移为"0"mV。等待两个通道的电压稳定。在图表记录仪上,标记ISM离子感应通道上测得的电压。使用它来计算万达的基线V参数。
- 将ISM和离子电渗微电极放在切片中200微米深,彼此距离120微米。将微电极移入脑切片后,等待信号稳定。
注意:施加到离子电渗微电极的偏置电流导致TMA的小量积累。这是一个常见的错误记录太早,低估了信号的积累。 - 在图表记录仪上,标记在ISM的离子感应通道上的脑切片中测得的稳定电压。计算在步骤8.3和8.4中测量的TMA信号之间的电压差,并将其输入到万达GUI测量电极盒中的"基线V(mV)"字段中( 图6a )。
- 在GUI的左侧,确保所有实验参数都被正确记录/输入。将"Medium"设置为"Brain","Transport number"设置为步骤7.4中离子电渗微电极计算的平均值,"Temperature"设置为含有切片的浴的温度。
注意:对于每组测量,必须记录V。基线V将由万达转换为基线C (mM)参数( 即脑组织中TMA的浓度)。 - 单击"获取"开始录制,并允许其进行完整录制。等待直到TMA信号在获得新录音之前返回到基线。
- 在从选定的大脑位置移除微电极之前,先后连续进行两到三次录像。在每次录制前立即输入万达软件测量的温度。
- 将两个微电极对角地移回到切片的表面。将两者提高至切片上方至少50μm。使用图表记录仪,确定现在测量的V与其步骤8.3之间的测量值之间的任何变化。
- 在x轴,y轴和z轴上使ISM和离子电渗微电极的尖端彼此相对。从显微操纵器控制箱的显示中获取间距变化(如果有的话)。
脑数据分析
- 打开分析输出的新电子表格。
- 在Walter中重复步骤7.1-7.4进行分析从大脑拍摄的录音。
- 通过单击Walter菜单中的"Excel"将数据写入电子表格程序。记录大脑ECS的α ,体积分数; λ ,脑的曲折ECS;和k (s -1 ),非特异性间隙。
10.检查运输号码和ISM校准
- 在实验结束时使用以下协议测量ISM传输数( n t )。可替代地,检查临界试验或测量时出现异常后N t 个 。然而,检查Nt个太多次会导致创伤对大脑切片。
- 在琼脂糖中拍摄新的录音。参见步骤6.4,6.11,6.12,6.14,6.15和6.17-6.22。
- 在Walter中重复步骤7.1-7.4,从新的琼脂糖记录中获取n t 。检查电子表格:如果nt已更改更多超过大脑测量之前获得的n t的 10%,用该离子电渗微电极获得的数据是不可靠的。
- 在收集所有脑数据后,对ISM执行新的校准(参见步骤3.29)。使用新获得的ISM校准数据作为万达校准框中的输入(参见步骤6.9和6.10),并检查斜率值是否与先前校准值相差不到10%。
注意:如果斜率与上一次校准相差超过10%,则使用此ISM获得的数据不可靠。
Access restricted. Please log in or start a trial to view this content.
结果
RTI技术的实用性在设计用于测量α和低渗摩洛尔挑战期间变化的实验中得到证明( 图8和图9 )。先前已经表明,降低了ECS的渗透压通过洗涤上低渗ACSF将产生α的降低,并增加了λ13。
在该实验中,在两个对照条件下和在低渗ACSF的洗涤期间对大?...
Access restricted. Please log in or start a trial to view this content.
讨论
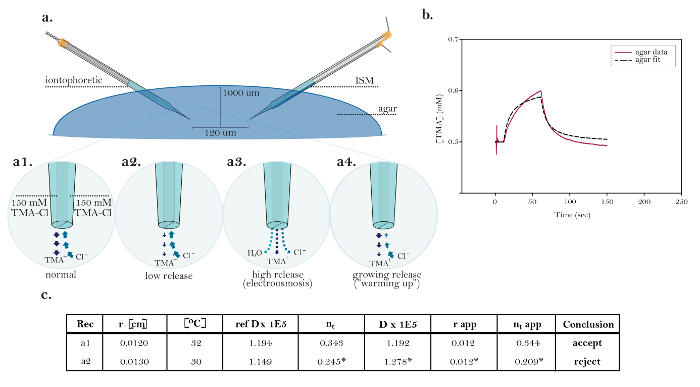
图10:展示常见技术问题的非理想数据。 ( a )离子电渗微电极的常见技术问题图:功能性离子电渗微电极的TMA正常释放与三个来源的技术问题的比较。 [高放大倍数,a1]理想的离子电渗源中的电流通过TMA释放和氯化物摄取而均匀地进行。 [高倍率,A2]一种离子电渗微电极具有低N t个释放更少TMA?...
Access restricted. Please log in or start a trial to view this content.
披露声明
作者宣称他们没有竞争的经济利益。
致谢
这项工作得到NIH NINDS授予R01 NS047557的支持。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| A/D and D/A converter | National Instruments Corporation | NI USB-6221 DAQ | The NI USB-6221 is still sold as a 'Legacy' device by NI. They recommend using NI USB-6341 X Series DAQs for new installations, however we have not tested the newer units. We describe the use of the NI USB-6221 with MATLAB and Windows 7 (32-bit). Alternatives: the much older PCI-MIO-16E-4 A/D converter (Used under Windows XP or older OS only) with BNC-2090 BNC connector panel and SH68-68-EP cable. As noted in the Wanda Manual, an experimental MATLAB program to use Axon Binary Files is available. |
| agarose | Lonza | NuSieve GTG Agarose #50081 | to prepare dilute agarose gel for RTI measurements |
| amplifier for ISM | Dagan | Model IX2-700 Dual Intracellular Preamplifier | ion and reference voltage amplifier with N=0.1 (for reference barrel) and N=0.001 (for ion barrel) headstages |
| biological compound miscroscope (with 4x and 10x objective) | for chipping the microelectrode tips and inspecting microelectrodes; various suppliers, e.g. AmScope | ||
| borosilicate theta capillary glass tubing | Harvard Apparatus | Warner Instruments model TG200-4; order #64-0811 | double-barreled glass tubing for ion-selective microelectrodes and iontophoretic microelectrodes; O.D. 2.0 mm, I.D. 1.4 mm, septum 0.2 mm, length 10 cm |
| brush | Winsor & Newton | University Series 233, size 0 | round shoft handle brush, available from Amazon |
| bunsen burner | Fisher | ||
| camera for visualizing micropipettes | Olympus | OLY-150 | requires monitor, IR filter on substage illuminator is optional |
| chart recorder | to record continuously voltages on ion-selective microelectrode during calibration in tetramethylammonium standards and during RTI experiment; e.g. Kipp & Zonen type BD112 dual-cannel chart recorded, available refurbished | ||
| chlorotrimethylsilane, puriss., > 99% | Sigma-Aldrich | catalog # 92360 | for silanization; CAUTION: flammable, acute toxicity (oral, dermal, inhalation), skin corrosion, eye damage, reacts violently with water, see Sigma-Aldrich Safety Information for full description |
| Commercial Software | The MathWorks | MATLAB, Data acquisition toolbox | for data acquisition and analysis using Wanda and Walter programs. Note that an academic license is available. |
| eye protective goggles | Fisher | ||
| fixed-stage compound microscope | Olympus | BX51WI | can use other compound microscopes with fixed stages |
| forceps | Fine Science Tools | #11251-10 | to chip glass capillary; Dumond #5, preferably used and no longer needed for fine work |
| fume hood | for silanization and filling the tip of ion-selective barrel with liquid ion exchanger; various supliers, e.g. Captair with approriate filter sold by Erlab | ||
| glass microscope slide | Fisher | #12-550A | to chip microelectrode tips |
| heater/stirrer | Fisher | Corning PC-420D | to prepare dilute agarose gel and stir solutions |
| iontophoretic unit | Dagan | ION-100 and PS-100 | ION-100 is a single channel iontophoresis unit +/- 130 V compliance; PS-100 is an external power supply; alternatives: e.g. Axoprobe-1A made by Axon Instruments (now Molecular Devices), out of production, check for availability of refurbished units (eBay and other sites) |
| liquid ion exchanger (LIX) for tetramethylammonium | World Precision Instruments | IE190 Potassium Ion Exchanger | Note: this is equivalent to the original Corning potassium exchanger 477317 based on tetraphenlyborate - do not confuse with neutral carrier potassium exchanger originating from the laboartory of Dr. Simon, ETH, Zurich, which does not sense tetramethylammonium, and is sold by Fluka. You can also make liquid ion exchanger for tetramethylammonium yourself: 3% by weight potassium tetrakis = (p-chlorophenyl) borate dissolved in 2,3-dimethylnitrobenzene. Buy chemicals from Fluka (now part of Sigma). See Oehme and Simon (1976) Anal. Chim. Acta 86: 21-25; CAUTION: The toxicological properties of this liquid ion exchanger have not been fully determined. Ingestion or contact with the human body may be harmful. Exercise due care! Liquid ion exchangers should be stored in a cool place out of direct sunlight. |
| microelectrode holder | WPI | M3301EH | to hold ion-selective microeletrode prefabricate for silanization and filling the tip of ion-selective barrel with liquid ion exchanger; WPI sells two versions of this holder, clear M3301EH and black M3301EH. In our experience, the clear M3301EH appears to be sturdier then the black M3301EH. |
| micromanipulator | Narishige | MM-3 | to position ion-selective microelectrode prefabricate during silanization and filling the tip of ion-selective barrel with liquid ion exchanger; can be substituted with any three-axis micromanipulator in good working condition |
| micropipette puller | Sutter Instruments | Model P-97 | to pull double-barreled glass tubing; other pullers can be used as long as they can accommodate large diameter double-barreled glass tubing |
| microprobe thermometer | Physiotemp | Model BAT-12R | fine probe of this thermometer is placed close to recording site |
| needle | BD | Syringes and Needles # 305122 (25 gauge) | for silanization; BD PrecisionGlide needles 25 G x 5/8 in (0.5 mm x 16 mm) |
| objective 5X dry | Olympus | MPlan N | |
| objective 10X water immersion | Olympus | UMPlan FL N | 10X objective is water immersion, numerical aperture is 0.3, working distance is 3.3 mm |
| plastic containers (with lids) | Fisher | #14-375-148 | to store tetramethylammonium standard solutions and microelectrodes |
| platform and x-y translation stage for fixed-stage microscope | EXFO | Gibraltar Burleigh | platform holds slice chamber, micromanipulators and accesorries, x-y translational stage moves microscope without compromising recording stability |
| porous minicup | for RTI measurements in a dilute agarose gel; homemade | ||
| reusable adhesive | Bostik | Blu-Tack | for securing microelectrodes to holding vessel and other uses; various suppliers, available from Amazon |
| robotic micromanipulator with precise x,y,z positioning | Sutter Instruments | MP-285 | two mircomanipulators are needed to hold separately ion-selective microelectrode and iontophoretic microelectrode. Also possible to glue micropipettes in a spaced array (see text). |
| signal conditioning unit with low-pass filter | Axon Instruments | CyberAmp 320 or 380 | no longer available from the manufacturer but may be available from E-Bay; alternatives: e.g. FLA-01 Filter/Amplifier from Cygnus Technology. This is a single channel instrument with a minimum cutoff at 10 Hz using a multipole Bessel filter but the company may be willing to modify it for a lower cutoff frequency (2 Hz) if needed. |
| silver wire | A-M Systems | #7830 | diameter 0.015", bare (no coating) |
| slice chamber | Harvard Apparatus | Warner Model RC-27L | this is submersion slice chamber; do not use interface slice chamber |
| stereomicroscope | for silanization and filling the tip of ion-selective barrel with liquid ion exchanger; horizontally mounted; various suppliers | ||
| syringe, 10 mL | BD | Syringes and Needles #309604 | to backfill microelectrodes and for silanization; BD Luer-Lok tip |
| syringe filter 0.22 µm pore | Whatman | #6780-1302 | to filter backfill solutions; available from Fisher |
| syringe needle, 28 gauge, 97mm | World Precision Instruments | MicroFil MF28G-5 | to backfill microelectrodes |
| Teflon (=PTFE) tubing | Component Supply | STT-28 PTFE tube light wall (28 gauge) | for silanization of ion-selective barrel; fits on BD PrecisionGlide needles 25 G x 5/8 in. Note: Teflon is essential, PVC tubing would melt by hot wax. |
| temperature control system | Harvard Apparatus | Warner Models TC-344B and SH-27A | TC-344B is a dual automatic temperature controller, SH-27A is an in-line heater; controller and heater work with Warner slice chambers |
| tetramethyammonium (TMA) chloride | Sigma-Aldrich | T-3411 | 5 M solution; CAUTION: acute toxicity (oral, dermal, inhalation), carcinogenicity, hazardous to the aquatic environment, see Sigma-Aldrich Safety Information for full description |
| vibrating blade microtome | Leica | VT1000S | to cut brain slices |
| xylenes | Fisher | X5-1 | for silanization; CAUTION: flammable, acute toxicity (oral, dermal, inhalation), skin corrosion, eye damage, carcinogenicity, see Fisher Safety Information for full description |
参考文献
- Sykova, E., Nicholson, C. Diffusion in brain extracellular space. Physiol Rev. 88 (4), 1277-1340 (2008).
- Nicholson, C. Diffusion and related transport mechanisms in brain tissue. Rep Prog Phys. 64 (7), 815-884 (2001).
- Nicholson, C. Ion-selective microelectrodes and diffusion measurements as tools to explore the brain cell microenvironment. J Neurosci Methods. 48 (3), 199-213 (1993).
- Nicholson, C., Phillips, J. M. Ion diffusion modified by tortuosity and volume fraction in the extracellular microenvironment of the rat cerebellum. J Physiol. 321, 225-257 (1981).
- Nicholson, C., Sykova, E. Extracellular space structure revealed by diffusion analysis. Trends Neurosci. 21 (5), 207-215 (1998).
- Xie, L. L., et al. Sleep drives metabolite clearance from the adult brain. Science. 342 (6156), 373-377 (2013).
- Hrabetova, S., Nicholson, C. Biophysical properties of brain extracellular space explored with ion-selective microelectrodes, integrative optical imaging and related techniques. Electrochemical Methods for Neuroscience Neuroscience. Michael, A. C., Borland, L. M. , CRC press. 167-204 (2007).
- Rice, M. E., Okada, Y. C., Nicholson, C. Anisotropic and heterogeneous diffusion in the turtle cerebellum: implications for volume transmission. J Neurophysiol. 70 (5), 2035-2044 (1993).
- Vargova, L., et al. Diffusion parameters of the extracellular space in human gliomas. Glia. 42 (1), 77-88 (2003).
- Haack, N., Durry, S., Kafitz, K. W., Chesler, M., Rose, C. Double-barreled and concentric microelectrodes for measurement of extracellular ion signals in brain tissue. J Vis Exp. (103), (2015).
- Xiao, F., Hrabetova, S. Enlarged extracellular space of aquaporin-4-deficient mice does not enhance diffusion of Alexa Fluor 488 or dextran polymers. Neuroscience. 161 (1), 39-45 (2009).
- Sherpa, A. D., Pvan de Nes,, Xiao, F., Weedon, J., Hrabetova, S. Gliotoxin-induced swelling of astrocytes hinders diffusion in brain extracellular space via formation of dead-space microdomains. Glia. 62 (7), 1053-1065 (2014).
- Kume-Kick, J., et al. Independence of extracellular tortuosity and volume fraction during osmotic challenge in rat neocortex. J Physiol. 542 (Pt 2), 515-527 (2002).
- Saghyan, A., Lewis, D. P., Hrabe, J., Hrabetova, S. Extracellular diffusion in laminar brain structures exemplified by hippocampus. J Neurosci Methods. 205 (1), 110-118 (2012).
- Fedirko, N., Svichar, N., Chesler, M. Fabrication and use of high-speed, concentric H+- and Ca2+-selective microelectrodes suitable for in vitro extracellular recording. J Neurophys. 96 (2), 919-924 (2006).
- Nicholson, C. Diffusion from an injected volume of a substance in brain tissue with arbitrary volume fraction and tortuosity. Brain Res. 333 (2), 325-329 (1985).
- Nicholson, C., Tao, L. Hindered diffusion of high molecular weight compounds in brain extracellular microenvironment measured with integrative optical imaging. Biophys J. 65 (6), 2277-2290 (1993).
- Thorne, R. G., Nicholson, C. In vivo diffusion analysis with quantum dots and dextrans predicts the width of brain extracellular space. Proc Natl Acad Sci U S A. 103 (14), 5567-5572 (2006).
- Wolak, D. J., Thorne, R. G. Diffusion of macromolecules in the brain: implications for drug delivery. Mol Pharm. 10 (5), 1492-1504 (2013).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。