需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
纳米颗粒对荷瘤小鼠药相结合的样品提取及同时色谱定量分析
摘要
该协议描述了一个高效和方便的分析过程中的样品提取和同时测定多药, 阿霉素 (DOX), 丝裂霉 C (MMC) 和心脏毒性 DOX 代谢物, doxorubicinol (DOXol), 在生物样品的临床前乳腺癌模型治疗的纳米颗粒制剂的协同药物组合。
摘要
联合化疗常用于肿瘤治疗的临床;然而, 与正常组织相关的不良反应可能会限制其治疗效果。纳米药物组合已被证明可以缓解问题的免费药物联合治疗。我们以前的研究表明, 两种抗癌药物, 阿霉素 (DOX) 和丝裂霉素 C (MMC) 的结合, 产生了对小鼠和人乳腺癌细胞的协同作用体外。DOX 和 MMC co-loaded 聚合物脂质杂交纳米颗粒 (DMPLN) 绕过各种外排转运泵, 赋予多药耐药性, 并证明了乳腺肿瘤模型的增强功效。与传统的溶液形式相比, 这种 DMPLN 的优越功效归因于 DOX 和 MMC 的同步药代动力学, 以及 nanocarrier PLN 所启用的肿瘤细胞内的细胞药物生物利用度的提高。
为了评价 co-administered DOX 和 MMC 在自由溶液和纳米颗粒中的药代动力学和生物分布, 采用反相高效液相色谱 (HPLC) 的简单高效的药物分析方法是开发.与以前报告的方法, 分别分析 DOX 或 mmc 在等离子体中, 这种新的 HPLC 法可以同时定量 DOX, mmc 和主要有氧 DOX 代谢物, doxorubicinol (DOXol), 在各种生物矩阵 (例如,全血, 乳腺肿瘤和心脏)。采用双荧光和紫外线吸收探针 4-伞形 (4 亩) 作为一个内部标准 (行列) one-step 检测多种药物分析不同的检测波长。该方法成功地应用于原位乳腺肿瘤小鼠模型中的全血和不同组织中纳米颗粒和溶液方法的 DOX 和 MMC 的浓度测定。所提出的分析方法是临床前分析药物组合纳米分娩的有效工具。
引言
化疗是许多癌症的主要治疗方式, 但它往往与严重的副作用和有限的功效, 由于耐药性和其他因素1,2,3。为了改善化疗的结果, 药物组合方案已在临床应用的考虑因素, 如不重叠的毒性, 不同的药物作用机制, 和非耐药性4,5,6. 在临床试验中, 与序贯药物传递的方案相比, 经常观察到肿瘤的反应率更高, 其方法是:7,8。然而, 由于游离药物形态的非最佳生物分布, 同时注射多种药物可引起明显的正常组织毒性, 超过治疗效果9,10,11。Nanocarrier-based 药物的传递已被证明改变药代动力学和生物分布的封装药物, 加强肿瘤靶向积累12,13,14。正如我们在最近的文章中所回顾的, 与协同药物组合的纳米 co-loaded 已经证明了能够减轻自由药物组合所遇到的问题, 由于其控制的时间和空间 co-delivery多种药物对肿瘤组织, 使协同药物对癌细胞的作用4,15,16。结果, 在临床前和临床医学研究中均表现出优异的治疗效果和低毒力4,17,18。
我们以前的体外研究发现, 两种抗癌药物, 阿霉素 (DOX) 和丝裂霉 C (mmc) 的结合, 产生了对几个乳腺癌细胞株的协同作用, 此外, co-loading DOX 和 mmc 在聚合物-脂质混合纳米颗粒 (DMPLN) 克服了各种耐药相关的外排泵 (例如, p-糖蛋白和抗乳腺癌蛋白)19,20,21。在体内, DMPLN 使 DOX 和 MMC 的空间颞 co-delivery 对肿瘤部位和癌症细胞内药物的生物利用度提高, 这表明 DOX 代谢产物 doxorubicinol (DOXol)22的形成是适度的。结果, DMPLN 增强肿瘤细胞凋亡, 抑制肿瘤生长, 延长宿主存活率, 与游离 DOX 和 MMC 组合物或脂质体 DOX 配方22,23,24, 25。
分析 nanocarrier co-delivered 药物的实际用量对于设计有效的纳米粒子配方是至关重要的。采用高效液相色谱 (HPLC) 单独或与质谱联用 (MS)26、27、28等方法, 对单 DOX 或 MMC 剂量的血浆水平进行了分析。,29,30,31,32,33,34. 然而, 这些方法往往是费时和不切实际的组合疗法, 因为大量的生物样品需要单独准备的分析多种药物 (有时包括药物代谢物)。除了强的血浆蛋白结合 DOX 和 MMC, 红细胞也有很大的能力绑定和集中许多抗癌药物35,36。因此, DOX 或 MMC 的等离子分析可能会混淆实际的血药浓度。本工作 (图 1) 描述了一种简单而稳健的多药分析方法, 采用反相高效液相色谱法同时提取和定量 DOX、MMC 和 DOX 代谢物 doxorubicinol (DOXol) 的全血和各种组织 (例如,肿瘤)。它已成功地应用于确定药物的药代动力学和生物分布的 DOX 和 MMC, 以及形成的 DOXol 后, 通过免费的解决方案或纳米颗粒 (即, DMPLN 和脂质体 DOX) 在原位植入小鼠乳腺肿瘤模型静脉注射后 (静脉注射)22。
研究方案
所有动物实验均由安大略省癌症研究所的大学卫生网络动物保育委员会批准, 并按照加拿大动物保育理事会的准则进行.
1. 生物样品制备
- 在静脉注射 (静脉注射) 药物制剂后, 在预定的时点上收集全血、主要脏器和乳腺肿瘤 (如 ,DMPLN, 脂质体 DOX)
- 用准备好的含药物的制剂注射乳房肿瘤的小鼠静脉注射.
- 麻醉在指定的时点 ( 如 , 15 分钟) 通过在密封腔中给予可吸入的2% 异氟醚.
- 将麻醉鼠标放在背部, 并将其鼻子通过鼻甲, 不断提供2% 异氟醚.
注意: 为确保鼠标进行深层麻醉, 轻轻捏住鼠标前部的四肢, 并寻找任何抽搐运动. - 使用70% 乙醇彻底清洁胸部和腹部区域, 然后使用素1毫升注射器和23克针对深麻醉小鼠进行心脏穿刺的终点程序.
- 将整个血液收集到一个标有钠的肝素喷塑管中, 并轻轻地将管子旋转, 以确保收集到的全血与管壁上的涂肝素接触。收集最低50和 #181; 我全血。总是把样品放在冰上.
- 将所有四只老鼠的四肢固定起来, 用剪刀和镊子把老鼠的腹腔和胸腔打开。将肠道移向一侧, 并向上推动肝脏, 以充分暴露门静脉。切开门静脉为血液排水.
- 灌注50毫升 ice-cold 0.9% 生理盐水通过心脏使用10毫升注射器与25克针的整个鼠标的身体.
注: 在90和 #176 弯曲针; 用于引导注射器进入门静脉.
按下列顺序 - 切除器官: 心脏、肺、肝、脾、肾。然后, 在鼠标右乳房脂肪垫上用一对切口剪刀将乳腺肿瘤从周围结缔组织中分离出来。将所有的器官分别收集到1.5 毫升聚丙烯管中, 并迅速将其冷冻在液氮中.
#8203; 注意: 将胆囊与肝脏分开. - 将整个血液储存在4和 #176; c 和切除组织在-80 和 #176; c 冷冻直到以后 HPLC 分析.
- 从生物矩阵中提取 DOX、MMC 和 DOXol.
- 将所有冰冻的解剖组织快速称量, 并将其转换为13毫升圆底锥形管。为了避免可能的药物代谢或降解, 请将样品放在冰上.
- 在试管中加入1-5 毫升的 ice-cold 细胞裂解缓冲液.
注: 所使用的缓冲体积取决于组织-缓冲比为1克: 5 毫升 (w/v);对于小器官, 如心脏和脾脏, 比例为1克: 2 毫升. - 使用一个上下行程的运动, 以质在冰上的组织样本在 1.8万 rpm 的速度使用电动手均质机.
注: 完成的均匀化需要大约3到5次迭代短的均一过程少于十五年代, 然后组织冷却在冰在每短的均一之间. - 用蒸馏去离子 (DDI) H 2 o, 70% 乙醇, 然后在每个组织样本之间的 DDI h 2 o 来洗涤 10 mm 的均质体的锯齿发生器探头, 以避免交叉感染.
- 将50和 #181; 将组织匀浆或全血转移到1.5 毫升聚丙烯微离心管中, 并以5和 #181; 内部标准 (行列) 4-伞形 (4-亩) (2000 ng/毫升) 插入管中.
注: 4 亩溶液在甲醇中制备. - 在含有全血或组织匀浆的试管中添加250和 #181; ice-cold 提取溶剂.
注: 萃取溶剂包括60% 乙腈 (ACN) 和40% 醋酸铵 (5 mM), ph 值调整为 ph 值 = 3.5 使用0.05% 甲酸。使用 1:5 (v/v) 样品: 萃取溶剂到容积比. - 强力涡旋混合物为2分钟, 离心机在 3000 x g 力在 4 o C 为 10 min 和吸管 200 & #181; 升上清成另 pre-chilled 新鲜微离心管.
- 在60和 #176 蒸发上清液; 在氮气的缓慢流动下, 从光中得到保护.
- 100 和 #181 的干燥残渣的重组; ice-cold 甲醇, 强力涡旋三十年代和离心 3000 x g 在4和 #176; C 为另外 5 min.
- 将上清液转移到 HPLC 瓶中插入, 并将样品瓶放入样托盘中进行注射.
2。高效液相色谱仪及操作参数
- 使用渐变圆柱体制备 hplc 移动相, 具有一致再现性
- 测量500毫升 hplc 级 H 2 O.
- 使用单独的分级气缸测量500毫升 HPLC 级乙腈 (ACN).
- 小心地将0.5 毫升的乙酸酸 (TFA) (警告) 放入 500 ml h 2 O 和 ACN 中, 以获取 h 2 o 和 ACN 的移动阶段, 分别包含 0.1% TFA.
注: TFA 具有腐蚀性和毒性, 应在实验室油烟罩下处理。所有溶剂混合物都在室温下制备. - 用 0.45 #181 的尼龙膜过滤器过滤移动相; m 孔径, 并将其转换成干净的 HPLC 储罐.
- 设置高效液相色谱仪同时检测 DOX、MMC、DOXol 和行列 4-亩.
- 开关在渐变泵、de-gasser、样、光电二极管阵列检测器和多 #955; 荧光探测器.
- 将移动相组成的初始条件输入到 16.5% H 2 O (0.1% TFA) 和 83.5% ACN (0.1% TFA) (v/v).
- 在两个通道上设置 UV 探测器, 一个位于 310 nm, 用于4亩 (行列), 另一个位于 360 nm, 用于 MMC.
- 在两个通道上设置荧光探测器, 一个在和 #955; ex /和 #955; em = 365/445 nm 为4亩和其他在和 #955; ex /和 #955; em = 480 nm/560 nm 分别用于 DOX 和 DOXol.
- 设置等的流量为1.0 毫升/分钟.
- 平衡预安装的反向阶段 C 18 列 (4.6 mm x 250 mm, 5 和 #181; m) 在室温下为基线设置的10分钟.
- 使用渐变移动阶段条件分离药物 (DOX、MMC、DOXol 和 4-MU).
- 注入15和 #181; 使用样提取和 re-concentrated 样本的 L.
- 使用自动渐变泵, 逐步改变初始的移动阶段条件 (请参阅协议步骤 2.2.2) 到 100% ACN (0.1% TFA), 18 分钟.
注: 在分离过程中, 四通道 (两个紫外线吸收剂和两个荧光) 同时出现, 每个通道显示一个药物化合物 (参考协议步骤2.2.3 和 2.2.4). - 保持 100% ACN (0.1% TFA) 1 分钟, 然后在1分钟内返回到初始移动阶段条件.
- 重新条件初始移动阶段的列, 其流速为1.5 毫升/分钟, 下一个样本注入4分钟.
3。HPLC 验证
- 准备 DOX、MMC 和 DOXol 的工作标准, 以及4亩 (行列).
- 分别称1毫克的 DOX 和 MMC 药粉 (警告) 和4亩的新鲜小称量纸 (3 x 3 英寸 2 )。 注意所有抗癌药物都被认为是一种健康危害, 在吸入或吞食时会导致急性毒性和生殖细胞致突变性。他们应该小心处理手套和口罩.
- 将称重的 DOX、MMC 和4μ转换为新的1.5 毫升聚丙烯微离心管.
- 添加1毫升的冰毒与和涡流简要地获得1毫克/毫升浓度的 DOX 和 MMC.
- 将1毫升甲醇加入含有称量1毫克 DOXol (谨慎) 和涡流的小瓶中, 以获得1毫克/毫升浓度的 DOXol.
注: DOXol 是一种有氧代谢产物, 应小心处理. - 吸管20和 #181; DOX、MMC、DOXol 和4亩的库存溶液, 制成新的独立1.5 毫升聚丙烯微离心管, 并添加980和 #181; 甲醇 l, 以获得20和 #181 的工作标准; 每种药物的克/毫升.
- 稀释20和 #181; 使用甲醇 DOX、mmc 和 DOXol 的 g/毫升, 以获得 50 ng-20 和 #181 的工作标准; DOX、mmc 和 DOXol 的 g/毫升, 行列 4-MU 的 2000 ng/毫升.
- 将工作溶液管的盖子密封在一个窄的石蜡膜覆盖层上, 以防止甲醇蒸发, 用铝箔包裹整个管子, 以避免暴露在-20 和 #176 上的直射光和贮存处.
- 确定生物矩阵中 DOX、MMC 和 DOXol 的线性度、精度和准确性 ( 即, 全血和肿瘤匀浆).
- 同时钉5和 #181; L DOX 和 DOXol 的工作标准 (50 ng/毫升-20 和 #181; g/毫升), MMC (1000 ng/毫升-16 和 #181; 克/毫升), 和4亩 (2 和 #181; g/毫升) 到50和 #181; 全血或组织匀浆在聚丙烯微离心管中的研究获得标准浓度曲线, 范围从 5-2000 ng/毫升为药物化合物和 200 ng/毫升为4亩 (行列).
- 执行协议1.2 中描述的药物提取试验.
- 使用低、中值和高浓度的 DOX 和 DOXol (50、500和 2000 ng/毫升) 和 MMC (100、1000、2000 ng/毫升), inter-day 精度和准确度.
注: 在分析当天准备新的标准浓度.
- 分析示例
- 注入15和 #181; L 使用样.
- 逐渐将移动阶段更改为0到18分钟, 从而在间隔时间内增加 ACN 的组成.
- 18 分钟后, 保持移动阶段条件为1分钟.
- 返回到下一个2分钟的初始状态, 然后在下一次注入之前 re-equilibrate 4 分钟.
- 在每个样本运行后, 请注意, 药物化合物的峰值及其保留时间如下所示: MMC、DOXol、4亩 (行列) 和 DOX.
- 使用 HPLC 软件将药物化合物的峰值面积与曲线 (联合自卫) 相结合.
- 计算单个药物化合物和行列 (方程式 1) 之间的联合自卫比, 并使用在相同提取程序下制备的标准曲线来确定 DMPLN 制剂中 DOX、MMC 和 DOXol 的药物浓度.
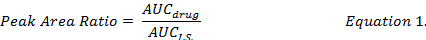
- 计算药物回收率百分比 (公式 2), 方法是通过将从尖刺生物样品提取物中回收的药物浓度与此相比较,的标准 (#34; #34;) 药物溶液中的甲醇.
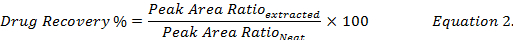
结果
两种抗癌药物, DOX 和 MMC, 以及 DOX 代谢物, DOXol, 同时检测没有任何生物干扰在相同的应用梯度 HPLC 条件下使用4亩作为行列的荧光和紫外线探测器。DOX, mmc, DOXol 和4亩分离从彼此的保留时间为5.7 分钟的 MMC, 10.4 分钟 DOXol, 10.9 分钟4亩, 11.1 分钟 DOX (图 2)。全血和各种组织中的每种药物都显示了相关系数的浓度线性 (R2), 范围从0.98 到 1.00 (<...
讨论
与其他能同时检测单一药物种类的色谱方法相比, 目前的 HPLC 协议能够同时定量三药物化合物 (DOX、MMC 和 DOXol) 在同一生物基质中, 无需改变移动阶段。这种制备和分析方法已成功地应用于确定两个纳米药物传递系统 (即脂质体 DOX 和 DMPLN) 的药代动力学和生物分布,22。由于乙二醇纳米颗粒可延长负载药物的全身循环, 从而在很长一段时间 (#62; 24 h) 中产生高血药浓度, ?...
披露声明
作者没有相互竞争的金融利益和利益冲突。
致谢
作者衷心感谢加拿大自然科学与工程研究理事会 ( NSERC ) 为高效液相色谱 , 加拿大卫生研究院 ( 研究院 ) 和加拿腺癌研究 ( CBCR ) 提供的手术补助金。加盟 x.y.z 吴, 和多伦多大学奖学金 R.X. 张和 t。
材料
| Name | Company | Catalog Number | Comments |
| Doxorubicin | Polymed Theraeutics | 111023 | Anticancer drug |
| Mitomycin C | Polymed Theraeutics | 060814 | Anticancer drug |
| Doxorubicinol (DOXol) | Toronto Research Chemicals | D558020 | Metabolite of DOX |
| 4-Methylumbelliferone sodium salt | Sigma-Aldrich | M1508 | Internal standard |
| Myristic Acid | Sigma-Aldrich | 544-63-8 | Materials for poly-lipid hybrid nanoparticles |
| Polyoxyethylene (100) Stearate | Spectrum | M1402 | Materials for poly-lipid hybrid nanoparticles |
| Polyoxyethylene (40) Stearate | Sigma-Aldrich | P3440 | Materials for poly-lipid hybrid nanoparticles |
| Pluronic F68 (PF68) | BASF Corp. | 9003-11-6 | Materials for poly-lipid hybrid nanoparticles |
| Ultrasonication (UP100H) | Hielscher, Ultrasound Technology | NA | Nanoparticle preparation |
| Water Bath (ISOTEMP 3016HS) | Fisher Scientific | NA | Nanoparticle preparation |
| Liposomal Doxorubicin (Caelyx) | Janssen | Purchased from the pharmacy Princess Margaret Hospital | Clinically-approved nanoparticle formulation |
| HPLC-graded Methanol | Caledon Chemicals | 6701-7-40 | HPLC mobile phase composition |
| HPLC-graded H2O | Caledon Chemicals | 8801-7-40 | HPLC mobile phase composition |
| HPLC-graded Acetonitrile | Caledon Chemicals | 1401-7-40 | HPLC mobile phase composition |
| Trifluoroacetic Acid | Sigma-Aldrich | 302031 | HPLC mobile phase composition |
| 0.45 μm Nylon Membrane Filter Paper | Whatman | WHA7404004 | HPLC mobile phase preparation |
| 1cc Plastic Syringes | Becton, Dickinson and Company | 2606-309659 | Treatment injection |
| 5cc Plastic Syringes | Becton, Dickinson and Company | 2608-309646 | Tissue collections |
| 30G 1/2 Needles | Becton, Dickinson and Company | 305106 | Treatment injection |
| 25G 5/8 Needles | Becton, Dickinson and Company | 305122 | Tissue collections |
| Sterile 0.9% Saline | Univeristy of Toronto House Brand | 1011 | Tissue perfusion |
| 13 ml Rounded-bottom conical tube | SARSTEDT | 62.515.006 | Prolyprolene, tissue homogenization |
| Alpha Minimum Essential Medium (MEM) | Gibco | 12571063 | Cell medium |
| 1 x Phosphate Buffer Saline | Gibco | 10010023 | Tissue homogenization |
| Triton X-100 | Sigma-Aldrich | X100-100 ML | Tissue homogenization |
| Formic acid | Caledon Chemicals | 1/5/3840 | Adjust pH for extraction solvent |
| Sodium heparin sprayed plastic tubes | Becton, Dickinson and Company | 367878 | Blood collection |
| Analytical Weigh Balance | Sartorius | CPA225D | NA |
| pH meters | Fisher Scientific | 13-637-671 | accumet BASIC |
| Vortex Mixter | Fisher Scientific | 02-215-365 | Vortexing samples at desired speed |
| 1.5 ml Microcentrifuge Tube | Fisherbrand | 2043-05408129 | Prolyprolene |
| Model 1000 homogenizer | Fisher Scientific | 08-451-672 | Tissue homogenization |
| Centrifuge 5702R | Eppendorf | 5702R | Extraction preparation |
| Heated Evaporator System | Glas-Col | NA | Sample reconstitution |
| HPLC Screw Thread Vials | DIKMA | 5320 | HPLC sample injection |
| HPLC Screw Caps with PTFE White Silicone Septa | DIKMA | 5325 | HPLC sample injection |
| HPLC Polypropylene Insert | Agilent Technologies | 5182-0549 | Maximum volume 250 μl, HPLC sample injection |
| Xbridge C18 Column | Waters Corporation | 186003117 | Drug analysis |
| Gradient pump | Waters Corporation | W600 | Drug analysis |
| Auto-sampler | Waters Corporation | W2707 | Drug analysis |
| Photodiode array detector | Waters Corporation | W2998 | Drug analysis |
| Multi λ fluoresence detector | Waters Corporation | W2475 | Drug analysis |
| EMPOWER 2 | Waters Corporation | NA | Data analysis software |
| Scientist | Micromath | NA | Pharmacokinetic analysis |
| Female Balb/c Mice | Jackson Laboratory | 001026 | In vivo |
| EMT6/WT Breast Cancer Cells | Provided by Dr. Ian Tannock; Ontario Cancer Institute | NA | In vivo |
参考文献
- Holohan, C., Van Schaeybroeck, S., Longley, D. B., Johnston, P. G. Cancer Drug Resistance: An Evolving Paradigm. Nat. Rev. Cancer. 13 (10), 714-726 (2013).
- Szakacs, G., Paterson, J. K., Ludwig, J. A., Booth-Genthe, C., Gottesman, M. M. Targeting Multidrug Resistance in Cancer. Nat Rev Drug Discov. 5 (3), 219-234 (2006).
- Kong, A. -. N. T., Kong, A. .. N. .. T. .. ,. . Inflammation, Oxidative Stress, and Cancer: Dietary Approaches for Cancer Prevention. , (2013).
- Zhang, R. X., Wong, H. L., Xue, H. Y., Eoh, J. Y., Wu, X. Y. Nanomedicine of Synergistic Drug Combinations for Cancer Therapy - Strategies and Perspectives. J Control Release. 240, 489-503 (2016).
- Webster, R. M. Combination Therapies in Oncology. Nat. Rev. Drug. Discov. 15 (2), 81-82 (2016).
- Waterhouse, D. N., Gelmon, K. A., Klasa, R., Chi, K., Huntsman, D., Ramsay, E., Wasan, E., Edwards, L., Tucker, C., Zastre, J., Wang, Y. Z., Yapp, D., Dragowska, W., Dunn, S., Dedhar, S., Bally, M. B. Development and Assessment of Conventional and Targeted Drug Combinations for Use in the Treatment of Aggressive Breast Cancers. Curr Cancer Drug Targets. 6 (6), 455-489 (2006).
- Cancello, G., Bagnardi, V., Sangalli, C., Montagna, E., Dellapasqua, S., Sporchia, A., Iorfida, M., Viale, G., Barberis, M., Veronesi, P., Luini, A., Intra, M., Goldhirsch, A., Colleoni, M. Phase Ii Study with Epirubicin, Cisplatin, and Infusional Fluorouracil Followed by Weekly Paclitaxel with Metronomic Cyclophosphamide as a Preoperative Treatment of Triple-Negative Breast Cancer. Clin Breast Cancer. 15 (4), 259-265 (2015).
- Masuda, N., Higaki, K., Takano, T., Matsunami, N., Morimoto, T., Ohtani, S., Mizutani, M., Miyamoto, T., Kuroi, K., Ohno, S., Morita, S., Toi, M. A Phase Ii Study of Metronomic Paclitaxel/Cyclophosphamide/Capecitabine Followed by 5-Fluorouracil/Epirubicin/Cyclophosphamide as Preoperative Chemotherapy for Triple-Negative or Low Hormone Receptor Expressing/Her2-Negative Primary Breast Cancer. Cancer Chemother Pharmacol. 74 (2), 229-238 (2014).
- Carrick, S., Parker, S., Thornton, C. E., Ghersi, D., Simes, J., Wilcken, N. Single Agent Versus Combination Chemotherapy for Metastatic Breast Cancer. Cochrane Database Syst Rev. 15 (2), 003372 (2009).
- Cardoso, F., Bedard, P. L., Winer, E. P., Pagani, O., Senkus-Konefka, E., Fallowfield, L. J., Kyriakides, S., Costa, A., Cufer, T., Albain, K. S., Force, E. -. M. T. International Guidelines for Management of Metastatic Breast Cancer: Combination Vs Sequential Single-Agent Chemotherapy. J Natl Cancer Inst. 101 (17), 1174-1181 (2009).
- Alba, E., Martin, M., Ramos, M., Adrover, E., Balil, A., Jara, C., Barnadas, A., Fernandez-Aramburo, A., Sanchez-Rovira, P., Amenedo, M., Casado, A. Multicenter Randomized Trial Comparing Sequential with Concomitant Administration of Doxorubicin and Docetaxel as First-Line Treatment of Metastatic Breast Cancer: A Spanish Breast Cancer Research Group (Geicam-9903) Phase Iii. J Clinn Oncol. 22 (13), 2587-2593 (2004).
- Sadat, S. M., Saeidnia, S., Nazarali, A. J., Haddadi, A. Nano-Pharmaceutical Formulations for Targeted Drug Delivery against Her2 in Breast Cancer. Curr. Cancer Drug Targets. 15 (1), 71-86 (2015).
- Devadasu, V. R., Wadsworth, R. M., Ravi Kumar, M. N. V. Tissue Localization of Nanoparticles Is Altered Due to Hypoxia Resulting in Poor Efficacy of Curcumin Nanoparticles in Pulmonary Hypertension. Eur. J. Pharm. Biopharm. 80 (3), 578-584 (2012).
- Li, S. D., Huang, L. Pharmacokinetics and Biodistribution of Nanoparticles. Mol. Pharm. 5 (4), 496-504 (2008).
- Zhang, R. X., Ahmed, T., Li, L. Y., Li, J., Abbasi, A. Z., Wu, X. Y. Design of Nanocarriers for Nanoscale Drug Delivery to Enhance Cancer Treatment Using Hybrid Polymer and Lipid Building Blocks. Nanoscale. 9 (4), 1334-1355 (2017).
- Wang, X., Li, S., Shi, Y., Chuan, X., Li, J., Zhong, T., Zhang, H., Dai, W., He, B., Zhang, Q. The Development of Site-Specific Drug Delivery Nanocarriers Based on Receptor Mediation. J. Control. Release. 193, 139-153 (2014).
- Batist, G., Gelmon, K. A., Chi, K. N., Miller, W. H., Chia, S. K., Mayer, L. D., Swenson, C. E., Janoff, A. S., Louie, A. C. Safety, Pharmacokinetics, and Efficacy of Cpx-1 Liposome Injection in Patients with Advanced Solid Tumors. Clin Cancer Res. 15 (2), 692-700 (2009).
- Mayer, L. D., Harasym, T. O., Tardi, P. G., Harasym, N. L., Shew, C. R., Johnstone, S. A., Ramsay, E. C., Bally, M. B., Janoff, A. S. Ratiometric Dosing of Anticancer Drug Combinations: Controlling Drug Ratios after Systemic Administration Regulates Therapeutic Activity in Tumor-Bearing Mice. Mol. Cancer Ther. 5 (7), 1854-1863 (2006).
- Prasad, P., Cheng, J., Shuhendler, A., Rauth, A. M., Wu, X. Y. A Novel Nanoparticle Formulation Overcomes Multiple Types of Membrane Efflux Pumps in Human Breast Cancer Cells. Drug Deliv Transl Res. 2 (2), 95-105 (2012).
- Shuhendler, A. J., Cheung, R. Y., Manias, J., Connor, A., Rauth, A. M., Wu, X. Y. A Novel Doxorubicin-Mitomycin C Co-Encapsulated Nanoparticle Formulation Exhibits Anti-Cancer Synergy in Multidrug Resistant Human Breast Cancer Cells. Breast Cancer Res Treat. 119 (2), 255-269 (2010).
- Shuhendler, A. J., O'Brien, P. J., Rauth, A. M., Wu, X. Y. On the Synergistic Effect of Doxorubicin and Mitomycin C against Breast Cancer Cells. Drug Metabol. Drug Interact. 22 (4), 201-233 (2007).
- Zhang, R. X., Cai, P., Zhang, T., Chen, K., Li, J., Cheng, J., Pang, K. S., Adissu, H. A., Rauth, A. M., Wu, X. Y. Polymer-Lipid Hybrid Nanoparticles Synchronize Pharmacokinetics of Co-Encapsulated Doxorubicin-Mitomycin C and Enable Their Spatiotemporal Co-Delivery and Local Bioavailability in Breast Tumor. Nanomedicine. 12 (5), 1279-1290 (2016).
- Zhang, T., Prasad, P., Cai, P., He, C., Shan, D., Rauth, A. M., Wu, X. Y. Dual-Targeted Hybrid Nanoparticles of Synergistic Drugs for Treating Lung Metastases of Triple Negative Breast Cancer in Mice. Acta Pharmacol Sin. , 1-13 (2017).
- Shuhendler, A. J., Prasad, P., Zhang, R. X., Amini, M. A., Sun, M., Liu, P. P., Bristow, R. G., Rauth, A. M., Wu, X. Y. Synergistic Nanoparticulate Drug Combination Overcomes Multidrug Resistance, Increases Efficacy, and Reduces Cardiotoxicity in a Nonimmunocompromised Breast Tumor Model. Mol Pharm. 11 (8), 2659-2674 (2014).
- Prasad, P., Shuhendler, A., Cai, P., Rauth, A. M., Wu, X. Y. Doxorubicin and Mitomycin C Co-Loaded Polymer-Lipid Hybrid Nanoparticles Inhibit Growth of Sensitive and Multidrug Resistant Human Mammary Tumor Xenografts. Cancer Lett. 334 (2), 263-273 (2013).
- Rafiei, P., Michel, D., Haddadi, A. Application of a Rapid Esi-Ms/Ms Method for Quantitative Analysis of Docetaxel in Polymeric Matrices of Plga and Plga-Peg Nanoparticles through Direct Injection to Mass Spectrometer. Am. J. Anal. Chem. 6 (2), 164-175 (2015).
- Daeihamed, M., Haeri, A., Dadashzadeh, S. A Simple and Sensitive Hplc Method for Fluorescence Quantitation of Doxorubicin in Micro-Volume Plasma: Applications to Pharmacokinetic Studies in Rats. Iran. J. Pharm. Res. 14, 33-42 (2015).
- Alhareth, K., Vauthier, C., Gueutin, C., Ponchel, G., Moussa, F. Hplc Quantification of Doxorubicin in Plasma and Tissues of Rats Treated with Doxorubicin Loaded Poly(Alkylcyanoacrylate) Nanoparticles. J. Chromatogr. B Analyt. Technol. Biomed. Life Sci. 887-888, 128-132 (2012).
- Al-Abd, A. M., Kim, N. H., Song, S. C., Lee, S. J., Kuh, H. J. A Simple Hplc Method for Doxorubicin in Plasma and Tissues of Nude Mice. Arch Pharm Res. 32 (4), 605-611 (2009).
- Loadman, P. M., Calabrese, C. R. Separation Methods for Anthraquinone Related Anti-Cancer Drugs. J. Chromatogr. B Biomed. Sci. Appl. 764 (1-2), 193-206 (2001).
- Zhang, Z. D., Guetens, G., De Boeck, G., Van Cauwenberghe, K., Maes, R. A., Ardiet, C., van Oosterom, A. T., Highley, M., de Bruijn, E. A., Tjaden, U. R. Simultaneous Determination of the Peptide-Mitomycin Kw-2149 and Its Metabolites in Plasma by High-Performance Liquid Chromatography. J. Chromatogr. B Biomed. Sci. Appl. 739 (2), 281-289 (2000).
- Alvarez-Cedron, L., Sayalero, M. L., Lanao, J. M. High-Performance Liquid Chromatographic Validated Assay of Doxorubicin in Rat Plasma and Tissues. J. Chromatogr. B Biomed. Sci. Appl. 721 (2), 271-278 (1999).
- Paroni, R., Arcelloni, C., De Vecchi, E., Fermo, I., Mauri, D., Colombo, R. Plasma Mitomycin C Concentrations Determined by Hplc Coupled to Solid-Phase Extraction. Clin. Chem. 43 (4), 615-618 (1997).
- Song, D., Au, J. L. Direct Injection Isocratic High-Performance Liquid Chromatographic Analysis of Mitomycin C in Plasma. J Chromatogr B Biomed Appl. 676 (1), 165-168 (1996).
- Schrijvers, D. Role of Red Blood Cells in Pharmacokinetics of Chemotherapeutic Agents. Clin. Pharmacokinet. 42 (9), 779-791 (2003).
- Colombo, T., Broggini, M., Garattini, S., Donelli, M. G. Differential Adriamycin Distribution to Blood Components. Eur. J. Drug Metab. Pharmacokinet. 6 (2), 115-122 (1981).
- Maeda, H., Nakamura, H., Fang, J. The Epr Effect for Macromolecular Drug Delivery to Solid Tumors: Improvement of Tumor Uptake, Lowering of Systemic Toxicity, and Distinct Tumor Imaging in Vivo. Adv. Drug Deliv. Rev. 65 (1), 71-79 (2013).
- Gustafson, D. L., Rastatter, J. C., Colombo, T., Long, M. E. Doxorubicin Pharmacokinetics: Macromolecule Binding, Metabolism, and Excretion in the Context of a Physiologic Model. J. Pharm. Sci. 91 (6), 1488-1501 (2002).
- Gabizon, A., Shiota, R., Papahadjopoulos, D. Pharmacokinetics and Tissue Distribution of Doxorubicin Encapsulated in Stable Liposomes with Long Circulation Times. J. Natl. Cancer Inst. 81 (19), 1484-1488 (1989).
- Motlagh, N. S., Parvin, P., Ghasemi, F., Atyabi, F. Fluorescence Properties of Several Chemotherapy Drugs: Doxorubicin, Paclitaxel and Bleomycin. Biomed Opt Express. 7 (6), 2400-2406 (2016).
- Mohan, P., Rapoport, N. Doxorubicin as a Molecular Nanotheranostic Agent: Effect of Doxorubicin Encapsulation in Micelles or Nanoemulsions on the Ultrasound-Mediated Intracellular Delivery and Nuclear Trafficking. Mol Pharm. 7 (6), 1959-1973 (2010).
- Cielecka-Piontek, J., Jelińska, A., Zając, M., Sobczak, M., Bartold, A., Oszczapowicz, I. A Comparison of the Stability of Doxorubicin and Daunorubicin in Solid State. J. Pharm. Biomed Anal. 50 (4), 576-579 (2009).
- Gilbert, C. M., McGeary, R. P., Filippich, L. J., Norris, R. L. G., Charles, B. G. Simultaneous Liquid Chromatographic Determination of Doxorubicin and Its Major Metabolite Doxorubicinol in Parrot Plasma. J. chromatogr. B Analyt. Technol. Biomed. Life sci. 826 (1-2), 273-276 (2005).
- Liu, Z. S., Li, Y. M., Jiang, S. X., Chen, L. R. Direct Injection Analysis of Mitomycin C in Biological Fluids by Multidemension High Performance Liquid Chromatography with a Micellar Mobile Phase. J. Liq. Chromatogr. Relat. Technol. 19 (8), 1255-1265 (1996).
- Zhou, Y., He, C., Chen, K., Ni, J., Cai, Y., Guo, X., Wu, X. Y. A New Method for Evaluating Actual Drug Release Kinetics of Nanoparticles inside Dialysis Devices Via Numerical Deconvolution. J. Control. Release. 243, 11-20 (2016).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。