Method Article
rna 下拉法识别长非编码 rna 的 rna 靶点
摘要
这种 rna 下拉法允许识别长的非编码 rna (lncRNA) 的 rna 目标。根据自制的、设计的抗感 DNA 寡核苷酸探针的杂交, 在适当的固定组织或细胞系 lncRNA, 它有效地允许捕获 lncRNA 的所有 RNA 目标。
摘要
长的非编码 rna (lncRNA), 这是200多个核苷酸序列没有一个定义的阅读框架, 属于监管非编码 rna 的家庭。虽然它们的生物学功能仍然很不为人知, 但这些 lncRNAs 的数量稳步增加, 现在估计人类可能有超过1万份这样的成绩单。其中一些已知参与了基因表达的重要调控途径在转录水平发生, 但也在不同的步骤 RNA 合作和转录后成熟。在后一种情况下, lncRNA 所针对的 rna 必须确定。这就是为什么它是有用的, 开发一种方法, 使识别的 rna 直接或间接相关 lncRNA 的利益。
本议定书的灵感来自于以前发布的协议, 允许隔离 lncRNA 及其相关的染色质序列, 以允许隔离相关 rna。我们确定, 两个步骤对本议定书的效率至关重要。首先是设计特定的抗感 DNA 寡核苷酸探针, 能够杂交到 lncRNA 的兴趣。为此, 利用生物信息学预测了 lncRNA 二次结构, 反感寡核苷酸探针的设计具有很强的亲和性, 对显示内部基配对概率低的区域具有强烈的亲和力。该程序的第二个关键步骤依赖于组织或培养细胞的固定条件, 必须在所有分子伙伴之间保持网络。加上高通量 rna 测序, 这个 rna 下拉协议可以提供整个 rna interactome 的 lncRNA 的兴趣。
引言
这里描述的方法的总体目标是识别长非编码 rna (lncRNA) 的 rna 分子伙伴。LncRNA 对应于200多个核苷酸序列, 没有定义的阅读框架。其中一些已被证明参与基因表达调控, 不仅在转录水平, 而且在不同的步骤 RNA 合作和转录后成熟。在后一种情况下, lncRNA 的分子伙伴是要鉴定的 rna。因此, 建立一种能够直接或间接与 lncRNA 相关的 rna 的识别方法是必不可少的。
以前发布的方法, 例如由 rna 纯化 (啁啾)1,2和捕获杂交分析 rna 目标 (图表)3,4的染色质分离, 允许高通量发现特定 lncRNA 的 RNA 束缚蛋白和基因组结合点。在这两种方法中, lncRNA 首先与生物素化互补寡核苷酸杂交, 然后用链亲和素珠分离复合物。这两种技术的主要区别与目标 lncRNAs 的探头设计有关。啁啾, 由 RNA 鱼启发的策略, 包括设计一池短互补 DNA 寡核苷酸探针, 以平铺整个 lncRNA 的长度。相比之下, 在图表中, 作者对 lncRNAs 的 RNase H 映射法进行了修改, 以探测可用于杂交的地点。
在这里提出的设计抗感 DNA 生物素化寡核苷酸探针的程序使用 lncRNA 二级结构的生物信息学建模5 选择具有强烈亲和力的探测器, 该区域显示内部的低概率基配对。此过程的优点是比基于 RNAse-H 灵敏度4的平铺寡核苷酸探针2和更少的时间消耗的池更便宜。
由于 lncRNAs6对转录后基因调控有越来越多的证据, 因此开发一种能够捕获作为 lncRNA 目标的 rna 的方法非常有用。此外, 对于大多数应用来说, 这种方法在培养细胞和组织提取物中都得到了优化。
研究方案
所有程序都严格按照欧洲经济共同体的规定进行, 以照顾和使用实验动物 (86/609/欧洲经济共同体和 2010/63/UE), 并根据授予 d. Becquet (Préfecture des Bouches, 授权 13-002) 的许可证。
1. 探头设计
-
使用 lncRNA 的主要序列, 在 "RNAstructure web 服务器"5上生成其辅助结构。
注意: 在这个站点上, 可以使用不同的算法。为探头设计提供最佳结果的三预测工具是: "折叠" (最低自由能结构)、"MaxExpect" (高度可能的基对) 和 "Probnot" (可能的基对包括伪结)。这三分析可以进行和比较。还可以使用其他 web 服务器, 如维也纳 RNA websuite7。- 选择显示内部基对的低概率的区域, 并设计具有与这些区域具有强烈亲和力的25基的反感寡核苷酸探针。
注: 这些探头的 GC 内容应包括在40和60% 之间。使用对齐搜索工具 (冲击波), 确保所选的反感觉寡核苷酸探针不能识别在所选细胞系统中表达的其他 RNA 中的核苷酸序列。
- 选择显示内部基对的低概率的区域, 并设计具有与这些区域具有强烈亲和力的25基的反感寡核苷酸探针。
- 也设计了一个非特定的 DNA 寡核苷酸探针的25个基地, 这显示不亲和 lncRNA 的兴趣和其他 RNA 序列的兴趣基因组。
- 在 3 ' 端订购探针与生物素。
注意: 为了减少空间障碍, 寡核苷酸和生物素之间的距离必须增加 triethyleneglycerol 间隔。为了获得最佳结果, 并能够评估下拉效果的特殊性, 建议设计3种不同的反感觉寡核苷酸探针, 然后进行实验比较其效率。
2. 交联
-
培养细胞交联
- GH4C1 sommatolactotroph 垂体细胞在火腿 F10 培养基中的培养, 辅以15% 匹马血清和2% 胎小牛血清。在78.5 厘米2培养板中汇合, 直到细胞生长。这大约对应于 1 x 107单元格。
- 从汇合的 GH4C1 78.5 厘米2培养板中取出细胞培养基, 然后用1x 冲洗磷酸盐缓冲盐水 (PBS) 的培养基容积。
- 在 PBS (10 毫升为 78.5 cm2菜) 修复细胞与1% 多聚甲醛解决方案;此解决方案必须从4% 多聚甲醛库存解决方案中新的准备。在室温下搅拌10分钟的交叉连接。
注意: 多聚甲醛 (粉煤灰) 是有毒的, 必须小心处理。 - 通过加入1/10 量甘氨酸1.25 米 (1 毫升每10毫升的多聚甲醛溶液) 来淬火多聚甲醛的作用;在 RT 中搅动5分钟。
- 用吸尘法丢弃介质, 冲洗两次 (5 分钟), 1X 的 PBS 介质体积。
- 添加一体积的 PBS 对应于 1/第十的介质体积, 收集细胞与一个细胞刮刀, 然后转移到离心管。
- 以510克为4摄氏度旋转5分钟。
- 尽可能多地清除上清。
- 按需要在-80 摄氏度处无限期贮存颗粒。
-
组织交联
- 将5毫克新鲜获得的小鼠垂体腺组织在 PBS 中稀释的1% 多聚甲醛溶液中 (大约10x 的组织体积), 在 RT 中鼓动10分钟。
- 通过加入一个1.25M 甘氨酸溶液 (1 毫升每10毫升多聚甲醛溶液) 和鼓动5分钟在 RT 多聚甲醛行动。
- 用吸尘法丢弃介质, 用 PBS 冲洗两次 (大约10x 的组织体积)。尽可能多地清除上清。
- 将交联组织无限期地存放在-80 摄氏度。
3. 细胞或组织裂解
- 制备裂解缓冲液 (50 毫米三盐酸 pH 7.0, 10 毫米 EDTA, 1% SDS 补充 RNAse 抑制剂溶液的 200 U/毫升, 以及蛋白酶抑制剂5µL/毫升的鸡尾酒)。
- 要获得裂解样品而不先解冻, 重新悬浮细胞小球或交联组织与这个缓冲 (大约1毫升每100毫克的细胞颗粒或组织)。从 1 x 107细胞获得的细胞颗粒产生了含有大约20毫克蛋白质的裂解样品。
注: 根据所使用的组织, 应增加机械中断的步骤。在这种情况下, 重要的是要避免加热的样品在这个额外的步骤。
4. 超声波
-
超声波条件的优化
- 节目 sonicator 与2到5系列三十年代和三十年代。
- 对稀释后的裂解样品 (稀释因子½或¼对应于大约10或5毫克蛋白质) 进行试验以优化超声波条件。在4°c 水浴中放置稀释的裂解样品, 开始超声波系列。
- 用 rna 纯化试剂盒或 rna 隔离试剂 (例如, Trizol) 纯化 rna。
- 在1% 琼脂糖凝胶电泳中载入纯化 rna 的整体, 检查 rna 片段的长度。此长度应介于200和 800 bp 之间。
注意: 根据 RNA 片段大小, 反感觉寡核苷酸探针的效率可能会有所不同。建议在不同的超声波条件下检查探头的效率。
-
裂解样品的超声波
- 在4°c 水浴中放置相应于20毫克蛋白质 (在步骤3.2 之后获得) 的裂解样本, 并开始在步骤4.1 中优化的超声波系列。
- 紧接超声波后, 离心机为5分钟, 在1.2万克4摄氏度。在新的离心管中转移上清液。
注意: 为了确保同质性, 复制上清液可以在这个步骤中进行汇总和重新分发。
5. RNA 下拉
-
1天-杂交步骤
- 添加2容量的杂交缓冲 (50 毫米三盐酸 pH 7.0, 750 毫米氯化钠, 1 毫米 EDTA, 1% SDS, 15% 甲酰胺添加即兴) 上清液收集后超声波步骤。涡。
- 转移20µL 的每个样品在离心管 (输入样品) 和存储在-20 °c。
- 添加 100 pmol 的生物素化寡核苷酸探针 (具体或非特定; 请参见表 1) 到每个示例。在 RT 的管转子中, 在适度搅拌下孵育4至6小时。
- 添加50µL 磁性链亲和素珠补充与 200 U/毫升的 RNAse 抑制剂溶液和鸡尾酒的蛋白酶抑制剂5µL/毫升。
- 在温和的搅拌下, 在 RT 的管转子上孵化过夜。
-
2天-RNA 隔离步骤
- 使用磁支持, 以分离的珠子从细胞裂解, 丢弃上清, 并洗涤珠900µL 洗涤缓冲 (SDS 0.5%, SSC 2x)。重复5次穿插5分钟的躁动在转子上 RT。
- 最后一次洗涤后, 醒酒最后一次, 并添加95µL 的 Proteinease k 缓冲 (10 毫米三 HCl pH 7.0, 100 毫米氯化钠, 1 毫米 EDTA, 0.5% SDS) 和5µL 蛋白酶 K (20 毫克/毫升) 的样品。
- 在冰上, 解冻输入样品 (20 ul) 和添加75µL 的 Proteinease K 缓冲器和5µL 蛋白酶 k (20 毫克/毫升)。
- 以蛋白酶 K 为45分钟孵育所有样品, 50 摄氏度, 10 分钟95摄氏度。
- 将样品放在冰上冷却3分钟, 然后用磁性支架将珠子与 rna 分离。保持上清, 丢弃珠子。
- 用 rna 纯化试剂盒纯化 rna, 其中包括 DNA 消化步骤。储存 rna 在-80 °c。
- 使用 rt 套件执行反向转录 qPCR (rt qPCR), 后跟 qPCR 使用特定引物 (表 1)。
- 构造两个与每个特定的 Neat1 探针 (表 1) 获得的两个 RNA 池对应的 DNA 库。对下一代测序系统进行排序。
结果
最近的几项研究表明, lncRNAs 在几乎每一个重要的生物学过程中都扮演着重要的角色, 并且通过控制基因表达在转录和转录后的水平来实现这个角色。显示在后一种情况下, rna 可能是 lncRNAs6的目标。
lncRNA 核丰富的记录 1 (Neat1) 涉及不同的 neuropathologies, 如额颞部痴呆, 肌萎缩侧索硬化症, 或癫痫8, 9, 10, 也是 misregulated在不同的癌症中11,12。
这个 lncRNA 也被称为特定核体的结构成分, paraspeckles, 并参与转录后的昼夜节律调节基因表达式13。Paraspeckles 发现在每个细胞核和形成周围不仅 Neat1, 这是必要的, 他们的形成, 但也围绕几个 RNA 结合蛋白 (限制性)14, 确实知道能够保留 RNA 目标在核15.paraspeckles 的形成是通过不同成分的关联来实现的。这一形成显示了一个昼夜节律的模式, 驱动一个有节奏的核保留 RNA 目标13。rna 目标的核保留通过 paraspeckles 可能发生通过结合到限制性或直接地通过 rna 或 rna 协会, 但 paraspeckles 的目标 rna 的范围必须确定。为了识别由 Neat1 直接或间接靶向的 rna, 设计了一种 rna 拉下协议, 它允许在培养的细胞以及组织样本中分离和鉴定所有 Neat1 rna 靶 (参见图 1以实现图形化技术的介绍)。
该协议也成功地用于鉴定另一个 lncRNA 转移相关的肺腺癌转录 1 (Malat1) 的 RNA 靶点。Malat1 是一个高度保守和表达 lncRNA 发现在核斑点连同几个 RNA 剪接因素。Malat1 已知参与了对几个新生的前 mRNA16、17的拼接的调节。
使用此处描述的探针设计策略生成了特定的 (如此) 和非特定的寡核苷酸 (国家统计局) 探针。该策略依赖于区域的选择, 它们显示了 lncRNA 的二次结构所预测的内部基配对的低概率, 以及对这些区域具有强烈亲和力的特定探头的设计。作为这些生物信息学预测的一个代表性结果, 在图 2中给出了一个 Neat1 序列 (核苷酸1480到 2000) 的预测二级结构的图片以及两个设计好的探测器的位置。
设计的探针被定向到大鼠 Neat1 或 Malat1 的 GH4C1 培养细胞和小鼠 Neat1 垂体组织提取物 (表 1)。Neat1 或 Malat1 的相对富集计算为相对于输入样品的非特定和特定探针。图 3显示了在大鼠 GH4C1 垂体细胞线 (图 3A) 和小鼠垂体组织提取物 (图 3B) 中下拉 Neat1 的特定探针的效率。当使用探针设计协议生成特定的寡核苷酸 (因此) 探头定向到 Malat1 时, 获得了一个有效的探针, 而另一个效率不够, 被丢弃 (图 4A)。
在 RNA 下拉程序之后, qPCR 实验, 一些 rna 评估与特定引物 (表 1) 被证明是与 Neat1 或 Malat1 在 GH4C1 提取。GH4C1 细胞提取物中与 Neat1 相关的 rna 也被证明与垂体组织提取物中的 Neat1 相关。事实上, 在 Neat1 RNA 拉下后, Malat1 被发现是 Neat1 在 GH4C1 细胞系和垂体小鼠组织提取物 (图 5A) 中的目标。在 GH4C1 细胞 (图 4B) 中使用特定探针执行 Malat1 RNA 下拉后, Neat1 显著丰富。通过突出两个 lncRNAs 之间的密切关系, 这些结果与 Malat1 挖空鼠标建议的 Neat1 和 Malat1 在 Neat1 RNA 表达式18,中显示变化的潜在的协同调节作用相一致.19. 在 GH4C1 细胞和垂体的 Neat1 RNA 下拉下后, 两种主要垂体激素、生长激素 (Gh) (图 5B) 和催乳素 (图 5C) 的转录记录显著丰富。提取物, 暗示可能的调节两种激素的 Neat1。在比较所使用的两个特定探头时, 它们的效率可能因所考虑的 RNA 目标而异 (图 5B和图 5C)。这些结果突出了设计几种特定探针的必要性, 以选择那些不仅显示了 lncRNA 的最佳效率, 而且在其 RNA 靶的富集上具有最佳的效率。
rna 下拉法还可以跟随 rna 高通量测序, 以获得 lncRNA 感兴趣的13的 rna 目标的综合列表。采用上述两种特定探针对 Neat1 rna 下拉 GH4C1 垂体细胞进行了 rna 序列分析。应当指出, 使用国家统计局的消极控制也可能受到 rna 序列分析, 如果在国家统计局的 rna 拉降后恢复的 rna 水平足以允许图书馆的建设。在以前的经验13中, 情况并非如此。使用带着它/袖扣管道20分析了用于特定探头后生成的库, 并且仅考虑到超过1的映射读取 (FPKM) 中每个 kilobase 片段值的记录.通过向 Neat1 (表 1) 定向的两个特定探头获得的列表被交叉, 以评估结果的特殊性。4268基因被发现与 paraspeckles 相关, 在 GH4C1 细胞13代表28% 表达的转录。与使用 qPCR 分析获得的结果一致 (图 5 a-c), Gh、泌乳素和 Malat1 的成绩单被发现与 Neat1 相关。因此, rna 下拉法已被证明是一种有效的工具来探索 lncRNAs 和它们的 RNA 靶的相互作用。
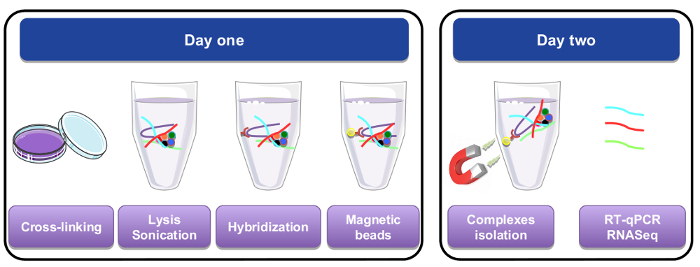
图 1: RNA 拉下过程的图形表示形式.第一天, 细胞或组织与多聚甲醛、裂解和微气泡交叉连接, 然后再通过添加生物素化特定探针执行杂交步骤。然后将磁性链亲和素珠添加到分离出细胞裂解物的特定材料中。第二天, 珠子被磁铁隔离, 洗了好几次。一个脱交联的步骤, 允许恢复的 rna, 纯化和用于 RT qPCR 或 RNA 序列分析。请单击此处查看此图的较大版本.
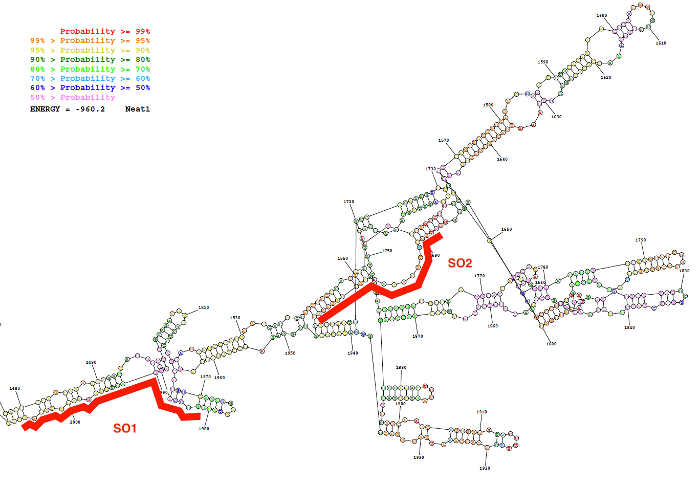
图 2: Neat1 序列的二次结构 (核苷酸1480到 2000), 如生物信息学资源 (RNAstructure 服务器; 最低自由能结构).该结构根据基配对概率的程度进行着色。红色的两个寡核苷酸探针 (SO1 和 SO2) 沿 Neat1 RNA 结构定位。请单击此处查看此图的较大版本.
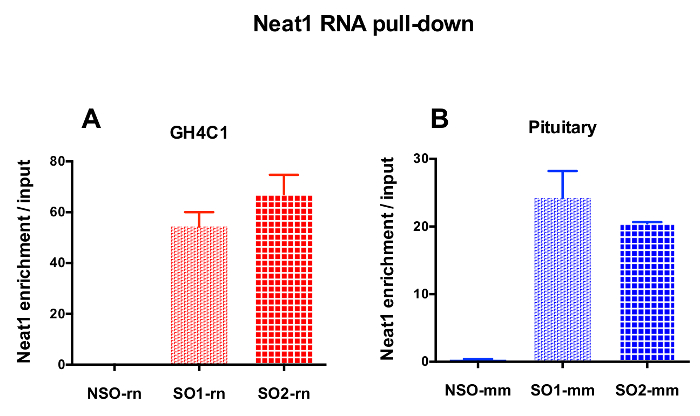
图 3: qPCR 验证 Neat1 富集与输入.qPCR 验证 Neat1 富集与输入后 Neat1 RNA 拉下两个不同的特定探针 (SO1-rn 和 SO2-rn GH4C1 细胞和 SO1-mm 和 SO2-mm 的垂体组织) 相比, 非特定的一个 (国家统计局-rn 为 GH4C1 细胞和国家统计局-毫米垂体组织) 在 GH4C1 大鼠细胞 (A) 和小鼠垂体组织提取物 (B)。结果均为3至10实验所得的平均扫描电镜。请单击此处查看此图的较大版本.
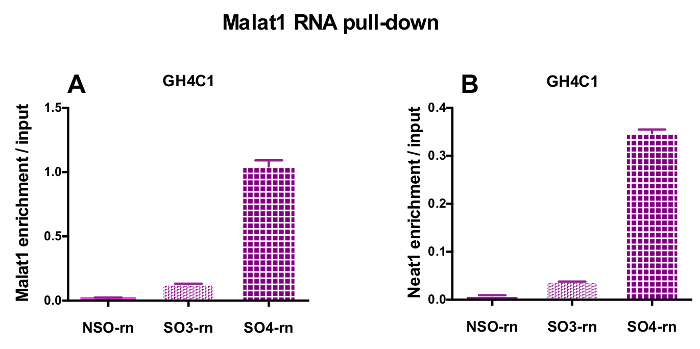
图 4: qPCR 验证 Malat1 和 Neat1 的富集与输入后 Malat1 RNA 拉下.qPCR 验证 Malat1 (A) 和 Neat1 (B) 的富集与输入后, Malat1 RNA 拉下两个不同的特定探针 (SO3-rn 和 SO4-rn) 相比, 一个非特定的 (国家统计局-rn) 在 GH4C1 鼠细胞。结果均为3实验所得的扫描电镜。请单击此处查看此图的较大版本.
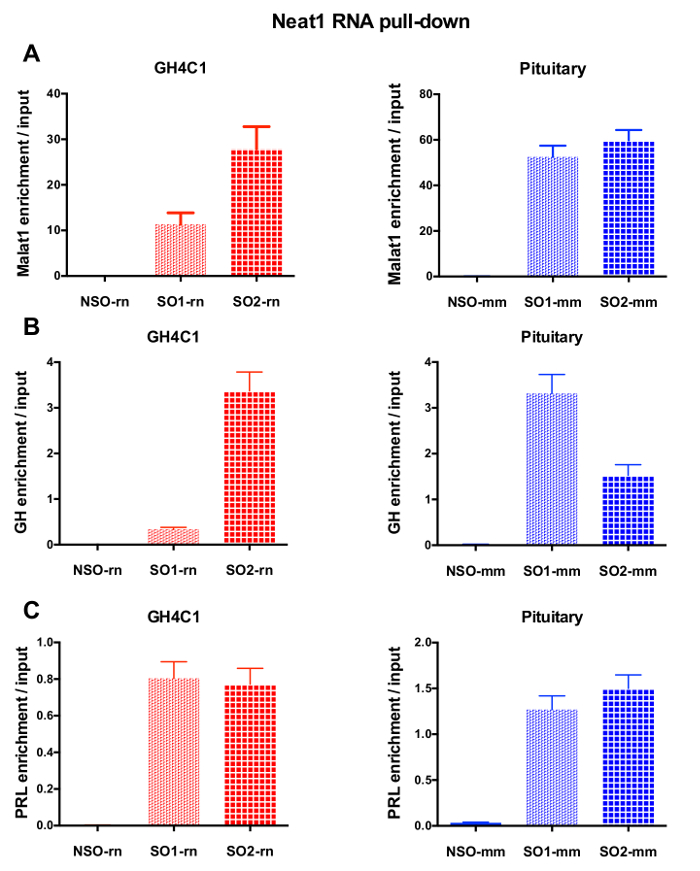
图 5: qPCR 验证 Malat1, Gh, 催乳素浓缩与输入后 Neat1 RNA 拉下.qPCR 验证 Malat1 (A)、Gh (B)、泌乳素 (C) 的富集与输入后, Neat1 RNA 拉下使用不同的特定探针, 比较非特定的一个在 GH4C1 大鼠细胞和小鼠垂体组织提取物。结果均为3至8实验所得的平均扫描电镜。请单击此处查看此图的较大版本.
| 探测器名称 | 序列 | |
| 国家统计局-Rn | TAAAATACCATTTGATGTTTGAAATTAT | |
| SO1-Rn | CTCCACCATCATCAATCCTCTGGAC | |
| SO2-Rn | GCCTTCCCACATTTAAAAACACAAC | |
| SO3-Rn | AACTCGTGGCTCAAGTGAGGTGACA | |
| SO4-Rn | AAGACTCTCAGGCTCCTGCTCATTC | |
| 国家统计局-mm | GTTTGTGGTTTAACAGTGGGAAGGC | |
| SO1-mm | GCCTTCCCACTGTTAAACCACAAAC | |
| SO2-mm | CTCACCCGCACCCCGACTCCTTCAA | |
| qPCR 底漆: | ||
| 鼠褐 | ||
| Neat1 | AAGGCACGAGTTAGCCGCAAAT | |
| TGTGCACAGTCAGACCTGTCATTC | ||
| Malat1 | GAAGGCGTGTACTGCTATGCTGTT | |
| TCTCCTGAGGTGACTGTGAACCAA | ||
| Gh1 | CCGCGTCTATGAGAAACTGAAGGA | |
| GGTTTGCTTGAGGATCTGCCCAAT | ||
| Prl | TGAACCTGATCCTCAGTTTGGT | |
| AGCTGCTTGTTTTGTTCCTCAA | ||
| 小家鼠 | ||
| Neat1 | TGGGCCCTGGGTCATCTTACTAGATA | |
| CACAGCTGTTCCAATGAGCGATCT | ||
| Gh1 | CTCGGACCGTGTCTATGAGAAACTGA | |
| TTTGCTTGAGGATCTGCCCAACAC | ||
| Prl | TGAACCTGATCCTCAGTTTGGT | |
| AGCTGCTTGTTTTGTTCCTCAA | ||
表 1: DNA 寡核苷酸探针和 qPCR 引物序列
讨论
长非编码 rna (lncRNAs) 由他们的数量和多样性代表一个大领域研究和他们的大部分作用仍然被发现。其中许多 lncRNAs 有核定位, 其中一些通过转录或转录后水平机制与基因表达调控途径有关。目前这一领域的一个挑战是了解这些 lncRNAs 在 rna 转录后处理中的相关性。为此目的, 必须确定以 lncRNAs 为目标的 rna。在前人研究的启发下, lncRNAs 与染色质的关联, 我们制定了一个程序, 允许识别与 lncRNA 相关的 rna。该协议的成功, 称为 RNA 下拉, 主要依赖于两个关键步骤, 即设计反感 DNA 寡核苷酸探针, 必须专门和专门杂交与 lncRNA 的利益, 和组织的条件或细胞固定, 必须保持网络的完整性在所有分子伙伴之间。
以前发布的协议提供了将 lncRNA 与其关联的染色质序列 (啁啾1、2、图表3、4) 隔离在一起的过程。在这些协议中, 采用了不同的策略来设计抗感 DNA 生物素化寡核苷酸探针。在啁啾过程中, 作者在排除所有冗余和非特定探头1、2之后, 使用了一组 DNA 生物素化寡核苷酸探针, 涵盖了整个 lncRNA 的长度。在图表协议中, 作者确定了 lncRNA 的区域, 它们可用于杂交和设计的捕获寡核苷酸以这些区域为目标。这些区域根据他们的 RNase 敏感性被选择了。事实上, 利用 RNAse 的特性, 在 rna dna 结合的部位水解 rna, 杂交到 lncRNA 中的可接触部位的寡核苷酸产生 rna-dna 混合体, 导致 lncRNA 的酶解分裂。作者选择了其中三个候选捕获寡核苷酸, 并在鸡尾酒3,4中使用它们。
我们用来设计抗感 DNA 生物素化寡核苷酸探针的过程接近于图表协议中使用的程序, 但根据它们的 RNAse 灵敏度, 没有选择所需 lncRNA 的杂交可用区域, 但根据 lncRNA 二次结构的生物信息学模型确定了其内部基配对的低概率。必须注意的是, 不同的次级结构将被预测使用不同的算法, 并选择的探针应该是那些杂交到可用序列的 lncRNA 在最大数量的二级结构预测。同样的结果也得到了使用三设计的鸡尾酒, 特定探头或单个探针单独。这就促使使用了两个独立的、特定的探头, 并考虑到了这两种探头共有的正面结果。最后, 建议在开发的方法开始时, 为了获得最佳的结果, 并能够评估下拉效果的特殊性, 设计出3种不同的反感寡核苷酸探针, 然后比较实验了它们的效率, 特别是因为探针的效率可以通过细胞裂解制剂来改变。然而, 基于 lncRNA 二次结构生物信息学建模的探针设计程序我们使用的成本仍然低于基于平铺寡核苷酸探针2的池, 这比基于方法的时间消耗更少。在 RNAse 灵敏度4上。
消极的控制也应该使用作为阴性捕获寡核苷酸或者感觉脱氧核糖核酸生物素化寡核苷酸探针或被炒的寡核苷酸探针或寡核苷酸指向不相关的 RNA。由于存在的自然反义转录 lncRNAs, 使用感觉寡核苷酸探针有时可能是不够的。无论为负控制选择的寡核苷酸探针, 都有必要通过爆炸来检查它不与已知的 RNA 杂交, 并记住这种寡核苷酸可以杂交到一个静止不带注释的 lncRNA。
这些 RNA 下拉实验中使用的细胞裂解物是从 10 6 到 10 7 细胞, 当与培养细胞工作时, 在使用组织时从1到10毫克. 细胞裂解物的制备需要根据组织或细胞类型进行调整, 这两个主要步骤必须优化: 即, 交联的步骤, 允许在 lncRNA 和它的分子伙伴之间形成共价键, 和超声波通过粉碎染色质降低粘度的步骤。
交联步骤的目的是确保所有的 RNA 目标保持关闭的 lncRNA 通过诱导形成一个网络的所有分子合作伙伴。将在 lncRNA 及其合作伙伴之间形成共价键的多聚甲醛处理步骤允许网络网格。在图表协议中, 建议如果使用核 lncRNA, 对整个细胞裂解进行第一次治疗, 并在分离的核酸分数34上进行第二次治疗。我们观察到, 这一补充步骤降低了探针的效率, 可能是通过减少细胞中的 lncRNA 可达性。因此, 多聚甲醛的网状程度必须考虑到所使用的细胞或组织类型、兴趣 lncRNA 的定位以及设计探针的效率。
在株溶藻细胞时, 染色质释放在裂解液中, 增加其粘度;然后, 有必要通过超声波来清除染色质, 以增加样品的流动性, 从而促进寡核苷酸探针的可获得性 lncRNA 的兴趣。然而, 超声波也将粉碎的 rna 提取与 lncRNA 的利益。因此, 重要的是要尽量减少超声波时间, 在这样的方式, 虽然它有效地降低了裂解液的黏度, 它也允许获取 RNA 片段的长度由 200-800 bp. 注意, 超声波时间将是高度取决于所使用的组织或培养细胞的数量和类型。
总之, 这里描述的过程在2-3 天之内允许捕获一个期望的 lncRNA 的 RNA 目标。再加上 RT qPCR, 这些方法将允许寻找一个特定的关联和调节的 mRNA 由期望的 lncRNA 作为候选的方法。对于全基因组的方法, rna 拉下实验可以通过高通量 RNA 序列分析, 允许检索与所需 lncRNA 相关的所有 rna。无论选择何种分析策略, rna 下拉程序都应为 lncRNAs 的 rna 调控提供新的重要知识。
披露声明
作者没有什么可透露的。
致谢
这项工作得到了 Aix-马赛大学和 CNRS 的支持, 并得到辉瑞实验室的资助。
材料
| Name | Company | Catalog Number | Comments |
| Bioruptor Plus | Diagenode | B01020001 | Sonicator |
| Dynabeads My One | Thermo-Fisher | 65001 | Magnetic streptavidin beads |
| Formamide | Thermo-Fisher | 15515-026 | |
| Gel electrophoresis apparatus | Advance | Mupid-One | Gel electrophoresis apparatus |
| Proteinase K | Sigma | P2308 | |
| RNA XS purification kit | Macherey-Nagel | 740902 | RNA purificationkit |
| RNAseOUT | Thermo-Fisher | 10777-019 | RNAse inhibitor |
| Trizol | Thermo-Fisher | 15596018 | RNA purification |
| Tube Rotator | Stuart | SB2 | Eppendorf tube rotator |
| RNA to DNA | Thermo-Fisher | 4387405 | Reverse transcription kit |
| iTaq Universal SYBR Green Supermix | BioRad | 1725124 | qPCR reagent |
| Applied 7500 Fast | Thermo-Fisher | 4351107 | qPCR apparatus |
| Illumina TruSeq Stranded mRNA Sample Preparation kit | Illumina | 20020594 | DNA library construction kit |
| Illumina NextSeq 500 | Illumina | SY-415-1002 | NGS system |
参考文献
- Chu, C., Qu, K., Zhong, F. L., Artandi, S. E., Chang, H. Y. Genomic maps of long noncoding RNA occupancy reveal principles of RNA-chromatin interactions. Mol Cell. , 667-678 (2011).
- Chu, C., Quinn, J., Chang, H. Y. Chromatin isolation by RNA purification (ChIRP). J Vis Exp. , e3912(2012).
- Simon, M. D., Wang, C. I., Kharchenko, P. V., West, J. A., Chapman, B. A., Alekseyenko, A. A., Borowsky, M. L., Kuroda, M. I., Kingston, R. E. The genomic binding sites of a noncoding RNA. Proc Natl Acad Sci U S A. , 20497-20502 (2011).
- Simon, M. D. Capture hybridization analysis of RNA targets (CHART). Curr Protoc Mol Biol. , Unit 21.25 (2013).
- Reuter, J. S., Mathews, D. H. RNAstructure: software for RNA secondary structure prediction and analysis. BMC Bioinformatics. 11, 129(2010).
- Sun, X., Haider Ali, M. S. S., Moran, M. The role of interactions of long non-coding RNAs and heterogeneous nuclear ribonucleoproteins in regulating cellular functions. Biochem J. , 2925-2935 (2017).
- Gruber, A. R., Lorenz, R., Bernhart, S. H., Neuböck, R., Hofacker, I. L. The Vienna RNA websuite. Nucleic Acids Res. , W70-W74 (2008).
- Tollervey, J. R., Curk, T., Rogelj, B., Briese, M., Cereda, M., Kayikci, M., König, J., Hortobágyi, T., Nishimura, A. L., Zupunski, V., Patani, R., Chandran, S., Rot, G., Zupan, B., Shaw, C. E., Ule, J. Characterizing the RNA targets and position-dependent splicing regulation by TDP-43. Nat Neurosci. , 452-458 (2011).
- Riva, P., Ratti, A., Venturin, M. The long non-coding RNAs in neurodegenerative diseases: novel mechanisms of pathogenesis. Curr Alzheimer Res. (27338628), (2016).
- Barry, G., Briggs, J. A., Hwang, D. W., Nayler, S. P., Fortuna, P. R., Jonkhout, N., Dachet, F., Maag, J. L., Mestdagh, P., Singh, E. M., Avesson, L., Kaczorowski, D. C., Ozturk, E., Jones, N. C., Vetter, I., Arriola-Martinez, L., Hu, J., Franco, G. R., Warn, V. M., Gong, A., Dinger, M. E., Rigo, F., Lipovich, L., Morris, M. J., O'Brien, T. J., Lee, D. S., Loeb, J. A., Blackshaw, S., Mattick, J. S., Wolvetang, E. J. The long non-coding RNA NEAT1 is responsive to neuronal activity and is associated with hyperexcitability states. Sci Rep. , 40127(2017).
- Adriaens, C., Standaert, L., Barra, J., Latil, M., Verfaillie, A., Kalev, P., Boeckx, B., Wijnhoven, P. W., Radaelli, E., Vermi, W., Leucci, E., Lapouge, G., Beck, B., van den Oord, J., Nakagawa, S., Hirose, T., Sablina, A. A., Lambrechts, D., Aerts, S., Blanpain, C., Marine, J. C. p53 induces formation of NEAT1 lncRNA-containing paraspeckles that modulate replication stress response and chemosensitivity. Nat Med. , (2016).
- Fang, J., Qiao, F., Tu, J., Xu, J., Ding, F., Liu, Y., Akuo, B. A., Hu, J., Shao, S. High expression of long non-coding RNA NEAT1 indicates poor prognosis of human cancer. Oncotarget. , (2017).
- Torres, M., Becquet, D., Blanchard, M. P., Guillen, S., Boyer, B., Moreno, M., Franc, J. L., François-Bellan, A. M. Circadian RNA expression elicited by 3'-UTR IRAlu-paraspeckle associated elements. Elife. , (2016).
- Fox, A. H., Lamond, A. I. Paraspeckles. Cold Spring Harbor Perspectives in Biology. , Available from: http://cshperspectives.cshlp.org/content/2/7/a000687.long (2010).
- Chen, L. L., DeCerbo, J. N., Carmichael, G. G. Alu element-mediated gene silencing. EMBO J. , 1694-1705 (2008).
- Tripathi, V., Ellis, J. D., Shen, Z., Song, D. Y., Pan, Q., Watt, A. T., Freier, S. M., Bennett, C. F., Sharma, A., Bubulya, P. A., Blencowe, B. J., Prasanth, S. G., Prasanth, K. V. The nuclear-retained noncoding RNA MALAT1 regulates alternative splicing by modulating SR splicing factor phosphorylation. Mol Cell. , 925-938 (2010).
- Engreitz, J. M., Sirokman, K., McDonel, P., Shishkin, A. A., Surka, C., Russell, P., Grossman, S. R., Chow, A. Y., Guttman, M., Lander, E. S. RNA-RNA Interactions Enable Specific Targeting of Noncoding RNAs to Nascent Pre-mRNAs and Chromatin Sites. Cell. , 188-199 (2014).
- Nakagawa, S., Ip, J. Y., Shioi, G., Tripathi, V., Zong, X., Hirose, T., Prasanth, K. V. Malat1 is not an essential component of nuclear speckles in mice. RNA. , (2012).
- Zhang, B., Arun, G., Mao, Y. S., Lazar, Z., Hung, G., Bhattacharjee, G., Xiao, X., Booth, C. J., Wu, J., Zhang, C., Spector, D. L. The lncRNA Malat1 is dispensable for mouse development but its transcription plays a cis-regulatory role in the adult. Cell Rep. , 111-123 (2012).
- Trapnell, C., Roberts, A., Goff, L., Pertea, G., Kim, D., Kelley, D. R., Pimentel, H., Salzberg, S. L., Rinn, J. L., Pachter, L. Differential gene and transcript expression analysis of RNA-seq experiments with TopHat and Cufflinks. Nat Protoc. , 562-578 (2012).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。