Method Article
小鼠巨噬细胞吞噬的延时3D 成像
摘要
本文介绍了利用旋转圆盘共聚焦显微镜对小鼠腹腔巨噬细胞单个吞噬事件进行图像的方法。这些协议可以扩展到其他吞噬细胞。
摘要
吞噬作用在寄主防御以及组织发展和维护中扮演着关键的角色, 涉及快速、受体介导的肌动蛋白骨架重排捕捉、包裹和吞噬大颗粒。尽管吞噬受体、下游信号通路和效应器 (如 Rho GTPases) 已经确定, 但特定受体介导的吞噬性事件的动态细胞骨架重构仍不清楚。四年前, 两种不同的吞噬机制, 以 Fcγ受体 (FcγR) 和补体受体 (CR) 介导的吞噬作用为例, 通过扫描电子显微镜识别。免疫球蛋白 G (IgG)-调理颗粒与 FcγRs 的结合触发薄膜扩展的突出, 最初形成一个所谓吞噬杯周围的粒子之前, 它变得完全封闭, 并收回到细胞。相比之下, 补充调理颗粒似乎沉入吞噬细胞后结合到补充受体。这两种吞噬、吞噬杯形成和下沉的模式已在文献中得到了很好的确立。然而, 两种模式之间的区别已变得模糊的报告, 补充受体介导的吞噬可能诱发各种膜突起。随着高分辨率成像技术的可用性, 吞噬试验需要允许实时 3D (三维) 可视化特定吞噬受体如何调解单个粒子的吸收。更常用的方法来研究吞噬, 如终点检测, 错过了了解在粒子和吞噬细胞界面发生了什么的机会。在这里, 我们描述吞噬试验, 使用时移旋转圆盘共聚焦显微镜, 允许单个吞噬事件的3D 成像。此外, 我们描述了明确的图像 Fcγ受体-或补充受体介导的吞噬功能的检测。
引言
在延年益寿对海星幼虫吞噬间充质细胞的观察二十年前, 在 1882年, 他的吞噬1理论的发展, 海克尔描述, 1862年, 吞没不溶性染料颗粒的血液忒提斯 fimbris (穹隆) 的细胞, 一种捕食性海蛞蝓 (欧内斯特海克尔。模 Radiolarien (Rhizopoda radiaria): Eine Monographie;Druck 和出版社雷蒙, 柏林, 1862)。他明确地描述了细胞膜突起包裹的粒子, 随后被纳入细胞质和积累周围的细胞核。100年后, 卡普兰的一项开创性研究表明, 至少有两种不同形态的吞噬2机制。卡普兰通过扫描电镜显示, 小鼠腹腔巨噬细胞摄取了 IgG-调理绵羊红细胞, 使用薄膜扩展来达到并紧紧包围粒子, 最初会引起杯状结构。吞噬杯形成需要肌动蛋白聚合, 因为它被废除的细胞渗透性真菌毒素细胞松弛素 B, 已知阻断肌动蛋白动力学3。相比之下, 绵羊红细胞调理与补充似乎直接下沉到巨噬细胞没有生成的膜扩展, 虽然, 在一些图像, 膜褶边可以看到在直接 vacinity 的下沉颗粒。与吞噬杯形成不同, 补体受体介导的下沉被 insenstive 到细胞松弛素 B 治疗2。在卡普兰所描述的实验中, 补充调理作用是通过孵化免疫球蛋白 M (IgM) 标记绵羊红细胞与补充 C5-deficient 小鼠血清, 通过补 C5-dependent 终端绕过溶血补充复杂。
在4、5、6、7、8、9等领域, 由卡普兰确定的吞噬、吞噬杯形成和下沉的两种模式已成为既定意见..然而, 由卡普兰2在原研究中使用的超高分辨率图像, 以及亚克塞尔·蒙特-Kaas等的类似研究。10, 只提供吞噬事件的快照。在最近的一次审查中, Rougerie等。11强调 FcγR 和 CR 介导的吞噬作用的形态学差异仍有待澄清, 此外, 在补受体介导的粒子吸收2中观察到膜褶边。从粒子捕获到内部化的单个吞噬事件的活细胞成像, 结合转基因小鼠模型, 可以大大提高我们对吞噬细胞捕获和摄取粒子的理解。一种方法可能是使用快速原子力显微镜 (AFM), 它允许对活细胞进行超高分辨率 (10–20 nm) 地形图成像。最近开发了一个快速的 AFM 系统12 , 适用于快速低噪声成像细胞表面。这种技术的优点是, 可以在短时间 (秒) 内测量活细胞的高分辨率、地形和力学参数, 与扫描电镜不同, 这就需要固定和关键点干燥细胞。另一种方法是延时3D 共聚焦显微镜, 这是广泛可用的, 虽然光毒性和漂白是在录音过程中的限制因素。这种方法具有高度的通用性, 可实现高空间分辨率的光学切片, 并在标记各种荧光探针 (包括基因编码的荧光蛋白) 时具有非凡的灵活性。在这里, 我们描述使用时移旋转圆盘共聚焦显微镜的吞噬试验, 允许特定受体介导的吞噬事件的高时空分辨率。
研究方案
这些协议遵循我们当地人类研究道德委员会的指导方针, 以及动物保育指南。
1. 居民小鼠腹腔巨噬细胞的分离
- 牺牲鼠标 (3–4月龄 (或性别);例如C57BL/6 菌株) 使用过量的挥发性麻醉剂异氟醚 (> 5% 在空气中) 或二氧化碳13, 其次是颈椎脱位。麻醉的诱导可以很容易地评估的纠正反射14的损失, 以及损失的爪撤回反射。
- 用80% 乙醇在水中清洁小鼠腹部后, 进行中线皮肤切口, 露出底层腹壁。
- 将一个24克的塑料导管放入 peritonium 中, 用 2x 4.5 毫升冰冷的汉克的缓冲盐溶液 (HBSS) 灌洗腔体, 没有 Ca2 +和 Mg2 +通过5毫升塑料注射器。注射时, 在注射器中留下约0.5 毫升残余 HBSS (注射) = 0.5 毫升), 以防组织被吸进导管的尖端, 需要排出。将吸气悬浮液转移到14毫升聚丙烯圆底管中, 在室温下离心 300 x g 6.5 分钟。
注意: 塑料导管的尖端是钝的, 与针头相比, 对腹部内容的损伤最小。通常, 在温和的腹部按摩后, 8 毫升腹膜细胞悬浮液可以从腹膜腔中提取。 - 丢弃上清和重悬的腹膜细胞在1毫升无碳酸盐 RPMI 1640 培养基含有20毫米 Hepes, 10% 热灭活胎儿牛血清和抗生素, 如青霉素 (100 单位/毫升) 和链霉素 (100 µg/毫升), 准备由稀释100x 青霉素/链霉素1:100。这通常提供大约 6 x 106细胞/毫升的浓度。
注意: 大约30% 的孤立的腹膜细胞是巨细胞, 而其他 (较小) 细胞是淋巴细胞, 主要是 B 细胞。
2. 在通道玻片中播种腹膜细胞
-
在移液细胞悬浮液上下以减少结块后, 移液器100µL 悬浮液进入纤维连接蛋白涂层通道滑块的预充式通道 (体积, 100 µL) (100 µL 通道具有尺寸 (长度 x 宽度 x 高度):50 毫米 x 5 毫米0.4 毫米)。
- 预填将1毫升血清补充 RPMI 1640 (Hepes) 培养基添加到通道滑块的两个储层中之一, 倾斜滑块, 然后从下游储层中吸气 (图 1)。
- 去除不想要的气泡, 或长条的空气, 在通道中加入了在两个水库之一, 严格应用储层盖, 然后泵出空气通过有节奏的拇指压力, 在必要时, 倾斜幻灯片。排出空气后, 在取下盖子前, 将滑块与无上限储层 (和含介质) 向下倾斜, 以避免空气被吸回通道中。
- 预填将1毫升血清补充 RPMI 1640 (Hepes) 培养基添加到通道滑块的两个储层中之一, 倾斜滑块, 然后从下游储层中吸气 (图 1)。
- 孵化的通道幻灯片, 种子与细胞, 在潮湿的室内2小时在37摄氏度, 没有 co2 (co2是不需要的, 因为 HCO3-/CO2缓冲系统被 Hepes 取代)。通道滑块可以方便地放置在机架上, 可容纳八张幻灯片。通常情况下, 6–8幻灯片是由一只鼠标准备的, 虽然最多可以达到10个或更多。
-
卸下机架并在每张幻灯片中交换 RPMI 1640 (Hepes) 介质, RPMI 1640 含碳酸氢钠的培养基, 辅以10% 胎牛血清, 以及青霉素/链霉素。
- 首先从下部储层和上部储层倾斜滑块和吸液介质。接下来, 将新介质的1毫升添加到其中一个储层中, 在流经通道后, 从下游储层倾斜滑块和吸液介质。
- 在这个洗涤 (中等交换) 步骤后, 通过增加1毫升培养基到其中一个水库填补通道幻灯片。
注: 使用通道滑块清洗步骤在溶液交换和去除非贴壁细胞方面非常简单和有效。请注意, RPMI 1640 (碳酸氢钠) 培养基通常预孵育 5% CO2过夜, 以确保热量和 pH 平衡。
- 在 5% CO2的加湿孵化器中, 在37摄氏度的夜间孵育细胞。在第二天进行实验。
3. 人类红细胞的分离
- 在2天 (实验的第二天; 分离的腹腔巨噬细胞过夜孵育后), 从一个健康的捐献者那里收集肝素化的外周静脉血, 变成一根管子。将1毫升转换成圆形底部2.0 毫升 (聚丙烯) 微量离心管, 离心在 300 x g 5 分钟在18摄氏度 (经验设置), 并删除上清 (等离子和菲比涂层)。
- 轻轻吸出100µL 的沉淀红细胞, 并将此卷1:1 与修改后的 RPMI 1640 (Hepes) 培养基 (如下所述) 在圆形底部2.0 毫升微量离心管。标签管 "1:1"。
注: 在分离细胞后使用的 RPMI 1640 (Hepes) 培养基, 除了10% 个热灭活胎牛血清、青霉素 (100 个单位/毫升)、链霉素 (100 µg/毫升) 和 1 mM n-(2-mercaptopropionyl) 甘氨酸 (以减少光毒性)。此后, 此介质称为 "修改" RPMI 1640 (Hepes) 介质。 - 移液器4µL 1:1 稀释红血球悬浮液转化为2毫升改性 RPMI 1640 (Hepes) 培养基, 预吹动为2.0 毫升微量离心管 (重复此步骤,即准备2管)。标签每管 "4:2000"。将 "1:1" 和 "4:2000" 管放在冰上。
4. 巨噬细胞等离子膜的标记
- 从 CO2孵化器中取出种子通道幻灯片, 并在每张幻灯片中交换 RPMI 1640 (碳酸氢钠) 介质, 以便修改 RPMI 1640 (Hepes) 介质。接下来, 将细胞放在潮湿的室内, 在37摄氏度的情况下, 没有 CO2。
注意: 过夜孵育和洗涤后, 大部分淋巴细胞从通道中移除。其余的贴壁细胞中, 大部分是噬细胞, 可以通过 anti-F4/80 抗体识别形态或免疫荧光染色。大约95% 的小鼠驻留腹膜巨噬细胞是 F4/80 阳性。 - 稀释荧光绿色标记的抗鼠 F4/80 抗体 (存储在4摄氏度) 1:40 在修改 RPMI 1640 (Hepes) 培养基。采取滑动, 倾斜它, 和移液器 (下降) 100 µL 的抗体混合物进入100µL 通道的幻灯片 (见图 1)。流入下游油藏的吸液介质。在37摄氏度孵育细胞20分钟 (加湿环境, 不含 CO2)。在潜伏期期间, 标记人类红细胞 (参见第5节)。
注意: 如上所述, co2是不需要的, 因为 HCO3/CO2缓冲系统被 Hepes 取代。 - 在20分钟孵育时间 (人类红细胞染色和调理) 后, 通过将1毫升改性的 RPMI 1640 (Hepes) 培养基添加到其中一个储层中, 然后在流经通道后吸气介质, 以此来洗涤滑块, 促进了倾斜幻灯片。添加1毫升培养基用于短期储存或进行实验 (例如,在粒子中移液 (调理红细胞) 和通过时间推移旋转圆盘共聚焦显微镜进行成像吞噬)。
5. 标记人类红细胞的等离子膜
- 在孵化一张带有绿色荧光标记 anti-F4/80 抗体的巨噬细胞的幻灯片后立即开始对人类红细胞进行标记 (4.2 节之后)。经过柔和的搅拌后, 从 "4:2000" 管 (见第3.3 节) 中的一个400µL, 并将其分配到一个 (圆形底部) 2.0 毫升微量离心管。让暂停时间预热到约37摄氏度 (见下段)。添加0.4 µL 橙色/红色荧光等离子膜染色 (等份存储在-20 摄氏度), 混合和孵育在37摄氏度5分钟。
注: 在层流罩内放置的加热铝块可用于在准备幻灯片时尽量减少热量损失。管可以放置在加热块的孔井中, 单独或集成加热的铝板可以作为工作空间。 - 5分钟孵育期后, 通过添加1600µL 改性 RPMI 1640 (Hepes) 培养基 (填充2.0 毫升微量离心管), 准备第一次洗涤步骤。
- 离心管在 300 x g 5 分钟在18摄氏度 (经验设置)。一个紧凑的红色颗粒应该是可见的墙上 (即,离中心) 在管的底部。旋转管子, 使球团朝上, 小心地移除所有上清液 (两步) 使用1–1.5 毫升移液头。
- 吸气上清液后, 添加2000µL 改性 RPMI 1640 (Hepes) 培养基, 混合 (以重悬细胞), 重复上述离心和上清吸入步骤。
- 用400µL 改性 RPMI 1640 (Hepes) 培养基重悬颗粒 (等离子膜染色和2x 水洗红细胞)。标签管 PMS (等离子膜染色的缩写)。
注: 另外, ph 敏感的罗丹明衍生物的琥珀酰亚酯在酸性 ph 下变得更强荧光, 可用于标记人类红细胞。在这种情况下, 荧光强度还可以作为测量粒子内部化后的吞噬体成熟度的量度。
6. 用小鼠免疫球蛋白 G (IgG) 对人红细胞调理作用 (标记)
- 添加1µL 鼠标 (IgG2b) 单克隆 (克隆 HIR2) 抗人 CD235a (1 毫克/毫升) 抗体 (储存在-20 摄氏度) 到管标记 PMS (见节 5.2–5.5), 包含等离子膜染色人红细胞悬浮在400µL 培养基中。CD235a (也称为 glycophorin A) 是红细胞谱系特定的膜 sialoglycoprotein。
-
在37摄氏度孵育8分钟. 请注意, 调理作用的人红细胞与 IgG 会导致凝集 (细胞结块)。虽然凝集可以作为调理作用的视觉指标, 但对于单一吞噬效果的成像是不可取的。为了规避凝集, 反复混合细胞悬浮液 (每1分钟) 使用, 例如, 可变20–200µL 体积移液器设置为200µL。
- 在8分钟潜伏期结束时, 如有需要, 洗涤巨噬细胞滑块, 用绿色荧光标记 anti-F4/80 抗体孵育, 1 毫升改性 RPMI 1640 (Hepes) 培养基。确保通道滑块的两个储层在洗涤步骤后均无介质。
7. 成像等离子体膜染色和 IgG 涂层人红细胞吞噬功能
- 在8分钟孵育与 anti-CD235a 抗体 (第 6.2), 移液器100µL 悬浮液含有等离子膜染色和 IgG-调理人红细胞进入包含绿色荧光标记的巨噬细胞的幻灯片的通道 anti-F4/80抗体 (步骤 4)。因此, 红色荧光, IgG-调理人类红细胞被添加到绿色荧光吞噬细胞 (巨噬细胞)。
- 一旦添加了人类红细胞, 在旋转圆盘共聚焦显微镜上安装通道滑块 (使用舞台孵化器设置为37摄氏度) 进行成像, 例如, 通过 60 x/1.49 油浸物镜。尽早开始成像, 因为粒子开始在1分钟内沉降。
注: 使用直径为 100 nm 的荧光珠, 通过对点扩散函数的分析测量, XY 分辨率为 x = 0.22 µm, y = 0.23 µm (488 nm 激光) 和 x = 0.27 µm, y = 0.27 µm (561 nm 激光)。然而, 为了减少光漂白和光毒性在3D 成像的活细胞, 我们妥协空间分辨率使用 2 x 2 装箱。分组增加灵敏度 (提高信噪比) 和允许的帧速率, 但代价是空间分辨率。 - 使用一个完美的对焦 (或类似) 系统来防止录音过程中的焦点漂移。激活完美对焦系统后, 使用偏移控制将焦点放在玻片上的巨噬细胞 lamellipodial 突起上方 (见下面的注释)。此焦点级别对应于 z = 0 µm. 从-1 µm 到 +16 µm 在0.8 µm 步骤 (相当于 22 z 切片) 获取 z 堆栈。例如, Z 栈可以在每十五年代的1个堆栈 (每个通道) 的速率下获得, 总共16分钟。
注意: 较长的记录周期遭受图像质量损失, 主要是由于光漂白。Z 栈为两个通道中的每一个获取: 巨噬细胞使用 488 nm 激光 (绿色通道) 成像, 而人类红细胞则使用 561 nm 激光 (红色通道) 进行成像。利用这种方法, 可以获得不同不仅的巨噬细胞摄取 IgG-调理人红细胞的各种观点 (例如, 参见图 2)。
注: 系统的典型设置 (带 2 x 2 装箱) 为: 绿色通道 (20.5% 激光 (50 mW; 488 nm) 功率、101灵敏度 (范围、0–255) 和 200 ms 曝光时间);红色通道 (10.5% 激光 (50 mW, 561 nm) 功率, 101 灵敏度 (范围, 0-255) 和 98 ms 曝光时间)。
注: 通道滑块的底部是一个与 #1 厚度相同的聚合物. 5 玻璃盖玻片和玻璃的相同光学性能, 但值得注意的是, 该材料具有透气性的优势。
8. 成像对等离子膜染色和补膜人红细胞的吞噬作用
- 补充-opsonize 等离子膜染色和 IgG-调理人红细胞像5和 6, 除了移液4µL 1:1 稀释红血球悬浮液到2毫升修改 RPMI 1640 (Hepes) 培养基, 如第3.3 节所述,移液器4µL 成1毫升改性 RPMI 1640 (Hepes) 培养基, 相应贴标管4:1、000。因此, 人类红细胞的浓度是2x。
- 继续执行4和5节中的步骤, 但开始与 4:1, 000, 而不是 4:2, 000 稀释的人红细胞 (4:1, 000 和 4:2, 000 的库存是指在部分中描述的最初1:1 稀释的人类红细胞的随后稀释3.1 和 3.2)。
- 牺牲一个 C5 的空鼠标 (例如, B10。D2-Hc0 H2d H2-T18c/oSnJ;杰克逊实验室) 通过 (> 5% 在空气中) 异氟醚吸入后被斩首, 并收集血液。在异氟醚吸入和斩首后, 我们通常会将大约0.8 毫升的血液滴入圆形底部14毫升塑料管中。
- 1小时后, 当血液完全凝固时, 将残余流体转移到2.0 毫升微量离心管, 在室温下离心 300 x g 5 分钟。随后, 仔细收集黄色血清。通常, 我们恢复至少200µL C5 零血清。将 C5 空血清放在冰上。
- 4分钟后孵育的等离子膜染色人红细胞与 IgG, 添加另一个1µL 的 anti-CD235a 抗体 (给予2x 浓缩), 然后采取50µL 的细胞悬浮液和混合在一个单独的2.0 毫升微量离心管包含50µL C5 空血清。继续反复混合 (每1分钟) 通过移液向上和向下, 如第6.2 节, 再4分钟。因此, 在这一步之后, 人类红细胞已经用 anti-CD235a 抗体孵育了总共8分钟。
注: C5 空血清的4分钟潜伏期足以激活经典补体级联和 opsonize 人红细胞与 C3b, 这是由因子 I 至 iC3b。
9. 确认人类红细胞的 IgG 和 C3b-opsonization
-
用小鼠 anti-CD235a igg (IgG2b; 见第6.1 节) 调理作用抗体, 用山羊抗小鼠 (次级) igg 抗体与绿色或红色荧光荧光基团进行孵育。
- 添加1µL 小鼠 anti-CD235a IgG 抗体和1µL 荧光标记为抗小鼠二抗的400µL 悬浮的人红细胞, 并孵育37摄氏度8分钟。随后, 洗两次 (如在5.2–5.5 节)。
- 将400µL 改性 RPMI 1640 (Hepes) 培养基和移液器100µL 悬浮入通道滑块 (见图 1C) 以进行共聚焦荧光成像, 从而重悬细胞颗粒。
注: 细胞将在洗涤和再悬浮后丛 (凝集), 但洗涤是必要的, 以减少背景荧光由于未绑定的二抗。
-
确认人红细胞的调理作用, 用小鼠 igg 预标记, 用 C5 空鼠血清孵育, C3b/iC3b 使用, 例如, 大鼠抗小鼠 C3b/iC3b/C3c 抗体和二抗, 例如山羊抗大鼠 igg 抗体共轭绿色荧光染料。
- 重复使用未染色人红细胞的第8节中的步骤。
- 添加0.25 µL 荧光标记的抗鼠 C3b/iC3b/C3c 抗体100µL 混合物 (50 µL IgG 标记人红细胞 + 50 µL C5 空鼠血清) 和孵育在37摄氏度8分钟。
- 洗涤两次, 在100µL 改性 RPMI 1640 (Hepes) 培养基中重悬颗粒, 将悬浮液移入通道滑块 (见图 1C) 以进行共聚焦荧光成像。
结果
图 1所示为利用时移纺丝共聚焦显微镜进行吞噬的成像的通道滑动示意图。人红细胞 (hRBCs) 染色与红色荧光等离子膜标记 CellMask 橙色, 而孤立小鼠驻留腹膜巨噬细胞 (Ms) 被标记绿色荧光 Alexa 氟488共轭 anti-F4/80 抗体 (图 2), 它既用作小鼠巨噬细胞的特定标记, 又用作等离子膜标签。人类红细胞可以调理与小鼠 igg (mIgG) 或小鼠 IgM (mIgM), 通过孵育细胞与 igg (或 IgM) anti-CD235a 抗体 (CD235a, 也称为 glycophorin a, 是一种蛋白质专门表达在人类红细胞)。用红色荧光人红细胞进行时移3D 成像可实现单个粒子吞噬事件的可视化 (图 2)。对单个吞噬事件的密切观察可以描述粒子捕获和摄入的细节。例如, 可以观察到由巨噬细胞 filopodium mIgG 调理人红细胞的捕获 (图 3A; 另见 Horsthemke等。15). 此外, 可以观察到在吞噬杯形成期间人类红细胞的压缩 (图 3A)。在引入新鲜的小鼠血清、mIgG 调理或 mIgM 调理时, 人类红细胞触发了传统的补体级联, 在溶血性膜攻击复合物的形成中达到高潮。用 CellMask 橙和 Calcein 双染色成像细胞测定补体介导的溶血动力学。在溶血过程中, 绿色荧光胞浆 Calcein 在细胞中迅速释放 (图 3B)。
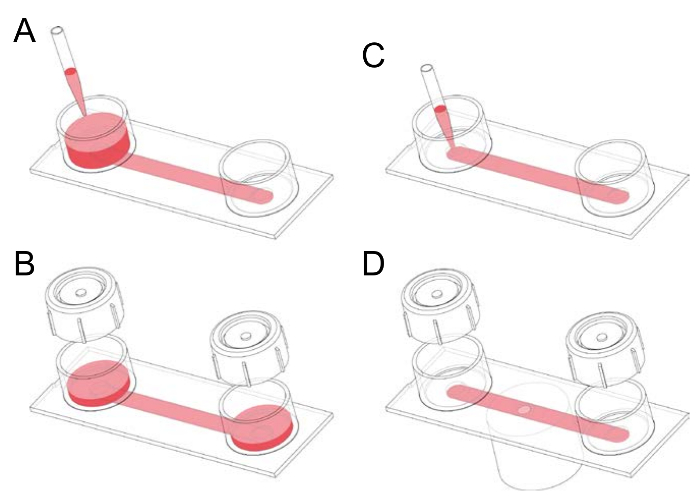
图 1: 处理纤维连接蛋白涂层的通道滑块.(a) 通道滑块由两个与尺寸为 50 mm x 5 mm 0.4 mm 的通道相连的储层组成. 通道幻灯片最初预充式通过应用1-2 毫升介质到两个储层之一和倾斜幻灯片。(B) 在孵化前, 可将瓶盖放置在储层上。在用细胞播种通道之前, 盖子可以方便地用于泵出不需要的气泡。(C) 无气泡100µL 通道可通过将介质直接移入通道口中来填充。例如, 此步骤用于将巨噬细胞植入幻灯片或添加 gfluorophore (绿色荧光)-共轭 anti-F4/80 抗体, 作为膜标签, 以及小鼠巨噬细胞标记。(D) 移液颗粒 (如调理人红细胞) 进入荧光染色巨噬细胞的通道, 可将滑块放置在倒置显微镜的舞台上, 而延时旋转圆盘共聚焦显微镜可执行。请点击这里查看这个数字的更大版本.

图 2: 吞噬的延时3D 成像.(A) 用小鼠 (m) anti-CD235a 免疫球蛋白 G (mIgG) 抗体调理作用等离子膜染色 (红色荧光) 人红细胞 (hRBCs) 的示意图, 并将标记 hRBCs 的表达式呈现给小鼠巨噬细胞 (Ms),标记 (绿色荧光) 与绿色荧光荧光染料共轭 anti-F4/80 抗体。(B)通过旋转圆盘共聚焦显微镜获得的延时图像 (XZ 视图), 显示吞噬杯的形成和 mIgG-调理 hRBCs 的摄入。比例尺 = 10 µm (C) 3D 重建, 显示巨噬细胞摄取 mIgG-调理 hRBCs。相应的 XZ 视图 (3 的不仅) 显示在 b. 网格间距代表5.07 µm.请点击这里查看这个数字的更大版本.

图 3: 通过 filopodium 捕获粒子.通过旋转圆盘共聚焦显微镜获得的延时图像, 显示老鼠巨噬细胞通过 filopodium (上部面板中的箭头) 捕捉老鼠免疫球蛋白 G (mIgG)-调理人红细胞 (hRBC), 一种手指状投影。请注意, 在吞噬杯形成过程中, 红血球在早期就失去了部。此外, 吞噬杯似乎挤压包裹的红细胞 (由下部面板中的箭头表示)。比例尺 = 10 µm.请单击此处查看此图的较大版本.
讨论
绝大多数吞噬性检测, 特别是终点和高通量检测, 不提供如何实际捕获、封装和摄取粒子的可视化。亚克塞尔·蒙特-Kaas等先锋研究。10和卡普兰2在二十世纪七十年代建议, 惊人不同的细胞骨架重组参与了免疫球蛋白调理与补充调理颗粒 (绵羊红细胞) 的吞噬。在这里, 我们描述使用旋转圆盘共聚焦显微镜的吞噬性检测, 允许对单一吞噬事件进行高分辨率、实时成像。我们的模型吞噬细胞是鼠标驻留腹腔巨噬细胞, 它可以被隔离最小的处理, 我们使用新鲜孤立的人类红细胞作为粒子。然而, 吞噬性检测可应用于其他吞噬细胞, 如小鼠骨髓衍生巨噬细胞或中性粒细胞、小鼠巨噬细胞系、人单核细胞衍生巨噬细胞或人外周血中性粒细胞。在人类吞噬细胞或小鼠嗜中性的情况下, 需要替代荧光标记抗体, 如荧光标记 anti-CD14 抗体 (人单核细胞/巨噬细胞)16或 anti-Gr-1 (Ly-6G) 抗体 (鼠标中性粒细胞)。
Unopsonized 人类红细胞, 像传统上使用的绵羊红细胞, 是惰性的意义上, 这些细胞不是 (或, 至少, 很少) 摄入的小鼠腹腔巨细胞。这确保了与聚苯乙烯珠相比, 低背景活动。人类红细胞可以方便地调理与免疫球蛋白使用小鼠 IgG 或 IgM 单克隆抗体对 CD235a (glycophorin a), 一个特定的标记的人红血球 (红血球) 和红细胞前体17, 18. 在平行检测中, 荧光标记的抗小鼠 IgG 或 IgM 二抗可用于确认调理作用。IgG 和 IgM 抗体类是 hemagglutinins, 物质 (抗体), 导致红血球凝集。为了避免凝集, 我们间歇性地混合细胞悬浮液在8分钟潜伏期与 anti-CD235a 抗体, 然后我们将混合悬浮液直接添加到含有巨噬细胞的通道滑块 (纤维连接蛋白涂层的幻灯片) 没有洗涤步骤.洗涤步骤包括通过离心法沉淀红细胞, 这有力地促进凝集。在 opsonizing 人类红细胞之前, 我们用亲脂橙色/红色荧光探针标记等离子膜。该探针在延时记录的开头是明亮的荧光, 但信号逐渐消退, 可能主要是由于光漂白19。此外, 在录音过程中, 巨噬细胞和玻纤蛋白涂层可能会变得微弱的橙色/红色荧光。这个问题可能是由于在标记后对人类红细胞的洗涤不足。而不是使用亲油性荧光等离子膜标记, 人类红细胞可以标记与 pH 敏感的罗丹明衍生物使用其胺反应琥珀酰亚酯15,20。由于荧光强度随 pH 值的降低15,20而增加, 因此这种方法具有吞噬体成熟度的优势, 但这种方式的缺点是反应性酯制剂目前在水介质中重构后价格昂贵且不稳定。
IgG-调理人类红细胞通过 FcγRs 摄取, 可以通过从航行通告21或Fcer1g-/-(Fcer1g 挖空) 小鼠中分离的腹腔巨噬细胞来证实。航行通告巨噬细胞结合 IgG-调理人红细胞, 但缺乏淡 (immunoreceptor 酪氨酸基激活图案)-介导的信号诱导吞噬, 而Fcer1g敲除巨噬细胞不表达表面 FcγRs. IgG-或 IgM-调理人红细胞可以额外调理与 C3b (这是切割到 iC3b) 通过孵化细胞与新鲜分离的血清从补充 C5 零鼠标 (野生型血清导致溶血)。opsonins IgG 和 IgM 激活经典补充级联, 导致毛孔形成 (膜攻击复合体) 和细胞裂解。在缺乏补 C5 的小鼠中, 补体级联继续补充 C3 裂解, 但 C5 溶菌素缺乏催化末端通路所需的基底。我们开发了简单的检测方法来测量补充级联的动力学。简而言之, 人类红细胞可以与红色荧光、等离子膜标记和绿色荧光、胞浆荧光素共同标记。膜攻击复合物形成后, 由补体成分 C5-C9 形成, 胞浆荧光迅速 (以秒为单位) 从细胞质中消失。补充级联的末端效应器 (细胞溶解) 功能的可视化表明, 4 分钟孵育时间足以 C3b/iC3b 调理作用的人红细胞。在平行检测中, 使用抗鼠 C3b 和荧光标记的二次抗体混合后, 可以很容易地评估人红细胞的 C3b/iC3b 涂层。在这种情况下, 需要清洗步骤来去除未绑定的荧光抗体。虽然洗涤步骤涉及细胞 sedimentaion 离心, 促进凝集, 成功的调理作用可以很容易地通过共聚焦显微镜评估。补充受体介导的吞噬可以通过应用 IgG-/iC3b-opsonized 人红细胞到航行通告或Fcer1g巨噬细胞或通过引入 IgM-/iC3b-opsonized 人红细胞到野生型巨噬细胞来成像。IgM-调理血细胞不认可的淡包含 FcγRs (FcγRI, FcγRIII 和 FcγRIV) 所需的吞噬 IgG-调理颗粒22。
为了图像吞噬事件, 巨噬细胞的等离子膜可以用绿色荧光荧光染料共轭 anti-F4/80 抗体标记, 这也可作为小鼠巨噬细胞的特异标记。如上文所述, 人类红细胞可以通过孵育与橙色/红色荧光等离子膜标记来呈现红色荧光。这种亲脂等离子膜标记可避免抗体基标签的潜在混淆效应。红色荧光人红细胞, 有或没有调理作用, 可以直接吹动到通道幻灯片的100µL 通道和3D 延时成像通过 60 x/1.49 油浸泡 (或类似) 物镜使用 488 nm 和 561 nm 激光线执行, 分别是旋转圆盘共聚焦 (或类似) 显微镜。对高分辨率成像系统进行优化是很诱人的, 但是16分钟以上的重复 Z 栈的采集可能会引起相当大的光漂白和光毒性。我们选择使用2x2 分组来提高信噪比, 并允许降低励磁强度和/或曝光时间, 但以牺牲光学分辨率为代价。此外, 为了减少光毒性, 我们在培养基中添加了活性氧的清除剂。在今后的研究中, 可以对检测结果进行修改, 以图象细胞凋亡的人红细胞的吞噬。应用 Ca2 +离子载体, 如 A23187, 可用于诱导磷脂外化23, 一个 "吃我" 信号和早期凋亡的标志24,25。
披露声明
作者没有什么可透露的。
致谢
这项工作得到赠款 ha 3271/4-1 和 ha 3271/4-2 从科技 (德意志的), 和赠款 FF-2016-05 从 1003 (卓越集群 1003), 细胞在运动 (CiM), 的支持。
材料
| Name | Company | Catalog Number | Comments |
| 24 G plastic catheter | B Braun Mesungen AG, Germany | 4254503-01 | Used for peritoneal lavage |
| Hank’s buffered salt solution without Ca2+ and Mg2+ | Thermo Fisher Scientific | 14170120 | Used for peritoneal lavage |
| 14 mL polypropylene round bottom tubes | BD Falcon | 352059 | Used to collect peritoneal cells |
| RPMI 1640 medium containing 20 mM Hepes | Sigma-Aldrich | R7388 | Basis medium for assays |
| Heat-inactivated fetal bovine serum | Thermo Fisher Scientific | 10082139 | Used as supplement for RPMI 1640 media |
| 100x penicillin/streptomycin | Thermo Fisher Scientific | 15140122 | Used as supplement for RPMI 1640 media |
| Fibronectin-coated µ-Slide I chambers | Ibidi, Martinsried, Germany | 80102 | Channel slides used for assays |
| µ-Slide (anodized aluminum) rack | Ibidi, Martinsried, Germany | 80003 | Autoclavable stackable rack for channel slides |
| RPMI 1640 medium containing bicarbonate | Sigma-Aldrich | R8758 | Medium for overnight culture |
| N-(2-mercaptopropionyl)glycine | Sigma-Aldrich | M6635 | Scavenger of reactive oxygen species |
| Alexa Fluor 488-conjugated rat (IgG2a) monoclonal (clone BM8) anti-mouse F4/80 antibody | Thermo Fisher Scientific | MF48020 | Mouse macrophage marker and plasma membrane label |
| CellMask Orange | Thermo Fisher Scientific | C10045 | Red fluorescent plasma membrane stain |
| Succinimidyl ester of pHrodo | Thermo Fisher Scientific | P36600 | Amine-reactive succinimidyl ester of pHrodo |
| Mouse (IgG2b) monoclonal (clone HIR2) anti-human CD235a | Thermo Fisher Scientific | MA1-20893 | Used to opsonize human red blood cells with IgG |
| Alexa Fluor 594-conjugated goat anti-mouse (secondary) IgG antibody | Abcam | Ab150116 | Used to confirm opsonization of human red blood cells with mouse IgG |
| Rat anti-mouse C3b/iC3b/C3c antibody | Hycult Biotech | HM1065 | Used to confirm C3b/iC3b opsonization of human red blood cells |
| Alexa Fluor 488-conjugated goat anti-rat IgG antibody | Thermo Fisher Scientific | A-11006 | Used as secondary antibody to confirm C3b/iC3b opsonization |
| Calcein/AM | Thermo Fisher Scientific | C3100MP | Used to load human red blood cells with Calcein |
| UltraVIEW Vox 3D live cell imaging system | Perkin Elmer, Rodgau, Germany | Spinning disk confocal microscope system | |
| Nikon Eclipse Ti inverse microscope | Nikon, Japan | Inverted microscope | |
| CSU-X1 spinning disk scanner | Yokogawa Electric Corporation, Japan | Nipkow spinning disk unit | |
| 14-bit Hamamatsu C9100-50 Electron Multiplying-Charged Couple Device (EM-CCD) peltier-cooled camera | Hamamatsu Photonics Inc., Japan | EM-CCD camera of the spinning disk confocal microscope system | |
| 488 nm solid state laser, 50 mW | Perkin Elmer, Rodgau, Germany | Laser (488 nm) source of spinning disk confocal microscope system | |
| 561 nm solid state laser, 50 mW | Perkin Elmer, Rodgau, Germany | Laser (561 nm) source of spinning disk confocal microscope system |
参考文献
- Tauber, A. I. Metchnikoff and the phagocytosis theory. Nature reviews. Molecular cell biology. 4, 897-901 (2003).
- Kaplan, G. Differences in the mode of phagocytosis with Fc and C3 receptors in macrophages. Scandinavian journal of immunology. 6, 797-807 (1977).
- Cooper, J. A. Effects of cytochalasin and phalloidin on actin. The journal of cell biology. 105, 1473-1478 (1987).
- Caron, E., Hall, A. Identification of two distinct mechanisms of phagocytosis controlled by different Rho GTPases. Science. 282, 1717-1721 (1998).
- Aderem, A., Underhill, D. M. Mechanisms of phagocytosis in macrophages. Annual review of immunology. 17, 593-623 (1999).
- Chimini, G., Chavrier, P. Function of Rho family proteins in actin dynamics during phagocytosis and engulfment. Nature cell biology. 2, E191-E196 (2000).
- Castellano, F., Chavrier, P., Caron, E. Actin dynamics during phagocytosis. Seminars in immunology. 13, 347-355 (2001).
- Swanson, J. A. Shaping cups into phagosomes and macropinosomes. Nature reviews. Molecular cell biology. 9, 639-649 (2008).
- Underhill, D. M., Goodridge, H. S. Information processing during phagocytosis. Nature reviews. Immunology. 12, 492-502 (2012).
- Munthe-Kaas, A. C., Kaplan, G., Seljelid, R. On the mechanism of internalization of opsonized particles by rat Kupffer cells in vitro. Experimental cell research. , 201-212 (1976).
- Rougerie, P., Miskolci, V., Cox, D. Generation of membrane structures during phagocytosis and chemotaxis of macrophages: role and regulation of the actin cytoskeleton. Immunological reviews. , 222-239 (2013).
- Liu, Z., et al. Nanoscale optomechanical actuators for controlling mechanotransduction in living cells. Nature. 13, 143-146 (2016).
- Valentim, A. M., Guedes, S. R., Pereira, A. M., Antunes, L. M. Euthanasia using gaseous agents in laboratory rodents. Laboratory animals. 50, 241-253 (2016).
- McCarren, H. S., Moore, J. T., Kelz, M. B. Assessing changes in volatile general anesthetic sensitivity of mice after local or systemic pharmacological intervention. Journal of visualized experiments. (80), e51079 (2013).
- Horsthemke, M., et al. Multiple roles of filopodial dynamics in particle capture and phagocytosis and phenotypes of Cdc42 and Myo10 deletion. The Journal of biological chemistry. 292, 7258-7273 (2017).
- Bzymek, R., et al. Real-time two- and three-dimensional imaging of monocyte motility and navigation on planar surfaces and in collagen matrices: Roles of Rho. Scientific reports. 6, 25016 (2016).
- Poole, J. Red cell antigens on band 3 and glycophorin A. Blood reviews. 14, 31-43 (2000).
- Aoki, T. A Comprehensive review of our current understanding of red blood cell (RBC) glycoproteins. Membranes. 7, (2017).
- Song, L., Hennink, E. J., Young, I. T., Tanke, H. J. Photobleaching kinetics of fluorescein in quantitative fluorescence microscopy. Biophysical journal. 68, 2588-2600 (1995).
- Miksa, M., Komura, H., Wu, R., Shah, K. G., Wang, P. A novel method to determine the engulfment of apoptotic cells by macrophages using pHrodo succinimidyl ester. Journal of immunological. 342, 71-77 (2009).
- Boross, P., et al. FcRgamma-chain ITAM signaling is critically required for cross-presentation of soluble antibody-antigen complexes by dendritic cells. Journal of immunology. , 5506-5514 (2014).
- Ehrenstein, M. R., Notley, C. A. The importance of natural IgM: scavenger, protector and regulator. Nature reviews. Immunology. 10, 778-786 (2010).
- Closse, C., Dachary-Prigent, J., Boisseau, M. R. Phosphatidylserine-related adhesion of human erythrocytes to vascular endothelium. British journal of haematology. , 300-302 (1999).
- Barth, N. D., Marwick, J. A., Vendrell, M., Rossi, A. G., Dransfield, I. The "phagocytic synapse" and clearance of apoptotic cells. Frontiers in immunology. 8, 1708 (2017).
- Sivagnanam, U., Palanirajan, S. K., Gummadi, S. N. The role of human phospholipid scramblases in apoptosis: An overview. Biochimica et biophysica acta. 1864, 2261-2271 (2017).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。