需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
髓轴突原位光谱 Reflectometric 显微术
摘要
在这里, 我们提出了一个分步协议的成像髓轴突在固定脑切片使用无标签的纳米尺度成像技术的基础上的光谱反射。
摘要
在哺乳动物神经系统中, 髓鞘通过将轴突纤维包裹成多层螺旋来提供电绝缘。在其高度组织的亚细胞体系结构的启发下, 我们最近开发了一种新的成像方式, 命名为光谱反射 (SpeRe), 它能够实现前所未有的无标签的现场髓轴突的纳米级成像。其基本原理是通过对多层亚细胞结构的反射谱进行分析, 获得纳米信息。在本文中, 我们描述了一个详细的分步协议, 以执行一个基本的 SpeRe 成像的神经组织使用一个商业共焦显微系统, 配备了白光激光器和可调谐滤波器。本文介绍了样品制备、光谱数据采集、图像处理等程序, 以获取纳米信息。
引言
在哺乳动物神经系统中, 髓鞘通过将轴突纤维包裹成多层膜鞘来提供快速的神经传导和轴突完整性。其多层结构由由等离子膜 (5 纳米)、细胞质 (~ 3 nm) 和胞外空间 (~ 7 nm)1、2组成的交替纳米薄膜组成。光学显微术, 包括最近的超分辨率显微镜, 不适合观察纳米髓鞘动力学, 由于其分辨率不足, 由于光学衍射3,4,5。尽管电子显微镜可以提供髓鞘纳米结构的细微细节, 但由于具有化学固定和 ultrasectioning6、7的高侵入性样品制剂, 它与生物系统不相容..直到最近, 还没有一种技术适用于髓轴突的纳米级动态观测。
Schain等人此前曾报道, 髓轴突呈现彩色光反射率8。通过对反射光的光谱分析, 我们设计了一种新的成像方式, 用于髓轴突的纳米成像, 称为光谱反射 (SpeRe)9。SpeRe 是基于在髓鞘多层结构中发生的薄膜干扰 (图 1)。通过对各种轴突的光学模拟, 揭示了反射谱是波数的周期性函数, 其周期性 (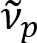 ) 与轴突直径 (d) 成反比。这种简单的关系
) 与轴突直径 (d) 成反比。这种简单的关系 () 提供了 SpeRe 数据的轴突直径的简便量化。利用这一点, 我们发现在我们的前报告中, 在轻度外伤性颅脑损伤下的流行轴突肿胀。
() 提供了 SpeRe 数据的轴突直径的简便量化。利用这一点, 我们发现在我们的前报告中, 在轻度外伤性颅脑损伤下的流行轴突肿胀。
SpeRe 系统以共焦显微镜为基础, 由专门的激光源和过滤器组成 (图 2)。输入源是白光激光器, 提供了红外区域可见的宽带频谱输出。对于光谱扫描, 系统配备两个声光器件: 一种声光可调谐滤波器 (AOTF), 用于从输入宽带源和声光光束分配器 (AOBS) 中传送选定的波长, 以指导选定的反射波长到探测器。高光谱共焦显微镜软件 (见材料表) 提供了一个可定制的光谱扫描选项, 以顺序获取各种输入波长的反射图像。此外, 色差能严重干扰光谱测量;因此, 建议使用复消色差物镜。
注意, 白光激光器产生不均匀的光谱输出, 光学元件也影响光谱剖面。因此, 需要对获得的光谱进行校准, 以便随后进行定量分析。受保护的银镜通常用作参考, 在整个可见区域上提供几乎恒定的反射率 (> 97%)。获得的光谱然后除以参考光谱从镜子。
光谱扫描的光谱步长决定了采集速度;因此, 它需要进行优化。由于一个较大的轴突具有较高的频谱周期, 它需要更精细的光谱取样。例如, 一个直径为10µm 的轴突, 是最大的生理轴突之一, 其光谱周期为 ~ 8 nm。应用采样标准, 采用 4 nm 的光谱采样间隔, 覆盖了小鼠神经组织的所有生理轴突。这种方法通常需要几秒钟的全光谱扫描, 因此不适合在体内应用, 其中生理运动 (如呼吸和心跳) 干扰稳定的光谱习得。我们以前通过检测一个自定义的垂直显微镜来解决这个问题, 它设计为每个点使用阵列光谱仪 (采集速度≈每像素30毫秒) 获得全部频谱。
在本报告中, 我们描述了一个关于固定脑切片的 SpeRe 成像的详细协议, 可以在商业高光谱显微镜下进行 (见材料表)。因此, 该协议可以由没有光学仪器专业知识的实验者完成。我们还讨论了 SpeRe 数据的获取和分析的潜在问题和疑难解答。
研究方案
所有手术程序均经成均大学机构动物护理和使用委员会 (IACUC) 批准。
1. 样品准备
注: 所有外科器械在动物搬运前都要用高压釜。在一个专门用于外科手术的房间里进行所有外科手术。手术室所有人员都应佩戴无菌的手术袍和手套。
-
组织固定
- 在 PBS 中准备两个10毫升的注射器, 每个灌满磷酸盐缓冲盐水 (pbs) 和4% 多聚甲醛 (粉煤灰)。
- 麻醉7-12 周大的老鼠, (C57BL/6J 或任何性别的鼠标线) 通过管理混合的 zoletil 和甲苯噻嗪 (1:1, 20 毫克/千克) 或替代适当的麻醉机制 (例如, 混合80毫克/千克氯胺酮和10毫克/千克甲苯噻嗪) 腹腔注射。
- 一旦鼠标到达麻醉的手术平面 (使用脚趾捏-反应方法), 暴露心脏通过切断皮肤和肋骨笼用剪刀。
- 用小剪刀剪右心房, 用针 (灌注率 = 4 毫升/分, 每种溶液的容积 = 10 毫升), 通过左心室依次排出血液并灌注 PBS 和粉煤灰溶液。
注意: 如果过程成功完成, 鼠标就会变硬。使用眼膏或绝育是没有必要的, 因为程序是终端。可跳过固定程序。然而, 建议这一步骤尽量减少结构变形, 包括机械组织损伤和缺血性轴突肿胀。有关组织固定的进一步细节, 请参阅本条, g.j.等。10
-
脑切片的制备
- 用手术剪刀把老鼠斩首腹胸和腹部。
- 使用适当的小剪刀取出头皮和骨膜, 直到完全暴露颅骨。
- 用小剪刀把前额骨和颅骨沿矢状缝线切开, 小心不要损伤大脑。
- 用细钳轻轻地取出颅骨和硬脑膜。
- 用柔软的塑料勺子提取大脑, 注意不要损伤组织。
- 冲洗和浸泡在4% 粉煤灰溶液中提取的大脑在4摄氏度30分钟。
- 用 vibratome 将固定的大脑切片成 100-150 µm 节。
注: 有关组织准备的进一步细节, 请参阅本文的塞格夫等。11. 对于后续的程序, 应将组织切片成比间隔厚度更薄的切片。
-
脑切片的安装
- 为每个组织切片准备1张玻璃滑梯和2平方盖眼镜 (22 x 22 x 0.17 毫米)。
- 使用玻璃切割机将方形罩玻璃切成一半 (两个矩形件)。
- 在幻灯片玻璃上使用超级胶水将两个半盖眼镜连接起来。
注意: 两个半杯之间的空间应该比组织切片的大小稍大一些。 - 用刷子或吸管收割脑切片, 并将纸巾放在隔板之间的滑动玻璃上。注意不要折叠组织。
- 在组织表面分配 100 ul 的 PBS。
- 将另一方形盖子玻璃放在组织的顶部。在这一阶段避免气泡的加入。
- 使用指甲油 (或合适的粘合剂) 在盖子玻璃周围密封, 以防止 PBS 蒸发, 并在随后的成像过程中灰尘污染。
注意: 实验者可能在这个阶段暂停。
2. 校准
- 在成像前至少在显微镜上切换1小时, 以允许激光源的热稳定 (见材料表)。然后, 打开用于光谱扫描的软件 (参见材料表), 然后单击 GUI 顶部的 "获取" 按钮 (图 3a).
- 打开白光激光器和光电倍增管 (PMT) 的软件快门 (图 3a)。
- 在获取模式下的下拉列表中选择xyΛ模式, 然后将激光输入模式自动从恒定百分比更改为恒功率。取消选中自动 SP 移动的复选框。然后, 将输入激光器的光谱窗口设置为 470–670 nm 和光谱步长到 4 nm 的λ激发 Lambda 扫描设置(图 3b)。
- 通过双击或移动用于光谱范围的调整条 (图 3c), 将 PMT 的频谱范围设置为450-690。
注: 此光谱范围应包括输入源的完整带宽。 - 选择一个水浸泡物镜, 适当的高数值孔径 (NA > 0.7), 并给予任何价值的 PMT 和激光功率, 以激活AOBS 配置和实时扫描按钮。通过检查AOBS 配置中的反射来切换光学路径 (图 3d)。
- 在显微镜阶段安装参考镜 (见材料表)。镜面应面对物镜。如果不容易把镜子放在显微镜台上, 把镜子粘在平板上 (如滑动玻璃)。
- 控制显微镜阶段, 使焦平面与镜面表面对齐。
- 调整 PMT 增益和激光功率考虑探测器的动态范围, 然后将激光输入模式从恒定的百分比转换为恒功率。
注: 通常情况下, PMT 增益为 500 (V), 相对激光功率为 0.1%, 用于 570 nm。 - 在伪色模式下确认, 以检查波长范围内没有饱和度。如果观测到饱和度, 则降低激光功率 (图 3a)。
- 运行Lambda 扫描获取。
- 从舞台上移除镜像, 并在没有样本的情况下重复相同的捕获, 以获取暗参照 (即暗偏移)。
- 以Multistacked TIF格式保存数据。
3. SpeRe 图像采集
- 将已安装的组织置于显微镜阶段。要大致将组织与物镜的焦平面对齐, 可通过眼片使用广域荧光模式。
- 使用实时扫描, 控制显微镜阶段, 使焦平面与组织中感兴趣的区域对齐。为避免来自盖板滑动的背景噪音, 请从玻璃组织界面中选择至少15微米深度的目标区域。
- 使用步骤2.1–2.10 中描述的相同过程获取目标区域的光谱图像堆栈。
- 以Multistacked TIF格式保存组织的数据和暗偏移量。
注意: 实验者可能在这个阶段暂停。
4. 图像处理与分析
- 在 ImageJ 中打开参考镜和脑组织的光谱数据 (multistacked TIF)。
- 为已打开的图像栈选择 ROIs (感兴趣的区域), 即参考镜的中心区域和用于脑组织的轴突纤维的片段。
- 获取所选 ROIs 的原始光谱, 方法是运行图像→堆栈→在 ImageJ 菜单上绘制 Z 轴轮廓。
- 打开暗偏移数据, 一个为参考镜和其他为脑组织采取。
- 通过运行图像来获取暗偏移的光谱→堆栈→在 ImageJ 菜单上绘制 Z 轴轮廓。
- 使用复制和粘贴选项保存所有获得的光谱。
注: 对于 SpeRe 成像, 建议使用中心成像场最小化离轴光学畸变。轴突纤维可能是结构上的异构沿其长度。因此, 建议在小轴突段 (通常 < 5 µm) 中选择 ROI, 以最小化部分体积工件。
5. 基线校正和 SpeRe 信号分析
- 从参考镜和脑组织的光谱中减去偏移光谱。
- 通过划分光谱的最大强度来正常化每个频谱。
- 将轴突的归一化谱除以参考镜的归一化光谱, 并从归一谱中减去 DC 偏移量。
- 通过将获得的频谱拟合为正弦曲线来测量波数频率 (参见材料表), 然后通过对等的方法将获得的波数转换为周期性。
- 使用图 4c中的等式将波数周期性转换为轴突直径。
结果
根据该协议, 用外源染色、髓鞘靶向荧光 (见材料表) 制备了固定脑切片。用商业高光谱共聚焦显微镜结合共焦荧光成像 (图 4a) 对脑切片进行 SpeRe 成像。对于 SpeRe, 输入光学强度设置为5µW/µm2 , 像素停留时间为1µs。这种光剂量比常规荧光共聚焦显微镜12级低。它需要 ~ 十七年代为光谱扫描470-670 毫微米在间隔4毫?...
讨论
SpeRe 是一种新的基于光谱干涉的无标签成像模式, 它首次提供了实时髓轴突中的纳米尺度信息。在当前的采集协议中, 轴突直径的空间分辨率为 10 nm。此外, SpeRe 利用数量级较低的光剂量比其他超分辨率镜;因此, 它是免费的毒性和漂白。SpeRe 将为研究髓轴突的纳米级动力学提供一个新的途径。
本文所描述的协议是基于声光学和点探测器 (即PMT) 介导的光谱扫描。该方法有?...
披露声明
作者宣布了相互竞争的金融利益: j. 和蔡是本文所描述的专利未决技术的发明者。
致谢
这项工作得到了基础科学研究所 (IBS-R015-D1) 和由教育部 (2017R1A6A1A03015642) 资助的韩国国家研究基金会 (NRF) 的基础科学研究项目的支持。
材料
| Name | Company | Catalog Number | Comments |
| Glass cutter | - | - | Can be purchased in a local convenience store or online stores. |
| Nail polish | - | - | Can be purchased in a local convenience store or online stores. |
| Apochromat objective 40×, NA 1.1 | Leica Microsystems | 15506357 | Water-immersion type |
| Fluoromyelin Green | Thermo Fisher | F34651 | Alternatively, Fluoromyelin Red (F34652) can be used. |
| Leica SP8 TCS microscope | Leica Microsystems | SP8 | Refer to the "Configuration of microscope" in Introduction Section for details. |
| Imaging software | Leica Microsystems | LAS-X | - |
| Matlab | MathWorks | - | - |
| Mirror | Thorlabs | PF10-03-P01 | Coated with protected silver. |
| Phosphate-buffered saline (PBS) | Life technologies | 14190-136 | - |
| Paraformaldehyde | Biosolution | BP031a | 4% v/v in PBS |
| Cover slip | Thermo Fisher | 3306 | Thickness: #1 (0.13 to 0.17 mm) |
| Slide glass | Muto Pure Chemicals | 5116-20F | Thickness: ~1 mm |
| Super glue | Henkel | Loctite 406 | Use a dispensing equipment to avoid skin or eye contact. |
| Syringe pump | Brainetree Scientific | BS-8000 DUAL | - |
| Vibratome | Leica Biosystems | VT1200S | - |
| White-light laser | NKT photonics | EXB-6 | EXB-6 was discontinued and replaced by EXU-6. |
参考文献
- Fernandez-Moran, H., Finean, J. B. Electron microscope and low-angle x-ray diffraction studies of the nerve myelin sheath. Journal of Cell Biology. 3, (1957).
- Blaurock, A. E. The spaces between membrane bilayers within PNS myelin as characterized by X-ray diffraction. Brain Research. 210, 383-387 (1981).
- Shim, S. -. H., et al. Super-resolution fluorescence imaging of organelles in live cells with photoswitchable membrane probes. Proceedings of the National Academy of Sciences. , 13978-13983 (2012).
- Urban, N. T., Willig, K. I., Hell, S. W., Nägerl, U. V. STED nanoscopy of actin dynamics in synapses deep inside living brain slices. Biophysics Journal. 101, 1277-1284 (2011).
- Manley, S., et al. High-density mapping of single-molecule trajectories with photoactivated localization microscopy. Nature Methods. 5, 155-157 (2008).
- Peters, A., Sethares, C. Is there remyelination during aging of the primate central nervous system?. Journal of Comparative Neurology. 460, 238-254 (2003).
- De Campos Vidal, B., Silveira Mello, M. L., Caseiro-Filho, A. C., Godo, C. Anisotropic properties of the myelin sheath. Acta Histochemica. 66, 32-39 (1980).
- Schain, A. J., Hill, R. A., Grutzendler, J. Label-free in vivo imaging of myelinated axons in health and disease with spectral confocal reflectance microscopy. Nature Medicine. 20, 443-449 (2014).
- Kwon, J., et al. Label-free nanoscale optical metrology on myelinated axons in vivo. Nature Communication. 8, 1832 (2017).
- Gage, G. J., Kipke, D. R., Shain, W. Whole Animal Perfusion Fixation for Rodents. JoVE. (65), e3564 (2012).
- Segev, A., Garcia-Oscos, F., Kourrich, S. Whole-cell Patch-clamp Recordings in Brain Slices. JoVE. (112), e54024 (2016).
- Waldchen, S., Lehmann, J., Klein, T., Van De Linde, S., Sauer, M. Light-induced cell damage in live-cell super-resolution microscopy. Scientific Reports. 5, 15348 (2015).
- Chang, J. B., et al. Iterative expansion microscopy. Nature Methods. 14, 593-599 (2017).
- Polishchuk, R. S., et al. Correlative light-electron microscopy reveals the tubular-saccular ultrastructure of carriers operating between Golgi apparatus and plasma membrane. Journal of Cell Biology. 148, 45-58 (2000).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。