Method Article
循环介导等温扩增 (灯管) 法快速识别烟粉虱
摘要
本文报道了一种基于环路介导等温扩增 (灯管) 技术的烟粉虱快速鉴定方法。该议定书要求进行最少的实验室培训, 因此可以在港口和机场等植物进口点现场实施。
摘要
粉虱烟粉虱(康海涛) 是一种相当重要的侵入性害虫, 影响着世界许多国家的蔬菜和观赏植物的生产。严重的产量损失是由直接喂养造成的, 更重要的是, 还有超过100种有害植物致病病毒的传播。至于其他侵入性害虫, 增加的国际贸易有助于将B. 粉虱分散到超出其原产范围的地区。因此, 在海港和机场等入境点检查工厂进口产品, 被视为一项重要的预防措施。然而, 只有在快速识别可疑昆虫标本的方法可用的情况下, 才能有效地抵御害虫入侵的最后防线。由于受控B 粉虱与近亲无检疫状态之间的形态学差异难以分类学家, 基于环介导等温扩增的快速分子识别方法 (灯) 技术的发展。本出版物报告了描述快速 DNA 提取、灯泡反应的设置以及对其读数的解释的新检测方法的详细协议, 该方法允许在一小时内识别B 粉虱标本。与现有的用于检测特定b. 粉虱虱的协议相比, 该方法在一项试验中针对整个b 粉虱物种复合物。此外, 该检测方法被设计为在现场由植物卫生检查员在入口点直接进行最少的实验室训练。在实验室和现场条件下进行的彻底验证表明, 所报告的灯泡检测是一种快速可靠的识别工具, 改善了B. 粉虱的管理。
引言
粉虱烟粉虱(康海涛) 是一种侵入性害虫, 影响许多经济重要作物的产量, 包括观赏植物、蔬菜、谷物豆类和棉花1,2。除了直接韧皮部喂养造成的损害之外, 同翅目物种通过大量的蜜汁排泄到树叶和果实表面, 以及通过大量植物致病病毒的传播, 间接伤害植物1,3,4. 最近的遗传学研究比较线粒体基因细胞色素c氧化酶 1 (morphocryptic) 的 DNA 序列表明, 粉虱是一种物种复合物, 至少有34个物种3,4。来自中东和亚洲小区域的这一复杂的生物型 B 中的两个高度侵入性和破坏性的成员, 以及来自地中海地区的生物型 Q, 已在全球范围内通过国际贸易分散开来。与植物产品的活动, 特别是通过运输观赏植物1,5,6。由于其全球害虫状况, 国际自然和自然资源保护联合会 (自然保护联盟) 列为 "世界100个最严重的外来入侵物种" 之一, 而物种综合体的成员则受许多国家1、3、4。
在欧盟 (eu), B. 粉虱被列为植物健康指令 2000/29/EC 附件1AI 作为检疫有机体, 其介绍从非欧盟国家和它在欧盟内的传播被禁止4。防止检疫有机体扩散的一项基本预防措施是检查在入境点 (民营企业) 的工厂出货量 (如机场和海港7,8)。在发现检疫有机体的情况下, 国家植物保护组织 (蛾) 负责采取行动, 要么拒绝或处理 (包括销毁) 受感染的货物9。然而, 检查进口的人员往往没有分类专门知识来准确识别与全球贸易有关的种类繁多的虫害9。特别是不成熟的生命阶段 (如卵子和幼虫) 的鉴定, 对于非分类学家8、9、10几乎是不可能的。因此, 为了使检疫措施能够以最小的延迟实施, 需要进行替代的快速现场鉴定检测9。
候选方法是循环介导的等温 DNA 扩增 (灯管) 技术, 最近被证明是一种适用于鉴定植物病原体11、12、13的技术。灯是高度特定的, 因为该方法使用至少两个引物对识别六个不同的 DNA 靶序列14。由于Bst dna 聚合酶的 dna 链位移活性, 在等温条件下进行灯泡反应14。因此, 与传统的聚合酶链反应 (PCR) 检测方法不同的是, 无需进行热循环仪13,14。PCR 检测的另一个优势是它能够抵御 dna 提取物中的潜在抑制剂, 规避 dna 纯化步骤13的需要。由于协议的速度和简单性, 灯泡甚至可以在现场条件下使用便携式, 电池驱动的实时检测设备8,15。
为了满足对B. 粉虱8快速现场识别方法的需求, 设计了一盏灯泡检测。其首要目标是制定一项可由植物卫生检查员进行有限的实验室培训的议定书。因此, 对议定书的速度和简易性进行了很大的关注。虽然现有的诊断测试通常是为了鉴定b 粉虱的一个或几个虱而开发的, 但新的灯泡检测覆盖了整个b. 粉虱种类复杂8,16,17 ,18。利用不同引物集的组合和退化底漆8的应用, 解决了复合体中明显的遗传群内多样性问题。这部小说B. 粉虱灯的测定方法是以这样的方式, 引物靶向线粒体8的 3 ' 末端的一个片段。这个基因为动物诊断检测提供了一个合适的目标, 因为它的区域足够保守, 以确保对特定物种的诊断敏感性, 同时在紧密相关的生物体之间辨别足够19,20. 此外, 在人口遗传学研究和 dna 条形码分析的签名序列中, 该物基因通常被用作基因标记, 从而在开源数据库中产生大量 dna 序列条目, 如 GenBank 和粗体21 ,22。除了来自B. 粉虱的可公开的黑虱序列之外, 还有密切相关的物种序列 ( [n = 2]、 Aleurochiton aceris、 Aleurodicus dugesii、烟杆菌 [n = 3]、Neomaskellia andropogonis、 Tetraleurodes acaciae和温室spp [N = 4]) 被纳入本研究的底漆设计中, 用于评估硅8中的诊断灵敏度和特异性。.
由于该方法的准确性、其速度 (< 1 小时) 和协议的简单性, 该检测结果适用于在瑞士 POE8中作为进口控制程序的一部分实施的现场应用。
研究方案
1. 准备工作
- 制备碱性 DNA 萃取液的等份。
- 使用分子级水补充600µM 氢氧化钾 (KOH) 和2µM 甲酚红, 生成碱性 DNA 萃取液的库存。
注意: KOH 是水中溶解的强碱基。避免溢出, 皮肤和眼睛接触。 - 将30µL 碱性 DNA 萃取液 (在步骤1.1.1 中制备) 放入0.5 毫升微量离心管中, 并将等份储存在4摄氏度。
注: 在1年内使用按 DNA 萃取液。
- 使用分子级水补充600µM 氢氧化钾 (KOH) 和2µM 甲酚红, 生成碱性 DNA 萃取液的库存。
- 准备B. 粉虱阳性放大控制 (PAC)。
- 生成荧光靶 DNA 片段的 PCR 扩增子。
注: 一般 PCR 原理和实践的介绍由洛仑兹23提供。- 合成或获得引物 C1-J-2195 (5 '-TTGATTTTTTGGTCATCCAGAAGT-3 ') 和 TL2-N-3014 (5 '-TCCAATGCACTAATCTGCCATATTA-3′) 放大线粒体基因的片段24,25。
- 如表 1所述, 设置 PCR 反应。使用 dna 提取物 (参见步骤 2.1) 的参考B. 粉虱标本作为 dna 模板。
注: 也可以根据制造商的说明, 使用商业工具包提取 PAC 的B. 粉虱DNA。 - 使用以下条件对热循环仪进行编程:15 分钟 (95 摄氏度);45个周期的四十年代在95摄氏度, 十五年代在45摄氏度, 斜坡在六十年代至60摄氏度, 2 分钟在72摄氏度;7分钟, 72 摄氏度;保持在4摄氏度。
- 根据制造商的协议, 使用商业 pcr 清理工具包清洁 pcr 扩增产品, 并洗脱分子级水中的最终产物。
- 使用带有 DNA 插层染料的商业试剂盒, 根据制造商的指示测量 PCR 扩增产品的 DNA 浓度, 并将分子级水稀释至浓度为 1 ng/µL. 存储稀释 PCR 扩增产品作为 PAC 库存解决方案, 在-20 摄氏度。
注: 在1年内使用 PAC 库存解决方案。 - 补充 PAC 库存解决方案 (在步骤1.2.1.5 中准备) 与0.6 µM KOH 和稀释与分子级水浓度 5 x 10-3 ng/µL. 将产品存储在4摄氏度。
注: 在 5 h 内使用 PAC, 准备下一步骤中所述的即用型粉虱灯套件。
- 生成荧光靶 DNA 片段的 PCR 扩增子。
-
准备好使用B 粉虱灯套件 (协议20台)
- 用剪刀把8管灯条切成两个4管的灯条。
- 根据图 1所示的方案, 对4管灯条的管进行标注。
- 准备B 粉虱灯反应 mastermix (80 反应的协议)。
- 添加1195.1 µL 现成使用的 GspSSD 等温主混合物 (包含 GspSSD 聚合酶、焦磷酸酶、硫酸镁、deoxynucleotides、双链结合 DNA 结合染料) 和717.4 µL B. 粉虱灯底漆混合到2毫升微量离心管。短暂涡旋和脉冲离心机。
- 将22.5 µL 的粉虱灯反应 mastermix (在步骤1.3.3.1 中准备) 放入4管灯条 (在步骤1.3.1 中准备) 和脉冲离心机的每个管中。
- 涡旋粉虱灯 PAC (在步骤1.2 中准备) 快速和脉冲离心机。然后, 将2.5 µL 添加到每个4管灯条的 "PAC" 标记的管中 (图 1)。
- 关闭盖子并将现成使用的B 粉虱灯套件单元存放在-20 摄氏度。
注: 在1年内使用。
2. 现场灯具分析
- DNA 提取
- 使用无菌牙签将昆虫标本转移到含有30µL DNA 萃取液的0.5 毫升微量离心管中 (在步骤1.1.2 中制备)。
注意: 确保昆虫浸入萃取液中。 - 在 thermomixer (300 rpm) 的95摄氏度下孵育样品5分钟。短暂涡旋和脉冲离心机。
- 使用无菌牙签将昆虫标本转移到含有30µL DNA 萃取液的0.5 毫升微量离心管中 (在步骤1.1.2 中制备)。
-
B. 粉虱灯检测
- 解冻在步骤1.3 中准备好使用的B 粉虱灯套件。快速涡旋和脉冲离心机。
注意: 对于每个试剂盒, 可以测试两个不同的标本, 也可以对一个标本的 DNA 提取物进行重复分析。 - 将2.5 µL 样品 DNA 提取物 (在步骤2.1 中准备好) 放入标记为 "S1" 和 "S2" 的管状粉虱灯套件 (图 1)。
- 将2.5 µL 的纯碱性 DNA 萃取液 (在第1.1 部分) 添加到标记为 "NAC" 的管中, 用于负放大控制 (图 1)。
- 快速涡旋粉虱灯套件和脉冲离心机。
- 将现成的B 粉虱灯套件插入灯具分析设备 (实时荧光测量) 或实时 PCR 平台, 并在65摄氏度下进行等温 DNA 放大分析, 60 分钟。
- 通过加热至98摄氏度 (斜坡速率为0.05 摄氏度) 至75摄氏度, 同时实时测量荧光, 测量 DNA 放大产品的熔化温度。
- 解冻在步骤1.3 中准备好使用的B 粉虱灯套件。快速涡旋和脉冲离心机。
- 灯泡检测读数
- 手动验证灯的读数, 如下所示。
- 如果检测到样本和 PAC 的 dna 扩增, 则不测量 NAC 的 dna 扩增, 放大产物的退火温度介于80.0 和85.5 摄氏度之间, 认为灯泡结果为正 (图 2)。
- 如果样品没有 DNA 扩增 (即,管标为 S1 和 S2), 但对于 PAC 和 NAC, 则将灯泡结果视为负值 (图 2)。
- 如果对样本进行了 DNA 扩增, 但相应放大产物的退火温度超出了 80.0 u2012 85.5 摄氏度, 并且/或 PAC 没有给出 dna 放大, 并且/或 NAC 给出了 dna 放大, 认为灯泡结果为无效 (图 2)。
- (可选) 使用灯泡验证应用程序 (补充文件 1) 验证灯泡读数。
- 定义目标物种并定义测试样本的数量。单击"生成报告"按钮。
- 将预读 (DNA 放大是/否, 退火温度放大产品, PAC 和 NAC 的结果) 从现场灯具分析设备或实时 PCR 平台转移到验证应用的相应输入字段。输入数据后立即显示验证结果。
- 手动验证灯的读数, 如下所示。
结果
在B. 粉虱灯测定的验证过程中, 分析了在瑞士常规进口控制过程中截获的昆虫标本8。这些标本来自八个不同的国家 (加那利群岛、多米尼加共和国、以色列、马来西亚、摩洛哥、新加坡、泰国和越南), 反映了在欧洲民营企业8发现的B. 粉虱的遗传多样性。所有的灯结果通过 DNA 条形码8交叉验证。
由灯具分析的80个标本中, 75 个标本 (93.8%) 被正确识别为b. 粉虱(真阳性), 两种标本 (2.5%) 被正确识别为不b. 粉虱(真阴性) 和三标本 (3.8%)被错误地识别为不是B 粉虱(假底片) (表 2)8。正确的阴性结果来源于两个温室白粉虱标本, 一种在高风险下不受管制的物种在民营企业的植物产品中与B. 粉虱混淆8。根据这些结果, 计算了以下诊断精度的测量值: 测试特异性 (真-负率), 100%;测试灵敏度 (真阳性率), 96.2%;测试效率 (正确测试结果的百分比), 96.3% (表 2)8。在评估分析灵敏度 (检测限值) 时, B. 粉虱灯检测成功地将样品 DNA 稀释为 100 fg/µL 三技术复制 (表 3)。
在瑞士 POE 苏黎世机场的现场条件下, 使用现成的B. 粉虱灯套件8进行了检测 (N = 13) 的一个子集。在参考实验室进行交叉验证时, 现场测试的所有结果都被发现是正确的 (测试效率 = 100%)8。评估现场灯泡检测性能, 平均时间为正数 (时间至阳性结果可用) 为38.4 ±10.3 分钟 (平均±标准差)8。在现场条件下进行的B. 粉虱灯分析中的代表性 DNA 扩增图和相应的退火导数如图 3A 和 b所示。在本例中, 样本一和二被正确地识别为B.在大约30分钟 (图 3A) 和预期退火温度约为82摄氏度 (图 3B) 后, DNA 放大表示的粉虱。

图 1: 在协议中描述的可立即使用的B 粉虱灯套件的实验设置的可视化.S1, 样本 1;S2, 样本 2;PAC, 正放大控制;台, 负放大控制。请点击这里查看这个数字的更大版本.
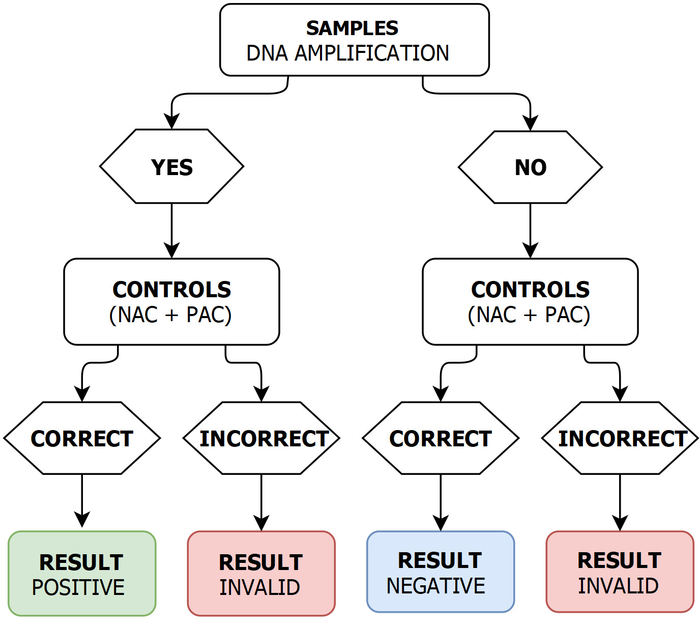
图 2: 灯读出验证架构.PAC: 正放大控制;台: 负放大控制。请点击这里查看这个数字的更大版本.
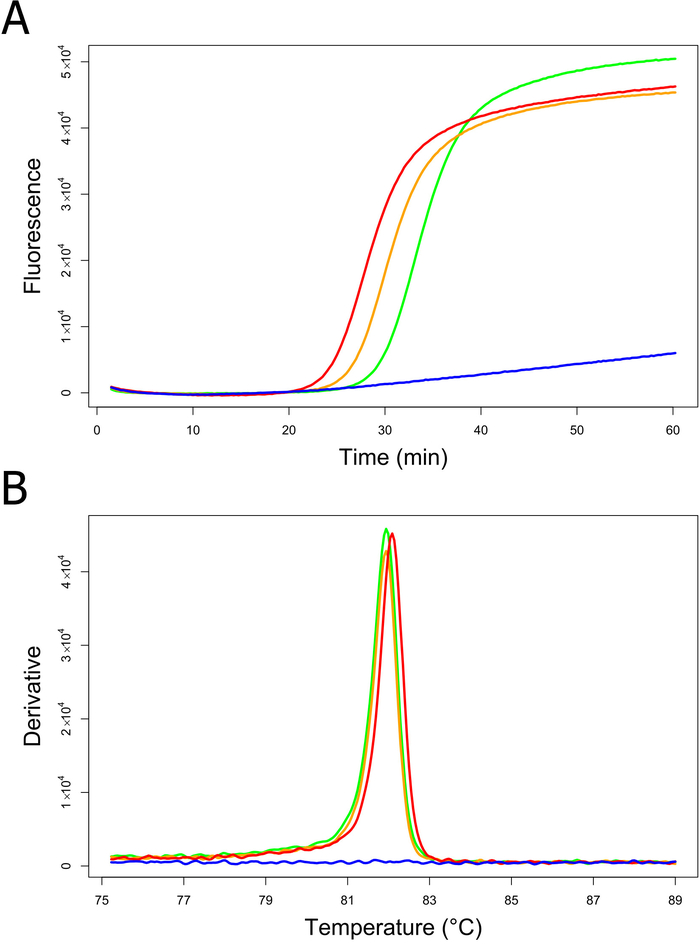
图 3: 在现场条件下进行的B. 粉虱灯分析的 DNA 放大图 (a) 和退火导数 (b).以相对强度单位测量荧光。绿线, 样本 1;橙色线, 样本 2;蓝线, 负放大控制 (NAC);红线, 正放大控制 (PAC)。请点击这里查看这个数字的更大版本.
| 组件 | 库存浓度。 | 最终反应浓度。 | 每反应体积 |
| Taq 聚合酶主混料 | 2x | 1x | 10µL |
| 底漆 C1-J-2195 | 20µM | 0.4 µM | 0.4 µL |
| 底漆 TL2-N-3014 | 20µM | 0.4 µM | 0.4 µL |
| 分子级水 | - | - | 8.2 µL |
| DNA 模板 | - | - | 1µL |
表 1: PCR 反应 mastermix 的制备B. 粉虱阳性放大控制.建立一个 PCR 反应所需的成分和浓度。最终反应量为20µL. 底漆序列显示在1.2.1.1 中。
| N | NTP | NFP | NTN | NFN | 森 (%) | SPE (%) | 效(%) |
| 80 | 75 | 0 | 2 | 3 | 96。2 | 100 | 96。3 |
表 2: B 的结果.粉虱灯检测验证.N、分析数量;NTP, 真实阳性结果数;NFP, 假阳性结果数;NTN, 真实阴性结果数;NFN, 假阴性结果数;森, 诊断敏感性;诊断特异性, 有效性, 测试效率。
| CDNA (fg/µL) | N公关 |
TP 分钟 (平均± SD) |
TA °C (平均± SD) |
| 1 x 105 | 3 | 33.5 ±2。9 | 81.3 ±0。1 |
| 1 x 104 | 3 | 30.7 ±1。1 | 81±0。0 |
| 1 x 103 | 3 | 40.4 ±3。9 | 81.1 ±0。1 |
| 1 x 102 | 3 | 50.7 ±1。6 | 81.1 ±0。1 |
| 1 x 101 | 0 | - | - |
| 1 x 100 | 0 | - | - |
表 3: 分析灵敏度 (检测限值)B. 粉虱灯检测.每次稀释均在且测试。Cdna, 每反应的 dna 浓度;NPR, 正复制数量;TP, 时间, 直到一个积极的结果是可用的;退火温度;标清, 标准差。
讨论
准确识别潜在有害生物的能力没有时间延迟是害虫物种9、10、26管理的一个关键方面。除了快速, 对于植物进口产品, 理想的害虫识别方法应该是简单地执行现场在民营企业8,26。本文报道了一种新的灯泡检测方法, 用于快速识别在欧洲边境频繁截获的检疫昆虫 (https://ec.europa.eu/food/sites/food/files/plant/docs/ph_biosec_europhyt_annual-报告 _ 2016.pdf)。
诊断测试的发展背后的理由是设计一个易于遵循的协议, 可以在工厂的进口控制过程中, 由植物卫生检查员进行最少的实验室培训。为了使现场测试尽可能快速、简单, 该协议分为两部分, 即准备使用的试剂盒和灯泡检测的实际性能。第一部分可以在外部实验室完成, 以便植物健康检查员可以在现场进行 DNA 提取和灯泡检测, 只需一个移液步骤。
虽然只有一步, 移液少量液体可能是挑战的用户很少或没有实验室经验。为了解决这个问题, 将染料 (甲酚红) 添加到萃取液中, 以便操作员能够直观地确认少量 (即2.5 µL) 的 DNA 正确地转移到相应的管上。该协议的另一个重要简化是验证应用程序, 因为它有助于对灯读出进行可靠的解释 (补充文件 1)。
该小说B. 粉虱灯检测在实验室和现场条件下通过测试在瑞士8常规进口控制过程中截获的昆虫标本进行了验证。从三大洲、非洲、欧亚大陆和北美洲共有80个标本进行了照明分析。在80个标本中, 只有三 (3.8%) 被错误识别 (假阴性)8。在分析伪阴性标本的引物靶 DNA 序列时, 发现它们是新的B. 粉虱单倍型, 至今未被描述为8。根据这些结果, 对B 粉虱灯底漆集进行了修改, 并成功地重新验证了8。
任何 dna 扩增的方法, 包括灯泡的一个主要限制是, 他们只识别预定义的目标 DNA 序列8,27。因此, 对底漆目标序列中发现的遗传变异的全面了解, 对于确保诊断准确度8、27至关重要。然而, 这种信息往往非常有限, 特别是在新出现的害虫物种8的情况下。尽管目标序列中的突变导致的罕见的假阴性结果预计为8。在目前的B. 粉虱灯检测中, 解决这个问题的方法是结合 DNA 条形码技术, 这是在8的 POE 苏黎世机场实施此诊断测试过程中实现的策略。在这里, 所有的灯阴性的结果被重新分析的 DNA 条形码在一个外部实验室8。如果遇到尚未描述的新型害虫单体型, 可以使用条形码过程8中生成的 DNA 序列来修改灯泡引物。因此, 在负灯结果的情况下, 所造成的速度损失是在这两个阶段过程8中保证的最大诊断精度补偿的。
POE 的电流灯检测的设置成本约为2.5万美元。随着对植物害虫 (例如软腐病疫病、时光酒店和Guignardia citricarpa) 的灯泡测试数量的增加, 这种一次性投资似乎有道理13,15, 28. 然而, 该议定书可能会被修改, 以进一步降低这些费用。例如, 在95摄氏度的 DNA 萃取步骤中, 这里使用的热混合器可以用较便宜的水浴代替, 或者直接在实时灯泡装置中执行此步骤。此外, 涡旋的混合步骤可能会被手动轻拂管子取代, 在 DNA 转移步骤中, 移液器可能被无菌接种循环所取代。
未来的改进, 以快速识别B. 粉虱和害虫种类一般可以是一个现场测序方法的实施, 将允许在民营企业进行 DNA 条形码分析。这种实现的一个有前途的候选系统是纳米孔测序技术。事实上, 这项技术最近已成功地在现场进行 DNA 条形码的研究, 以评估8、29、30雨林的生物多样性。现场 DNA 条形码识别系统可以完全取代开发靶向诊断测试和验证的必要性。此外, 它还允许收集有关害虫特性的其他信息, 如杀虫剂耐药性基因8。然而, 在进行常规的新测序技术之前, B. 粉虱灯测定法是一种快速 (< 1 小时) 和准确的识别方法。
披露声明
作者迈克尔科威特是 OptiGene 有限公司的股东, 生产本文使用的试剂和仪器。其他作者没有什么可透露的。
致谢
作者感谢安妮特 Grendelmeier, Drenovac, 科妮莉亚 Studer, 丹尼尔弗雷, 伊丽莎白 Razavi, 马库斯 Oggenfuss, 菲林翁瑟莱纳酒店 Vonzun, 和斯文穆勒参与验证B. 粉虱灯测定。
材料
| Name | Company | Catalog Number | Comments |
| B. tabaci LAMP primer mix | OptiGene Ltd. | on request | For preparation of read-to-use B. tabaci LAMP kit |
| Centrifuge MiniSpin | Eppendorf AG | 5452000010 | For several centrifugation steps |
| Cresol red (red dye) | Sigma-Aldrich Corp. | 114472 | Component of DNA extraction solution |
| Eppendorf ThermoMixer | Eppendorf AG | 5382000015 | For DNA extraction |
| Genie II (on-site LAMP analysis device) | OptiGene Ltd. | Genie® II | For LAMP analysis |
| Genie Strips (8-tube LAMP strips) | OptiGene Ltd. | OP-0008-50 | For preparation of read-to-use B. tabaci LAMP kit |
| HotStarTaq Master Mix | Qiagen AG | 203443 | For generation of positive amplification control |
| Labcycler (Thermocycler) | SensoQuest GmbH, distributed by Witec AG | 011-103 | For DNA extraction |
| GspSSD Lyse n' Lamp Isothermal Mastermix | OptiGene Ltd. | ISO-001LNL | For preparation of read-to-use B. tabaci LAMP kit |
| Mini centrifuge Labnet Prism | Labnet International Inc. | C1801 | For several centrifugation steps |
| NucleoFast 96 PCR | Marcherey-Nagel GmbH | 743500.4 | For clean-up of positive amplification control |
| Potassium hydroxide solution | Sigma-Aldrich Corp. | 319376 | Component of DNA extraction solution |
| Qbit Fluorometer 3 | Thermo Fisher Scientific Corp. | Q33226 | For measuring DNA conentration of positive control |
| Qubit dsDNA HS Assay Kit | Thermo Fisher Scientific | Q32854 | For clean-up of positive amplification control |
| Safe-Lock Tubes 0.5 mL (microcentrifuge tube) | Eppendorf AG | 0030 121.023 | For DNA extraction |
| Safe-Lock Tubes 2.0 mL (microcentrifuge tube) | Eppendorf AG | 0030 120.094 | For preparation of read-to-use B. tabaci LAMP kit |
| Wood Toothpicks | VWR International LLC | 470226-594 | For DNA extraction |
| Vortex-Genie 2 (Vortex) | Scientific Industries Inc. | SI-0236 | For several mixing steps |
参考文献
- De Barro, P. J., Liu, S. S., Boykin, L. M., Dinsdale, A. B. Bemisia tabaci: a statement of species status. Annual Review of Entomology. 56, 1-19 (2011).
- Zhang, G. F., Lü, Z. C., Wan, F. H., Lövei, G. L. Real-time PCR quantification of Bemisia tabaci (Homoptera: Aleyrodidae) B-biotype remains in predator guts. Molecular Ecology Notes. 7 (6), 947-954 (2007).
- Boykin, L. M., De Barro, P. J. A practical guide to identifying members of the Bemisia tabaci species complex: and other morphologically identical species. Frontiers in Ecology and Evolution. 2, (2014).
- Cuthbertson, A. G. S., Vänninen, I. The importance of maintaining protected zone status against Bemisia tabaci. Insects. 6 (2), 432-441 (2015).
- Dalmon, A., Halkett, F., Granier, M., Delatte, H., Peterschmitt, M. Genetic structure of the invasive pest Bemisia tabaci: evidence of limited but persistent genetic differentiation in glasshouse populations. Heredity. 100 (3), 316-325 (2008).
- Dickey, A. M., Osborne, L. S., Shatters, R. G., Hall, P. A. M., Mckenzie, C. L. Population genetics of invasive Bemisia tabaci (Hemiptera: Aleyrodidae) cryptic species in the United States based on microsatellite markers. Journal of Economic Entomology. 106 (3), 1355-1364 (2013).
- Bacon, S. J., Bacher, S., Aebi, A. Gaps in border controls are related to quarantine alien insect invasions in Europe. PLOS ONE. 7 (10), e47689 (2012).
- Blaser, S., et al. From laboratory to point of entry: development and implementation of a loop-mediated isothermal amplification (LAMP)-based genetic identification system to prevent introduction of quarantine insect species. Pest Management Science. 74 (6), 1504-1512 (2018).
- Floyd, R., Lima, J., de Waard, J., Humble, L., Hanner, R. Common goals: policy implications of DNA barcoding as a protocol for identification of arthropod pests. Biological Invasions. 12 (9), 2947-2954 (2010).
- Armstrong, K. F., Ball, S. L. DNA barcodes for biosecurity: invasive species identification. Philosophical Transactions of the Royal Society B: Biological Sciences. 360 (1462), 1813-1823 (2005).
- Notomi, T., et al. Loop-mediated isothermal amplification of DNA. Nucleic Acids Research. 28 (12), E63 (2000).
- Tomlinson, J. A., Boonham, N., Dickinson, M. Development and evaluation of a one-hour DNA extraction and loop-mediated isothermal amplification assay for rapid detection of phytoplasmas. Plant Pathology. 59 (3), 465-471 (2010).
- Kogovšek, P., et al. LAMP assay and rapid sample preparation method for on-site detection of flavescence dorée phytoplasma in grapevine. Plant Pathology. 64 (2), 286-296 (2015).
- Lee, M. S., Su, T. Y., Lien, Y. Y., Sheu, S. C. The development of loop-mediated isothermal amplification (LAMP) assays for the rapid authentication of five forbidden vegetables in strict vegetarian diets. Scientific Reports. 7, 44238 (2017).
- Bühlmann, A., et al. Erwinia amylovora loop-mediated isothermal amplification (LAMP) assay for rapid pathogen detection and on-site diagnosis of fire blight. Journal of Microbiological Methods. 92 (3), 332-339 (2013).
- Cavalieri, V., Manglli, A., Tiberini, A., Tomassoli, L., Rapisarda, C. Rapid identification of Trialeurodes vaporariorum, Bemisia tabaci (MEAM1 and MED) and tomato-infecting criniviruses in whiteflies and in tomato leaves by real-time reverse transcription-PCR assay. Bulletin of Insectology. 67 (2), 219-225 (2014).
- Baek, J. H., Lee, H. J., Kim, Y. H., Lim, K. J., Lee, S. H., Kim, B. J. Development of an antibody-based diagnostic method for the identification of Bemisia tabaci biotype B. Pesticide Biochemistry and Physiology. 131, 18-23 (2016).
- Hsieh, C. H., Wang, H. Y., Chen, Y. F., Ko, C. C. Loop-mediated isothermal amplification for rapid identification of biotypes B and Q of the globally invasive pest Bemisia tabaci, and studying population dynamics. Pest Management Science. 68 (8), 1206-1213 (2012).
- Rejili, M., et al. A PCR-based diagnostic assay for detecting DNA of the olive fruit fly, Bactrocera oleae, in the gut of soil-living arthropods. Bulletin of Entomological Research. 106 (5), 695-699 (2016).
- Hebert, P. D. N., Ratnasingham, S., deWaard, J. R. Barcoding animal life: cytochrome c oxidase subunit 1 divergences among closely related species. Proceedings. Biological Sciences. 270 (Suppl 1), 96-99 (2003).
- Ratnasingham, S., Hebert, P. D. N. bold: The Barcode of Life Data System (http://www.barcodinglife.org). Molecular Ecology Notes. 7 (3), 355-364 (2007).
- Benson, D. A., Karsch-Mizrachi, I., Lipman, D. J., Ostell, J., Bank Wheeler, D. L. G. e. n. GenBank. Nucleic Acids Research. 33, D34-D38 (2005).
- Lorenz, T. C. Polymerase chain reaction: basic protocol plus troubleshooting and optimization strategies. Journal of Visualized Experiments. (63), e3998 (2012).
- Simon, C., Frati, F., Beckenbach, A., Crespi, B., Liu, H., Flook, P. Evolution, weighting, and phylogenetic utility of mitochondrial gene sequences and a compilation of conserved polymerase chain reaction primers. Annals of the Entomological Society of America. 87 (6), 651-701 (1994).
- Simon, C., Buckley, T. R., Frati, F., Stewart, J. B., Beckenbach, A. T. Incorporating molecular evolution into phylogenetic analysis, and a new compilation of conserved polymerase chain reaction primers for animal mitochondrial DNA. Annual Review of Ecology, Evolution, and Systematics. 37 (1), 545-579 (2006).
- Harper, S. J., Ward, L. I., Clover, G. R. G. Development of LAMP and real-time PCR methods for the rapid detection of Xylella fastidiosa for quarantine and field applications. Phytopathology. 100 (12), 1282-1288 (2010).
- Lauri, A., Mariani, P. O. Potentials and limitations of molecular diagnostic methods in food safety. Genes & Nutrition. 4 (1), 1-12 (2009).
- Tomlinson, J. A., et al. A loop-mediated isothermal amplification-based method for confirmation of Guignardia citricarpa in citrus black spot lesions. European Journal of Plant Pathology. 136 (2), 217-224 (2013).
- Branton, D., et al. The potential and challenges of nanopore sequencing. Nature Biotechnology. 26 (10), 1146-1153 (2008).
- Pomerantz, A., et al. Real-time DNA barcoding in a rainforest using nanopore sequencing: opportunities for rapid biodiversity assessments and local capacity building. GigaScience. 7 (4), giy033 (2018).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。