Method Article
冷冻斑马鱼胚胎的连续免疫荧光与免疫组化学
摘要
该方案演示了早期斑马鱼胚胎的冷冻节的连续免疫荧光和免疫组织化学,从而对特定细胞群进行精确的共定位分析。
摘要
研究细胞间相互作用通常需要对特定细胞群进行离散标记和精确的蛋白质定位。斑马鱼胚胎是检查这种与体内模型相互作用的极好工具。全装免疫成体化学和免疫荧光测定常应用于斑马鱼胚胎,以评估蛋白质表达。然而,在三维空间中很难实现共定位蛋白的精确映射。此外,有些研究可能需要使用两种与同一技术不相容的抗体(例如,抗体1仅适用于免疫组织化学,抗体2仅适用于免疫荧光)。本文所述方法的目的是对从早期斑马鱼胚胎衍生的单个冷冻节进行顺序免疫荧光和/或免疫性化学。在这里,我们描述了在单个冷冻节使用连续的免疫荧光、成像、免疫组化学、成像,以实现单细胞水平上蛋白质表达的精确识别。这种方法适用于需要准确识别单个细胞中多个蛋白质靶点的早期斑马鱼胚胎的任何研究。
引言
斑马鱼是一种极其强大的模型生物体,目前用于生物医学研究的各种学科。特别是斑马鱼胚胎的快速外部发育和半透明性为体内研究提供了极好的工具。本文描述了一种低温斑马鱼胚胎的连续免疫荧光(IF)和免疫组织化学(IHC)分析方法。这种新程序在一张幻灯片上连续应用两个抗体,从而在细胞水平上准确识别共位化蛋白,同时保存组织部分。该协议对于斑马鱼模型的研究特别有用,因为与小鼠模型相比,在斑马鱼的IF和/或IHC应用中,已经验证了相对较少的抗体。
细胞间相互作用的观察是许多研究中的一个基本要素,并可能为在细胞水平上发挥作用的分子机制提供关键见解,这些机制是表型在有机体水平上的基础。此外,蛋白质表达可以提供有关细胞功能的信息,特别是在同时检查细胞内多个蛋白质的表达时(共定位)。虽然全装载IHC和IF是分析斑马鱼胚胎1、2、3、4、5中蛋白质表达的常用技术,但整个安装程序可以实现精确的共定位数据存在问题。根据我们的经验,在全装载标本的单细胞水平上很难区分组织层和可视化蛋白质表达。成像软件程序通常无法区分表面染色和更深的染色。非表面水平蛋白表达可以通过更明亮的表面水平表达来模糊,从而导致定量不准确。此外,大多数传统的斑马鱼清除方法毒性很大,因此不太适合使用。
基于抗体的技术,如IF和IHC,通常用于检测切片材料中的蛋白质表达,从而简化对在复杂组织中表达特定蛋白质的离散细胞群的识别。IHC通常用于共定位,最常见的是使用两种不同的抗体结合在不同的宿主物种和可视化与不同颜色的色原4,7,8,9,10.然而,使用多种色原会导致非特异性背景染色或颜色11、12的不兼容。
我们开发了一种新型方案,用于在冷冻早期斑马鱼胚胎上通过顺序IF和IHC检测多种蛋白质。冷冻切片特别适合细腻组织,如斑马鱼胚胎,而冷冻切片优于石蜡嵌入部分,用于荧光基测定13、14。我们选择优化组合的IF和IHC,而不是双色IF或IHC,以避免单一测定类型的抗体不兼容问题。这些问题与斑马鱼的研究特别相关,因为用于斑马鱼的商用抗体数量有限。事实上,一项对四家大公司的研究表明,用于小鼠的商用抗体约为11.2万种,而斑马鱼15号时使用的抗体约为5,300种。最后,我们选择开发一种可在单个冷冻组进行的协议,这对于处理小型或有限的组织样本(如从斑马鱼胚胎获得)至关重要。
该协议旨在评估供体细胞在48小时受精后嵌合斑马鱼胚胎的增殖行为,这些胚胎是由卡莫尼-兰佩和莫恩斯16所述的爆破到爆卵移植产生的。在将供体细胞移植到受体胚胎之前,在单细胞阶段用荧光标记的dextran结合注射供体胚胎。我们使用Ser 10磷酸化组蛋白H3(pH3)的免疫荧光来检测增殖细胞,然后对标记的dextran进行免疫组织化学,以检测嵌合斑马鱼胚胎中的供体细胞。在单个冷冻节内对pH3和标记的dextran进行顺序检测,使我们能够识别和量化表达这两个标记的单个细胞。
这种用于冷冻剖分斑马鱼的连续IF/IHC协议将为斑马鱼研究人员提供有用的工具,他们渴望蛋白质表达的共定位协议。该协议旨在解决的问题,如小组织标本和有限的抗体可用性,并非斑马鱼模型所独有。因此,此方法可能对希望执行顺序 IF/IHC 的任何研究人员使用。
道德声明:
所有动物研究都通过了美国北卡罗来纳州立大学罗利分校机构动物护理和使用委员会的批准。
研究方案
1. 胚胎制备
- 修复 48 h 受精后 (hpf) 嵌合斑马鱼胚胎,通过在 AB 野生型斑马鱼胚胎之间在 4% 甲醛 (PFA) 中移植产生,在 4°C 下摇动。使用500μL的1倍磷酸盐缓冲盐水在室温下进行两次5分钟的脉液,含有0.1%的非离子表面活性剂(1x PBSt;参见材料表)
注:甲醛是有毒和致癌物质,必须根据机构规定妥善处理。使用甲醛工作应在化学罩中进行,并且应始终使用适当的个人防护设备(手套、实验室涂层和安全眼镜)。 - 脱水胚胎在室温下用1x PBSt稀释,每次10分钟,在室温下摇动,按500μL(30%、50%)和70%甲醇(MeOH)进行清洗。在500μL的100%MeOH中孵育胚胎,在-20°C下孵育至少14小时。
注:甲醇是有毒的,必须根据机构规定妥善处理。使用甲醇应在化学罩中进行,并且应始终使用适当的个人防护设备(手套、实验室涂层和安全眼镜)。 - 在室温下,用500μL(70%、50%)和30%MeOH稀释1xPBSt,每次10分钟,通过摇动,对胚胎进行再水化。在室温下用500μL的1x PBSt进行两次5分钟的处理,并摇动。
- 取出 1x PBSt,在 500 μL 的 30% 蔗糖中孵育,在室温下用去离子水稀释,摇动,直到胚胎沉入管底(约 1 小时)。用500μL(15%的鱼明胶/25%蔗糖(15/25;见材料表)代替蔗糖,并在室温下孵育,过夜摇动。
- 用最佳切割温度介质(OCT介质)替换大约一半的15/25体积,并在室温下用摇动孵育,直到胚胎沉入管底(约1小时)。
- 用OCT介质替换大约一半的体积,在室温下孵育1小时。
- 在使用 15/25 和 OCT 介质的孵育步骤中,根据需要反转或轻拂管以组合这些试剂。
2. 胚胎嵌入和冷冻节的制备
- 将胚胎转移到塑料模具(见材料表),用钳子,尽量减少15/25-OCT混合物的任何转移。用OCT培养基填充大约半满的模具,并在OCT培养基中轻轻混合胚胎。
- 制备贴有标签的塑料模具,将所需的胚胎(通常为1\u20123胚胎)移植到空的、贴有标签的塑料模具中,最大限度地减少OCT介质的携带。一旦所需的胚胎在塑料模具中,轻轻填充OCT介质到模具的顶部。
- 使用钳子或25G针将胚胎排列到所需的方向,使用光立体显微镜进行可视化(图1A,B)。
- 将准备好的模具冷冻在用金属平台的绝缘容器中。将冰桶或泡沫冷却器轻轻放在金属平台上,形成冷室(图1C,D)
-
使用-20°C的低温设置制备10μu201212 μm厚的低温截面。
- 一次设置一个块,并使用 OCT 介质将块冻结到光盘/夹头上,块的底部朝向刀片 (图 2A)。在开始切片之前,确保块完全冻结到光盘上(OCT 介质将变为白色)(图2B)。
- 在带电玻璃滑梯上放置低温部分(图2C,D),并在室温下对滑片进行空气干燥过夜。
3. pH3的免疫荧光
- 在适当的容器(如科普林罐)中,在 1x PBS 中对幻灯片进行 3 次 5 分钟的处理。如果组织未很好地粘附在幻灯片上,则通过在平坦的表面上铺设幻灯片,并将 500 μL 的 1x PBS 轻轻移至表面上进行处理。通过轻轻翻倒幻灯片,在浇注之间倒入 1x PBS。
- 用障碍笔或蜡笔勾勒各部分,以保持幻灯片上的液体(图3)。
- 将幻灯片放在潮湿室的平面上,并将每个部分的块缓冲液 200 μL 放在滑片上。在块缓冲液中孵育2小时,在室温下孵育,或在4°C下孵育过夜。
- 在块缓冲液中制备原抗体稀释(兔子抗pH3抗体,1:200;见材料表),通过移液混合良好。轻轻将滑片吸出块缓冲液,返回到潮湿室,并将每节 200 μL 的初级抗体溶液移液器排到滑片上。对于二次控制,移液器 200 μL 的块缓冲液到适当的部分。
- 在充满去离子水的潮湿室内过夜,在4°C下孵育幻灯片。密封潮湿腔室的边缘,以帮助保持水分。
- 在适当的容器(如科普林罐)中,在 1x PBS 中对幻灯片进行 3 次 5 分钟的处理。在洗涤步骤中,在块缓冲液中制备二次抗体稀释(抗兔子荧光二级抗体结合,1:2,000;参见材料表),并通过移液混合良好。
- 将幻灯片放在潮湿室的平面上,并将每截面的二次抗体溶液移液器 200 μL 放在滑片上。在室温下在二级抗体溶液中孵育幻灯片,在光线遮挡下孵育30分钟。
- 在适当的容器(如可遮挡光线的 Coplin jar)中,在 1x PBS 中对幻灯片进行 3 次 5 分钟的清理。在洗涤步骤中,准备核染色溶液(参见材料表)。
- 将滑轨放在平坦的表面上,将移液器 200_u2012500 μL(取决于样品大小)放在每个部分。在核染色溶液中孵育幻灯片10分钟,不受光线照射。
- 排出核染色溶液,用非硬化荧光安装介质和玻璃盖玻片安装滑片。将幻灯片保持在黑暗中 4°C,直到执行成像。
注:当幻灯片在同一天或第二天进行图像成像时,将获得最佳结果。 - 跟随 IF,使用共聚焦荧光显微镜和数码相机以 100 倍放大倍数(10 倍眼部放大倍率和 10 倍物镜放大率)使用 555 nm(红色)和 645 nm(远红色)发射滤镜对幻灯片进行可视化和成像。在整个成像过程中保持激光功率的一致性。
- 成像后,将幻灯片放入 1x PBS 的单个容器中,并放在 4°C 的平整位置,为去除盖玻片做好准备。将幻灯片置于 1x PBS 中时,轻轻搅拌滑轨以帮助拆下盖玻片。
注:请勿按下盖玻片或尝试手动拆下盖玻片,因为这可能危及各部分的质量。必须水平拆下盖玻片,同时尽量减少强制移动。
4. 标记的Dextran的免疫性化学
- 拆下盖玻片后,将幻灯片轻轻地转移到适当的容器(如 Coplin jar)中的新 1x PBS 中。在室温下,用0.1%的非离子表面活性剂(1x TBSt)在1xTris缓冲盐水中去除1xPBS,并在1xTris缓冲盐水中执行3个5分钟的导流明流。
- 在适当大小的容器中,在去离子水中制备250mL的3%过氧化氢(H2 O2)。在室温下用3%H2O2溶液孵育幻灯片15分钟。
注:过氧化氢具有腐蚀性,必须根据机构规定妥善处理。应始终使用适当的个人防护设备(手套、实验室外套和安全眼镜)。 - 快速用去离子水冲洗幻灯片。在 1x TBSt 中对幻灯片进行 3 次 5 分钟的洗刷。小心地干燥组织部分周围的区域,并将幻灯片平放在潮湿的室内。用阻隔笔或蜡笔勾勒组织部分,以便在需要时将液体放在各部分上。
- 将随二级抗体标记试剂盒(见材料表)提供的即用型2.5%血清阻断溶液滴落到每个部分。在室温下在潮湿的室内孵育幻灯片20分钟。
- 准备原抗体稀释在抗体稀释剂(兔子抗标记dextran,1:7,500;见材料表),并通过温和的移液混合。轻轻倾斜滑片以排出块缓冲液,干燥各部分周围的区域,并将幻灯片平放在潮湿的室内。
- 在应用原抗体溶液之前不要清洗。移液器 200 μL 原发抗体溶液每截面到幻灯片上,并在 4°C 的潮湿腔室中孵育过夜。对于二次控制,移液器 200 μL 的抗体稀释到适当的部分。
- 轻轻将滑片倾斜以排出原抗体溶液,并放入 1x TBSt 中,放入适当的容器中,如 Coplin 罐。在 1x TBSt 中对幻灯片进行两次 5 分钟的洗刷。干燥各部分周围的区域,并平放在潮湿的室内。
- 将随时可用的防底还原阻滞试剂(参见材料表)滴落到每个部分。在室温下在潮湿的室内孵育幻灯片20分钟。
- 轻轻倾斜滑片以排出块缓冲液,小心地干燥各部分周围的区域,并将幻灯片平放在潮湿的室内。在涂抹二级抗体溶液之前请勿清洗。
- 将即用型二次抗体溶液(抗兔马萝卜过氧化物酶(HRP)聚合物二级抗体;见材料表)涂抹到每个部分,并在室温下在潮湿室中孵育30分钟。
- 轻轻将滑片倾斜以排出二次抗体溶液,并放入 1x TBSt 中,放入适当的容器中,如 Coplin 罐。在 1x TBSt 中执行两次 5 分钟的幻灯片处理。
- 在使用前立即按照制造商的协议制备HRP致色基板(见材料表)。
- 干燥各部分周围的区域,将幻灯片放在平坦的表面上,并将 200 μL 的 HRP 致色基板应用于每个部分。在室温下孵育3分钟,当基板应用于第一张幻灯片时启动定时器(图4)。
- 排出基板溶液,在含有 1x PBS 的 Coplin 罐中短暂冲洗幻灯片。将滑梯放入适当的容器(如 Coplin jar)中的去离子水中,并在去离子水中进行两次 5 分钟的洗洗,轻轻搅拌。
- 将滑片置于血氧林染色溶液中,长达 30 s,从而对滑片进行反污染。
注:血氧林是有毒的,必须根据机构规定进行处置。应始终使用适当的个人防护设备(手套、实验室外套和安全眼镜)。 - 将滑梯放入适当的容器(如 Coplin jar)中的去离子水中,并在去离子水中进行三次 5 分钟的洗洗。将幻灯片转移到装有 Scott 自来水的容器(参见材料表),然后孵育 1 分钟。
- 将滑梯放入适当的容器(如 Coplin jar)中的去离子水中,并在去离子水中进行三次 5 分钟的洗洗。
- 通过一系列乙醇(EtOH)牌号(在去离子水中稀释)和化学罩中的二甲苯脱水。在 70% EtOH 中进行 1 2 分钟孵育,在 95% EtOH 中进行两个 1 分钟孵育,在 100% EtOH 中进行两个 1 分钟孵育,在二甲苯中进行三个 1 分钟孵育。从二甲苯上取下滑片,在化学罩中用基于甲苯的安装介质进行湿滑时放置盖玻片。
注:二甲苯和甲苯有毒和易燃,必须根据机构规定妥善处理。使用二甲苯和甲苯应在化学罩中工作,并且应始终使用适当的个人防护设备(手套、实验室涂层和安全眼镜)。 - 在 IHC 之后,使用复合光学显微镜和数码相机以 100 倍放大倍数(10 倍眼部放大倍率和 10 倍物镜放大倍数)对幻灯片进行可视化和成像。(图5)
结果
我们开发了这个方案,以识别和分析48小时受精后嵌合斑马鱼胚胎中单个供体细胞中的蛋白质表达,这些胚胎是由AB野生型斑马鱼胚胎之间的腹肌到爆卵体移植产生的。在单细胞水平上成功分析蛋白质表达需要用适当定向的胚胎制备冷冻切片(图1和图2),并仔细、连续地应用IF和IHC技术低温节(图3和图4)。使用特定抗体同时检测增殖细胞(抗pH3,图5A,B)和供体细胞(抗标记dextran,图5D)可用于识别和量化正在积极增殖的供体细胞(图 5E.在IF(图2A,B)和IHC(图2D)之后生成高质量的图像至关重要,以便准确识别单个细胞。图像分析程序应该用于执行图像叠加 (图 5E)。根据所使用的图像分析程序,如果需要量化,可以自动对标记的细胞进行计数。

图 1:制备冷冻的OCT方块。(A) 在准备冷冻的低温模具中,在OCT中胚胎的50倍微观视图。红色箭头表示斑马鱼胚胎的头部对模具底面的位置;黑色箭头表示尾部朝上,指向用户。(B) 塑料模具与胚胎和OCT放置在冷冻金属平台。(C) 将泡沫冰桶放在塑料模具上,形成冷冻室。(D) 一旦方块完全冻结,OCT就会变白。请点击此处查看此图的较大版本。

图 2:冷冻OCT块的冷冻剖分。(A) 将新鲜 OCT 应用于冷冻盘,并在 OCT 上放置冷冻块,从块的冻结方向旋转 180°。(B) 冻结到切片盘的块的侧面视图。(C) 带卷板位置的切片块视图。(D) 使用带电滑片从低温器的金属平台拾取部分。请点击此处查看此图的较大版本。

图 3:放置在幻灯片上的后已准备的节的视图。箭头表示疏水屏障,虚线划定了障碍周长内包含部分的区域。请点击此处查看此图的较大版本。

图4:IHC期间染色体基质应用的准备。滑片放置在覆盖着塑料包装的平面上,以便均匀地应用致色基板,同时包含任何有害物质溢出。请点击此处查看此图的较大版本。
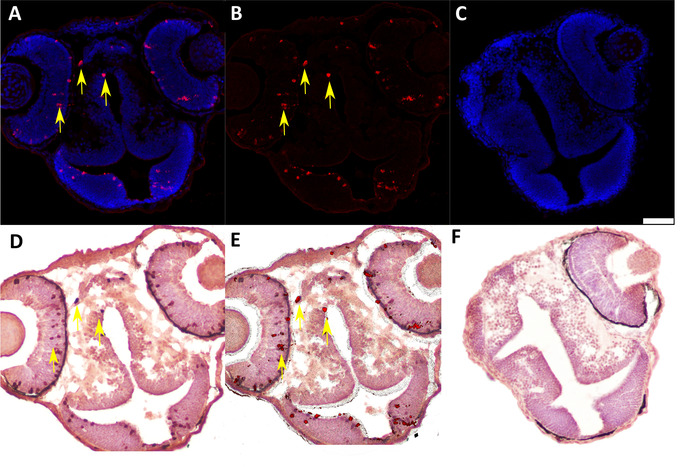
图 5:代表性IF和IHC标记的冷冻切片48hpf嵌合斑马鱼胚胎产生由Ab野生型斑马鱼胚胎之间的腹肌到爆卵移植。(A) 如果检测 Ser 10 磷酸酯组蛋白 H3 (抗 pH3, 1:200) 表达在 48 hpf 嵌合斑马鱼胚胎。红色 = pH3 阳性细胞;蓝色 = 原子核。黄色箭头表示正细胞的示例。(B) 去除数字图像(ImageJ软件)中的蓝色核污渍,可增强pH3阳性细胞的可视化,实现定量和图像叠加。(C) 在冷冻48 hpf嵌合斑马鱼胚胎中为IF测定的阴性对照(仅限二级抗体)。刻度条表示 50 μm(适用于所有面板)。(D) IHC检测AB型斑马鱼胚胎之间由腹肌到爆体移植产生的嵌合48hpf斑马鱼胚胎中贴有标记的dextran(反标记dextran,1:7,500)。供体胚胎在用于爆破到爆破移植之前,在单细胞阶段被注射了荧光标记的dextran结合。红色表示标有 dextran 偶联的细胞;蓝色表示原子核。黄色箭头表示正细胞的示例。(E) 面板 B(pH3 的 IF)和面板 C(标记为 dextran 的 IHC)的叠加,显示 pH3 表达式的共定位和单个单元格中的 dextran 标记。黄色箭头表示双正细胞的示例。(F) 在冷冻48hpf嵌合斑马鱼胚胎中IHC测定的阴性对照(仅限二级抗体)。请点击此处查看此图的较大版本。
讨论
我们提出了一种免疫荧光和免疫组织化学相结合的新方法,这标志着在冷冻分块斑马鱼胚胎进行共定位实验方面迈出了重要的一步。目前严重缺乏与小胚胎和冷冻分型材料17、18一起使用的共定位协议,这两种方案在分子研究中都有普遍用途14。现有的共定位协议主要侧重于同时可视化两个荧光草17,18。虽然这些协议可以很好地工作,其有用性受到抗体的可用性的限制,这些抗体(i)可用于斑马鱼和(ii)与IF兼容。
我们认为,在保存的组织形态方面,使用冷冻切片为斑马鱼胚胎提供了显著的优势。由于IHC在石蜡部分比低温节7、8更常见,因此有必要进一步探索基于冷冻切片的IHC方法来检测蛋白质表达。使用整个装载IF是一种常见的方法,以可视化斑马鱼胚胎的表达水平,并在文献中比使用冷冻节1,2,3,4的IF更普遍地描述。 19.然而,整个安装协议有局限性,包括缺乏深度组织中表达的蛋白质的精确定位,以及表面水平表达可能模糊深层组织中的蛋白质表达。在冷冻保存、切片和连续IF和IHC之后,我们一直观察到细胞形态的良好维持。对于需要在单细胞水平上精确定位蛋白质表达的应用,基于节的程序具有显著的优势,正如我们在本协议中所述。树脂嵌入为在早期斑马鱼胚胎20的截面上执行IF或IHC检测提供了一种替代选择。与冷冻节相比,树脂部分为组织形态提供卓越的保存,可以制备相对较薄的组织部分。然而,制造商一般不建议使用树脂部分进行免疫化检测,因为树脂的某些成分不能从部分中去除,并可能掩盖抗体结合位点21。
虽然整个协议对于准确和成功地分析表达模式至关重要,但几个具体步骤对于实验成功至关重要。第一个关键步骤是在OCT13、14中嵌入胚胎过程中的处理。将每个胚胎定位在同一横向平面上,以便从所有胚胎的大致相同区域切割部分可能具有挑战性。我们发现,使用小量表针通过粘性OCT介质进行小而有意的运动,以进行胚胎定向优于使用钳子,后者太大,取代过多的OCT介质。第二个关键步骤发生在冷冻块的切片过程中,因为如果没有大量的培训和经验,很难获得含有所需组织的高质量截面。因此,我们建议使用测试样本,直到掌握了该技术。第三个关键步骤是盖玻片去除,有可能干扰或剥去组织样本。我们发现,通过轻柔的搅拌来松开盖玻片和缓慢地从 PBS 容器中取出滑轨的组合是去除盖玻片的最有效方法。温柔而稳重的手是最好的;研究人员可能会发现,一些试验和错误是必要的,以学习如何有效地去除盖玻片。
该协议中的其他重要步骤包括抗体优化(IF 和 IHC 检测的主要和次要抗体)和幻灯片暴露于致色基质和反染色。对原发抗体特异性和目标浓度的深入研究至关重要;通常,最好在开始IF/IHC组合之前为IF和IHC进行至少两项单独的实验,以优化原抗体浓度。在每个实验中,包括每个原抗体的已知正负对照对于确保IF和IHC检测均能正常工作至关重要。对二级抗体浓度的调整可能也是必要的。需要优化组织部分与致色基质的暴露,以及IHC测定的反染色,因为制造商指南通常描述广泛的可能暴露时间。并非所有色原都与反染色剂和内源性组织色素沉着相容,需要仔细规划色原选择。
有许多潜在的修改可以应用于所述的协议,我们已经成功地执行了该协议与其他抗体组合,不能同时用于IF。如上所述,致变色物质与特定的反污物具有明显的相容性。我们发现这些组件在协议中很容易修改。此外,抗体孵育的参数相当灵活,可根据所需的染色强度增加或减少。也可以修改嵌入过程。虽然我们专注于横向部分,但胚胎可以很容易地定向到任何方向,以解决感兴趣的特定组织。最后,此协议中有多个可能的暂停点。脱水胚胎可在-20°C下储存在100%MeOH中几个月;冷冻块可在-80°C下储存长达三个月;和准备好的幻灯片可在 -80°C 下存储在幻灯片盒中长达 9 个月。
由于此组合的 IF/IHC 协议相对复杂,因此有多种可能的变化或错误来源,可能需要进行故障排除,从组织质量到研究人员经验再到样品处理。上述大多数关键步骤都被认为是关键步骤,因为它们要么需要在单个用户级别进行优化,要么需要特定的灵巧、技能和经验。然而,我们发现非特异性背景染色和低信号强度是需要优化的最重要问题。与任何 IF 或 IHC 协议一样,解决这些问题可能既耗时又耗费人力,并且可以采用此方法进行复合,因为这两种技术是结合的。因此,我们强烈建议在继续组合协议之前分别优化 IF 和 IHC。
尽管我们预测这种方法对于广泛的实验是有用的,但存在潜在的局限性。此过程的成功执行取决于通过两个包括大量洗涤步骤的连续实验来保持完整的组织样本。因此,在切片或组织处理过程中出现的任何问题,包括使用可能质量下降的旧幻灯片,将严重限制研究人员成功执行此协议的能力。尽管幻灯片可能储存在-80°C下长达 9 个月,但组织对幻灯片的依从性会随着时间的推移而下降,而且我们在一个月内使用幻灯片,最好在第二天使用幻灯片,从而取得最佳成功。第二个限制是斑马鱼胚胎的小块脚印。虽然我们发现这个实验在可视化早期胚胎中相对丰富的蛋白质方面很有用,但表达不一致或低水平的蛋白质可能很难在一节中捕获。最后,由于该协议使用10_u20122μm低温节,它最适合评估蛋白质表达在较大的结构,如核,而不是较小的亚细胞成分。
总之,我们组合的IF/IHC方案将有利于早期斑马鱼胚胎的广泛研究,是此类标本中精确蛋白质表达分析的重要创新。我们的方法,如图5中成功显示,将允许研究人员保存早期斑马鱼胚胎在冷冻部分的微妙形态,同时使用目前可用的初级抗体范围有限,验证用于该物种的IF或IHC。该协议可能可用于研究其他鱼类和两栖动物物种(例如,Medaka和Xenopus spp.),这些鱼类和两栖动物受到抗体可用性的类似限制,并可能适用于传统哺乳动物模型,嗯
披露声明
作者没有什么可透露的。
致谢
这项工作得到了NIH赠款5K01OD021419-02和北卡罗来纳州立大学兽医学院的支持。
材料
| Name | Company | Catalog Number | Comments |
| 15/25 | N/A | N/A | 15% fish gelatin/25% sucrose w/v, made in dH2O |
| Alexa 555 secondary antibody | Invitrogen | A21429 | used at 1:2000 dilution in block buffer for IF |
| Antibody Diluent | Dako | S3022 | |
| Background Buster | Innovex | NB306 | |
| block buffer (IF) | N/A | N/A | 5% normal goat serum, 0.1% Triton X-100 in 1X PBS |
| cellSens imaging software | Olympus | cellSens | imaging software used with compound light microscope |
| chimeric zebrafish embryos | N/A | N/A | AB wild-type chimera zebrafish embryos analyzed at 48 hpf |
| Compound light microscope | Olympus | BX51 | used with digital camera and cellSens imaging software for image capture after IHC |
| Confocal fluorescence microscope | Leica | DM 2500 | used with digital camera and Leica Application Suite Advanced Fluorescence imaging software for image capture after IF |
| disposable plastic molds, 15 mm x 15 mm x 5 mm | Ted Pella | 27147-2 | |
| Digital camera, light microscope | Olympus | DP27 | |
| Digital camera, fluorescence microscope | Leica | TCS SPE | |
| Ethanol | Koptec | V1001 | |
| fish gelatin | Sigma | G7041 | |
| Glass slides | Fisher | 12-550-15 | |
| Hydrogen peroxide, 30% | Fisher | H325-100 | |
| ImmPRESS HRP Polymer detection kit | Vector | MP-7401 | anti-rabbit secondary antibody, HRP polymer |
| Leica Application Suite Advanced Fluorescence imaging software | Leica | LAS AF 2.3.6 | imaging software used with confocal fluorescence microscope |
| Methanol | Fisher | A452-4 | |
| Modified Meyer's Hematoxylin | Thermo | 72804 | |
| Normal Goat Serum | MP Biomedical | 191356 | |
| OCT medium | Tissue-Tek/Fisher | 4583/4585 | |
| anti-Oregon Green antibody | Molecular Probes/Life Technologies | A889 | used at 1:7500 dilution for IHC |
| Oregon Green Dextran | Invitrogen | P7171 | used at 2.5% in 0.2M KCl |
| Paraformaldehyde, 4% | Acros Organics | 416780030 | made in lab in 1x PBS |
| Permount | Fisher | SP15 | |
| 1X phosphate-buffered saline | made in lab | N/A | 50 mL 10x PBS, up to 500 mL volume with dH2O |
| 10X phoshpate-buffered saline | made in lab | N/A | use Cold Spring Harbor protocol |
| 1X PBSt | made in lab | N/A | 50 mL 10x PBS, 1 mL 10% Tween 20, up to 500 mL volume with dH2O |
| anti-Ser10 phosphorylated Histone H3 antibody | Santa Cruz | sc-8656-R | used at 1:500 dilution for IF |
| Scott's Tap Water | Electron Microscopy Sciences | 26070-06 | have used other brands successfully in addition to EMS |
| sucrose | Amresco | 335 | |
| Tween-20 | Fisher | BP337 | |
| TO-PRO3 | Invitrogen | T3605 | used at 1:1000 in 1x PBS for IF |
| 1X Tris-buffered saline | made in lab | N/A | 50 mL 10x TBS, up to 500 mL volume with dH2O |
| 10x Tris-buffered saline | made in lab | N/A | 85 g NaCl, 61 g Tris base, up to 1 L volume with dH2O |
| 1X TBSt | made in lab | N/A | 50 mL 10x TBS, 1 mL 10% Tween 20, up to 500 mL volume with dH2O |
| Triton X-100 | Acros Organics | 327371000 | |
| Vectashield | Vector | H-1000 | non-hardening mounting media |
| Vector NovaRed substrate | Vector | SK-4800 | HRP substrate |
| Xylene | Fisher | X3P-1GAL |
参考文献
- Inoue, D., Wittbrodt, J. One for all--a highly efficient and versatile method for fluorescent immunostaining in fish embryos. PLoS One. 6 (5), (2011).
- Kogata, N., Howard, B. A. A whole-mount immunofluorescence protocol for three-dimensional imaging of the embryonic mammary primordium. Journal of Mammary Gland Biology and Neoplasia. 18 (2), 227-231 (2013).
- Santos, D., Monteiro, S., Luzio, A. General Whole-Mount Immunohistochemistry of Zebrafish (Danio rerio) Embryos and Larvae Protocol. Methods in Molecular Biology. 1797, 365-371 (2018).
- Shive, H. R., West, R. R., Embree, L. J., Sexton, J. M., Hickstein, D. D. Expression of KRASG12V in Zebrafish Gills Induces Hyperplasia and CXCL8-Associated Inflammation. Zebrafish. 12 (3), 221-229 (2015).
- Karlsson, J., von Hofsten, J., Olsson, P. E. Generating transparent zebrafish: a refined method to improve detection of gene expression during embryonic development. Marine Biotechnology (NY). 3 (6), 522-527 (2001).
- Macdonald, R., Guille, M. Zebrafish Immunohistochemistry. Molecular Methods in Developmental Biology. , 77-88 (1999).
- Santos, C., Pinto, M. L. Immunohistochemical Assessment as a Tool for Investigating Developmental Toxicity in Zebrafish (Danio rerio). Methods in Molecular Biology. 1797, 461-476 (2018).
- Shive, H. R., West, R. R., Embree, L. J., Azuma, M., Sood, R., Liu, P., et al. brca2 in zebrafish ovarian development, spermatogenesis, and tumorigenesis. Proceedings of the National Academy of Sciences. 107 (45), 19350-19355 (2010).
- Shive, H. R., West, R. R., Embree, L. J., Golden, C. D., Hickstein, D. D. BRCA2 and TP53 collaborate in tumorigenesis in zebrafish. PLoS One. 9 (1), (2014).
- van der Loos, C. M. Multiple Immunoenzyme Staining: Methods and Visualizations for the Observation With Spectral Imaging. Journal of Histochemistry and Cytochemistry. 56 (4), 313-328 (2008).
- van der Loos, C. M. . Immunoenzyme Multiple Staining Methods. , (1999).
- OCT Embedding For Cryostat Sectioning Of Embryos or Larvae [Internet]. The Zebrafish Book, 5th edition Available from: https://wiki.zfin.org/display/prot/OCT+Embedding+For+Cryostat+Sectioning+Of+Embryos+Or+Larvae (2007)
- Fischer, A. H., Jacobson, K. A., Rose, J., Zeller, R. Preparation of Cells and Tissues for Fluorescence Microscopy. Basic Methods in Microscopy. , (2006).
- The Lack of Commercial Antibodies for Model Organisms (and How You Can Deal with It) [Internet]. BenchSci Blog Available from: https://blog.benchsci.com/the-lack-of-commercial-antibodies-for-model-organisms-and-how-you-can-deal-with-it (2018)
- Carmany-Rampey, A., Moens, C. B. Modern mosaic analysis in the zebrafish. Methods. 39, 228-238 (2006).
- Da’as, S. I., Balci, T. B., Berman, J. N. Mast cell development and function in the zebrafish. Methods in Molecular Biology. 1220, 29-57 (2015).
- Quan, F. B., et al. Comparative distribution and in vitro activities of the urotensin II-related peptides URP1 and URP2 in zebrafish: evidence for their colocalization in spinal cerebrospinal fluid-contacting neurons. PLoS One. 10 (3), (2015).
- Westerfield, M. . The zebrafish book. A guide for the laboratory use of zebrafish (Danio rerio). , (2000).
- Sullivan-Brown, J., Bisher, M. E., Burdine, R. D. Embedding, serial sectioning and staining of zebrafish embryos using JB-4 resin. Nature Protocols. 6 (1), 46-55 (2011).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。