Method Article
CRISPR/Cas9 核糖核酸蛋白介导的精确基因编辑通过管电穿孔
摘要
这里介绍的是使用管电穿孔在哺乳动物细胞中高效CRISPR/Cas9核苷酸介导基因编辑的协议。
摘要
以CRISPR相关蛋白9(Cas9)为代表的基因编辑核酸酶正在成为生物医学研究的主流工具。通过转染成功地将CRISPR/Cas9元素传递到目标细胞中是有效基因编辑的先决条件。该协议证明,管电穿孔(TE)机器介导的CRISPR/Cas9核苷酸蛋白(RNP)的交付,以及单链寡核苷酸(ssODN)供体模板到不同类型的哺乳动物细胞,导致强大的精确的基因编辑事件。首先,TE被应用来提供CRISPR/Cas9 RNP和ssODN,以诱导白细胞介素2受体亚单位伽马(IL2RG)基因和棕嘴素还原酶(SPR)基因中的白细胞成纤维细胞中的致病突变。通过细菌TA克隆测序测定,精确突变率达到3.57%-20%。在人类iPSCs中,使用同样的策略,用于几个临床相关的基因,包括表皮生长因子受体(EGFR)、肌苷结合蛋白C、心脏(Mybpc3)和血红蛋白亚单位β(HBB)。一致,实现了高精度突变率(11.65%-37.92%)由深度测序(DeepSeq)确定。本研究证明,CRISPR/Cas9 RNP的管电穿孔是哺乳动物细胞中基因编辑的有效转染方案。
引言
CRISPR/Cas9 是基因编辑最常用的可编程核酸酶。它通过单导RNA(sgRNA)介导识别靶序列和基因组中相邻的原细胞相邻图案(PAM)序列工作。Cas9核酸酶产生一个双链DNA断裂(DSB),位于PAM序列1上游的三个核苷酸。DSB 可通过容易出错的非同源端连接 (NHEJ) 或同源导向修复 (HDR) 路径进行修复。为了通过HDR途径实现精确的基因编辑,通常以质粒DNA(pDNA)或单链寡核苷酸(ssODN)的形式提供供体模板。
CRISPR/Cas9和sgRNA可以以三种格式输送到细胞:Cas9蛋白和gRNA2、3的核苷酸蛋白(RNP)复合物;Cas9 mRNA 和 sgRNA4,5;或包含必要的启动子、驱动sgRNA和Cas9编码区域6,7,8的质粒DNA(pDNA)。许多组已经证明,当CRISPR/Cas9作为RNP提供时,基因编辑效率通常优于pDNA或mRNA格式,原因是RNP的体积比核酸9小得多。此外,此前已经表明,一种新型管电穿孔(TE)机在几种细胞类型9的基因编辑应用中特别有效。
本工作介绍的是利用TE向几个临床相关位点的哺乳动物细胞提供CRISPR/Cas9 RNP的分步协议。这种新型TE转染技术和高HDR率现象在生物医学研究中有着广泛的应用。
研究方案
所有动物维护、护理和使用程序都经过密歇根大学机构动物护理和使用委员会 (IACUC) 的审查和批准。
1. 细胞的制备
-
从美国类型文化收藏 (ATCC) 中获取人类 iPSC (ACS-1030)。按照供应商的指示,在细胞培养箱(37°C时5%CO 2)中,使用无进纸细胞培养基培养基(见材料表)在人工细胞外基质培养iPScs。
- 在转染前2小时,用10μM Rho关联、盘绕线圈(含有蛋白激酶(ROCK)抑制剂Y27632(使用它减少分离的人类HiPSCs的凋亡,提高hiPSCs的存活率和克隆效率,而无需影响其多能)。
- 转染时,用细胞分离溶液(见材料表)将iPSC分离到37°C的单个细胞5分钟。
-
建立兔子成纤维细胞培养使用兔子耳皮组织活检的主要培养物,如前所述10。
- 从兔子耳朵尖获得0.5厘米x0.5厘米的耳皮活检。把头发从耳组织上掉下来。
- 用杜贝克的磷酸盐缓冲盐水(DPBS)用5%的青霉素-链霉素冲洗2次。将耳组织转移到新的 6 厘米组织培养盘中,然后将组织切成小块(±1.0 mm x 1.0 mm)。加入几滴胎儿牛血清,防止组织干燥。
- 将切碎的组织铺至10厘米的组织培养皿中,然后加入10mL培养基。兔子成纤维细胞在Dulbecco的改性鹰培养(DMEM)中培养,具有10%的胎儿牛血清。将组织培养皿放入细胞培养箱(37°C时5%CO2)。
- 电镀后三至五天,使用胰蛋白酶-EDTA在37°C下消化细胞2分钟。
2. gRNA和捐助奥利戈斯的设计与合成
- 对于每个基因,使用在线工具(例如,)设计基于目标位点序列的设计RNA。
- 粘贴在感兴趣的DNA序列中。
- 选择基因组和原型间隔邻接图案(PAM)。输入 DNA 序列中的可能引导序列将显示在输出页上。建议选择具有较高预测效率和降低非目标电位的gRNA。
- 由商业供应商合成DNA转录gRNA。根据制造商的说明,使用gRNA合成试剂盒进行gRNA体外转录。
- 使用包含在gRNA合成试剂盒中的RNA纯化微柱纯化gRNA。测量浓度,然后将gRNA储存在-80°C。
- 为每个突变位点设计一个ssODN供体模板。ssODN 可以由商业供应商(如 IDT)合成。一般来说,每个ssODN的长度为120-160个核苷酸(nt),包括左同源臂60-80 nt和右同源臂60-80 nt。为了防止重新切割经过编辑的DNA,应尽可能在SSODN中引入PAM的无声突变。CRISPR 切位应尽可能靠近预期的基因组变化。
3. Cas9 RNP 和 ssODN 的管电穿孔
- 按照第 1 节所述准备单元格。
- 在20μL电穿孔缓冲液中重新悬浮2-3 x 105个电池。小心上下移液,产生单细胞悬浮液。
- 对于Cas9 RNP转染,在室温(RT)下将2μg的Cas9-NLS蛋白与0.67μgRNA混合10-15分钟。接下来,将形成的RNP复合物与2 μg的ssODN与细胞混合。
- 使用管电穿孔套件提供的通用贴合移液器吸头将电池混合物转移到 20 μL 电穿孔管中。为了达到更好的电穿孔效果,尽量避免在传输过程中形成气泡。
- 将电穿孔管放入电孔器的插槽中,然后按"Go"完成。遵循制造商针对每种单元格类型的建议参数。例如,对于人类 iPSC 和兔子成纤维细胞,电压集为 420 V,脉冲时间为 30 ms。 电波器显示屏上的脉冲报告指示成功的电穿孔循环。
- 电穿孔后,将人类iPS细胞转移到细胞培养部分所述的预加热Y-27632培养基的1mL。对于兔子成纤维细胞,用10%的胎儿牛血清将其转移到DMEM。
- 将重新悬浮的细胞板板到12孔细胞培养板的一个孔上。
- 每天更改文化媒体。Y-27632 从人类 iPSC 培养基培养基中去除 24 小时电穿孔后。
4. 基因编辑事件分析
- 电穿孔后收获细胞72小时。从培养板消化细胞使用胰蛋白酶-EDTA用于兔子成纤维细胞或人类iPSC的细胞分离溶液。离心机后,用350 mL的赖舍缓冲液(1M Tris HCl,5M NaCl,0.5 M EDTA;pH 8.0,10%SDS,每1mL的赖舍缓冲液加入20μL20mg/mL蛋白酶K)的细胞,然后在55°C孵育过夜。
- 使用标准程序用苯酚氯仿提取基因组DNA。
- 使用高保真DNA聚合酶放大含有靶区的100-200 bp DNA片段,然后使用凝胶提取试剂盒或使用PCR SV迷你试剂盒直接从PCR产品中纯化凝胶中的DNA片段。
- 为了通过细菌菌群测序确定基因编辑效率,使用TOPO TA克隆试剂盒将纯化的PCR产品联结到pCR4-TOPO载体中。随机拾取细菌克隆,然后使用 TOPO TA 克隆试剂盒提供的通用测序引物对刀片进行排序。
- 要通过深度测序确定基因编辑效率,请从步骤 4.3 发送纯化的 PCR 产品(+100-200 bp),用于 DNA 测序核心中的 CRISPR 大氧测序。
结果
Cas9 RNP 和 ssOdN 的 TE 到兔子成纤维细胞
图1说明了以TE介导的Cas9 RNP向哺乳动物细胞输送的全过程。首先,在IL2RG基因中产生C231Y和Q235X突变,在兔子成纤维细胞的SPR基因中产生R150G突变。IL2RG和SPR基因的机能丧失突变分别导致原发性免疫缺陷11和运动和认知缺陷12。
具体的sgRNA设计如图2A所示。表3列出了用于放大目标区域的引注。ssODN 序列显示在表 1中。基因编辑率由细菌TA克隆测定(图2B)。在IL2RG C231位点,在28个已测序的克隆中,有一个(3.57%)进行精确的C231Y突变,四 (14.28%)进行插入或删除(indel)突变,其余23个(82%)是野生型。在IL2RG Q235位点,在27个已测序的克隆中,有两个(7.41%)携带精确的Q235X突变,三携带indel突变(11.11%)其余的是野生型的。在SPG R150位点,在20个克隆序列中,5个(25%)携带精确的R150G突变,10 (50%)进行indel突变,其余的是野生型。
Cas9 RNP 和 ssOdN 的 TE 到人类 iPSC
然后,TE 用于将 Cas9 RNP 和 ssODN 交付给人类 iPSC,并针对 EGFR、Mybpc3 和 HBB 基因中的临床相关位点。EGFR T790近端区域的点突变使非小细胞肺癌(NSCLC)患者对EGFR酪氨酸激酶抑制剂产生抗药性,使EGFR13的活化突变发生。Mybpc3中外大16的帧移位突变与肥大性心肌病14有关。HBB基因中的E6V点突变导致刀状细胞疾病15。
具体的sgRNA设计如图3A所示。表3列出了用于放大目标区域的引注。ssODN 序列显示在表 1中。基因编辑率由DeepSeq确定(图3B)。在EGFR位点,15.68%的等位基因携带精确点突变(6,315次读取),22.75%携带indel突变(9,162次读取),其余61.57%为野生型(24,797次读取)。在Mybpc3位,37.92%携带精确的4bp TGAA删除(11,654次读取),2.24%携带indel突变(410次读取),其余59.84%为野生型(18,692次读取)。在HBB位点,11.65%携带精确的E6V突变(6,565次读取),23.35%携带indel突变(13,163次读取),其余65%为野生型(36,644次读取)。

图1:Cas9 RNP管电穿孔流程图。

图 2:兔子成纤维细胞的基因编辑。(A) 目标序列的插图.框表示目标位点。下划线字母对应于 gRNA 序列。红色字母表示 PAM 序列。(B) 基因编辑事件的TA克隆结果.框表示精确突变的位点。显示的 indel 序列仅代表一个等位基因类型。不显示其他 indel 序列。请点击此处查看此图的较大版本。
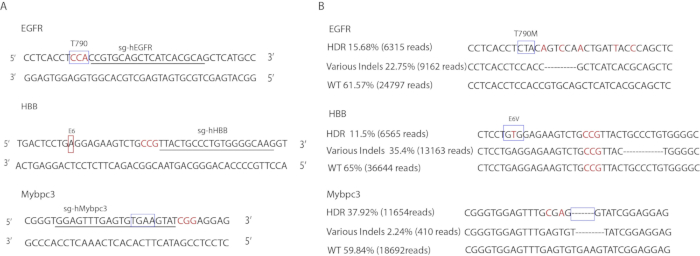
图 3:人类iPSC的基因编辑。(A) 目标序列的插图.框表示目标位点。下划线字母对应于 gRNA 序列。红色字母表示 PAM 序列。(B) 基因编辑事件的深层结果.框表示精确突变的位点。红色字母表示在捐赠者模板中引入的无声突变。显示的 indel 序列仅代表一个等位基因类型。不显示其他 indel 序列。请点击此处查看此图的较大版本。
| 轨迹 |
奥利戈序列 | |||||||
| (目标突变) | ||||||||
| 兔子 IL2RG (C231Y) | AGCGGAGGGAAAATCTCTCTCTCTGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGATATATATG 加特加加加加加中协GGGGAAAAAAAAATGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGAAAATGGG | |||||||
| 兔子 IL2RG (Q235X) | AGCGGGGGGGAAAATCTCTCTCTCTGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGATATGGGGGGGGGGGGGGGGGGGGGGGGGGGATATGGG 加特加加加加加中协GGGGAAAAAAAAATGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGAAAATGGG | |||||||
| 兔子 SPR | 加克特卡特克特克特克特克特加特加特加特加特格特格特格特格特格特格格格格格格格格格格格格格加特加特加特加特加特加特加特格特格特格特格格格克特克特克特克特克特克特克特加特加格格格格格格格 茨克塔克 | |||||||
| (R150G) | ||||||||
| 人类EGFR | ACGGATGGCCAGCGGGACACCCCGGGGCCGGGCGGCCTCTCTCTCTCTCTCTCTACATATATATATATATACCACATATATACCCCC AGCTCATCTCTCTCTATCTATATGGAGAAAAAAAATATATCTCTCTCTCTCTAGAGTACTAC | |||||||
| (点突变接近 T790) | ||||||||
| 人类Mybpc3 | 海合会的TGCTCCTCGCCGGGCGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGAGGAGAGAGAGAGAGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGAGGAGGAGAGGAGAGGAGAGGAGGAGGAGGAGG GGGGGGGAAAATATATGGGGGAGAGAGGGGGGGTGTGGGGGGAT | |||||||
| (4 bp 删除) | ||||||||
| 人类HBB | TCTGACACAATCTCTCTCTCTCTCTGGCTCTCTCTCTCTCTCTCTCTCTATCTCTCTATCTATATCTATCTATATCTATATCTATATATCTATATATCTATATCTATATATCTATATCTATATCTATATCTATATCTATATCTATCTATATCTATCTATCTATCTATATATATCTATATCTATCTATATCTATCTATATCTATCTATCTATCTATCTATATCTATATCTATATCT CTGTGGGGAGGAGGAGGAGATAGATGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGG | |||||||
| (E6V) | ||||||||
表 1:ssODN 序列。
| 步 | 问题 | 可能的原因 | 解决 方案 |
| 2.1 | 低内德尔率 | 引导RNA设计不良,导RNA库存>6个月,导引RNA浓度低 | 重新设计指南RNA,产生/订购新的指南RNA。 |
| 2.3 | 低 PGE 效率 | 供体DNA设计不良,低效率引导RNA,供体DNA数量不正确或DNA质量差 | 增加同源臂长度,引入PAM突变,引入沉默突变到供体DNA,使用更有效的引导RNA,优化Cas9蛋白对引导RNA的比例。 |
| 3.4 | 转染失败 | 将电池缓冲混合物转移到电穿孔管过程中形成的气泡,电压/持续时间设置不正确 | 尽量避免形成气泡,调整电压/持续时间设置。 |
| 3.6 | 电穿孔后细胞活力低 | 单一人类生存率低 | 电穿孔后加入ROCK抑制剂,增加电池数量。 |
| 4.1 | PCR 故障 | 高 GC 内容或重复序列 | 优化 PCR 条件,将 DMSO 添加到 PCR 系统中。 |
表 2:常见问题的故障排除指南。
| 引种名称 | 序列 | 注意 |
| Rb-IL2RG-F | 卡特加格特加格格格CCC | 用于放大兔子 IL2RG DNA 片段 |
| Rb-IL2RG-R | TGCCAGAGACACAGCAC | |
| Rb-SPR-F | 格格特格加加加加格格 | 用于放大兔子SPRDNA片段 |
| RB-SPR-R | CTCAGCCACCGG | |
| H-EGFR-F | TGATGGCCAGCGGGGGAAC | 用于扩增人类EGFR DNA片段 |
| H-EGFR-R | 阿加特加格加格格格格格 | |
| H-Mybpc3-F | 加特加特加特加特加加理事会 | 用于扩增人类 Mybpc3 DNA 片段 |
| H-Mybpc3-R | 塔加格格加卡尔卡恰特 | |
| H-HBB-F | 塔阿奇加特塔卡卡塔茨格 | 用于扩增人类HBB DNA片段 |
| H-HBB-R | CATGCCTCTACACAACT |
表 3:步骤 4.3 中使用的引性。
讨论
管电穿孔方法有效地向兔子和人体细胞提供CRISPR/Cas9 RNP和ssODN,从而实现强大的精确基因编辑(PGE)。TE 和其他传统电穿孔装置的主要区别是使用管,其中两个电极位于管的顶部和底部,样品被装满,然后在电穿孔时密封(图 1)。相比之下,在传统的比色皿中,电极位于两侧,样品在电穿孔过程中未完全密封。这种新设计减少了气泡的产生和压缩气泡大小,从而改善了电压的均匀分布,从而减少了细胞死亡和高转染效率9。在目前的工作中,高PGE率(15%-37%)以EGFR、Mybpc3和HBB基因为目标,在人类iPSC中实现。这些结果与先前的报告一致,该报告在人类干细胞9中实现了高PGE率。
致病突变以兔子细胞的IL2RG和SPR基因为目标。最近,IL2RG敲除兔子已经生产为人类X链接严重合并免疫缺陷(SCID-X1)16,17的模型。本研究表明,患者IL2RG突变(例如,C231Y和Q235X)可以在兔细胞中有效生成,证明创建携带患者突变的SCID-X1兔子模型的可行性。还表明,SPR R150G突变可以在兔细胞中有效产生。这种突变导致12岁儿童的机和认知缺陷。这些IL2RG和SPR突变兔子模型一旦生成,可作为转化研究的宝贵临床前模型。它们还可用于建立基于基因编辑的用于治疗这些单源性疾病。
CRISPR/Cas9介导的基因编辑应用的一个关注点是脱靶编辑事件。本研究中使用的sgRNA(表S1),使用前面描述的方法,在预测的最高偏离目标站点对Indel率进行了分析。总共,使用表S2中列出的引热剂,对sg-rb-IL2RG-01的7个潜在顶离目标位点进行了分析,对sg-rb-SPR分析了5个,为sg-hEGFR分析了7个,对sg-hMybpc3进行了7次分析。T7E1测定(图S1)未发现脱靶基因,表明使用这些sgRNA进行CRISPR/Cas9介导基因编辑的离目标风险最小。还表明,管电穿孔方法本身不会引起或增加偏离目标编辑。然而,应致力于减少或消除不良的偏离目标编辑。对于打算用于临床应用的细胞,可能需要全基因组测序来排除此类事件。
在技术层面,以下被认为是通过CRISPR/Cas9 RNP管电穿孔实现高效精确基因组编辑的关键因素。首先,建议选择具有预测低脱靶潜力的高效sgRNA。在将所选sgRNA用于PEG应用之前,验证其内德尔效率非常重要。软件预测良好的sgRNA在验证步骤中失败并不罕见。
其次,为了实现高PGE,建议尽可能诱导PAM突变到ssODN捐赠者。其理由是,通过这样做,CRISPR/Cas9在阻止捐赠者模板集成后重新切割。在某些情况下,PGE 本身引入 PAM 突变。在其他情况下,有可能将沉默突变引入 PAM 序列。如果 PAM 突变是不可能的,建议尝试在捐赠者中包括几个与 sgRNA 序列对应的无声突变。
第三,与TE特别相关,在将电池和RNP混合物转移到电穿孔管时,避免形成气泡非常重要。虽然 TE 管的设计已经最大限度地减少了气泡的形成,但小心处理将进一步减少甚至完全避免气泡形成。表2提供了一个故障拍摄指南,用于CRISPR/Cas9核苷酸介导的精确基因编辑,在应用管电穿孔时可能遇到的常见问题。
最后,这里证明,管电穿孔是向哺乳动物细胞输送CRISPR/Cas9 RNP和ssODN以实现高PGE速率的有效手段。这种新的TE转染技术及其强大的精确基因编辑率,可促进基因编辑应用的发展。
披露声明
J. C. 在 Celetrix LLC 工作,该制造商是管电波机的制造商。L.M.、L.J.、J.S.、D.Y.、J.Z.、Y.E.C.和J.X.宣布没有相互竞争的利益。
致谢
这项工作得到了国家卫生研究院(R21OD023194至JX)的支持。这项工作利用了密歇根大学医学中心转化科学和治疗高级模型中心(CAMTraST)支持的核心服务。
材料
| Name | Company | Catalog Number | Comments |
| Accutase | STEMCELL Technologies | 792 | Cell detachment solution for human iPSCs, first used in Step 1.1.2. |
| Cas9 Nuclease 3NLS | IDT | 1074182 | Cas9 protein, first used in Step 3.3. |
| DMEM | Thermo Fisher | 11965092 | For cell culture, first used in Step 1.2.3. |
| DPBS | Thermo Fisher | 1708075 | For preparing cell culture, first used in Step 1.2.2. |
| EDTA | Lonza | 51201 | For making lysis buffer, first used in Step 4.1. |
| Electroporation buffer | Celetrix | 13–0104 | The electroporation buffer, first used in Step 3.2. |
| Electroporation tubes | Celetrix | 20 μL: 12–0107; 120 μL: 12–0104 | The electroporation tube, first used in Step 3.4. |
| Electroporator | Celetrix | CTX-1500A LE | The tube electroporation machine, first used in Step 3.5 |
| Fetal bovine serum | Sigma Aldrich | 12003C | For cell culture, first used in Step 1.2.2. |
| Forma CO2 Incubators | Thermo Fisher | Model 370 | For cell culture, first used in Step 1.1. |
| Gel Extraction Kit | Qiagen | 28115 | For gel purification, first used in Step 4.3. |
| Human induced pluripotent stem cells | American Type Culture Collection | ACS-1030 | Human iPSCs, first used in Step 1.1. |
| Matrigel | Corning | 354277 | Artificial extracellular matrix; for precoating cell culture plate, first used in Step 1.1. |
| mTeSR 1 medium | STEMCELL Technologies | 85850 | Feeder-free cell culture medium for human iPSCs, first used in Step 1.1. |
| PCR SV mini | GeneAll | 103-102 | For PCR product purification, first used in Step 4.3. |
| Penicillin-Streptomycin | Thermo Fisher | 15140163 | For preparing cell culture, first used in Step 1.2.2. |
| Phenol-chloroform | Thermo Fisher | 15593031 | For DNA extraction, first used in Step 4.2. |
| Precision gRNA Synthesis Kit | Invitrogen | A29377 | For the generation of full length gRNA (guide RNA), first used in Step 2.4. |
| Proteinase K Solution | Thermo Fisher | AM2548 | For DNA extraction, first used in Step 4.1. |
| Q5 high-fidelity DNA polymerase | NEB | M0491 | For PCR amplification, first used in Step 4.3. |
| Sodium dodecyl sulfate | Sigma Aldrich | L3771 | For making lysis buffer, first used in Step 4.1. |
| TA Cloning Kit | Thermo Fisher | K457502 | For TA clone sequencing, first used in Step 4.4. |
| Tissue Culture Dish (10 cm) | FALCON | 353003 | For cell culture, first used in Step 1.2.3. |
| Tissue Culture Dish (12 well) | FALCON | 353043 | For cell culture, first used in Step 3.7. |
| Tissue Culture Dish (6 cm) | FALCON | 353004 | For cell culture, first used in Step 1.2.2. |
| Tris HCl | Thermo Fisher | BP1757-500 | For making lysis buffer, first used in Step 4.1. |
| Trypsin-EDTA | Thermo Fisher | 25200056 | For cell digestion, first used in Step 1.2. 4. |
| Universal Fit Pipette Tips | Celetrix | 14-0101 | For electroporation, first used in Step 3.4. |
| Y27632 | LC Labs | Y-5301 | The apoptosis inhibotor, first used in Step 1.1.1. |
参考文献
- Cong, L., et al. Multiplex genome engineering using CRISPR/Cas systems. Science. 339 (6121), 819-823 (2013).
- Mout, R., et al. Direct Cytosolic Delivery of CRISPR/Cas9-Ribonucleoprotein for Efficient Gene Editing. ACS Nano. 11 (3), 2452-2458 (2017).
- Zuris, J. A., et al. Cationic lipid-mediated delivery of proteins enables efficient protein-based genome editing in vitro and in vivo. Nature Biotechnology. 33 (1), 73-80 (2015).
- Miller, J. B., et al. Non-Viral CRISPR/Cas Gene Editing In Vitro and In Vivo Enabled by Synthetic Nanoparticle Co-Delivery of Cas9 mRNA and sgRNA. Angew Chem Int Ed Engl. 56 (4), 1059-1063 (2017).
- Finn, J. D., et al. A Single Administration of CRISPR/Cas9 Lipid Nanoparticles Achieves Robust and Persistent In Vivo Genome Editing. Cell Reports. 22 (9), 2227-2235 (2018).
- Liang, C., et al. Tumor cell-targeted delivery of CRISPR/Cas9 by aptamer-functionalized lipopolymer for therapeutic genome editing of VEGFA in osteosarcoma. Biomaterials. 147, 68-85 (2017).
- Luo, Y. L., et al. Macrophage-Specific in Vivo Gene Editing Using Cationic Lipid-Assisted Polymeric Nanoparticles. ACS Nano. 12 (2), 994-1005 (2018).
- Wang, H. X., et al. Nonviral gene editing via CRISPR/Cas9 delivery by membrane-disruptive and endosomolytic helical polypeptide. Proceedings of the National Academy of Sciences of the United States of America. 115 (19), 4903-4908 (2018).
- Xu, X., et al. Efficient homology-directed gene editing by CRISPR/Cas9 in human stem and primary cells using tube electroporation. Scientific Reports. 8 (1), 11649 (2018).
- Du, F., et al. Beneficial effect of young oocytes for rabbit somatic cell nuclear transfer. Cloning Stem Cells. 11 (1), 131-140 (2009).
- Allenspach, E., Rawlings, D. J., Scharenberg, A. M., Adam, M. P., et al. . GeneReviews(R). , (1993).
- Friedman, J., et al., Adam, M. P., et al. . GeneReviews(R). , (1993).
- Hidaka, N., et al. Most T790M mutations are present on the same EGFR allele as activating mutations in patients with non-small cell lung cancer. Lung Cancer. 108, 75-82 (2017).
- Ma, H., et al. Correction of a pathogenic gene mutation in human embryos. Nature. 548 (7668), 413-419 (2017).
- Vakulskas, C. A., et al. A high-fidelity Cas9 mutant delivered as a ribonucleoprotein complex enables efficient gene editing in human hematopoietic stem and progenitor cells. Nature Medicine. 24 (8), 1216-1224 (2018).
- Song, J., et al. Bacterial and Pneumocystis Infections in the Lungs of Gene-Knockout Rabbits with Severe Combined Immunodeficiency. Frontiers in Immunology. 9, 429 (2018).
- Song, J., et al. Production of immunodeficient rabbits by multiplex embryo transfer and multiplex gene targeting. Scientific Reports. 7 (1), 12202 (2017).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。