Method Article
毛细管电泳质谱法提取培养细胞中的水代谢物进行代谢组学分析
摘要
本文的目的是描述从培养的粘附细胞中提取水代谢物的方案, 用于代谢组学分析, 特别是毛细管电泳质谱法。
摘要
代谢组学分析是一种很有前途的组学方法, 不仅可以了解癌细胞与正常细胞相比的特定代谢调节, 而且可以识别早期癌症检测和化疗反应预测的生物标志物。癌症患者。为代谢组学分析制备均匀样品是一个有待解决的关键问题。在这里, 我们提出了一个简单可靠的方案, 提取水代谢物从培养的粘附细胞代谢组学分析使用毛细管电泳质谱 (CE-MS)。通过培养和清洗细胞、用甲醇处理细胞、提取代谢物、用自旋柱去除蛋白质和大分子进行 CE-MS 分析, 对培养细胞的水代谢物进行分析。使用用氧化试剂----二胺治疗的肺癌细胞系----的代表性结果, 说明了细胞在氧化应激下明显可观察到的代谢转移。本文对参与代谢组学研究的学生和研究人员特别有价值, 他们是从细胞系中收获代谢物的新手, 由 CE-MS 进行分析。
引言
奥托沃伯格观察到, 癌细胞获得了不寻常的能力, 吸收葡萄糖并发酵它, 在有足够氧气的情况下产生乳酸--这种现象被称为 warburg 效应或好氧糖酵解1,2。线粒体呼吸缺陷被推测为癌细胞有氧糖酵解的基础3。事实上, 沃堡效应是氟脱氧葡萄糖 (fdg)-正电子发射断层扫描 (pet) 肿瘤成像的基础, 在临床实践中广泛使用 4,5。高的有氧糖酵解率被认为是癌症的一个关键特征, 最近被采纳为著名的 "癌症特征" 之一, 正如 D. Hanahan 和 B. Weinberg6所描述的那样。癌基因和肿瘤抑制基因的体细胞突变--如hras/kras/nras、 egfr、 braf、myc、 tp53、异氰酸酯脱氢酶 (idh) 和富马酸水合酶 ( fh))--与癌细胞的特定代谢变化有关, 相信这是沃堡效应7的结果.
代谢组学分析是一种很有希望的方法, 不仅可以了解癌细胞的代谢调节, 而且可以识别早期癌症生物标志物和化疗反应预测。在用抗癌化合物治疗敏感或耐药癌细胞后, 跟踪其代谢反应有助于识别代谢生物标志物, 以预测特定抗癌疗法在癌症患者中的有效性8 , 9,10,11。本文将用二胺处理的 Egfr 突变从肺腺癌中提取的癌细胞系作为代谢分析模型。这种使用毛细管电泳质谱 (ce-ms) 的分析方法的优点是它对质量范围为 50-1000 12,13的带电代谢物进行了综合测量。本文的目的是为新手提供一个详细的逐步视觉方案, 用于从培养的癌细胞中制备水代谢物和随后的代谢组学分析, 特别是通过 CE-MS。
研究方案
1. 第1天的细胞培养
注: 代谢物提取的每个样品应从一个100毫米的组织培养盘中制备, 该培养盘是适度的, 但不是完全融合的 (含有大约2-500万细胞)。计算检测所需的菜数, 并做好相应的准备。
- 在 RPMI-1640 培养基中, 在37°c 条件下培养 5% co2 中的 hcc827 和 pc-9 细胞, 辅以10% 的胎牛血清 (fbs)。
- 从100毫米培养皿中吸收细胞培养培养基。
- 使用不含钙和镁的2毫升磷酸盐缓冲盐水 (PBS) 溶液清洗每道菜上的细胞。轻轻摇晃每一道菜, 使 PBS 溶液完全覆盖菜的表面。
- 从培养皿中吸走洗涤缓冲。
- 将0.25% 的色氨酸-edta 溶液加热至 37°c, 并在5毫升血清学移液器中加入2毫升的色氨酸 edta 溶液。轻轻摇晃每一道菜, 使胰蛋白酶完全覆盖在菜品的表面。
- 在37°c 下将培养皿孵化约5分钟。
- 每道菜加入4毫升预热完全生长介质。通过轻轻移液多次, 将细胞重新进入培养基中。
- 将每个细胞的悬浮液以800xg 的速度转移到单独的15毫升锥形管和离心机中5分钟。
- 在预热完全培养基2毫升中重新选择每个细胞颗粒。
- 使用自动单元计数器和0.4% 的色氨酸蓝色溶液确定细胞的总数和存活率。
- 混合10Μl 的细胞悬浮液和10μl 的0.4% 色氨酸蓝溶液。
- 通过毛细管作用将10μl 的样品加载到细胞计数室中。
- 将室滑动插入自动单元计数器。传输的光自动发光, 仪器自动聚焦在电池上。
- 按下捕获按钮以捕获图像并显示结果。
- 如有必要, 添加进一步的培养基, 以获得所需的细胞浓度。
- 每100毫米细胞培养皿种子约有1–2.5 个细胞。
注: 通过 CE-MS 分析确定的代谢物浓度将根据活细胞的数量进行归一化。为了细胞计数的目的, 有必要为每个群体至少多准备一道种子培养皿。 - 在37°c 下将培养皿中的 5% co2 中培养18小时。
2. 试剂的制备
- 稀释商业内部标准溶液, 包括 l-蛋氨酸磺酸和d-樟脑-10-磺酸在超纯水中1000倍。
注: 对于少于80个样品, 只需将内部标准溶液1和 45 mL 的超纯水混合在50毫升的体积瓶中, 然后用超纯水将溶液混合到50毫升。 - 在超纯水中制备 0.05 gml 甘露醇溶液作为洗涤缓冲液。
注: 对于少于30个样品, 只需将25克甘露醇溶解在500毫升的超纯水中即可。每100毫米培养盘大约需要15毫升的洗涤缓冲液, 因此请根据样品的数量准备足够数量的洗涤缓冲液。
3. 预洗离心滤清器
- 将50μl 的超纯水放入每个离心过滤单元的过滤杯中 (参见材料表)。
注: 每个样品需要两个过滤单元。 - 将滤清器盖紧, 在4°c 下将离心机固定在 9 100xg下5分钟。
- 检查每个滤液的体积--如果在第一次短旋转过程中积累了大量滤液, 过滤单元可能有缺陷。在这种情况下, 请丢弃过滤单元, 而是使用新的过滤单元。
- 紧紧地关闭滤清器盖, 在4°c 下再次以 9 100xg的状态离心30分钟。
- 确保任何滤杯中都没有超纯水;用移液器取出每个收集管中过滤过的超纯水, 然后丢弃。
注: 不要试图去除带有移液器的过滤器杯中的剩余水, 因为它可能会损坏过滤器。 - 将过滤杯更换到它们的收集管中。
注: 使用离心过滤装置在一个小时内, 因为过滤器可能会损坏干燥。
4. 第2天的细胞培养
-
从孵化器中取出100毫米培养皿。
注: 建议的细胞培养持续时间为18小时。 - 从每一道100毫米培养皿中吸收细胞培养培养基。
- 在每个菜品中加入10毫升的细胞培养基, 包括适当浓度的化合物或药物, 注意不要干扰细胞层。
注: 为了演示目的, 我们在本实验中添加了10μl 的 250 Mm 二胺溶解在 PBS 中 (最终浓度为 250μm)。 - 在以二胺或 PBS 为对照的情况下, 在37°c 下将培养皿培养30分钟。
- 从每一道100毫米培养皿中吸收细胞培养培养基。
- 将细胞轻轻加入2毫升的5% 甘露醇溶液, 加入每道菜的边缘, 注意不要打扰细胞层, 然后稍微倾斜盘子。
注: PBS 或盐水干扰基于 Ce-ms 的代谢组学分析, 并对测量结果产生不利影响, 因此不应用作洗涤缓冲液。 - 从每个培养皿中吸出洗涤缓冲液, 然后再清洗细胞, 每盘轻轻加入 1 0 毫升的洗涤缓冲液, 并稍微倾斜洗盘。
- 从每个培养盘的边缘完全吸气清洗缓冲液。
注: 吸吸尽可能多的洗涤缓冲液, 同时注意不要吸气细胞。残留甘露醇可能会干扰 CE-MS 分析;细胞的抽吸会减少细胞的数量, 从而成为数据规范化的误差来源。
5. 从培养细胞中提取代谢物
- 每道菜加入800μl 的99.7% 甲醇。轻轻摇晃每一道培养皿来回摇晃, 以覆盖其整个表面。把盘子放在室温下30秒。
- 通过将移液器的尖端浸入甲醇中, 并轻轻向上和向下轻轻移液几次, 慢慢地加入每盘稀释后的内部标准溶液550Μl。
- 轻轻摇晃每一道培养皿来回摇晃, 以覆盖其整个表面。
- 把盘子放在室温下30秒。
6. 细胞提取物的超滤
- 将提取的溶液从每个培养皿中转移到一个单独的 1.5 mL 微离心管中。
- 在4°c 条件下以230xg 离心管 5分钟.
- 将每个上清液的350μl 转移到每个样品的两个离心过滤单元中。
注: 从每个培养盘中, 总共有700μl 的提取溶液被转移到两个过滤管 (350μl 管) 中。 - 在4°c 条件下, 以 9 100xg 离心过滤管约 2小时, 直到过滤杯中没有液体残留.
- 取下过滤器杯, 并紧紧地关闭收集管的盖子。
7. 样品蒸发
- 准备一个离心蒸发器--通常, 它由蒸发器、冷疏水阀和真空泵组成。
- 将收集管放置在离心蒸发器中。
注: 保持管盖打开。 - 在室温下真空条件下蒸发提取的样品溶液。
注: 旋转次数和压力的典型配置分别为 1, 500 转/分和 1, 000 帕, 通常需要约3小时才能完全蒸发样品。 - 确认任何收集管中都没有液体残留, 并紧紧地关闭收集管的盖子。
- 将收集管存放在超低温 (-80°c) 的深冰柜中, 直至代谢组学分析。
8. CE-MS 代谢组分析
- 在 CE-MS 分析之前, 立即将滤液重新吸收在50μl 的超纯水中。
- 使用前面12、13所述的方法进行 ce-ms 分析, 使用毛细管电泳系统和飞行时间质谱仪系统, 该系统配备了一个等温泵、一个 ce-ms 适配器和一个 ce-esic-ms 喷雾器。
注: 这两个系统都可以由系统供应商的软件控制, 并由熔融二氧化硅毛细管 (50 微米内径 x80 厘米总长度) 连接。- 设置仪器和样品瓶, 用毛细管盒准备毛细管, 根据阴离子或阳离子分析模式补充鞘液体和适当的电泳缓冲液, 然后施加电压。
注: 仪器和分析条件在其他地方详细说明12、13。 - 打开软件并准备包含数据采集方法和示例信息的工作列表。
- 开始试运行并检查内部标准的信号强度和峰值形状以及其他标准化合物的峰值分辨率等数据。
- 必要时对分析条件进行微调。
- 以50毫巴的速度注入样品解决方案, 电压为 3秒, 电压为30千伏。
注: CE-MS 是在正离子模式下进行的。设置光谱仪扫描质量范围ms50–1000 。毛细管电压设置为 4kv;氮气流量 (加热器温度 300°C)。对于正模式, 片段、脱脂机和 OCT RFV 电压分别设置为75、50和 125 V。对于负离子模式, 片段、脱脂器和 OCT RFV 电压分别设置为100、50和 200 V。
- 设置仪器和样品瓶, 用毛细管盒准备毛细管, 根据阴离子或阳离子分析模式补充鞘液体和适当的电泳缓冲液, 然后施加电压。
- 分析频谱数据。
- 利用自动集成软件从质谱数据中提取峰值, 以获取峰值信息, 包括m/z、峰值面积和迁移时间 (mt)。
注: 该方法在其他地方详细说明14。 - 排除与已知代谢物的同位素异构体、加合物离子和其他产物离子相对应的信号峰。
- 根据m/z值和 mt, 利用 hmt 代谢物数据库中的信息对剩余峰值进行注释。
- 将带注释的峰值区域归一化为每个样本的内部标准级别和单元数。
- 使用为每种代谢物准备的标准曲线评估培养细胞中每个代谢物的浓度。
- 使用量化的代谢物浓度进行后续统计分析和生物解释14。
- 利用自动集成软件从质谱数据中提取峰值, 以获取峰值信息, 包括m/z、峰值面积和迁移时间 (mt)。
结果
由于癌细胞中的代谢物浓度 (pmol/10 -10个细胞) 被归化为活细胞的数量, 因此应谨慎地建立实验条件, 以尽量减少条件之间活细胞数量的变化。例如, 二胺处理的浓度相对较高 (250 微米), 但时间很短, 可以使所有细胞尽可能平等地生长, 从而使所分析的活细胞数量相等。在这些实验条件下, HCC827 和 PC-9 细胞平均生长 3小时 (图 1)。对金刚石处理的细胞进行 CE-MS 分析, 与 pbs 处理 (对照) 细胞相比, 分别发现 HCC827 和 CE-MS 细胞中有175和150种不同代谢物。其中, 在两种细胞系的二胺处理条件下, 戊糖磷酸盐途径 (PPP) 和上糖酵解中的几种中间体明显高于二胺处理条件, 而少数三羧酸 (TCA) 循环中间体在处理中的含量较低。条件 (图 2和图 3)。
PPP 以减少烟酰胺腺嘌呤二核苷酸磷酸 (NADPH) 的形式产生还原等价物, 用于氧化还原稳态维持和脂肪酸生物合成 15。经过二胺处理后, HCC827 细胞中葡萄糖酸--氧化葡萄糖--的含量增加了 12倍, PC-9 细胞增加了 10倍;类似地, 经过二胺处理后, 六氯化钾 (G6P)—a 磷酸化葡萄糖和第一种己基酶催化糖酵解产物的水平--在 HCC827 和 PC-9 细胞中也分别增加了6.3倍和 3.5倍 (图 4)。此外, 经过二胺处理后, 6-磷谷氨酸 (PPP 中的第一个中间体6PG)—the 水平----HCC827 细胞中的水平与 PBS 控制中的水平相比, 在 PC-9 细胞中显著增加了 89倍, 在 PC-9 细胞中增加了 231倍 (图 4)。相比之下, 其他糖基中间体, 如 6-磷酸果糖 (F6P) 和果糖 1, 6-双磷酸 (F6P) 的水平在二胺实验条件下没有变化 (图 4)。烟酰胺腺苷二核苷酸 (NADP+) 总水平在二胺处理和 pbs 控制条件 (图 4) 之间几乎相等, 表明葡萄糖主要是通过 ppp 分解代谢的。
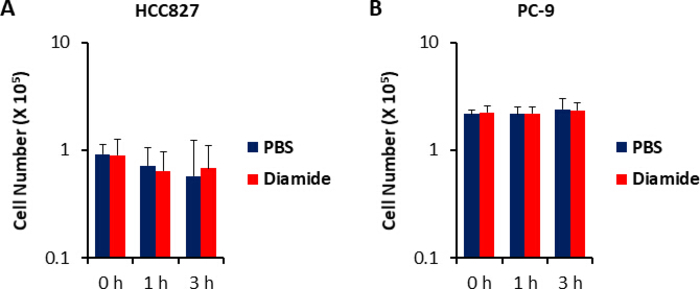
图1。二胺治疗时细胞数量不变。用色氨酸蓝染色法测定了细胞对250μm 二胺的生长反应。显示了 (a) hcc827 和 (b) 用 pbs (蓝色) 或二胺 (红色; 250μm)处理1或3小时的 pc-9 细胞的细胞数。数据显示为平均值±SD (n = 6)。请点击这里查看此图的较大版本.
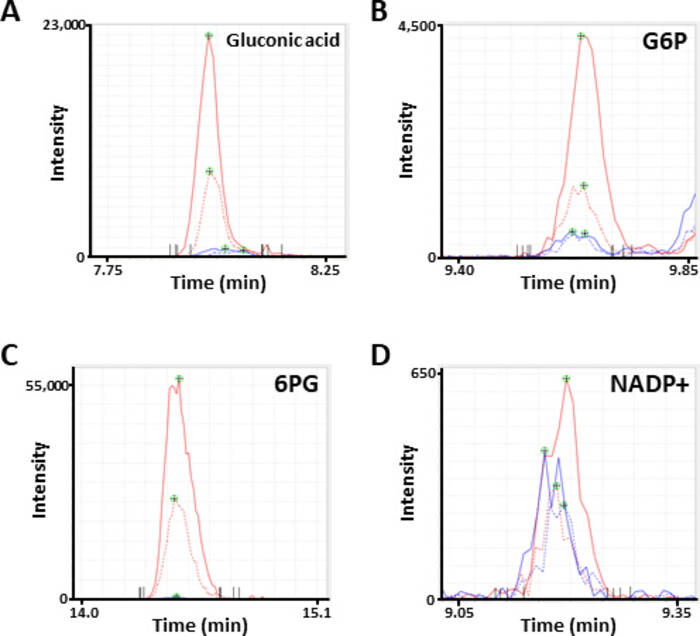
图2。代表性 ms 代谢物峰值。电泳图注释为 (a) 葡萄糖酸, (b) 葡萄糖 6-磷酸 (g6p), (c) 6-磷谷氨酸 (6pg), 和 (d) 烟酰胺腺苷二核苷酸磷酸 (napd+) 通过 ce-ms 分析获得。每行表示所使用的细胞系 (固体、HCC827; 虚线、PC-9) 和处理 (蓝色、PBS; 红色、二胺)。请点击这里查看此图的较大版本.
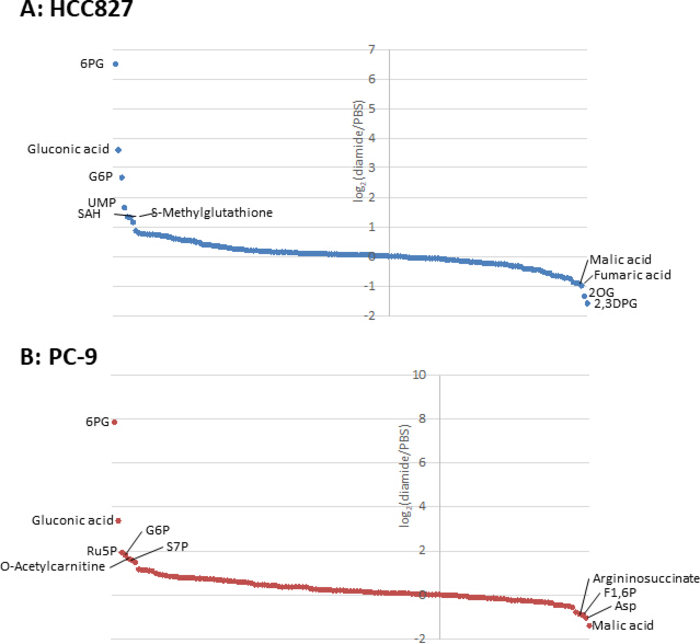
图3。细胞内代谢物的代谢组谱。用二胺处理的 (a) Hcc827 和 (b) pc-9 细胞中代谢物的折叠变化为日志2(二米/pbs)。在 HCC827 和 PC-9 细胞中分别对175种和150种代谢物进行了注释。请点击这里查看此图的较大版本.
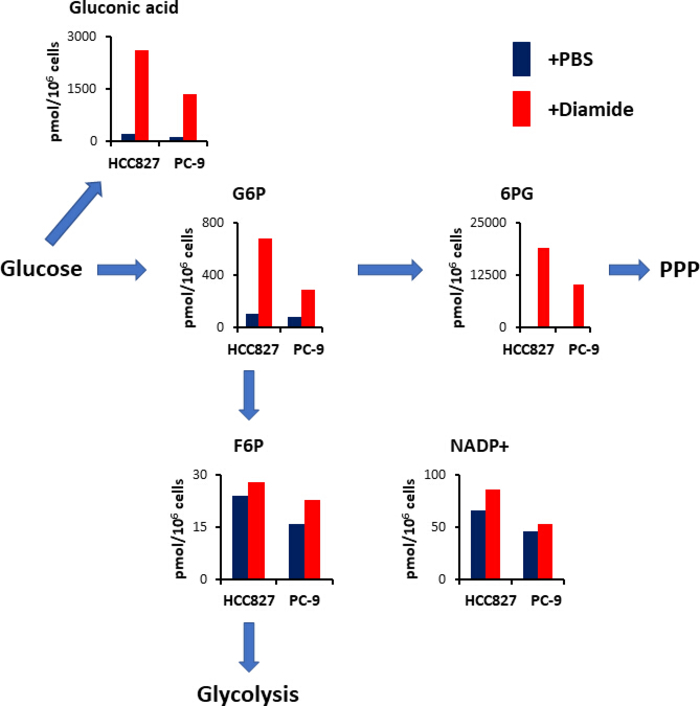
图4。在二胺处理后对 PPP 进行上调。显示了糖酵解和戊糖磷酸盐途径 (ppp) 治疗后的关键代谢物的细胞内浓度 (pmome106 细胞) 。从 HCC827 和 pc-9 细胞中提取代谢物, 用 PBS (蓝色) 或二胺 (红色, 250 微米) 处理 30分钟. 具有代表性的代谢物, 如葡萄糖酸、葡萄糖 6-磷酸 (g6p)、果糖 6-磷酸(G6P), 6-磷酸二甲酸酯 (6Pg)和烟酰胺腺嘌呤二核苷酸磷酸 (nadp+)。请点击这里查看此图的较大版本.
讨论
在这里, 我们描述了一种广泛使用的方法, 用于制备培养的癌细胞中的代谢物, 用于基于 cer-ms 的代谢组学分析。该方案中最关键的一点是癌细胞的适当准备, 因为测量的代谢物浓度被归一化到活细胞的数量。为了准确估计细胞数量, 有必要为每个实验组准备至少一个额外的培养皿, 以便在提取代谢物的同时计算活细胞的数量, 从而进行代谢分析。此外, 在每一道菜中, 为复制的细胞和用于计数的盘子中播种的细胞数量也应相同;在未来, 这将有助于快速和无压力 (例如, 无色氨酸) 细胞计数协议, 允许相同的菜数与活细胞和提取代谢物。在清洗过程中, 应注意, 以免细胞脱离盘子表面。严重的细胞毒性试验和其他减少细胞粘附的实验可能不适合这种提取协议, 因为在清洗过程中细胞可能会丢失。
使用5% 甘露醇溶液作为从培养细胞中提取代谢物的洗涤缓冲液非常重要, 因为基于盐的缓冲液 (如 PBS) 会干扰代谢组学分析并对测量产生不利影响。
两到三个菜可以结合成一个单一的样本, 通过单独提取代谢物从每个菜品, 然后汇集样本;然而, 结合多个菜肴往往会增加提取的代谢物溶液中残留的甘露醇。这也可能干扰 CE-MS 的代谢组学分析, 因此, 建议不要使用多个盘子或水井作为单个样品。
利用 CE-MS 的代谢组学分析方法已经开发出来, 用于分子量在50至1000达之间的带电分子的综合测量;因此, 该协议针对水、低分子量化合物的提取进行了优化。因此, 该方案不适合提取疏水代谢物, 如脂类或大分子, 如蛋白质和核酸。由于对培养细胞样品进行全面脂质分析或脂质体组学的需求日益增加, 因此需要制定一种简单有效的方案, 同时提取亲水性和疏水性代谢物。
代谢物提取的第一步--吸入培养基和用甘露醇清洗细胞--应尽快进行, 以最大限度地减少细胞代谢状况的变化。用甘露醇洗涤后用甲醇处理细胞被认为是变性蛋白, 从而防止酶催化进一步的代谢反应。然而, 即使经过甲醇处理, 也可能发生非酶化学反应--如氧化还原反应、一些脱羧过程和硫醇连接。因此, 对本议定书所衡量的这些反应中涉及的任何代谢物浓度都应谨慎解释。与基因组或转录组不同的是, 代谢组由具有多种化学性质的分子组成;因此, 没有一个单一的协议可以提取所有代谢物而不造成任何损失或干扰。为了更准确地测量这种高反应代谢物, 应参考专门为提取某些代谢物群体而设计的协议, 该方案需要分馏和衍生。然而, 这里介绍的协议描述了一种简单而快速地从培养的细胞样品中提取水代谢物, 以便通过 CE-MS 进行代谢组学分析。在本文中, 我们无法详细描述如何建立 CE-MS, 因为目前手稿的重点不同, 但是, 描述建立 CE-MS 的详细步骤可能需要单独的专门文章。
披露声明
作者没有什么可透露的。
致谢
我们感谢索奈地区产业促进中心的所有成员的帮助。这项工作得到了山形县和鹤冈市研究基金、国家癌症中心研究和发展基金 [28-A-9号赠款] 和日本科学促进会 KAKENHI [赠款号码] 的部分支持。17K07189] 到 HM。
材料
| Name | Company | Catalog Number | Comments |
| Automated cell counter | Thermo Scientific | AMQAX1000 | Countess II automated cell counter |
| Automatic integration software | Agilent Technologies | MassHunter G3335-60041 | version B.02.00 |
| CE system | Agilent Technologies | Agilent 7100 CE system | |
| CE/MS adapter kit | Agilent Technologies | G1603A | |
| CE-ESI-MS Sprayer kit | Agilent Technologies | G1607A | |
| Cell counting chamber slide | Thermo Scientific | C10282 | Countess cell counting chamber slides |
| Centrifugal filter device, 5 kDa | Human Metabolome Technologies | ULTRAFREE MC PLHCC, UFC3LCCNB-HMT | |
| Conical sterile polypropylene tube, 15 ml | Thermo Scientific | N339651 | |
| Conical sterile polypropylene tube, 50 ml | Thermo Scientific | N339653 | |
| Costar stripette, 10 ml | Corning | 4488 | |
| Costar stripette, 5 ml | Corning | 4487 | |
| D(-)-Mannitol | Wako | 133-00845 | 500 g |
| Dulbecco's phosphate buffered saline (DPBS) | Sigma-Aldrich | D8537-500ML | |
| Electrophoresis buffer | Human Metabolome Technologies | H3301-1001 | for cation analysis |
| Electrophoresis buffer | Human Metabolome Technologies | H3302-1021 | for anion analysis |
| Fetal bovine serum | Biowest | S1780 | |
| Filter tip, 1000 μl | Watson | 124P-1000S | |
| Filter tip, 20 μl | Watson | 124P-20S | |
| Filter tip, 200 μl | Watson | 1252-703CS | |
| Fused silica capillary | Polymicro Technologies | TSP050375 | 50 μm i.d. × 80 cm total length |
| HCC827 | American Type Culture Collection | CRL-2868 | |
| Internal standard solution | Human Metabolome Technologies | H3304-1002 | |
| Isocratic pump | Agilent Technologies | Agilent 1100 Series Isocratic Pump | |
| Methanol | Wako | 138-14521 | 1 L, LC/MS grade |
| Microtube, 1.5 ml | Watson | 131-415C | |
| Operating Software | Agilent Technologies | ChemStation G2201AA | version B.03.01 for CE |
| PC-9 | RIKEN Bio Resource Center | RCB4455 | |
| RPMI-1640 | Sigma-Aldrich | R8758-500ML | |
| Sterile tissue culture dish, 100 mm | Corning | 430167 | |
| Time-of-flight mass spectrometer | Agilent Technologies | Agilent G1969A Time-of-Flight LC/MS | |
| Trypan blue solution, 0.4% | Thermo Scientific | T10282 | |
| Trypsin-EDTA solution | Sigma-Aldrich | T4049-100ML | |
| Ultrapure water | Merck | Milli-Q water | 18.2 MΩ·cm pure water |
| Volumetric flask, 50 ml | Iwaki | 5640FK50E | TE-32 |
参考文献
- Lunt, S. Y., Vander Heiden, M. G. Aerobic glycolysis: meeting the metabolic requirements of cell proliferation. Annual Review Cell and Developmental Biology. 27, 441-464 (2011).
- Soga, T. Cancer metabolism: key players in metabolic reprogramming. Cancer Science. 104 (3), 275-281 (2013).
- Zong, W. X., Rabinowitz, J. D., White, E. Mitochondria and Cancer. Molecular Cell. 61 (5), 667-676 (2016).
- Fukuda, H., et al. Experimental study for cancer diagnosis with positron-labeled fluorinated glucose analogs: [18F]-2-fluoro-2-deoxy-D-mannose: a new tracer for cancer detection. European Journal of Nuclear Meddicine and Molecular Imaging. 7 (7), 294-297 (1982).
- Miles, K. A., Williams, R. E. Warburg revisited: imaging tumour blood flow and metabolism. Cancer Imaging. 8, 81-86 (2008).
- Hanahan, D., Weinberg, R. A. Hallmarks of cancer: the next generation. Cell. 144 (5), 646-674 (2011).
- Levine, A. J., Puzio-Kuter, A. M. The control of the metabolic switch in cancers by oncogenes and tumor suppressor genes. Science. 330 (6009), 1340-1344 (2010).
- Makinoshima, H., et al. Epidermal growth factor receptor (EGFR) signaling regulates global metabolic pathways in EGFR-mutated lung adenocarcinoma. The Journal of Biological Chemistry. 289 (30), 20813-20823 (2014).
- Makinoshima, H., et al. Signaling through the Phosphatidylinositol 3-Kinase (PI3K)/Mammalian Target of Rapamycin (mTOR) Axis Is Responsible for Aerobic Glycolysis mediated by Glucose Transporter in Epidermal Growth Factor Receptor (EGFR)-mutated Lung Adenocarcinoma. The Journal of Biological Chemistry. 290 (28), 17495-17504 (2015).
- Makinoshima, H., et al. Metabolic Determinants of Sensitivity to Phosphatidylinositol 3-Kinase Pathway Inhibitor in Small-Cell Lung Carcinoma. Cancer Research. 78 (9), 2179-2190 (2018).
- Sato, Y., et al. Metabolic Characterization of Antifolate Responsiveness and Non-responsiveness in Malignant Pleural Mesothelioma Cells. Frontiers in Pharmacology. 9, 1129 (2018).
- Ohashi, Y., et al. Depiction of metabolome changes in histidine-starved Escherichia coli by CE-TOFMS. Molecular BioSystems. 4 (2), 135-147 (2008).
- Ooga, T., et al. Metabolomic anatomy of an animal model revealing homeostatic imbalances in dyslipidaemia. Molecular BioSystems. 7 (4), 1217-1223 (2011).
- Sugimoto, M., Wong, D. T., Hirayama, A., Soga, T., Tomita, M. Capillary electrophoresis mass spectrometry-based saliva metabolomics identified oral, breast and pancreatic cancer-specific profiles. Metabolomics. 6 (1), 78-95 (2010).
- Patra, K. C., Hay, N. The pentose phosphate pathway and cancer. Trends in Biochemical Sciences. 39 (8), 347-354 (2014).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。