Method Article
人类干细胞衍生的伊拉尔肠细胞单层中M细胞样细胞的诱导分化
摘要
该协议描述了如何诱导M细胞在人类干细胞衍生的卵单层中的分化,以及评估其发育的方法。
摘要
肠道的M(微折叠)细胞功能将抗原从锥形流明输送到免疫细胞所在的底层的佩耶的贴片和拉米纳普里亚,从而促进肠道的粘膜免疫。缺乏对M细胞在肠道中如何分化以及M细胞吸收抗原的分子机制的全面了解。这是因为M细胞是肠道中罕见的细胞群,并且因为M细胞的体外模型不健壮。肠道自更新干细胞培养系统的发现,称为肠细胞,为培养M细胞提供了新的可能。肠类比标准培养细胞系更有利,因为它们可以分化成肠道中几种主要细胞类型,包括卵泡细胞、Panth细胞、肠内分泌细胞和肠细胞。细胞因子RANKL在M细胞发育中至关重要,在培养基中加入RANKL和TNF-α可促进从肠细胞中分化成M细胞的细胞子集。以下协议描述了使用人肠体在肠道的转井上皮偏振单层系统中分化M细胞的方法。该方法可用于M细胞发育和功能的研究。
引言
M(微折叠)细胞是特殊的肠道上皮细胞,主要存在于肠道的卵泡相关上皮(FAE)上覆,覆盖小淋巴区域,称为Peyer的斑块1。M细胞有短不规则的杏状微维利,并深深插入其巴索侧侧,这使得免疫细胞密切驻留在他们的细胞体2。这种独特的形态使M细胞能够从肠道的表红血亚中取样抗原,并将其直接输送到底层免疫细胞2。这样,M细胞对肠道的免疫监测很重要,但病原体也可以利用它们进入拉米纳丙菌1、2、3、4、5, 6,7.
M细胞的研究受到多种因素的阻碍。首先,M细胞在小鼠和人类肠道8的低频处被发现。在培养细胞系统中,通过共同培养极化腺癌细胞系Caco-2,通过小鼠Peyer的补丁或B细胞淋巴瘤细胞系的B淋巴细胞诱导到分化,Raji B9,10.这导致在极化上皮9,10中表达M细胞标记的SialylLewisA抗原和UEA-1的Caco-2细胞的子集。(这些标记也表达在肠道组织的果子细胞上,所以现在不太常用作为明确的M细胞标记11,12。这种Caco-2-M细胞系统已用于研究颗粒摄取和细菌易位13,14。然而,Caco-2细胞是来自大肠腺癌的已建立的细胞系,其混杂因子是Caco-2细胞的不同来源在实验室15中表现出不同的表型。此外,它们可能无法完全重述真实M细胞的转录水平,因为它们缺乏目前已知的M细胞标记GP2和SpiB16的表达。因此,需要额外的和更生理相关的培养模型,以便能够研究M细胞的发育和功能。
近十年来,肠内衍生模型系统领域从初步发现从人类肠道活检中提取的肠道干细胞可以在培养中自我繁殖和自我更新,迅速向前推进。17,18.重要的是,从生长培养基中去除干细胞促进因子,使这些干细胞培养物能够分化成肠道18中的多种细胞类型。此外,最近的研究表明,RANKL-RANK信号在肠道19、20的M细胞发育中的重要性。RANK受体是TNF受体家族的成员,在肠道19的上皮前体细胞上表达,而RANKL(RANK受体配体)由Peyer斑块20的基质细胞释放。由于在肠小体中存在的上皮细胞类型不产生RANKL,在回肠培养中M细胞分化可以通过将RANKL添加到培养基21、22诱导。将TNF®纳入培养基有助于支持肠细胞23的M细胞发育。在这里,我们描述了诱导从人类肠细胞中提取的肠道单层中的M细胞分化的方法。我们的方法部分基于以下协议21、22、23的修改。
研究方案
此处描述的所有方法均已获得塔夫茨大学 IBC 和 IRB 的批准。
1. 诱导M细胞分化在人类肠道衍生单层
注:该协议使用从人体组织活检中提取的肠状体。请参阅已公布的协议,了解如何生长和传递这些细胞18,24。以下单层开发方法改编自Zou等人24。诱导M细胞在肠衍生培养物中诱导的方法从以前的报告21、22、23改编而成。所有工作都在无菌组织培养罩中进行,孵化在罩或组织培养箱中,如所示。参见制备肠状单层和各种介质所需的材料表。
- 在细胞外基质(ECM)中生长4-10天(参见材料表)(图1),取决于其内在生长速率,然后再播种到透水井上。
- 涂层跨井膜
- 将所需数量的跨孔放入 24 孔板中,形成双腔系统。
- 在冷无菌磷酸盐缓冲盐水 (PBS) 中稀释 ECM 25 倍,并将 100 μL 的冷稀释溶液添加到膜上的每个上腔。
注:ECM 和稀释的 ECM 溶液必须保持在冰上,直到添加前立即。 - 用盖子盖住24孔板,将板放入37°C的组织培养箱中2小时,使ECM在膜上凝固。
- 2小时后,从培养箱中取出板,放入组织培养罩中。使用无菌钳子,反转每个转井,轻轻去除剩余的溶液。在收集细胞时,让膜在盖打开的情况下在引擎盖中通风(步骤 1.3.1- 1.3.11)。
- 将肠子分离到单个细胞中
- 从培养箱中取出肠子板,通过真空吸气或移液器从每个孔中轻轻去除培养膜。
注:一口含有大约100个健康囊肿的肠球菌井就足以成为1.5-2口井的种子。 - 在每个井中加入 500 μL 的冰冷 0.5 mM 乙烯二甲酸 (EDTA),每口井中含有悬浮在 ECM 中的肠子,以分解 ECM。使用 P1000 移液器在 500 μL 处大力上下移液,以分解 ECM,从而将回肠细胞释放到溶液中。为了改善ECM的溶解,移液后,在4°C下用力摇动板30分钟。
- 将溶液从每个孔收集到15 mL锥形管中。
注:每 15 mL 锥形管收集多达 10 口孔,以获得最佳的单细胞收集。 - 在140 x g和4°C的离心机中将细胞颗粒5分钟。
注:如果担心颗粒和细胞的丢失,请使用移液器,并将上清液保存在单独的管中。 - 为了消化紧密的结连结,将肠子分解成单个细胞,在步骤1.3.3中每5口井中每5口井中重新悬浮500μL室温胰蛋白酶。使用 P1000,上下移液器将管块分解,并在 37°C 水浴中孵育管 5 分钟或更少。
注:需要优化以确定孵育管所需的适当时间,以便细胞被分解,而不是过度试穿到它们死亡时。在步骤 1.3.9 中使用胰蛋白酶蓝色,以确保胰蛋白酶治疗后细胞是可存活的。 - 每500μL的胰蛋白酶加入1mL的高级DMEM/F12,每500μL的10%胎儿牛血清(FBS)使胰蛋白酶灭活。
- 将P1000设置为500μL,至少50次,在锥形管的侧面上下移液,以进一步将剩余的团块分解为单个细胞。
- 将 40 μm 细胞滤网置于 50 mL 锥形上,并添加 1 mL 的高级 DMEM/F12,并加入 10% FBS 来润湿细胞滤网。将单细胞悬浮液从 15 mL 锥形移到滤网上。使用 10% FBS 清洗 1 mL 高级 DMEM/F12 的滤网。
- 将穿过细胞滤网的细胞从50 mL锥形转移到新的15 mL锥形管中。在离心步骤 1.3.10 期间,细胞颗粒在 15 mL 锥形管中更容易看到。使用血细胞计对细胞进行计数。使用 Trypan 蓝色验证单元格是否还活着。通常,观察到 >95% 的生存能力。
- 在计算细胞时,在400 x g和室温下,将新15 mL管中的细胞离心5分钟。用移液器小心地去除上清液,再次保存上清液,以防颗粒脱落。
- 准备经过修改的完整生长介质25 (MCMGF® 介质) 辅以 10 μM Y-27632。在MCMGF+中,在2.5 x 105细胞/200μL处重新悬浮颗粒细胞。请参阅有关优化细胞种子编号的讨论说明。
注:MCMGF® 介质是高级 DMEM/F12,具有 75% L-Wnt3a 调节介质, 10% R-spondin 调节介质, 5% Noggin 调节介质, 1x B27 补充剂, 1x N2 补充剂, 1 mM N-乙酰半胱氨酸, 50 ng/mL 小鼠重组 EGF, 500 nM A-8301, 10 nM [Leu15]-Gastrin I,10 mM HEPES、2 mM 谷氨酸MAX 和 1x 青霉素/链霉素(可选)。 - 确保步骤 1.2 中制备的 ECM 涂层膜已完全干燥,经眼部评估。用 200 μL 的 MCMGF® 清洗上腔。在每个上腔室中加入200μL的细胞溶液。
- 在每个下腔室中加入700μL的MCMGF+,每个腔室10μM Y-27632。将板放入37°C组织培养箱中,CO2为5%。
- 生长1天后,从上腔室中取出介质,用200μL的新鲜MCMGF®替换,以防止多个细胞层的生长。
- 从培养箱中取出肠子板,通过真空吸气或移液器从每个孔中轻轻去除培养膜。
- 更换介质
- 一旦单层体达到 +80% 的康成,通常在播种后 1-3 天之间,用分化介质 (DM) 替换巴索侧介质以控制井(有关更多详细信息,请参阅步骤 1.4.2)或 M 细胞介质(有关更多详细信息,请参阅步骤 1.4.3)。在这两种情况下,用 DM 替换上腔室中的介质。
注:DM 是高级 DMEM/F12,具有 5% 诺金调节介质, 1x B27 补充剂, 1x N2 补充剂, 1 mM N-乙酰半胱氨酸, 50 ng/mL 小鼠重组 EGF, 500 nM A-8301, 10 nM [Leu15] - Gastrin I, 10 mM HEPES 缓冲液, 2 m M GlutaMAX, 和 1x Penicillin/链霉素 (可选).M细胞介质由200纳克/mL RANKL和50纳克/mL TNF+补充。 - 对于不应包含 M 细胞的控制井,向上腔室添加 200 μL DM,向底部腔室添加 700 μL DM。
- 要诱导M细胞,将200μLDM添加到上腔室,将700μL的M细胞介质添加到底部腔室。
- 每 2 天更换一次介质。对于控制井,在上腔和下腔更换 DM。对于 M 单元孔,在上腔室中更换 DM,在下腔室中更换 M 单元介质。
注:到第7天后细胞播种,M细胞完全诱导在单层。
- 一旦单层体达到 +80% 的康成,通常在播种后 1-3 天之间,用分化介质 (DM) 替换巴索侧介质以控制井(有关更多详细信息,请参阅步骤 1.4.2)或 M 细胞介质(有关更多详细信息,请参阅步骤 1.4.3)。在这两种情况下,用 DM 替换上腔室中的介质。
2. 通过qRT-PCR验证M细胞分化
注:在无菌无RNAe工作台空间执行以下工作。有关 qRT-PCR 的首选材料列表,请参阅材料表。
- 从上腔和底部腔室中取出介质,用 300 μL 室温 PBS 轻轻清洗上腔室 2 倍。
- 在每个上腔室中加入 300 μL 的三佐尔。在室温下孵育5分钟。
注意:使用 Trizol 时,请戴上手套和护目以,避免接触制造商说明中所示的皮肤。 - 同时,为每个井标出微离心管,并在每口管中加入700μL的Trizol。
- 用P1000轻轻上下移液3x,收集细胞均质,并将内容物转移到相应的微离心管中。涡旋5s混合。
- 将样品保存在室温下3分钟。然后在-80°C下储存一个月。
- 遵循标准qRT-PCR方法进行RNA分离、DNase治疗、逆转录和qRT-PCR反应。请参阅材料表中的引物列表。
3. 通过免疫荧光验证M细胞分化
注:始终保持板的下室充满 PBS,使膜保持湿润。此过程在工作台上执行。有关免疫荧光的首选材料列表,请参阅材料表。
- 从上室取下介质,用 300 μL 室温 PBS 轻轻清洗 2 次。在PBS中加入100μL室温4%PFA到上室室。用铝箔盖住板,在室温下站立 25 分钟。去除 4% PFA。
注意:4% PFA 应作为危险化学品废物正确处置。 - 用300μL室温PBS清洗上室3倍。此时,样品在染色前可保持在 4°C 下长达一个月。一旦染色,样品应在一周内可视化,以获得最佳质量的图像。
- 用100μL的5%牛血清白蛋白(BSA)孵育在室温下在PBS中溶解30分钟,以阻止单层。
- 在PBS中制备1%BSA的GP2原抗体溶液,稀释1:100。每口加100 μL。在黑暗中室温下染色1小时。删除解决方案。
注:在GP2发生原发性染色之前不要渗透单层,因为M细胞的最佳原发性GP2表面染色无需渗透即可实现。 - 用300μL室温PBS清洗上室3次。
- 在 1:200 时制备荧光标记山羊抗小鼠 IgG 的二次染色溶液,在 1:100 时制备 phalloidin,在 PBS 中制备 1% BSA+ 0.1% 三吨中的 DAPI。每口加100 μL。在黑暗中室温下染色30分钟。
注:Triton 被添加到二次染色溶液中,以渗透这一步骤中的细胞,以进行适当的 phalloidin 染色。 - 用 300 μL PBS 洗涤 3 次。
- 将 5 μL 的安装溶液 (材料表) 放在玻璃滑块上。从 24 孔板中取出井并反转。使用手术刀小心地从井中切割膜。将电池朝上放在玻璃滑轨上安装溶液的液滴上。将 10 μL 的安装溶液添加到膜的顶部和中心,并在顶部放置一个盖玻片,以密封玻璃滑片和盖玻片之间的膜。
- 在黑暗中将幻灯片在室温下干燥 24 小时。染色的幻灯片应在染色后 1 周内在共聚焦显微镜上可视化。
结果
ECM 中生长的回肠体通过 qRT-PCR 进行视觉分析,分析其相对健康状况和分化状态,作为对回肠培养物进行质量控制和单层使用的质量控制手段。在ECM中生长的未分化的肠细胞在形态上显得清晰和囊性,表明存在许多干细胞(图1A)。随着时间的推移,生长在生长介质中生长的未分化的肠子可能采用中间表型,其中一些会出现囊性,有些则显得不透明(图1B)。通常,我们的未区分样本类似于图 1B所示的样本,而不是图 1A所示的样本。这些中间培养物包含更具有最终分化的肠细胞,通过肠细胞标记的表达、苏克拉塞等麦芽酶(SI)的表达来衡量,并且大概在流明中挤出的死肠细胞有助于其密集的外观。回肠细胞可用于单层发育的这种中间状态,但必须记住,培养物中存在的肠道干细胞数量可能较低,并且可能存在一些分化的细胞类型(例如,参见 qRT-PCRECM中生长的未分化样品中的水平,如图2所示图1B。为进行比较,在ECM中用分化培养基培养的肠子在ECM中培养5天以上,将均匀地变暗和球状,这种形态的培养物不是播种单层的良好候选物(图1C)。
qRT-PCR可以分析干细胞基因和肠道细胞分化基因的表达,作为评估ECM中生长的肠子的健康状况的另一种方法,以及一旦在转孔上作为单层播种,其分化能力。干细胞基因LGR5、肠细胞基因、SI、卵泡细胞基因、MUC2和Paneth细胞基因LYZ的表达,在ECM中生长的未分化的肠细胞培养物和分化的肠细胞培养物之间进行了比较在存在或不存在 RANKL/TNF+的情况下的肠状单层 (图 2)。虽然实验之间的值可能不同,但单层18、26的分化后,LGR5的表达应会减少。 LGR5表达通常不在第7天没有RANKL和TNF®的分化的回肠单层中检测到。相反,特定细胞类型的分化标记的表达,如SI和MUC2,在分化18之后增加。LYZ的表达在分化我们的文化中通常会减少。如果用于使单层的肠状培养物看起来更像图 1B而不是图 1A,则在分化后肠道分化标记的增加可能不大,因为这些初始培养物在肠道细胞类型,具有较高的基础水平的SI和MUC2。然而,单层分化仍然发生LGR5表达和显微镜损失(见下文)。此外,将RANKL和TNF®添加到微分介质中可减少LGR5表达的损耗(图2)。同时,SI和MUC2的表达略低于缺乏RANKL和TNF+的差别化条件,尽管它们的含量高于未分化条件。
单层中的M细胞分化由qRT-PCR和免疫荧光两个M细胞特异性标记确定,包括细胞表面糖蛋白2(GP2)和转录因子SpiB21。GP2和SPIB的表达在存在RANKL和TNF®的情况下在肠衍生单层中得到调节,在非RANKL和TNF®处理样品中未检测到(图3)。这些标记的表达也可以归一化为一块小肠组织22,如果有的话。这允许将这些M细胞标记的折叠变化与具有M细胞的组织进行比较,而不是控制没有这些标记表达的单层,并允许在一个实验室的实验之间进行标准化。M细胞也通过免疫荧光检测GP2的表面表达(图4)。通常,在交波单层中,在用RANKL和TNF®处理的样品中,在40倍放大的给定显微镜场中观察到1至5M细胞,第6天至8天,在使用RANKL和TNF®处理的样品中进行播种(图4A-D)。未经处理的样本中未发现GP2表达式(图4E)。XZ平面的正交视图覆盖在一个方体素探头显示围绕每个细胞的活性球结构和GP2表达在M细胞的表层(图4F-G)。该模型概括了在人类肠道1、2、8中发现的低频M细胞。为了纯化和分离M细胞供进一步研究,M细胞可以使用GP2表面表达染色,并使用FACS对GP2+细胞进行分类。
M细胞结合并传输抗原从肠道流明到免疫细胞驻留在上皮2。肠道中产生的分泌IgA与细菌结合,可结合M细胞的表层,以方便微生物27、28的转运。为了确定该模型中开发的M细胞是否能够与IgA结合,将人血清IgA添加到上腔,允许结合1小时,然后为免疫荧光分析制备单层。使用氟结合的二级抗体识别人血清IgA的重链,对M细胞上IgA的存在进行可视化。使用IgA处理1h的M细胞与表层结合的M细胞(图5A),而仅用IgA的次级抗体处理的控制井中的M细胞没有可检测信号(图5B)。此外,IgA特别结合M细胞的表层,并且未发现与缺乏GP2表面染色的任何细胞结合。此外,M细胞在其表层2上具有更短的致密活性球。为了分析本模型中的M细胞形态,将肠类衍生单层生长7天,并收获,用于使用phalloidin对F-actin进行免疫荧光分析。使用 ImageJ 软件计算 M 单元和非 M 单元的 actin 像素强度测量(图 6A)。此模型中的GP2+M单元的活性强度降低,图6B显示了一个代表性的图像。总体而言,在这种肠衍生单层模型中发育的M细胞具有特征基因表达、形态和人肠道M细胞的一些M细胞功能,如与IgA结合。
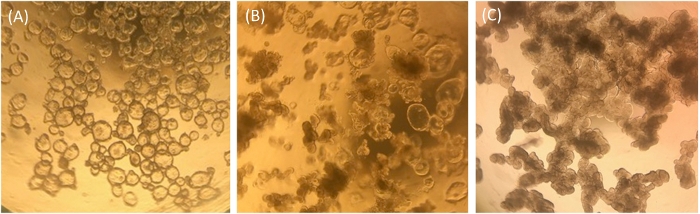
图1:在ECM分裂后一周中,人类肠细胞的代表性形态。(A) 清除和囊性无差别的肠细胞。(B) 中间表型与一些囊性肠子和一些不透明的球状肠。(C) 变暗和球状分化的肠子。使用 iPhone7 相机以 4 倍放大倍率通过光学光学显微镜镜头拍摄的图像。请点击此处查看此图的较大版本。
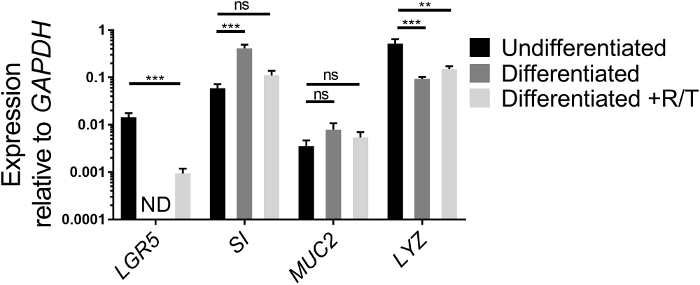
图2:在ECM中生长或分化为单层的人类肠细胞和分化标记的相对表达。在 ECM 中,肠子生长 7 天(无差别),或作为无(分化)或 RANKL 和 TNF®(差异化 +R/T)的单层生长和分化。在Trizol中收获了用于RNA提取的肠状体培养物或单层。基因表达由qRT-PCR测定,并相对于GAPDH表达。数据是平均3个独立的井的肠状物或单层每个条件。错误条指示未检测到 SEM. ND。使用单向 ANOVA 与 Dunnett 的多重比较测试与未区分值进行比较,在对数转换值上确定统计显著性。* p < 0.01, = p < 0.001请点击这里查看此图的较大版本。
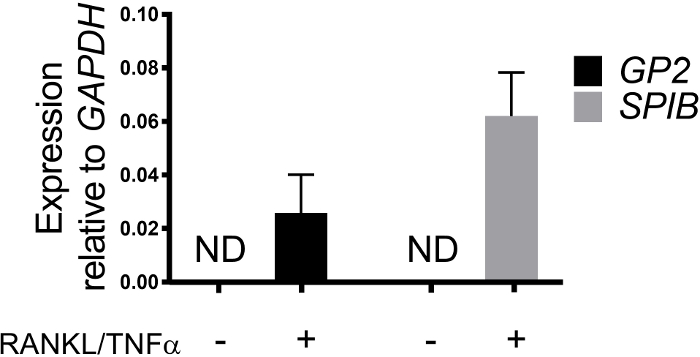
图3:M细胞特定标记GP2和SPIB相对表达来自人类肠衍生的单层。RANKL/TNF® 经过处理和未经处理的人类肠衍生单层在Trizol中收获,在播种后7天提取RNA。基因表达由qRT-PCR测定,并相对于GAPDH表达。数据是每个条件的平均 6 独立单层。错误条指示未检测到 SEM. ND。请点击此处查看此图的较大版本。
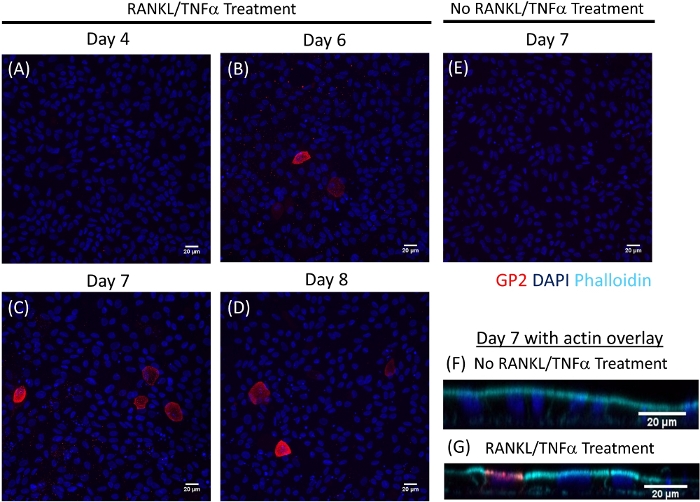
图4:随着时间的推移,人类肠衍生单层中M细胞表面GP2表达的免疫荧光。RANKL/TNF®处理和未经处理的人类肠衍生单层固定在4%PFA中,并在播种后的各种指定日期染色为免疫荧光。使用 ImageJ 软件对图像进行分析。DAPI = 蓝色;糖蛋白 2 (GP2) = 红色。(A-D)RANKL/TNF® 在播种后不同天对单层进行处理。(E) 播种后第7天收获的未经处理的单层。(F-G)单层的正交XZ平面在第7天播种后覆盖与phalloidin探头F-actin。法洛丁 = 青色。请点击此处查看此图的较大版本。
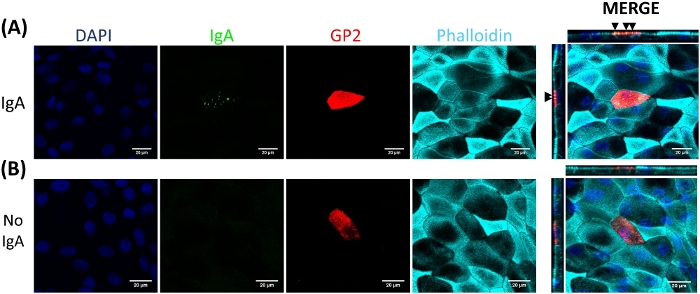
图5:IgA与M细胞的表层特别结合。RANKL/TNF®处理的人类肠衍生单层生长7天,然后(A)用10μg的人类血清IgA处理1小时或(B)仅用PBS(无IgA对照)进行模拟处理。1小时后,单层在PBS中洗涤2次,固定在4%PFA中,渗透0.1%TritonX-100,并染色为免疫荧光。使用ImageJ软件对图像进行了分析,并代表3个独立实验。DAPI = 蓝色;糖蛋白 2 (GP2) = 红色;人血清抗体 IgA = 绿色;法洛丁 = 青色。黑色箭头表示与 M 细胞的表层绑定的 IgA。请点击此处查看此图的较大版本。
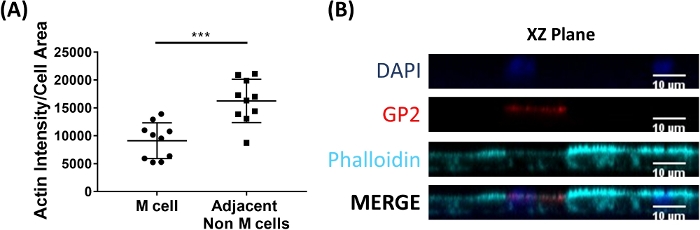
图6:与相邻的非M细胞相比,M细胞的活性强度降低。RANKL/TNF®处理的人类肠衍生单层生长7天,然后固定在4%PFA中,并染色进行免疫荧光。(A) 使用 ImageJ,使用手绘工具概述了 GP2+ M 细胞,并在 Phalloidin 通道中测量了面积和综合密度。然后,对与 M 单元格相邻的每个相邻非 M 单元格完成相同的分析。原始集成密度除以每个单个单元的面积进行规范化。为每个 M 单元的每个相邻非 M 单元计算了平均综合密度/面积。通过3个独立实验对图像进行了分析;每个点是一个M细胞或相邻单元格的平均值。误差条表示 SD。 统计显著性是使用配对 t 测试在日志转换值上确定的。p = 0.0001 (B) A. 图像中来自图的 XZ 平面的代表性图像使用 ImageJ 软件进行分析。DAPI = 蓝色;糖蛋白 2 (GP2) = 红色;法洛丁 = 青色。请点击此处查看此图的较大版本。
讨论
要开发能够正确分化成主要肠道细胞类型和M细胞的单层细胞,必须注意几个因素。回肠细胞必须从未分化的ECM培养物中采集,并且具有高比例的Lgr5+干细胞。从视觉上看,ECM培养物中的大多数回肠体不应变暗和多叶,LGR5表达应通过qRT-PCR分析在这些培养物中检测到。 条件介质的质量控制对于随时间传播未分化的培养物至关重要,必须针对生产的每一批有条件介质完成。通过在一些ECM培养物上测试一批新的介质,并在一周内将肠子的形态与前一批介质进行比较,即可完成质量控制。LGR5表达在新一批介质中生长的肠子培养物中应与前一批相对相似。
在制备用于单层播种的肠子时,使用胰蛋白酶孵育后大力移液细胞溶液,将肠子分解成单个细胞。因此,将肠子作为单层体进行播种非常重要。当为单层播种时,细胞团块可能导致多层形成。此外,有必要从经验上确定为获得的每个独立肠状线形成单层所需的细胞数量。通常,此值的范围可以从 2.5 x 105 + 5.0 x 105 5 细胞/井,但取决于囊肿的程度到非囊性肠细胞在培养中,并因每个单独的回肠细胞线而异。根据经验,在ECM中生长的肠子,看起来较少囊化,需要更高的细胞播种密度,以实现单层。建议在生长1天后清洗上腔,轻轻移液介质上下2-3次,并用新的生长介质替换。这个过程使已经降落在其他细胞之上的细胞脱落,从而减少多层形成的可能性。当单层为 ±80% 的汇合时,将上腔室中的介质从生长介质切换到 M 细胞介质,这通常发生在播种后的第 2 天,有助于实现良好的 M 细胞分化。在M细胞诱导期间向上腔室添加RANKL/TNF®不会导致每个单层产生更多数量的M细胞,因此可以被排除在上腔介质之外。不同孔径的转孔可用于本协议,而不影响M细胞发育;然而,细胞播种密度必须针对孔径较大的孔径进行优化。胶原蛋白IV可以替代ECM作为底膜蛋白涂层的跨井或井板,可能更适合某些应用。
在透水井上,肠体衍生的单层提供一个双腔系统,允许创建定义的表状和双侧表面,使4-5种不同类型的上皮肠道细胞可以极化,以表达每个表面标记相对于在肠道中发现的。可以向任何一侧添加其他因素,如颗粒、传染性病原体或其他细胞类型。然而,迄今为止仍然存在一些限制。如上所述,该系统是一个静态系统,缺乏生理流动、肠道收缩和肠道内容。此外,由于平面单层的形成,隐晦建筑也丢失了。这些系统缺乏Peyer的贴片区域、免疫细胞和基质细胞。M细胞下面缺乏免疫细胞和基质细胞是否影响本系统未观察到的阴道和其他生理功能,是未来一个重要的研究领域。该协议可适用于 96 孔板或多孔板格式。用ECM涂覆96孔板和用单细胞从回肠体中播种的过程与跨孔相同。获得单层所需的细胞播种密度的滴定必须完成,但通常范围为 1.0 x 105 × 3.0 x 105细胞/孔在 96 孔板格式。M细胞诱导时,单层是80%的汇合,通常由第1-3天根据初始细胞播种密度替换M细胞培养基。
这种将M细胞与体外肠状体区分的方法比Caco-2方法有显著的改进。回肠细胞是原细胞,系统中至少存在4-5个上皮细胞类型。此外,还可以研究从不同人中提取的肠状体,以研究遗传或疾病状态如何影响M细胞发育和行为。在M细胞分化期间对回肠细胞进行额外的操作,将使人们更好地了解M细胞的发展,包括特征化M细胞前体细胞。最后,由于M细胞噬菌体和转细胞化的分子机制尚未完全了解3,29,该模型提供了研究和可视化M细胞抗原和颗粒接受的机会。
披露声明
作者没有什么可透露的。
致谢
这项工作得到了NIAID U19AI131126对伊斯伯格博士(塔夫茨大学医学院)和卡普兰博士(塔夫茨大学)的支持;(JM 是项目 2 的领导者)和 NIAID R21AI128093 到 JM。NIAID T32AI007077 部分支持 ACF。SEB 和 MKE 由 NIAID U19AI116497-05 提供支持。我们感谢Mecsas实验室、Ng实验室和塔夫茨大学医学院的伊斯伯格博士进行了有益的讨论。共聚焦成像在塔夫茨神经科学研究中心进行,P30 NS047243。
材料
| Name | Company | Catalog Number | Comments |
| [Leu15]-Gastrin I | Sigma-Aldrich | G9145 | MCMGF+ and DM ingredient Solvent: PBS Stock Concentration: 10 µM Final Concentration: 10 nM |
| 0.5 M EDTA | Invitrogen | 15575020 | For breaking up ECM Solvent: PBS Stock Concentration: 0.5 M Final Concentration: 0.5 mM |
| 40 µm cell strainer | Corning | 352340 | For excluding clumps from single cells Solvent: Stock Concentration: Final Concentration: |
| A-8301 | Sigma-Aldrich | SML0788-5MG | MCMGF+ and DM ingredient Solvent: DMSO Stock Concentration: 500 µM Final Concentration: 500 nM |
| Advanced DMEM/F12 | Invitrogen | 12634-028 | MCMGF+ and DM Basal medium Solvent: Stock Concentration: Final Concentration: |
| Alexa Fluor 594 goat anti-mouse IgG | Thermo Fisher | A-11005 | For secondary stain Solvent: Stock Concentration: Final Concentration: 1:200 |
| Alexa Fluor 647 Phalloidin | Invitrogen | A22287 | Optional secondary stain for F-actin Solvent: Stock Concentration: Final Concentration: 1:100 |
| B27 Supplement | Invitrogen | 17504-044 | MCMGF+ and DM ingredient Solvent: Stock Concentration: 50x Final Concentration: 1x |
| Bovine Serum Albumin | Chem-Impex | 00535 | 5% for blocking solution Solvent: PBS Stock Concentration: Final Concentration: 0.01 |
| Chloroform | Fisher Scientific | C298-500 | For RNA isolation Solvent: Stock Concentration: Final Concentration: |
| Circle coverslips | Thomas Scientific | 1157B50 | For mounting membrane on glass slide Solvent: Stock Concentration: Final Concentration: |
| DAPI (4′,6-diamidino-2-phenylindole) | Thermo Fisher | 62247 | For secondary stain Solvent: PBS Stock Concentration: 100x Final Concentration: 1x |
| DEPC Treated RNAse free H2O | Fisher Scientific | BP561-1 | For RNA isolation Solvent: Stock Concentration: Final Concentration: |
| DNA Removal Kit | Invitrogen | AM1906 | For RNA isolation Solvent: Stock Concentration: Final Concentration: |
| Ethyl Alcohol, 200 proof | Sigma Aldrich | EX0276-4 | For RNA isolation Solvent: Stock Concentration: Final Concentration: |
| Feather Scalpels | VWR | 100499-580 | For cutting membrane from transwells Solvent: Stock Concentration: Final Concentration: |
| Fetal Bovine Serum (FBS) | Gibco | 26140079 | For inactivating trypsin Solvent: Advanced DMEM/F12 Stock Concentration: 1 Final Concentration: 0.1 |
| Glass slides | Mercedes Scientific | MER 7200/90/WH | For mounting membrane on glass slide Solvent: Stock Concentration: Final Concentration: |
| GlutaMAX | Invitrogen | 35050-061 | MCMGF+ and DM ingredient Solvent: Stock Concentration: 200 mM Final Concentration: 2 mM |
| GP2 Antibody | MBL International | D277-3 | Surface stain for M cells Solvent: Stock Concentration: Final Concentration: 1:100 |
| HEPES | Invitrogen | 15630-080 | MCMGF+ and DM ingredient Solvent: Stock Concentration: 1 M Final Concentration: 10 mM |
| Human Serum IgA | Lee BioSolutions | 340-12-1 | For functional analysis of M cells Solvent: PBS Stock Concentration: 1 mg/mL Final Concentration: 10 µg |
| L-Wnt3a conditioned media | Cell line from ATCC | CRL-2647 | Refer to ATCC Product Sheet for L Wnt3A (ATCC CRL2647) for conditioned media protocol; MCMGF+ ingredient Solvent: Stock Concentration: Final Concentration: 75% in MCMGF+ 0% in DM |
| Matrigel, GFR, phenol free | Corning | 356231 | Extracellular Matrix (ECM) Solvent: Stock Concentration: Final Concentration: |
| Mouse recombinant EGF | Invitrogen | PMG8043 | MCMGF+ and DM ingredient Solvent: PBS Stock Concentration: 50 µg/mL Final Concentration: 50 ng/mL |
| N2 Supplement | Invitrogen | 17502-048 | MCMGF+ and DM ingredient Solvent: Stock Concentration: 100x Final Concentration: 1x |
| N-acetylcysteine | Sigma-Aldrich | A9165-5G | MCMGF+ and DM ingredient Solvent: H2O Stock Concentration: 500 mM Final Concentration: 1 mM |
| Noggin conditioned media | Cell line gift from Dr. Gijs van den Brink (University of Amsterdam) | Ref 30 for conditioned media protocol; MCMGF+ and DM Ingredient Solvent: Stock Concentration: Final Concentration: 5% in MCMGF+ 5% in DM | |
| Paraformaldehyde (PFA) | MP Biomedicals | 2199983 | For fixing monolayers Solvent: PBS Stock Concentration: 0.16 Final Concentration: 0.04 |
| PBS, -Mg, -Ca | Corning | MT21040CV | Solvent for 0.5 mM EDTA Solvent: Stock Concentration: Final Concentration: |
| Penicillin/Streptomycin | Invitrogen | 15140-122 | Optional ingredient of MCMGF+ and DM Solvent: Stock Concentration: 100x Final Concentration: 1x |
| Prolong Gold | Invitrogen | P36930 | Antifade mounting solution Solvent: Stock Concentration: Final Concentration: |
| Qiagen RNeasy Kit | Qiagen | 74106 | For RNA isolation Solvent: Stock Concentration: Final Concentration: |
| Recombinant human RANKL | Peprotech | 310-01 | Used to induce M cells Solvent: H2O Stock Concentration: 0.1 mg/mL Final Concentration: 200 ng/mL |
| Recombinant murine TNFa | Peprotech | 315-01A | Used to induce M cells Solvent: H2O Stock Concentration: 5 mg/mL Final Concentration: 50 ng/mL |
| R-spondin conditioned media | Cell line from Trevigen | 3710-001-01 | Refer to Trevigen Cultrex Rspo1 Cells product manual (HA-R-Spondin1 293T cell line) for conditioned media protocol; MCMGF+ Ingredient Solvent: Stock Concentration: Final Concentration: 10% in MCMGF+ 0% in DM |
| Secondary anti-human IgA antibody | Jackson Immuno Research | 109-545-011 | For secondary stain Solvent: Stock Concentration: Final Concentration: 1:200 |
| Super Script IV Reverse Transcriptase | Thermo Fisher | 18091200 | For conversion of RNA to DNA Solvent: Stock Concentration: Final Concentration: |
| Transwell inserts, 24 well-sized | Greiner Bio-One | 662641 | 0.4 µm pore size Solvent: Stock Concentration: Final Concentration: |
| TritonX-100 | Sigma-Aldrich | T8787 | Not required during GP2 primary stain Solvent: 1% BSA Stock Concentration: Final Concentration: 0.001 |
| TRIzol | Invitrogen | 15596018 | For RNA isolation Solvent: Stock Concentration: Final Concentration: |
| TrypLE Express | Invitrogen | 12605010 | Trypsin for breaking up enteroids into single cells Solvent: Stock Concentration: Final Concentration: |
| Y-27632 | Sigma-Aldrich | Y-0503 | MCMGF+ ingredient on day 0 Solvent: H2O Stock Concentration: 5 mM Final Concentration: 10 µM |
| GAPDH forward primer | CATGAGAAGTATGACAACAGCCT | ||
| GAPDH reverse primer | AGTCCTTCCACGATACCAAAGT | ||
| GP2 forward primer | CAATGTGCCTACCCACTGGA | ||
| GP2 reverse primer | ATGGCACCCACATACAGCAC | ||
| LYZ forward primer | CGCTACTGGTGTAATGATGG | ||
| LYZ reverse primer | TTTGCACAAGCTACAGCATC | ||
| MUC2 forward primer | ATGCCCTTGCGTCCATAACA | ||
| MUC2 reverse primer | AGGAGCAGTGTCCGTCAAAG | ||
| SI forward primer | TCCAGCTACTACTCGTGTGAC | ||
| SI reverse primer | CCCTCTGTTGGGAATTGTTCTG | ||
| SPIB forward primer | CAGCAGCCGCTTTTAGCCAC | ||
| SPIB reverse primer | GCATATGCCGGGGGAACC | ||
| LGR5 forward primer | TCAGTCAGCTGCTCCCGAAT | ||
| LGR5 reverse primer | CGTTTCCCGCAAGACGTAAC |
参考文献
- Kraehenbuhl, J. P., Neutra, M. R. Epithelial M cells: differentiation and function. Annual Review of Cell and Developmental Biology. 16, 301-332 (2000).
- Neutra, M. R., Frey, A., Kraehenbuhl, J. P. Epithelial M cells: gateways for mucosal infection and immunization. Cell. 86 (3), 345-348 (1996).
- Nakamura, Y., Kimura, S., Hase, K. M. cell-dependent antigen uptake on follicle-associated epithelium for mucosal immune surveillance. Inflammation and Regeneration. 38, 15 (2018).
- Clark, M. A., Hirst, B. H., Jepson, M. A. M-cell surface beta1 integrin expression and invasin-mediated targeting of Yersinia pseudotuberculosis to mouse Peyer's patch M cells. Infection and Immunity. 66 (3), 1237-1243 (1998).
- Jensen, V. B., Harty, J. T., Jones, B. D. Interactions of the invasive pathogens Salmonella typhimurium, Listeria monocytogenes, and Shigella flexneri with M cells and murine Peyer's patches. Infection and Immunity. 66 (8), 3758-3766 (1998).
- Jones, B. D., Ghori, N., Falkow, S. Salmonella typhimurium initiates murine infection by penetrating and destroying the specialized epithelial M cells of the Peyer's patches. Journal of Experimental Medicine. 180 (1), 15-23 (1994).
- Marra, A., Isberg, R. R. Invasin-dependent and invasin-independent pathways for translocation of Yersinia pseudotuberculosis across the Peyer's patch intestinal epithelium. Infection and Immunity. 65 (8), 3412-3421 (1997).
- Ohno, H. Intestinal M cells. Journal of Biochemistry. 159 (2), 151-160 (2016).
- Kerneis, S., Bogdanova, A., Kraehenbuhl, J. P., Pringault, E. Conversion by Peyer's patch lymphocytes of human enterocytes into M cells that transport bacteria. Science. 277 (5328), 949-952 (1997).
- Gullberg, E., et al. Expression of specific markers and particle transport in a new human intestinal M-cell model. Biochemical and Biophysical Research Communications. 279 (3), 808-813 (2000).
- Giannasca, P. J., Giannasca, K. T., Leichtner, A. M., Neutra, M. R. Human intestinal M cells display the sialyl Lewis A antigen. Infection and Immunity. 67 (2), 946-953 (1999).
- Jang, M. H., et al. Intestinal villous M cells: an antigen entry site in the mucosal epithelium. Proceedings of the National Academy of Sciences of the United States of America. 101 (16), 6110-6115 (2004).
- Beloqui, A., Brayden, D. J., Artursson, P., Preat, V., des Rieux, A. A human intestinal M-cell-like model for investigating particle, antigen and microorganism translocation. Nature Protocols. 12 (7), 1387-1399 (2017).
- Martinez-Argudo, I., Jepson, M. A. Salmonella translocates across an in vitro M cell model independently of SPI-1 and SPI-2. Microbiology. 154 (Pt 12), 3887-3894 (2008).
- Lee, J. B., et al. Quantitative analysis of lab-to-lab variability in Caco-2 permeability assays. European Journal of Pharmaceutics and Biopharmaceutics. 114, 38-42 (2017).
- Mabbott, N. A., Donaldson, D. S., Ohno, H., Williams, I. R., Mahajan, A. Microfold (M) cells: important immunosurveillance posts in the intestinal epithelium. Mucosal Immunology. 6 (4), 666-677 (2013).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- Knoop, K. A., et al. RANKL is necessary and sufficient to initiate development of antigen-sampling M cells in the intestinal epithelium. Journal of Immunology. 183 (9), 5738-5747 (2009).
- Taylor, R. T., et al. Lymphotoxin-independent expression of TNF-related activation-induced cytokine by stromal cells in cryptopatches, isolated lymphoid follicles, and Peyer's patches. Journal of Immunology. 178 (9), 5659-5667 (2007).
- de Lau, W., et al. Peyer's patch M cells derived from Lgr5(+) stem cells require SpiB and are induced by RankL in cultured "miniguts". Molecular and Cellular Biology. 32 (18), 3639-3647 (2012).
- Rouch, J. D., et al. Development of Functional Microfold (M) Cells from Intestinal Stem Cells in Primary Human Enteroids. PloS One. 11 (1), e0148216 (2016).
- Wood, M. B., Rios, D., Williams, I. R. TNF-alpha augments RANKL-dependent intestinal M cell differentiation in enteroid cultures. American Journal of Physiology: Cell Physiology. 311 (3), C498-C507 (2016).
- Zou, W. Y., et al. Human Intestinal Enteroids: New Models to Study Gastrointestinal Virus Infections. Methods in Molecular Biology. , (2017).
- Kozuka, K., et al. Development and Characterization of a Human and Mouse Intestinal Epithelial Cell Monolayer Platform. Stem Cell Reports. 9 (6), 1976-1990 (2017).
- Barker, N., et al. Identification of stem cells in small intestine and colon by marker gene Lgr5. Nature. 449 (7165), 1003-1007 (2007).
- Mantis, N. J., et al. Selective adherence of IgA to murine Peyer's patch M cells: evidence for a novel IgA receptor. Journal of Immunology. 169 (4), 1844-1851 (2002).
- Rios, D., et al. Antigen sampling by intestinal M cells is the principal pathway initiating mucosal IgA production to commensal enteric bacteria. Mucosal Immunology. 9 (4), 907-916 (2016).
- Miller, H., Zhang, J., Kuolee, R., Patel, G. B., Chen, W. Intestinal M cells: the fallible sentinels?. World Journal of Gastroenterology. 13 (10), 1477-1486 (2007).
- Heijmans, J., et al. ER stress causes rapid loss of intestinal epithelial stemness through activation of the unfolded protein response. Cell Reports. 3 (4), 1128-1139 (2013).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。