Method Article
斑马鱼原位杂交染色的基因分型与定量
摘要
基因编辑技术使研究人员能够相对轻松地生成斑马鱼突变体来研究基因功能。在这里,我们提供了一个指南,以执行平行胚胎基因分型和定量的原位杂交信号在斑马鱼。这种无偏的方法在基于原位杂交的表型分析中提供了更高的精度。
摘要
原位杂交 (ISH) 是使研究人员能够研究原位 mRNA 分布的重要技术,几十年来一直是发育生物学中的关键技术。传统上,大多数基因表达研究依赖于对ISH信号的视觉评估,这种方法容易产生偏差,特别是在样本身份是先验的。我们之前已经报告了一种规避这种偏差并提供更精确量化的ISH信号的方法。在这里,我们提出了一个简单的指南,以应用此方法量化在ISH染色胚胎感兴趣的基因的表达水平,并将其与其相应的基因型相关联。该方法对于在混合基因型样本中量化空间受限基因表达信号特别有用,它提供了传统视觉评分方法的公正和准确的替代方法。
引言
基因组编辑技术的引入(ZFN、TALEN以及最近的CRISPR/Cas9)导致世界各地利用这些系统研究体内特定基因功能的实验室数量大幅增加。斑马鱼尤其适合进行基因操作,最近1、2日产生了许多突变体。对于发育生物学家来说,评估胚胎发育中基因突变表象后果的最常见方法之一是原位杂交(ISH)。在没有明显的形态缺陷,分离同源突变体从他们的野生类型或异体兄弟姐妹,这是至关重要的,能够正确识别不同的基因类型准确。
经典ISH依靠信号强度的定性分析来得出关于感兴趣的基因和选定标记基因之间的调节相互作用的结论。这些分析虽然有用,但受到技术差异的影响,并且可能因研究人员的期望而产生偏差。因此,在未事先了解相应基因型的情况下,开发了一种在成像ISH染色胚胎后对基因表达进行量化的方法。随后是一个有效的DNA提取和基因分型,使我们能够定量地将基因型与基因表达3相关联。虽然在4、5之前已经使用了ISH后胚胎的基因分型,但除了一些研究6、7外,基于图像的ISH模式定量并没有被广泛使用。最流行的替代方法依赖于对ISH染色细胞8、9、10的视觉评分或计数,这两种细胞都容易产生不良的可重复性和研究人员的偏见。这种方法对于研究具有空间受限的表达模式的基因变化特别有用,例如runx1或gata2b,两者都在主动脉底细胞的受限子集中表达,称为造血内皮11,12。
在这里,我们的目的是提供一个实用的指导,通过图像分析使用斐济13,以及DNA提取和基因分型协议实现量化。这是为了直观地说明我们以前发布的方法3。我们的方法能够准确表示ISH检测到的基因表达变异,并公正地将基因表达水平分配给特定的基因型。
研究方案
涉及动物主体的程序受1986年《动物(科学程序)法》的管制,并已获得内政部和当地动物福利和伦理审查机构的批准。
1. 图像 ISH 染色胚胎
- 制备甘油溶液(1x PBS缓冲液中50%~80%),混合使溶液均质化(例如,在辊中至少离开5分钟)。此解决方案可在室温下保存数月。
- 原位杂交14、15、16、17后,用3mL巴斯德移液器将胚胎转移到甘油溶液中,并离开至少5分钟。如果成像胚胎超过24 hpf(受精后数小时),它们可能会像描述18那样被漂白。
- 制备并标记足够的PCR管,在成像后转移有ISH染色的胚胎。
- 在3 mL巴斯德移液器的玻璃凹陷滑梯中,将100%甘油添加到井底。
- 使用 3 mL 巴斯德移液器,将单个 ISH 染色的胚胎转移到玻璃幻灯片上,并在配备数码相机和底部和顶部照明的立体显微镜下根据需要定向。
注:使用凝胶加载移液器提示定位胚胎进行成像,但其他工具(如钳子、解剖针)同样足够。 - 使用第一个胚胎,以所需的放大倍率调整照明和曝光时间。在同一实验中,对所有胚胎使用这些条件(即,如果从异体突变体交叉中成像40个胚胎,请确保所有胚胎的照明、曝光时间和放大倍率都相同)。
- 根据需要成像尽可能多的胚胎。用唯一的数字标记每个图像。成像后,将胚胎移植到标有相同数量的PCR管/板。
注: 图像应保存为 TIF 文件,但其他格式也足够。- 如果需要,去除 PCR 管/板中的多余甘油。
注:此时,胚胎可在室温下在PCR管中储存数周。
- 如果需要,去除 PCR 管/板中的多余甘油。
2. 提取ISH染色胚胎的DNA和基因型
注:在这里,使用可靠和廉价的方法分离基于HoTSHOT方法19的基因组DNA,DNA提取效率为95%-100%3。
- 成像完成后,向每根管中加入40-75 μL的碱性莱沙缓冲液(例如,HoTSHOT)。
- 在95°C孵育约30分钟,将管冷却至4°C,然后加入相等体积的中和缓冲液。在4°C过夜孵育可以提高PCR效率。
注:此时,基因组DNA可用于基因分型或储存在-20°C,直到需要为止。 - 基因型样本与适当的方法(例如,HRMA,RFLP)3 ,20,21根据需要为感兴趣的突变.
- 注意对应于每个样本的基因型(例如,使用电子表格软件)。
3. 量化ISH染色胚胎的像素强度(使用斐济软件进行图像分析)
- 要量化原位杂交 (ISH) 染色信号强度,将所有图像转换为 8 位灰度,如描述3所述。如果图像已保存为 。TIF文件,使用斐济宏进行批处理转换3。或者,转换其他格式的图像(例如 , 。JPG) 到 。使用适当的软件使用 TIF,然后使用斐济转换为 8 位灰度。为方便起见,下面是前面发布的分步过程3,并带有一些更改。
- 在斐济打开图像,然后使用"编辑 > 反转"反转来反转图像。然后将图像类型更改为 8 位 (图像 > 类型 > 8 位)。
- 使用多边形选择工具,在包含信号的区域周围的图像上手动绘制感兴趣区域 (ROI)。
- 按t打开 ROI 管理器。使用 ROI 管理器的度量命令来测量 ROI 的强度。将平均值从"结果"窗口复制到电子表格软件。
- 将相同的 ROI 移动到斑马鱼区域,确保其大小和形状与原始区域相同。重复步骤 3.4 以测量背景。
- 要获得ISH信号的平均像素强度,从每个胚胎的染色区域中减去背景区域的平均强度值。
- 将每个强度值分配给基因型(从步骤 2.3 开始)。
4. 通过适当的统计测试分析结果
- 绘制一个 Q-Q 图上的所有值,以识别与正态分布的任何偏差。
注:正态分布也可以通过科尔莫戈罗夫-斯米尔诺夫测试或夏皮罗-威尔克测试进行验证。但是,对于较大的样本大小,在这些测试中存在误报的高风险。 - 如果存在与正态分布有很强的偏差,则转换所有值(使用 ln 或 sqrt 函数),以确保它们在继续之前是正态分布的。
- 分析分配给每个基因型的值(必要时变换)与 2 尾 ANOVA 的值之间的差异(wt vs. 杂性基体与突变体),其置信度为 95%,这占了与 Levene 测试和 Welch 校正的方差相等。对于每对基因型之间的成对比较,请使用 Tukey 的(相等方差)或游戏-豪厄尔(不等方差)的事后测试。
- 如果值在变换时未正态分布,请使用非参数检验(Kruskall-Wallis)分析排名值之间的差异,并使用 Bonferroni 校正进行配对校正后邓恩的多重比较测试比较。
- 将未转换的值(从步骤 3.6)绘制为点图,以获得最佳结果表示。
结果
在这里,我们描述了管道在图像定量和胚胎基因分型的实际应用,如在其他地方发表3。该方法的工作流如图1 所示。为了说明如何使用此方法,ISH在runx1W84X/+22交叉的 33 个 hpf 胚胎中为dnmt3bb.1进行了操作(图2)。130个胚胎的图像使用与协议中详述相同的照明条件,并用唯一的数字标记它们。成像后,每个胚胎被转移到PCR管进行基因分型。此时,执行图像分析以将像素强度值赋予每个图像。然后,将基因型分配给其相应的图像,并根据基因型对像素强度值进行分组,以便进行统计分析。在runx1W84X/W84X突变体(图2A,B)3中检测到dnmt3bb.1表达式的减少,与先前的观察结果5一致。有趣的是,runx1W84X/®异体胚胎在dnmt3bb.1表达(图 2A,B)中与野生类型同级相比没有显著差异,这表明 Runx1 的一个副本足以将dnmt3bb.1表达保持在适当的水平。
许多斑马鱼突变体没有表现出一种胚胎表型,否则可以使用其他功能丧失技术(如形态寡核苷酸(MOs)来检测。这种差异可归因于多种原因,包括脱靶效应、母体蛋白补偿、低态等位基因23或最近发现的遗传补偿现象24、25、26、27。在此示例中,我们询问runx1表达式在lmo4auob100突变体中是减少还是丢失,因为以前使用lmo4a MO 发布的数据表明,在lmo4a变形剂中runx1减少28。在这里,分析表明野生型和lmo4auob100同源突变体3(图3A,B)在runx1表达上没有显著差异。单胚胎qPCR的进一步分析表明,lmo4auob100突变体中的runx1表达有小但显著的减少(图3C)。因此,图像量化可能无法检测到表达级别的微小差异。或者,我们检测到的基因型之间缺乏差异是真实的,qPCR实验正在检测其他组织中runx1表达的变化,如电传,其中lmo4a和runx1都表达。研究人员应始终用一种独立的方法(如qPCR)来验证他们的结果,但最好通过流动细胞仪来丰富感兴趣的组织。
在 ISH 具有高背景的罕见情况下(图 3D),此区域的像素强度值非常高,以至于从信号值的减法产生负数,在这种情况下,这些胚胎将从分析中排除。根据我们的经验,这发生在大约0.4%的runx1-探针胚胎3,但可能不同实验,探针或试剂批次。虽然这可能是该方法的一个限制,但高背景的低频不太可能影响整体结果。
为了测试选择不同区域进行背景校正的效果,我们首先测量了 28 hpf 胚胎中的runx1 ISH 信号的像素强度,使用不同的区域进行背景校正(图 4)。选择了四个不同的区域:两个在主干区域(R1 和 R2),一个在蛋黄区域(未染色,但可能积累背景染色),以及一个较小的区域前 ROI(R4,图 4B)。测量这些区域的像素强度显示 ROI 和任一背景区域之间的强度差异相对稳定 (图 4C)。但是,R3 始终显示非常高的值(高于 ROI 中的值)。反转和转换到8位后,蛋黄区域显得非常明亮,因此不适合用作背景校正。R2 更接近 ROI,但包含一些 ISH 信号,与 R1(位于更远的左右,远离 ISH 信号)或 R4 相比,使用它进行校正降低了平均像素强度。因此,R1 或 R4 是可用于背景校正的适当区域(尽管 R4 的面积小于 R1)。接下来,我们希望比较使用 R1 或 R4 在比较runx1表达式时对结果的影响。为此,我们跨越了dll4+/-杂物29,并分析了随机选择的野生类型和dll4-/-胚胎中的runx1表达式(图4E)。尽管使用 R1 或 R4 进行背景校正会影响单个值,但同一基因型内的平均像素强度没有显著差异(图 4E)。此外,比较runx1表达式仍使用 R1 或 R4 区域作为背景校正(分别为R1=16.3 和=R4=18.2)的基因型之间产生相似的平均强度值。综合起来,我们的结论是,虽然选择背景区域很重要,但主要标准是它不包括蛋黄区域(容易积累背景染色),并且它不应包含任何可能扭曲背景像素强度值的(特定)染色。
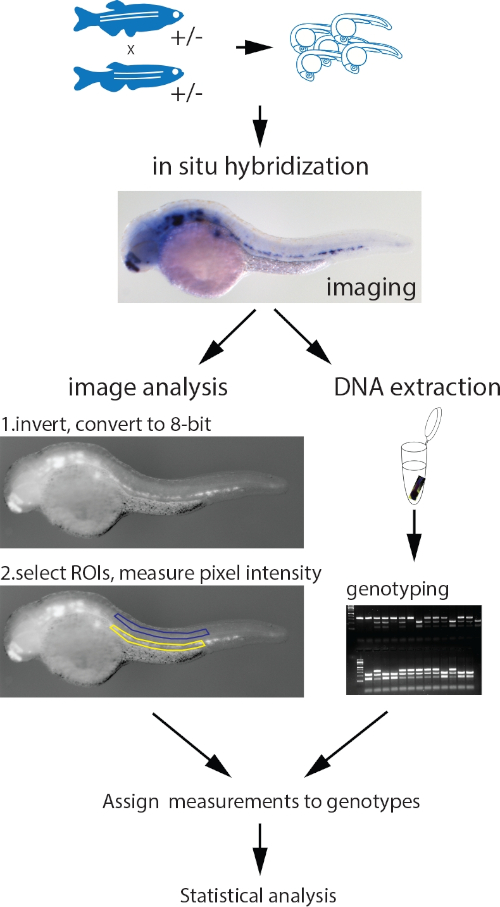
图1:并行图像定量和基因分型协议的工作流。用标准的ISH协议对从变种等位基因的交叉鱼中采集的胚胎进行探测。这种胚胎被探测为测量的基因。成像后,使用HotSHOT协议提取基因组DNA,在0.2 mL PCR管中将解液缓冲液直接添加到胚胎中,随后在95°C下孵育30分钟。此 DNA 用于通过 PCR、PCR 和限制片段长度多态性 (RFLP)、KASP 测定或任何其他适当方法对胚胎进行基因分型。同时,每个胚胎的图像被倒置并转换为8位灰度。手动选择和测量包含 ISH 信号(黄色)和背景(蓝色)的相同形状和大小的 ROIs。测量值,分配给相应的基因型,进行统计分析。图改编自多布日基等人3请点击这里查看这个数字的较大版本。
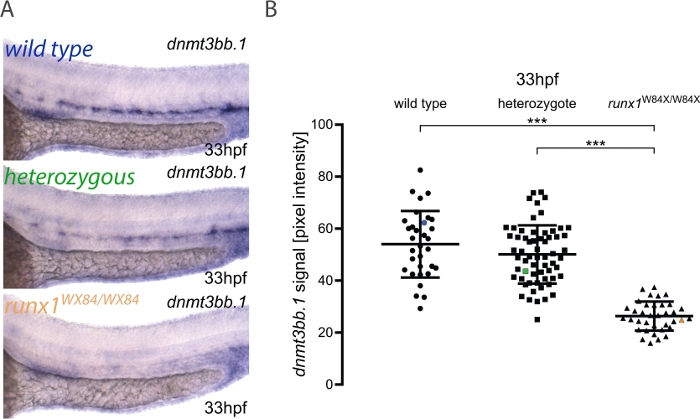
图2:runx1突变体中的图像定量显示ISH的dnmt3bb.1表达水平降低。(A) 33 hpf 野生类型 (蓝色)、runx1+/W84X (绿色) 和runx1W84X/W84X(橙色)胚胎的 ISH 示例图像,在背主塔中显示dnmt3bb.1表达式。(B) 与野生类型 (n=32) 和杂合物 (n=62) (ANOVA, p < 0.001) 相比,runx1W84X/W84X胚胎 (n=36) 中的dnmt3bb.1 mRNA 的像素强度值显著降低。野生型、杂性和突变组变异系数分别为24%、22%和21%。蓝色、绿色和橙色数据点对应于面板 A 中的示例图像。条形表示均值 = s.d. =p<0.001(游戏-豪厄尔后临时测试)。图改编自多布日基等人3请点击这里查看这个数字的较大版本。
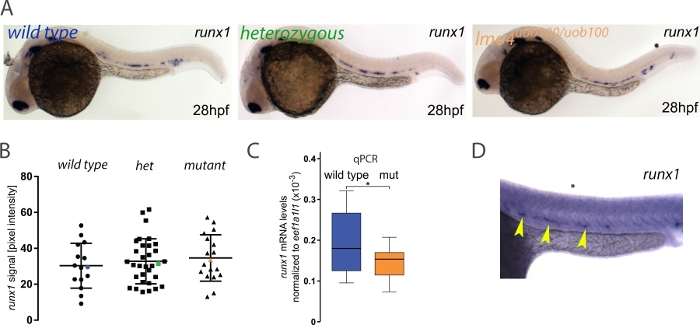
图3:在lmo4auob100突变体中按ISH测量runx1表达水平。(A) 在 28 hpf 野生类型 (蓝色)、 杂物 (绿色) 和lmo4auob100/uob100 (橙色) 胚胎中,ISH 的IS代表图像,显示了背主菜中的表达。(B) runx1 mRNA 信号的量化, 由 ISH 检测,从 28 hpf 野生类型 (n=15), 杂合性 lmo4a+/- (het) (n=34) 和lmo4auob100/uob100突变 (n=18) 胚胎从一个离合器显示不同基因型 (ANOVA,> p 0.6) 的runx1像素强度没有显著差异。蓝色、绿色和橙色数据点对应于面板 A 中的示例图像。条形图表示在单个野生类型(蓝色;n=12)和lmo4auob100/uob100(突变、橙色;n=12)胚胎(由qRT-PCR测量)中显示标准化的runx1 mRNA水平(2-+Ct)的盒图,显示与野生类型相比,突变体中的runx1水平有所下降。•p < 0.05(t测试)。(D) 在显示高背景的 28 hpf 胚胎(为runx1,黄色箭头染色)上的 ISH 实验示例。图改编自多布日基等人3请点击这里查看这个数字的较大版本。
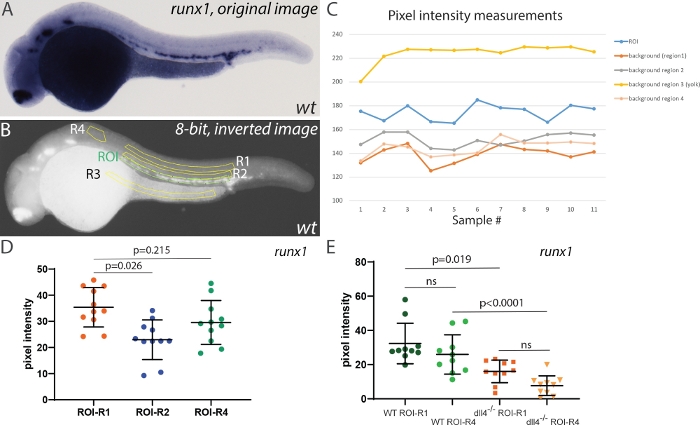
图4:背景强度校正对测量结果的影响。(A) 在28 hpf的野生型胚胎中,runx1 ISH染色的代表性图像。(B) 反转后相同的图像并转换为 8 位。感兴趣区域 (ROI) 以绿色突出显示,用于背景校正的四个不同区域 (R1-R4) 以黄色突出显示。(C) 面板 B 中显示的所有区域的原始像素强度测量。请注意 R3(蛋黄)的强度始终高于 ROI (n=11) 中的实际 ISH 信号。(D) 使用 R1、R2 和 R4 背景区域在 ROI 中的Runx1表达式级别。ROI、R1、R2 和 R3~28500 像素区域;R4~8500 像素。请注意,R3 背景未用于此比较,因为背景校正 (ROI-R3) 始终产生负值。(E) 野生类型的Runx1表达式级别和使用 R1 或 R4 进行背景校正的dll4-/-突变体(每个样本的 n=10)。假设像素强度值未正态分布,则使用非参数 Kruskal-Wallis 测试对面板 D 和 E 中的统计分析执行。请点击此处查看此图的较大版本。
讨论
使用这种方法量化基因表达时,应考虑几个因素。在整个实验过程中,必须保持成像条件(例如照明、暴露时间和胚胎定位),以减少测量之间的变异性。关键点是避免样品过污,因为样品之间的染色差异可能被掩盖。例如,在Xenopus laevis胚胎30中没有Eto2的情况下,VegfA表达的减少只能通过在24小时内仔细监测染色来检测。因此,最好从经验上确定每个基因的足够的染色水平,这些基因最能代表其表达,而不会达到饱和。过色还会人为地增加转换后的 8 位灰度图像中的背景像素强度,并扭曲定量结果。在极端情况下,胚胎组织的背景水平可能高于所选 ROI 中的 ISH 信号,这些样本应排除在分析之外。当我们测试未染色蛋黄是否适合背景校正时,也观察到类似的现象(图4)。反转和转换为 8 位后,蛋黄区域中较暗的像素会比胚胎中的 ISH 信号更亮,并使背景校正值为负值。因此,避免使用蛋黄进行背景校正。测量胚胎中色素区域的背景信号(例如,从 26/28 hpf 起,眼睛或躯干的背部分)同样会扭曲定量结果,也应避免。在ISH18之前或之后,有用于漂白斑马鱼胚胎的协议,在推荐成像之前,可以漂白超过 24 hpf 的胚胎。
由于此方法依赖于在等效非染色区域中根据背景像素强度测量定义区域中的像素强度,因此不适合按现有或几乎无所不在表示的基因进行定量。相反,它非常适合测量具有空间限制分布的基因表达,其中可以容易识别用于测量背景像素强度的区域。我们现在的附加分析表明,使用较小的区域(3-4 倍较小)进行背景校正会产生与使用与 ROI 等效区域类似的结果。这扩展了该方法的适用性,适用于在较宽的空间域中表达的基因(因此需要更大的ROIs进行强度测量),只要可以使用胚胎明显未染色的区域进行背景校正。
最后,我们建议在图像定量后平行或后进行基因分型,以尽量减少实验者的偏见。要求第二个实验者重复对匿名样本的定量,并与第一组测量进行比较,也有助于减少实验者的偏见。如果要量化的图像来自不需要基因分型的治疗方法之间的比较(例如,野生类型与化学抑制剂或野生类型与 MO 敲除),则执行测量的实验者应对样品。
披露声明
作者宣称他们没有相互竞争的经济利益。
致谢
我们要感谢牛津和伯明翰生物医学服务的工作人员为优秀的斑马鱼饲养。T.D.由威尔康信托染色体和发育生物学博士奖学金(#WT102345/Z/13/Z)资助。R.M.和M.K.由英国心脏基金会(BHF IBSR奖学金FS/13/50/30436)资助,并感谢他们的慷慨支持。R.M. 感谢来自牛津 BHF 卓越研究中心 (RE/13/1/30181) 的支持。
材料
| Name | Company | Catalog Number | Comments |
| 0.2 mL PCR tubes (8-strips with lids) | StarLab | A1402-3700 | 96-well plates are equally appropriate for sample handling but beware of cross contamination between samples |
| 3 mL Pasteur pipettes | Alpha Laboratories | LW4114 | |
| Cavity slides | Brand | BR475535-50EA | |
| Digital Camera (Qimaging Micropublisher 5.0) | Qimaging | ||
| Eppendorf Microloader tips | Eppendorf | 10289651 | the tips are used to orient the embryos for imaging in glycerol |
| Excel | Microsoft | ||
| F3000 Fiber Optic Cold Light Source | Photonic | ||
| Fiji | |||
| Glycerol | Sigma | G5516-1L | |
| Graphpad Prism 8.01 | GraphPad Software, Inc. | we prefer to use Graphpad, but other statistics software packages are also suitable (e.g. SigmaPlot or SPSS) | |
| HotSHOT alkaline lysis buffer | 25 mM NaOH, 0.2 mM disodium EDTA, pH 12 | ||
| HotSHOT neutralization buffer | Tris HCl 40 mM, pH 5 | ||
| PBS (10X) pH 7.4 | Thermofisher | 70011044 | |
| Stereomicroscope with illumination stand (Nikon SMZ800N) | Nikon | ||
| Thermocycler | Thermofisher |
参考文献
- Varshney, G. K., et al. High-throughput gene targeting and phenotyping in zebrafish using CRISPR/Cas9. Genome Research. 25 (7), 1030-1042 (2015).
- Varshney, G. K., et al. CRISPRz: a database of zebrafish validated sgRNAs. Nucleic Acids Research. 44 (D1), D822-D826 (2016).
- Dobrzycki, T., Krecsmarik, M., Bonkhofer, F., Patient, R., Monteiro, R. An optimised pipeline for parallel image-based quantification of gene expression and genotyping after in situ hybridisation. Biology Open. 7 (4), bio031096 (2018).
- Bresciani, E., et al. CBFbeta and RUNX1 are required at 2 different steps during the development of hematopoietic stem cells in zebrafish. Blood. 124 (1), 70-78 (2014).
- Gore, A. V., et al. Epigenetic regulation of hematopoiesis by DNA methylation. Elife. 5, e11813 (2016).
- Fan, Y., et al. Tissue-Specific Gain of RTK Signalling Uncovers Selective Cell Vulnerability during Embryogenesis. PLoS Genetics. 11 (9), e1005533 (2015).
- Wen, B., et al. GATA5 SUMOylation is indispensable for zebrafish cardiac development. Biochimica et Biophysica Acta. 1861 (7), 1691-1701 (2017).
- Espin-Palazon, R., et al. Proinflammatory signaling regulates hematopoietic stem cell emergence. Cell. 159 (5), 1070-1085 (2014).
- Peterkin, T., Gibson, A., Patient, R. Redundancy and evolution of GATA factor requirements in development of the myocardium. Developmental Biology. 311 (2), 623-635 (2007).
- Genthe, J. R., Clements, W. K. R-spondin 1 is required for specification of hematopoietic stem cells through Wnt16 and Vegfa signaling pathways. Development. 144 (4), 590-600 (2017).
- Kalev-Zylinska, M. L., et al. Runx1 is required for zebrafish blood and vessel development and expression of a human RUNX1-CBF2T1 transgene advances a model for studies of leukemogenesis. Development. 129 (8), 2015-2030 (2002).
- Butko, E., et al. Gata2b is a restricted early regulator of hemogenic endothelium in the zebrafish embryo. Development. 142 (6), 1050-1061 (2015).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Lleras Forero, L., et al. Segmentation of the zebrafish axial skeleton relies on notochord sheath cells and not on the segmentation clock. Elife. 7, (2018).
- Jowett, T., Yan, Y. L. Double fluorescent in situ hybridization to zebrafish embryos. Trends in Genetics. 12 (10), 387-389 (1996).
- Thisse, C., Thisse, B. High-resolution in situ hybridization to whole-mount zebrafish embryos. Nature Protocols. 3 (1), 59-69 (2008).
- Narayanan, R., Oates, A. C. Detection of mRNA by Whole Mount in situ Hybridization and DNA Extraction for Genotyping of Zebrafish Embryos. Bio-protocol. , e3193 (2019).
- Monteiro, R., Pouget, C., Patient, R. The gata1/pu.1 lineage fate paradigm varies between blood populations and is modulated by tif1gamma. EMBO JOURNAL. 30 (6), 1093-1103 (2011).
- Truett, G. E., et al. Preparation of PCR-quality mouse genomic DNA with hot sodium hydroxide and tris (HotSHOT). Biotechniques. 29 (1), 52-54 (2000).
- Wilkinson, R. N., Elworthy, S., Ingham, P. W., van Eeden, F. J. A method for high-throughput PCR-based genotyping of larval zebrafish tail biopsies. Biotechniques. 55 (6), 314-316 (2013).
- Parant, J. M., George, S. A., Pryor, R., Wittwer, C. T., Yost, H. J. A rapid and efficient method of genotyping zebrafish mutants. Developmental Dynamics. 238 (12), 3168-3174 (2009).
- Jin, H., et al. Definitive hematopoietic stem/progenitor cells manifest distinct differentiation output in the zebrafish VDA and PBI. Developement. 136 (4), 647-654 (2009).
- Stainier, D. Y. R., et al. Guidelines for morpholino use in zebrafish. PLoS Genetics. 13 (10), e1007000 (2017).
- El-Brolosy, M. A., Stainier, D. Y. R. Genetic compensation: A phenomenon in search of mechanisms. PLoS Genetics. 13 (7), e1006780 (2017).
- Rossi, A., et al. Genetic compensation induced by deleterious mutations but not gene knockdowns. Nature. 524 (7564), 230-233 (2015).
- Ma, Z., et al. PTC-bearing mRNA elicits a genetic compensation response via Upf3a and COMPASS components. Nature. 568 (7751), 259-263 (2019).
- El-Brolosy, M. A., et al. Genetic compensation triggered by mutant mRNA degradation. Nature. 568 (7751), 193-197 (2019).
- Meier, N., et al. Novel binding partners of Ldb1 are required for haematopoietic development. Development. 133 (24), 4913-4923 (2006).
- Kettleborough, R. N., et al. A systematic genome-wide analysis of zebrafish protein-coding gene function. Nature. 496 (7446), 494-497 (2013).
- Leung, A., et al. Uncoupling VEGFA functions in arteriogenesis and hematopoietic stem cell specification. Developmental Cell. 24 (2), 144-158 (2013).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。