Method Article
一种可定制的酶化生产与纯化天然产物的方法
摘要
在这里,我们提出了易于使用的协议,通过大肠杆菌或尼科蒂亚纳本塔米亚中的生物合成酶的组合表达来生产和纯化二苯基代谢物,然后是色谱产物净化。由此产生的代谢物适用于各种研究,包括分子结构表征、酶功能研究和生物活性测定。
摘要
二苯醚类形成一类多样化的小分子天然产物,广泛分布于生命王国,在发育过程、组织间相互作用和环境适应中具有重要的生物功能。由于这些不同的生物活性,许多二甲苯类药物也具有经济重要性,如药品、食品添加剂、生物燃料和其他生物产品。先进的基因组学和生化方法使对二苯基代谢基因、酶和通路的知识迅速增加。然而,二苯甲苯的结构性复杂性和单个化合物在单个物种中狭窄的分类分布,仍然是限制其有效生产的因素。更广泛的代谢酶现在为生产足够的二苯并物质和纯度提供了资源,以促进对这一重要代谢物群的深入研究。利用微生物和植物酶共表达的既定工具,我们提出了一个易于操作和可定制的方案,用于在大肠杆菌或尼科蒂亚纳本查米亚纳的酶化生产二苯基苯甲酮,通过硅色谱和半预准备HPLC对所需产品的纯化。以玉米组 (Zea Mays) 多拉布拉辛二苯基异物为例, 我们强调如何使用二苯甲苯合成酶 (diTPS) 和细胞色素 P450 单氧酶 (P450) 酶的模块化组合来生成不同的二苯甲苯脚手架。纯化化合物可用于各种下游应用,如代谢物结构分析、酶结构功能研究以及体外和植物生物活性实验。
引言
二苯酚由12,000多种以多环20碳天然产品组成的化学多样性组组成,在许多生物体中起着关键作用。真菌和植物产生最大的多样性的二甲苯类化合物,但细菌也已被证明形成生物活性二苯甲苯类化合物(见评论2,3,4,5)。植根于其巨大的结构多样性, 二苯甲醚服务于多种生物功能.少数二苯甲苯,如赤霉素生长激素,在发育过程中具有基本功能5。然而,大多数二苯甲苯类化合物是化学防御和组织间相互作用的中介。其中,针叶树的害虫和病原体防御中的二苯基树脂酸,以及玉米(Zea Mays)和水稻(Oryzasativa)等主要粮食作物中抗菌二苯酚的物种特异性混合物中,其范围最为广泛。研究6,7。这些生物活性为商业应用提供了丰富的化学储存库,而精选的二苯甲酮被用作现代生活中重要的药品、食品添加剂、粘合剂和其他生物产品8、 , 10.为了推进对二苯醚的自然多样性和生物功能的研究,并最终促进更广泛的商业应用,需要为具有成本效益的纯化合物制备工具。已经为一些二烯类生物制品建立了与植物材料的大规模隔离,例如作为纸浆和造纸工业的副产品生产的二苯基树脂酸。然而,仅在特定组织中积累二苯基苯甲苯,并在环境刺激的严格监管下,往往限制了从天然生产者2分离足够的产品量。此外,二苯甲苯的结构复杂性阻碍了其通过化学合成的生产,尽管这些方法在一些情况下已经成功11,12。随着先进的基因组和生化技术的可用性,酶生产平台在生产一系列二苯甲酮化合物方面越来越受到关注(见评论13,14,15,16,17,18。
所有三烯类化合物,包括二苯甲酸酯,均来自两个异位异类前体,二磷基苯甲基(IPP)和二甲基二磷酸二磷酸二醇(DMAPP)19,反过来,通过甲氧酸酯(MVA)或甲基二甲二醇-5-磷酸盐(MEP)途径。特氏体生物合成通过细菌中的MEP通路和真菌中的MVA通路进行,而植物则具有细胞体MVA和表皮MEP通路,后者是二苯甲苯形成的主要途径20。IPP和DMAPP的冷凝通过前尼转移酶产生中央20碳前体的所有二苯基苯甲酸二醇,二磷酸盐(GGPP)20。在GGPP形成的下游,两个酶系,三烯合成酶(TTPS)和细胞色素P450单氧酶(P450s)在很大程度上控制了三烯代谢的庞大化学多样性21、22的形成。二聚苯乙烯合成酶 (diTPS) 催化承诺的雕刻驱动循环和重新排列的 GGPP 形成各种立体特异性双、多、或宏观环二苯基器支架1,3,23 , 24.然后由P450酶和选择其他酶族22、25促进这些支架的氧化和进一步功能装饰。TTPS 和 P450 通常作为物种特定的多基因家族存在,可以形成模块化生物合成网络,结合共同蓝图的不同酶模块,从而形成广泛的化合物2。26.近年来,在模块化三烯体通路中运行的功能独特的酶的迅速发现,为它们作为部分或完整通路的代谢工程的多功能部件列表提供了不断扩大的机会。微生物和植物生产平台。例如,酵母(糖母素)已成功应用于设计用于制造三烯类生物制品的多酶通路,如抗疟药物青蒿素27、Sesquiterpenoid生物燃料比萨博列和法尔内内28,但也选择了二苯甲苯29,30,31。同样,为工业规模制造而设计的大肠杆菌平台已经为一些二苯丙酮代谢物而建立,包括用作抗癌药物的Taxol前体Taxadiene和二苯酚醇,sclareol,用于香水行业13,32,33,34.基因工程和转化技术的进步也使植物宿主系统越来越适用于生产植物天然产物9,14,35,36。特别是,密切的烟草亲戚,尼科蒂亚娜本查米亚纳,已成为一个广泛使用的底盘的三苯酮通路分析和工程,由于容易的农业细菌介导转换的多个基因组合,内源前体的有效生物合成,高生物量14,35,36。
利用这些已建立的三烯生物合成平台,我们在这里描述了用于酶化生产二苯酮和纯化单一化合物的易于使用且经济高效的方法。所提出的协议说明了如何利用大肠杆菌和N.benthamiana平台,用于增强二烯体前体生物合成,以组合表达不同的二苯基苯甲醚和P450酶,以产生所需的二苯二烯化合物。该协议在生产和纯化结构上不同的二苯基苯甲苯(二苯类)的实例中显示了来自玉米(Zea Mays)的专用二苯甲苯(Zea Mays),称为多拉布拉列辛,其内源性生物合成,其中招募了两个二TPS和一个P450酶。通过将分离漏斗萃取与大规模硅柱色谱和预置高压液相色谱(HPLC)相结合,实现从烯烃到含氧衍生物的不同多拉拉列辛的纯化。所述协议针对二苯甲苯类的产生进行了优化,但也可轻松适应相关的类,以及可用于酶资源的其他天然产品。使用这种方法生产的化合物适用于各种下游应用,包括但不限于通过核磁共振 (NMR) 分析进行的结构表征、用作酶功能研究的基质,以及一系列生物活性测定。
研究方案
注意:此处描述的协议包括使用危险化学品、尖锐物体、电气设备、热物体和其他可能导致伤害的危险。应佩戴适当的个人防护装备,并遵循适当的安全程序,包括安全培训。
1. 材料和解决方案的制备
- 制备和高压灭菌液培养基(LB)30分钟:每1升培养基,混合10克胰腺酮,5克细菌酵母提取物和10克NaCl,并溶解在1L的去离子化(DI)水中。
- 对于1 L共表达培养物,制备和高压灭菌特极果(TB)培养基为30分钟:在2.8 L Erlenmeyer烧瓶混合12克锥酮,24克细菌酵母提取物和40 mL的10%(v/v)甘油,并溶解在860 mL的DI水。制备和高压灭菌器 1.3 L 的 10x 磷酸盐缓冲液 [1.3 L 的 DI 水,30.03 克磷酸三钾 (KH2PO4)和 163.02 g 磷酸二钾 (K2HPO4)],并添加到上述介质中。
- 使用催化压压 (SOC) 介质准备超级最佳肉汤。
- 制备和高压灭菌30分钟溶液含有2%(w/v)胰锥酮,0.5%(w/v)细菌酵母提取物,8.5 mM NaCl和2.5 mM KCl。
- 加入无菌MgSO4和葡萄糖,最终浓度为20 mM。使用 1 M NaOH 调整到 pH 7.0。将 SOC 介质储存在 -20 °C。
- 准备1升1M丙酸钠。高压灭菌15分钟,储存在4°C。
- 在无菌DI水中制备20 m等丙基β-D-1-硫拉多拉诺赛德(IPTG)。在 -20 °C 下存储 1⁄2 mL 等分。
- 制备渗透缓冲液:10 mM MES (1.952 g) 和 10 mM MgCl2 (2.033 g) 溶解在 1 L 的 DI 水中。储存在4°C。
- 准备和高压灭菌LB琼脂30分钟:每100mL的DI水,加入1克锥酮,0.5克细菌酵母提取物,1克NaCl和1.5克琼脂。一旦LB琼脂足够冷,以处理瓶子,添加抗生素所需的质粒组合。使用培养皿倒入琼脂板,并储存在 4°C。
- 有关大肠杆菌和大肠杆菌中化合物生产的规格,分别见表1。将含有瑞福霉素的板包裹在铝箔中,以防止储存时降解。
| 工作浓度(μg/mL) | |||||
| 抗生素 | 库存(毫克/升) | 溶剂 | 1 质粒 | 2 个质粒 | 3 或 4 个质粒 |
| 卡贝尼西林 | 50 | H2O | 50 | 25 | 20 |
| 氯霉素 | 30 | 埃特OH | 30 | 20 | 20 |
| 卡那霉素 | 50 | H2O | 50 | 25 | 20 |
| 斯佩诺霉素 | 30 | H2O | 30 | 25 | 20 |
| 庆大霉素 | 50 | H2O | 30 | ||
| 利福平 | 10 | 甲醇 | 10 | ||
表1:大肠杆菌或大肠杆菌中质粒共表达的抗生素浓度。
2.大肠杆菌中二苯甲苯代谢物的产生
注:此处描述的在大肠杆菌中生产二苯甲酸酯代谢物的协议改编自由Reuben J. Peters博士(美国伊奥瓦州立大学)小组开发的酶共表达平台,13 , 32.
- 使用质粒组合转化合格细胞。
- 在冰上解冻具有化学能力的大肠杆菌细胞(本协议使用了BL21DE3-C41细胞)。
- 在1.5 mL微管中,将用于共表达的每个结构的100纳克/μL溶液加入1μL,以25μL的能称细胞。请勿通过移液涡旋或混合。
注:为了TPS和P450酶的最佳表达和活性,需要考虑几个序列修改。对于 TPS,去除 N 端蛋白体过境肽通常是必不可少的。具体来说,单体和二TPS通常需要去除预测的过境肽(使用常见的预测算法37),而细胞分体-TPS通常可用作全长基因。关于P450s,科顿优化以及去除或更换与N端跨膜域的领先序列MAKKTSSKGK在许多情况下已被证明是有效的38,39。此外,当共同表达P450酶时,应加入细胞色素P450还原酶(CPR),以确保足够的P450活性。 - 在冰上孵育混合物30分钟,通过轻轻刮过微管架,每10分钟混合一次。
- 预孵化SOC介质和LB琼脂板在37°C含有抗生素所需的所需的结构组合。
注:每个共同转化的构造都必须具有明显的抗生素耐药性,以及不同的复制来源,以确保最佳的蛋白质表达。 - 热冲击细胞混合物在42°C1分钟,然后在冰上孵育至少2分钟。
- 添加 200 μL 的暖 SOC 介质。
- 在 37°C 和 200 rpm 下摇动电池混合物 1 小时。
- 将大约 10 个灭菌玻璃珠添加到加热的 LB 琼脂板中。加入100 μL的细胞混合物并更换盖子。水平摇动板,盖上盖子,均匀分布细胞。将玻璃珠敲入废物容器,将其取出。或者,使用其他首选电镀方法。
- 在37°C下孵育LB琼脂板过夜,涂层表面朝下。具有转化大肠杆菌菌落的板可在第二天使用,或储存在4°C密封在石蜡薄膜中长达2周。
- 接种培养的制备
- 第二天,使用表1中提供的浓度,用转化质粒组合所需的抗生素制备LB培养基溶液。
- 在无菌罩中,将 5 mL LB 介质转移到带塑料透气盖的 15 mL 无菌玻璃试管中。为每个所需的大 (1 L) 培养体准备一个小培养管。
- 使用移液器尖端从 LB 琼脂板中选择单个大肠杆菌菌落。将一个含有选定菌群的移液器尖端喷射到每个管中,用大肠杆菌菌落为LB的每个管接种。
- 用透气塑料盖盖住每个接种培养试管。将盖盖大肠杆菌小培养物置于37°C摇动培养箱中12~24小时。
- 共同表达文化的准备和诱导
- 第二天,将100 mL制备的10倍磷酸盐缓冲液加入900 mL的制备TB中,最终磷酸盐缓冲液浓度为1倍。根据表1,加入必要的抗生素。
- 在 37°C 下以 140 rpm 的速度摇动,直到温暖(约 30 分钟)。
- 用5 mL的接种培养法为1L培养物接种每个烧瓶。在接种培养管中保留用于接种培养的移液器尖端,以便在后续步骤中用有机溶剂萃取时,没有提取的塑料污染物。
- 在 200 rpm 下孵育,直到 600 nm (OD600)处的光学密度达到 0.6,约 3 小时。要使用分光光度计测量 OD600,请使用无菌 TB 与磷酸盐缓冲液的混合物作为空白。
- 在所需的OD600下,将培养箱设置设置为16°C。
- 当共同表达P450时,新鲜制备核黄素和氨基硫兰酸,这对于足够的P450共因子生产至关重要。对于每个实验,制作4克核黄素和150克/L氨基硫兰酸。保持溶液包裹在铝箔,直到使用,因为核黄素是光敏感。
- 培养箱达到16°C(约30分钟)后,在每个培养基中加入1 mL的1M IPTG、1mL的4克/L核黄素和1mL的150克/L氨基硫化酸。对于二苯丙胺生产,应在每种培养物中加入25 mL的1M丙酸钠,以确保足够的前体形成。
注:此测定中使用的所有构造都位于同一 IPTG 诱导器下。可根据需要使用不同的启动器。 - 在16°C和140rpm下孵育72小时。如果产生二苯甲酮,在诱导后的每天每天加入25 mL的丙酮酸钠。立即使用培养物立即用于提取代谢物的分段漏斗;不收获或储存文化。
3. 代谢物的分离和纯化
- 代谢物的分量漏斗提取
注意:使用有机溶剂时,必须仅使用玻璃器皿和玻璃移液器,以防止增塑剂污染。- 在烟机罩中,将分段漏斗固定在环形支架上。在分片漏斗下方放置一个废烧杯。
- 将 500 mL 的 50/50 (v/v) 乙酸乙酯/六氯苯甲酸酯/六氯苯甲酸酯倒入分色漏斗中。
注:溶剂混合物应根据目标代谢物的溶解度和极性进行调整。应避免使用水化溶剂,以确保适当的相分离。 - 将 500 mL 的大肠杆菌培养剂添加到分片漏斗中,并放置在玻璃塞上。
- 摇动漏斗,将培养剂与萃取溶剂混合,约 5~10 倍。当漏斗倒置并指向烟气罩以释放压力时,经常打开漏斗,从而对漏斗进行除气。重复摇动和脱气程序 2 倍。
- 将漏斗直立放在环支架中,等待溶剂层(顶部)与水层(培养)层(底部)分离,约 1 分钟。
注:在相间观察到大量气泡时,可添加5~10 mL EtOH的小体积,以改善相分离。 - 拆下塞。将大肠杆菌层排入废杯中,将溶剂层保留在漏斗中。
- 使用剩余的500 mL大肠杆菌培养剂和用于首次萃取的相同 500 mL 溶剂重复此过程。
- 将含有萃取代谢物的溶剂排入清洁烧瓶中。避免受到大肠杆菌培养的污染。
- 旋转蒸发浓度
- 准备旋转蒸发(rotovap)设备:注水浴,将温度设定为25°C。对于热敏化合物,请使用较低的温度设置或向水浴中添加冰。将冷凝室加注干冰,并将转速设置为 60–80 rpm。
- 将约 700 mL 的提取代谢物添加到 1 L 蒸发瓶中,附着在轮状物上,然后放入水浴中。打开水浴加热器并设置为 25°C。
- 开始旋转蒸发瓶,打开真空系统,并逐渐增加吸力,以避免代谢物溶液快速沸腾进入废烧瓶。蒸发的溶剂应开始冷凝并滴入冷凝水收集(废物)烧瓶中。
- 当代谢物溶液仅保留在蒸发瓶中时,停止旋转并关闭真空系统。通过关闭真空管路升起蒸发瓶并减压。保留蒸发瓶中的浓缩代谢物溶液。处理废瓶中的废物。
- 将高达 700 mL 的额外萃取代谢物溶液添加到蒸发瓶中,继续旋转蒸发。重复处理,直到所有提取的代谢物溶液被浓缩。
- 用玻璃移液器转移到新的试管中,从蒸发瓶中取出浓缩代谢物。用 5 mL 的 50/50 (v/v) 乙酸乙酸酯/六氯苯甲酸酯或所需溶剂混合物冲洗蒸发瓶两次,将冲洗溶液转移到试管。
- 将浓缩代谢物储存在-20°C或-80°C(取决于产品稳定性),直至进一步使用。
- 硅柱纯化
- 通过用己酸和乙酸乙酯一次的1L烧杯、玻璃漏斗、50 mL试管和3.2 L色谱柱(配有玻璃胶)来制备玻璃器皿。标记 50 mL 试管,用于收集分数。
- 将 2 L 硅胶(230–400 网格,60 级)添加到具有 2 L 储液罐容量和碎盘的 3.2 L 色谱柱中,然后装载沙,在色谱柱顶部形成 5 厘米层。
- 用 2 L 的己带彻底冲洗色谱柱,准备色谱柱。在任何时候,柱的沙层上方应有一层薄薄的(±0.5厘米)溶剂液体,以确保柱子不会干涸或获得气囊。连接到空气软管的玻璃入口适配器可用于轻轻地增加通过柱的流速,而不是仅增加重力。
- 将浓缩代谢物提取物(见第 3.2 节)加载到柱上。用己带冲洗含有样品3x的瓶子,并添加到柱中,以确保所有样品都已转移。
- 使用以下梯度,一次加载 100 mL,在标记的试管中收集 50 mL 分数:100% 己酸 3 倍、10% (v/v) 乙酸乙酸乙酯在己欧 3xe 3x、12.5% (v/v) 乙酸乙酯中,己安为 3 倍,15% (v/v) 乙酸乙酸乙酯 3x,20%(v/v)乙酸乙酯在己安3x,40%(v/v)乙酸乙酯在己安3x,60%(v/v)乙酸乙酯在己安3x,和100%乙酸乙酯4x。
注:应根据复合大小和极性以及所需的分离来调整渐变。 - 使用玻璃移液器,将每个馏分的 1 mL 转移到标记的 GC 小瓶中。通过 GC-MS 分析每个样本,确定哪些馏分包含所需的代谢物及其纯度水平。
注:GC-MS方法适用于该方法产生的代谢物,已在Mafu等人201839中描述。简而言之,所有分析均使用 HP-5MS 柱(参见材料表)使用 XL MS 检测器在 GC 上执行,样本体积为 1 μL,烤箱温度在 20°C 最小-1时从 50°C 到 300°C。 - 确定哪个分数包含感兴趣的化合物后,合并包含相同化合物的所有分数。将不含任何化合物的馏分正确放入废物容器中。如有必要,重复旋转蒸发程序以浓缩纯化代谢物。
- 如果需要额外的纯化,请使用(半)预准备HPLC提高产品纯度。HPLC 协议应根据个别设备规格和感兴趣的化合物进行调整。
- 在 1 mL 己相苯甲酸酯(二苯丙烯碳氢化合物)或乙酰乙酰乙酯(含氧二苯甲苯)中重新悬浮干燥的硅色谱样品,并通过过滤注射器过滤,以防止受到小颗粒的污染。
- 对于非极性二苯基苯甲酸酯,使用推荐流量为 1 mL/min 的 CN 列(参见材料表)和己化:乙酸乙酯梯度,每 1 分钟收集一次分数。
- 对于极性二苯基苯甲酸酯,使用建议的流量为 3 mL/min 的 C18 柱(参见材料表)和乙酰乙酰基拉:水梯度,每 1 分钟收集一次分数。
- 在GC-MS分析之前,在氮流下干燥所有HPLC纯化馏分,并在1mL己婉中重新悬浮,以评估产品丰度和纯度。
4.使用N. 本塔米亚纳生产二苯甲苯代谢物
注:这里描述的在N.benthamiana生产二苯甲苯代谢物的协议,是从先前报告的研究35,36,40,41改编而成的。以下协议是特定于注射器渗透N.本查米亚纳叶。其他渗透方法,如真空渗透同样适用。二进制T-DNA载体系统,如pCAMBIA130035Su(pLIFE33)或pEAQ-HT 40,41,42,在大肠杆菌和A.肿瘤中繁殖,并在植物宿主的基因表达适合此协议。
- 种植尼科蒂亚娜·本查米亚纳
- 将一个 750 mL 的锅装满盆栽土壤和水。加入+20烟草种子,用手指轻轻敲击,使其在土壤中。不要用土壤覆盖。
注:种子可以通过自授繁殖产生,用于种子繁殖。该实验的种子从加州大学戴维斯分校植物生物学系获得,并通过美国农业部种质库(https://npgsweb.ars-grin.gov/gringlobal/accessiondetail.aspx?id=1450450)公开获得。 - 将锅放在生长室中,条件如下,每隔一天浇水,以确保土壤不会干涸。在 26°C 和 60% 湿度下种植植物,在 16:8 小时/夜循环下,实现此协议中的所有步骤。
- 1周后,将20个锅装满盆栽,将锅水浇注。用钳子,抓住茎上的烟草幼苗,轻轻地从源锅中取出,在每个新锅中放一个幼苗,小心地刺除根部。不要损坏叶子或根部。
- 每隔一天,在盆子中的托盘中放一次水给植物浇水(也称为"底部浇水")。每四次浇水,根据包装说明在水中加入普通肥料。
- 将一个 750 mL 的锅装满盆栽土壤和水。加入+20烟草种子,用手指轻轻敲击,使其在土壤中。不要用土壤覆盖。
- 农业细菌菌株GV3101合格细胞的冻融转化
- 解冻农业细菌菌株GV3101(或其他首选菌株)在冰上的能型细胞(±1小时)。在冰上预冷0.2 mL微离心管。28°C 时加热 SOC 介质。
- 将细胞与移液头(不要上下移液)和等分 15 μL 的细胞轻轻混合,每次转换到冷却的 1.5 mL 微管中。
- 将 1-5 μL (+400 ng) 的 DNA 添加到每个管的合格细胞中,并通过沿着管架刮管轻轻混合。
注:所需结构不需要不同的抗生素耐药性,因为它们各自被分别转化,在渗透前混合。 - 将微管放入液氮中5分钟。
- 从液氮中取出微管,并将管放在室温度架上。在37°C培养箱中解冻管5分钟。
- 在每个微管中加入250 μL的预加热(28°C)SOC。在 28-30 °C、225 rpm 下摇动 3 小时。
- 根据步骤 2.1.8 中所述,使用无菌玻璃珠将转化细胞的 50 μL 板板板放在含有表 1中描述的必要抗生素的 LB 琼脂板上。
- 孵育板在28-30°C倒置48小时。在孵育的第1天内生长可能是污染的迹象。转化的 A. 肿瘤可在2天孵育后使用,或在石蜡薄膜中密封的4°C下储存长达2周。
- 农业细菌介导瞬态酶共表达在尼科蒂亚娜本塔米亚纳
- 修剪4周大尼科蒂亚娜弯曲哈米亚植物前2天渗透通过去除下叶。留下4片最上面的叶子。浇水植物。在渗透前24小时不要给植物浇水,以便开放气孔和更容易渗透。
- 将10 mL的LB与用于选定结构的适当抗生素和Agrobacs菌株(如表1)的工作浓度添加到带箔盖的50 mL无菌玻璃试管中。
- 使用移液器尖端接种,将转化的农用细菌的单一菌群拭下,并将吸头喷射到 LB 介质中。每个农业细菌转化剂应至少具有2个小培养物。
- 在 28°C 和 220 rpm 下孵育过夜。
- 使用分光光度计测量隔夜培养物 600 nm (OD600)的光学密度。将隔夜培养物稀释到 OD600的 1。
注: 使用其他农业细菌菌株时,最佳 OD600值可能会有所不同。 - 将 10 mL 的稀释过夜培养液分配到 50 mL 锥形管中。
- 在室内温度下,在 3500 rpm 下离心 15 分钟,收获细菌。倒掉并丢弃上清液。
- 通过轻轻摇动管并在管架上滚动,在 10 mL 渗透缓冲液中重新悬浮培养物。OD600应等于每个构造的 1。
- 通过组合每个转化的细胞系的相等体积来生成渗透所需的组合。对于每个渗透,OD600应等于 1。估计每叶渗透溶液5 mL,每株2片叶子。
- 将管子水平连接到摇臂上,在室温下轻轻摇动 2 小时。
- 使用每叶约 5 mL 的渗透混合物,每株N. 本塔米亚纳植物渗透 +2 叶。在叶子的底面用无针注射器渗透健康叶子,同时在叶子顶部用手指施加反压,以确保渗透溶液使叶组织窒息。
- 用黑色标记或其他指示器标记所有渗入的叶子。将渗入植物置于生长室中5天。保持植物水浇。
注:5天的孵育时间已证明足以达到大多数下游分析的二苯并位,同时保持产品形成的时间效率。可以测试更长的孵育期,需要更高的产品量。
- 代谢物提取和纯化从改造尼科蒂亚纳本塔米亚纳
- 收获从植物中剪下叶子,从植物中渗出叶子。将100 mL的液氮和单片叶子加入砂浆中,然后用砂浆、虫子或纸巾磨碎,直到获得细粉。
- 将粉末状组织添加到 GC-MS 小瓶中,以至 500 μL 分界。将1.5 mL的50/50(v/v)乙酸乙酸酯/己酸或所需溶剂混合物加入小瓶和盖紧。
- 对于经过测试以提供所需产品的表达,将地面组织汇集到较大的烧瓶或试管中,然后加入比组织体积高 2 倍的溶剂量,并在一夜之间摇动。继续执行步骤 4.4.5 进行纯化。
- 将所有小瓶放在微管机架中,并紧密放下胶带以固定。在室温下在剧烈晃动下萃取过夜。
- 将400μL提取物和600μL己己醇转移到新鲜的GC-MS小瓶中。不要对任何叶组织进行等分。使用步骤 3.3.6.1 中描述的方法使用 GC-MS 分析样本。
- 通过GC-MS分析所需代谢物的存在后,将池叶提取物一起提取,并通过旋转蒸发、硅柱色谱和HPLC进行,以获得第3.2节和第3.3节所述的纯化合物。
结果
使用大肠杆菌生产二苯并类动物的原理工作流程
图 1说明了描述的二苯二烯生产的工作流。此处概述的协议改编自前面描述的大肠杆菌平台,用于二烯体生物合成 13、32,用于使用大体积培养物,并通过二氧化硅纯化所需的二苯基苯甲酸酯产品相 色 谱 法。为了演示此协议的使用, 我们使用最近鉴定的玉米多拉布拉列辛通路,包括两个diTpS,ZmAN2(Zm00001d029648)和ZmKSL4(Zm00001d032858),一种多功能P450(CYP71Z18,Zm000001d14134),以及acytochrome P450还原酶 (ZmCPR2, Zm00001d026483) (图2)。简而言之,大肠杆菌BL21DE3-C41合格细胞用pCDFDuet:IRS和pACYC-Duet:GGPPS/ZmAN2质粒13、32进行预转化。 pCDFDuet:IRS质粒含有用于二苯甲酸酯前体生产的关键酶,包括1-脱氧-D-黄糖-5-磷酸合成酶(dxs)、1-脱氧-D-黄糖-5-磷酸还原酶(dxr),以及二磷酸二醇酶(i),并证明增加大肠杆菌13的二苯基苯甲酸酯形成。pACYC-Duet:GGPPS/ZmAN2质粒含有玉米正二磷酸二磷酸合成酶ZmAN2和来自阿比斯大分的GGPP合成酶。酶催化多拉布拉辛生物合成中的承诺反应,然后共同转化为质粒pET28b:ZmKSL4和pETDUET:ZmCPR2/ZmCYP71Z18。有关序列和质粒构造的详细信息,请参阅 Mafu 等人 201839。
图3A显示了萃取酶产物的GC-MS色谱图,说明了三种多拉布拉辛化合物的形成,即多拉布拉基尼(1.2± 0.25 mg/L 培养物)、环氧二苯丙烯(0.65 ± 0.2 mg/L 培养)和环氧二醇 (11.4)• 1.1 mg/L 培养物,根据使用二苯丙酮的标准曲线进行量化。斯克拉罗被用作参考标准,因为它的结构和化学性质与多拉布拉辛相似。通常观察到的次要副产品包括氯霉素、蛋白醇衍生物牛耳和丁多尔-5-醛,以及前体二磷酸二磷酸二磷酸二磷酸(GGPP)(图3)。Indole 通常代表主要副产品,但此处未显示,因为其保留时间比设定的溶剂延迟短 7 分钟,以保持 GC-MS 仪器的完整性。
使用N.本查米亚纳生产二苯甲苯的原理工作流程
图4描绘了在N.本查米亚纳的多拉布拉辛通路表达的概述。对于此处描述的产品,以下结构分别转换为A. tumefaciens菌株 GV3101:pLife33:p19(表达 p19 基因沉默抑制蛋白),pLife33:ZmCYP71Z18,pLife33:ZmAN2,pLife33:ZmKSL4。玉米多拉拉列辛通路基因的全长原生序列用于二元T-DNA载体pLife3341,具有卡那霉素耐药性,在大肠杆菌和A.tumefaciens中繁殖。上游三烯体通路基因的共同表达是可选的,因为前体二磷酸盐是内生形成的N.benthamiana。然而,一些研究已经成功地采用这些方法,以增加在N.本塔米亚纳14,36,41的二苯甲苯形成。如图3所示,共表达成功地产生了多拉布拉迪烯和15,16-环氧二苯丙烯。与大肠杆菌中的酶共表达不同,在代谢物提取物中未检测到15,16-环氧二甲苯酚。
叶提取物中15,16-环氧多烯的存在表明CYP71Z18在N.benthamiana的活性。由于15,16-环氧多拉他醇在从微生物培养物中萃取后稳定(图3),以及从玉米根组织分离后,在以前的研究中,似乎似乎羟基化产物是糖基化通过内源性糖基转移酶,随后在真空中隔离,使其无法用此处用于提取的有机溶剂混合物进行提取 36、43、44、45 , 46.在以前的研究中,类似的不受欢迎的产品修改在N.benthamiana的通路工程中已经报道。如大肠杆菌中的共表达所示,N.benthamiana中的瞬态表达导致提取了几种副产品,包括基于参考质量光谱数据库比较的不同链长度的线性烷。从叶材料中提取的复合定子平均为2.4 +/- 0.5毫克多拉比拉酮和0.9+/- 0.3毫克15,16-环氧二苯丙烯每克干叶组织。鉴于不同的实验设置,这些定子不能直接与大肠杆菌共同表达系统进行比较。
二苯并苯纯化
使用硅柱色谱法和随后的半预化HPLC实现了二苯基苯甲酸化合物纯化。使用二氧化硅柱色谱法纯化了12L池大肠杆菌培养物的代谢物提取物,以分离三种焦多拉拉列辛化合物(图3A)。硅色谱是实现目标化合物高纯度的理想选择,因为它能够简单分离二烯烯烃和含氧衍生物,并轻松去除主要污染物,氧化硅基质上保留的氧化烷(图 3A.
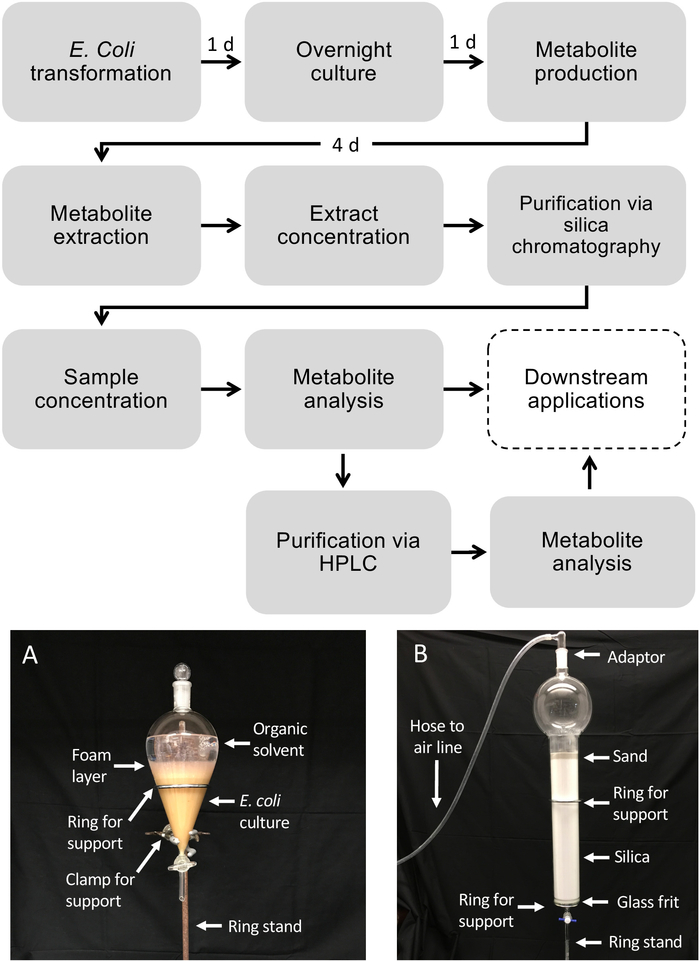
图1:大肠杆菌中二苯二烯类药物的生产工作流程,以及从液体细菌培养物中代谢物纯化的工作流程。虚线框表示需要额外纯化的可选步骤。(A) 使用分皮漏斗提取大肠杆菌培养物的代表图像.(B) 使用硅色谱法的代谢物提取物纯化的代表性图像。 请点击此处查看此图的较大版本。

图2:本研究中使用的多拉布拉辛生物合成途径和基因结构。请点击此处查看此图的较大版本。
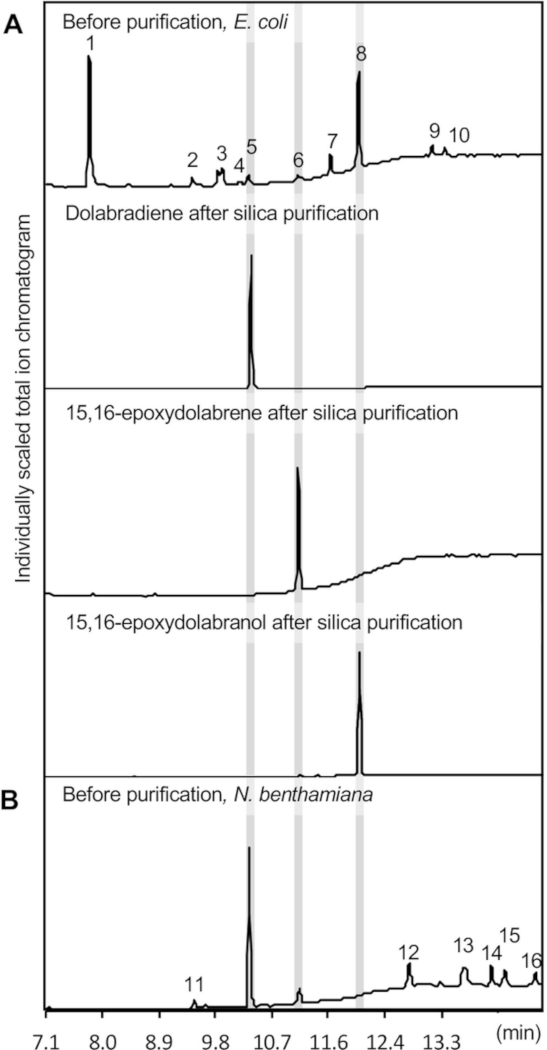
图 3:GC-MS 结果。所示是使用酶co表达测定在大肠杆菌和(B)N.本查米亚纳中获得的纯化二苯甲苯类产品的代表性GC-MS色谱图。产品识别基于与美国国家标准与技术研究院 (NIST) 质量光谱库的真实标准和参考质谱的比较。1、牛耳;2、蛋白二苯甲醚5甲醛;3、皮罗洛[1,2-a_pyrazine-1,4-二酮,六氢-3-(2-甲基丙基)-;4、6-O-乙酰-1-[4-溴化物]-d-葡胶面S,S-二分;5、多拉拉迪尼;6, 15,16-环氧二苯丙烯;7、皮罗洛[1,2-a_pyrazine-1,4-二烯,六氢-3-(苯甲基)-;8, 15,16-环氧多拉他醇;9 和 12,未知;10、氯霉素;11, 3,7,11,15-四甲基-2-六十二十二丁基-1-醇;13-16,烷。请点击此处查看此图的较大版本。

图4:N.本巴米亚纳的二苯胺生产。(A) 在修剪前,从叶材料中生产二苯甲酸盐和从叶材料中纯化代谢物的工作流程. (B) N. 本特哈米亚纳植物的代表性图像,准备进行渗透实验,然后再修剪。(C) 修剪后N.本查米亚纳植物的代表图像.(D) 注射器渗透的叶子的图像.较暗的地区已被渗透。请点击此处查看此图的较大版本。
讨论
更广泛的调查和应用二苯甲苯天然产品需要简单,廉价的协议来合成和纯化足够数量的所需化合物。各种物种中可用的二苯基代谢酶数量迅速增加,这为使用微生物和植物宿主系统的二苯甲苯类酶的酶生产提供了广阔的库存。此外,许多二苯醚通路的模块化架构允许在"即插即用"组合工程方法中使用来自相同或不同物种的酶,以生成一系列天然和新的自然类二苯类天然产品2,14,26,35.
大肠杆菌是天然产品生物合成的首选微生物宿主,因其坚固性、易伸缩性、减少副产品污染的化学复杂性有限以及可用于 DNA 组装和表达的丰富工具优化。根据我们的经验,这里描述的平台非常适合生产高达几百毫克的二烯烯烃和醇的产品产量,适用于许多下游应用,包括这里提出的应用。虽然不符合工业规模,但此处所述的生产平台可以作为进一步途径、宿主和发酵优化的基础,正如已成功地证明相关的二苯酚(如 taxadiene 和 sclareol33)一样 , 34.已成功地建立了速率限制 MVA 或 MEP 通路基因的表达,以克服二苯基苯甲酸盐生物合成的产量限制因素,例如前体供应不足和前体通量进入竞争途径13 32,33,39.虽然在多项研究中证明是成功的,但大肠杆菌中三烯代谢真核P450s和其他膜结合酶的表达和催化活性差是一个可能的限制因子33,39 ,48,49,50,51,52。使用科顿优化的序列和蛋白质修饰,如去除内质视网膜信号肽或引入一个板面信号肽,已被证明有助于增加可溶性P450表达14,38 ,49,50,53.这种修饰也用于玉米CYP71Z1839的微生物共表达,作为本研究的范例途径。所述协议基于每个构造携带一个或两个基因的质粒的使用,所有基因都位于同一诱导启动子之下。在需要大规模基因组合的情况下,建议使用各种可用的多基因盒或基因堆叠系统,以减轻由于使用多种质粒和抗生素而降低转化效率和培养增长的情况 13.
随着遗传学和基因组学资源的广泛普及,植物宿主系统也越来越适合制造天然产品。优点包括植物能够生产所需的天然前体由光合作用,从而使产品形成,而无需补充前体分子54,55。N. 本查米亚纳已广泛用于体内功能表征和组合表达的三苯酮和其他天然产物通路14,35,36,40.使用N. benthamiana作为宿主系统的显著优势包括二苯甲苯前体的内源性生产、使用本地基因序列、简化真核P450s的表达、易于组合基因转化(如瞬态共转化不需要单独的抗生素,并且从叶材料中简单提取目标产品。必要时,可通过共同表达关键MEP通路基因来增强二苯基苯甲苯的产生,以增加前体供应36,41。与液体微生物培养相比,在N.benthamiana中可扩展的二苯并苯生产的限制更为复杂,因为需要产生足够的植物生物量,从化学复杂物中更劳动密集型的产品进行纯化植物组织,以及目标产品的可能不需要的代谢,例如,氧化、糖基化或内源酶的脱磷酶36、43、44、45 ,46,47.然而,通过增加用于农业渗透的植物数量,可以扩大到毫克产品数量56。
此处描述的产品提取和纯化方案与大肠杆菌和N.benthamiana,以及S.cerevisiae和其他植物或微生物宿主系统兼容,并提供一种经济高效的方法,易于在生物和化学实验室建立,不需要昂贵的净化设备。使用分色漏斗提取代谢物非常适合在色谱纯化之前进行高效提取和相分离。漏斗尺寸可以很容易地调整,以允许更大的培养量,并减少从大型培养物中提取所需的实验时间。我们发现,使用己氧/乙酸乙酯梯度是提取不同极性二苯基的理想产物,这里就证明了包括碳氢化合物和含氧化合物的多拉布拉辛组(图3)。根据目标产品的性能,其他溶剂混合物可能具有优势。但是,溶剂不得与水相融合,以确保使用分离漏斗技术成功提取和相分离。此外,在使用这种方法生产挥发性有机化合物(VOC)时,必须考虑蒸发产生的产品损失,例如低分子量单体和分体类化合物以及其他挥发性有机化合物。使用较大规模(±2 L)二氧化硅柱对不同氧化水平的二甲苯的色谱分离对我们的经验有利,因为它提供了改进的产品分离,并最大限度地减少了迭代纯化的需要使用较小的列卷时的步骤。可以根据需要根据所需的培养量和天然产品类型调整列卷和矩阵。使用该协议可实现的目标产品的纯度适用于许多下游应用,如生物活性测定或酶活性分析。然而,当需要更高的纯度时,例如通过NMR进行结构分析,通过使用(半)预置HPLC进行额外的纯化可以有效地提高产品纯度。
此处描述的此协议已针对二苯甲苯基天然产物的生产进行了优化,但也可以轻松定制到相关的单体、分体和三元苯甲酯,以及其他天然产品类别,只需生成所需的酶组合表达式14,57的模块。但是,对于挥度较高的化合物,如单体和分体,或更高的极性和功能修饰,必须考虑产品提取和纯化程序的修改,许多三烯酰胺、苯丙酮和其他天然产物的糖基化。
尽管有工业规模的天然产品制造平台,但此处描述的协议提供了一种价格低廉、可定制的工具,可在大多数实验室轻松设置。正如在这里和其他地方生产玉米多拉布拉辛所所证明的39,使用这种方法可以达到的产品数量和纯度通常足以促进各种下游分析和使用,包括,但不限于各种生物活性研究,分析生物体之间的相互作用,以及用作酶基质或半合成方法的起始材料。
披露声明
作者宣称他们没有相互竞争的经济利益。
致谢
我们感谢鲁本·彼得斯博士(美国伊奥瓦州立大学)提供pIRS和pGGxZmAN2结构。NSF 植物-生物相互作用计划(授予 1758976 到 P.Z.)、DOE 早期职业研究计划(授予# DE-SC0019178 到 P.Z.)、DOE 联合基因组研究所社区科学计划(授予 CSP2568 到 P.Z.))为这项工作提供财政支持研究生研究奖学金计划(到K.M.M.),和加州大学戴维斯分校院长导师奖奖学金(K.M.M.)是感谢感谢。
材料
| Name | Company | Catalog Number | Comments |
| 1020 Trays | Greenhouse Megastore | CN-FLHD | |
| 2-(N-morpholino)ethanesulfonic acid | Sigma | M8250-500g | MES |
| 4" Tech Square Pot | McConkey Wholesale Grower's Supply | JMCTS4 | |
| 5977 Extractor XL MS | Agilent | - | |
| 7890B GC | Agilent | - | |
| Acetonitrile | Sigma | 271004 | |
| Agar | Fisher | BP1423-2 | |
| Bacterial yeast extract | Fisher | BP9727-2 | |
| Beaker | CTechGlass | BK-2001-015B | |
| Cap, 9 mm blue screw, PFTE | Agilent | 5185-5820 | GC vial cap |
| Carbenicillin | Genesee | 25-532 | Carb |
| Chloramphenicol | Fisher | 50247423 | Chlor |
| Chromatography column | CTechGlass | CL-0015-022 | |
| Clear humidity dome | Greenhouse Megastore | CN-DOME | |
| ColiRollers Plating Beads | Sigma | 71013 | Glass beads |
| CoorsTek Porcelain Mortars | Fisher | 12-961A | mortar |
| CoorsTek Porcelain Pestles | Fisher | 12-961-5A | pestle |
| Delta-Aminolevulinic acid hydrochloride | Sigma | 50981039 | Aminoleuvolinic acid |
| Ethanol | Fisher | A962-4 | EtOH |
| Ethyl acetate | Fisher | E1454 | |
| Falcon 50 mL Conical Centrifuge Tubes | Fisher | 14-432-22 | Falcon tubes |
| Fisherbrand Disposable Cuvettes | Fisher | 14-955-127 | cuvette |
| Fisherbrand Petri Dishes with Clear Lid | Fisher | FB0875713 | petri dish |
| Fisherbrand Polypropylene Microtube Storage Racks | Fisher | 05-541 | microtube rack |
| Glucose | Sigma | G7021 | |
| Glycerol | Fisher | G33-500 | |
| Hexanes | Fisher | H292-4 (CS) | |
| HP-5MS | Agilent | 19091S-433 | GC column |
| Inlet adapter | CTechGlass | AD-0006-003 | glass inlet adapter |
| Isopropyl β-D-1-thiogalactopyranoside | Fisher | BP1755-100 | IPTG |
| Kanamycin | Fisher | BP9065 | Kan |
| KIM-KAP Caps, Disposable, Polypropylene, Kimble Chase | VWR | 60825-798 | breathable test tube lids |
| Magnesium chloride | Acros | 223210010 | MgCl2 |
| Magnesium sulfate | Sigma | M7506-500g | MgSO4 |
| Miracle-Gro Water Soluble All Purpose Plant Food | Miracle-Gro | 2756810 | |
| Mixer Mill MM 200 | Retsch | 20.746.0001 | tissue mill |
| Nalgene Fernbach culture flask | Sigma | Z360236 | 2.8 L flask |
| New Brunswick I26 | Eppendorf | M1324-0000 | Shaking incubator |
| Nicotiana benthamiana seed | USDA Germplasm Repository | Accession TW16 | N. benthamiana |
| OverExpress C41(DE3) Chemically Competent Cells | Lucigen | 60442 | C41-DE3 cells |
| Parafilm M wrapping film | Fisher | S37440 | Parafilm |
| Potassium chloride | Sigma | P-9541 | KCl |
| Potassium phosphate dibasic anhydrous | Fisher | P288-3 | Dipotassium phosphate |
| Potassium phosphate monobasic | Monopotassium phosphate | ||
| Pyrex disposable culture tubes, rimless | Sigma | CLS9944516 | test tubes |
| Pyruvate Acid Sodium Salt | Fisher | 501368477 | Sodium pyruvate |
| Retort Ring Stands | CTechGlass | ST00 | ring stand |
| Riboflavin | Amresco | 0744-250g | |
| Rifampicin | Sigma | R7382 | Rif |
| Rotovap | |||
| Sand, 50-70 mesh particle size | Sigma | 274739-1KG | |
| Silica | Fisher | AC241660010 | silica gel |
| Sodium chloride | Fisher | 5271-3 | NaCl |
| Sodum hydroxide | Fisher | SS266-1 | NaOH |
| Spectinomycin | Fisher | 501368607 | Spec |
| Squibb Separatory Funnel | CTechGlass | FN-1060-006 | Separatory funnel |
| Sunshine Mix #1 | Sungro Horticulture | Potting soil | |
| Thermo Scientific Snap Cap Low Retention Microcentrifuge Tubes | Fisher | 21-402-902 | microtube |
| Triangle funnel | CTechGlass | FN-0035 | funnel |
| Tryptone | Fisher | BP14212 | |
| Vial, screw, 2 mL, amber, WrtOn | Agilent | 5182-0716 | GC vial |
| visible spectrophotometer, V-1200 | VWR | 634-6000P | spectrophotometer |
| ZORBAX Eclipse XDB-C18 | Agilent | 990967-202 | HPLC column |
| ZORBAX Eclipse XDB-CN | Agilent | 990967-905 | HPLC column |
参考文献
- Peters, R. J. Two rings in them all: the labdane-related diterpenoids. Natural Product Reports. 27 (11), 1521-1530 (2010).
- Zerbe, P., Bohlmann, J. Plant diterpene synthases: exploring modularity and metabolic diversity for bioengineering. Trends in Biotechnology. 33 (7), 419-428 (2015).
- Toyomasu, T. Recent advances regarding diterpene cyclase genes in higher plants and fungi. Bioscience, Biotechnology, and Biochemistry. 72 (5), 1168-1175 (2008).
- Smanski, M. J., Peterson, R. M., Huang, S. X., Shen, B. Bacterial diterpene synthases: new opportunities for mechanistic enzymology and engineered biosynthesis. Current Opinion in Chemical Biology. 16 (1-2), 132-141 (2012).
- Salazar-Cerezo, S., Martinez-Montiel, N., Garcia-Sanchez, J., Perez, Y. T. R., Martinez-Contreras, R. D. Gibberellin biosynthesis and metabolism: A convergent route for plants, fungi and bacteria. Microbiological Research. 208, 85-98 (2018).
- Keeling, C. I., Bohlmann, J. Diterpene resin acids in conifers. Phytochemistry. 67 (22), 2415-2423 (2006).
- Schmelz, E. A., et al. Biosynthesis, elicitation and roles of monocot terpenoid phytoalexins. Plant Journal. 79 (4), 659-678 (2014).
- Bohlmann, J., Keeling, C. I. Terpenoid biomaterials. Plant Journal. 54 (4), 656-669 (2008).
- Mafu, S., Zerbe, P. Plant diterpenoid metabolism for manufacturing the biopharmaceuticals of tomorrow: prospects and challenges. Phytochemistry Reviews. 17 (1), 113-130 (2017).
- Hillwig, M. L., Mann, F. M., Peters, R. J. Diterpenoid biopolymers: new directions for renewable materials engineering. Biopolymers. 95 (2), 71-76 (2011).
- Jorgensen, L., et al. 14-step synthesis of (+)-ingenol from (+)-3-carene. Science. 341 (6148), 878-882 (2013).
- Line, N. J., Burns, A. C., Butler, S. C., Casbohm, J., Forsyth, C. J. Total Synthesis of (-)-Salvinorin A. Chemistry. 22 (50), 17983-17986 (2016).
- Morrone, D., et al. Increasing diterpene yield with a modular metabolic engineering system in E. coli: comparison of MEV and MEP isoprenoid precursor pathway engineering. Applied Microbioly and Biotechnology. 85 (6), 1893-1906 (2010).
- Kitaoka, N., Lu, X., Yang, B., Peters, R. J. The application of synthetic biology to elucidation of plant mono-, sesqui-, and diterpenoid metabolism. Molecular Plant. 8 (1), 6-16 (2015).
- George, K. W., et al. Metabolic engineering for the high-yield production of isoprenoid-based C(5) alcohols in E. coli. Scientific Reports. 5, 11128(2015).
- Paddon, C. J., Keasling, J. D. Semi-synthetic artemisinin: a model for the use of synthetic biology in pharmaceutical development. Nature Reviews Microbiology. 12 (5), 355-367 (2014).
- Keasling, J. D. Synthetic biology and the development of tools for metabolic engineering. Metabolic Engineering. 14 (3), 189-195 (2012).
- Kampranis, S. C., Makris, A. M. Developing a yeast cell factory for the production of terpenoids. Computational and Structural Biotechnology Journal. 3 (4), e201210006(2012).
- Tholl, D. Biosynthesis and biological functions of terpenoids in plants. Advances in Biochemical Engineering/Biotechnology. 148, 63-106 (2015).
- McGarvey, D. J., Croteau, R. Terpenoid metabolism. The Plant Cell. 7 (7), 1015-1026 (1995).
- Chen, F., Tholl, D., Bohlmann, J., Pichersky, E. The family of terpene synthases in plants: a mid-size family of genes for specialized metabolism that is highly diversified throughout the kingdom. The Plant Journal. 66 (1), 212-229 (2011).
- Pateraki, I., Heskes, A. M., Hamberger, B. Cytochromes P450 for terpene functionalisation and metabolic engineering. Advances in Biochemical Engineering/Biotechnology. 148, 107-139 (2015).
- Cao, R., et al. Diterpene cyclases and the nature of the isoprene fold. Proteins. 78 (11), 2417-2432 (2010).
- Reiling, K. K., et al. Mono and diterpene production in Escherichia coli. Biotechnology and Bioengineering. 87 (2), 200-212 (2004).
- Hamberger, B., Plant Bak, S. P450s as versatile drivers for evolution of species-specific chemical diversity. Philosophical Transactions of the Royal Society B: Biological Sciences. 368 (1612), 20120426(2013).
- Jia, M., Potter, K. C., Peters, R. J. Extreme promiscuity of a bacterial and a plant diterpene synthase enables combinatorial biosynthesis. Metabolic Engineering. 37, 24-34 (2016).
- Paddon, C. J., et al. High-level semi-synthetic production of the potent antimalarial artemisinin. Nature. 496 (7446), 528-532 (2013).
- Peralta-Yahya, P. P., Zhang, F., del Cardayre, S. B., Keasling, J. D. Microbial engineering for the production of advanced biofuels. Nature. 488 (7411), 320-328 (2012).
- Pateraki, I., et al. Total biosynthesis of the cyclic AMP booster forskolin from Coleus forskohlii. Elife. 6, e23001(2017).
- Ignea, C., et al. Carnosic acid biosynthesis elucidated by a synthetic biology platform. Proceedings of the National Academy of Sciences of the United States of America. 113 (13), 3681-3686 (2016).
- Ignea, C., et al. Reconstructing the chemical diversity of labdane-type diterpene biosynthesis in yeast. Metabolic Engineering. 28, 91-103 (2015).
- Cyr, A., Wilderman, P. R., Determan, M., Peters, R. J. A modular approach for facile biosynthesis of labdane-related diterpenes. Journal of the American Chemical Society. 129 (21), 6684-6685 (2007).
- Ajikumar, P. K., et al. Isoprenoid pathway optimization for Taxol precursor overproduction in Escherichia coli. Science. 330 (6000), 70-74 (2010).
- Schalk, M., et al. Toward a biosynthetic route to sclareol and amber odorants. Journal of the American Chemical Society. 134 (46), 18900-18903 (2012).
- Andersen-Ranberg, J., et al. Expanding the Landscape of Diterpene Structural Diversity through Stereochemically Controlled Combinatorial Biosynthesis. Angewandte Chemie International Edition in English. 55 (6), 2142-2146 (2016).
- Bruckner, K., Tissier, A. High-level diterpene production by transient expression in Nicotiana benthamiana. Plant Methods. 9 (1), 46(2013).
- Emanuelsson, O., Brunak, S., von Heijne, G., Nielsen, H. Locating proteins in the cell using TargetP, SignalP and related tools. Nature Protocols. 2 (4), 953-971 (2007).
- Hausjell, J., Halbwirth, H., Spadiut, O. Recombinant production of eukaryotic cytochrome P450s in microbial cell factories. Bioscience Reports. 38 (2), BSR20171290(2018).
- Mafu, S., et al. Discovery, biosynthesis and stress-related accumulation of dolabradiene-derived defenses in maize. Plant Physiology. 176 (4), 2677-2690 (2018).
- Zerbe, P., et al. Gene discovery of modular diterpene metabolism in nonmodel systems. Plant Physiology. 162 (2), 1073-1091 (2013).
- Bach, S. S., et al. High-throughput testing of terpenoid biosynthesis candidate genes using transient expression in Nicotiana benthamiana. Methods in Molecular Biology. , 245-255 (2014).
- Sainsbury, F., Thuenemann, E. C., Lomonossoff, G. P. pEAQ: versatile expression vectors for easy and quick transient expression of heterologous proteins in plants. Plant Biotechnology Journal. 7 (7), 682-693 (2009).
- Wang, B., et al. Transient production of artemisinin in Nicotiana benthamiana is boosted by a specific lipid transfer protein from A. annua. Metabolic Engineering. 38, 159-169 (2016).
- Reed, J., Osbourn, A. Engineering terpenoid production through transient expression in Nicotiana benthamiana. Plant Cell Reports. 37 (10), 1431-1441 (2018).
- Dong, L., Jongedijk, E., Bouwmeester, H., Der Krol, A. V. an Monoterpene biosynthesis potential of plant subcellular compartments. New Phytologist. 209 (2), 679-690 (2016).
- Liu, Q., et al. Reconstitution of the costunolide biosynthetic pathway in yeast and Nicotiana benthamiana. PLoS One. 6 (8), e23255(2011).
- Karunanithi, P. S., et al. Functional characterization of the cytochrome P450 monooxygenase CYP71AU87 indicates a role in marrubiin biosynthesis in the medicinal plant Marrubium vulgare. BMC Plant Biology. 19 (1), 114(2019).
- Pelot, K., et al. Functional diversity of diterpene synthases in the biofuel crop switchgrass. Plant Physiology. 178 (1), 54-71 (2018).
- Wang, Q., Hillwig, M. L., Wu, Y., Peters, R. J. CYP701A8: a rice ent-kaurene oxidase paralog diverted to more specialized diterpenoid metabolism. Plant Physiology. 158 (3), 1418-1425 (2012).
- Wang, Q., Hillwig, M. L., Peters, R. J. CYP99A3: functional identification of a diterpene oxidase from the momilactone biosynthetic gene cluster in rice. The Plant Journal. 65 (1), 87-95 (2011).
- Morrone, D., Chen, X., Coates, R. M., Peters, R. J. Characterization of the kaurene oxidase CYP701A3, a multifunctional cytochrome P450 from gibberellin biosynthesis. Biochemical Journal. 431 (3), 337-344 (2010).
- Swaminathan, S., Morrone, D., Wang, Q., Fulton, D. B., Peters, R. J. CYP76M7 is an ent-cassadiene C11alpha-hydroxylase defining a second multifunctional diterpenoid biosynthetic gene cluster in rice. The Plant Cell. 21 (10), 3315-3325 (2009).
- Gnanasekaran, T., et al. Heterologous expression of the isopimaric acid pathway in Nicotiana benthamiana and the effect of N-terminal modifications of the involved cytochrome P450 enzyme. Journal of Biological Engineering. 9 (1), 24(2015).
- De Luca, V., Salim, V., Atsumi, S. M., Yu, F. Mining the biodiversity of plants: a revolution in the making. Science. 336 (6089), 1658-1661 (2012).
- Wurtzel, E. T., Kutchan, T. M. Plant metabolism, the diverse chemistry set of the future. Science. 353 (6305), 1232-1236 (2016).
- Menon, A., et al. Mobile-based insulin dose adjustment for type 2 diabetes in community and rural populations: study protocol for a pilot randomized controlled trial. Therapeutic Advances in Endocrinology and Metabolism. 10, 2042018819836647(2019).
- Moses, T., et al. OSC2 and CYP716A14v2 catalyze the biosynthesis of triterpenoids for the cuticle of aerial organs of Artemisia annua. The Plant Cell. 27 (1), 286-301 (2015).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。