Method Article
使用波动测定测量微生物突变率
摘要
在这里,提出了一个协议,以执行波动测定,并使用型言标记估计微生物突变率。该协议将使研究人员能够检测不同微生物和环境的突变,确定基因型和生态环境如何影响自发突变率。
摘要
波动测定广泛用于估计液体环境中生长的微生物的突变率。许多培养物都接种了几千个细胞,每个细胞对一个选择性标记敏感,这个标记可以典型地被测定。这些平行文化在没有特征标记的情况下生长了许多代。培养的子集用于估计有突变风险的细胞总数(即生长期结束时的人口大小,或Nt)。其余的培养物被镀在选择性琼脂上。然后,使用数学模型估计突变事件的预期数量m。 将m除以Nt可估计每代位点突变率。测定有三个关键方面:选择的表型标记,选择的平行培养物体积,并确保选择性琼脂的表面在孵育前完全干燥。检测费用相对便宜,只需要标准实验室设备。它也比替代方法(如突变积累和单细胞测定)更费力。这种测定对能快速经历几代人的生物体有效,它取决于对标记和细胞死亡的适宜效应的假设。然而,最近开发的工具和理论研究意味着这些问题现在可以分析解决。该测定允许对不同基因型在单独或社区中生长的细胞中不同型型标记物的突变率估计。通过并行进行多重检测,分析可用于研究生物体的环境环境如何影响自发突变率,这对了解抗微生物药物耐药性、致癌性、老化和进化至关重要。
引言
1901年,荷兰植物学家雨果·德·弗里斯(HugodeVries)用"突变1"这个词。二十六年后,当赫尔曼·约瑟夫·穆勒发现X射线2的诱变作用时,突变已经被认为是进化的动力之一。然而,突变的性质尚不清楚。为了回答突变是自发出现(即自发突变)还是对选择(即诱导突变)的反应这一基本问题,需要一种方法来观察突变事件。这种方法将测量每个细胞分裂或已经被称为突变率3,4的预期突变数。
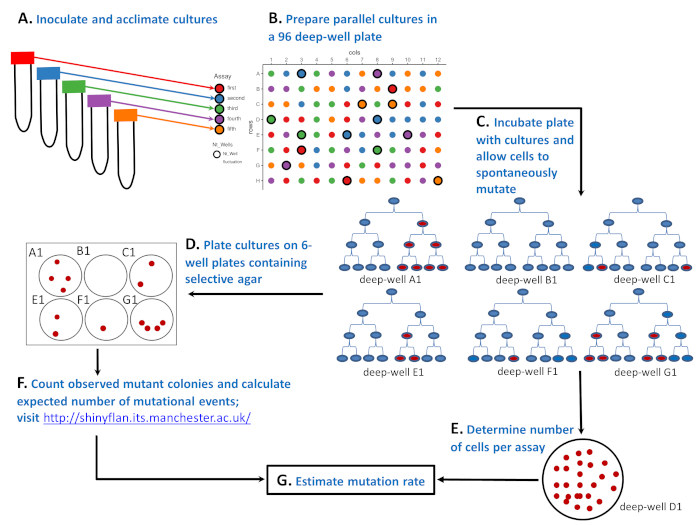
图1:96深井板中微生物应变如何进行波动测定的原理图。(A) 在包含五种不同环境("红色"、蓝色、"绿色","紫色"和"橙色"检测)的 50 mL 管中接种和适应细胞。(B) 在96深井板中用少量敏感细胞制备平行培养物。"红色"检测具有 20 种平行区域性,而"蓝色""绿色""紫色"和"橙色"检测均具有 19 种平行区域性。96深井板上平行培养物的位置是随机的。可以使用辅助布局生成器.R 脚本或其他工具进行随机化。右上角的布局是随机化结果。(C) 孵育96深井板,使细胞分裂并自发变异.来自深井 A1、B1、C1、E1、F1 和 G1 的六种培养物显示了突变体的数量如何波动:第三细胞分裂后分别为 4、0、2、2、1 和 4 个红细胞。突变体的数量不同,不仅因为自发突变的数量不同(如第一个红细胞所示为0、1或2),还因为在培养周期中,当电阻突变自发出现(细胞分裂1、2或3)时,这很重要。(D) 96深井板孵育后,突变体的数量由电镀81个平行培养物决定。在布局上,这些是没有粗体边的圆圈。整个平行培养物镀在含有选择性琼脂的6孔板的一口井上。(E) 其余15种培养物被稀释,并镀在非选择性琼脂上,以确定细胞的平均数量(Nt)。在布局上,这些标记为 Ntwells,并带有粗体边缘。对于每个测定N t在三个平行区域性上求平均值。右下角是一个培养皿,含有非选择性琼脂板,含有25个稀释培养物,生长在深井D1("绿色"测定的一部分)。(F) 选择性6孔板孵育后,计算观察到的突变体数量,并使用最大可能性估计器估计预期突变事件数m。(G) 知道突变数、m和每个测定的细胞数 N t,突变率估计为m/Nt。请点击此处查看此图的较大版本。
1943年,萨尔瓦多·卢里亚和马克斯·德尔布吕克用波动测定5为这一问题提供了一个巧妙的解决方案(见图1)。测定从由少量微生物细胞启动的多个种群(称为平行培养物)开始(图1A,B)。在良性、非选择性环境中生长后(图1C),平行培养物在含有选择性标记(噬菌体、抗生素等)的板上转移,只有具有抗药性突变的细胞存活并产生菌群(图1D)。主要期望是,如果诱导了抗药性突变,携带突变的细胞数量应分布在不同群体,均值等于方差。Luria和Delbrück在波动测定中发现,突变体的数量波动很大,不同种群的突变数差异远远大于平均值。卢里亚和德尔布吕克因此证明突变是自发的。他们发现,只要DNA被复制,突变就会自发地出现,突变的数量取决于突变在种群增长期间发生的时间。参见图1C,其中6个种群,每个以微生物细胞(蓝色)启动,没有经历,1个或2个单个突变。群体A1、E1和F1经历了一次突变(第一个红细胞),但由于在培养周期的不同时间点自发出现单个突变,种群最终观察到的突变数非常不同(分别为4个、2个和1个)。另一方面,尽管经历了两个突变事件而不是一个突变事件,但种群C1和G1最终观察到的突变数与E1和A1相同。种群中观察到的突变体的波动不仅给测定提供了名称,而且表明突变频率(即突变细胞的比例)是突变率的一个不充分的指标。
波动测定的总体目标是估计在特定液体环境中生长的细菌或其他单细胞生物体的自发突变率。波动测定仍然是研究微生物突变率环境依存性的最适当工具,允许快速、廉价的突变率估计。突变率估计的替代方法,如最大深度测序6、种群测序7、突变累积实验8,或将后代的基因组序列与父母9的基因组序列进行比较,都更加费力,因此不适合潜在地检测环境依赖性。然而,突变的生成和修复的动态方面基本上无法访问波动测定或上面列出的任何测定突变率的方法。为了研究突变的数量在时间、空间或种群中单个细胞之间如何变化,单个细胞接近11,12是必要的,除了比波动分析更费力之外,还需要高度专业化的技能和设备。
在实践中,波动测定是计数细胞获得一个型状标记,由于突变发生在缺乏选择该标记的环境。对数百份已发表的测定10的荟萃分析表明,自1943年测定结果开始以来,至少使用了39种不同的型型标记。波动测定可用于比较实验室、临床、非突变和突变菌株在宽松环境中生长的突变率的平均值和环境依存度。该测定允许在在最小或富于环境中生长的具有不同遗传背景的细胞中进行突变率估计。该测定不仅适用于作为单一培养种生长的种群,还可用于研究细胞-细胞相互作用对突变率的影响11。当感兴趣的菌株与第二个菌株共培养,并且中性标记用于区分菌株时,可以同时对同一管中的两个菌株进行突变率测定。
波动测定表明,自发突变率取决于细胞的基因型及其环境12,是自身进化的一种特征。每当一个特定基因型的突变率随环境变化时,它被描述为突变率可塑性11。塑料突变率已经最彻底地解决了应力引起的诱变(SIM)14。此外,使用波动测定法,最近已经表明,细胞群的生长密度(通常是承载能力的批量培养物)与细菌和单细胞真核生物之间的突变率密切相关。每代基因组的突变率在密集种群中减少多达23倍10,11。这种密度相关的突变率可塑性(DAMP)可以依赖于仲裁感应系统15,并独立于SIM16运行。
这里,提出了用于研究大肠杆菌菌株K-12在葡萄糖最小介质环境中对抗生素利福平产生抗药性的波动测定的详细方案。然而,该协议应该被看作是一个基本模板,它可以通过简单地修改突变的培养条件和型型标记来研究各种各样的微生物。该协议从最初的第5、17、18、19、20、21、22、23、24、25、26、27、28、29,通过它用于各种微生物甚至癌细胞30而演变而来,并经过修改以增加吞吐量,这对于正确测试微生物突变率10、11、16的环境依赖性至关重要。本文所述的协议并不涵盖文献中已经充分讨论过的波动测定的所有方法和分析问题,特别是抗性突变31、表型延迟32、细胞死亡33的适宜性,以及可用于估计突变率26、34的各种算法的适用性。这一点很重要,例如,当环境依赖的健身效应可能导致错误变异的突变率估计35。然而,我们注意到,我们在这里使用的分析工具可以处理突变体适应性和细胞死亡的变化。如笔记和讨论所述,还建议考虑不太可能具有同样环境相关健身效果的多个型型标记。该协议将使人们能够定期检测微生物菌株和环境多样性中突变率的环境依赖性。测定不同环境中的突变尚未得到彻底测试,一旦考虑种群密度,波动测定可以给出更精确的突变率10估计值。该协议将允许进行更多的波动测定,这是理解突变率机制所必需的,而突变率又对了解进化、致癌、老化和抗微生物药物耐药性至关重要。
研究方案
1. 第1天:文化接种和适应
- 用大肠杆菌MG1655甘油(18%甘油,-80°C)的冰块接种3 mL的液体液化溴(LB,见补充表1)。在 37°C 下,在 120 rpm 下摇动 LB 培养基,以 ±7 小时的速度摇动。
注:在这个实验中,使用大肠杆菌K12 MG1655生长在LB中,但这种测定可用于任何大肠杆菌菌株或任何其他可培养的微生物物种。生长培养的孵育温度、孵育时间和营养水平可能都会因物种或菌株的变化而变化。 - 使用盐水溶液稀释培养液 2,000 倍。将100 μL的稀释溶液加入三个50 mL螺帽锥形底部聚合物管(50 mL管),其中含有10 mL的液体戴维斯最小介质(DM,见补充表1),分别含有80mg/L、125 mg/L或250 mg/L葡萄糖。这是相同的介质(即环境),在其中将估计突变率。在 37°C 下以 120 rpm 的转速摇动培养物。
注:介质的选择取决于物种、菌株或研究问题的变化。
2. 第2天:平行文化中突变的产生
- 首先,准备培养细菌的环境。始终准备超过所需值 10%的培养物(即 20 1 ml 培养物需要 22 mL)。制备 22 mL 1) DM 与 80 毫克/升葡萄糖, 2) DM 与 125 毫克/升葡萄糖, 3) DM 与 250 毫克/升葡萄糖, 4) DM 与 80 毫克/升葡萄糖, 5) DM 与 250 毫克/升葡萄糖在五个 50 mL 管.分别标为GLC-80A、GLC-125、GLC-250A、GLC-80B和GLC-250B。
- 为环境准备接种。确保环境 1 mL 的接种包含 1,000-5,000 个细胞。按照以下步骤操作。
- 测量 600 nm 处隔夜培养物(从步骤 1.2 起)的光密度 (OD)。
- 稀释每个隔夜培养,以达到每mLDM与葡萄糖1,000-5,000细胞的最终密度。在我们手中,如果 2.2.1 中测得的 OD 为 0.3,这意味着对隔夜培养物进行 100 倍稀释(盐溶液),然后将此溶液的 11μl 添加到 22 mL 环境中。
- 准备并行区域性。
注:本协议为一个96深井板编写,使用三种环境执行五个波动测定(一个96孔板上的最大合理值)。根据经验,多个深井板可以并行运行。- 为一个 96 深井板创建并行区域性的随机布局。补充 R 脚本布局生成器.R(参见图1B中的布局)可用于此。根据布局将每个平行培养层放置在 96 深井板上。
注:运行 Layoutgenerator.R 将确保第一个检测具有 20 个并行区域性,并且第二个、第三个、第四个和第五个检测具有 19 个并行区域性。 - 根据随机布局,将 1 mL 的接种介质转移到 96 深孔板的每个孔中。
- 用胶带固定深井板的盖子。不要把盖子紧紧地固定好,因为文化生长对曝气量很敏感。
- 用盖子和胶带称量整个板,并在 250 rpm 转速下摇动板,在 37°C 下摇动板 24 小时。将2L蒸馏水放入培养箱,以稳定实验组之间的蒸发量。
- 为一个 96 深井板创建并行区域性的随机布局。补充 R 脚本布局生成器.R(参见图1B中的布局)可用于此。根据布局将每个平行培养层放置在 96 深井板上。
- 通过在非选择性四氧化二氮 (TA) 琼脂板上电镀每个接种介质的 10 μL 确定接种量(参见补充表 1)。使用无菌 L 形扩张器,直到琼脂表面干燥。孵育TA琼脂板在37°C下过夜。
注:TA琼脂是一种丰富的琼脂,含有糖L-阿拉伯基诺和水溶性染料2,3,5-三苯丙二氧化硅,这是无色的氧化形式。当细菌减少染料时,它会因福马赞的形成而变红。TA琼脂上的殖民地不能利用L-阿拉伯糖是深红色的。其他菌株,如MG1655,是粉红色的。建议使用 TA 琼脂而不是标准 LB 琼脂,因为彩色细菌菌落更容易发现,这使得菌落计数更可靠、更快。 - 在6个孔板中制备含有瑞法平的选择性TA琼脂。将选择性TA琼脂5mL移液器放入6个孔板的每口井中。在添加到TA琼脂之前,准备抗生素瑞法平。
注:当使用环丙氨酸作为标记时,使用戴维斯最小介质,250 mg/L葡萄糖辅以琼脂和L-阿拉伯糖和2,3,5-三氯甲酰三氯甲酰三甲作为选择性琼脂。也就是说,TA琼脂不只选择对环丙氨酸具有抗药性的细胞,因为胰锥酮和酵母提取物(TA琼脂的基本成分)含有氨基酸D-丙氨酸。这种氨基酸对抗环素的抗菌作用,并允许所有细胞组成一个菌落。- 在室温下将选择性板和剩余非选择性板放在黑暗中(例如,放在盒子里)。
3. 第3天:选择性和非选择性琼脂板上的电镀培养物
- 在非选择性琼脂板上计算菌群形成单位(CFU),并通过将CFU乘以100来确定接种的大小。这是平行培养的体积(1 mL = 1,000 μL)和镀层体积(10 μL)之间的比率。
注:如果储存非选择性板冷藏,CFU 可以稍后计数。 - 孵育24小时后,称量整个深井板,以确定蒸发量。这一点可能在10%左右。
- 使用起始体积V[0h] = 1,000 μl 计算微升孵育后 24 小时孵育(V[24h]) 的平均体积,并将板的重量转换为微升,其中生长培养基的密度以 mg/μl 为单位进行测量。本研究使用1mg/μl的密度:
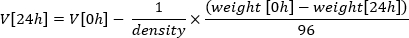
- 将每个测定随机选择的三种培养物(共 15 个,在图 1B的布局中用黑色圆圈突出显示)转移到标记的微离心管中。将它们放在长凳上供以后使用(参见步骤 3.6)以确定最终总体大小(或 N t)。
-
将剩余的81种平行培养物从深井板盘到含有瑞法平的选择性TA琼脂。移液器一个完整的平行培养从96深井板到一口6孔板。确保任何 6 孔板包含来自多个波动测定的平行培养物。
- 从选择性琼脂板上取下盖子,在无菌条件下保持无盖。干燥选择性 TA 琼脂表面的所有液体。
注:完全干燥的琼脂至关重要。但是,不要过度干燥选择性 TA 琼脂,因为它不能允许开裂。
- 从选择性琼脂板上取下盖子,在无菌条件下保持无盖。干燥选择性 TA 琼脂表面的所有液体。
-
当选择性 TA 琼脂板干燥时,可能需要几个小时,使用菌群形成单元 (CFU) 确定步骤 3.4 中制备的 15 种培养物中的Nt。
- 通过稀释微离心管的培养物来确定CFU。使用五个 10 倍稀释步骤,将 900 μL 的盐溶液混合和涡旋,每步使用 100 μL 的培养液。板40μL的最后稀释(稀释系数105)在非选择性TA琼脂和孵育板盖过夜在37°C。
注:96孔板的稀释系列可使用多通道移液器进行,可提高该步骤的速度。
- 通过稀释微离心管的培养物来确定CFU。使用五个 10 倍稀释步骤,将 900 μL 的盐溶液混合和涡旋,每步使用 100 μL 的培养液。板40μL的最后稀释(稀释系数105)在非选择性TA琼脂和孵育板盖过夜在37°C。
- 一旦 6 孔板上的所有孔没有培养液,将盖子放回,将 6 个孔板盖放在长凳上,直到所有 6 个孔板都干燥。一旦全部干燥,在37°C下孵育板盖44-48小时。
注:对于其他标记物(纳利迪克辛、环状、湿霉素 B 或 5-FOA)孵育板 68-72 小时。确保培养箱中的湿度高。在潜伏期,选择性琼脂板不要干燥,这一点至关重要。
4. 第4天:确定培养物中细胞的数量
- 计算非选择性琼脂板上的 CFU。通过将 CFU 与稀释系数 (105) 相乘,并在微升中计算的平均体积V[24h] (参见步骤 3.3) 和镀值体积 (40 μl) 之间的比率,估计培养基中的活细胞数:
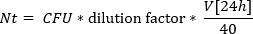
- 在特定环境中生长的特定基因型的Nt是来自三种培养物的这些值的平均值。
5. 第5天:突变率估计
-
计算选择性TA琼脂板上对抗生素有抗药性的菌落数量(即,第2天第2⁄3天通过深井板自发突变而产生耐药细胞的数量)。记录特定测定的观察到的突变数的平行培养体之间的分布(例如,16 或 17 个值,包括零计数)。
注:如果冷冻储存选择性板,对抗生素有抗药性的菌落可以稍后计数。- 使用每个分布来估计突变事件 m的数量,使用 R-package flan36。
注:也有具有类似功能的R-packagersalvador29。 - 将文本文件中一个测定的观测突变体的分布保存为单个列。
- 使用每个分布来估计突变事件 m的数量,使用 R-package flan36。
-
使用 Shinyflan 软件 (http://shinyflan.its.manchester.ac.uk/) 来估计m,详情如下。
- 在选项卡假设测试将值保留为默认值(即,未知健身勾选、估计方法= 最大可能性 (ML)、突变寿命分布= 指数 (LD 模型)、Winsor参数= 1,024、突变数和适宜性= 1、置信度 = 0.95、类数和最大值= 100)。
- 单击"浏览"并选择具有观察突变体分布的文本文件。首先尝试使用补充数据文件。
- 上传文件后,单击"执行测试"。在测试结果的右侧,在一个样本 ML 测试(LD 模型) 下,找到突变编号。这是m,突变事件的预期数量。
- 在突变数的 95% 置信区间下,找到m的上限和下限。
- 一旦m和Nt(由 CFU 确定)可用,估计特定环境中特定基因型的突变
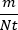 率为 。以相同的方式将m上的上限和下限除以Nt,以生成突变率的置信区间(NB 这不包括Nt中的不确定性)。
率为 。以相同的方式将m上的上限和下限除以Nt,以生成突变率的置信区间(NB 这不包括Nt中的不确定性)。
注:结果以每代rpoB位点的突变率表示。每个碱基对的突变率是通过将每个rpoB位点的突变率除以79而生成的,这是我们目前对rpoB基因中有多少点突变对rifampicin37产生抗药性的知识。将每个核苷酸的突变率乘以染色体的大小(大肠杆菌K-12 MG1655 = 4,639,675 bp),给出每个基因组的突变率。 - 重复步骤 5.1_5.3 与其余四个波动测定。
结果
结果由三个不同的研究人员在四个不同的星期内用报告的协议收集,每周使用96孔板生成五个突变率估计值。在大肠杆菌K-12 MG1655(图2A,如协议中使用的图2A),共生成了15个突变率估计值(±95%置信区间,CI),而一个96深井板用于大肠杆菌K-12 BW25113 +突变突变的5个估计值(±95%CI)。在图 2中,估计m的四分位数范围的中位精度为 17.5%(1.00%-28.9%,n = 20)。精度是突变事件(m) 的预期数量变化系数,计算为+m / m x 100%(其中=计算,如前38 所示)。图 2的原始数据在补充数据文件"Krasovec_etal_JoVE_data.csv"中可用。补充数据文件附带一个R脚本来生成图2。有关细菌菌株的更多详细信息,请参阅补充表 2,以及补充表 3,其中解释了数据文件中的列。使用利福平和纳利迪克西酸获得的数据点以前在Kraéovec等人10上发表,并且与首次出版时一样具有同样的置点。
在图2A中,给出了三种不同型型标志物的MG1655突变率,即环状物、利弗霉素和纳利迪克酸。在这里,在戴维斯最小介质中评估突变率,其中80、125和250mg/L的葡萄糖,如协议所述。在一个案例中,使用了1,000毫克/升葡萄糖(图1B)。在实践中,可以使用任何初始葡萄糖浓度。不出所料,环素抗突变率较高,纳利迪克西酸抗性最低,利福平耐药率处于中间。这符合这三种电阻的已知目标大小,其中最大的是环素,最小的是纳利迪克酸。讨论和图3详细介绍了如何利用环境中的目标大小、平行培养物量和营养物质水平,以利用波动测定优化微生物突变率的测量。
波动测定清楚显示哪个菌株是构成突变器,具有正常突变率。αT菌株的突变率比MG1655(图2A)高约50倍,对纳利迪克酸的抗性(图2B)。但是,为了确定特定基因型在不同环境中的突变率,建议仅使用一个型型标记,每个环境至少进行五个基因型复制。有关以前用于分析此类实验的统计方法的详细概述,请参阅 Kra_ovec 等人10中的补充信息。
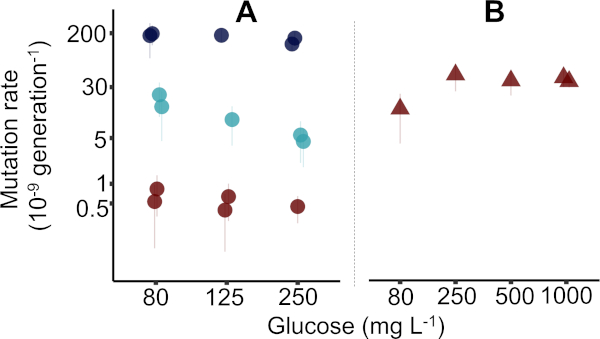
图2:大肠杆菌种群波动测定估计的突变率代表性图。(A) 野生类型 MG1655(圆圈)中报告的协议确定的突变率。图中显示了利法平(浅蓝色圆圈)、纳利迪克酸(红圈)和环素(深蓝色圆圈)抗性存在的突变率。对于纳利迪克酸,使用 10 mL 的较大培养体积(参见补充数据文件)。利福平和纳利迪克西酸的数据从Kraíovec等人10中的图2a重新绘制。(B) Keio39 μmutT突变突变(红色三角形)中纳利迪克酸抗的突变率。注意突变率轴上的对数刻度。错误柱 = 95% 置信区间,如协议中所述。数据从 Kra_ovec 等人10中的图 4a重新绘制。请点击此处查看此图的较大版本。
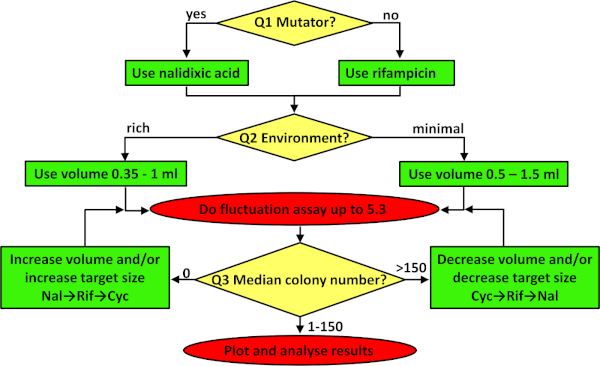
图 3:用于对波动测定进行故障排除的流程图。流程图将从顶部依次遵循,依次解决黄色钻石中的三个问题,根据生成的绿色框的内容调整协议,并实现红色椭圆中指示的协议。有关如何排除故障的更多详细信息,请参阅讨论的前三段。请点击此处查看此图的较大版本。
补充表1:协议中使用的介质公式。请点击此处查看此表(右键单击下载)。
补充表2:细菌菌株。请点击此处查看此表(右键单击下载)。
补充表 3:原始数据文件中列Krasovec_etal_JoVE_data.csv 的详细说明。请点击此处查看此表(右键单击下载)。
补充数据文件。请点击此处下载这些文件。
讨论
任何突变率的估计都需要最大化所实现的精度,以确保研究34内和之间可重复性和可重复性。对于波动测定,有三个关键的考虑因素。前两个已在给定的协议中设置,但如果协议适应不同的应变或环境,则需要进行故障排除(参见图 3)。首先是选择适当的型板标记。对于细菌,建议在两个标记位点之一,rpoB或陀螺A,分别给予抗生素利福平和纳利迪克西酸的抗药性。这两个位点对抗生素耐药性突变的目标大小是不同的。有79个和20个独特的突变,分别赋予利法平37和纳利迪克西酸40的抗药性。在实践中,这意味着平均而言,抗瑞霉素突变体更经常被观察到。因此,需要回答的第一个问题(图3中的Q1)是应变是否是突变。当研究组成突变体时,在预期许多观察到的突变菌落时,最好使用目标尺寸较小的标记(例如,纳利迪克酸)。参见图2B,其中用纳利迪克酸作为标记,估计了大肠杆菌K-12 BW25113 +突变率。 当使用具有野生类型(即正常)突变率的非突变菌菌株时,利法平是一个更好的选择(参见图2A)。如果由于某种原因需要更多的观察到的突变体,则相关标记物对环色氨酸的抗性。对于这个标记,抗药性突变可以出现在超过十个基因41,这意味着目标大小甚至比瑞福平更大。在研究酵母和古体时,建议分别估计25S核糖体蛋白和URA3的突变率,分别对湿霉素B和5-氟-溶性酸(5-FOA)产生抗药性。
第二个关键考虑因素是并行区域性的体积。使用哪个体积取决于观察到的突变体的实际数量。观察到的突变体的预期数量受所选型型标记的目标大小、菌株修复和避免突变的能力(平均突变率)以及环境的承载能力(受所使用的介质和培养体积的影响)影响。如果没有平行培养物含有对瑞霉素有抗药性的突变菌落,则应使用环素或增加镀层细胞的数量。这可以通过向最小介质中添加更多葡萄糖或在更丰富(或完整的)环境中生长细胞来实现。然而,在许多情况下,人口密度的这种增加与突变率的下降有关,导致观察到的突变菌群数量有限(如果有的话)。如果增加营养物质不是一个解决方案,那么通过增加每个平行培养物的体积增加细胞数量是一种选择。当环境包含以糖为唯一碳和能源来源的最小盐时(即图 3中 Q2 的答案为"最小介质"),则应使用 0.5 到 1.5 mL 之间的体积。如果环境丰富,则并行区域性的体积应介于 0.35±1 mL 之间。最后一个问题涉及耐药殖民地的中位数。如果观察到的突变菌落太少(即图 3中 Q3 的答案为 0),并且环境不被修改,则应增加平行培养物的体积,或者使用目标尺寸较大的抗生素(例如,环色)。另一方面,如果在所有选择性板上观察到大量突变菌落(每板超过150欧元,见图3),则镀层细胞的数量应减少,这通常意味着使用较低的体积或切换到目标尺寸较小的抗生素(例如,纳利迪克酸)。
一旦选择卷,最好在一个 96 深井板上的所有平行区域性具有相同的体积。这样,就可以根据板的重量更精确地确定平行培养物的实际体积。当在不同环境之间比较特定基因型的突变率时,最好在所有环境中使用相同的并行培养物量。如果使用 nalidix 酸用于估计野生类型(即正常)突变率或使用比 nalidix 酸更小的目标大小的其他型型标记,则体积必须增加更多。一种选择是在 50 mL 管中制作平行培养物,其体积高达 15 mL。例如,在估算大肠杆菌K-12 MG1655突变率至纳利迪克西酸时,在50 mL管中制备了10 mL平行培养物(见图2A)。平行的10 mL培养物然后镀在选择性TA琼脂上,倒入150毫米大板,而不是标准的90毫米培养皿。在 50 mL 管中制备平行培养物的缺点是,与 96 深孔板的分瓶突变率相比,其通量要低得多。一种解决方案是减少并行区域性的数量。但是,这将影响m估计的精度,这取决于突变事件的预期数和并行区域性26的数量。获得具有 14-17 个并行培养物的观测突变体的分布(如图 2所示),在固体吞吐量和可接受的精度级别26 20% 之间实现良好的平衡。中位精度水平为 17.5%, 与四分位数范围为 16.4%(5.7%-38.9%,n = 580)的中值精度相似,该精度范围基于更大的数据集10计算得出。因此,建议在96个深井板或50 mL管中制备平行培养物时,使用至少14个平行培养物获得观察到的突变体的分布。当在不同的环境中估计突变率时,建议通过多板实验来测试精度水平,其中一个板上的所有 96 个平行培养体都在同一环境中生长。此外,在制备平行培养物时,接种含有少量细胞至关重要,因为它减少了任何耐药细胞在接种中存在的机会。在接种中不需要预先存在的抗性突变体,因为它们会增加数量,并在选择性板上创建草坪,并且无法估计突变率。例如,在大多数非突变大肠杆菌种群中,对利福平的突变率在+10-8左右。因此,为了避免用预先存在的抗性突变体接种培养物,必须用少于108个细胞(例如,103+104细胞)接种。最后的关键步骤是确保在孵育选择性琼脂板之前,选择性琼脂的表面完全干燥。例如,如果使用 6 孔板,并且平行培养件的初始体积为 1 mL,则无法使用扩展器。必须在无菌条件下未覆盖板材,以便使表面液体干燥。这所需的时间可能非常多变,具体取决于环境条件和板材的状况。此时间应最小化,但最多可达几个小时。
波动测定有内在的限制。它只在基因组的一小部分中测定突变的表型标记。因此,测定需要大量经过足够数量的几代人来观察足够的突变来估计一个速率。这意味着波动测定只能用于能够快速经历大量后代的生物体,如细菌、面包师酵母42或液体培养哺乳动物细胞30。此外,突变是发生在特定细胞的特定生化环境中的罕见事件。波动测定随时间看遍了大量细胞,这意味着这些情况可能有很大差异。因此,使用这种测定,很难研究特定人群从滞后阶段到早期和晚期指数阶段,最后到固定阶段的突变率。种群中单细胞突变率的任何分化都完全隐藏在波动测定中。单细胞突变动力学可以通过DNA修复蛋白MutS43的单分子跟踪或计算累积的MutL蛋白44的正点来研究。高通量测序的最新进展也使得直接估计来自亲子三重三重组9、45和多代谱系46的突变率成为可能。这种方法的进步正开始允许直接计数在一代人内发生的突变。然而,这种直接方法需要昂贵和最先进的技术,如荧光显微镜、微流体学或全基因组测序。另一方面,波动测定成本相对较低,只需要标准实验室设备。进行更多的波动测定也有助于产生新的假设,这些假设可以通过更直接的单细胞方法进行测试。
对突变的研究有着长期的兴趣,因此波动测定可能仍然是一种广泛使用的方法。在过去 4 年(2015-2018 年),Luria 和 Delbrück5的开创性论文引文数量均位列本文引文前五名。然而,由于正确进行波动测定需要大量的精确体力劳动,大多数研究只进行少量波动测定。然而,这不足以揭示突变率的环境相关性。通过简化使用多孔板的波动测定,如本文所述,当前最大吞吐量可能为11深井板(55波动测定)并联,如本文所述。以一天并联运行两组波动测定,每周可执行多达 110 次检测。通过自动执行纯手动协议的波动检测的各个步骤,吞吐量可能还有可能的另一步变化。此外,为了研究突变率的环境依存性,需要考虑人口密度。此前的结果表明,在计算影响突变率的已知因素时,控制种群密度可使突变率估计的变异减少90%以上。为了控制密度,我们建议从确定种群密度的方法中独立确定Nt(用于估计突变率)。在细菌中,Nt可以通过CFU和密度来确定,例如,使用基于ATP的发光测定10。
在研究生物体的生态环境如何影响自发突变率时,高通量和控制密度都是必不可少的。了解突变率可塑性的存在很重要,但了解其成因和影响是需要应对的关键挑战,如果要将突变率的可塑性纳入更广泛的生物学环境。波动测定是一个伟大的工具,可用于测试许多假设,因为结果得到迅速,并且与其他方法相比成本低。例如,研究细菌群落和微生物群落突变率的环境依赖性。调整波动测定以适应共培养可以检验菌株通过小分子影响彼此突变率的假设。用共培养法进行数千次波动测定可以确定菌株在改变对方突变率的能力和易感方面是否因其他菌株的突变率而有所变化。也许,突变率操纵的易感性菌株之间的变异可归因于特定的遗传变异。这可能改变我们对复杂社区进化如何运作的看法,尤其是在具有广泛重要性的例子中,例如抗微生物药物耐药性是如何产生的。
披露声明
作者没有什么可透露的。
致谢
RK得到了BB/M020975/1和曼彻斯特大学生物科学学院的支持。HR 由 BB/J014478/1 提供支持。GG得到了BBSRC博士培训合作伙伴BB/M011208/1的支持。DRG 由 UKRI 奖励编号 MR/R024936/1 提供支持。
材料
| Name | Company | Catalog Number | Comments |
| 1.5 mL Microcentrifuge tubes | Starlab International GmbH | S1615-5550 | |
| 2,3,5-Triphenyltetrazolium chloride | Sigma-Aldrich | T8877-10g | |
| 6-well plates | Greiner Bio-One | REF 657102 | |
| 90 mm Petri Dishes Triple Vented | ThermoFisher Scientific | REF 120189 | |
| 96 deep-well plate (Masterblock 2 mL) | Greiner Bio-One | REF 780270 | |
| Ammonium sulfate | Fisher Chemical | A/6440/53 | |
| Bacto Agar | Becton, Dickinson and Company | REF 214010 | |
| Bacto yeast extract | Becton, Dickinson and Company | REF 212750 | |
| Cycloserine | Sigma-Aldrich | 1158005-250MG | Only for assaying an alternative phenotypic marker |
| D-Glucose anhydrous | Fisher Chemical | G/0500/61 | |
| 50 mL Centrifuge Tube | Corning | REF 430828 | |
| L-(+)-Arabinose | Sigma-Aldrich | A3256-500g | |
| Magnesium sulfate heptahydrate | Fisher Chemical | M/1050/53 | |
| Nalidixic acid | Sigma-Aldrich | N8878-5G | Only for assaying an alternative phenotypic marker |
| Potassium phosphate dibasic trihydrate | Sigma-Aldrich | P5504-500g | |
| Potassium phosphate monobasic | Sigma-Aldrich | P0662-500g | |
| Rifampicin | EMD Millipore Corp, USA | 557303-1GM | |
| Sodium chloride | Fisher Chemical | S/3160/60 | |
| Spectophotometer | Jenway | 6320D | |
| Thiamine hydrochloride | Sigma-Aldrich | T4625-25g | |
| Trisodium citrate dihydrate | Sigma-Aldrich | S1804-500g | |
| Tryptone | Fisher Chemical | 1278-7099 |
参考文献
- de Vries, H. Die mutationstheorie. Versuche und beobachtungen über die entstehung von arten im pflanzenreich. 1, (1901).
- Muller, H. J. Artificial transmutation of the gene. Science. 66 (1699), (1927).
- Muller, H. J. The measurement of gene mutation rate in Drosophila, its high variability, and its dependence upon temperature. Genetics. 13 (4), 279-357 (1928).
- Sturtevant, A. H. Essays on evolution. I. On the effects of selection on mutation rate. The Quarterly Review of Biology. 12 (4), 464-467 (1937).
- Luria, S. E., Delbrück, M. Mutations of bacteria from virus sensitivity to virus resistance. Genetics. 28 (6), 491-511 (1943).
- Jee, J., et al. Rates and mechanisms of bacterial mutagenesis from maximum-depth sequencing. Nature. 534 (7609), 693-696 (2016).
- Fusco, D., Gralka, M., Kayser, J., Anderson, A., Hallatschek, O. Excess of mutational jackpot events in expanding populations revealed by spatial Luria-Delbrück experiments. Nature Communications. 7, (2016).
- Halligan, D. L., Keightley, P. D. Spontaneous mutation accumulation studies in evolutionary genetics. Annual Review of Ecology Evolution and Systematics. 40 (1), 151-172 (2009).
- Jónsson, H., et al. Parental influence on human germline de novo mutations in 1,548 trios from Iceland. Nature. 549, (2017).
- Krašovec, R., et al. Spontaneous mutation rate is a plastic trait associated with population density across domains of life. PLoS Biology. 15 (8), (2017).
- Krašovec, R., et al. Mutation rate plasticity in rifampicin resistance depends on Escherichia coli cell-cell interactions. Nature Communications. 5, 3742 (2014).
- Massey, R. C., Buckling, A. Environmental regulation of mutation rates at specific sites. Trends in Microbiology. 10 (12), 580-584 (2002).
- Lynch, M., et al. Genetic drift, selection and the evolution of the mutation rate. Nature Review Genetics. 17 (11), 704-714 (2016).
- Foster, P. L. Stress-induced mutagenesis in bacteria. Critical Reviews in Biochemistry and Molecular Biology. 42 (5), 373-397 (2007).
- Krašovec, R., et al. Where antibiotic resistance mutations meet quorum-sensing. Microbial Cell. 1 (7), 250-252 (2014).
- Krašovec, R., et al. Opposing effects of final population density and stress on Escherichia coli mutation rate. The ISME Journal-Multidisciplinary Journal of Microbial Ecology. 12, 2981-2987 (2018).
- Lea, D., Coulson, C. The distribution of the numbers of mutants in bacterial populations. Journal of Genetics. 49 (3), 264-285 (1949).
- Armitage, P. The statistical theory of bacterial populations subject to mutation. Journal of the Royal Statistical Society. Series B (Methodological. 14 (1), 1-40 (1952).
- Koch, A. L. Mutation and growth rates from Luria-Delbrück fluctuation tests). Mutation Research/Fundamental and Molecular Mechanisms of Mutagenesis. 95 (2-3), 129-143 (1982).
- Cairns, J., Overbaugh, J., Miller, S. The origin of mutants. Nature. 335 (6186), 142-145 (1988).
- Stewart, F. M., Gordon, D. M., Levin, B. R. Fluctuation analysis: the probability distribution of the number of mutants under different conditions. Genetics. 124 (1), 175-185 (1990).
- Drake, J. W. A constant rate of spontaneous mutation in DNA-based microbes. Proceedings of the National Academy of Sciences. 88 (16), 7160-7164 (1991).
- Ma, W. T., Sandri, G. V., Sarkar, S. Analysis of the Luria-Delbrück distribution using discrete convolution powers. Journal of Applied Probability. 29 (2), 255-267 (1992).
- Shapiro, J. A. Adaptive mutation - Who's really in the garden. Science. 268 (5209), 373-374 (1995).
- Matic, I., et al. Highly variable mutation rates in commensal and pathogenic Escherichia coli. Science. 277 (5333), 1833-1834 (1997).
- Rosche, W. A., Foster, P. L. Determining mutation rates in bacterial populations. Methods. 20 (1), 4-17 (2000).
- Rosenberg, S. M. Evolving responsively: Adaptive mutation. Nature Reviews Genetics. 2 (7), 504-515 (2001).
- Lynch, M. Evolution of the mutation rate. Trends in Genetics. 26 (8), 345-352 (2010).
- Zheng, Q. A new practical guide to the Luria-Delbrück protocol. Mutation Research. 781, 7-13 (2015).
- Boesen, J. J. B., Niericker, M. J., Dieteren, N., Simons, J. How variable is a spontaneous mutation-rate in cultured-mammalian-cells. Mutation Research. 307 (1), 121-129 (1994).
- Melnyk, A. H., Wong, A., Kassen, R. The fitness costs of antibiotic resistance mutations. Evolutionary Applications. 8 (3), 273-283 (2015).
- Sun, L., et al. Effective polyploidy causes phenotypic delay and influences bacterial evolvability. PLoS Biology. 16 (2), (2018).
- Frenoy, A., Bonhoeffer, S. Death and population dynamics affect mutation rate estimates and evolvability under stress in bacteria. PLoS Biology. 16 (5), (2018).
- Foster, P. L. Methods for determining spontaneous mutation rates. Methods in Enzymology. , 195-213 (2006).
- Wrande, M., Roth, J. R., Hughes, D. Accumulation of mutants in "aging" bacterial colonies is due to growth under selection, not stress-induced mutagenesis. Proceedings of the National Academy of Sciences of the United States of America. 105 (33), 11863-11868 (2008).
- Adrien, M., Rémy, D., Stéphane, D., Bernard, Y. flan: An R package for inference on mutation models. The R Journal. 9. 334, (2017).
- Garibyan, L., et al. Use of the rpoB gene to determine the specificity of base substitution mutations on the Escherichia coli chromosome. DNA Repair. 2 (5), 593-608 (2003).
- Stewart, F. M. Fluctuation tests: how reliable are the estimates of mutation rates?. Genetics. 137 (4), 1139-1146 (1994).
- Baba, T., et al. Construction of Escherichia coli K-12 in-frame, single-gene knockout mutants: the Keio collection. Molecular Systems Biology. 2 (1), (2006).
- Yamagishi, J. -. I., Yoshida, H., Yamayoshi, M., Nakamura, S. Nalidixic acid-resistant mutations of the gyrB gene of Escherichia coli. Molecular and General Genetics MGG. 204 (3), 367-373 (1986).
- Chen, J., et al. Identification of novel mutations associated with cycloserine resistance in Mycobacterium tuberculosis. Journal of Antimicrobial Chemotherapy. 72 (12), 3272-3276 (2017).
- Lang, G. I., Murray, A. W. Estimating the per-base-pair mutation rate in the yeast Saccharomyces cerevisiae. Genetics. 178 (1), 67-82 (2008).
- Uphoff, S., et al. Stochastic activation of a DNA damage response causes cell-to-cell mutation rate variation. Science. 351 (6277), 1094-1097 (2016).
- Robert, L., et al. Mutation dynamics and fitness effects followed in single cells. Science. 359 (6381), 1283-1286 (2018).
- Kong, A., et al. Rate of de novo mutations and the importance of father/'s age to disease risk. Nature. 488 (7412), 471-475 (2012).
- Narasimhan, V. M., et al. Estimating the human mutation rate from autozygous segments reveals population differences in human mutational processes. Nature Communications. 8 (1), 303 (2017).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。