Method Article
聚类诱导解吸/电电质谱法对复杂分子及其在表面的反应分析
摘要
中性SO2簇低动能(<0.8 eV/成分)用于解脱复杂的表面分子,如肽或脂质,通过使用电环质谱仪进行进一步分析。无需特殊的样品制备,可以实时观察反应。
摘要
中性SO2簇(DINeC)诱导的解吸/电化技术是复杂分子质谱(MS)及其表面反应的一种非常柔软和高效的解吸/电化技术。DINeC 基于 SO2聚类束,以低聚类能量影响样品表面。在聚类表面冲击过程中,一些表面分子在冲击簇中通过解索进行解吸和离子化;由于这种解解介导解吸机制,低簇能量足够,解吸过程非常柔软。可以分析表面吸附和表面由其组成的分子。从肽和蛋白质等复杂分子中获得清晰和无碎片的光谱。DINeC不需要任何特殊的样品制备,特别是不需要应用基质。该方法产生样本成分的定量信息;可检测到表面覆盖率低至单层0.1%的分子。可以实时观察到H/D交换或热分解等表面反应,并推导出反应的动力学。DINeC 使用脉冲喷嘴生成聚束束,可有效地与电偶圈质谱相结合。DINeC 工艺的无基质和柔软特性与电偶圈的 MSn功能相结合,可以非常详细和毫不含糊地分析复杂有机样品和表面有机吸附物的化学成分。
引言
表面敏感分析技术通常基于粒子探针,如低能电子、原子或离子,它们与固体样品强相互作用。因此,它们表现出较高的表面灵敏度,并可获得1.然而,化学信息往往有限。例如,X射线光电子光谱可以定量地提供关于原子组成和特定物种的平均化学环境(例如,在表面吸附的有机分子中的碳原子)。然而,很难用标准表面分析技术获得关于复杂表面吸附分子的更详细信息,例如其详细结构或结合位点。另一方面,随着人们对通过有机分子实现表面功能化的兴趣日益浓厚,对此类信息的需求也越来越大。表面合成3或表面功能化通过附加生物分子4,5的扩展领域是两个突出的例子。在所有这些领域,为了更好地了解系统,研究了基板-吸附和吸附-吸附-吸附性相互作用的基本问题。对于这些调查,最好获得关于吸附分子的最大信息。
部分地,二次子质谱(SIMS)可以提供这样的信息。首先,SIMS 对表面高度敏感。其次,由于溅射吸附及其片段是通过MS检测的,因此获得的信息远远超出原子成分。根据在表面吸附的化学物种的性质,可以通过在质量谱6中观察到的分子质量和片段模式来识别它。由主离子诱导的碎片确实有助于识别被分析的材料。另一方面,如果样品的原发性-子由修饰(破碎、发力反应、混合)太强,则大部分样品的原始状态信息会丢失。因此,已作出重大努力来减少SIMS的破碎(例如,使用带电分子簇作为初级离子7、8、9)。然而,碎片仍然主导着大型大分子和生物样品的SIMS光谱10,限制了SIMS在各个领域的应用。
作为替代方案,我们表明中性簇(DINeC)诱导的解吸/电化是一种软质和无矩阵电电化方法,已成功用于复杂分子11、12、13、14、15、16、17的质谱分析。DINeC基于由10个3至10个4SO2分子组成的分子簇束(图1)。当簇对样品产生影响时,它们以各种方式与表面和表面的分子相互作用:首先,聚子团的动能的一部分被重新分配并激活解吸。同样重要的是,在星团表面撞击11、18、19期间,脱冰分子溶解在簇中(图1和图2)。换句话说,基于SO2的高偶极子矩,聚类非常有效地充当极性分析物的瞬态矩阵。因此,分析分子的解吸发生在低至1 eV/分子及以下的聚类能量下。当SO2簇在表面撞击11、19期间和之后破碎时,系统的快速冷却进一步支持了解吸过程的软性。由于这些各方面,聚类诱导的解吸复杂分子,如肽,蛋白质,脂质和染料进行,没有任何分裂的解吸分子11,15;典型质谱显示完整分子的m/z值的显性峰值([M=H]=或[M-H]- 图3)。根据分子中功能组的数量和性质,形式 [M = n] 的多个带电阳离子H_n_被观察到11,15,18。对于生物分子,电电化通常通过在基本或酸性功能组(分别为11)的质子的接收或提取而发生。如果样品中存在水分子,则簇中的SO2分子可以与形成硫酸18的水分子发生反应。后者可以作为一个有效的质子源,进一步促进电电化过程的情况下,通过质子的接收(正电模式)13,18。
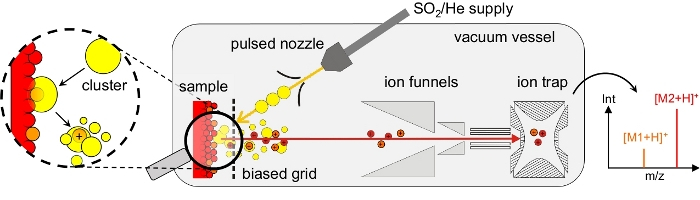
图1:聚类诱导解吸/电电和实验设置的原理图。聚组诱导解吸/电电在高真空容器中进行。SO2簇(黄点)的光束是通过从脉冲喷嘴上超音速膨胀 SO2/He 气体混合物产生的。在聚类表面冲击期间,表面分子被解吸和离子化。分子离子(红色/橙色点)通过偏置网格、双离子漏斗入口和八极离子导板传输到质谱的离子陷阱。典型的质谱显示完整分子的m/z值占显性峰,这里:M1(橙色)和M2(红色)在正子模式。爆炸:在聚类表面撞击期间,脱氧核化分子溶解在撞击团或其碎片之一中。SO2分子的进一步粉碎和蒸发,然后导致在质谱仪中检测到的裸光、完整的分子电团。另见图2。请点击此处查看此图的较大版本。
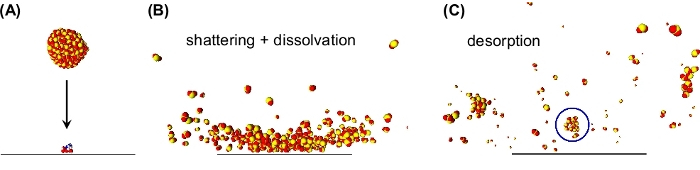
图2:分子动力学模拟的快照,说明通过解沉降产生的簇诱导解吸。(A) SO2簇(300个分子)以1250米/s垂直于吸附二肽(阿斯分酸精氨酸,ASP-ARG)的表面接近表面。(B)在集群表面撞击期间,聚类会碎裂。吸附二肽与周围的SO2分子相互作用,导致其在其中一个簇片段中分离。(C)簇碎片从表面被击退。标记的片段(蓝色圆圈)携带二肽,该二肽在此片段中脱吸。这一数字已由参考文献19修改。请点击此处查看此图的较大版本。
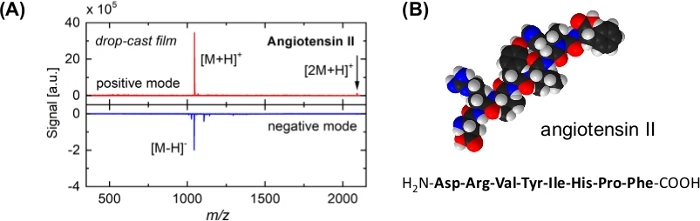
图3:血管紧张2的代表性质量谱和分子模型。(A)质谱(顶部面板:正电子模式,底部面板:负电模式),这是从血管紧张素II样品中聚组诱导解吸/电离后获得的。样品是通过在Si晶圆上(由其天然氧化物覆盖)上滴铸相应的溶液制备的。主峰被分配给完整的生物分子,[M[H]=和[M-H]-;未观察到碎片模式。丁二器([2M[H]=, 箭头) 进一步指示解吸过程的软性。由于SO2簇18的影响,正子信号更强烈。(B)血管紧张剂II的空间填充模型和氨基酸序列。白色球表示氢原子;黑色:碳;蓝色:氮气;红色:氧气。请点击此处查看此图的较大版本。
DINeC 可应用于任何与高真空条件兼容的固体样品。无需特殊样品制备,特别是DINeC-MS测量之前无需应用基质,与矩阵辅助激光解吸/电化(MALDI)质谱及相关技术20、21相比。这样可以实时测量样品的化学变化,具有不同的实验条件,如真空室22中活性物种的背景压力或样品温度。DINeC-MS的检测极限已被证明在飞毛人范围11。当应用于分析生物分子吸附在固体表面的亚单层系统,表面覆盖率低至0.1%的单层被检测23。在此覆盖制度中,信号强度线性取决于表面覆盖,DINeC-MS可用于表面成分的定量分析23。对于混合样品,对样品组合物进行定量评价是可能的17、24,因为没有观察到化学环境对电电化概率的主要影响(例如,混合脂质/肽样品17)。这与SIMS形成鲜明对比,因为SIMS的电电大概率通常受到不同化学成分的存在的强烈影响(所谓的"矩阵效应"25、26)。
除表面分析外,地下区域的化学成分可以通过深度剖面分析17进行探测。在目前的设置下,生物分子簇诱导解吸的典型解吸率为10-3nm/s。对于混合脂质/肽样品17,观察到1至2nm范围内的高深度分辨率。
另一个应用领域是 DINeC-MS 与薄层色谱 (TLC) 的结合。传统的TLC板可以直接通过DINeC-MS分析。位置相关质谱可以从TLC板获得,因此可以从TLC板27获得质量特异性色谱图。无需重新洗脱分离的分析物,与与 ESI28、29的组合的 TLC 不同。与 TLC 与 MALDI28、29的耦合相比,DINeC-MS + TLC 组合也不需要矩阵。
脱吸电喷雾电化(DESI)也是MS应用30、31的软脱吸/电化方法。DINeC和DESI之间最显著的区别是:DINeC23的定量性质,其与超高真空(UHV)条件的兼容性,特别是在不破坏真空23的情况下研究在特高压条件下制备和转移的样品的可能性,以及有效解除非极分子19的可能性。
原则上,DINeC作为解吸/电电源可以耦合到任何类型的质谱仪。然而,与辐射陷井质谱的组合具有两个主要优点:第一,典型脉冲聚类束的脉冲宽度和重复率与不连续积累时间以及辐射陷集15、32的光谱速率非常吻合。其次,DINeC工艺的软性导致完整分子的解吸。结合MSn能力的ION陷阱质谱,这允许最全面的分析调查的样品15。
研究方案
注: 协议可以随时暂停。
1. 基材制备
- 对于标准样品,将硅片(厚度约0.5至1毫米)的基板切割成1 x 1 cm2的片断。
- 在乙醇和丙酮的超声波浴中清洁Si基质,每次15分钟。
- 在干氮气流中干燥基材。
2. 样品制备
-
标准样品制备
- 对于标准样品,根据需要解决的科学问题制备含有分析剂分子的溶液。麻醉剂的浓度应至少为1 x10-10摩尔/升。
- 在基板上滴铸样品溶液的5至30μL。根据溶剂的蒸汽压力,让样品在环境条件下或干燥器中干燥,直到所有溶剂都蒸发并形成干燥膜。根据所应用的物质量,薄膜的厚度可以在几十微米(可能目视检查)和单层到亚单层系统(因此无法通过眼睛检测)之间。
- 将样品安装在样品架上(例如,使用用螺钉拧紧的胶带或夹子,具体取决于所需的样品和真空条件)。
- 如果可能,还可在样品架上安装参考样品,如千米厚的血管紧张2膜。
-
替代样品制备
- 在相应的溶液中使用替代样品制备方案,如真空或浸渍涂层中的电喷雾电喷电束沉积 (ES-IBD)。
- 在准备步骤之前,将准备并在真空中传输的样品安装在 DINeC 样品架上。
- 确保浸渍样品在最终准备步骤后干燥。
- 考虑最简单的准备方案。例如,对于荧光笔油墨的调查,只需在基板表面画一个点。
3. 将样品转移到DINeC质谱仪中
-
将样品从环境条件转移到疏散的 DINeC 室
- 通风负载锁系统。
- 打开负载锁并安装样品支架。
- 关闭负载锁并将负载锁室泵至低于 2 x 10-5 mbar 的压力。
- 将阀门打开至 DINeC 造型室,并将带有转移杆的样品支架转移到主操纵器上。将样品支架连接到操纵器。
- 收回传输杆并关闭负载锁和 DINeC 造型室之间的阀。
-
样品从真空转移到疏散的DINeC室
- 使用可运输的真空容器,该容器可连接到 DINeC 造型室的 CF40 法兰上。用这个容器在真空中制备的样品,而不会打破真空。确保样品安装在与 DINeC 系统中使用的操纵器兼容的样品支架上。
- 将可运输真空容器连接到 CF40 法兰,并降低容器和 DINeC 造型室之间的体积。
- 一旦压力降至 2 x 10-5 mbar 以下,打开 DINeC 造型室和可运输真空容器的闸门阀,并使用摆动杆或其他具有 50 厘米以上线性运动的转移系统将样品转移到 DINeC 造型室。
- 收回传输系统并关闭两个闸门阀。
4. 气体混合物的制备
- 首先将气体混合系统的气瓶排空 10 分钟,在氦气中制备约 3% SO2的混合物。
- 用 SO2填充气缸,直到达到 1 bar 的压力。
- 进一步用氦气填充气缸,直到达到 30 bar 的总压力。
注意:使用 SO2时,应始终执行相应的安全预防措施,例如将 SO2气缸存放在指定的气体柜中。
5. DINeC质谱仪的制备
- 打开气瓶和喷嘴之间的阀。将气体混合系统轮廓处的 SO2/He 气体混合物的压力调整到 15 bar。
- 将操纵器的位置设置为参考样本的位置。
- 为了测量阳离子质谱,将样品和网格偏置分别设置为+40和+7 V。
- 要驱动脉冲喷嘴和电环质谱仪,将外部功能发生器设置为 2 Hz。使用延迟发生器,将来自气动陷阱的清除陷阱信号和脉冲喷嘴的触发信号之间的时间延迟 \tn设置为 5 ms。
- 在控制软件中,通过按下相应的按钮或键入主对话框的"模式"页面中的相应值来调整以下参数:扫描模式:增强分辨率,范围:m/z 50 = 3000,Accu时间:0.1 ms,平均值:10 个周期,极性:为阳离子质量光谱的测量正数
注:为了测量阴离子光谱,样品和网格偏置对接地的偏置必须为负,极性必须在控制软件中切换到负。
6. 质谱测量
- 一旦 DINeC 造型室中的压力达到低于 3 x 10-6 mbar,即可开始测量。首先按"待命",然后按控制软件中的"操作",开始测量。开始记录测量值,按下"播放"按钮。
- 测量参考样本(如血管紧张症II)的测试光谱约300s。使用色度图设置为相应的m/z值,跟踪信号的时间依赖性。通过调整清除陷阱信号和触发脉冲喷嘴的信号之间的时间延迟 \tn来优化信号强度。
- 将操纵器移到要测量的样品的位置。通过调整样品架平面内的样品位置来优化信号强度。
- 在感兴趣的时间跨度内获取质谱。根据实验细节修改实验参数,如样品温度或室背景压力。改变实验参数时,继续采用质谱。
7. 数据评价
- 测量完成后,在数据分析程序中加载相应的数据集。使用鼠标的右键在色谱图中选择感兴趣的时间跨度。平均频谱将显示在单独的窗口中。
- 将频谱导出为数据文件,以便在选择的程序中进一步处理。
结果
下面给出了DINeC-MS实时应用的两个实例。图4显示了当样品加热到约140°C时,从血管紧张素II获得的质量谱的变化。当达到最终温度时(图4B,图4E),频谱的特征是一个额外的峰值,指示H2O实体(m/z = 1029)的损失。当样品保持在这个温度下时,血管紧张素II分子的进一步分解被观察(图4C),包括失去一个终端氨基酸单位,阿斯巴酸(峰值在m/z = 932,图4D)。数据定量分析允许评估底层反应动力学(图4E)。特别是,图 4E演示了m/z = 1029 的实体是一个中间体,随着强度首先增加,然后减小,该中间体会进一步分解为更小的片段。因此,伴随速率常数的幅度相同。
第二个例子,如图5所示,对血管紧张症II22中的氢/铀交换的调查。在DINeC室(pD2O =10-4 mbar)中将血管紧张素样品暴露于D2O时,血管紧张素II的同位素模式被扩大并转向更高的m/z值,表明D原子交换H。这个过程在前60年代是快速的,但在实验的进一步过程中明显减慢:图5B中的同位素模式覆盖了宽的m/z范围(约15 m/z单位)。当我们将d的去向定义为分子中交换的H原子的数量时,可以从光谱中提取d = 0到d= 13之间的值。在图5C中,同位素模式的宽度再次减小。这一观察可归因于与最低脱光程度相关的峰的强度急剧下降。在图5D中,频谱显示的反应时间更长。覆盖的 m/z范围几乎保持不变,但频谱的质量中心仍然缓慢地向增加的 m/z值移动。在长时间的接触中,分子的一部分达到最高程度的去向,dmax = 17。它对应于可交换 H 原子的最大数量,由绑定到功能组(如卡博基酸或胺组)的 H 原子数给出。
已经从光谱的时间演化可以推断出H/D交换是在不同的速率常数下发生的。对于此观测值的定量描述,图 5E中绘制了平均解化d+度作为时间的函数。检查实验结果(符号)揭示了三种不同的制度:t < 50 s 的快速增加,50 s < t < 200 s 的中间系统迅速增加,t > 200 s 缓慢但几乎连续增加。通过蒙特卡罗模拟模拟实验结果;伪一阶反应动力学与反应常数ki被假定为H/D交换的分子的功能组调查22。只有在血管紧张二分子的H/D交换中至少应用三种不同的速率常数ki时,所有三种机制的模拟和实验结果之间才取得良好的一致。在图5F,G中,显示了从拟合实验同位素模式中推断出的动力学,即不同程度的分离的同位素模式之和(图5A到图5D)。实验数据和模拟之间的良好一致,以及低度和高度分离的非常不同的汇率。与六甘醇等不同寡聚肽相比,快速汇率归因于显性功能组,而缓慢的汇率与肽主干22的酰胺组有关。
前两个例子是用微米厚的血管紧张物II样本测量的,图6显示了通过电喷雾电束沉积(ES-IBD)23制备的金样品上血管紧张氨酸II的亚单层覆盖的结果。在3个数量级以上的物质量上观察到信号强度的线性依赖性,检测到的最低物质量相当于金表面上血管紧张症II分子单层的0.1%。如图5所示的H/D交换实验也用血管紧张氨酸II在亚单层制度23中进行。
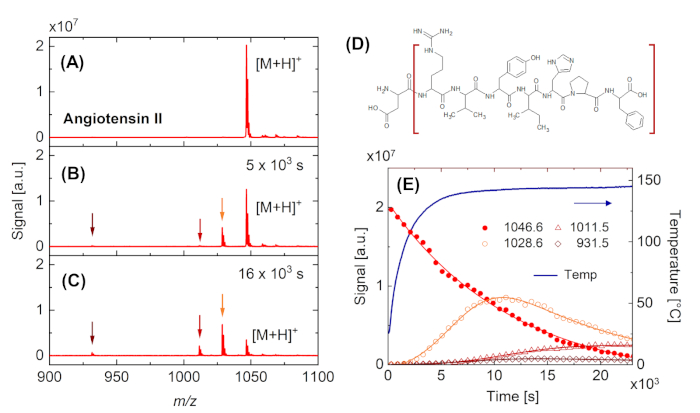
图4:血管紧张性二期热降解的实时观测。(A-C)从血管紧张素II样品的簇诱导解吸/电离后获得的质量光谱。(A) RT.(B)样品加热至约140°C的新鲜样品。除了与完整分子 [M[H]相关的m/z = 1047 的峰值外,m/z = 932、1012 和 1029 的峰值(以箭头表示)。(C)当样品保持在较高温度时,后一个峰值增加,主峰随时间而减小。(D)血管紧张素II的结构公式,指示片段(棕色支架),由于一个氨基酸单位(阿斯巴酸)的损耗,导致在m/z = 932处出现峰值。(E)样品温度的时间依赖性以及图(A)至(C)中所示主峰的强度。实线是眼睛的参考线。请点击此处查看此图的较大版本。
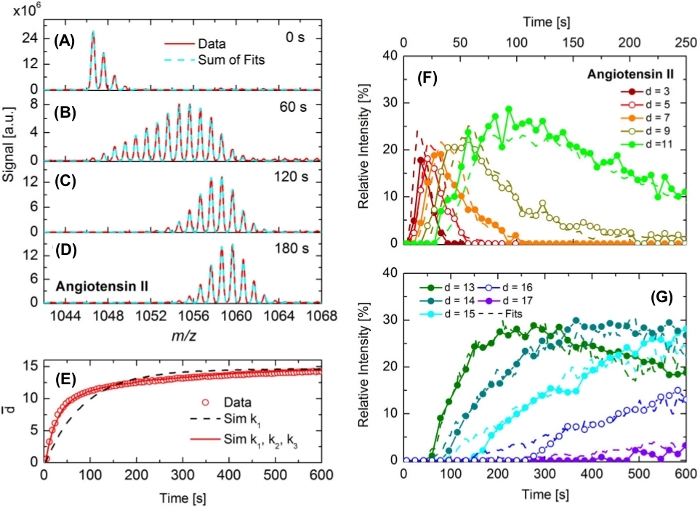
图5:血管紧张2中H/D交换的实时观测。(A-D)通过DINeC-MS获得血管紧张素II的阳相质谱。由于H/D交换,与(A)所示未解生物种的同位素模式相比,同位素模式在(B)到(D)中扩大并趋向更高的m/z值。红线是数据,虚线青色线适合数据,并考虑不同程度的去功能化。(E)从实验中推导的时间函数(开放点)的平均脱化程度。此外,还显示了d_作为通过蒙特卡罗模拟推导的时间函数。黑色虚线曲线:考虑到一个速率常数(k1)的模拟;红色曲线:考虑三个速率常数(k1, k2, k3)。(F,G)血管紧张度 II(符号 + 实线)的选定去失度的相对信号强度,以及蒙特卡罗模拟(虚线)的相应结果。这一数字已由参考文献22修改。请点击此处查看此图的较大版本。
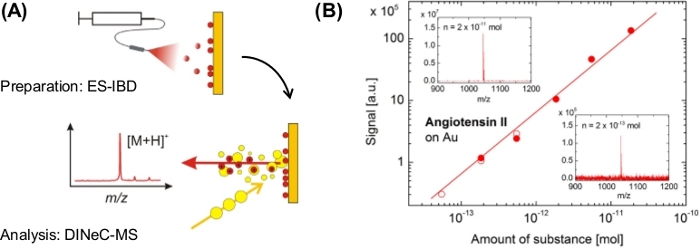
图6:在亚单层制度中DINeC-MS在金上应用血管紧张素II。(A) ES-IBD用于沉积和DINeC-MS组合的原理表示,用于亚单层机制中分离血管紧张素II分子的质谱。(B)信号强度与从两组独立数据(填充和打开的符号)获得的沉积在样品上的物质量的依赖性。内落:DINeC质谱,从按指示沉积物质量的样品中获取。这一数字已由参考文献23修改。请点击此处查看此图的较大版本。
讨论
在迄今为止进行的许多研究中,DINeC-MS对各种物质的高灵敏度已经得到证明。事实上,这允许在女性细胞机制11中测量到一定量的物质。由于这种高灵敏度,样品制备,特别是基板清洁,必须使用高度纯的化学品进行,以避免DINeC质谱中的污染。与许多分析技术一样,从空白基底进行适当的背景测量有助于将峰与分析物和峰中分离出来,这些峰在基板/样品制备中具有原点。
虽然我们已经表明,给定分析物分子的电离概率没有受到混合样品17、24中共吸附剂或共分子的存在的强烈影响,但电离概率可能因物质13而异。因此,在清洁条件下工作更为重要,因为污染物根据其电电化概率,可能导致信号比分析物强得多。预制离子(例如,在许多染料分子中发现),或具有功能组的分子,它们表现出明显的质子接受或脱硫趋势(即碱或酸),在DINeC-MS中通常表现出高电离概率。如果分析剂中不存在此类功能组,电电化概率可能较低。然后,样品可以通过电离剂(如三氟酸)进行处理(例如,将样品暴露于电离剂的蒸汽压力)。
图4和图5中讨论的代表性结果表明DINeC-MS适用于通过质谱法对化学反应进行实时调查。图 6说明了该方法的亚单层灵敏度。如果两种特性相结合,表面及其产品的化学反应可以实时跟踪23。对于所谓的"表面合成"来说,这尤其令人感兴趣,它导致在表面3、33、34、35、36上组装大分子结构。在目前的设置中,在低反应表面(如黄金23和其他贵金属)上可以观察到这种表面反应;由于解吸室的基压在10-7-mbar范围内,因此在硅表面(如硅表面37)等高活性表面进行实验更加困难。目前的活动解决了这一限制,正在建立一个与特高压兼容的DINeC设备。对于无功表面,在测量表面吸附和表面反应之前,必须测试SO2和基板表面之间的相互作用。
由于聚组束是中性的,因此无法聚焦。因此,样品上的光束大小由正在使用的滑水器的设置和孔的几何形状给出;样品上光束直径的典型值为一至几毫米。因此,只需以极低的分辨率扫描样品才能进行成像。另一方面,由于高电电位概率13,DINeC有效地利用了脱吸分子。因此,DINeC-MS 和电成像探测器38的组合似乎极具吸引力。
披露声明
提交人声明,他们没有什么可透露的。
致谢
作者感谢赫尔姆霍尔茨国际FAIR中心(HICforFAIR)和赫尔姆霍尔茨哈德龙和伊恩研究研究生院(P.S.)的财政支持。作者感谢劳申巴赫教授(牛津大学)和他的团队在ES-IBD/DINeC联合实验中进行了富有成效的合作。
材料
| Name | Company | Catalog Number | Comments |
| Acetone rotisolv HPLC | Roth | 7328.2 | HPLC Gradient Grade |
| Copper tape | |||
| Ethanol rotisolv HPLC | Roth | p076.1 | HPLC Gradient Grade |
| Helium | Praxair | 4800086706 | Purity 99.9999% |
| Nitrogen | Praxair | 40728408 | Purity 99.5 - 100% |
| Silicon Wafers | Active Business Company GmbH | G60007 | |
| Sulfur dioxide | Air Liquide | P1734S10R0A001 | Purity 99.98% |
| Water rotisolv LC-MS | Roth | HN43.1 | Ultra LC-MS |
参考文献
- Vickerman, J. C., Gilmore, I. Surface Analysis: The Principal Techniques. , 2nd ed, John Wiley & Sons. New York. (2009).
- Reutzel, M., Münster, N., Lipponer, M. A., Länger, C., Höfer, U., Koert, U., Dürr, M. Chemoselective Reactivity of Bifunctional Cyclooctynes on Si(001). Journal of Physical Chemistry C. 120, 26284-26289 (2016).
- Grill, L., Dyer, M., Lafferentz, L., Persson, M., Peters, M., Hecht, S. Nano-architectures by covalent assembly of molecular building blocks. Nature Nanotechnol. 2, 687-691 (2007).
- Stutzmann, M., Garrido, J. A., Eickhoff, M., Brandt, M. S. Direct biofunctionalization of semiconductors: A survey. Physica Status Solidi A. 203, 3424-3437 (2006).
- Adler-Abramovich, L., Gazit, E. The physical properties of supramolecular peptide assemblies: from building block association to technological applications. Chemical Society Reviews. 43, 6881-6893 (2014).
- Vickerman, J. C., Briggs, D. TOF-SIMS: Materials Analysis by Mass Spectrometry, 2nd ed. , IM Publications. Chichester, UK. (2013).
- Winograd, N. The magic of cluster SIMS. Analytical Chemistry. 77, 142-149 (2005).
- Ichiki, K., Ninomiya, S., Nakata, Y., Honda, Y., Seki, T., Aoki, T., Matsuo, J. High Sputtering Yields of Organic Compounds by Large Gas Cluster Ions. Applied Surface Science. 255, 1148-1150 (2008).
- Mochiji, K., Hashinokuchi, M., Moritani, K., Toyoda, N. Matrix-free Detection of Intact Ions from Proteins in Argon-Cluster Secondary Ion Mass Spectrometry. Rapid Communications in Mass Spectrometry. 23, 648-652 (2009).
- Yokoyama, Y., Aoyagi, S., Fujii, M., Matsuo, J., Fletcher, J. S., Lockyer, N. P., Vickerman, J. C., Passarelli, M. K., Havelund, R., Seah, M. P. Peptide Fragmentation and Surface Structural Analysis by Means of ToF-SIMS Using Large Cluster Ion Sources. Analytical Chemistry. 88, 3592-3597 (2016).
- Gebhardt, C. R., Tomsic, A., Schröder, H., Durr, M., Kompa, K. L. Matrix-Free Formation of Gas-Phase Biomolecular Ions by Soft Cluster-Induced Desorption. Angewandte Chemie, International Edition. 48, 4162-4165 (2009).
- Baur, M., Lee, B. J., Gebhardt, C. R., Durr, M. Soft Clusterinduced Desorption and Ionization of Biomolecules - Influence of Surface Load and Morphology on Desorption Efficiency. Applied Physics Letters. 99, 234103(2011).
- Lee, B. J., Baur, M., Gebhardt, C. R., Durr, M. Quantification of the Ionization Probability During Desorption/Ionization of Oligopeptides Induced by Neutral Cluster Impact. Rapid Communications in Mass Spectrometry. 27, 1090-1094 (2013).
- Lee, B. J., Gebhardt, C. R., Schroder, H., Kompa, K. L., Durr, M. Observation of Ionic Desorption Channels in Cluster-induced Desorption of Alkali Halides - Influence of Surface Electronic Properties and Surface Configuration. Chemical Physics Letters. 556, 77-81 (2013).
- Baur, M., Gebhardt, C. R., Durr, M. Desorption/Ionization Induced by Neutral Cluster Impact as a Soft and Efficient Ionization Source for Ion Trap Mass Spectrometry of Biomolecules. Rapid Communications in Mass Spectrometry. 28, 290-296 (2014).
- Kley, C. S., Dette, C., Rinke, G., Patrick, C. E., Cechal, J., Jung, S. J., Baur, M., Durr, M., Rauschenbach, S., Giustino, F., Stepanow, S., Kern, K. Atomic-Scale Observation of Multiconformational Binding and Energy Level Alignment of Ruthenium-Based Photosensitizers on TiO2 Anatase. Nano Letters. 14, 563-569 (2014).
- Portz, A., Aoyagi, S., Durr, M. Soft depth-profiling of mixed peptide/lipid samples by means of cluster induced desorption/ionization mass spectrometry - high depth resolution and low matrix effect. Biointerphases. 13, 03B405(2018).
- Portz, A., Baur, M., Gebhardt, C. R., Frank, A. J., Neuderth, P., Eickhoff, M., Durr, M. Influence of the Cluster Constituents' Reactivity on the Desorption/Ionization Process Induced by Neutral SO2 Clusters. Journal of Chemical Physics. 146, 134705(2017).
- Schneider, P., Durr, M. Cluster-induced desorption investigated by means of molecular dynamics simulations - Microsolvation in clusters of polar and non-polar constituents. Journal of Chemical Physics. 150, 214301(2019).
- Karas, M., Hillenkamp, F. Laser Desorption Ionization of Proteins with Molecular Masses Exceeding 10 000 Daltons. Analytical Chemistry. 60, 2299-2301 (1988).
- Buchberger, A. R., DeLaney, K., Johnson, J., Li, L. Mass Spectrometry Imaging: A Review of Emerging Advancements and Future Insights. Analytical Chemistry. 90, 240-265 (2018).
- Portz, A., Gebhardt, C. R., Durr, M. Real-Time Investigation of the H/D Exchange Kinetics of Porphyrins and Oligopeptides by Means of Neutral Cluster-Induced Desorption/Ionization Mass Spectrometry. Journal of Physical Chemistry B. 121, 11031-11036 (2017).
- Portz, A., Baur, M., Rinke, G., Abb, S., Rauschenbach, S., Kern, K., Dürr, M. Chemical Analysis of Complex Surface-Adsorbed Molecules and Their Reactions by Means of Cluster-Induced Desorption/Ionization Mass Spectrometry. Analytical Chemistry. 90, 3328(2018).
- Portz, A., Baur, M., Gebhardt, C. R., Durr, M. Mass Spectrometry of Oligopeptides in the Presence of Large Amounts of Alkali Halides Using Desorption/Ionization Induced by Neutral Cluster Impact. Biointerphases. 11, 02A316(2016).
- Shard, A. G., Spencer, S. J., Smith, S. A., Havelund, R., Gilmore, I. S. International Journal of Mass Spectrometry. 377, 599-609 (2015).
- Nakano, S., Yamagishi, T., Aoyagi, S., Portz, A., Durr, M., Iwai, H., Kawashima, T. Evaluation of Matrix Effects on TOF-SIMS Data of Leu-enkephalin and DOPC Mixed Samples. Biointerphases. 13, 03B403(2018).
- Heep, J., Tuchecker, P. H. K., Gebhardt, C. R., Dürr, M. Coupling of planar chromatography to mass spectrometry. ACS Omega. 4, 22426-22430 (2019).
- Morlock, G., Schwack, W. Coupling of planar chromatography to mass spectrometry. Trends in Analytical Chemistry. 29, 1157-1171 (2010).
- Cheng, S. C., Huang, M. Z., Shiea, J. Thin layer chromatography/mass spectrometry. Journal of Chromatography A. 1218, 2700-2711 (2011).
- Takats, Z., Wiseman, J. M., Gologan, B., Cooks, R. G. Mass spectrometry sampling under ambient conditions with desorption electrospray ionization. Science. 306, 471(2004).
- Cooks, R. G., Ouyang, Z., Takats, Z., Wiseman, J. M. Ambient mass spectrometry. Science. 311, 1566(2006).
- Dürr, M., Gebhardt, C. Ion generation in mass spectrometers by cluster bombardment. US Patent. , 926322 B2 (2019).
- Lindner, R., Kuhnle, A. Bottom-up Assembly of Molecular Wagons on a Surface. ChemPhysChem. 16, 1582-1592 (2015).
- Dong, L., Liu, P. N., Lin, N. Bottom-up Assembly of Molecular Wagons on a Surface. Accounts of Chemical Research. 48, 2765-2774 (2015).
- Björk, J. Reaction mechanisms for on-surface synthesis of covalent nanostructures. Journal of Physics: Condensed Matter. 28, 083002(2016).
- Rauschenbach, S., Rinke, G., Gutzler, R., Abb, S., Albarghash, A., Le, D., Rahman, T. S., Durr, M., Harnau, L., Kern, K. Two-Dimensional Folding of Polypeptides into Molecular Nanostructures at Surfaces. ACS Nano. 11, 2420-2427 (2017).
- Dürr, M., Höfer, U. Dissociative adsorption of molecular hydrogen on silicon surfaces. Surface Science Reports. 61, 465-526 (2006).
- Zhang, J., Franzreb, K., Aksyonov, S. A., Williams, P. Mass Spectra and Yields of Intact Charged Biomolecules Ejected by Massive Cluster Impact for Bioimaging in a Time-of-Flight Secondary Ion Microscope. Analytical Chemistry. 87, 10779-10784 (2015).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。